Dayvent 20 mcg İnhalasyon İçin Ölçülü Dozlu Aerosol Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Diğer İnhalanlar (solukla içeri çekilen ilaçlar) » Antikolinerjik İlaçlar » İpratropium Bromür KISA URUN BILGISI1. BEŞERI TIBBI URUNUN ADIDAYVENT 20 mcg inhalasyon için ölçülü dozlu aerosol2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde:İpratropium Bromür Monohidrat* 21,000 mcg*20 mcg ipratropium bromür'e eşdeğerYardımcı maddeler:Dehidrat alkol 5,760 mgYardımcı maddeler için 6.1'e bakınız.3. FARMASÖTIK FORMİnhalasyon için ölçülü dozlu aerosolAlüminyum inhaler kabı içinde basınçlı propellant gaz ile doldurulmuş çözelti.Alüminyum konteynere bir dozajlama valf eklidir.4. KLINIK ÖZELLIKLER4.1. Terapötik endikasyonlarDAYVENT, Kronik bronşit, amfizem ve astım dahil olmak üzere, kronik obstrüktif akciğer hastalığına bağlı bronkospazmın idame tedavisinde bronkodilatör olarak endikedir.4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:DAYVENT, sadece inhalasyon yolu ile uygulanır.Yetişkinler (Yaşlılar dahil):Yetişkinler için önerilen doz genellikle günde üç veya dört kez bir veya iki puftur. Bununla birlikte bazı hastalar erken tedavi süresince maksimum yarar elde edebilmek için bir seferde 4 pufa kadar ihtiyaç duyabilir.Çocuklar:6-12 yaş: Genellikle günde üç kez bir veya iki puf 6 yaş altı: Genellikle günde üç kez bir pufSpreyin doğru kullanıldığından emin olmak için, uygulama yetişkin bir bireyin gözetiminde yapılmalıdır.Önerilen doz aşılmamalıdır.Eğer tedavi anlamlı iyileşme sağlamıyorsa, hastanın durumu kötüleşiyorsa veya tedaviye yanıt azalmışsa, tıbbi yardım alınmalıdır. Akut dispne veya hızlı bir şekilde kötüleşen dispne (nefes alıp vermede zorluk) olduğu taktirde hemen doktora danışılmalıdır.İnhaler cihazı uygun bir hava odacığı ile kullanılabilir. İnhaler cihazının uygun bir hava odacığı ile birlikte kullanılması nefes alma ile (inspirasyon) aerosol uygulamasının aynı anda olmasında (senkronizasyonunda) zorluk yaşayan hastalar (örneğin; çocuklar) için yardımcı olabilir.Uygulama şekli:DAYVENT, sadece inhalasyon yolu ile uygulanır.İnhalasyon spreyinin doğru kullanımı doktor veya eczacı tarafından hastaya gösterilmelidir. İnhalasyon sırasında hastalar tercihen oturmalı veya ayakta durmalıdır. İnhalasyon spreyi dik konumda kullanım için tasarlanmıştır.İnhalasyon cihazı kullanma talimatı için bakınız ekli talimat.Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda doz ayarlanması gerektiğini gösteren veri bulunmamaktadır.Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda doz ayarlanması gerektiğini gösteren veri bulunmamaktadır. Pediyatrik popülasyon:Pediyatrik popülasyonda kullanım için Bölüm 4.2'ye bakınız.Geriyatrik popülasyon:Yaşlı hastalar yetişkinler için önerilen dozu kullanabilirler.4.3. KontrendikasyonlarDAYVENT, ipratropium bromüre, atropin veya türevlerine veya ürünün içindeki yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleriHFA-134a (taşıyıcı, hidrofloroalkan 134 a) içeren bir sprey ilk kez kullanılırken, bazı hastalar CFC-içeren (taşıyıcı, kloroflorokarbon) sprey formülasyonundan tadının biraz daha farklı olduğunu fark edebilirler. Hastalar bir formülasyondan diğerine geçirilirken bu konuda bilgilendirilmelidirler. Hastalara ayrıca formülasyonların hangi açıdan bakılırsa bakılsın değiştirilebilir olduğunun gösterildiği ve tattaki bu farklılığının yeni formülasyonun güvenilirliği veya etkinliği bakımından sonuçlar oluşturmadığı anlatılmalıdır.DAYVENT uygulamasından sonra ürtiker, anjiyoödem, döküntü, bronkospazm, orofaringeal ödem ve anafilaksi vakaları olarak beliren ani aşırı duyarlık reaksiyonları meydana gelmiştir.DAYVENT, dar-açılı glokomu olan veya dar-açılı glokom gelişimine karşı eğilimi olan, ya da prostat hiperplazisi veya mesane boynu obstrüksiyonu bulunan hastalarda dikkatli kullanılmalıdır.Kistik fibrozlu hastalar, gastrointestinal motilite bozukluklarına daha yatkın olabileceğinden, diğer antikolinerjikler gibi ipratropium bromür bu hastalarda dikkatli kullanılmalıdır.Aerosol şeklindeki ipratropium bromür tek başına veya bir adrenerjik beta-agonist ile kombine halde göze kaçtığında, oküler komplikasyonlar (midriyazis, göz içi basıncında artış, dar açılı glokom, göz ağrısı) geliştiği bildirilen izole vakalar vardır. Hastalara DAYVENT'nin doğru bir şekilde nasıl kullanılacağı öğretilmelidir. Gözlerin DAYVENT içindeki aerosol ile kazara temas etmemesi için hastalar uyarılmalıdır. İnhaler ağızlık aracılığı ile uygulandığı ve manuel olarak kontrol edildiği için, gözün areosol ile teması sınırlıdır. Antiglokom tedavi, akut dar açılı glokomun önlenmesinde duyarlı bireylerde etkilidir. Glokoma karşı duyarlılık gösterebilecek hastalar, gözlerini korumaları konusunda özel olarak uyarılmalıdır.Konjunktivada konjesyon ve korneada ödem sonucu gelişen göz kızarmasıyla birlikte gözde ağrı veya rahatsızlık hissi, bulanık görme, haleler veya renkli görüntüler görme, akut dar açılı glokom belirtileri olabilir. Bu semptomlar herhangi bir kombinasyon şeklinde gelişirse, miyotik damlalar ile tedaviye başlanmalı ve hemen bir uzman hekimin görüşü alınmalıdır.Hastalar tedaviye başlarken ipratropium bromürün etki başlangıcının inhale sempatomimetik bronkodilatörlerden daha yavaş olduğu konusunda bilgilendirilmelidir.Diğer inhaler tedavilerde olduğu gibi, inhalasyon dozunun uygulanmasının ardından hırıltılı solunumda ani bir artış ile inhalasyon kaynaklı bronkokonstriksiyon meydana gelebilir. Bu durum, hızlı etkili bir inhale bronkodilatörler ile hemen tedavi edilmelidir. DAYVENT tedavisi hemen sonlandırılmalı, hasta değerlendirilmeli ve eğer gerekli ise alternatif tedaviye başlanmalıdır.Bu tıbbi ürün az miktarda -her dozda 100 mg'dan daha az- alkol içerir.4.5. Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriİpratropium bromürün beta-adrenerjikler ve ksantin preparatları ile birlikte kullanımı bronkodilatör etkiyi arttırabilir.Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin herhangi bir etkileşim çalışması tespit edilmemiştir.Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması tespit edilmemiştir.4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi B.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlara yönelik bir veri mevcut değildir.Gebelik dönemiHayvanlar üzerinde yapılan çalışmalar, gebelik/ve-veya/embriyonal/fetal gelişim/ve-veya/doğum/ve-veya/doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir.Gebe kadınlara verilirken tedbirli olunmalıdır.DAYVENT, anneye sağlaması beklenen yararları fetüse veya yeni doğan bebeğe olan potansiyel riskinden fazla değilse hamilelikte kullanılmamalıdır.Klinik öncesi çalışmalar ipratropium bromürün insanlar için önerilen dozlardan oldukça yüksek dozlarda inhalasyonunu veya intranazal uygulamasını takiben embriyotoksik veya teratojenik etkilere neden olmadığını göstermiştir.Laktasyon dönemiİpratropiumun anne sütüne geçip geçmediği bilinmemektedir. İpratropium bromürün inhalasyon yoluyla uygulandığında, bebekte önemli düzeylere ulaşabilme olasılığı çok uzaktır. Ancak birçok ilaç anne sütüne geçtiğinden, emziren bir anneye DAYVENT verilirken dikkatli olunması gereklidir.DAYVENT, anneye sağlaması beklenen yararları fetüse veya yeni doğan bebeğe olan potansiyel riskinden fazla değilse emziren annelerde kullanılmamalıdır.Gebe ve emziren sıçanlara ve tavşanlara HFA-134a'nın uygulandığı çalışmalar, HFA-134a'nın herhangi bir zararının olmadığını göstermiştir.Üreme yeteneği/FertiliteVeri mevcut değildir.4.7. Araç ve makine kullanımı üzerindeki etkilerDAYVENT'in araç ve makine kullanımı üzerine etkilerinin gösterildiği çalışma gerçekleştirilmemiştir. Bununla birlikte, hastalar DAYVENT ile tedavi sırasında sersemlik, göz merceğinin farklı uzaklıklara uyum bozukluğu, gözbebeğinin genişlemesi, bulanık görme gibi istenmeyen etkilerin meydana gelebileceği konusunda bilgilendirilmelidir. Eğer bahsedilen etkiler meydana gelirse, araç ve makine kullanımından kaçınılmalıdır.4.8. İstenmeyen etkilerAşağıda listelenmiş istenmeyen etkilerin birçoğu DAYVENT'in antikolinerjik özellikleridir. Diğer tüm inhalasyon tedavilerinde olduğu gibi, DAYVENT tedavisi ile de lokal tahriş meydana gelebilir. Tanımlanan advers ilaç reaksiyonları klinik çalışmalardan ve ilacın onaylanmasından sonra farmakovijilans verilerinden elde edilmiştir.Klinik çalışmalarda en sık bildirilen istenmeyen etkiler baş ağrısı, boğaz tahrişi, öksürük, ağız kuruluğu, gastrointestinal motilite bozuklukları (konstipasyon, diyare, kusma dahil), mide bulantısı, sersemlik olmuştur.Yan etkilerin görülme sıklığı aşağıda belirtilmektedir:Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1000 ila <1/100), seyrek (>1/10.000 ila <1/1000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).Bağışıklık sistemi hastalıklarıYaygın olmayan: Anjiyoödem (dil, dudak, yüzde anjiyoödem), anafilaktik reaksiyon, aşırı duyarlılık reaksiyonlarıSinir sistemi hastalıklarıYaygın: Baş ağrısı, sersemlikGöz hastalıklarıYaygın olmayan: Bulanık görme, midriyazis1Kardiyak hastalıklarıYaygın olmayan: Palpitasyonlar, supraventriküler taşikardi Seyrek: Atriyal fibrilasyon, kalp atımının hızlanmasıSolunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın: Boğaz tahrişi, öksürükYaygın olmayan: Bronkospazm, paradoksikal bronkospazm2Gastrointestinal hastalıklarıYaygın: Ağız kuruluğu, mide bulantısı, gastrointestinal motilite bozukluğu,Yaygın olmayan: Diyare, konstipasyon, kusma, stomatitDeri ve deri-altı doku hastalıklarıYaygın olmayan: Döküntü, prurit Seyrek: ÜrtikerBöbrek ve idrar hastalıklarıYaygın olmayan: İdrar retansiyonu3beklenmez. Diğer antikolinerjiklerde olduğu gibi ağız kuruluğu, gözde akomodasyon bozuklukları (göz merceğinin farklı uzaklıklara uyum bozukluğu) ve kalp hızında artış gibi minör sistemik antikolinerjik aktivite belirtileri oluşabilir.5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapotik grubu: Antikolinerjikler ATC Kodu: R03BB01Yetişkin astım ve KOAH hastalarının, astımlı çocukların katılmış oldukları, HFA formülasyonunun ve CFC formülasyonunun karşılaştırıldığı 3 ay tedavi süresine varan çalışmalarda her iki formülasyonun da terapötik olarak eşit etkinlik sağladığı gösterilmiştir. İpratropium bromür, antikolinerjik (parasempatolitik) özellikleri olan bir kuaterner amonyum bileşiğidir. Klinik öncesi çalışmalarda, vagus sinirinden salıverilen transmitter madde olan asetilkolinin etkilerini antagonize ederek, bu sinir aracılığıyla gerçekleşen refleksleri inhibe eden bir bileşik olarak görünmüştür. Antikolinerjikler, bronş düz kaslarındaki muskarinik reseptörler ile asetilkolinin etkileşiminden kaynaklanan hücre içi Ca++ konsantrasyonunun artışını engeller. Ca++ salınımı, IP3 (inositol trifosfat) ile DAG (diaçilgliserol)'den oluşan ikinci mesajcı sistem aracılığı ile gerçekleşir.İpratropium bromür inhalasyonunu izleyen bronkodilatasyon, bronş düz kaslarında uygulama yerine özgü lokal ilaç konsantrasyonunun ortaya çıkardığı bir antikolinerjik etkidir ve sistemik ilaç konsantrasyonuna bağlı değildir.Kronik obstrüktif akciğer hastalığı veya astıma bağlı reversibl bronkspazmı olan hastalara ölçülü doz inhaleri ile uygulama yapılan klinik çalışmalarda, akciğer fonksiyonunda 15 dakika içerisinde anlamlı iyileşmeler oluşmuş (%15 ya da daha fazla FEVartışları), bu iyileşme 1-2 saat içerisinde doruğa ulaşmış ve yaklaşık 4 saat kadar kalıcı olmuştur.Klinik öncesi ve klinik veriler ipratropium bromürün hava yolu mukus sekresyonu, mukosiliyer klerens ya da gaz alış-verişi üzerine zararlı bir etkisi olmadığını ileri sürmektedir.5.2. Farmakokinetik özellikleri Genel özellikler:Emilim:İpratropium bromürün terapötik etkisi, solunum yollarındaki lokal etkisiyle meydana gelir. Bronkodilatasyon süreci ve sistemik farmakokinetiği paralellik göstermez.İnhalasyonu takiben formülasyona, cihaza, inhalasyon tekniğine bağlı olarak dozun %10 ile %30 arasındaki bir bölümü akciğerde tutulur. Dozun büyük bir bölümü yutulur ve gastrointestinal kanala geçer. İpratropium bromürün ihmal edilebilir gastrointestinal emiliminden dolayı, yutulan dozun biyoyararlanımı sadece yaklaşık %2 oranındadır. Dozun yutulan bölümü, etkin maddenin plazma konsantrasyonlarına önemli bir katkıda bulunmaz. Akciğerde tutulan doz bölümü, hızla dolaşıma geçer (dakikalar içinde) ve neredeyse tam bir sistemik yararlanım gösterir.Ana bileşiğin toplam renal atılımı (0-24 saat) intravenöz olarak uygulanan dozun yaklaşık olarak %46'sı, oral dozun %1'inden daha azı ve inhale dozun yaklaşık olarak %3-13'ü arasındadır. Bu verilere dayanarak, ipratropium bromürün oral ve inhale dozlarının total sistemik biyoyararlanımlarının sırasıyla %2 ve %7-28 olduğu tahmin edilmektedir.İpratropium bromür dozunun yutulan bölümü, sistemik maruziyete önemli bir katkı sağlamaz.Dağılım:İlaç plazma proteinlerine minimal oranda bağlanır (%20'den az). İpratropium iyonu molekülün kuvaterner amonyum yapısına uygun olarak, kan-beyin bariyerini geçmez.Biyotransformasyon:İpratropiumun ortalama total klerensi 2,3 L/dak ve renal klerensi 0,9 L/dak'dır. İntravenöz uygulamanın ardından dozun yaklaşık olarak % 60'ı temel olarak konjugasyon ile (%40) metabolize olur. Bunun yanı sıra inhalasyonun ardından sistemik olarak mevcut dozun yaklaşık olarak %77'si ester hidrolizi (%41) ve konjugasyon (%36) ile metabolize olur.Atılım:İpratropium bromürün ya HFA 134a formülasyonu ya da CFC formülasyonu ile inhalasyonunun ardından 24 saat içerisindeki toplam renal atılımı sırasıyla yaklaşık olarak %12 ve %10'dur. Atılım denge çalışmasında ilaca bağlı radyoaktivitenin (ana bileşik ve tüm metabolitleri içerir) toplam renal atılımı (6 gün) intravenöz uygulamanın ardından %72,1, oral uygulamanın ardından %9,3 ve inhalasyonun ardından %3,2 olarak hesaplanmıştır. Dışkı ile atılan total radyoaktiviteintravenöz uygulamanın ardından %6,3, oral uygulamanın ardından %88,5 ve inhalasyonun ardından %69,4'tür. İntravenöz uygulamanın ardından ilaç ile ilişkili radyoaktivitenin atılımına bakıldığında, temel atılımın böbrekler aracılığıyla olduğu görülmektedir. İlaca bağlı radyoaktivitenin (ana bileşik ve metabolitler) eliminasyon yarılanma ömrü 3,2 saattir. Temel üriner metabolitler muskarinik reseptörlere zayıf bağlanırlar ve etkisiz olarak kabul edilebilirler.Doğrusallık/Doğrusal Olmayan Durum:Veri mevcut değildir.5.3. Klinik öncesi güvenlilik verileriKlinik öncesi verileri, geleneksel güvenlilik farmakolojisi, tekrarlanan doz toksisitesi, genotoksisite, karsinojenik potansiyel ve üreme toksisitesi çalışmalarına dayalı olarak insanlara yönelik özel bir tehlike ortaya koymamaktadır.6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiHFA134a Dehidrat alkol6.2 GeçimsizliklerBilinen geçimsizliği yoktur.6.3 Raf ömrü24 ay6.4 Saklamaya yönelik özel tedbirler25 °C'nin altındaki oda sıcaklığında saklayınız. Direkt gün ışığından ve donmaktan koruyunuz. Aerosol kutusu delinmemeli, boş olsa bile kırılmamalı, ateşten uzak tutulmalıdır.6.5 Ambalajın niteliği ve içeriğiDAYVENT 20 mcg İnhalasyon için 200 dozluk ölçülü aerosol, aerosol tüplerde kullanma talimatı ile birlikte karton kutuda sunulmaktadır.6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir.7. RUHSAT SAHİBİ Salutis İlaç San. Tic. Ltd. Şti.General Ali Rıza Gürcan CaddesiMerter İş Merkezi Bağımsız Bölüm No: 2/12Zeytinburnu / İSTANBULTelefon: 0 212 481 83 05Faks: 0 212 481 83 05e-mail: [email protected]8. RUHSAT NUMARASI (LARI)244/159. İLK RUHSAT TARİHİ/ RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 06.08.2012Ruhsat yenileme tarihi:10. KÜB'UN YENİLENME TARİHİİlk kez kullanımdan önce hastalar ağızlık kapağını, kapağın yanlarından hafifçe sıkarak çıkarmalı, inhalasyon spreyini iyi bir şekilde sallamalı, baş parmak ağızlığın altında inhalasyon spreyinin tabanında olacak şekilde parmaklar ve baş parmak arasında tutmalı ve boşluğa sıkım yapmalıdır. İnhalasyon spreyi her sıkımdan önce sallanmalıdır.İnhalasyon spreyi bir hafta veya daha uzun süre kullanılmadığında hastalar ağızlık kapağını çıkarmalı, inhalasyon spreyi ile boşluğa iki kez sıkım yapılmalıdır.Inhalasyon spreyinin kullanım talimatıİnhalasyon spreyinin test edilmesi: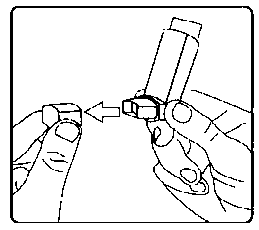 İnhalasyon spreyinizi kullanacağınız zaman oturunuz veya ayakta dik durunuz.1. İlk resimde gösterildiği gibi ağızlık kapağını çıkarınız. Ağızlığın temiz olduğundan emin olmak için içini ve dışını kontrol ediniz.2. İnhalasyon spreyinizi her kullanımdan önce iyice çalkalayınız.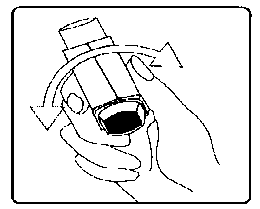
3. İnhalasyon spreyinizi baş parmağınız ağızlığın altında, inhalasyon spreyinizin tabanında olacak şekilde dik tutunuz.5. Ağzınızdan yavaş ve derin nefes alınız ve aynı anda bir puf doz boşaltmak için inhalasyon spreyinizin üst kısmına basınız.
6. Nefesinizi birkaç saniye veya rahatça tutabildiğiniz kadar tutunuz ve ağızlığı ağzınızdan çıkarıp parmağınızı inhalasyon spreyinizin üst kısmından çekiniz.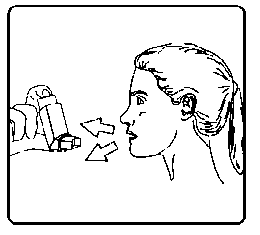 4. Ağızlığı dişlerinizin arasına koyunuz ve dudaklarınızı sıkıca kapatınız. 
7. Her bir puf ilaç alımı arasında yaklaşık yarım dakika bekleyiniz ve sonra 2-6. basamakları tekrarlayınız.8. Kullanımdan sonra tozdan korumak için ağızlığın kapağını hemen kapatınız. Ağızlık kapağı doğru bir şekilde yerleştirildiğinde tam yerine oturacaktır. Eğer yerine oturmuyorsa, ağızlık kapağını diğer yöne çeviriniz. Çok fazla güç uygulamayınız.Hastalar 4, 5 ve 6. basamakları hızlı bir şekilde yapmamalıdır. Hastaların inhalasyon spreyini etkin hale getirmeden hemen önce mümkün olduğunca yavaş bir şekilde nefes almaya başlaması önemlidir. Hastalar aynanın önünde ilk birkaç uygulama için pratik yapmalıdırlar. Eğer hastalar inhalasyon spreyinin üstünden veya ağızlarının yanından buhar geldiğini görürse, 2. basamaktan itibaren uygulamaya tekrar başlamalıdırlar.İnhalasyon spreyinin temizlenmesiİnhalasyon spreyinizi haftada en az bir kez temizleyiniz.1. Ağızlık kapağını çıkarınız.2. Tüpü plastik gövdeden çıkarmayınız.3. Kuru bir bez veya kumaş ile ağızlığın içini ve dışını ve plastik gövdeyi siliniz.4. Ağızlık kapağını doğru bir şekilde yerleştiriniz. Kapağı yerleştirmek için çok fazla güç uygulamayınız.12 agonist ile kombine halde göze kaçtığında bildirilmiştir.23 4.9. Doz aşımı ve tedavisiDoz aşımına özgü hiçbir semptom ile karşılaşılmamıştır. İpratropium bromürün geniş terapötik aralığı ve lokal olarak uygulandığı göz önüne alındığında, hiçbir ciddi antikolinerjik semptom |
İlaç BilgileriDayvent 20 mcg İnhalasyon İçin Ölçülü Dozlu AerosolEtken Maddesi: İpratropium bromür monohidrat Atc Kodu: R03BB01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.