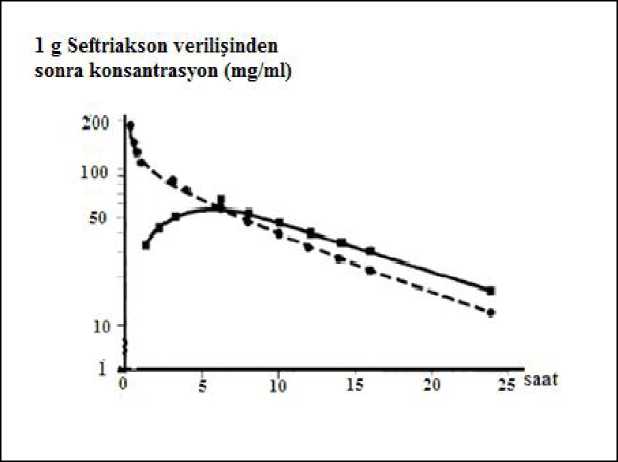
Triaxon 1 G I.v. Enjeksiyonluk Toz ve Çözücü Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI TRİAXON 1 g İ.V. enjeksiyonluk toz ve çözücü Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Bir flakon 1 g seftriaksona eşdeğer 1194,24 mg seftriakson disodyum Yardımcı madde: Yardımcı madde bulunmamaktadır. Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORM Enjeksiyonluk çözelti tozu Beyaz ya da beyazımsı kristalize toz Sulandırıldıktan sonra açık sarı ile bal rengi çözelti. 4. KLİNİK ÖZELLİKLER TRİAXON'a duyarlı patojenlerin neden olduğu enfeksiyonlar: - Sepsis, - Menenjit, - Dissemine Lyme borreliosis'i (hastalığın erken ve geç evreleri), - Abdominal enfeksiyonlar (peritonit, safra ve gastrointestinal sistem enfeksiyonları), - Kemik, eklem, yumuşak doku, cilt ve yara enfeksiyonları, - İmmün sistem bozukluğuna bağlı enfeksiyonlar, - Böbrek ve idrar yolları enfeksiyonları, - Solunum yolları enfeksiyonları, özellikle pnömoni, kulak-burun-boğaz enfeksiyonları, akutbakteriyel komplike olmayan otitis media, - Gonore dahil olmak üzere genital enfeksiyonlar, - Preoperatif enfeksiyon profilaksisi. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi Doktor tarafından başka şekilde tavsiye edilmediği takdirde; Standart doz Yetişkinler ve 12 yaşından büyük çocuklar: Tedavi süresi hastalığın seyrine göre değişir. Genellikle bütün antibiyotik tedavilerinde olduğu 1 / 16 gibi, hastanın ateşi düştükten veya bakteriyel eradikasyon sağlandıktan sonra en az 48-72 saat TRİAXON tedavisine devam edilmelidir. Kombine tedavi: Deneysel koşullar, birçok gram-negatif bakterilere karşı TRİAXON ile aminoglikozidler arasında sinerji olduğunu göstermektedir. Bu tür kombinasyonlarda aktivite artışı her zaman kesin olmasada, Pseudomonas aeruginosagibi patojenlerin neden olduğu ciddi ve hayatı tehdit edenenfeksiyonlarda TRİAXON ile aminoglikozidler kombine edilebilinir. Ancak bu iki ilaç,aralarındaki fiziksel geçimsizlik nedeniyle önerilen dozlarda ayrı ayrı uygulanmalıdır.Menenjit: Bebek ve çocuklardaki bakteriyel menenjitte tedaviye günde tek doz 100 mg/kg (4 g aşılmamalıdır) ile başlanır. Etken organizmalar belirlenip duyarlılık testleri yapıldıktan sonra,gerekirse doz azaltılabilir. En iyi tedavi sonuçları aşağıdaki tedavi sürelerinde elde edilmiştir:Neisseria meningitidis: 4 günHaemophilus influenzae: 6 günStreptococcus pneumoniae: 7 gün Lyme borreliosis: Çocuk ve yetişkinlerde, 14 gün boyunca günde tek doz olarak 50 mg/kg ile en fazla 2 g arasında uygulanır. Gonore: Gonore (penisilinaz üreten ve üretmeyen suşlar) tedavisinde i.m. olarak 250 mg tek doz TRİAXON önerilir. Preoperatif profilaksi: Enfeksiyon riskine bağlı olarak operasyondan 30-90 dakika önce 1-2 g'lık tek doz TRİAXON uygulaması önerilir. Kolorektal cerrahide, TRİAXON'un tek başınaveya ornidazol gibi 5-nitroimidazol türevinin birlikte (ayrı ayrı verilerek) uygulanmasının etkiliolduğu kanıtlanmıştır. Uygulama şekli: TRİAXON çözeltisi hazırlandıktan hemen sonra kullanılmalıdır. İntravenöz enjeksiyon: IV enjeksiyon için, TRİAXON 500 mg 5 ml, TRİAXON 1 g ise 10 ml steril enjeksiyonluk suda çözünür. İntravenöz uygulama 2-4 dakika içinde gerçekleştirilmelidir.İntravenöz infüzyon: İnfüzyon en az 30 dakika süreyle verilmelidir. İntravenöz infüzyon için, 2g TRİAXON aşağıdaki kalsiyum içermeyen çözeltilerden birinde 40 ml'de çözülür: Sodyumklorür %0,9, Sodyum klorür %0,45 + dekstroz %2,5, dekstroz %5, dekstroz %10, dekstran %6,%5 dekstroz içinde, hidroksi etil nişasta %6-10, enjeksiyonluk su. TRİAXON çözeltilerimuhtemel geçimsizliklerden dolayı diğer antimikrobiyal ilaçları içeren çözeltilerle veyayukarıda listenenlerden farklı çözücülerle karıştırılmamalıdır. Çökelti oluşabileceğinden; TRİAXON flakonları sulandırmak veya sulandırılmış bir flakonu IV uygulama için seyreltmek üzere Ringer çözeltisi veya Hartmann çözeltisi gibi kalsiyum içerençözücüler kullanmayınız. Ayrıca, TRİAXON aynı IV uygulama hattında kalsiyum içerençözeltilerle karıştırıldığında da seftriakson-kalsiyum çökeltisi meydana gelebilir. TRİAXON bir 2 / 16 Y-bölgesinden parenteral beslenme gibi sürekli kalsiyum içeren infüzyonlar da dahil olmak üzere eş zamanlı olarak kalsiyum içeren IV çözeltilerle birlikte uygulanmamalıdır. Ancak,neonatlar dışındaki hastalarda, TRİAXON ve kalsiyum içeren çözeltiler infüzyonlar arasındainfüzyon hatlarının uygun bir sıvıyla çok iyi yıkanması şartı ile, birbirinin ardından sıralı olarakuygulanabilir. Özel popülasyonlara ilişkin ek bilgiler: Böbrek/Karaciğer yetmezliği: Sadece böbrek fonksiyon bozukluğu olan, karaciğer fonksiyonları normal hastalarda TRİAXON dozunu azaltmaya gerek yoktur. Ancak preterminal safhada böbrek yetmezliği olanlarda(kreatinin klirensi < 10 ml/dakika) TRİAXON dozu günde 2 g'ı aşmamalıdır. Sadece karaciğerhasarı olan, böbrek fonksiyonları normal hastalarda TRİAXON dozunu azaltmaya gerek yoktur. Ciddi böbrek ve karaciğer fonksiyon bozukluklarının bir arada görüldüğü vakalarda, seftriakson plazma konsantrasyonları düzenli olarak kontrol edilmeli ve gerektiğinde doz ayarlamasıyapılmalıdır. Diyalize alınan hastalara diyaliz sonrasında supleman olarak ilave dozlara gerekyoktur. Ancak bu hastalarda eliminasyon oranı değişmiş olabileceğinden, doz ayarlamasınıngerekli olup olmadığını belirlemek için serum konsantrasyonları kontrol edilmelidir. Pediyatrik popülasyon: Yenidoğan, bebek ve 12 yaşından küçük çocuklarda: Aşağıda belirtilen doz şeması günde tek dozda uygulanır. Kontrendi kasyonlar). Bebek ve çocuklar (15 günlükten 12 yaşına kadar): Günde tek doz 20-80 mg/kg. Vücut ağırlığı 50 kg veya üstünde olan normal çocuklarda normal yetişkin dozu kullanılmalıdır. Akut bakteriyel komplike olmayan otitis media tedavisi için 50 mg/kg dozunda (1g'ıaşmamak koşuluyla) tek uygulama önerilmektedir (single-shot therapy). Geriyatrik popülasyon: Geriatrik hastalarda, yetişkinler için önerilen dozlar kullanılır. 4.3. Kontrendikasyonlar TRİAXON sefalosporin sınıfı antibiyotiklere karşı aşırı hassasiyeti olan hastalarda kontrendikedir. Penisiline karşı aşırı hassas hastalarda çapraz alerjik reaksiyonların görülebileceği 3 / 16 unutulmamalıdır. Seftriakson veya ilacın içerdiği diğer yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda TRİAXON kullanımı kontrendikedir. Hiperbilirubinemiliyeni doğanlar ve prematüre yeni doğanlar seftriakson ile tedavi edilmemelidir. İn vitro çalışmalarseftriaksonun bilirubini serum albumininden ayırabildiğini ve bu hastalarda bilirubinensefalopatisi gelişebileceğini göstermiştir. Seftriakson ve intravenöz kalsiyum içeren ürünlerineş zamanlı olarak yenidoğanlarda (<28 gün) kullanımı kontrendikedir. Kalsiyum içerenintravenöz ürünleri kullanan (veya bu ürünleri kullanması beklenen) yenidoğanlarda seftriaksonkullanılmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleri Diğer sefalosporinlerde olduğu gibi, sefalosporinlere karşı alerjisi olduğu bilinmeyen ya da daha önceden alerjik reaksiyon geçirmeyen kişilerde dahi ölümcül olabilen anafilaktikreaksiyonlar bildirilmiştir. TRİAXON gibi sefalosporin sınıfı antibakteriyel ilaç kullanan çocuk ve yetişkin hastalarda immün-sistem aracılı hemolitik anemi olguları gözlenmiştir. Seftriakson tedavisi sırasında anemi görülürse sefalosporine bağlı anemi tanısı göz önünde bulundurulmalıdır ve hastalığın etyolojisi tespit edilene kadar tedavi durdurulmalıdır. Clostridium difficileC.difficile'nin aşırı çoğalmasına yol açmaktadır.C.difficileC.difficile'inaşırı toksin üreten suşları artan morbidite ve mortaliteye nedenolabilmektedir. Antibiyotik kullanımının ardından diyare görülen tüm hastalarda CDADdüşünülmelidir. CDAD'ın antimikrobiyal maddelerin uygulanmasının ardından iki aya kadargörülebildiği bildirildiğinden, dikkatli tıbbi anamnez önemlidir.Eğer CDAD'dan şüpheleniliyor veya bu durum doğrulanmış ise, doğrudan C. difficile'yeC. difficiletedavisi ve cerrahideğerlendirme yapılmalıdır.Antibiyotik ilişkili diyare, kolit veya psödomembranöz vakaları seftriakson kullanımında bildirilmiştir. Ciddi veya kanlı diyare görüldüğünde tedavi sonlandırılmalıdır. Gastrointestinalbir hastalığı olan veya daha önce kolit hikayesi olan hastalarda dikkatli olunmalıdır. Diğersefalosporinlerde gözlendiği gibi seftriaksonun uzun süre kullanılması duyarlı olmayanorganizmaların (EnterococcusCandidatürleri gibi) gelişmesine yol açabilir.Günümüzde bilimsel veriler, seftriakson veya kalsiyum içeren çözeltilerle veya diğer 4 / 16 kalsiyum içeren ürünlerle tedavi edilen neonatlar haricindeki hastalarda herhangi bir intravasküler çökelti bildirimi olmamıştır. Ancak, seftriakson farklı infüzyon yollarından olsadahi hiçbir hastaya kalsiyum içeren çözeltilerle birlikte veya bunlarla karıştırılarakverilmemelidir (Bkz. 4.2 Kontrendikasyonlar) Diğer antibakteriyel ilaçlarda olduğu gibi, duyarlı olmayan mikroorganizmaların neden olduğu süper enfeksiyonlarla karşılaşılabilinir. Önerilenden daha yüksek doz uygulanan vakalarda, safra kesesi ultrasonografisinde safra taşını düşündüren gölgeler belirlenmiştir. Bu gölgeler TRİAXON tedavisinin tamamlanması veya araverilmesi sonucu kaybolan kalsiyum seftriakson çökeltileridir. Bu bulgulara, nadiren semptomlarda eşlik edebilir. Semptomatik vakalarda, cerrahi olmayan, konservatif tedavi önerilmektedir. Semptomatik vakalarda TRİAXON tedavisinin sonlandırılmasına hekim karar verir. TRİAXON ile tedavi gören hastalarda safra tıkanmasına bağlı olması muhtemel pankreatit vakaları nadirenbildirilmiştir. Hastaların çoğunda, daha önceden uygulanmış majör bir tedavi, şiddetli hastalıkve tam parenteral beslenme gibi safra stazı ve safra tortusu gibi durumlar oluşturabilecek riskfaktörleri bulunmakta idi. Safra çökmesiyle ilgili olarak, TRİAXON'un başlangıç etkisi yaratıcıveya kofaktör rolü gözardı edilmemelidir. Yenidoğan, bebek ve çocuklarda TRİAXON'un güven ve etkinliği Kullanım Şekli ve Dozu bölümünde açıklanan dozlarla belirlenmiştir. Çalışmalar, diğer sefalosporinlerin olduğu gibi,seftriaksonun da bilirubini serum albümininden ayırabildiğini göstermiştir. Bu nedenlehiperbilirubinemili yenidoğanların TRİAXON ile tedavisi sırasında bu noktaya dikkat edilmelidir.Bilirubin ensefalopatisi gelişme riski bulunan yenidoğanlarda (özellikle prematürelerde)TRİAXON kullanılmamalıdır. Uzun süreli tedavilerde kan tablosu düzenli olarak kontroledilmelidir. Duyarlı kişilerde aşırı duyarlılık reaksiyonları gelişebilir. Tanı testleri üzerindeki etkisi: TRİAXON tedavisi gören hastalarda Coombs testi nadiren de olsa yalancı pozitiflik verebilir. Diğer antibiyotiklerde olduğu gibi TRİAXON'da galaktozemi testinde yalancı pozitif sonucaneden olabilir. Benzer şekilde, idrarda glikoz tayini için kullanılan enzimatik olmayan testlerde deyalancı pozitif sonuç alınabilir. Bu nedenle, TRİAXON tedavisi sırasında idrarda glikoz tayinienzimatik testlerle yapılmalıdır. Pediyatri: Term ve preterm bebeklerin akciğer ve böbreklerinde ölümcül olan seftriakson- kalsiyum çökeltileri bildirilmiştir. 28 günden büyük hastalarda seftriakson ve kalsiyum içeren ürünlerardışık olarak kullanılabilir. Bu durumda infüzyon yolu uygun sıvılar verilerek iyice yıkanmalıdır. Seftriakson hiçbir yaş grubunda intravenöz kalsiyum içeren solüsyonlarla aynı anda bir ''Y-seti'' kullanılarak 5 / 16 verilmemelidir. Seftriakson Ringer ve Hartmann solüsyonu gibi kalsiyum içeren solüsyonlarla veya kalsiyum içeren parenteral beslenme solüsyonu ilesulandırılmamakveya karıştırılmamalıdır. İntravenöz seftriakson ve oral kalsiyum içeren ürünler arasında veya intramusküler seftriakson ile intravenöz veya oral kalsiyum içeren arasındaki etkileşimkonusunda henüz yeterli bilgi bulunmamaktadır. Bu tıbbi ürün her bir flakonda 82,95 mg sodyum ihtiva eder. Bu durum, kontrollü sodyum diyetinde olan hastalar göz önünde bulundurulmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri Şimdiye kadar, yüksek doz TRİAXON ile güçlü diüretiklerin (örneğin, furosemid) aynı anda uygulanması sonucu herhangi bir böbrek fonksiyon bozukluğuna rastlanmamıştır. TRİAXON'un, aminoglikozidlerin renal toksisitesini artırdığına ilişkin bir bulgu yoktur. TRİAXON uygulamasının ardından alkol alındığında disülfiram benzeri etkiler gözlenmemiştir. Seftriaksonun kimyasal yapısında diğer bazı sefalosporinlerde bulunan, etanol intoleransı ve kanama sorunlarına neden olabilen N-metiltiotetrazol bulunmaz. TRİAXON'un eliminasyonu probenesid ile etkilenmez. In vitrobir çalışmada, kloramfenikol ve seftriakson kombinasyonunun antagonist etki gösterdiği saptanmıştır.Literatür raporlarına göre, seftriakson amsakrin, vankomisin, flukonazol ve aminoglikozidlerle geçimsizdir. Çökelti oluşabileceğinden; TRİAXON flakonları sulandırmak veya sulandırılmış bir flakonu IV uygulama için seyreltmek üzere Ringer çözeltisi veya Hartmann çözeltisi gibi kalsiyum içerençözücüler kullanmayınız. Ayrıca, TRİAXON aynı IV uygulama hattında kalsiyum içerençözeltilerle karıştırıldığında da seftriakson-kalsiyum çökeltisi meydana gelebilir. TRİAXON birY-bölgesinden parenteral beslenme gibi sürekli kalsiyum içeren infüzyonlar da dahil olmaküzere eş zamanlı olarak kalsiyum içeren IV çözeltilerle birlikte uygulanmamalıdır. Ancak,neonatlar dışındaki hastalarda, TRİAXON ve kalsiyum içeren çözeltiler infüzyonlar arasındainfüzyon hatlarının uygun bir sıvıyla çok iyi yıkanması şartı ile, birbirinin ardından sıralı olarakuygulanabilir. TRİAXON tedavisi gören hastalarda Coombs testi nadiren de olsa yalancı pozitiflik verebilir. Diğer antibiyotiklerde olduğu gibi TRİAXON de galaktozemi testinde yalancı pozitif sonucaneden olabilir. Benzer şekilde, idrarda glikoz tayini için kullanılan enzimatik olmayan testlerde deyalancı pozitif sonuç alınabilir. Bu nedenle, TRİAXON tedavisi sırasında idrarda glikoz tayini 6 / 16 enzimatik testlerle yapılmalıdır. Seftriakson hormonal kontraseptiflerin etkinliğini istenmeyen biçimde etkileyebilirler. Sonuç olarak, tedavi sırasında veya tedaviyi takip eden ilk ay destekleyici ve hormonal olmayankontraseptif önlemlerin kullanılması önerilmelidir. Özel popülasyonlara ilişkin ek bilgiler: Özel popülasyonlara ilişkin etkileşim çalışmaları yapılmamıştır. Pediyatrik popülasyon: Pediyatrik popülasyona ilişkin etkileşim çalışmaları yapılmamıştır. 4.6. Gebelik ve laktasyonGenel tavsiye Gebelik kategorisi: B Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Çocuk doğurma potansiyeli bulunan kadınlarda TRİAXON kullanımına ilişkin klinik veri mevcutdeğildir. Ancak, seftriaksonun hormonal kontraseptif ilaçların etkinliği üzerinde ters etki gösterme olasılığı bulunmaktadır. Bu nedenle, hastalara seftriakson tedavisi sırasında veya tedaviyi takipeden ilk ay destekleyici ve hormonal olmayan kontraseptif önlemlerin kullanılmasıönerilmektedir. Gebelik dönemi Seftriakson plasenta engelini aşar. İnsanda gebelikte kullanımının güvenirliliği henüz kesinleşmemiştir. Hayvanlarda yürütülen üreme çalışmaları embriyotoksisite, fetotoksisite,teratojenisite veya doğumda, perinatal ve postnatal gelişimde erkek veya dişi fertilitesindeolumsuz etkiler göstermemiştir. Primatlarda embriyotoksisite veya teratojenisitegözlenmemiştir. Gebe kadınlara verilirken tedbirli olunmalıdır. Laktasyon dönemi Seftriakson anne sütüne küçük miktarlarda da olsa geçtiği için, emziren annelerde bu durumun göz önünde bulundurulması önerilmektedir. Üreme yeteneği /Fertilite: İntravenöz yolla uygulanan ve 586 mg/kg/gün' e kadar olan seftriakson dozu sıçanlarda üreme yeteneğini bozmamıştır. 4.7. Araç ve makine kullanımı üzerindeki etkiler Kişinin motorlu taşıt ve makine kullanma yetisi üzerinde olumsuz etkisi olduğuna dair bir veri bulunmamaktadır. TRİAXON, bazen sersemlik veya baş dönmesine yol açabildiği için motorlu 7 / 16 taşıt kullanımım veya makine kullanımım etkileyebilir. 4.8. İstenmeyen etkiler Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). TRİAXON kullanımı sırasında kendiliğinden veya ilacın kesilmesiyle ortadan kalktığı gözlenen yan etkiler aşağıda belirtilmiştir. Enfeksiyonlar ve enfestasyonlar Seyrek: Genital bölgede mikoz Değişik bölgelerde maya, mantar veya diğer dirençli organizmalarla görülen süperenfeksiyonlar. Kan ve lenf sistemi hastalıkları Seyrek: Nötropeni, eozinofili, lökopeni, granülositopeni, hemolitik anemiyi de içeren anemi, trombositopeni, protrombin zamanında hafif uzama. Çok seyrek: Koagülasyon bozuklukları Çoğunluğu 10 günlük tedavi sonucunda ve toplam 20 g veya daha yüksek dozların uygulanmasından sonra bazı tek tük agranülositoz vakaları (< 500/mm ) bildirilmiştir. Bağışıklık sistemi hastalıkları Seyrek: Anafilaktik (örn. bronkospazm) veya anafilaktoid reaksiyonlar Sinir sistemi hastalıkları Seyrek: Baş ağrısı ve baş dönmesi Gastrointestinal hastalıklar Yaygın: Yumuşak dışkı ya da ishal, bulantı, kusma Seyrek: Stomatit ve glossit. Bu yan etkiler genellikle hafiftir ve tedavi sırasında veya tedavinin sonlamasının ardından çoğunlukla kaybolurlar. Çok seyrek (izole vakalar): Psödomembranöz kolit (çoğunlukla Clostridium difficile 'nin neden olduğu),pankreatit (olasılıkla safra kanalının kasılmasından bağlı gelişir). Bu nedenle,antibakteriyel tedaviye bağlı diyare görülen kişilerde, safra hastalığı ihtimali göz önündebulundurulmalıdır.Hepato-bilier hastalıklar Seyrek: Karaciğer enzimlerinde artış (AST, ALT, alkalin fosfataz) Özellikle önerilen standart dozun üzerinde ilaç alan kişilerde seftriakson-kalsiyum tuzu çökelmesi gözlemlenmiştir. Prospektif çalışmalar, çocuklarda iv uygulama ile çökelmeinsidansında değişkenlik göstermiştir ve yavaş infüzyon yöntemi ile (20-30 dk) çökelme 8 / 16 insidansının azalması beklenmektedir. Genelde asemptomatik olan bu olaya nadiren ağrı, bulantı, kusma gibi klinik semptomlarda eşlik etmiştir. Seftriakson tedavisi sonlandırıldığında çökelmeortadan kalkmaktadır. Deri ve deri altı doku hastalıkları Yaygın olmayan: Makülopapülar raş, ekzantem gibi alerjik deri reaksiyonları veya alerjik dermatit, kaşıntı, ürtiker, ödem. Çok seyrek: İzole vakalarda, eritema multiforme, Stevens Johnson sendromu veya Lyell's sendromu / toksik epidermal nekroliz Böbrek ve idrar yolu hastalıkları Seyrek: Serum kreatininde artış, oligüri, glikozüri, hematüri. Çok seyrek: İzole raporlarda, çoğunluğu 3 yaşından büyük, yüksek doz (örn. >80mg/kg/gün) veya toplam 10 g'ı aşan dozlarda tedavi gören ve diğer risk faktörlerini gösteren (örn. sıvıkısıtlamaları, yatağa bağımlılık, vs) çocuklarda renal presipitasyon bildirilmiştir. Ancak, ilaçkesildiği taktirde presipitasyon ortadan kalkar. Bu olaya böbrek yetmezliği ve anürinin eşlik ettiğigözlenmiştir. Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar Seyrek: Ateş, rigor, flebilit ve İV uygulamaya bağlı olarak enjeksiyon bölgesinde ağrı. Ağrı, en az 2-4 dk sürede ve yavaş enjeksiyon uygulaması ile minimum düzeye indirilebilir. Lidokain çözeltisi olmadan intramüsküler enjeksiyon ağrılıdır. Araştırmalar: Kalsiyum ile etkileşim 4.9. Doz aşımı ve tedavisi Doz aşımında, bulantı, kusma veya diyare görülebilir. İlaç konsantrasyonu hemodiyaliz veya periton diyaliziyle azaltılamaz. Spesifik bir antidot bulunmamaktadır. Doz aşımı tedavisisemptomatik olmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik özellikler Farmakoterapötik grup: Diğer beta-laktam antibiyotikleri (3. Kuşak sefalosporinler) ATC kodu: J01DD04 Seftriakson, hücre duvarı sentezini inhibe ederek bakterisid etki gösterir. Seftriakson, gram-negatif ve gram-pozitif mikroorganizmaların büyük bir kısmında in vitroin vitroveklinik enfeksiyonlarda etkilidir (Endikasyonları bölümüne bakınız).9 / 16 Gram-pozitif aeroblar:Metisiline duyarlı StaphylococcusepidermisStreptococcus pyogenes (AStreptococcus agalactiaeStreptococcusviridansStreptococcus bovis, Streptococcus pneumoniae11: Hem in vitro,in vivoStaphylococcusEnterococcus faecalis, Enterococcus faeciumListeria monocytogenesde dirençlidir.Metisiline dirençli koagülaz negatif Staphylococcus(S. epidermidisgibi) doğal olarak dirençli organizmalardır.Gram-negatif aeroblar:+ Acinetobacter türleri (Acinetobacter lwoffi, Acinetobacter anitratusA. baumaniiAcinetobacter calcoaceticusAeromonas hydrophila, Alcaligenes faecalis, Alcaligenes odorans,AlcaligenesBorrelia burgdorferi, CapnocytophagaCitrobacter(Citrobacter diversus [C. amalonaticusCitrobacter freundii**), Escherichia coli1,,+Enterobacter aerogenes1*, +Enterobacter cloacae1*,+Enterobacter türleri (diğer)1*,Haemophilus ducreyi, Haemophilus influenzae (beta- laktamaz pozitif izolatları1 dahil), Haemophilus parainfluenzae1, Hafnia alvei, Klebsiella(Klebsiella oxytoca, Klebsiellapneumoniae**), Moraxella catarrhalis 1 (Branhamella catarrhalis), Moraxella osloensis,MoraxellaMorganella morganii1, Neisseria gonorrhoea1Neisseria meningitidis1, Pasteurella multocida, Plesiomonas shigelloides, Proteus(Proteus mirabilis1, Proteus penneri*, Proteus vulgaris1Pseudomonas fluorescens*,PseudomonasProvidentia rettgeri*, ProvidentiaSalmonellatyphi, SalmonellaSerratia(Serratia marsescens*), SerratiaShigellaVibrioYersinia enterocolitica, Yersiniatürleri (diğer)1: Hem in vitroin vivoolarak seftriaksona duyarlılık göstermiş olan türler * Bu türlerin izole edilen bazı suşları, özellikle kromozomal P-laktamaz üreterek seftriaksonadirenç göstermektedir.** Bu türlerin izole edilen bazı suşları, özellikle genişletilmiş spektrumlu ve plazmide bağlı P-laktamaz üreterek seftriaksona direnç göstermektedir. +: Bir veya birden fazla Avrupa Birliği bölgesinde yüksek direnç oranlarının gözlendiği türler, mikroorganizmaların duyarlı olup olmama olasılığı konusunda tahmini bir kılavuz niteliğitaşımaktadır. Not: Yukarıdaki organizmaların, amino- ve üreido-penisilinler, eski sefalosporinler ve aminoglikozidler gibi diğer antibiyotiklere karşı multipl direnç gösteren birçok suşu, seftriaksona duyarlıdır. Treponema pallidum, in vitroçalışmalar ve hayvan deneylerinde duyarlı bulunmuştur.10 / 16 Klinik çalışmalar, primer ve sekonder sifilizin seftriakson tedavisine iyi cevap verdiğini göstermektedir. Birkaç istisna dışında, klinikte izole edilen P. Aeruginosa +suşları seftriaksonadirençlidir.Listeria monocytogenes, MycoplasmaStenotrophomanas maltophilia, Ureplasma urealyticum, Chlamydiatürleri de seftriaksona doğal olarak dirençli organizmalardır.Anaerob organizmalar:BacteroidesClostridium türleri1 (C. difficile (C. difficilegrubu hariç),Fusobacterium nucleatum, FusobacteriumGaffkia anaerobica (peptococcus), Peptostreptococcustürleri1.1: Hem in vitro,in vivoolarak seftriaksona duyarlılık göstermiş olan türler * Bu türlerin izole edilen bazı suşları, P-laktamaz üreterek seftriaksona direnç göstermektedir.Not: P-laktamaz üreten BacteroidesB. fragilis)Clostridium difficiledirençlidir.Sınır değerleri:Seftriaksona duyarlılık tayini, disk difüzyon testi, agar veya besiyeri dilüsyon testi gibi, National Committee for Clinical Laboratory Standards (NCCLS) (Klinik Laboratuvar Standartları UlusalKomitesi tarafından önerilen standart teknikler kullanılarak yapılabilir. Aşağıdaki seftriaksonduyarlılık kriterleri NCCLS tarafından bildirilmiştir: 30 mg/L'lık ilaç konsantrasyonu kullanılarak bildirilen değerler mg/L (MIC testi) veya mm'dir (disk difüzyon testi)
11 / 16
* 2002 S. pneumoniaesınır değerleri (NCCLS M100-S12), non-menenjit örnekler için <1 (Duyarlı), 2 (Orta derece) ve >4 (Dirençli) olarak ve menenjit örnekleri için >0.5 (Duyarlı), 1(Orta derece), ve> 2 (Dirençli) olarak belirlenmiştir.** 2002 Streptococcus viridansgrubu sınır değerleri (NCCLS M100-S12) <1 (Duyarlı), 2 (Orta derece), ve >4 (Dirençli) olarak belirlenmiştir.Duyarlılık testleri seftriakson diskleri ile yapılmalıdır, çünkü sefalosporin sınıfı disklerle yapılan in vitrotestlerde dirençli olduğu bilinen suşlara karşı TRİAXON'un etkili olduğu görülmüştür.NCCLS kriterlerinin kullanılmadığı ülkelerde alternatif olarak DIN, ICS veya diğer standart veyorumlanabilir duyarlılık testleri kullanılabilir.5.2. Farmakokinetik özellikler Genel özellikler Emilim:İntramüsküler, tek doz 1 g'lık uygulamadan sonraki 2-3 saat içinde ulaşılan maksimum plazma konsantrasyonu 81 mg/litre'dir.Bolus intravenöz enjeksiyondan sonra ortalama pik konsantrasyonlar, 500 mg'lık dozu takiben yaklaşık olarak 120 mg/l ve 1 gramlık dozu takiben yaklaşık olarak 200 mg/l'dir; 30 dakikalık 2 gramlık infüzyondan sonra ortalama 250mg/l'lık düzeyler elde edilir. %1,06'lık lidokainde 500 mg TRİAXON'un intramüsküler enjeksiyonu, 1 saat içinde 40-70 mg/l'lık ortalama pik plazma konsantrasyonları oluşturur. İntramüsküler enjeksiyondan sonrabiyoyararlanım %100'dür. Dağılım: Seftriaksonun dağılım hacmi 7-12 litredir. Seftriakson 1-2 g'lık dozdan sonra akciğer, kalp, safra yolu/karaciğer, tonsillalar, orta kulak ve nazal mukoza, kemik, serebrospinal, plevra,prostat ve sinovyal sıvılarının da dahil olduğu 60'ın üzerinde doku ve vücut sıvısında, etkenpatojenlerin çoğunun minimum inhibisyon konsantrasyonunun üzerinde ve 24 saatten uzunsürelerle mükemmel penetrasyon sağlamaktadır.İntravenöz uygulamada, seftriakson interstisyel sıvıya süratle difüze olur ve duyarlı organizmalara karşı 24 saat süren bakterisid konsantrasyonlar sağlanır (şekle bakınız). TRİAXON'unfarmakokinetiği, büyük ölçüde konsantrasyona bağlı olarak serum albüminine bağlanması ilebelirlenir. İnsanda ilacın plazmada serbest (bağlı olmayan) fraksiyonu, terapötik konsantrasyonaralığının çoğu için yaklaşık olarak %5'tir ve 300 mg/l'lik konsantrasyonlarda %15'e yükselir. 12 / 16 Seftriakson albümine geri dönüşümlü olarak bağlanır ve bağlanma oranı ilacın kandaki konsantrasyonu yükseldikçe azalır; örneğin, 100 mg/litre'den düşük plazmakonsantrasyonlarında%95, 300 mg/litre'lik plazma konsantrasyonlarında ise %85 bağlanma görülür. Düşük albüminmiktarına bağlı olarak interstisyel sıvıdaki serbest seftriakson oranı plazmadakine göre dahayüksektir. Seftriakson, yenidoğan, bebek ve çocuklarda enflamasyonlu meninkslere penetre olur. Bebek ve çocuklarda 50-100 mg/kg i.v. TRİAXON enjeksiyonunu izleyen 24 saat içinde,serebrospinalsıvıda seftriakson konsantrasyonu 1,4 mg/litre'nin üstündedir. Serebrospinal sıvıda ortalama 18mg/l olan doruk konsantrasyona i.v. enjeksiyondan yaklaşık 4 saat sonra ulaşılır. Ortalamaserebrospinal sıvı düzeyleri, bakteriyel menenjitte plazma konsantrasyonunun %17'si, aseptikmenenjitte ise %4'ü kadardır. Menenjitli erişkinlerde 50 mg/kg'lık uygulamayla 2-24 saat süreyleelde edilen serebrospinal sıvı konsantrasyonları, menenjitte en sık rastlanan etken patojenlerinMİK değerlerinin birkaç kat üzerindedir. Seftriakson plasentadan geçer ve anne sütünde düşük konsantrasyonlarda bulunur. Biyotransformasyon:Seftriakson sistematik olarak metabolize edilmez, fakat bağırsak florası tarafından inaktif metabolitlere dönüştürülür.Eliminasyon:TRİAXON esas olarak değişmeden atılır. Seftriaksonun %50-60'ı değişmemiş olarak idrarla (tamamına yakını glomerüler filtrasyon ile), %40-50'si ise değişmemiş olaraksafrayla ve bağırsaklarla atılır.Seftriaksonun total plazma klerensi 10-22 ml/dakika'dır. Renal klerens 5-12 ml/dakikadır. Yetişkinlerde eliminasyon yarı-ömrü yaklaşık 8 saattir ve yarı ömür, doz, uygulama yolu veyatekrarlanan uygulamalardan büyük ölçüde etkilenmez. 13 / 16 Doğrusallık/ doğrusal olmayan durum: Seftriaksonun farmakokinetiği lineer değildir. Toplam ilaç konsantrasyonu bazında eliminasyon yarı-ömrü hariç, tüm temel farmakokinetik parametrelerdoza bağımlıdır.Hastalardaki karekteristik özellikler: Yaşlı hastalar:75 yaşın üstündeki yaşlı hastalarda ortalama eliminasyon yarı ömrü genç yetişkinlerle karşılaştırıldığında genellikle 2-3 kez daha uzundur. Tüm sefalosporinlerde olduğugibi, yaşlı hastalarda böbrek fonksiyonundaki azalma, yarı ömürde uzamaya yol açabilir. Ancak,seftriaksonla ilgili bugüne kadar toplanan bulgular, doz rejiminde değişiklik yapılmasının gerekliolmadığını göstermektedir.Yeni doğanlar:%80'i idrarla atılır. Sekiz günlükten küçük bebeklerde ortalama eliminasyon yarı-ömrü genç erişkinlerle karşılaştırıldığında 2-3 kez dahauzundur.Böbrek ve karaciğer yetmezliği olan hastalar: Böbrek veya karaciğer yetmezliği olan hastalarda, seftriaksonun farmakokinetik özelliklerinde çok az değişiklik gözlenir ve eliminasyon yarı ömrühafif düzeyde uzar. Tek başına böbrek fonksiyonlarında bozukluk varsa seftriaksonun safrayoluyla atılımı ve tek başına karaciğer fonksiyonlarında bozukluk varsa böbrek yoluyla atılımıartar.Beyin omurilik sıvısı: TRİAXON inflamasyonlu ve inflamasyonsuz meninkslerden geçer (eş zamanlı plazma konsantrasyonunun %4-17'si düzeyinde bir konsantrasyona ulaşır). 5.3. Klinik öncesi güvenlilik verileri İnsanlarda üreme çalışmaları embriyotoksisite, fetotoksisite, teratojenisite veya doğumda, perinatal ve postnatal gelişimde erkek veya dişi fertilitesinde olumsuz etkiler göstermemiştir.Primatlarda embriyotoksisite veya teratojenisite gözlenmemiştir. 6. FARMASÖTİK ÖZELLİKLER 6.1. Yardımcı maddelerin listesi TRİAXON 1 g i.v. enjeksiyonluk çözelti hazırlamak için toz içeren flakon herhangi bir yardımcı madde içermemektedir. 6.2. Geçimsizlikler TRİAXON içeren çözeltiler diğer ajanlar ile karıştırılmamalı veya diğer ajanlara eklenmemelidir. Özellikle, kalsiyum içeren seyrelticiler (örneğin Ringer çözeltisi veya Hartmançözeltisi) seftriakson flakonlarını rekonstitüe etmek için veya rekonstitüe edilmiş bir flakonu IVuygulama için daha fazla seyreltmek için kullanılmamalıdır, çünkü çökelti oluşabilir.Seftriakson ve kalsiyum içeren çözeltiler karıştırılmamalı veya aynı anda uygulanmamalıdır. 14 / 16 Literatürlerde seftriaksonun amsakrin, vankomisin, flukonazol, aminoglikozidler ve labetalol ile geçimsiz olduğu bildirilmiştir. 6.3. Raf ömrü 24 ay. 6.4. Saklamaya yönelik özel tedbirler 30°C altındaki oda sıcaklığında saklayınız. Işıktan korumak için flakonu dış kartonun içerisinde tutunuz. 6.5. Ambalajın niteliği ve içeriği TRİAXON 1 g i.v. flakon, 1 adet + bir ampul 10 ml steril enjeksiyonluk su içerir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Kullanılmamış olan ürünler ya da atık materyaller 'Tıbbi atıkların kontrolü yönetmeliği ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmelikleri ne uygun olarak imha edilmelidirKural olarak, çözeltiler hazırlandıktan sonra hemen kullanılmalıdır. Intravenöz uygulama için 1 g Triaxon, 10 ml enjeksiyonluk su ile sulandırılır, iyice çalkalanır ve 2 - 4 dakika içinde direkt olarak intravenöz yoldan enjekte edilir. İntravenöz infüzyon için Triaxon yukarıda belirtilen şekil ve miktarlarda sulandırıldıktan sonra 40 ml uygun ve kalsiyum içermeyen bir infüzyon sıvısı (%0,9 sodyum klorür, %0,45 NaCl +%2,5 dekstroz, %5 ve %10 dekstroz, %5 levuloz, dekstroz içinde %6 dekstran, enjeksiyonluk su)içine konur ve 30 dakikalık bir süre içinde infüzyon şeklinde uygulanır. 7. RUHSAT SAHİBİ KOÇAK FARMA İLAÇ VE KİMYA SANAYİ AŞ. Bağlarbaşı, Gazi Cad. No: 64-66 Üsküdar/İSTANBULTel.: 0216 492 57 08Faks: 0216 334 78 88 8. RUHSAT NUMARASI 221/53 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ Ruhsat tarihi: 04.11.2009 Ruhsat yenileme tarihi: 15 / 16
10. KÜB'ÜN YENİLENME TARİHİ
16 / 16 |
İlaç BilgileriTriaxon 1 G I.v. Enjeksiyonluk Toz ve ÇözücüEtken Maddesi: Seftriakson Disodyum Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.