Verzenios 50 Mg Film Kaplı Tablet Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Antineoplastik İlaçlar (Kanser İlaçları) KISA ÜRÜN BİLGİSİBu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERİ TIBBİ ÜRÜNÜN ADIVERZENIOS® 50 mg film kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir film kaplı tablet 50 mg abemasiklib içerir. Yardımcı maddeler:Her bir film kaplı tablet 14 mg sığır kaynaklı laktoz (monohidrat olarak) içerir. Yardımcı maddelerin tamamı için 6.1'e bakınız. 3. FARMASÖTİK FORMFilm kaplı tablet (tablet).Bir tarafında Lilly, diğer tarafında 50 baskısı bulunan, 5.2 x 9.5 mm boyutunda bej, modifiye oval tablet. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarVERZENIOS, - Letrozol veya anastrozol ile kombinasyon halinde, en az %10 östrojen reseptörü pozitif veinsan epidermal büyüme faktörü reseptörü 2 (HER2) negatif postmenopozal metastatik memekanseri olan, adjuvan tedavinin tamamlanmasından 12 ay sonra relaps yapmış ya da ileri evrememe kanseri için daha önce hiç bir endokrin tedavi almamış hastalarda endikedir.- Fulvestrant ile kombinasyon halinde, en az % 10 östrojen reseptörü pozitif ve insan epidermalbüyüme faktörü reseptörü 2 (HER) negatif postmenopozal metastatik meme kanseri olan,fulvestrant ile tedavi edilmemiş hastalarda endikedir, 1- Metastatik hastalığın tedavisi için en az 6 ay boyunca ve en az bir basamak aromataz inhibitörü aldıktan sonra klinik ve/veya radyolojik hastalık progresyonu varlığında fulvestrantile kombinasyon halinde, 1/19 2- En az 12 ay boyunca adjuvan aromataz inhibitörü tedavisi aldıktan sonra veya adjuvan aromataz inhibitörü tedavisini tamamladıktan sonraki 12 ay içinde relaps gösteren hastalardafulvestrant ile kombinasyon halinde kullanılır. a) Adjuvan aromataz inhibitörü tedavisinin ilk 12 ayı içinde relaps yapan hastalardakullanılmaz. b) Metastatik hastalık için bir sıradan daha fazla aromataz inhibitörü almış hastalardakullanılmaz. 4.2 Pozoloji ve uygulama şekliVERZENIOS tedavisi anti-kanser tedavilerinin kullanımı konusunda deneyimli hekimler tarafından başlatılmalı ve bu hekimlerin gözetimi altında uygulanmalıdır. Pozoloji:Endokrin tedaviyle kombinasyon halinde VERZENIOSEndokrin tedaviyle kombinasyon halinde uygulandığında, önerilen abemasiklib dozu günde iki kez 150 mg'dır. Birlikte kullanılacağı diğer ürünün önerilen pozolojisi için ilgili ürünün KısaÜrün Bilgisine bakınız. VERZENIOS, hasta tedaviden klinik yarar sağladığı sürece veya kabul edilemez toksisite gelişene dek sürekli olarak kullanılmalıdır. Eğer hasta kusarsa veya bir VERZENIOS dozunu atlarsa, bir sonraki dozu planlanan zamanda alması gerektiği konusunda bilgilendirilmelidir; ek doz alınmamalıdır. Doz ayarlamalarıBazı advers reaksiyonların yönetilmesi için Tablo 1-5'te gösterilen şekilde doza ara verme ve/veya doz azaltımı gerekebilir. Tablo 1. Advers reaksiyonlar için doz ayarlama önerileri
Tablo 2. Hematolojik toksisiteler için yönetim önerileriVERZENIOS tedavisi başlatılmadan önce, tedavinin ilk iki ayı boyunca iki haftada bir, sonraki iki ay boyunca ayda bir ve klinik olarak endike olduğu şekilde tam kan sayımı kontroledilmelidir. Tedavi başlatılmadan önce mutlak nötrofil sayısı (ANC) >1500/mm3, plateletdüzeyi >100.000/mm3 ve hemoglobin düzeyi >8 g/dL olması önerilmektedir. 2/19
a NCI Advers Olaylar İçin Ortak Terminoloji Kriterleri (CTCAE) b ANC: GRADE 1: ANC < LLN - 1500/mm3; GRADE 2: ANC 1000 - <1500/mm3; GRADE 3: ANC 500 - <1000/mm3; GRADE 4: ANC <500/mm3 LLN: Normal alt limiti Tablo 3. Diyare için yönetim önerileri
3/19 Tablo 4. Aminotransferazların yükselmesi için yönetim önerileriVERZENIOS tedavisi başlatılmadan önce, tedavinin ilk iki ayı boyunca iki haftada bir, sonraki iki ay boyunca ayda bir ve klinik olarak uygulandığı şekilde alanin aminotransferaz (ALT) veaspartat aminotransferaz (AST) kontrol edilmelidir.
Tablo 5. Hematolojik olmayan toksisiteler için yönetim önerileri (diyare ve aminotransferazların yükselmesi hariç)
a NCI CTCAE CYP3A4 inhibitörleriGüçlü CYP3A4 inhibitörlerinin eşzamanlı kullanımından kaçınılmalıdır. Eğer güçlü CYP3A4 inhibitörü kullanımından kaçınılamazsa, abemasiklib dozu günde iki kez 100 mg'adüşürülmelidir. Abemasiklib dozu günde iki kez 100 mg abemasiklibe düşürülmüş ve güçlü bir CYP3A4 inhibitörünün eşzamalı kullanımından kaçınılamayan hastalarda, abemasiklib dozu günde ikikez 50 mg'a düşürülmelidir. Dozu günde iki kez 50 mg abemasiklibe düşürülmüş ve güçlü bir CYP3A4 inhibitörünün eşzamanlı kullanımından kaçınılamayan hastalarda, toksisite belirtileri yakından izlenerekabemasiklib dozu sürdürülebilmektedir. Alternatif olarak, abemasiklib dozu günde bir kez 50mg'a düşürülebilir veya kesilebilir. CYP3A4 inhibitörü kesilirse, abemasiklib dozu, CYP3A4 inhibitörünün başlatılmasından önce kullanılan doza yükseltilmelidir (CYP3A4 inhibitörünün 3 ila 5 yarı ömründen sonra). Uygulama şekli:VERZENIOS oral kullanım içindir. Doz aç veya tok karnına alınabilir. Abemasiklib greyfurt veya greyfurt suyu ile birlikte alınmamalıdır (bkz. Bölüm 4.5). 4/19 Hastalar dozları her gün yaklaşık olarak aynı saatlerde almalıdır. Tablet bütün olarak yutulmalıdır (tabletler yutulmadan önce çiğnenmemeli, ezilmemeli veya bölünmemelidir). Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Hafif veya orta derece böbrek yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli böbrek yetmezliği, son dönem böbrek hastalığı olan veya diyaliz uygulanan hastalardaabemasiklib uygulaması ile ilgili veri yoktur (bkz. Bölüm 5.2). Şiddetli böbrek yetmezliği olanhastalarda, abemasiklib toksisite belirtileri yakından izlenerek dikkatli bir şekildeuygulanmalıdır. Karaciğer yetmezliği:Hafif (Child Pugh A) veya orta derece (Child Pugh B) karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli karaciğer yetmezliği (Child Pugh C) olan hastalardadozlama sıklığının günde bir defaya düşürülmesi önerilmektedir (bkz. Bölüm 5.2). Pediyatrik popülasyon:18 yaş altı çocuklarda abemasiklibin güvenliliği ve etkililiği belirlenmemiştir. Bu konuda veri yoktur. Geriyatrik popülasyon:Yaşa göre doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). 4.3 KontrendikasyonlarEtkin maddeye veya bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine aşırı duyarlılık. 4.4 Özel kullanım uyarıları ve önlemleriNötropeniAbemasiklib kullanan hastalarda nötropeni bildirilmiştir. GRADE 3 veya 4 nötropeni gelişen hastalarda doz modifikasyonu önerilmektedir (bkz. Bölüm 4.2). Ölümcül olaylar, hastaların <%1'inde meydana gelmiştir. Hastalar herhangi bir ateş epizodunu sağlık uzmanlarına bildirmelerikonusunda bilgilendirilmelidir. Enfeksiyonlar / enfestasyonlarAbemasiklib artı endokrin tedavisi alan hastalarda, plasebo artı endokrin tedavisi alan hastalardan daha yüksek oranda enfeksiyon bildirilmiştir. Eş zamanlı nötropenisi olmayanabemasiklib alan hastalarda akciğer enfeksiyonu bildirilmiştir. Ölümcül olaylar, hastaların <%1'inde meydana gelmiştir. Hastalar enfeksiyonun belirtileri ve semptomları açısından izlenmelive tıbbi açıdan uygun olan şekilde tedavi edilmelidir. Venöz TromboembolizmVenöz tromboembolik olaylar abemasiklib artı fulvestrant veya aromataz inhibitörleriyle tedavi edilen hastaların %5.3'ünde, plasebo artı fulvestrant veya aromataz inhibitörleriyle tedaviedilen hastaların %0.8'inde bildirilmiştir. Hastalar derin ven trombozu ve pulmoner embolizmbelirti ve semptomları açısından izlenmeli ve tıbbi açıdan uygun olan şekilde tedavi edilmelidir. 5/19 Artmış AminotransferazlarAbemasiklib kullanan hastalarda ALT ve AST yükselmesi bildirilmiştir. ALT ve AST artış düzeyine bağlı olarak, abemasiklib dozunun değiştirilmesi gerekebilir (bkz. Bölüm 4.2). DiyareDiyare en yaygın advers reaksiyondur. Klinik çalışmalarda, ilk diyare olayının başlangıcına kadar geçen medyan süre yaklaşık 6-8 gün, medyan diyare süresi 9-12 gün (GRADE 2) ve 6-8gün (GRADE 3) olarak belirlenmiştir. Diyare dehidrasyon ile ilişkili olabilir. Hastalar ilk suludışkı bulgusu tespit ettiğinde loperamid gibi bir antidiyareik tedavisine başlamalı, oral sıvıalımını artırmalı ve doktorunu bilgilendirmelidir. > GRADE 2 diyare gelişen hastalarda dozmodifikasyonu önerilmektedir (bkz. Bölüm 4.2). CYP3A4 indükleyicileri ile eşzamanlı kullanımAbemasiklib etkililiğinde azalma riski nedeniyle CYP3A4 indükleyicilerinin eşzamanlı kullanımından kaçınılmalıdır (bkz. Bölüm 4.5). Viseral krizViseral kriz gelişen hastalarda abemasiklibin etkililiği ve güvenliliği hakkında veri yoktur. LaktozNadir kalıtımsal galaktoz intoleransı, total laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDiğer tıbbi ürünlerin abemasiklib farmakokinetikleri üzerindeki etkileriAbemasiklib primer olarak CYP3A4 tarafından metabolize edilir.CYP3A4 inhibitörleriAbemasiklibin bazı CYP3A4 inhibitörleriyle birlikte uygulanması abemasiklib plazma konsantrasyonlarını artırabilir. İleri evre ve/veya metastatik kanser hastalarında bir CYP3A4inhibitörü olan klaritromisin ile birlikte uygulama, abemasiklibin plazma maruziyetinde 3,4 katartış, abemasiklib ve aktif metabolitlerinin kombine bağlı olmayan potansiyel plazmamaruziyetinde ise 2,5 kat artışa yol açmıştır. Abemasiklib ile birlikte güçlü CYP3A4 inhibitörlerinin kullanılmasından kaçınılmalıdır. Eğer güçlü CYP3A4 inhibitörlerinin birlikte uygulanması gerekiyorsa, abemasiklib dozuazaltılmalıdır (bkz bölüm 4.2), ardından toksisitenin dikkatlice izlenmesi gerekir. GüçlüCYP3A4 inhibitörlerinin örnekleri bunlarla birlikte ama bunlarla sınırlı olmayan: klaritromisin,itrakonazol, ketokonazol, lopinavir/ritonavir, posakonazol veya vorikonazolu içermektedir.Greyfurt veya greyfurt suyundan kaçınılmalıdır. Orta veya zayıf CYP3A4 inhibitörleri ile tedavi edilen hastalar için doz ayarlaması gerekmez. Bununla birlikte, toksisite belirtileri için yakın izleme yapılmalıdır. CYP3A4 indükleyicileri6/19 Abemasiklibin güçlü CYP3A4 indükleyicisi rifampisin ile birlikte uygulanması, abemasiklibin plazma konsantrasyonunu %95 ve bağlı olmayan potansiyel abemasiklibin konsantrasyonunuve aktif metabolitlerini EAA0-ro değerine göre %77 oranında azaltmıştır. Güçlü CYP3A4indükleyicilerinin birlikte kullanımından (karbamazepin, fenitoin, rifampisin ve St. John's wortdahil, ancak bunlarla sınırlı olmamak üzere), abemasiklibin etkililiğinin azaltılması riskinedeniyle kaçınılmalıdır. Abemasiklibin diğer tıbbi ürünlerin farmakokinetikleri üzerindeki etkileriTaşıyıcı substratı olan tıbbi ürünlerAbemasiklib ve majör aktif metabolitleri renal taşıyıcılar olan organik katyon taşıyıcı 2 (OCT2), çoklu ilaç ve toksin ekstrüzyon proteini (MATE1) ve MATE2-K'yi inhibe eder. Butaşıyıcıların dofetilid veya kreatinin gibi klinik olarak anlamlı substratları ile abemasiklibarasında in vivoetkileşimler gerçekleşebilir (bkz. Bölüm 4.8). Abemasiklib 400 mg vemetforminin (OCT2, MATE1 ve 2 substratı) birlikte uygulandığı bir klinik ilaç etkileşimiçalışmasında, metformin plazma maruziyetinde küçük ancak klinik açıdan anlamlı olmayan birartış (%37) gözlemlenmiştir. Bu artışın, glomerüler filtrasyondan etkilenmediği renal sekresyonazalmasına bağlı olduğu tespit edilmiştir.Sağlıklı bireylerde abemasiklib ile bir P-glikoprotein (P-gp) substratı olan loperamidin birlikte uygulanması, loperamid plazma maruziyetinde EAA0-® değerine göre %9, Cmaks değerine göre%35 artışa yol açmıştır. Bu artış klinik açıdan anlamlı bulunmamıştır. Bununla birlikte,abemasiklib ile gözlemlenen in vitroin vivoetkileşim gerçekleşebilir.Meme kanseri hastalarının yer aldığı bir klinik çalışmada, abemasiklib ile anastrozol, fulvestrant, eksemestan, letrozol veya tamoksifen arasında klinik açıdan anlamlıfarmakokinetik ilaç etkileşimi gözlenmemiştir. Abemasiklibin sistemik etki gösteren hormonal kontraseptiflerin etkinliğini azaltıp azaltmadığı henüz bilinmemektedir; bu nedenle, sistemik etkili hormonal kontraseptif kullanan kadınlarınek olarak bariyer yöntemi uygulaması önerilmektedir. Özel popülasyonlara ilişkin ek bilgiler:Hiçbir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:Hiçbir etkileşim çalışması yapılmamıştır. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)7/19 Çocuk doğurma potansiyeli olan kadınlar tedavi sırasında ve tedavi tamamlandıktan sonra en az 3 hafta boyunca yüksek oranda etkili kontrasepsiyon yöntemleri (ör. çift bariyerkontrasepsiyon) kullanmalıdır (bkz. Bölüm 4.5). Gebelik dönemiGebe kadınlarda abemasiklib kullanımıyla ilgili veri yoktur. Hayvanlarda yapılan çalışmalarda üreme toksisitesi gösterilmiştir (bkz. Bölüm 5.3). VERZENIOS, gebelik sırasında vekontrasepsiyon kullanmayan çocuk doğurma potansiyeli olan kadınlarda önerilmemektedir. Laktasyon dönemiAbemasiklibin anne sütüne geçip geçmediği bilinmemektedir. Yenidoğana/bebeğe yönelik risk dışlanamaz. Abemasiklib kullanan hastalar emzirmemelidir. Üreme yeteneği /FertiliteAbemasiklibin insanlarda fertilite üzerindeki etkisi bilinmemektedir. Hayvan çalışmalarında, dişi üreme organları üzerinde etki gözlenmemiştir. Bununla birlikte, sıçanlarda ve köpeklerdeerkek üreme sistemindeki sitotoksik etkiler abemasiklibin erkeklerde fertilite bozukluğunaneden olabileceğine işaret etmektedir (bkz. Bölüm 5.3). 4.7 Araç ve makine kullanımı üzerindeki etkilerVERZENIOS'un araç ve makine kullanımı üzerindeki etkisi çok azdır. VERZENIOS ile tedavi sırasında hastalara yorgunluk veya baş dönmesi yaşamaları durumunda araba sürerken veyakullanırken dikkatli olmaları önerilmelidir (bkz. Bölüm 4.8). 4.8 İstenmeyen etkilerGüvenlilik profili özetiEn sık gelişen advers reaksiyonlar diyare, enfeksiyonlar, nötropeni, anemi, yorgunluk, bulantı, kusma ve iştah kaybıdır. Advers reaksiyonların tablo halinde listesiAşağıdaki tablolarda, advers reaksiyonların sıklığı ve şiddeti MedDRA vücut sistem organ sınıfı, sıklık ve şiddet derecesine (GRADE'e) göre listelenmiştir. Sıklık dereceleri: Çok yaygın(>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Her sıklık grubunda, advers reaksiyonlar azalan sıklıkta sunulmaktadır.
8/19
9/19 Enfeksiyonlar, Sistem Organ Sınıfı Enfeksiyonlar ve enfestasyonlar kapsamında olan tüm PT'leri içermektedir.
b
c
Venöz tromboembolik olaylar arasında DVT, pulmoner embolizm, serebral venöz sinüs trombozu, subklavyen, aksiller ven trombozu, DVT inferior vena kava ve pelvik venöztromboz yer alır. Seçili advers reaksiyonların tanımıNötropeniAromataz inhibitörleri veya fulvestrant ile kombinasyon halinde abemasiklib alan hastaların %45,1'inde nötropeni sıklıkla bildirilmektedir ve hastaların %28,2'sinde nötrofil sayısındaGRADE 3 veya 4 azalma (laboratuvar bulgularına göre) bildirilmektedir. GRADE 3 veya 4nötropeni başlangıcına kadar geçen medyan süre 29-33 gün, iyileşmeye kadar geçen medyansüre 11-15 gün olarak belirlenmiştir. Hastaların %0,9'unda febril nötropeni bildirilmiştir.GRADE 3 veya 4 nötropeni gelişen hastalarda doz modifikasyonu önerilmektedir (bkz. Bölüm4.2). DiyareDiyare en sık bildirilen advers reaksiyondur (bkz. Tablo 6). Abemasiklib tedavisinin ilk ayı içinde en yüksek düzeyde kaydedilen insidans daha sonra düşmüştür. Çalışmalarda, ilk diyareolayının başlangıcına kadar geçen medyan süre yaklaşık 6-8 gün, medyan diyare süresi 9-12gün (GRADE 2) ve 6-8 gün (GRADE 3) olarak belirlenmiştir. Diyare, loperamid gibidestekleyici tedaviler ve/veya doz ayarlaması sonucunda başlangıca veya daha düşükGRADE'e gerilemiştir (bkz. Bölüm 4.2). Artmış AminotransferazlarAromataz inhibitörleri veya fulvestrant ile kombinasyon halinde abemasiklib alan hastalarda ALT ve AST artışı sık bildirilirken (sırasıyla %15,1 ve %14,2), GRADE 3 veya 4 ALT veyaAST artışları (laboratuvar bulgularına göre) hastaların %6,1 ve %4,2' sinde bildirilmiştir.GRADE 3 veya 4 ALT artışı başlangıcına kadar geçen medyan süre 57-61 gün, iyileşmeyekadar geçen medyan süre 14 gün olarak belirlenmiştir. Grade 3 veya 4 AST artışı başlangıcınakadar geçen medyan süre 71 ila 185 gündür ve normale dönmesi için geçen medyan süre 13 ila15 gündür. GRADE 3 veya 4 ALT veya AST artışı gelişen hastalarda doz modifikasyonuönerilmektedir (bkz. Bölüm 4.2). KreatininAdvers reaksiyon olarak kabul edilmese de, abemasiklibin hastaların %98,3'ünde serum kreatinin artışına yol açtığı gösterilmiş (laboratuvar bulgularına göre) ve hastaların %1,9'undaGRADE 3 veya 4 artış (laboratuvar bulgularına göre) kaydedilmiştir. Tek başına aromatazinhibitörü veya fulvestrant alan hastaların %78,4'ünde serum kreatinin artışı bildirilmiştir (tümlaboratuvar derecelerinde). Abemasiklibin, renal tübüler sekresyon taşıyıcılarının inhibisyonuaracılığıyla glomerüler fonksiyonu etkilemeden (ioheksol klerensine göre ölçülen) serumkreatinin düzeyini artırdığı gösterilmiştir (bkz. Bölüm 4.5). Klinik çalışmalarda, serumkreatinin artışları abemasiklib dozlamasının ilk ayında ortaya çıkmış, tedavi dönemi boyuncayüksek ancak stabil kalmış, tedavi bırakıldıktan sonra geri dönüşümlü seyir izlemiş ve buna kanüre azotu (BUN), sistatin C veya sistatin C baz alınarak hesaplanan glomerüler filtrasyon hızı 10/19 gibi böbrek fonksiyonu belirteçlerinde değişiklikler eşlik etmemiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlanma yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr, e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9 Doz aşımı ve tedavisiAbemasiklib doz aşımı durumunda, yorgunluk ve diyare gelişebilir. Genel destekleyici tedavi uygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Diğer antineoplastik ajanlar, Protein kinaz inhibitörleri, ATC kodu: L01XE50 Etki mekanizmasıAbemasiklib, siklin bağımlı kinaz 4 ve 6'nın (CDK4 ve CDK6) potent ve seçici bir inhibitörü olup, enzimatik testlerde en çok Siklin D1/CDK4'e karşı aktif olduğu bulunmuştur.Abemasiklib retinoblastom proteininin (Rb) fosforilasyonunu önleyerek hücre döngüsününG1'den hücre bölünmesi S fazına ilerlemesini bloke eder ve böylece tümör büyümesininbaskılanmasını sağlar. Östrojen reseptörü pozitif meme kanseri hücre soylarında abemasiklibile sağlanan uzun süreli hedef inhibisyonu Rb fosforilasyonunun geri dönüşünü önleyerek hücreyaşlanmasına ve apoptoza yol açmıştır. İn vitro, Rb-negatif ve Rb-depleted kanser hücreserileri, genellikle abemasiklibe karşı daha az hassastır. Meme kanseri ksenogreft modellerinde,klinik açıdan anlamlı konsantrasyonlarda tek başına veya anti-östrojenlerle kombinasyonhalinde kesintisiz olarak her gün dozlama yapılarak uygulanan abemasiklib tümör boyutundaküçülme sağlamıştır. Farmakodinamik etkilerG1 restriksiyon noktasından önce hücre döngüsü inhibisyonuyla sonuçlanan Rb fosforilasyonu ve topoizomeraz II alfa inhibisyonundan anlaşıldığı üzere, abemasiklib kanser hastalarındaCDK4 ve CDK6'yı inhibe eder. Kardiyak elektrofizyolojiAbemasiklibin QTcF aralığı üzerindeki etkisi 144 ileri evre kanser hastasında değerlendirilmiştir. Terapötik dozlama programının ardından gözlemlenen ortalama maksimumkararlı durum abemasiklib konsantrasyonunda QTcF aralığında büyük bir değişiklik (>20 ms)saptanmamıştır. Sağlıklı bireylerde günde iki kez 200 mg dozuna benzer maruziyet düzeylerinde yapılan maruziyet-yanıt analizinde, abemasiklibin QTcF aralığını klinik açıdan anlamlı derecedeuzatmadığı belirlenmiştir. 11/19 Klinik etkililik ve güvenlilikRandomize Faz 3 Çalışma MONARCH 3: Aromataz inhibitörleriyle kombinasyon halinde VERZENIOSBir aromataz inhibitörü (anastrozol veya letrozol) ile kombinasyon halinde VERZENIOS'un etkililiği ve güvenliliği, bu hastalık koşullarında önceden sistemik tedavi uygulanmamış HRpozitif, HER2 negatif, lokal olarak ilerlemiş veya metastatik meme kanseri olan kadınların yeraldığı randomize, çift kör, plasebo kontrollü bir faz 3 çalışma olan MONARCH 3 çalışmasındadeğerlendirilmiştir. Hastalar, günde iki kez 150 mg VERZENIOS artı aynı programa göreplasebo artı nonsteroid aromataz inhibitörüne karşı önerilen dozda günlük olarak uygulanannonsteroid aromataz inhibitörü almak üzere 2:1 oranında randomize edilmiştir. Primer sonlanımnoktası RECIST 1.1 uyarınca araştırmacı tarafından değerlendirilen progresyonsuz sağkalım(PFS), temel sekonder etkililik sonlanım noktaları ise objektif yanıt oranı (ORR), klinik yararoranı (KYO) ve genel sağkalım (GS) olarak belirlenmiştir. Çalışmaya alınan hastaların medyan yaşı 63 (aralık: 32-88) olarak kaydedilmiştir. Neo(adjuvan) koşullarda hastaların yaklaşık %39'u kemoterapi ve %44'ü antihormonal tedavi almıştır.Önceden (neo) adjuvan endokrin tedavisi alan hastalar, bu tedaviyi çalışmarandomizasyonundan en az 12 ay önce tamamlamış olmalıdır. Hastaların büyük bölümünde(%96) başlangıçta metastatik hastalık tespit edilmiştir. Hastaların yaklaşık %22'sinde yalnızcakemikte hastalık gözlenirken, %53'ünde viseral metastazlar belirlenmiştir. Çalışma, PFS'nin iyileştirilmesi olarak belirlenen primer sonlanım noktasını karşılamıştır. Primer etkililik bulguları Tablo 7 ve Şekil 1'de özetlenmektedir.
12/19
c Tam yanıt + kısmi yanıt + >6 ay boyunca stabil hastalık N=hasta sayısı; CI=güven aralığı; NR=ulaşılmamıştır. Şekil 1. MONARCH 3: Progresyonsuz sağkalıma ilişkin Kaplan-Meier grafiği (Araştırmacı değerlendirmesi, tedavisi amaçlanan popülasyon)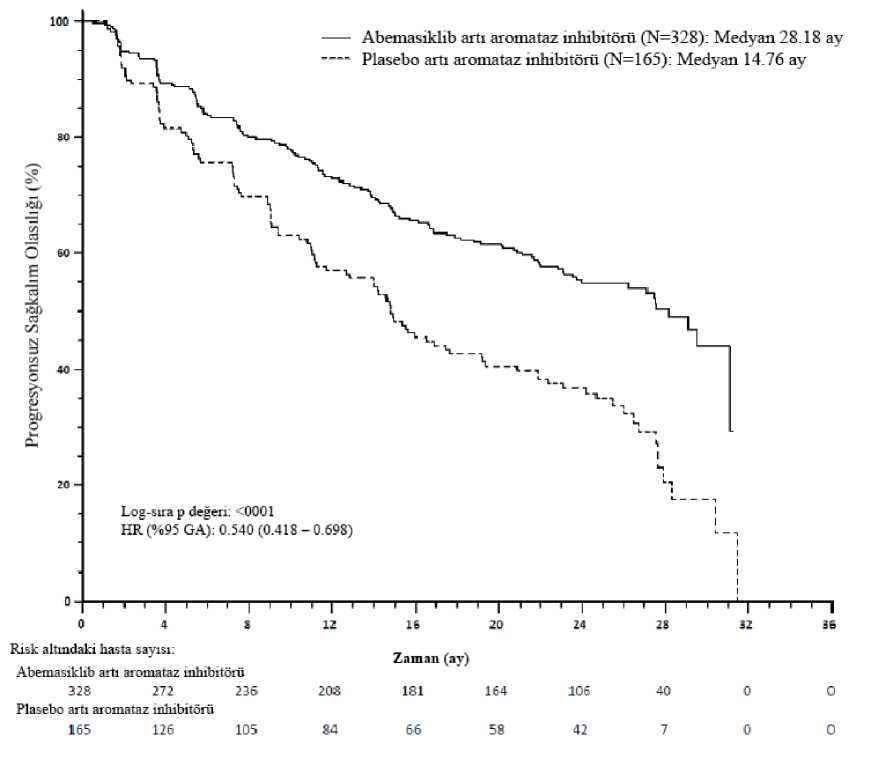 Progresyonsuz sağkalım (PFS) VERZENIOS artı aromataz inhibitörü (Aİ) kolunda anlamlı ölçüde uzamıştır (Tehlike Oranı [HR] 0,540 [%95 GA, 0,418-0,698]); medyan PFSVERZENIOS artı Aİ kolunda 28,18 ay, plasebo artı Aİ kolunda 14,76 ay olarak belirlenmiştir.Bu bulgular, abemasiklib artı aromataz inhibitörü ile tedavi edilen hastalarda hastalık 13/19 progresyonu veya ölüm riskinde %46 oranında klinik açıdan anlamlı bir azalmaya karşılık gelmektedir. Son PFS analizi sırasında genel sağkalım verileri olgunlaşmamıştır (iki kolda 93 olay gözlemlenmiştir). HR 1,057 (%95 GA: 0,683, 1,633), p=0,8017 olarak bildirilmiştir. Önceden belirlenmiş bir dizi alt grup PFS analizi göstermiştir ki, yaş (<65 veya >65 yıl), hastalık bölgesi, hastalık durumu (de novo metastatik veya rekürren metastatik ya da lokalolarak ilerlemiş rekürren), ölçülebilir hastalığın varlığı, progesteron reseptörü durumu dahilolmak üzere hasta alt grupları arasında ve temel ECOG performans durumu parametrelerindesonuçlar tutarlıdır. Hastalık progresyonu veya ölüm riskinde azalma viseral hastalık bulunanhastalar (HR 0,567 [%95 GA: 0,407, 0,789], medyan PFS 21,6 ay ve 14,0 ay), yalnızca kemiktehastalık bulunan hastalar (HR 0,565, [%95 GA: 0,306, 1,044]) ve ölçülebilir hastalık bulunanhastalarda (HR 0,517, [%95 GA: 0,392, 0,681]) gözlenmiştir. Randomize Faz 3 Çalışma MONARCH 2: Fulvestrant ile kombinasyon halinde VERZENIOSFulvestrant ile kombinasyon halinde VERZENIOS'un etkililiği ve güvenliliği HR pozitif, HER2 negatif, lokal olarak ilerlemiş veya metastatik meme kanseri olan kadınların yer aldığırandomize, çift kör, plasebo kontrollü bir faz 3 çalışma olan MONARCH 2 çalışmasındadeğerlendirilmiştir. Hastalar, günde iki kez 150 mg VERZENIOS artı ilk dozdan iki hafta sonrauygulanan ek 500 mg dozla birlikte bir aylık aralıklarla 500 mg fulvestrant ve plasebo artı aynıprograma göre tek başına fulvestrant almak üzere 2:1 oranında randomize edilmiştir. Primersonlanım noktası RECIST 1.1 uyarınca araştırmacı tarafından değerlendirilen PFS, temelsekonder etkililik sonlanım noktaları ise objektif yanıt oranı (ORR), klinik yarar oranı (KYO)ve genel sağkalım (GS) olarak belirlenmiştir. Çalışmaya alınan hastaların medyan yaşı 60 (aralık: 32-91) olarak kaydedilmiştir. Her tedavi kolunda hastaların büyük bölümü beyaz ırktandır ve daha önce metastatik hastalık içinkemoterapi almamıştır. GnRH agonisti ile overi baskılanan hastaların %17'sipre/perimenopozal dönemdedir. Hastaların yaklaşık %56'ında viseral Hastaların yaklaşık %25'i primer endokrin direncine sahiptir (adjuvan endokrin tedavisinin ilk 2 yılında endokrinterapisinde ilerleme veya metastatik meme kanseri için ilk sıradaki endokrin tedavisinin ilk 6ayında) ve çoğunluğunda endokrin direnci daha sonra gelişmiştir.Hastaların % 59'u (neo)adjuvan basamakta ve % 38'i metastatik basamakta en son endokrin tedavisini almıştır. Çalışma, PFS'de primer sonlanım noktasını karşılamıştır. Primer etkililik bulguları Tablo 8 ve Şekil 2'de özetlenmektedir. Tablo 8. MONARCH2:Etkililik verilerinin özeti (Araştırmacı değerlendirmesi, tedavisi amaçlanan popülasyon)
14/19
Şekil 2. MONARCH 2: Progresyonsuz sağkalıma ilişkin Kaplan-Meier grafiği (Araştırmacı değerlendirmesi, tedavisi amaçlanan popülasyon)15/19
Medyan PFS VERZENIOS artı fulvestrant kolunda anlamlı ölçüde uzamış (HR 0,553 [%95 GA 0,449, 0,681]) ve VERZENIOS artı fulvestrant kolunda medyan PFS 16,4 ay, plasebo artıfulvestrant 9,3 ay olarak belirlenmiştir. Bu bulgular, VERZENIOS artı fulvestrant ile tedaviedilen hastalarda hastalık progresyonu veya ölüm riskinde klinik açıdan anlamlı olan %44,7azalmaya ve medyan PFS'de 7,2 aylık artışa karşılık gelmektedir. VERZENIOS artı fulvestrant sağlıkla ilgili yaşam kalitesinde klinik açıdan anlamlı veya önemli bir zarara yol açmadan progresyonsuz sağkalımı uzatmıştır. Final PFS analizi sırasında genel sağkalım verileri olgunlaşmamıştır (iki kolda 133 olay gözlemlenmiştir). HR 0,854 (%95 GA: 0,598, 1,221), p=0,3886 olarak bildirilmiştir. Önceden belirlenmiş bir dizi alt grup PFS analiziyapılmıştır, yaş (<65 veya >65 yıl), ırk, coğrafi bölge, hastalık bölgesi, endokrin tedavi direnci, ölçülebilir hastalık varlığı, progesteronreseptörü durumu ve menopozal durum dahil olmak üzere hasta alt grupları arasında tutarlısonuçlar göstermiştir. Hastalık progresyonu veya ölüm riskinde azalma viseral hastalık bulunanhastalar (HR 0,481 [%95 GA: 0,369, 0,627], medyan PFS 6,5 aya karşılık 14,7 ay ), yalnızcakemikte hastalık bulunan hastalar (HR 0,543, [%95 GA: 0,355, 0,833]) ve ölçülebilir hastalıkbulunan hastalarda (HR 0,523, [%95 GA: 0,412, 0,644]) gözlemlenmiştir. Tehlike oranı,pre/perimenopozal dönemdeki hastalarda 0,415 (%95 GA: 0,246, 0,698), progesteron reseptörünegatif hastalarda ise 0,509 [%95 GA: 0,325, 0,797]) olarak belirlenmiştir. 16/19 PFS, lokal olarak ilerlemiş veya metastatik hastalığı olan ve önceden endokrin tedavisi almayan alt popülasyonda da tutarlıdır. 5.2 Farmakokinetik özelliklerGenel özelliklerEmilim:Abemasiklib, Tmaks değeri 8 saat ve ortalama mutlak biyoyararlanımı yaklaşık %45 olan yavaş emilimli bir ilaçtır. 50-200 mg terapötik doz aralığında, plazma maruziyeti (EAA) ve Cmaksdeğerindeki artış dozla yaklaşık olarak orantılıdır. Tekrarlanan günde iki kez dozlamadan sonrakararlı duruma 5 gün içinde ulaşılırken, abemasiklibin Cmaks ve EAA'ya göre sırasıyla 3,7 (%58CV) ve 5,8 (%65 CV) geometrik ortalama birikim oranıyla biriktiği belirlenmiştir. Yüksek yağiçerikli öğün abemasiklib ve aktif metabolitlerinin kombine EAA değerini %9, Cmaks değerini%26 artırmıştır. Bu değişiklikler klinik açıdan anlamlı bulunmamıştır. Dolayısıyla, abemasiklibaç veya tok karnına alınabilir. Dağılım:Abemasiklib insanlarda plazma proteinlerine yüksek oranda bağlanır (ortalama bağlı fraksiyon yaklaşık %96-98). Yaklaşık 750 L (%69 CV) olarak belirlenen geometrik ortalama sistemikdağılım hacmi abemasiklibin dokulara dağıldığını göstermektedir. Abemasiklib ve aktif metabolitlerinin beyin-omurilik sıvısındaki konsantrasyonları bağlanmamış plazma konsantrasyonlarına benzerdir. Biyotransformasyon:Abemasiklibin temel klerens yolu hepatik metabolizmadır. Abemasiklib, ağırlıklı olarak sitokrom P450 (CYP) 3A4 tarafından çeşitli metabolitlere metabolize edilir. Primerbiyotransformasyon, ana ilacın % 77'si olan bir EAA ile sirküle olan bir metabolitehidroksilasyondur. Ek olarak, N-desetil ve N-desetilhidroksi metabolitleri, ana ilacın % 39 ve% 15'i olan EAA'larda sirküle olmaktadır. Bu sirküle olan metabolitler, abemasiklibe benzer birpotansiyele sahiptir. Eliminasyon:Abemasiklibin geometrik ortalama hepatik klerensi (CL) 21,8 L/sa. (%39,8 CV) olarak hesaplanırken, hastalardaki ortalama plazma eliminasyon yarılanma ömrü 24,8 saat (%52,1CV) olarak belirlenmiştir. [14C]-abemasiklibin tek oral dozundan sonra dozun yaklaşık %81'ifeçes ve %3,4'ü idrar ile atılır. Feçeste elimine edilen dozun büyük kısmı metabolitlerdir. Doğrusallık/doğrusal olmayan durum:Veri bulunmamaktadır. Hastalardaki karekteristik özelliklerÖzel popülasyonlar:Yaş, cinsiyet ve vücut ağırlığı:Kanser hastalarına ilişkin popülasyon farmakokinetiği analizinde (135 erkek, 859 kadın; yaş aralığı 24-91 yaş, vücut ağırlığı aralığı 36-175 kg) yaş, cinsiyet ve vücut ağırlığının abemasiklib 17/19 maruziyeti üzerinde etki göstermediği saptanmıştır. Karaciğer yetmezliği:Abemasiklib karaciğerde metabolize edilir. Hafif (Child Pugh A) ve orta derece (Child Pugh B) karaciğer yetmezliğinin abemasiklib maruziyeti üzerinde etkisi olmadığı belirlenmiştir.Şiddetli karaciğer yetmezliği (Child Pugh C) bulunan hastalarda bağlanmamış abemasiklib artıaktif metabolitleri sırasıyla 2,1 kat ve 2,4 kat artmıştır. Abemasiklibin yarı ömrü 24 saatten 55saate yükselmiştir (Bkz. Bölüm 4.2). Böbrek yetmezliği:Abemasiklib ve metabolitlerinin renal klerensi minör düzeydedir. Hafif ve orta derece böbrek yetmezliğinin abemasiklib maruziyeti üzerinde etkisi olmadığı belirlenmiştir. Şiddetli böbrekyetmezliği, son dönem böbrek hastalığı olan veya diyaliz uygulanan hastalarla ilgili veri yoktur. 5.3 Klinik öncesi güvenlilik verileriİnsanlarla potansiyel olarak ilgili olan primer hedef organ bulguları, 13 haftaya kadar sürdürülen çalışmalarda sıçan ve köpeklerde görülen gastrointestinal ve hematolenfopoetikorgan etkileridir. Akciğer ve iskelet kası üzerindeki etkiler, yalnızca sıçanlarda insan maruziyetseviyelerinden yaklaşık 2 kat daha yüksek maruziyet seviyelerinde ve böbreklerdeki etkiler,yalnızca sıçanlarda insan maruziyet seviyelerinden yaklaşık 6 kat daha yüksek maruziyetseviyelerinde meydana gelmiştir. 28 günlük iyileşme süresinin sonunda tüm hedef organlardatam veya kısmi iyileşme gözlenmiştir. GenotoksisiteAbemasiklib bakteriyel ters mutasyon (Ames) testinde mutajenik, insan periferik kan lenfositlerindeki in vitro kromozomal aberasyon testinde klastojenik ve in vivo sıçan kemikiliği mikronükleus testinde klastojenik bulunmamıştır. KarsinojenisiteAbemasiklibin karsinojenik potansiyelini test etmek için spesifik hayvan çalışması yapılmamıştır. Gelişim toksisitesiAbemasiklib, insanlar için önerilen doza benzer maternal maruziyetlerde teratojenik bulunmuş ve fetus ağırlığında azalmaya neden olmuştur. 6. FARMASOTIK ÖZELLİKLER6.1 Yardımcı maddelerin listesiTablet çekirdeğiKroskarmelloz sodyum Laktoz monohidrat; Laktoz HidratMikrokristalin selüloz 101Mikrokristalin selüloz 102 Silikon Dioksit; Silika, Sulu Kolloidal; Sulu Silikon Dioksit 18/19 Sodyum stearil fumarat Film kaplamaPolivinil alkol - Kısmen Hidrolize Edilmiş (E1203) Titanyum dioksit (E171) Makrogol 4000 / PEG MW 3350 (E1521) Talk (E553b) Sarı demir oksit (E172) Kırmızı demir oksit (E172) 6.2 GeçimsizliklerGeçerli değildir. 6.3 Raf ömrü24 ay 6.4 Saklamaya yönelik özel uyarılar30°C altındaki oda sıcaklığında saklayınız. 6.5 Ambalajın niteliği ve içeriğiAlüminyum folyo ile kapatılmış PCTFE/PE/PVC blisterlerde 28, 42 veya 56 film kaplı tabletlik ambalajlarda Tüm ambalaj boyutlarında pazarlanmayabilir. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİLilly İlaç Ticaret Ltd ŞtiAcıbadem Mah. Çeçen SokakAkasya Acıbadem Kent EtabıA Blok Kat: 334660 Üsküdar / İstanbul Tel : 0 216 554 00 00 Faks : 0 216 474 71 99 8. RUHSAT NUMARASI(LARI)2019/124 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 28.02.2019 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ19/19 |
İlaç BilgileriVerzenios 50 Mg Film Kaplı TabletEtken Maddesi: Abemasiklib Atc Kodu: L01EF03 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.
