Nurse Baby 50 Mg/5 Ml Oral Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADINURSE BABY 50 mg/5 ml oral çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMHer 5 ml çözelti; Etkin madde:Sodyum bikarbonat 50 mg Yardımcı maddeler:Sukroz 1500 mg Polioksil 40 hidrojene hint yağı (PEG 40) 50 mg içerir. Yardımcı maddeler için, 6.1'e bakınız. 3. FARMASÖTİK FORMSteril Oral Çözelti Renksiz, berrak - sarımsı çözelti 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarBebeklerde mide gazı, infantil kolik ve gaz şikayeti ile ilişkili tüm ağrılarda semptomatik iyileşme sağlamada endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:1 ila 6 ay arası bebeklerde: Günde en fazla 6 kere 5 ml çözelti (5 ml'lik pipet ile) 6 ila 12 ay arası bebeklerde: Günde en fazla 6 kere 10 ml çözelti kullanılır. 1 aylıktan küçük bebeklerde kontrendikedir. 1 yaşın üstündeki çocuklarda kullanımı önerilmez. Uygulama şekli:NURSE BABY besinlerle birlikte kullanılabilir. Ağız yolu ile kullanılır. Besinlere ya da biberona karıştırılarak verilmesi önerilmez. Günde 6 dozdan fazla kullanılmamalıdır. Kullanıma hazır hale getirmek için aşağıdaki talimatlar izlenir:NURSE BABY rezervuar kapak sistemi ile kapatılmıştır. Kapak içinde sodyum bikarbonat içeren piston bulunmaktadır. Pistonun ucu tıpa ile kapalıdır. 1 / 6 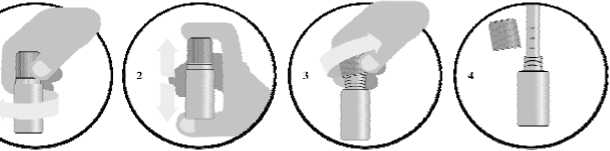
Şekil 1.
Kapak emniyet halkası kırılana kadar Şekil 1'deki gibi çevrilmelidir. Kapağın içindeki sodyum bikarbonat içeren piston, otomatik olarak tıpayı delerek sodyum bikarbonatınflakondaki sıvıya karışmasını sağlayacaktır. Şekil 2. Şişe içerisinde partikül (parçacık) kalmayana kadar kuvvetlice çalkalanır. Şekil 3. Kapak açılır. Şekil 4. Pipetle uygun dozdaki çözelti kullanılır ve kapak tekrar kapatılır. Kullanıma hazır hale getirilmiş çözelti 24 saat içinde kullanılmalı, kullanılmayan kısmı ise atılmalıdır. Özel popülasyonlara ilişkin ek bilgiler Böbrek/Karaciğer yetmezliği:Böbrek yetmezliği olan hastalarda kullanılmamalıdır. Böbrek ve/veya karaciğer yetmezliği durumlarında doz ayarlaması gerekir. Vücutta sıvı tutulumu veya karın zarı boşluğunda sıvı toplanması varsa, vücuda giren sodyum miktarı göz önünde bulundurulmalıdır. Pediyatrik popülasyon1 aylıktan küçük bebeklerde kullanılmaz. 1 yaşın üstündeki çocuklarda kullanımı önerilmez. Böbrek ve/veya karaciğer yetmezliği durumlarında doz ayarlaması gerekir. 4.3. Kontrendikasyonlar 1 aylıktan küçük bebeklerde NURSE BABY'nin içindeki bileşenlerden birine karşı aşırı duyarlılığı olduğu bilinen kişilerde Kandaki kalsiyum düzeyi aşırı derecede düşükse Hipoklorhidri Düşük sodyum diyetinde olan hastalarda Konjestif kalp yetmezliği Ödem (sıvı retansiyonu) Hipertansiyon Karaciğer sirozu Aldosteronizm Aşırı düzeyde alkali gıdanın alınması veya idrardan asit kaybı varsa ya da sürekli kusma varsa (metabolik alkaloz ya da respiratuar alkaloz) Böbrek yetmezliği olan hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriAşırı kullanımı alkaloza sebep olabileceğinden önerilen doz aşılmamalıdır. 2 / 6 Bu tıbbi ürün beslenmeden önce ya da sonra ağız yolu ile verilmelidir. Herhangi bir çalışma bulunmadığından besinlere ya da biberona karıştırılarak verilmesinden kaçınılmalıdır. Polioksil 40 hidrojene hint yağı (PEG 40) içerdiğinden mide bulantısına ve ishale sebep olabilir. NURSE BABY sukroz içerir. Eğer daha önceden doktorunuz tarafından bebeğinizin bazı şekerlere karşı dayanıksızlığı olduğu söylenmişse bu tıbbi ürünü almadan önce doktorunuzla temasageçiniz. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriNURSE BABY'nin etkin maddesi sodyum bikarbonatın bazı maddelerle (anoreksiyanlar, benzodiazepinler, flekainit, ketokonazol, lityum, salisilatlar, sülfonilüreler, sempatomimetikler vetolmetin) etkileştiği bilinmektedir. Oral bikarbonat bileşiklerinin gastrik pH'ı yükseltici etkisi bazı ilaçların absorbsiyon hızı ve/veya derecesini azaltabilir ya da arttırabilir. İdrarın alkalize olması salisilatlar, tetrasiklinler vebarbitüratlar gibi asidik ilaçların renal klirensinde artışa neden olur. Bazik ilaçların ise tam tersineyarı ömrünü uzatır. Sodyum bikarbonat lityum atılımını arttırır. Özel popülasyonlara ilişkin ek bilgiler:Etkileşim çalışması bulunmamaktadır. Pediyatrik popülasyon:Etkileşim çalışması bulunmamaktadır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)NURSE BABY'nin çocuk doğurma potansiyeli bulunan kadınlar ve doğum kontrolü üzerine etkisine ilişkin yeterli veri mevcut değildir. Gebelik dönemiNURSE BABY'nin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. NURSE BABY gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiNURSE BABY'nin laktasyon döneminde kullanımına ilişkin yeterli veri mevcut değildir. 3 / 6 Üreme yeteneği/FertiliteNURSE BABY'nin üreme yeteneği/fertilite üzerindeki etkisine ilişkin yeterli veri mevcut değildir. 4.7. Araç ve makine kullanımı üzerindeki etkileriAraç ve makine kullanımı üzerine bilinen bir yan etkisi bulunmamaktadır. 4.8. İstenmeyen etkilerKlinik çalışmalar sırasında tedaviyle ilişkili olarak görülen istenmeyen etkiler, aşağıdaki kurala göre sınıflandırılmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Belirtilen şekilde kullanıldığında bilinen bir yan etkisi yoktur. Kan ve lenfatik sistem hastalıkları:Bilinmiyor: Hipernatremi, metabolik alkaloz Bağışıklık sistemi hastalıkları:Çok seyrek: Deri döküntüsü dahil alerjik reaksiyonlar Metabolizma ve beslenme hastalıkları:Bilinmiyor: Laktik asidoz, özellikle renal fonksiyonu bozuk olan hastalarda aşırı kullanılması halinde hipernatremi ve hiperozmolariteye, hipokalemi ve metabolik asidoza neden olabilir. Sinir sistemi hastalıkları:Bilinmiyor: Tremor, nöbet, adale krampları Kardiyak hastalıklar:Bilinmiyor: Periferik ödem Gastrointestinal hastalıklar:Çok seyrek: Abdominal ağrı, mide krampı, geğirme, flatulans, kusma Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:Bilinmiyor: Halsizlik Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanaksağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiAşırı dozda kullanılması durumunda; uyuşukluk ve irritabilite, ateş, taşipne ve hiperpneyi içerebilir. Daha ciddi akut sodyum aşırı yüklenmesi olgularında dehidratasyon ve konvülziyonbulguları gelişebilir. Tedavisi, gelişen dehidratasyonun iyileştirilmesi ve plazma sodyum konsantrasyonunun tedrici 4 / 6 olarak azaltılmasıdır. Eğer varsa, alkaloz genellikle hipernatremi tedavisine yanıt verir. Tüm olgularda elektrolitler, dolaşım ve merkezi sinir sisteminin yakın takibi gerekmektedir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Sodyum bikarbonat içeren antasid preparatları ATC Kodu: A02AH Sodyum bikarbonat oral yoldan verildiğinde sodyum klorür, karbon dioksit ve su oluşturarak midedeki hidrolik asidi nötralize eder. Bikarbonat iyonlarının aşırısı ince bağırsaklardan absorbeedilir. Böylece, verilen sodyum bikarbonatın tümü ekstraselüler sıvıya geçerek hafif bir alkalozmeydana getirir. Bu durum böbrek fonksiyonu normal olan kimselerde böbreklerin işlevisonucunda hızla normalize edilir. Sodyum bikarbonat verilmesinden kaynaklanan aşırı bikarbonat iyonları idrarla elimine edilir ve idrarın alkalileşmesine neden olur. Bu alkalileşme belirli ilaçların, zehirlerin, zayıf asitlerin ve kanpigmentlerinin renal absorbsiyonunu azaltır ve klirenslerinin artmasına neden olur. 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:Sodyum bikarbonat oral yoldan verildiğinde hızla absorbe olur. Dağılım:Sodyum bikarbonat kana bikarbonat ve sodyum iyonları halinde geçer. Bikarbonat iyonlarının aşırısı ince bağırsaklardan absorbe edilir. Biyotransformasyon:Biyotransformasyona uğramaz. Eliminasyon:Bikarbonat iyonları böbreklerde filtrasyona uğradıktan sonra reabsorbe edilirler. Doğrusallık/ Doğrusal olmayan durum:Farmakokinetiği doğrusaldır. Plazma düzeyleri verilen dozlara bağlı olarak artış gösterir. 5.3. Klinik öncesi güvenlilik verileriGeçerli değildir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiMaltodekstirin Kimyon yağıDereotu yağıSukroz Polioksil 40 hidrojene hint yağı (PEG 40) Deiyonize su 6.2. GeçimsizliklerUygulama dışı 5 / 6 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız. Kullanıma hazır hale getirilen çözelti 24 saat içinde kullanılmalı, kullanılmayan kısım ise atılmalıdır. 6.5. Ambalajın niteliği ve içeriğiNURSE BABY, polipropilen (PP) piston (plunger) ve düşük yoğunluklu polietilen (LDPE) tıpadan (plug) oluşan, lineer düşük yoğunluklu polietilen (LLDPE) rezervuar kapak sistemi ilekapatılmış amber renkli polietilen tereftalat (PET) şişede 10 ml halinde pazarlanmaktadır. Her bir kutu 10 ml x 10 şişe ve 1 adet 5 ml'lik pipet içermektedir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİBerko İlaç ve Kimya Sanayi A.Ş. Yenişehir Mah. Özgür Sok. No: 16-18 Ataşehir/İstanbul 0 216 456 65 70 (Pbx) 0 216 456 65 79 (Faks) [email protected]8. RUHSAT NUMARASI2018/448 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 16.08.2018 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ6 / 6 |
İlaç BilgileriNurse Baby 50 Mg/5 Ml Oral ÇözeltiEtken Maddesi: Sodyum Bikarbonat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.