Azonefrol-pd Periton Diyaliz Çözeltisi Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIAZONEFROL-PD periton diyaliz çözeltisi Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİM
Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız. 3. FARMASOTİK FORM^ . j. ,. . .. - . . Bu belgePeriton diyalizi çözeltisi.
1/11 Steril, berrak çözelti. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarAZONEFROL-PD glukoz kaynaklı olmayan bir periton diyalizi çözeltisi olarak periton diyalizi tedavisinin bir parçası olarak kronik böbrek yetmezliği olan hastalarda endikedir. Özelliklebeslenme yetmezliği olan periton diyalizi hastalarında önerilmektedir. 4.2 Pozoloji ve uygulama şekliPozoloji / uygulama sıklığı ve süresi:Tedavi şekli, sıklığı, kullanılacak çözeltinin hacmi, karın boşluğunda kalacağı süre ve toplam diyaliz süresi hastanın doktoru tarafından kararlaştırılarak, tedaviye bu hekimin gözetimialtında başlanır. Üç aylık uygulamadan sonra hastanın durumunda klinik ya da biyokimyasal açıdan bir düzelme görülmezse tedaviye devam konusu yeniden değerlendirilmelidir. Erişkinler: 70 kg vücut ağırlığı olan bir hasta için günde 2,0 ya da 2,5 litrelik torbalarla bir değişi önerilir. Vücut ağırlığı daha az olan hastalarda dolum hacminin azaltılması gerekebilir. Nadirdurumlarda daha değişik bir pozoloji uygulanabilirse de günde iki değişimden fazlasındakullanılmamalıdır. Erişkin diyaliz hastalarında günlük önerilen toplam protein alımın vücutağırlığının kg'ı başına 1,2 gram ya da daha fazladır. İki litrelik AZONEFROL-PD 22 g aminoasit içerir ve 70 kg'lık bir erişkin diyaliz hastası için günde vücut ağırlığının kg'ı başına 0,30grama eşdeğer amino asit desteği sağlar (günlük ihtiyacının yaklaşık %25'i).Yaşlılar: Erişkinlerdeki gibidir. Çocuklar ve gençler: Pediyatrik hastalarda güvenliliği ve etkililiği gösterilmemiştir. Bu yaş grubunda AZONEFROL-PD kullanılacaksa önerilen doz günde bir değişimdir. Bu hasta grubunda ilacınkullanılıp kullanılmamasına, AZONEFROL-PD'nin kullanılmasından sağlanacak klinik yararile olası yan etkileri karşılaştırılarak karar verilmelidir. İki yaşından büyük pediyatrik hastalardavücut yüzey alanının metrekaresi başına 800 mL ile 1200 mL (tolere edebilirse maksimum 2litreye kadar) bir dolum hacmi önerilir. İki yaşından küçük pediyatrik hastalarda ise 200 - 1000mL/m2'lik bir dolum hacmi önerilir. Uygulama şekli:AZONEFROL-PD, periton diyalizi ile tedavi gören hastalarda karın içine uygulanarak kullanılır. AZONEFROL-PD yalnızca periton içine uygulama içindir; intravenöz yoldan kullanılmaz. Periton diyalizi çözeltileri, hasta konforunun arttırılması amacıyla 37°C sıcaklığa kadar ısıtılabilir. Ancak bu amaçla yalnızca kuru ısı (örn. ısıtıcı pedler, ısıtma cihazları)kullanılmalıdır. Kontaminasyon riskinde artışa neden olabileceğinden, çözeltiler kaynar su
2/11 içinde ısıtılmamalıdır. Torbasında bozulmaya ve hastada hasar veya rahatsızlığa neden olabileceğinden çözeltiler mikrodalga fırında ısıtılmamalıdır. Tüm periton diyalizi süreci boyunca aseptik teknik kullanılmalıdır. Çözeltinin renginde değişiklik varsa, bulanıksa, partikül içeriyorsa, torbada sızıntı varsa ya da torbayı kapatmak için kullanılan parçalar yerinde değilse uygulanmamalıdır. Drene edilen sıvı olası bir peritoniti gösterebilecek fibrin ya da bulanıklık olup olmadığı açısından kontrol edilmelidir. Tek kullanımlıktır. Kullanımla ilgili daha detaylı bilgi için bkz. Bölüm 6.6: Tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:AZONEFROL-PD böbrek yetmezliğinin tedavisinde uygulanan periton diyalizi yönteminin bir parçası olarak kullanılır. Karaciğer yetmezliği:Karaciğer yetmezliği durumunda kontrendikedir. Pediyatrik popülasyon:Çocuk ve gençlerde önerilen doz günde bir değişimdir. Risk/yarar oranı değerlendirilmeli ve diyaliz reçetesi, uygun dolum hacimlerine adaptasyon dahil, her vaka için bireysel olarakbelirlenmelidir. Geriyatrik popülasyon:Erişkin dozları kullanılır. 4.3 KontrendikasyonlarAZONEFROL-PD aşağıdaki durumlarda kontrendikedir: - İçeriğinde bulunan amino asitlerden ya da yardımcı maddelerden herhangi birine aşırıduyarlılığı olan hastalarda, - Serum üre düzeyinin 38 mmol/Litre üzeri olması durumunda, - Üremik semptomların varlığında, - Metabolik asidoz durumunda, - Doğuştan amino asit metabolizma bozukluğunda, - Karaciğer yetersizliğinde, - Ciddi hipokalemisi olan hastalarda, - Etkili bir periton diyalizini engelleyen veya enfeksiyon riskini arttıran düzeltilemeyenmekanik bozukluklar, - Periton işlevlerinin kaybedilmiş olması ya da periton işlevlerini bozma riski olan yaygınperitoneal yapışıklıklar.
3/11 4.4 Özel kullanım uyarıları ve önlemleri- Enkapsülan periton sklerozu (EPS), periton diyalizi tedavisinin nadiren görülen birkomplikasyonudur. AZONEFROL-PD'nin de dahil olduğu periton diyalizi çözeltilerinikullanan hastalarda EPS rapor edilmiştir. - Peritonit gelişirse, kullanılacak antibiyotiğin seçimi ve dozaj mümkün olan her durumdaizole organizma(ların) tanıma ve duyarlılık test sonuçlarına göre seçilmelidir. Peritoniteneden olan organizma(ların) belirlenmesi için yapılacak testlerden önce genişspektrumlu antibiyotik kullanımı gerekebilir. - Aşırı duyarlılığı düşündürecek herhangi bir işaret ya da belirti görülmesi durumunda,intraperitoneal AZONEFROL-PD uygulamasına derhal son verilmelidir. Klinik olarakgerekliyse uygun terapötik önlemler alınmalıdır. - Metabolik asidoz durumu AZONEFROL-PD tedavisinden önce ve tedavi sırasındadüzeltilmelidir. - Pediyatrik hastalarda etkililik ve emniyetli kullanımı gösterilmemiştir. - Periton diyalizi, diğer kullanılan ilaçların (suda çözünen vitaminler dahil) önemliderecelerde kaybına neden olabilir. Gerektiğinde replasman tedavisi yapılmalıdır. - Diyetle alınan protein miktarı izlenmelidir. - Periton diyalizi şu durumlarda dikkatle uygulanmalıdır: 1) iyileşme tamamlanana kadarcerrahi girişimler, konjenital anomaliler ya da travma sonucu periton membranı vediyafragmanın bütünlüğünün bozulması, abdominal tümör, karın duvarınınenfeksiyonu, herniler, fekal fistül, ileostomi veya kolostomi, sık divertikülit atağı,enflamatuvar veya iskemik barsak hastalığı, büyük polikistik böbreklerin olması ya dakarın duvarı, karın yüzeyi ya da karın boşluğunun bütünlüğünü bozan bir başkarahatsızlığın bulunması durumunda 2) aralarında son zamanlarda geçirilmiş aortik greftreplasmanı ve şiddetli pulmoner hastalığın bulunduğu diğer durumlar. - Peritoneal diyaliz çözeltilerinin periton boşluğuna aşırı infüzyonu sonucu karındadistansiyon / karın ağrısı ve/veya soluk kesilmesi görülebilir. - Peritoneal diyaliz çözeltilerinin periton boşluğuna aşırı infüzyonunun tedavisi, peritonboşluğundaki sıvının drene edilmesiyle gerçekleştirilir. - Hastalar aşırı ve yetersiz hidrasyon açısından dikkatle izlenmelidir. Hastanın sıvıdengesinin dikkatlice kaydedildiği kayıtlar saklanarak vücut ağırlığı izlenmelidir. - Hiperkalemi riski nedeniyle AZONEFROL-PD çözeltisine potasyum eklenmemiştir. - Serum potasyum düzeylerinin normal ya da düşük olduğu (hipokalemi) durumlarda,ağır bir hipokalemi gelişmesini önlemek amacıyla, çözeltiye potasyum klorür eklemek(4 mEq/L'ye kadar) gerekebilir; bu ekleme ancak serum ve toplam vücut potasyumdüzeyleri dikkatli bir şekilde değerlendirildikten sonra ve yalnızca doktor tarafındanönerildiğinde yapılmalıdır. - Serum elektrolit konsantrasyonları (özellikle bikarbonat, potasyum, magnezyum,kalsiyum ve fosfat, kandaki biyokimyasal parametreler (parat hormon düzeyleri dahil)ve hematolojik değerler düzenli aralıklarla kontrol edilmelidir. - Diyabetli hastalarda kan glukoz düzeyleri düzenli aralıklarla izlenmeli ve insülin ya dahiperglisemi için kullanılan diğer tedavilerin dozajı ayarlanmalıdır. - AZONEFROL-PD'nin bileşimindeki amino asitlerin bir bölümü üre gibi azotun wBelge Dosonrası oluşacak ek metabolik atıklar iştahsızlık ya da kusma gibi üremik semptomların ortaya çıkmasına neden olabilir. Semptomların düzelmesi için AZONEFROL-PDkesilebilir ya da amino asit içermeyen çözeltilerle gerçekleştirilen diyalizin dozuarttırılabilir. - Sekonder hiperparatiroidi olan hastalarda, hiperparatiroidizmi kötüleştirebileceği için,düşük kalsiyum içeren diyaliz çözeltilerinin kullanımının olası yarar ve riskleri dikkatledeğerlendirilmelidir. - Bu tıbbi ürün 132 mmol/litre sodyum ihtiva eder. Bu durum, kontrollü sodyumdiyetinde olan hastalar için göz önünde bulundurulmalıdır. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri- AZONEFROL-PD ile diğer tıbbi ürünlerin etkileşimini araştıran bir çalışmabulunmamaktadır. Diyaliz işlemi sırasında, diyalizle uzaklaştırılan diğer ilaçların kankonsantrasyonları azalabilir. - Kardiyak glikozit kullanan hastaların plazma potasyum, kalsiyum ve magnezyumdüzeyleri dijital entoksikasyonu riski nedeniyle dikkatle takip edilmelidir. Tedaviyepotasyum eklenmesi gerekebilir. Özel popülasyonlara ilişkin ek bilgiler:Hiçbir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:Hiçbir etkileşim çalışması yapılmamıştır. 4.6 Gebelik ve laktasyonGenel tavsiye:Gebelik Kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)AZONEFROL-PD'nin çocuk doğurma potansiyeli bulunan kadınlarda kullanımı ve doğum kontrolü üzerindeki etkilerine ilişkin veri yoktur. AZONEFROL-PD kullanılırken herhangi birdoğum kontrol yönteminin kullanılmasının gerekli olup olmadığına ilişkin bir çalışmayapılmamıştır. Gebelik dönemiAZONEFROL-PD'nin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /veveya/doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. kısım5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Hastanın başka bir diyaliz yöntemi iletedavi edilemediği durumlar dışında gebelerde kullanılmamalıdır. AZONEFROL-PD doktor tarafından gerekli görülmediği sürece gebe kadınlarda kullanılmamalıdır. Gebe kadınlara verilirken tedbirli olunmalıdır. Gebelik döneminde periton diyalizi yöntemi tercih edilecekse elde edilecek faydalar, olası komplikasyonlarla bir arada değerlendirildikten sonra tedaviye karar verilmelidir.
5/11 Laktasyon dönemiEmziren kadınlarda AZONEFROL-PD kullanımı ile ilgili deneyimler yeterli değildir. AZONEFROL-PD reçetelemeden önce emzirmenin durdurulup durdurulmayacağına tedaviyidüzenleyen hekim tarafından karar verilmelidir. Üreme yeteneği / fertiliteAZONEFROL-PD'nin üreme yeteneği/fertilite üzerindeki etkisini araştıran bir çalışma bulunmamaktadır. 4.7 Araç ve makine kullanımı üzerindeki etkilerPeriton diyalizi tedavisi gören Son Dönem Böbrek Yetmezlikli (SDBY) hastalarda, araç ve makine kullanımını etkileyebilecek istenmeyen etkiler (örneğin kırıklık/keyifsizlik,hipovolemi) görülebilir. 4.8 İstenmeyen etkilerBu bölümde AZONEFROL-PD ya da periton diyalizi prosedürüyle ilgili olduğu düşünülen advers reaksiyonlar yer almaktadır. Klinik çalışmalarda ve pazarlama sonrası deneyim sırasında hastalarda bildirilen advers etkiler aşağıda sıralanmıştır. Görülen advers ilaç reaksiyonlarının sıklık sınıflandırması şu şekildedir: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000), çok seyrek, izole raporlar dahil (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Enfeksiyonlar ve enfestasyonlarYaygın: Enfeksiyon Kan ve lenf sistemi hastalıklarıYaygın: Anemi. Bağışıklık sistemi hastalıklarıBilinmiyor: Aşırı duyarlılık Metabolizma ve beslenme hastalıklarıÇok yaygın: Asidoz, hipervolemi, anoreksi Yaygın: Hipokalemi, hipovolemi Psikiyatrik hastalıklarYaygın: Depresyon Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: Dispne Gastrointestinal hastalıklarÇok yaygın: Kusma*, bulantı, gastrit Yaygın: Karın ağrısı
6/11 Bilinmiyor: Enkapsülan periton sklerozu, karında rahatsızlık hissi, peritonit, peritoneal sıvıda bulanıklık Deri ve deri altı doku hastalıklarıBilinmiyor: Prurit, anjiyoödem Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok yaygın: Asteni Bilinmiyor: Ateş, Halsizlik AraştırmalarÇok yaygın: Kan üre düzeylerinde yükselme Bilinmiyor: Periton sıvısı analizinde anormallik * Bulantı ve kusma terimi MedDRA 11.0'da yer almamasına rağmen, bu terimler mevcut veri kaynağındaki gibi bu şekilde bırakılmıştır. Periton diyalizi sırasında görülen diğer prosedürel istenmeyen reaksiyonlar: kateter çıkış yeri enfeksiyonu, kateterle ilişkili komplikasyonlar, hipokalsemi ve bakteriyel peritonit. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9 Doz aşımı ve tedavisiDoz aşımının muhtemel sonuçları arasında hipervolemi ve elektrolit bozuklukları yer alır. Doz aşımının tedavisi: Hipervolemi durumu hipertonik periton diyalizi çözeltilerinin kullanımı ve sıvı kısıtlaması ile tedavi edilir. Elektrolit dengesindeki bozulmalar, azalan ya da artan elektrolit kan testleriyle belirlendikten sonra spesifik olarak bozukluğa yönelik olarak düzeltilmelidir. En olası bozukluk olanhipokalemi durumu potasyumun oral olarak uygulanmasıyla ya da diyaliz çözeltisine hekimönerisiyle potasyum klorür eklenmesiyle tedavi edilir (bkz. Bölüm 6.2). 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grubu: Periton diyalizi çözeltileri ATC kodu: B05D Sürekli Periton Diyalizi (SAPD) tedavisinde, ekstrarenal atık temizleme için kullanılan, steril bir çözeltidir. Çözeltinin bileşimindeki elektrolit konsantrasyonları (laktat dışında), normal ekstraselüler sıvının bileşimine benzer. 3 Bu belge
7/11 AZONEFROL-PD'nin ozmolaritesi 365 mOsm/L'dir. 5.2 Farmakokinetik özelliklerGenel özelliklerPeriton membranı üzerindeki etkisini gösterebilmesi için çözelti periton boşluğuna uygulanır ve hekimin belirlediği bir bekleme süresinden sonra geri alınır. Çözelti, ozmoz ve difüzyonprensiplerine göre periton zarı üzerinde etki gösterir; çözelti (diyalizat) ile hastanın plazmasıarasında değişim (diyaliz) gerçekleşir. Emilim:Periton boşluğunda altı saat kadar kalan çözeltideki amino asitlerin %70-80 kadarı absorbsiyona uğrar. Dağılım:Emilime uğrayan amino asitler standart metabolizmalarını izlerler. Çözelti içindeki elektrolitler de absorbsiyona uğradılarsa, her bir iyon standart metabolizmasını izler. Biyotransformasyon:Laktat, bikarbonatın biyolojik prekürsörüdür. Vücutta bikarbonata dönüşür. Çözelti içindeki amino asitler, tıpkı biyolojik olarak bulunanlar ya da besinlerle alınanlar gibi vücutta yapı taşıya da enzimlerin yapısında yer alırlar. Vücut tarafından kullanılmayan amino asitler azotlubileşiklere dönüşürler. Eliminasyon:Amino asitlerin vücutta kullanılmayanları, azotlu bileşiklere dönüşerek böbreklerden atılır. Doğrusallık / doğrusal olmayan durum:AZONEFROL-PD'nin bileşimindeki amino asitlerin periton membranından emilimi, çözeltinin periton boşluğunda kalış süresi, hastanın periton membranının geçirgenlik özelliği, hastanınnutrisyonel durumu gibi bir çok parametre tarafından belirlendiğinden, doğrudan uygulanandozla doğrusal bir ilişkiden bahsedilemez. 5.3 Klinik öncesi güvenlilik verileri%1,1 amino asit çözeltileri hakkındaki toksisite verileri, sıçan ve köpeklerde tahmin edilen güvenlilik marjı göstermektedir. Fötal toksisite ya da fertilite, mutajenik potansiyel,karsinojenik potansiyel, iritasyon veya duyarlılık potansiyeli, bağımlılık ya da düşkünlükriskini araştıran çalışmalarda advers etkiye ilişkin herhangi bir kanıt bulunamamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiKonsantre hidroklorik asit (pH ayarı için) Enjeksiyonluk su 6.2 GeçimsizliklerBaşka maddeler eklendiğinde, pH ve tuzlarla geçimlilik göz önünde bulundurulmalıdır. AZONEFROL-PD ile heparin veya insülin ilavesi arasında geçimsizlik yoktur.
8/11 Güncel olarak, aminoglikozitler ile AZONEFROL-PD'nin stabilitesi hakkında herhangi bir bilgi mevcut değildir. Başka maddelerle karıştırmadan önce geçimliliği kontrol edilmelidir. Kullanmadan önce berraklığı ve rengi kontrol edilmelidir. 6.3 Raf ömrü24 ay Dış ambalajından çıkarıldıktan sonra ürün hemen kullanılmalıdır. 6.4 Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında ışıktan koruyarak saklayınız. 6.5 Ambalajın niteliği ve içeriği2000 mL ve 2500 mL'lik esnek PVC torbalarda ambalajlandıktan sonra dış torbalara koyulur. 2000 mL, 2500 mL Tekli torba (boşaltma torbasız) 2000 mL, 2500 mL Çiftli torba (boşaltma torbalı) + mini kapaklı 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerUygulamayla ilgili ayrıntılar için bölüm 4.2'ye bakınız. - İntraperitoneal uygulama çözeltinin torbasını hastanın kateterine bağlayan, bu amaca uygunözel bir kateter kullanımını gerektirir - Torba değişim prosedürleri, ürünü evde kullanmalarından önce, hastalara özel merkezlerdeverilen eğitimlerle ayrıntılı olarak anlatılmaktadır. Bu eğitimlerdeki bilgilerin ve hekimintalimatı doğrultusunda kullanılmalıdır. - Hasarlı ürünler atılmalıdır. - Kullanıma hazır hale gelene kadar çözeltinin koruyucu dış ambalajı açılmamalıdır. - Çözelti berrak değilse kullanılmamalıdır. - Ürün tek kullanımlıktır; kullanımdan sonra torbada kalan çözelti atılmalıdır. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. Mini Kapak (Povidon İyotlu):TanımBu ürün periton diyalizi tedavisinde kullanılan plastik bir kapaktır ve Polifarma ara setini kontaminasyondan korumak üzere povidon-iyot içerir. Kontrendikasyonlarİyoda karşı bilinen alerjik reaksiyon öyküsü varsa bu ürünü kullanmayınız. Daha fazla bilgi için doktorunuza başvurunuz. UyarılarAseptik teknik kullanınız. Sıvı yolunun herhangi bir kısmında kontaminasyon olması peritonit ile sonuçlanabilir.
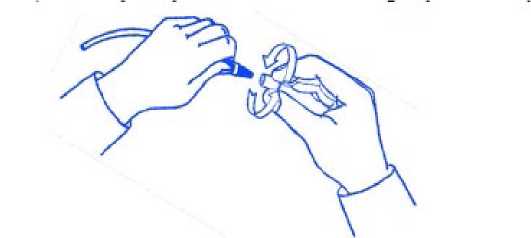
9/11 Ambalajı daha önceden açılmış, hasar görmüş veya lekelenmişse ya da iç kısımda bulunan povidon-iyotlu sünger kuruysa kullanmayınız. Ürün kullanılmışsa atınız. Oda sıcaklığında saklayınız. Aşırı ısıdan koruyunuz. Bu ürün tek kullanımlıktır. Tek kullanımlık bir ürünün yeniden kullanılması veya yeniden işlemden geçirilmesi, kontaminasyona ve ürünün işlevinin veya yapısal bütünlüğünün zarargörmesine neden olabilir. Çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız. Kazara yutulması halinde, derhal doktorunuza danışınız. Küçük peritoneal diyalizat dolum hacmi olan hastalarda, özellikle bebek ve çocuklarda, tiroid fonksiyonunun izlenmesi tavsiye edilmektedir. İyot maruziyetini minimuma indirmek için,klinik olarak mümkün olduğunda, bir sonraki dolum döngüsünü başlatmadan önce peritonboşluğundaki sıvıyı drenaj torbasına boşaltınız. Diğer üreticilerden temin edilebilen pek çok diyaliz ürünü, Polifarma İlaç San ve Tic A.Ş ekipmanı veya tek kullanımlık ürünleriyle birlikte kullanılmaktadır. Bu ürünlerdekideğişkenlik, toleranslar, mekanik kuvvet veya zaman zaman yapılabilecek değişikliklerPolifarma İlaç'ın kontrolü dışındadır. Bundan dolayı Polifarma, başka üreticilerin diyalizürünlerinin, kendi ürünleri ile kullanıldığında tatmin edici bir şekilde işleyeceğini garantiedemez. Kullanım TalimatıDikkat: Aseptik teknik kullanınız.- Doktorunuz tarafından verilen talimatlara uyunuz. Bir yüz maskesi takınız. Ellerinizidezenfektan özelliği olan sabun ile yıkayıp tamamen kurutunuz. Ellerinize antiseptikuygulayınız. -Mini KapakMini Kapak'ı tamamen açığa çıkaracak şekilde aşağıya doğruaçınız.-Mini Kapak'ı ambalajından alınız.- Ara setin uç kısmını aşağıya doğru pozisyonda tutunuz. Mini KapakMini Kapak'ı çok sıkmayınız.
10/11 Yerel atık imha kılavuzları doğrultusunda atınız. 7. RUHSAT SAHİBİPOLİFARMA İLAÇ SAN. VE TİC. AŞ. Vakıflar OSB Mah. Sanayi Caddesi No:22/1 Ergene/TEKİRDAĞ Tel: 0282 675 14 04 Faks: 0282 675 14 05 8. RUHSAT NUMARASI2019/271 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 23.05.2019 Ruhsat yenileme tarihi: 10.KÜB'ÜN YENİLENME TARİHİ
11/11 |
İlaç BilgileriAzonefrol-pd Periton Diyaliz ÇözeltisiKullanma talimatı ve kısa ürün bilgileri |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.