Denta-clar 250 Mg/5ml Oral Süspansiyon İçin Granül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIDENTA-CLAR 250 mg/5 ml oral süspansiyon hazırlamak için granül 2. KALİTATİF VE KANTİTATİF BİLEŞİM
Yardımcı maddeler için 6.1'e bakınız. 3. FARMASOTIK FORMUSüspansiyon için granül 4. KLİNİK ÖZELLİKLERİ4.1. Terapötik Endikasyonlar12 yaşından küçük pediatrik hastalar6 ay-12 yaş arasındaki çocuklarda yürütülen klinik çalışmalar klaritromisin pediatrik süspansiyon ile yapılmıştır. Bu nedenle 12 yaşından küçük çocuklar klaritromisin pediatriksüspansiyon (oral süspansiyon için granül) kullanmalıdır. DENTA-CLAR® Oral Süspansiyon aşağıdaki durumlarda, duyarlı organizmaların sebep olduğu enfeksiyonların tedavisinde endikedir: 1.Haemophilus influenzae, Moraxella catarrhalis, Streptococcus pneumoniae veStreptococcus pyogenes'tenkaynaklanan farenjit, tonsilit ve akut maksiler sinüzit gibiüst solunum yolu enfeksiyonları.1/31 2.Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis,Streptococcus pneumoniae, Mycoplasma pneumoniae ve Chlamydophilapneumoniae 'dankaynaklanan pnömoni, kronik bronşit gibi alt solunum yoluenfeksiyonları.3. Haemophilus influenzae, Moraxella catarrhalis, Streptococcus pneumoniae'denkaynaklanan akut otitis media.4.Staphylococcus aureus, Streptococcus pyogenes'tenkaynaklanan impetigo, folikülit,selülit, erizipel, abseler gibi komplike olmayan deri ve yumuşak doku enfeksiyonları(abseler genellikle cerrahi drenaj gerektirir).5. Klaritromisin,Mycobacterium aviumveyaMycobacterium intracellulare'yebaglıyaygın veya lokal mikobakteriyel enfeksiyonların veMycobacterium chelonae,Mycobacterium fortuitum ve Mycobacterium kansasii'yebaglı lokal enfeksiyonlarıntedavisinde endikedir.4.2. Pozoloji ve uygulama şekliPozoloji:DENTA-CLAR Oral Süspansiyon (250 mg/5 ml) çocuklarda tavsiye edilen dozu günde iki defa 7,5 mg/kg olup mikobakteriyel olmayan enfeksiyonlar için maksimum doz günde ikidefa 500 mg'dır. Dozajı belirlemek için aşağıdaki tablo yol gösterici olabilir:ÇOCUKLARDA DENTA-CLAR SÜSPANSİYON (250mg/5ml) DOZ TAYİNİVücut Ağırlığına GöreŞIRINGA DOZ TABLOSU
2/33
Mikobakteriyel Enfeksiyonları Olan Hastalarda DozajYaygın veya lokalize mikobakteriyel enfeksiyonları olan çocuklarda (M. avium, M. intracellulare, M. chelonae, M. fortuitum, M. kansasii),önerilen doz, günde iki dozabölünmüş olarak 15 - 30 mg/kg klaritromisindir.Klinik yarar gösterildiği sürece klaritromisin tedavisine devam edilmelidir. Başka antimikobakteriyel ajanların ilave edilmesi yararlı olabilir. Uygulama sıklıı ve süresi:Normal tedavi süresi, ilgili patojene ve hastalığın şiddetine bağlı olarak 5 ila 10 gün arasındadır. Uygulama şekli Sulandırılmış ilaç aç veya tok karnına verilebilir; ayrıca sütle de alınabilir. Süspansiyonun hazırlanması: 1. Açmadan önce şişeyi iki-üç kez sallayınız. 2. Şişeye, şişe üzerindeki işaret çizgisini geçmeyecek şekilde bir miktar kaynatılıpsoğutulmuş su ilave edip, kuvvetlice çalkalayınız. 3. Birkaç dakika bekleyiniz. Sıvının düzeyi alçalacaktır. İşaret çizgisine kadar tekrar su iletamamlayınız ve bu suretle elde edilen süspansiyon iyice homojen oluncaya kadar yenidençalkalayınız. İlacınız şimdi kullanıma hazırdır. Aşağıda belirtilen şekilde kullanınız. Her kullanımdan önce şişevi iyice çalkalayınız. 3/33 Hazırlanmış süspansiyondaki klaritromisin konsantrasyonu 5 ml'de 250 mg'dır.İlacın alınması:İlacı kaşık veya şırınga ile çocuğunuza verebilirsiniz.Kaşık ile kullanım: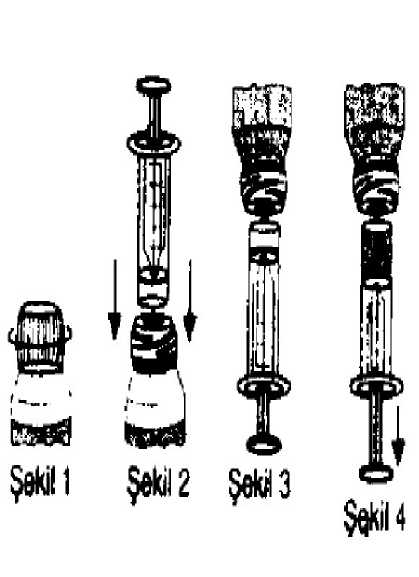 1. İlacı çocuğunuza kaşık ile vereceksenizdoktorunuzun önerdiği şekilde kaşıktablosunu esas alınız.2. İlacı çocuğunuza şırınga ileverecekseniz aşağıdaki talimatlarauyunuz.Şırınga ile kullanım:a. Şişeyi açınız. (Bkz. Şekil 1)b. Verilen adaptör tıpayı şişenin ağzınayerleştiriniz ve iyice bastırınız. Şırıngayışişenin ağzındaki adaptör tıpayayerleştiriniz. (Bkz. Şekil 2)c. İlacı şırıngaya çekmek için, şişe +şırınga birlikte olarak ters çeviriniz vedik bir konumda tutunuz (Bkz. Şekil 3)d. Hekim tarafından belirtilen dozuşırıngaya çekiniz. (Bkz. Şekil 4)Örneğin, 5 kg ağırlığındaki bir çocuk için bir defalık doza karşılık gelen miktar 1,5 ml olduğu için şırıngaya çekilmesi gereken miktar 1,5 ml'dir. Günde iki kez 1,5 ml verilmelidir.e. Şırıngayı şişeden geri çekiniz ve ilacı çocuğunuzun ağzına doğrudan şırınga ile veyaşırıngaya çektiğiniz ilacı kaşığa aktararak verebilirsiniz.f. İlacın ağzını kapatınız. Her kullanımdan önce şişeyi iyice çalkalayınız.g. İlacın alımından sonra bir miktar sıvı verebilirsiniz.4/33h.Özel popülasyonlara ilişkin ek bilgilerBöbrek yetmezlii/Karacier yetmezliği:Kreatinin klerensi 30 ml/dak'dan az olan çocuklarda klaritromisin dozu yarıya düşürülmelidir. Örneğin günde bir defa 250 mg'a kadarveya daha şiddetli vakalarda günde 2 defa 250 mg. Bu hastalarda tedavi süresi 14 günügeçmemelidir. Orta dereceden şiddetli dereceye kadar böbrek bozukluğu olan hastalarda dadikkatle uygulanmalıdır.Karaciğer fonksiyonu bozuk olan hastalara klaritromisin uygulanırken dikkatli olunmalıdır. Bununla birlikte, şiddetli böbrek yetmezliği durumlarında, beraberinde karaciğer yetmezliğiolsun veya olmasın, dozun azaltılması veya doz aralarının uzatılması uygun olabilir. 4.3. KontrendikasyonlarıDENTA-CLAR Oral Süspansiyon, makrolid antibiyotiklere ya da içindeki herhangi bir maddeye karşı bilinen aşırı duyarlığı olan hastalarda kontrendikedir. Klaritromisinin şu ilaçlardan biri ile beraber kullanılması QT uzaması ve ventriküler taşikardi, ventriküler fibrilasyon ve torsades de pointes gibi kardiyak aritmilere neden olabileceğindenkontrendikedir: Astemizol, sisaprid, pimozid ve terfenadin. Klaritromisinin ergotamin ve dihidroergotamin ile beraber kullanılması ergot toksisitesine neden olabileceğinden kontrendikedir. Klaritromisin, rabdomiyolizi de içeren miyopati artışı riski sebebiyle, CYP3A4 ile büyük ölçüde metabolize olan HMG-CoA redüktaz inhibitörleri (statinler; lovastatin veyasimvastatin) ile eşzamanlı olarak kullanılmamalıdır. Kolşisin P-glikoprotein ya da güçlü bir CYP3A4 inhibitörü kullanan renal ya da hepatik yetmezliği olan hastalarda kontrendikedir.(bkz. Bölüm 4.4. Özel kullanım uyarıları veönlemleri ve Bölüm 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri) 5/33 Klaritromisin QT uzaması ya da Torsades de Pointes dahil ventriküler kardiyak aritmi öyküsü olan hastalara verilmemelidir (bkz. Bölüm 4.4. Özel kullanım uyarıları ve önlemleri ve Bölüm4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). Hipokalemi (QT aralık uzaması riski) olan hastalara klaritromisin verilmemelidir. Böbrek bozukluğu ile birlikte şiddetli karaciğer yetmezliği olan hastalarda klaritromisin kullanılmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleriDENTA-CLAR Oral Süspansiyon ergenlik çağını aşan hastalarda kullanılacağında, eğer gebelik mevcut veya şüpheleniliyorsa, hekim tarafından yarar / risk faktörleri özenletartılmalıdır. Diğer antibiyotik kullanımlarında görüldüğü gibi uzun dönem kullanımı duyarlı olmayan bakteri ve mantarların sayısında artışa yol açar. Eğer süperinfeksiyon meydana gelirse, uyguntedaviye başlanmalıdır. H. pylori infeksiyonunda ilaç direnci gelişmiş organizmalar için klaritromisin gibi herhangi bir antimikrobiyal tedavi seçilebilir. Klaritromisin ile triazolam ve midazolam gibi triazolobenzodiazepinlerin eşzamanlı kullanımında dikkatli olunmalıdır (bkz. Bölüm 4.5. Diğer tibbi ürünler ile etkileşimler vediğer etkileşim şekilleri). Koroner arter hastalığı olan hastalarda klaritromisin ile tedavinin sonuçlarının değerlendirildiği bir klinik çalışmada, klaritromisin almak üzere randomize edilmişhastalarda, tedavi bitiminden bir yıl ya da daha fazla süre sonra, tüm nedenlere bağlı ölümriskinde artış gözlenmiştir. Klaritromisin koroner arter hastalığının tedavisinde endikedeğildir. Risk artışının nedeni belirlenememiştir. Bu riskin değerlendirildiği diğerepidemiyolojik çalışmalar değişken sonuçlara ulaşmıştır. Koroner arter hastalığı veya şüphesiolan hastalarda klaritromisin kullanmadan önce yarar-risk değerlendirmesi yapılmalıdır. 6/33 QT uzaması riski nedeniyle, klaritromisin koroner arter hastalığı, şiddetli kalp yetmezliği, hipomagnezemi, bradikardi (<50 vuru/dk) durumunda ya da QT uzaması ile ilişkili diğer tıbbiürünler ile eşzamanlı kullanımında dikkatli olunmalıdır (bkz. 4.5 Diğer tıbbi ürünler ileetkileşimler ve diğer etkileşim şekilleri). Klaritromisin konjenital ya da belgelenmiş kazanılmış QT uzaması ya da ventriküler aritmi öyküsü olan hastalarda kullanılmamalıdır (bkz. bölüm 4.3 Kontrendikasyonlar). Psödomembranöz kolitMakrolidler dahil olmak üzere hemen hemen bütün antibakteriyel ajanlarla psödomembranöz kolit görülmüştür ve şiddeti hafiften hayatı tehdit eden dereceye kadar uzanabilir. Dolayısıyla,antibakteriyel ajanların uygulanmasından önce, diyaresi bulunan hastalarda bu teşhisindeğerlendirmeye alınması önem taşır. Clostridium difficileC. difficile'ninçoğalmasına yol açabilecek olan kolonun normal florasında değişikliğe yol açar. CDADantibiyotik kullanımını takiben gelişen diyare olan tüm hastalarda dikkate alınmalıdır.Antibakteriyel ajanların uygulanmasını takiben 2 aydan uzun süre sonra bile CDADoluşumunun rapor edilmesi dikkatli bir medikal öykü alınmasını gerektirir.Antibakteriyel ajanlarla tedavi, kalın barsağın normal florasını değiştirir ve klostridyumların aşırı üremesine sebep olabilir. Çalışmalar, Clostridium difficile'mnürettiği bir toksininantibiyotiğe bağlı kolitin esas nedeni olduğunu göstermiştir.Psödomembranöz kolit teşhisi konulduktan sonra tedaviye yönelik önlemler başlatılmalıdır. Hafif derecede psödomembranöz kolit vakaları genellikle sadece ilacın kesilmesine yanıtverirler. Orta ile şiddetli durumlarda sıvı, elektrolit tedavisi, protein desteği ve Clostridiumdifficilekolitine karşı etkili bir antibakteriyel ilaçla tedavi uygulanmalıdır.Klaritromisin tedavisi alan hastalarda myastenia gravis belirtilerinin şiddetlendiği bildirilmiştir. 7/33 Böbrek ve karaciğer yetmezliğiKlaritromisin başlıca karaciğer tarafından atılır. Dolayısıyla bozuk karaciğer fonksiyonlu hastalara klaritromisin uygulanırken dikkatli olunmalıdır. Klaritromisin ile karaciğerenzimlerinde artış ve sarılık ile ya da tek başına hepatosellüler ve/veya kolestatik hepatiti deiçeren hepatik disfonksiyon bildirilmiştir. Bu hepatik disfonksiyon şiddetli olabilir vegenellikle geri dönüşümlüdür. Bazı olgularda, ölümcül hepatik yetmezlik bildirilmiştir vegenellikle altta yatan şiddetli hastalık ve/veya eşzamanlı ilaç kullanımı ile ilişkilidir.Anoreksi, sarılık, koyu renkli idrar, kaşıntı ya da karında hassasiyet gibi hepatit belirti vesemptomları ortaya çıktığında klaritromisin hemen kesilmelidir. Orta dereceden şiddetli dereceye kadar böbrek bozukluğu olan hastalarda da dikkatle uygulanmalıdır. Bununla birlikte, şiddetli böbrek yetmezliği durumlarında, beraberindekaraciğer yetmezliği olsun veya olmasın, dozun azaltılması veya doz aralarının uzatılmasıuygun olabilir. Kolşisin toksisitesiKlaritromisin ve kolşisin birlikte kullanıldığında, özellikle yaşlılarda olmak üzere ve bazıları böbrek yetmezliği olan hastalarda ortaya çıkan kolşisin toksisitesi bildirimleri bulunmaktadır.Bu hastaların bazılarında ölümler bildirilmiştir (bkz. bölüm 4.5. Diğer tıbbi ürünler ileetkileşimler ve diğer etkileşim şekilleri). Klaritromisin ve kolşisinin birlikte uygulanmasıgereken durumlarda hastalar kolşisin toksisitesi klinik belirtileri açısından gözlenmelidir.Kolşisin dozu, kolşisin ve klaritromisini birlikte alan tüm hastalarda azaltılmalıdır.Klaritromisin ve kolşisinin birlikte uygulanması, böbrek veya karaciğer yetmezliği olanhastalarda kontrendikedir (bkz. Bölüm 4.3). Makrolid AntibiyotiklerKlaritromisin ile linkomisin ve klindamisinde olduğu gibi diğer makrolid antibiyotiklerle çapraz rezistans olasılığı da düşünülmelidir. Klaritromisin ile diğer ototoksik ilaçlar ve özellikle aminoglikozitlerin eşzamanlı kullanımında dikkatli olunmalıdır. Tedavi sırasında ve sonrasında vestibular ve işitmeişlevleri izlenmelidir. 8/33 Oral Hipoglisemik Ajanlar/InsülinKlaritromisinin ve oral hipoglisemik ajanların ve/veya insülinin eşzamanlı kullanımı, önemli ölçüde hipoglisemiye neden olabilir. Nateglinid, pioglitazon, repaglinid ve rosiglitazon gibibelirli hipoglisemik ilaçlarla eşzamanlı olarak kullanıldığında, klaritromisin CYP3Aenziminin inhibisyonuna ve sonuç olarak da hipoglisemiye neden olabilir. Bu gibi durumlardaglikoz seviyesinin dikkatle izlenmesi tavsiye edilir. Oral AntikoagülanlarKlaritromisin varfarin ile birlikte uygulandığında, ciddi bir hemoraji riski ve INR, protrombin zamanında önemli artış riski vardır. Hastalar eşzamanlı olarak klaritromisin ve antikoagülankullanırken, INR ve protrombin zamanları sık sık kontrol edilmelidir. HMG-CoA Redüktaz Inhibitörleri (Statinler)Klaritromisinin lovastatin ya da simvastatin ile eşzamanlı kullanımı, bu statinlerin büyük ölçüde CYP3A4 tarafından metabolize edilmesi ve klaritromisin ile eşzamanlı tedavininplazma konsantrasyonlarını arttırarak rabdomiyaliz dahil miyopati riskini arttırması nedeniylekontrendikedir (bkz. Bölüm 4.3 KONTRENDİKASYONLAR). Bu statinler ile eşzamanlıolarak klaritromisin alan hastalarda rabdomiyoliz raporlanmıştır. Klaritromisin ile tedavikaçınılmaz ise tedavi sırasında lovastatin veya simvastatin ile terapiye ara verilmelidir. Klaritromisini statinler ile birlikte reçetelerken dikkatli olunmalıdır. Klaritromisinin statinler ile eşzamanlı kullanımının kaçınılmaz olduğu durumlarda, statinin kayıtlı olan en düşükdozunun yazılması önerilmektedir. CYP3A metabolizmasına bağımlı olmayan statinlerin (örn.fluvastatin) kullanımı değerlendirilebilir. Klaritromisin, sitokrom CYP3A4 enzimini indükleyen ilaçlarla eşzamanlı kullanıldığında dikkatli olunmalıdır (bkz. Bölüm 4.5. Diğer tibbi ürünler ile etkileşimler ve diğer etkileşimşekilleri). PnömoniStreptococcus pneumoninin makrolidlere karşı direnç geliştirmesi açısından, toplumda kazanılmış pnömoni için klaritromisin verilmeden önce duyarlılık testi yapılması önemlidir. 9/33 Hastanede kazanılmış pnömonide klaritromisin uygun ek antibiyotiklerle kombinasyon halinde kullanılmalıdır. Hafif ve orta şiddette deri ve yumuşak doku enfeksiyonlarıBu enfeksiyonlara sıklıkla makrolidlere direnç geliştirebilen Staphylococcus aureus ve Streptococcus pyogenes ya da her ikisi birlikte neden olur. Bu nedenle duyarlılık testininyapılması önemlidir. Beta-laktam antibiyotiklerin kullanılamadığı (örn. allerji nedeniyle)olgularda, klindamisin gibi diğer antibiyotikler ilk seçenek ilaç olabilir. Güncel olarakmakrolidlerin yalnızca Corynebacterium minutissimum (eritrazma) kaynaklı enfeksiyonlar,akne vulgaris ve erizipel gibi bazı deri ve yumuşak doku enfeksiyonlarda ve penisilintedavisinin kullanılamadığı durumlarda rol oynadığı düşünülmektedir. Anafilaksi, Stevens-Johnson Sendromu, toksik epidermal nekroliz, DRESS ve Henoch-Schonlein purpurası gibi şiddetli akut hipersensitivite reaksiyonları durumunda, hemen klaritromisin tedavisi kesilmeli ve uygun tedaviye başlanmalıdır. DENTA-CLAR Oral Süspansiyon, 1 mmol (23 mg)'den daha az sodyum ihtiva eder; yani esasında sodyum içermez. DENTA-CLAR Oral Süspansiyon aspartam potasyum içerdiğinden fenilalanin için bir kaynak içermektedir. Fenilketonürisi olan insanlar için zararlı olabilir. DENTA-CLAR Oral Süspansiyon, her dozda 2543,852 mg sukroz içerir. Nadir kalıtımsal fruktoz intoleransı, glikoz-galaktoz malabsorpsiyon veya sükraz-izomaltaz yetmezliğiproblemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriAşağıda yer alan ilaçların kullanımı ciddi ilaç etkileşimleri dolayısıyla kontrendikedir. Sisaprid, pimozid, astemizol ve terfenadin:Klaritromisin sisaprid ile birlikte uygulandığında, sisaprid seviyeleri yükselebilir. Bu durum özellikle kalp hastalarında QT aralığı genişlemesi ile ventriküler taşikardi, ventrikülerfibrilasyon ve Torsades de Pointes dahil kardiyak aritmilerle sonuçlanabilir. Klaritromisin 10/33 pimozid ile birlikte kullanıldığında da benzer etkiler ortaya çıkabilir (bkz. bölüm 4.3. Kontrendikasyonları). Makrolidler, terfenadin ile uygulandıklarında, terfenadin seviyeleri yükselebilir ve terfenadin metabolizması etkilenebilir. Bu etkilenme sonucu kalp hastalarında QT aralığı genişlemesi,ventriküler taşikardi, ventriküler fibrilasyon ve Torsade de Pointes dahil kardiyak aritmilergelişebilir (bkz. bölüm 4.3. Kontrendikasyonları). On dört sağlıklı gönüllüde yapılan birçalışmada klaritromisin tablet ve terfenadinin birlikte uygulanması, terfenadinin asitmetabolitinin serum düzeyinde 2-3 kat artışlarla ve QT aralığında klinik açıdan saptanabilirbir etkiye yol açmayan uzamayla sonuçlanmıştır. Astemizol ve diğer makrolidlerin birlikteuygulanmasıyla benzer etkiler görülmüştür. Ergotamin/dihidroergotamin:Pazarlama sonrası raporlarda klaritromisinin ergotamin veya dihidroergotaminin eş zamanlı uygulanmasının kol ve bacaklarda ve merkezi sinir sistemi dahil diğer dokularda vazospazmve iskemiyle karakterize akut ergot toksisitesiyle ilişkili olduğuna işaret edilmektedir.Klaritromisin ve bu tıbbi ürünlerin eş zamanlı verilmesi kontrendikedir (bkz.KONTRENDİKASYONLAR). Etravirin:Klaritromisin maruziyeti etravirin ile azalmıştır; bununla birlikte aktif metabolit 14-OH-klaritromisin konsantrasyonu artmıştır. 14-OH-klaritromisin Mycobacterium avium kompleksine (MAC) karşı etkinliği azalttığından, bu patojene karşı toplam aktivitedeğişebilir; bu nedenle MAC tedavisi için klaritromisinin alternatifleri düşünülmelidir. Diğer İlaçların Klaritromisin Üzerindeki EtkileriCYP3A indükleyici ilaçlar:CYP3A (örn. rifampisin, fenitoin, karbamazepin, fenobarbital, St John Bitkisi) indükleyicisi ilaçlar klaritromisin metabolizmasını artırabilir. Bu durum etkinliğinin azalmasına yol açansubterapötik klaritromisin düzeylerine neden olabilir. Ayrıca, CYP3A indükleyicisinin plazmadüzeyinin de izlenmesi gerekebilir; klaritromisinin CYP3A inhibisyonuna bağlı olarak builacın düzeyi artabilir (bkz. kullanılan CYP3A4 indükleyicisi ürün bilgisi). Rifabutin ve 11/33 klaritromisinin eşzamanlı kullanımında, rifabutin serum düzeyi artarken klaritromisin serum düzeyi azalarak üveit riski artışına yol açar. Aşağıdaki ilaçlar dolaşımdaki klaritromisin konsantrasyonları üzerinde bilinen veya şüpheli etki gösterir; klaritromisin doz ayarlaması veya alternatif tedaviye geçiş gerekli olabilir. Efavirenz, nevirapin, rifampisin, rifabutin ve rifapentin:Sitokrom P450 metabolizma sisteminin kuvvetli uyaranları, örneğin efavirenz, nevirapin, rifampisin, rifabutin ve rifapentin klaritromisinin metabolizmasını hızlandırabilir ve böylecemikrobiyolojik olarak aktif olan 14(R)-hidroksi-klaritromisini (14-OH-klaritromisini)arttırarak klaritromisinin plazma seviyelerini düşürür. Klaritromisin ve 14-OH-klaritromisininmikrobiyolojik aktiviteleri farklı bakteriler için farklılık gösterir. Klaritromisin ile birlikteenzim uyaranlarının verilmesiyle amaçlanan terapötik aktivite bozulabilir. Flukonazol:21 sağlıklı gönüllüye flukonazol 200 mg/gün ile birlikte klaritromisin 500 mg/günde 2 kez verilmiştir. Klaritromisinin ortalama sabit durum minimum konsantrasyonu (Cmin) ve eğrialtındaki alan (AUC) sırası ile %33 ve %18 olarak ölçülmüştür. Flukonazol ile eş zamanlıverilmesinden aktif metabolit 14-OH-klaritromisinin sabit durum konsantrasyonları anlamlıderecede etkilenmemiştir. Klaritromisin için doz ayarlaması yapılmasına gerek yoktur. Ritonavir:8 saatte bir 200 mg ritonavir ile 12 saatte bir 500 mg klaritromisinin birlikte uygulandığı bir çalışma, klaritromisin metabolizmasında belirgin bir inhibisyonla sonuçlanmıştır. Ritonavirile birlikte uygulanmasıyla klaritromisin Cmaks %31, Cmin %182 ve EAA %77 artmıştır. 14-[R]-hidroksikla- ritromisin oluşumunun tamamen inhibe olduğu görülmüştür. Klaritromisiningeniş terapötik aralığı nedeniyle böbrek fonksiyonu normal olan hastalarda dozunazaltılmasına gerek yoktur. Bununla birlikte, böbrek bozukluğu olan hastalarda şu doz ayarıyapılmalıdır: CLCR < 30-60 ml/dak. olan hastalarda klaritromisin dozu %50 azaltılmalıdır.CLCR < 30 ml/dak. olan hastalarda doz %75 azaltılmalıdır. Günde 1 g'dan daha yüksekklaritromisin dozları ritonavir ile uygulanmamalıdır. 12/33 Renal işlevleri azalmış hastalarda farmakolojik bir artırıcı olarak ritonavir, atazanavir ve sakinavir gibi diğer HIV proteaz inhibitörleri ile birlikte kullanıldığında benzer dozayarlamaları düşünülmelidir (bkz. bölüm Çift-yönlü İlaç Etkileşimleri). Klaritromisinin Diğer İlaçlar Üzerindeki EtkileriAntiaritmikler:Klaritromisin ile kinidin veya disopiramid ile birlikte kullanımıyla oluşan Torsades de Pointes bildiren pazarlama sonrası raporları vardır. Hastaların, bu ilaçlar ile birlikte klaritromisinverilmesi sırasında QTc uzaması açısından elektrokardiyografiler ile izlenmesi gereklidir. Builaçların serum düzeyleri klaritromisin tedavisi sırasında izlenmelidir. CYP3A-kaynaklı Etkileşimler:CYP3A'yı inhibe ettiği bilinen klaritromisin ile öncelikli olarak CYP3A tarafından metabolize edilen bir ilacın birlikte verilmesi, bu ilaçların konsantrasyonlarında hem terapötikve hem de advers etkilerin artışına veya uzamasına yol açabilecek artışlara neden olabilir.CYP3A enzim substratları olarak bilinen, özellikle eğer CYP3A substratı dar güvenliksınırına sahipse (örneğin karbamezapin) ve/veya substrat bu enzim tarafından geniş çaplıolarak metabolize ediliyorsa, diğer ilaç tedavileri alan hastalarda dikkatli kullanılmalıdır. Eğermümkünse, CYP3A tarafından öncelikli olarak metabolize edilen ilaçların serumkonsantrasyonları klaritromisin alan hastalarda yakından izlenmeli ve doz ayarlamasıdüşünülmelidir. Aşağıdaki ilaçların veya ilaç sınıflarının aynı CYP3A izozimi tarafından metabolize edildiği bilinmekte veya bundan kuşkulanılmaktadır: Alprazolam, astemizol, karbamazepin, silostazol, bromokriptin, sisaprid, siklosporin, disopiramid, ergot alkaloidleri, lovastatin, metilprednizolon, midazolam, omeprazol, oralantikoagülanlar (örn. varfarin), pimozid, kinidin, rifabutin, sildenafil, simvastatin, sirolimus,takrolimus, alfentanil, terfenadin, triazolam ve vinblastin, fenitoin, heksobarbital, teofilin vevalproat. Teofilin, Karbamazepin:13/33 Klinik çalışmalar, teofilin ve karbamazepinin klaritromisinle birlikte uygulanması sonucunda, kanda bu ilaçların seviyelerinde orta derecede ama istatistiki olarak anlamlı (P < 0,05) bir artışolduğunu göstermiştir. Dozun azaltılması gerekebilir. Ranitidin bizmut sitrat:Klinik olarak önemsiz olmakla birlikte, ranitidin bizmut sitrat ile klaritromisinin birlikte uygulanması ranitidin, bizmut ve 14-hidroksiklaritromisinin plazma konsantrasyonlarınınartışı ile sonuçlanmıştır. Omeprazol:Sağlıklı erişkin kişilere klaritromisin (500 mg/8 saatte bir) omeprazol (40 mg/gün) ile kombine edilerek verilmiştir. Omeprazolün sabit durum plazma konsantrasyonları (Cmax,AUC0-24 ve t1/2 sırası ile %30, %89 ve %34) klaritromisinin eşzamanlı verilmesi ileyükselmiştir. Omeprazolün tek başına verildiği durumda ortalama 24 saatlik gastrik pH 5,2olarak bulunurken klaritromisin ile eşzamanlı verilmesinde ise 5,7 olarak tespit edilmiştir. Sildenafil, tadalafil ve vardenafil:Fosfodiesteraz inhibitörlerin herbiri, en azından kısmi olarak, CYP3A ile metabolize edilmektedir ve CYP3A klaritromisinin eşzamanlı verilmesi ile inhibe edilebilir.Klaritromisinin sildenafil, tadalafil veya vardenafil ile birlikte verilmesi artmış fosfodiesterazinhibitör maruziyetine yol açabilir. Sildenafil, tadalafil ve vardenafil ile birlikte klaritromisinverildiği zaman bu ilaçların dozlarının azaltılması düşünülmelidir. Tolterodin:Tolterodin'in öncelikli metabolizma yolu sitokrom P450'nin 2D6 izoformu (CYP2D6) aracılığı iledir. Fakat, CYP2D6'si bulunmayan bir alt grup topluluk için tespit edilmiş olanmetabolizma yolu CYP3A aracılığı iledir. Bu topluluk alt grubunda CYP3A'nın inhibisyonuanlamlı derecede yüksek serum tolterodin konsantrasyonlarına yol açar. Tolterodindozajındaki bir düşüş CYP3A inhibitörleri, örneğin CYP2D6'yı zayıf metabolize edentoplulukta klaritromisin kullanımı varlığında gerekli olabilir. Triazolobenzodiazepinler (örneğin, alprazolam, midazolam, triazolam):14/33 Midazolam klaritromisin tablet (500 mg/günde 2 kez) ile birlikte verildiğinde, midazolamın AUC değeri intravenöz uygulamadan sonra 2,7 kat ve oral verilmesinden sonra ise 7 katartmıştır. Oral midazolam ile klaritromisinin eşzamanlı olarak verilmesinden kaçınılmalıdır.Eğer klaritromisin ile birlikte intravenöz midazolam veriliyorsa, hasta doz ayarlaması içinyakından izlenmelidir. Aynı önlemler CYP3A tarafından metabolize edilen diğerbenzodiazepinler için de uygulanmalıdır. Eliminasyon için CYP3A'ya bağımlı olmayanbenzodiazepinler (temazepam, nitrazepam, lorazepam) için klaritromisin ile klinik olarakönemli etkileşim söz konusu değildir. Pazarlama sonrası klaritromisin ve triazolamın eşzamanlı kullanımında ilaç etkileşimleri ve merkezi sinir sistemi (MSS) etkileri (örneğinuykululuk hali ve konfüzyon) bildirilmiştir. Hastaların artmış MSS farmakolojik etkileriaçısından izlenmeleri önerilmektedir. Diğer İlaç EtkileşimleriKolşisin:Kolşisin hem CYP3A'nın hem de dışarıya-akış taşıyıcısı olan P-glikoprotein'in (Pgp) bir substratıdır. Klaritromisin ve diğer makrolidlerin CYP3A ve Pgp'yi inhibe ettikleribilinmektedir. Klaritromisin ve kolşisin birlikte uygulandıklarında Pgp ve/veya CYP3A'nınklaritromisin tarafından inhibisyonu, kolşisine maruziyette artışa öncülük edebilir. Hastalarkolşisin toksisitesinin klinik semptomları yönüyle izlenmelidir (bkz. bölüm 4.4. Özelkullanım uyarıları ve önlemleri).Digoksin:(efflux transporter)Zidovudin:HlV-enfeksiyonlu yetişkinlere sürekli olarak oral klaritromisin ve zidovudin uygulanması, zidovudinin kararlı durum seviyelerinde düşüşe sebep olabilir. Klaritromisin eşzamanlıuygulanan oral zidovudin emilimini engellediğinden, bu etkileşim klaritromisin ve zidovudin 15/33 dozlarının 4 saatlik aralarla kullanılması sonucu önlenebilir. Bu etkileşim, klaritromisin süspansiyon ile birlikte zidovudin veya dideoksinozin alan paediyatrik HlV-enfektehastalarda gözlenmemiştir. Bu etkileşim klaritromisin, intravenöz infüzyon ile uygulandığındamuhtemel değildir. Fenitoin ve Valproat:Klaritromisin dahil olmak üzere CYP3A inhibitörleri ile CYP3A ile metabolize olduğu düşünülmeyen ilaçlar (örn. fenitoin ve valproat) arasındaki etkileşime ilişkin spontan ya dayayınlanmış bildirimler mevcuttur. Bu ilaçlar klaritromisin ile eşzamanlı kullanıldığındaserum düzeylerinin saptanması önerilir. Serum düzeylerinin artışı bildirilmiştir.Klaritromisinin, aşağıdaki ilaçlarla etkileşimine dair in-vivo insan verisi bulunmamaktadır;aprepitant, eletriptan, halofantrine ve ziprasidon. Fakat, in-vitro verilerin bu ilaçların CYP3Asübstratları olduğunu önermesi sebebiyle klaritromisinin bu ilaçlarla birlikte uygulanmasındadikkatli olunmalıdır. Eletriptan, klaritromisin gibi CYP3A inhibitörleri ile birlikteuygulanmamalıdır. Klaritromisin dahil CYP3A inhibitörleri ile siklosporin, takrolimus, metilprednisolon, vinblastin ve silostazol etkileşimlerine dair spontane veya yayınlanmış raporlar olmuştur. Çift-yönlü İlaç EtkileşimleriAtazanavir:Klaritromisin ve atazanavirin her ikisi de CYP3A'nın substrat ve inhibitörleridir ve çift yönlü ilaç etkileşimine yol açtığı yönünde kanıt mevcuttur. Klaritromisinin (500 mg/günde 2 kez)atazanavir (400 mg/günde 1 kez) ile birlikte verilmesi klaritromisine maruziyette 2 kat artışave 14-OH-klaritromisin maruziyetinde %70 azalmaya ve atazanavirin AUC değerinde %28artışa yol açar. Klaritromisinin geniş terapötik penceresi nedeni ile böbrek fonksiyonlarınormal olan hastalarda doz düşürülmesi gerekmez. Orta dereceli böbrek fonksiyonu olanhastalarda (kreatinin klerensi 30-60 mL/dak), klaritromisin dozu %50 azaltılmalıdır. Kreatininklerensi <30 mL/dak olan hastalarda uygun klaritromisin formülasyonu kullanılarakklaritromisin dozu %75 azaltılmalıdır. 1000 mg'dan yüksek günlük dozlarda klaritromisinproteaz inhibitörleri ile birlikte verilmemelidir. İtrakonazol:16/33 Klaritromisin ve itrakonazolün her ikisi de CYP3A'nın substrat ve inhibitörleridir ve çift yönlü ilaç etkileşimine yol açar. Klaritromisin itrakonazolün plazma seviyeleriniyükseltebilirken itrakonazol klaritromisinin plazma seviyelerini yükseltebilir. İtrakonazol ve klaritromisini eşzamanlı olarak alan hastalar artmış veya uzamış farmakolojik etki belirtileri açısından yakından izlenmelidir. Sakuinavir:Klaritromisin ve sakuinavirin her ikisi de CYP3A'nın substrat ve inhibitörleridir ve çift yönlü ilaç etkileşimine yol açtıkları yönünde delil vardır. Klaritromisin (500 mg/günde 2 kez) ve sakuinavir (yumuşak jel kapsüller, 1200 mg/günde 3 kez) eşzamanlı olarak 12 sağlıklı gönüllüye verilmiştir. Sakuinavirin ortalama sabit durumeğri altındaki alan (AUC) ve minimum konsantrasyonu (Cmin) tek başına sakuinavir alımınagöre %177 ve %İlaç Etkileşimleri).Didanosin:Denta-Clar MR, didanosin ile eş zamanlı olarak HIV ile enfekte yetişkinlere uygulandığında didanosinin farmakokinetiğinde istatistiksel olarak önemli bir değişiklik olmadığıkaydedilmiştir. Verapamil:Eşzamanlı olarak klaritromisin ve verapamil alan hastalarda hipotansiyon, bradiaritmi ve laktik asidoz gözlemlenmiştir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin ek bilgiler mevcut değildir. 17/33 Pediyatrik popülasyonPediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması mevcut değildir. 4.6. Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi C. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):Herhangi bir veri bulunmamaktadır. Gebelik dönemi:DENTA-CLAR' ın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz.kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Klaritromisinin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut olmadığından gebelik sırasında kullanımının güvenliliği saptanmamıştır. Bu nedenle, DENTA-CLAR OralSüspansiyonun dikkatli biçimde yarar risk değerlendirmesi yapılmadan kullanılmasıönerilmez. Laktasyon dönemi:Klaritromisinin emzirilen bebeklerdeki güvenliliği saptanmamıştır. Klaritromisin anne sütüne geçer. Üreme yeteneği/Fertilite:Fertilite ve üreme çalışmalarında, 150-160 mg/kg/günlük dozlar erkek ve dişi sıçanların, estrus siklusunda, fertilitede, doğumda ve yavruların sayı ve yaşamasında hiçbir advers etkiyesebep olmamıştır (bkz. bölüm 5.3. Klinik öncesi güvenlilik çalışmaları). 4.7. Araç ve makine kullanımı üzerindeki etkilerKlaritromisinin araç ve makina kullanımı üzerine etkisi hakkında veri bulunmamaktadır. İlaç ile baş dönmesi, vertigo, konfüzyon ve dezoryantasyon ortaya çıkma potansiyeli, hastalarınaraç ya da makine kullanması öncesinde dikkate alınmalıdır. 18/33 4.8. İstenmeyen etkilerKlaritromisin tedavisinin yetişkinlerde ve pediatrik popülasyonda en sık ve yaygın görülen advers reaksiyonları karın ağrısı, diyare, bulantı, kusma ve tat değişiklikleridir. Bu adversreaksiyonlar genellikle hafif şiddette olup makrolid antibiyotiklerinin bilinen güvenirlikprofili ile uyumludur. Klinik çalışmalarda saptanan bu gastrointestinal advers reaksiyonlarıninsidansı açısından önceden mikobakteriyel enfeksiyon olan ve olmayan hasta popülasyonlarıarasında anlamlı fark bulunmamıştır. Klaritromisin ile en azından ilişkisi olası bulunan reaksiyonlar sistem organ sınıfına ve aşağıdaki sıklığa göre gösterilmiştir: çok yaygın (>1/10), yaygın (> 1/100 ile < 1/10), yaygınolmayan (>1/1.000 ile < 1/100), çok seyrek (<1/10.000), bilinmiyor (pazarlama sonrasıdeneyime ilişkin advers reaksiyonlar; mevcut veri ile sıklığı hesaplanamayan). Her bir sıklıkgrubunda advers reaksiyonlar şiddet değerlendirmesine göre azalan şiddete göre sunulmuştur.
20/33
Klaritromisin ve kolşisin birlikte kullanıldığında, özellikle yaşlılarda olmak üzere ve bazıları böbrek yetmezliği olan hastalarda ortaya çıkan kolşisin toksisitesi bildirimleri vardır. Buhastaların bazılarında ölümler bildirilmiştir (bkz. İlaç etkileşimleri ve Uyarılar/Önlemler). Bağışıklık Sistemi Bozulmuş Pediyatrik Hastalar:Mikobakteriyel enfeksiyonlar için uzun süre klaritromisinin yüksek dozları ile tedavi edilen AIDS hastaları veya bağışıklık sistemi bozuk diğer hastalarda, olasılıkla klaritromisinuygulamasıyla alakalı advers etkileri altta yatan HIV hastalığının veya seyir eden hastalığınbelirtilerinden ayırt etmek genellikle zordur. 1000 mg ve 2000 mg klaritromisin toplam günlük dozu ile tedavi edilen yetişkin hastalar tarafından en sık bildirilen advers reaksiyonlar: bulantı, kusma, tat değişiklikleri, karın ağrısı,diyare, döküntü, gaz, baş ağrısı, konstipasyon, duyma bozukluğu, SGOT ve SGPTyükselmesidir. Daha düşük sıklıkta dispne, insomni ve ağız kuruluğu bildirilmiştir. İnsidansaçısından 1000mg ve 2000mg tedavisi arasında fark saptanmazken, günlük 4000mgklaritromisin tedavisinde insidans 3-4 kat artmıştır. Bağışıklık sistemi bozulmuş bu hastalarda testin en yüksek ya da en düşük düzeyi dışına çıkan laboratuvar değerleri analiz edilmiştir. Bu analize göre günlük toplam 1000mg ya da 2000mgklaritromisin kullanan hastaların yaklaşık %2-3'ünde SGOT ve SGPT düzeyleri yüksek vebeyaz kan hücresi ile trombosit sayısı normalden düşük bulunmuştur. Bu iki tedavi grubundadaha az oranda kan üre nitrojeninde yükselme saptanmıştır. Günlük 4000 mg doz grubundabeyaz kan hücresi dışındaki tüm paramatrelerde insidans biraz daha yüksek olmuştur. 21/33 Laboratuar Bulgularında Değişiklikler:Klinik açıdan önemli olabilecek laboratuar bulgularındaki değişimler şunlardır:Karaciğer:Yükselmiş SGPT (ALT) < %1, SGOT (AST) < %1, GGT < %1, alkalen fosfataz < %1, LDH < %1 ve total bilirubin < %1.Hematoloji:Azalmış lökosit sayısı < %1 ve yüksek protrombin zamanı %1.Böbrek:Yüksek BUN %4 ve yüksek serum kreatinini < %1Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr;[email protected];4.9. Doz aşımı ve tedavisiAşırı miktarlarda klaritromisin alımının, gastrointestinal (mide - barsak ile ilgili) semptomları vermesi beklenebilir. Bipolar bozukluk öyküsü olan bir hastada 8 g klaritromisin almış vemental durumda değişmeler, paranoid davranışlar, hipokalemi ve hipoksemi görülmüştür.Aşırı doza eşlik eden advers reaksiyonlar, absorbe edilmemiş ilacın uygun eliminasyonu vedestekleyici tedavi ile kontrol altına alınmalıdır. Diğer makrolidlerle olduğu gibi,klaritromisinin serum seviyeleri hemodiyaliz veya peritoneal diyalizden etkilenmez. 5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik özelliklerFarmakoterapötik grup : Sistemik kullanılan antibiyotikler - Makrolidler ATC Kodu: J01FA09 Klaritromisin bir semi-sentetik makrolid antibiyotiktir. Kimyasal adı 6-0 metileritromisin A'dır. Klaritromisin antibakteriyel etkisini, duyarlı bakterilerin 50S ribozomal alt ünitelerine bağlanma yoluyla protein sentezini baskılayarak gösterir. 14-OH klaritromisin metaboliti klinik açıdan anlamlı antimikrobiyal aktivitesi sayesinde Haemophilus influenzae'yakarşı ana bileşiğe nazaran 2 kat daha etkilidir.22/33 Mikrobiyolojisi:Klaritromisin, duyarlı bakterinin 50S ribozom alt ünitelerine bağlanarak antibakteriyel etkisini gösterir ve protein sentezini inhibe eder. Klaritromisinin standart bakteri suşlarına ve klinik izolatlara karsı mükemmel in vitroaktivite göstermiştir. Geniş bir aerob ve anaerob Gram pozitif ve Gram negatif organizma yelpazesinekarşı yüksek bir potansa sahiptir. Klaritromisinin minimum inhibitör konsantrasyonları (MIC)genellikle eritromisin MIC'larından bir log2 dilüsyonu kadar daha güçlüdür.İn vitroLegionella pneumophila, Mycoplasma pneumoniaeHelicobacter (Campylobacter) pylori'yeİn vitroin vivoİn vitroEnterobacteriaceae,Pseudomonastürleri ve laktozu fermente etmeyen diğer Gram negatif basillerin klaritromisineduyarlı olmadığını göstermektedir.14-OH klaritromisin metaboliti klinik açıdan anlamlı antimikrobiyal aktivitesi sayesinde Haemophilus influenzae'yakarşı ana bileşiğe nazaran 2 kat daha etkilidir.Klaritromisinin bölüm 4.1. Terapötik endikasyonlar ve bölüm 4.2. Pozoloji ve uygulama şekli bölümünde tanımlandığı gibi aşağıdaki mikroorganizmaların çoğu suşuna karşı in vitroolarakve klinik enfeksiyonlarda etkili olduğu gösterilmiştir:Gram pozitif aeroblar:Staphylococcus aureus, Streptococcuspneumoniae, Streptococcus pyogenes, Listeria monocytogenesGram negatif aeroblar:Haemophilus influenzae, Haemophilusparainfluenzae, Moraxella catarrhalis, Neisseria gonorrhoeae, Legionella pneumophilaDiğer aeroblar:Mycoplasma pneumoniae, Chlamydia pneumoniae (TWAR)Mikobakteriler:Mycobacterium leprae, Mycobacterium kansasii, Mycobacterium chelonae, Mycobacterium fortuitum, Mycobacterium avium kompleksi (MAC): Mycobacterium avium veMycobacterium intracellulareBeta laktamaz üretiminin klaritromisin aktivitesi üzerinde bir etkisi yoktur. NOT:Metisiline dirençli ve oksasiline dirençli stafilokokların çoğu suşları klaritromisine23/33 dirençlidir. Helicobacter:Helicobacter pyloriTedaviden önce yapılan kültürlerde, 104 hastada H. pyloriin vitroama bunların klinik anlamlılığı bilinmemektedir.Klaritromisin, aşağıdaki mikroorganizmaların çoğu suşuna karşı in vitro olarak etkili olduğu gösterilmekle beraber klaritromisinin bu mikroorganizmaların neden olduğu klinikenfeksiyonların tedavisindeki güvenliği ve etkililiği yeterli ve iyi kontrollü klinik çalışmalardabelirlenmiş değildir: Gram pozitif aeroblarStreptococcus agalactiae, Streptococci (Grup C.F.G), Viridans grubu streptococci,Gram negatif aeroblarBordetella pertussis, Pasteurella multocidaGram pozitif anaeroblarClostridium perfringens, Peptococcus niger, Propionibacteriumacnes.Gram negatif anaeroblar;Bacteroides melaninogenicus.Spiroketler:Borrelia burgdorferi, TreponemapallidumKampilobakterler:Campylobacter jejuniKlaritromisinin başlıca metaboliti, mikrobiyolojik aktiviteye sahip bir metabolit olan 14-OH-klaritromisindir. Bu metabolit, iki katı daha aktif olduğu H. influenzaeH. influenzaein vitroin vivoDuyarlılık TestleriZon çaplarının ölçüldüğü kantitatif yöntemler antibiyotik duyarlılığının en hassas tahminlerini vermektedir. Önerilen bir işlemde duyarlılık testi için 15 mcg klaritromisin emdirilmiş disklerkullanılmaktadır; bu disk testindeki inhibisyon zon çapları ile klaritromisinin MIC değerleriaralarında korelasyon vardır. MIC buyyon veya agar dilüsyon yöntemiyle belirlenmektedir. 24/33 Bu prosedürle, laboratuardan gelen bir rapordaki "duyarlı" ifadesi, enfeksiyon etkeni olan organizmanın tedaviye yanıt verebileceğini göstermektedir. Rapordaki "dirençli" ifadesi,enfeksiyon etkeni olan organizmanın tedaviye yanıt vermeyebileceğini göstermektedir.Rapordaki "ara duyarlılık" ifadesi ilacın terapötik etkisinin belirsiz olabileceğini veya yüksekdozlar kullanıldığında organizmanın duyarlı olabileceğini göstermektedir. (Bu son ifade aynızamanda orta derecede duyarlı olarak da belirtilebilir). Duyarlı, dirençli ve ara duyarlılık için mutlak sınırlarla ilgili olarak ülkeye veya bölgeye özgü bilgilere başvurunuz. 5.2. Farmakokinetik özelliklerEmilim:İlk farmakokinetik veriler klaritromisin tablet formülasyonlarından elde edilmiştir. Bu veriler ilacın gastrointestinal (mide - barsak) kanaldan hızlı absorbe edildiğini ve klaritromisin 250mg tabletin mutlak biyoyararlanımının yaklaşık %50 olduğunu göstermektedir.Absorpsiyonun başlaması ve antimikrobiyal olarak aktif metabolit 14-OH-klaritromisinoluşması yemeklerle hafifçe gecikir ama biyoyararlanım derecesi ilacın tok karnınaverilmesinden etkilenmez. Bu nedenle klaritromisin aç ya da tok karnına alınabilir. Erişkin bireylerdeki tek dozluk bir çalışmada pediyatrik formülasyonun genel biyoyararlanımının tabletinkine eşit veya ondan az miktarda daha yüksek olduğu bulunmuştur(her birinde dozaj 250 mg). Tabletle olduğu gibi, pediyatrik formülasyonun yemekleverilmesi absorpsiyonun başlamasında hafif bir gecikmeye yol açar ama klaritromisinin genelbiyoyararlanımını etkilemez. Karşılaştırmalı klaritromisin Cmax, AUC ve T 'A değerleri(tokluk halinde) pediyatrik formülasyon için sırasıyla 0.95 mcg/ml, 6.5 mcg saat/ml ve 3.7saat ve 250 mg tablet için (açlık halinde) sırasıyla 1.10 mcg/ml, 6.3 mcg saat/ml ve 3.3 saatolmuştur. Dağılım:İn vitroçalışmalar klaritromisinin insan plazmasında proteine bağlanma oranı, klinikte önem taşıyan konsantrasyonlar olan 0.45 ile 4.5 mcg/ml arasında ortalama %70 civarındadır.Klaritromisin ve metaboliti 14 -OH klaritromisin vücut dokularına ve sıvılarına kolaycadağılır. Serebrospinal sıvı penetrasyonu ile ilgili bilgi mevcut değildir. Dokukonsantrasyonları serum konsantrasyonlarından daha yüksektir. Klaritromisin, büyük ölçüdeBubekar§ciğe5d§efflgtib1oJizgediiirrXeasiffaarası^ğınldafe&esifeâiılAfip Öftemi.imterdMMellaadresinden kontrol edilebilir. Güvenli elektronik imza aslı ile aynıdır. Dokümanın doğrulama kodu : lYnUyZmxXM0FyRG83ZmxXZlAxZW5625/33 (idrarla) da atılır. Klaritromisinin böbrek klerensi doz miktarından bağımsız olup, normal glomerüler filtrasyon hızına yaklaşır. Doku ve serum konsantrasyonlarından örnekler aşağıdasunulmuştur:
Biyotransformasyon:Oral antibiyotik tedavisi gereken pediyatrik hastalarda, klaritromisin aynı süspansiyon formülasyonunun kullanıldığı erişkin bireylerde daha önce alınan sonuçlarla uyumlu birfarmakokinetik profille birlikte iyi bir biyoyararlanım göstermiştir. Sonuçlar, çocuklarda hızlıve yaygın bir ilaç absorpsiyonu olduğunu göstermektedir. Absorpsiyonun başlamasındakihafif bir gecikme dışında yiyeceklerin, ilacın biyoyararlanımı veya farmakokinetik profilleriüzerinde anlamlı bir etkisi yok gibi görünmektedir. Tedavinin beşinci gününde dokuzuncudozdan sonra ana ilaç ve aktif metaboliti 14-OH klaritromisin için elde edilen farmakokinetikparametreler sırasıyla şöyledir: Cmaks 4.60 mcg/ml ve 1.64 mcg/ml; EAA 15.7 mcg saat/ml ve6.69 mcg saat/ml. Tmaks 2.8 saat ve 2.7 saat; eliminasyon yarı ömrü 2.2 ve 4.3 saat. Eliminasyon:12 saatte bir verilen 250 mg oral dozun ortalama %20'si idrarda değişmemiş klaritromisin olarak atılır. 12 saatte bir verilen 500 mg dozdan sonra değişmemiş ana ilacın idrarla atılımıortalama %30'dur. Ancak, klaritromisinin böbrek klerensi doz büyüklüğünden göreceli olarakbağımsızdır ve normal glomerüler filtrasyon hızı civarındadır. İdrarda bulunan majörmetabolit 14-OH-klaritromisin, 12 saatte bir uygulanan 250 mg veya 500 mg dozlarında, ilavebir %10 ila %15'lik miktardan sorumludur. Doğrusallık Doğrusal Olmayan Durum:Klaritromisin doğrusal olmayan bir farmakokinetiğe sahiptir. 26/33 Hastalardaki karakteristik özelliklerKaraciğer Yetmezliği:Karaciğer fonksiyonu bozuk olan olgularda klaritromisinin kararlı durum konsantrasyonları, normal bireylerden farklı değildir; ancak, karaciğer yetmezliği olanlarda 14-OH-klaritromisinkonsantrasyonları daha düşüktür. 14-OH-klaritromisin oluşumundaki azalma, karaciğeryetmezliği olan olgularda sağlıklı bireylerle karşılaştırıldığında klaritromisinin böbrekklerensindeki bir artışla en azından kısmen dengelenmektedir. Böbrek Yetmezliği:Klaritromisinin farmakokinetiği, çoklu 500 mg oral dozlar alan, böbrek fonksiyonu bozulmuş olgularda da değişiklik gösterir. Böbrek yetmezliği olanlarda klaritromisin ve 14-OHmetabolitinin plazma düzeyleri, yarı ömrü, Cmaks ve Cmin değerleri normal bireylere göre dahayüksektir ve EAA daha büyüktür. Bu parametreler arasındaki farkın derecesi, böbrekyetmezliğinin derecesi ile orantılıdır; böbrek yetmezliği ne kadar şiddetli ise fark o derecedeanlamlıdır (Bkz. bölüm 4.2. Pozoloji ve uygulama şekli). Yaşlılarda:Yapılan çalışmalar sonucunda, klaritromisinle ilgili etkilerin bireyin yaşı değil böbrek fonksiyonuyla ilişkili olduğuna karar verilmiştir. Pediyatrik hastalarda:Oral antibiyotik tedavi gerektiren pediyatrik hastalarda klaritromisin; yetişkinlerde elde edilen farmakokinetik profile paralel biyoyararlılık vermiştir. Sonuçlar, çocuklarda hızlı ve yoğunbir ilaç absorpsiyonu göstermiş, gıda alımı absorpsiyonu biraz geciktirse de, biyoyararlılık vefarmakokinetik profili etkilememiştir. 5 günlük bir tedavinin son gününde dokuzuncu dozdansonra ana ilaç ve aktif metaboliti için elde edilen farmakokinetik parametreler sırasıylasöyledir; Cmaks 4,60 mcg/ml ve 1,64 mcg/ml; EAA 15,7 mcg saat/ml ve 6,69 mcg saat/ml;Tmaks 2,8 saat ve 2,7 saat; eliminasyon yarı ömrü 2,2 saat ve 4,3 saat. Yapılan bir başka çalışmada, otitis media'lı hastaların orta kulak sıvısına klaritromisin penetrasyonu ile ilgili bilgiler edinilmiştir. 5'inci dozun (doz günde 2 defa 7.5 mg/ kg'dır )alınmasından yaklaşık 2.5 saat sonra, klaritromisinin orta kulaktaki ortalama konsantrasyonu 27/33 2.53 mcg/sıvı, 14-OH metabolitininki 1.27 mcg/g sıvı'dır. Ana ilaç ve 14-OH metabolitinin konsantrasyonları serumdaki konsantrasyonlarının genellikle 2 katıdır. 5.3 Klinik öncesi güvenililik verileriAkut, subkronik ve kronik toksisite:Oral olarak klaritromisin uygulanan fare, sıçan, köpek ve/veya maymunlarda çalışmalar yapılmıştır. Uygulama süresi, 6 birbirine takip eden ay süresince tek bir oral dozdantekrarlanan günlük dozlara kadar uzanmıştır. Akut fare ve sıçan çalışmalarında, 5 g/kg. vücutağırlığındaki tek bir gavajı takiben, 1 sıçan ölmüş, ölen fare olmamıştır. Dolayısıyla, medyanletal doz 5 g/kg'dan (uygulama için en yüksek fizibl doz) daha büyüktür. 14 gün süreyle 100 mg/kg/gün dozunda veya 1 ay süreyle 35 mg/kg/gün dozunda klaritromisine maruz kalan primatlarda klaritromisine atfolunacak hiç bir advers etkigörülmedi. Benzer şekilde 1 ay süreyle 75 mg/kg/gün dozuna; 3 ay süreyle 35 mg/kg/gündozuna veya 6 ay süreyle 8 mg/kg/gün dozuna maruz kalan sıçanlarda da hiç bir advers etkigörülmedi. 50 mg/kg/gün dozunu 14 gün, 10 mg/kg/gün dozunu 1 ve 3 ay ve 4 mg/kg/gündozunu 6 ay, advers etki görülmeksizin tolere eden köpekler, klaritromisine daha hassastılar. Yukarıda bahsedilen bu klinik çalışmalarda, toksik dozlarda beliren önemli klinik belirtiler; kusma, zayıflık, gıda tüketiminde düşüş ile kilo almada düşüş, salivasyon, dehidrasyon vehiperaktiviteyi içerir. 400 mg/kg/gün dozu uygulanan 10 maymundan ikisi 8'inci tedavi günüölmüştür; 28 gün boyunca 400 mg/kg/gün klaritromisin uygulanan bazı yaşayanmaymunlarda, bazı izole durumlarda sarı renkli feçes görülmüştür. Bütün türlerdeki toksik dozlarda, primer hedef organı karaciğerdi. Bütün türlerde hepatotoksisite gelişimi, alkalin fosfataz, alanin ve aspartat amino transferaz, gamma-glutamiltransferaz ve/veya laktik dehidrogenazın serum konsantrasyonlarındaki erken artışlarıyla,tespit edilebilirdi. İlacın kesilmesi, bu spesifik parametrelerin konsantrasyonlarının normaledönüşü ile sonuçlandı. Çeşitli çalışmalarda daha az etkilenen organlar, mide, timus ile diğer lenf dokuları ve böbreklerdi. Terapötik dozlara yakın dozları takiben, konjonktival enfeksiyon ve göz yaşı 28/33 akması sadece köpeklerde görüldü. 400 mg/kg/gün'lük yoğun dozda, bazı köpekler ve maymunlarda, korneal donukluk ve/veya ödem görüldü. Fertikte, Üreme ve Teratojenite:Fertikte ve üreme çalışmalarında, 150-160 mg/kg/günlük dozlar erkek ve dişi sıçanların, estrus siklusunda, fertilitede, doğumda ve yavruların sayı ve yaşamasında hiçbir advers etkiyesebep olmamıştır. Wistar (po) ve Spraque-Dawley (po ve IV) sıçanlarında iki teratojenite çalışması, Yeni Zelanda tavşanlarında bir çalışma ve sinomolog maymunlarda bir çalışma, klaritromisindenkaynaklanan bir teratojenite göstermemiştir. Sadece, benzer dozlarda ve benzer koşullardaSprague-Dawley sıçanlarda yapılan ilave bir çalışmada, istatiksel olarak önemsiz ensidansta(yaklaşık %6) kardiyovasküler anomaliler oluşmuştur. Bu anomaliler, koloni içindeki genetikdeğişimlerin spontan ifadesine bağlı görünmektedir. Sıçanlarda yapılan iki çalışmada,insanlarda kullanılan günlük klinik dozun üst limitinin (500 mg BID) 70 katı dozuygulanmasını takiben değişken insidansta (%3'den %30'a) konjenital damak yarığıgörülmüştür; günlük klinik dozun 35 katı uygulandığında bu anomalinin görülmemesi,maternal ve fetal toksisite olduğunu, ama teratojenite olmadığını ifade eder. Klaritromisin günlük insan dozunun (500 mg BID) üst limitinin yaklaşık 10 katı uygulandığında, gebeliğin 20'inci gününden itibaren maymunlarda embriyonik kayıba(düşüğe) sebep olmuştur. Bu etki, ilacın çok çok yüksek dozlardaki maternal toksisitesinebağlanmıştır. Maksimum günlük dozun yaklaşık 2.5 - 5 katı uygulanan gebe maymunlardakiek bir çalışmada, fetusa herhangi bir zarar gelmemiştir. 1000 mg/kg/gün (maksimum insan günlük klinik dozunun yaklaşık 70 katı) dozunun uygunlandığı farelerdeki dominant letal test, mutajenik aktivite açısından açıkça negatiftir ve80 gün boyunca günde kg başına 500 mg'a kadar doz (maksimum günlük insan klinikdozunun yaklaşık 35 katı) uygulanan sıçanlardaki segment 1 çalışmasında, klaritromisinin buçok yüksek dozlarına böylesine uzun-süre maruz kalmaktan dolayı erkek fertilitesindefonksiyonel bir bozukluğa rastlanmadı. Mutajenite:Klaritromisinin mutajenik potansiyelini değerlendirmek için hem aktivite edilmemiş hem de sıçan-karaciğer-mikrozom aktivite edilmiş test sistemleri (Ames Testi)29/33 kullanılarak çalışmalar yapılmıştır. Bu çalışmaların sonucunda, 25mcg/petri'lik veya daha az ilaç konsantasyonlarında hiç bir mutajenik potansiyel deliline rastlanmadı. 50 mcg'lıkkonsantrasyonda ilaç test edilen bütün suşlar için toksiktir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı Maddelerin ListesiKarbomer Kolloidal Anhidr Silika Metakrik asit kopolimer dispersiyonuMakrogol 1500Talk Karbopol 974P Sukroz Aspartam potasyum Ksantan zamkıKolloidal Anhidr SilikaSodyum Sitrat MonohidratSodyum BenzoatTitanyum DioksitKarışık Meyva AromasıTat Maskeleyici Aroma 6.2 GeçimsizliklerMevcut değil. 6.3 Raf ömrü24 ay. 6.4 Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında, kuru bir yerde ve iyi kapatılmış şişesinde muhafaza edilir. Süspansiyon hazırlandıktan sonra 25°C'nin altındaki oda sıcaklığında 14 günsaklanabilir. 30/33 6.5 Ambalajın niteliği ve içeriğiDENTA-CLAR 250 mg/5 ml oral süspansiyon hazırlamak için granül:6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİDrogsan İlaçları San. ve Tic. A.Ş. Oğuzlar Mah. 1370. sok. No:7/3 06520 Balgat-ANKARATel : 0 312 287 74 10Faks: 0 312 287 61 15 8. RUHSAT NUMARASI211/73 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi : 07.06.2007 Ruhsat yenileme tarihi : 10. KÜB'ÜN YENİLEME TARİHİ31/33 |
İlaç BilgileriDenta-clar 250 Mg/5ml Oral Süspansiyon İçin GranülEtken Maddesi: Klaritromisin Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.