Reminyl 16 mg uzatılmış salımlı kapsül Kısa Ürün BilgisiSinir Sistemi » Psikoanaleptikler » Anti Demans İlaçlarAlzheimer İlaçları » Antikolinesterazlar » Galantamin KISA ÜRÜN BİLGİSİh BEŞERİ TIBBİ ÜRÜNÜN ADIREMINYL 16 mg uzatılmış salimli kapsül2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Her bir uzatılmış salimli kapsül, 16 mg galantamine eşdeğer galantamin hidrobromür içerir.Yardımcı maddeler:117,07 mg sükroz içerir.Yardımcı maddeler için 6.1 'e bakınız. 3. FARMASÖTİK FORMUzatılmış salimli kapsül.Beya2 ve beyaza yakın renkte tanecikler İçeren, üzerinde "G16 baskısı bulunan, 2 numara büyüklüğünde, pembe opak sert jelatin kapsüller. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarREMINYL, hafif ve orta şiddette Alzheimer tipi demansın semptomatik tedavisinde, serebrovasküler hastalık ile ilişkili hafif ve orta şiddetli Alzheimer tipi demansın semptomatik tedavisinde endikedir.4.2 Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:Başlangıç dozuÖnerilen başlangıç dozu 4 hafta süreyle günde 8 mg'dır. Halen REMINYL hızlı salimli formülasyonlar (oral solüsyon) ile tedavi gören hastalarda, REMINYL uzatılmış salimli kapsül tedavisine geçilirken, son REMINYL oral solü.syon dozu akşam alınıp, ertesi sabah günde bir kez REMINYL uzatılmış salimli kapsül tedavisine başlanabilir. Günde iki kez REMINYL oral solüsyondan, günde bir kez REMINYL uzatılmış salimli kapsül tedavisine geçilirken aynı toplam günlük doz kullanılmalıdır. Uygun değerlendirmeler sonucunda hastanın tedaviyi kabul edilebilir düzeyde tolere ederek, tedaviden yarar gördüğü belirlenirse, tedaviye aşağıda tanımlanan idame rejimine göre devam edilebilir. İdame dozu Başlangıçtaki idame dozu günde 16 mg'dır ve hastalar en az 4 hafta süreyle günde 16 mg kullanmahdır. - Galantamin toleransı ve dozu, tercihen tedaviye başlandıktan üç ay içerisinde, düzenli aralıklarla tekrar değerlendirilmelidir. Bunun ardından, galantaminin klinik yararı ve hastanın tedaviye toleransı klinik kılavuzlara uygun olarak düzenli aralıklarla tekrar değerlendirilmelidir. Terapötik yarar sağlandığı ve hasta galantamin tedavisini tolere ettiği sürece idame tedavisine devam edilebilir. Terapötik etkinliğe dair belirtiler sürmediğinde veya hastanın tedaviyi tolere etmemesi halinde galantamin tedavisinin kesilmesi düşünülmelidir. - Doz, klinik yarar ve tolerabilite değerlendirilerek, maksimum idame dozu olan günde 24 mg'a çıkarılabilir. Günde 24mg doza yanıt artışı göstermeyen ya da tolerabilite sorunu olan hastalarda dozun günde 16 mg'a düşürülmesi düşünülmelidir.Tedavinin aniden kesilmesinin ardından rebound etki görülmez (örneğin cerrahiye hazırlık sırasında). Eşzamanlı tedavi Güçlü CYP2D6 ya da CYP3A4 inhibitörleri ile tedavi gören hastalarda doz azaltılması düşünülmelidir (bkz. Bölüm 4.5 Diğer fıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri).Uygulama şekli:REMINYL uzatılmış salimli kapsül, günde tek doz olmak üzere sabahları ve tercihen yemekle birlikte kullanılmalıdır. Kapsüller bütün olarak bir miktar sıvıyla yutulmalıdır. Kapsüller çiğnenmemeli veya ezilmemelidir. Tedavi süresince hastanın yeterli miktarda sıvı alması sağlanmalıdır.özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Orta veya ağır derecede karaciğer veya böbrek yetmezliği olan hastalarda galantamin plazma seviyeleri yükselebilir.Kreatinin klerensi 9 ml/dk'mn üzerinde olan hastalarda doz ayarlamasma gerek yoktur. Ağır böbrek yetmezliği olan (kreatinin klerensi 9 ml/dk'nm altında) hastalarda REMINYL kullanımı Önerilmemektedir, (hkz. Bölüm 4.3 Kontrendikasyonlar).-{bkz. Bölüm 4.3 Kontrendikasyonlar).Hafif derecede karaciğer yetmezliği olan hastalarda doz ayarlamasma gerek yoktur.Pediyatrik popülasyon:REMINYL'in çocuklarda kullanılması tavsiye edilmemektedir. Çocuklar Üzerinde kullanım ile ilgili deneyim yoktur,4.3 KontrendikasyonlarREMINYL aşağıdaki durumlarda kontrendikedir: Galantamin, galantamin hidrobromür veya yardımcı maddelerden herhangi birine karşı aşın duyarlılığı olan hastalarda Ağır böbrek yetmezliği (kreatinin klerensi 9 ml/dk'nın altında) olan hastalarda Ağır karaciğer yetmezliği (Child-Pugh puanı 9'un üzerinde) olan hastalarda Belirgin böbrek ve karaciğer fonksiyon bozukluğu olan hastalarda 4.4 Özel kullanım uyarılan ve önlemleriREMINYL, hafif ve orta şiddette Alzheimer tipi demansın .semptomatik tedavisinde, serebrovasküler hastalık ile ilişkili hafif ve orta şiddetli Alzheimer tipi demansın semptomatik tedavisinde endikedir. REMINYL'in diğer tiplerde demansı ya da zihinsel bozukluklan olan hastalar üzerindeki yararı gösterilmemiştir.Alzheimer tipi demans tanısı, güncel rehberler doğrultusunda, deneyimli bir hekim tarafmdan konulmalıdır. REMINYL tedavisi hekim gözetimi altında yapılmalıdır ve yalnızca hastanın ilaç alimini düzenli olarak izleyecek biri mevcutsa başlatılmalıdır. Alzheimer Hastalığı olan hastalar kilo kaybederler. Galantamini de içeren kolinomimetikler bu hastalarda kilo kaybı ile ilişkilidir. Tedavi sırasında hastanın kilosu izlenmelidir. Di&er kolinomimetiklerde olduğu gibi, aşağıdaki durumlarda galantamin verilirken dikkatliolunmalıdır:Kardiyovasküler Durumlar:Farmakolojik etkileri nedeniyle kolinomimetikler kalp atım hızı üzerinde vagotonik etkiye sahip olabilirler (Örn. bradikardi). Bu etki potan.siyeli hasta sinüs sendromu ve diğer supraventriküler kalp iletim bozuklukları olan ya da eşzamanlı olarak digoksin ve beta bloker gibi kalp atım hızını düşüren ilaçlar alan ya da düzenlenememiş elektrolit dengesizliği (örn. hiperkalemi, hipokalemi) olan hastalarda özellikle Önemli olabilir. Klinik çalışmalarda REMINYL kullanımı senkop ve nadiren şiddetli bradikardi ile ilişkilendirilmiştir. Bu sebeple ani post-miyokardiyal enfaktüs periyodu, yeni başlayan atriyal fibrilasyon, ikinci dereceden veya daha üstü kalp bloğu, unstabil anjina pektoris veya konjestif kalp yetmezliği (özellikle NYHA grup III - IV) gibi kardiyovasküler rahatsızlıkları olan hastalarda galantamin uygulanırken dikkatli olunmalıdır. Alzheimer demans hastası ve galantamin ile tedavi edilen hastaların olduğu plasebo kontrollü çalışmaların değerlendirildiği bir analizde bazı kardiyovasküler advers olayların sıklığında artış gözlenmiştir (hkz. Bölüm 4.8 İstenmeyen etkiler).Gastrnintestinal durumlar:Halen nonsteroidal antiinflamatuar ilaçlar (NSAİl) alan hastalar dahil olmak üzere, ülser hikayesi olan ya da bu gibi durumlara yatkınlığı olan kişiler gibi peptik ülser gelişme riski yüksek olan hastalar belirtiler açısından izlenmelidir. Gastrointestinal obstrüksiyonu olan ya da gastrointestinal cerrahi sonrası iyileşme döneminde olan hastalarda REMINYL kullanımı tavsiye edilmemektedir. Nörolojik durumlar:Kolinomimetiklerin jeneralize nöbete neden olma potansiyeline sahip olduklarına inanılmaktadır. Bununla birlikte nöbet gelişmesi Alzheimer Hastalığı'nm bir belirtisi de olabilir. Seyrek olarak kolineıjik tonusun artması Parkinson tipi semptomları kötüleştirebilir. Alzheimer demans hastası ve galantamin ile tedavi edilen hastaların olduğu plasebo kontrollü çalışmaların değerlendirildiği bir analizde serebrovasküler olaylar nadir olarak gözlenmiştir {bkz. Bölüm 4.8 İstenmeyen etkiler).Bu durum serebrovasküler rahatsızlığı olan hastalara galantamin uygulanırken düşünülmelidir.Pulmoner durumlar:Kolinomimetikler, şiddetli astım ya da obstrüktif akciğer hastalığı veya pulmoner enfeksiyonu (pnömoni v.b.) olan hastalarda dikkatli kullanılmalıdır. Genitoüriner:İdrar yolu obstrüksiyonu olan ya da mesane cerrahisinin iyileşme dönemindeki hastalarda REMINYL kullanımı önerilmez. Anestezi:REMINYL, bir kolinomimetik olarak, anestezi sırasında süksinilkolin tipi ka,s gevşemesini artırabilir. Nadir kalıtımsal früktoz intoleransı, glikoz-galaktoz malabsorpsiyon veya sükraz-izomaltaz yetmezliği problemi olan hastalar bu ilacı kullanmamalıdır. Hafif Kognitif Bozukluğu (HKB) o)an hastalarda güvenlilikREMINYL, yaş ve eğitimlerine göre beklenenden daha fazla izole hafıza bozukluğu gösteren ancak Alzheimer hastalığının kriterlerine uymayan kişiler gibi HKB'si olan kişilerde endike değildir.HKB'li hastalarda yapılan iki ayrı 2 yıllık kontrollü çalışma, ikili primer etkinlik sonuçlarını karşılamamıştır. Her iki tedavi grubunda da görülen mortalite düşük olmasına rağmen, galantamine randomize edilen hastalarda, başlangıçta plaseboya kıyasla daha fazla ölüm gözlenmiştir. Ancak her iki tedavi grubunda görülen ciddi advers olay sıklığı özdeştir, ölümler, yaşlı popülasyon için beklenmedik olmayan çeşitli nedenlere bağlıdır. Çift-kör dönem tamamlanmak üzereyken çalışmayı bırakan geniş bir hasta grubunda elde edilen veriler çalışmaya dahil edildiğinde, REMINYL tedavisi gören hastalarda ölüm riskinin artışına dair bir kanıt olmadığı görülmüştür. Plasebo grubunda galantamin grubuna kıyasla daha fazla hasta ölmeden kısa bir süre önce çalışmayı bırakmıştır. Bu durum başlangıçta bildirilen mortalite farklılıklarına yol açmıştır. HKB çalışmasının sonuçları, Alzheimer hastalığı çalışmalarının sonuçlarından farklıdır. Alzheimer hastalığı ile ilgili çalışmaların havuzunda (n=46l4), REMINYL ile görülen mortalite oranı plaseboya göre sayısal olarak yüksektir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriFarmakodinamik etkileşimlerEtki mekanizması nedeniyle galantamin diğer kolinomimetiklerle (ambenonyum, donepazil, neostigmin, piridostigmin, rivastigmin veya sistemik uygulanan pilokarpin gibi) birlikte verilmemelidir. Galantamin antikolinerjik ilaçların etkilerini antagonize eder. Atropin gibi antikolineıjik bir ilaç aniden kesilirse, galantamin etkisinin artma riski olabilir. Kolinomimetikler ile bekleneceği gibi, kalp atım hızını belirgin biçimde düşüren ilaçlar ile (öm. digoksin, beta blokerler, bazı kalsiyum kanal blokörleri ve amiadoron) farmakodinamik bir etkileşim mümkündür. Torsades de pointes'ç^neden olabilecek ilaçlar kullanılırken dikkatli olunmalıdır. Bu gibi durumlarda EKG düşünülmelidir.Bir kolinomimetik olarak galantamin, anestezi sırasında süksinilkolin tipi kas gevşemesini artırabilir. Farmakokinetik etkileşimlerGalantaminin eliminasyonunda birçok metabolik yol ve renal atılım rol oynamaktadır. Klinik önem taşıyan etkileşimlerin olasılığı düşüktür. Fakat bireysel çalışmalarda anlamlı etkileşimlerin sıklığı klinik olarak anlamlı olabilir. Gastrik asit sekresyonunun inhibisyonu galantaminin emilimini değiştirmez. Yiyeceklerle birlikte alınması galantaminin emilim hızını yavaşlatır fakat emilim miktarını değiştirmez. Kolinerjik yan etkileri en aza indirmek için galantaminin yiyeceklerle birlikte alınması önerilir. Galantaminin metabolizmasını etkileyen diğer ilaçlarGüçlü CYP2D6 ve CYP3A4 inhibitörleri galantaminin eğri altındaki alanını (EAA) artırabilir. Çoklu doz farmakokinetik çalışmalar, galantaminin EAA'sının, ketokonazol ve eritromisin ile birlikte uygulandığında %30 ve %I2, paroksetin ile birlikte uygulandığında %40arttığını göstermiştir. Diğer bir CYP3A4 inhibitörü olan eritromisin ile uyguladığında ise EAA yalnızca %10 artmıştır. Alzheimer hastalığı olan hasta popülasyonu farmakokinetik analizleri, galantamin klerensinin, bilinen CYP2D6 inhibitörleri olan amitriptilin, fluoksetin, fluvoksamin, paroksetin ve kinidin ile birlikte kullamldığmda %25-33 azaldığını göstermiştir.Bu nedenle, güçlü CYP2D6 ve CYP3A4 inhibitörleri ile tedaviye başlandığında, hastalarda çoğunlukla bulantı ve kusma gibi kolinerjik yan etkilerin sıklığında artış görülebilir. Bu gibi durumlarda, tolere edilebilirliğe bağlı olarak, REMINYL idame dozunun düşürülmesi düşünülebilir {hkz. Bölüm 4.2 Pozoloji ve uygulama ^'ekli).N-metil-D-aspartat (NMDA) reseptör antagonisti olan memantinin, 2 gün süresince günde 10 mg dozu takiben, 12 gün süresince günde 2 kez 10 mg dozda uygulandığında, günde 16 mg dozda uygulanan galantaminin kararlı durum farmakokinetik değerleri üzerinde herhangi bir etkisi olmamıştır. Galantaminin diğer ilaçların metabolizmalarına etkiniREMINYL'in terapötik dozunun (günde 24 mg) digoksin ve varfarin kinetiği üzerinde etkisi yoktur. REMINYL, varfarin tarafından indüklenmiş olan protrombin zamanındaki artışı etkilememiştir. In viiroçalışmalar, galantaminin insan sitokrom P450 sisteminin başlıca formlarını inhibe etme potansiyelinin çok düşük olduğunu göstermiştir.4.6 Gebelik ve Laktasyon Gene] tavsiyeGebelik kategorisi: BÇocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon)Galantamin için gebeliklerde maruz kalmaya ilişkin klinik veri mevcut değildir.Hayvanlar üzerinde yapılan çalışmalar fetus ve yenidoğanda kemik gelişiminde hafif bozulma [hafif bir gelişim geriliği] olduğunu göstermiştir (hkz. Bölüm 5J Klinik öncesi güvenlilik verileri).İnsanlara yönelik potansiyel risk bilinmemektedir.Gebelik dönemiREMINYL'in gebe kadmlarda kullanımı ile ilgili yeterli çalışma bulunmamaktadır. REMINYL, sadece anneye sağlayacağı muhtemel yarar fetüsün maruz kalacağı potansiyel riski karşıladığında kullanılabilir.Laktasyon dönemiGalantaminin insan sütüyle atılıp atılmadığı bilinmemektedir. Galantaminin süt ile atılımı emziren anneler üzerinde araştırılmamıştır. REMINYL emzirme döneminde kullanılmamalıdır.Üreme yeteneği / FertiliteREMINYL'in üreme yeteneği üzerine etkisi ile ilgili klinik çalışma yoktur.4.7 Araç ve makine kuliammı üzerindeki etkiierAlzheimer hastalığı araç ve makine kullanma yeteneği üzerinde kademeli bir bozukluğa neden olabilir. Bunun yanında REMINYL, özellikle tedavinin ilk haftalarında, diğer kolinomimetikler gibi, araç ve makine kullanma yeteneğini etkileyebilecek biçimde somnolans ve uyku hali oluşturabilir.Hastalar araç ve makine kullanmadan önce doktora danışmaları konusunda uyarılmalıdır. 4.8 İstenmeyen etkilerEn sık görülen advers ilaç reaksiyonları olan bulantı ve kusma daha çok titrasyon süresi boyunca gözlenmiş, çoğu vakada bir haftadan krsa süre içerisinde sonlanmış ve hastaiann çoğunda sadece bir olay görülmüştür. Anti-emctik kullanımı ve yeterli sıvı alımı bu durumlarda yararlı olabilir.Randomize, çift-kör, plasebo-kontrollü bir klinik çalışmada, REMINYL uzatılmış salım kapsüller ile günde bir kez tedavinin güvenlilik profili sıklık ve tip olarak tabletler ile görülenlere benzerdir. Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1000 ila <1/100); seyrek (>1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Gastrointestinaihastalıklar
Kusma, bulantı Abdotninal ağrı, üst abdominal ağrı, diyare,dispepsi, midede rahatsızlık, abdominal rahatsızlık
Öğürmek Hepato-bilier
Hepatit hastalıklarDeri ve deri altı doku
Hiperhidröz hastalıklarıKas'iskelet bozukluklar, bağ doku ve kemik hastahkları
Kas spazmları
Kaslarda zayıflık Genelbozukluklar
Yorgunluk, asteni, kırıklık Hepatik Araştırmalar
Kiloda azalma enzimlerde yükselme Yaralanma
Düşme 4.9 Doz aşımı ve tedavisiBelirtilerREMINYL'in belirgin doz aşımma ait belirti ve bulgularının diğer kolinomimetiklerin doz aşımlarına benzer olması beklenir. Bu etkiler genellikle merkezi sinir sistemini, parasempatik sinir sistemini ve nöromüsküler kavşağı kapsar. Kas güçsüzlüğü ve fasikülasyonlara ek olarak kolinerjik kriz bulgulannm bazıları ya da tümü gelişebilir: şiddetli bulantı, kusma, gastrointestinai kramp, tükrük ve gözyaşı salgısınm artması, idrar yapma ve defekasyoıı, terleme, bradikardi, hipotansiyon, kollaps ve konvülziyonlar. Trakeal hipersekresyon ve bronkospazmlarla birlikte artan kas güçsüzlüğü yaşamı tehdit edici hava yolu tıkanıklığına yal açabilir. Pazarlama sonrası raporlarda, REMINYL'in yanlışlıkla aşırı dozda alınması ile bağlantılı olarak Torsade de Pointes, QT uzaması, bradikardi, ventriküler taşikardi ve kısa süreli bilinç kaybı bildirilmiştir. Alınan dozun bilindiği bir vakada bir günde sekiz adet 4 mg tablet (toplam 32 mg) alınmıştır. iki ayrı vakada 32 mg'ın (bulantı, kusma ve ağız kuruluğu; bulantı, kusma ve substernal göğüs ağnsı) ve bir vakada 40 mg'ın (kusma) yanlışlıkla alınması, hastaların tamamen iyileştiği gözlenene kadar hastaneye yatırılmaları ile sonuçlanmıştır. Günde 24 mg reçetelenmiş olan ve son iki yıldır devam eden halüsinasyon hikayesi olan bir hasta yanlışlıkla 34 gün süreyle günde iki defa 24 mg almış ve halü.sinasyonlar nedeniyle hastaneye yatırılmıştır. Günde 16 mg oral solüsyon reçetelenmiş olan bir başka hasta ise yanlışlıkla 160 mg (40 mİ) almış ve bir saat sonra terleme, kusma, bradikardi ve bayılma hissi nedeniyle hastane tedavisine gereksinim duymuştur. Belirtiler 24 saat içinde düzelmiştir. TedaviHer doz aşımı olgusunda olduğu gibi, genel destekleyici önlemler alınmalıdır. Şiddetli olgularda atropin gibi antikolinerjikler, kolinomimetikler için genel bir antidot olarak kullanılabilir. Başlangıç dozu olarak intravenöz uygulama yolu ile 0,5-1,0 mg önerilir ve doz klinik yanıta göre ayarlanır. Doz aşımına ait tedavi stratejileri sürekli geliştiğinden doz aşımı tedavisindeki son önerileri saptamak için bir zehir kontrol merkezine başvurulması önerilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Antidemans ilaçları ATC kodu: N06D A04Etki MekanizmasıTersiyer bir alkaloid olan galantamin, asetilkolinesterazın seçici, yarışmalı ve geri dönüşlü bir inhibitörüdür. Ayrıca galantamin, muhtemelen reseptörün allo.sterik bölgesine bağlanarak, asetilkolinin nikotinik reseptörler üzerindeki intrinsik etkisini artırır. Bunun sonucunda Alzheimer tipi demansı olan hastalarda kolinerjik etkinliği artırmak kognitif fonksiyonları düzel tebilmektedir. Farmakodinamik EtkilerREMINYL tedavisi ile, Alzheimer tipi demansı olan hastalarda, artmış kogııitif fonksiyona bağlı olarak kolinerjik sistemde aktivite artışı elde edilir. Klinik Etkinlik ve GüvenlilikAlzheimer hastalığmm kontrollü klinik çalışmalarında REMINYL'in etkin dozları günde 16, 24 ve 32 mg' dır. Günde 16 ve 24 mg dozların en iyi yarar/risk oranına sahip olduğu kanısına varılmış ve bu dozlar, idame dozlar olarak önerilmiştir. Gulantaminin etkinliği dört özel sonuç ölçümü kullanılarak gösterilmiştir; ADAS-cog (performansa dayalı ölçümü temel alan bir performans testi), CIBIC-plus (hasta ve hasta yakmı ile yapılan görüşmeye dayalı olan ve bağımsız bir hekim tarafından yapılan global bir değerlendirme), gündelik yaşam aktivitelerinin çeşitli ölçümleri ve Nöropsikiyatrik Anket (NPI, davranış bozukluğunu ölçen bir ölçek). Klinik çalışmalarda galantamin ile tedavi gören hastaların ADAS-cog ve CIBIC-plus performansları, plasebo alan hastalara göre daima istatistiksel açıdan belirgin derecede daha iyidir. Galantamin ile 6 ay tedavi gören hastaların ADAS-cog skorları başlangıçtaki skorlar ile karşılaştırıldığında belirgin derecede iyileşmiştir. Tedavi almayan hastalar ile karşılaştırıldığında kavrama fonksiyonu üzerinde önemli ve devamlı bir yarar sağlanmıştır. Galantamin tedavisi ayrıca giyinme, hijyen, yemek hazırlama gibi gündelik yaşam aktivitelerinin bozulmasını belirgin şekilde önlemiştir. Bunlar Demansın Yetersizlik Değerlendirmesi (DAD) ve Alzheimer Hastalığı İşbirliği Çalışması (ADCS)-ADL-Anketi, hasta yakını değerlendirmesi kullanılarak değerlendirilmiştir. Davranış bozukluklarının ortaya çıkmasının sonucu olarak plasebo hastalarının skoru açık bir şekilde gerilerken, günde 16 ve 24 mg galantamin dozları inceleme süresi boyunca NPI skorunu korumuştur. e 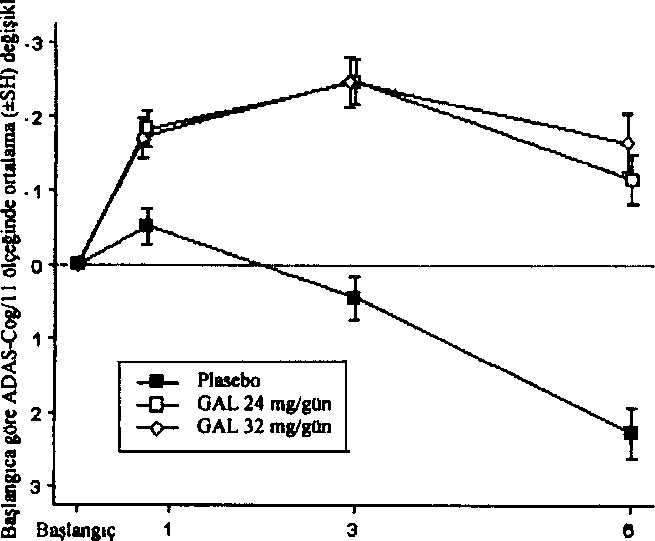
Ay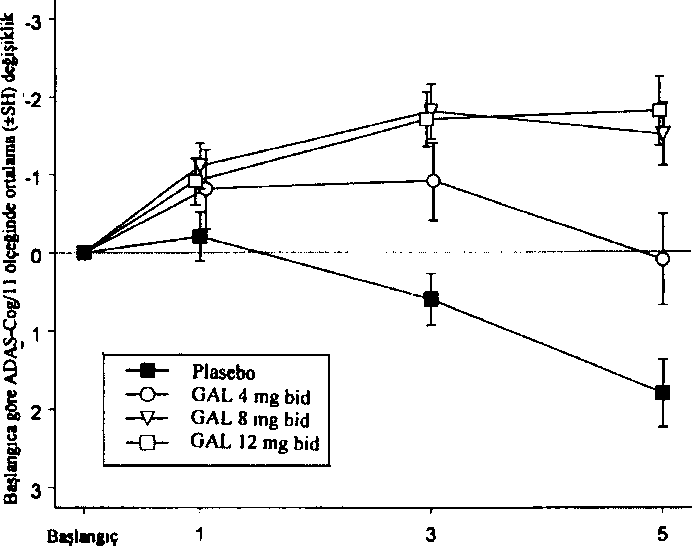 Ay
AyUzun süreli tedavi (6 aylık çift-körü takiben 6 aylık açık tedavi kombinasyonu) hastalann kavrama ve fonksiyonel performanslarının bütün bir yıl devam ettiğini göstermiştir. Randomizc, çift kor ve plasebo kontrollü bir çalışmada, REMINYL uzatılmış salimli kapsülün Alzheimer hastalığındaki etkinliği çalışılmıştır. Hastalar 4 hafta süreyle günde 8 mg galantamini takiben 4 hafta süreyle günde 16 mg galantamin almışlardır. Güvenlilik ve tolerabiliteye bağlı olarak S.haftada doz günde 24 mg'a çıkarılabilir veya I2.haftada günde 16 mg'a düşürülebilir. 12.haftada seçilen doz kalan 6 ay için sabitlenir. 6.ayda, sırasıyla iki sona erme noktasındaki, protokol ile belirlenmiş primer etkinlik analizinde (ADAS-cog/11 ve CIBIC-plus) REMINYL uzatılmış salimli kapsül yalnız ADAS-cog/11 skorunda plaseboya göre istatistiksel olarak belirgin bir iyileşme göstermiştir. Ayrıca REMINYL uzatılmış salimli kapsül, bir sekonder etkinlik ölçümü olan gündelik yaşam aktivitelerinin iyileşmesinde (ADCS-ADL) plaseboya göre istatistiksel açıdan belirgin olarak üstündür. Bu çalışmada aktif kontrol olan REMINYL uzatılmış salimli kapsül ve REMINYL tabletin etkinlik sonuçlan benzerdir. Serebrovasküler Hastalık ile Birlikte Seyreden Alzheirner Hastalığı (AD+CVD)Galantaminin etkinlik ve güvenliliği Alzheirner hastalığı ve belirgin serebrovasküler hastalığı (AD+CVD) olan hastalarda çift-kör, plasebo-kontrollü bir çalışma ile araştırılmıştır. Toplam çalışma popülasyonunun (n=592) %48'i (282) AD+CVD kriterlerine uymuştur. Klinik çalışma alt grup analizleri için güçlendirilmiş olmasa da galantamin tedavisi alan hastalar, plasebo tedavisi alan hastalar ile karşılaştırıldığında her iki primer sonuçta [kavrama; ADAS-cog/l 1 (p<0,001); genel klinik değerlendirme: CIBIC-plus (p<0,001)] ve günlük yaşam aktiviteleri ölçümünde [DAD (p=0,003)] istatistiksel olarak belirgin bir iyileşme göstermiştir. Genel olarak AD+CVD hastalarında galantaminin güvenlilik ve tolere edilebilirliği Alzheirner hastalığında galantaminle yapılan daha önceki çalışmalarda gözlenene benzerdir. Deneklerde en sık bildirilen yan etki bulantı (galantamin grubunda %19 ve plasebo grubunda %11) olmuştur. AD+CVD hastalarında %5'in üzerinde oluşan ve galantamin grubunda plasebo grubuna göre daha sık bildirilen diğer yan etkiler baş dönmesi, kusma, kann ağrısı, diyare ve bitkinliktir. Plasebo grubunda serebrovasküler bozukluk (örn; inme) sıklığı daha yüksektir [plasebo, 5/96 (%5) denek; galantamin, 2/186 [%l] denek].Sonuç olarak AD+CVD'deki güvenlilik profili Alzheirner hastalığı olan deneklerdeki galantamin çalışmalarında gözlenen ile uyumludur. Hafif Kognitif Bozukluk (HKB)HKB'li denekler ile yapılan iki ayrı 2 yıllık kontrollü çalışma, ikili primer etkinlik sonuçlarını karşılamamıştır. Mortalitenin düşük olmasına rağmen (%0,7) galantamine randomize edilen hastalarda (13/1026) plaseboya göre (1/1022) başlangıçta daha fazla ölüm bildirilmiştir. Ancak ciddi yan etkilerin görülme sıklığı (% 19) tedavi gruplan arasında özdeştir. Her iki tedavi grubunda çift-kör dönem tamamlanmak üzereyken çalışmayı bırakan (GAL-COG-3002) geniş bir hasta grubundan elde edilen veriler çalışmaya dahil edildiğinde, 56'sı galantamin grubunda ve 46'sı plasebo grubunda olmak üzere toplam 102 ölüm saptanmıştır [bağıl risk (%95 GA)= 1,24 (0,84, 1,83); p= 0,274]. 24 aylık tedavi-amaçlı analizlerde plaseboya randomize edilen deneklerde 20 ölüm, REMINYL'e randomize edilen deneklerde ise 34 ölüm bildirilmiştir [relatif risk (%95 GA)- 1,70 (1,00, 2,90); p=0,051], Çift-kör çalışma ilacını bırakmak için protokol ile belirlenmiş süre olan 30 gün içinde ölen deneklerden 14'ü galantamin grubundan, 3'ü ise plasebo grubundandır [relatif risk (%95 GA)= 4,08 (1,57, 10,57); p=0,004]. Galantamin ile tedavi gören denelilere göre, plasebo ile tedavi gören deneklerden daha fazlası ölmeden kısa bir süre önce çalışmayı bırakmıştır. Bu durum başlangıçta bildirilen mortalite farkhiıklanna yol açmıştır. Plasebo grubundaki 13 ölüm ve galantamin grubundaki 20 ölüm, hastalar çift-kör çalışma ilacına maruz bırakıldığı sırada gelişen yan etkiler ile direkt ilişkili bulunmuştur [relatif risk (%95 GA)= 1,54 (0,78, 3,04); p=0,2l8]. Ölümler, yaşlı popülasyon için beklenmedik olmayan çeşitli nedenlere bağlıdır. Plasebo ve aktif tedavi gruplarındaki ölümlerin yaklaşık yarısı vasküler nedenlere bağlı olmuştur. REMINYL ile tedavi gören hastalarda ölüm riskinde artışa dair bir bilgi yoktur. Bu durum verilerin tüm analizlerinde sürekli olarak incelenmiştir. HKB çalışma sonuçları, Alzheimer hastalığı çalışmalannda gözlenenler ile uyumlu değildir. Alzheimer hastalığının havuz çalışmalarında (n= 4614) plasebo grubundaki mortalite oranı REMINYL grubuna göre sayısal olarak yüksektir. Serebrovasküler hastalık ile birlikte seyreden Alzheimer demansı dahil Alzheimer hastalığında, REMINYL'e bağlı olarak mortalitede artışa dair bir kanıt yoktur. 5.2 Farmakokinetik özellikler Genel özelliklerEmilimOral yolla tek doz 8 mg galantamin tablet alınmasının ardından emilim hızlıdır. 1,2 saat sonra ulaşılan pik plazma konsantrasyonu 43 ± 13 ng/ml ve ortalama AUCoo değeri ise 427 ± 102 ng.sa/ml'dir. Galantaminin mutlak oral biyoyararlanımı %88,5'dir. Galantaminin yemekler ile birlikte oral alımı absorpsiyon hızını düşürür (Cmaks %25 düşer) ancak absorbe olan miktar değişmez (EAA). Tekrarlayan oral dozlarda günde iki defa 12 mg galantamin tablet alınmasını takiben ortalama vadi ve pik konsantrasyonları 30-90 ng/ml arasında değişmektedir. Günde 2 kez 4-16 mg dozda kullanılması halinde lineer kinetik gösterir. Bir kararlı durum biyoyararlanım çalışmasında, günde bir kez 24 mg REMINYL uzatılmış salimli kap.sülün, AUC24saat ve Cmm'e göre, günde iki kez 12 mg hızlı salimli tablete biyoeşdeğer olduğu gösterilmiştir. Günde bir kez 24 mg uzatılmış salimli kapsülün 4,4 saat sonra ulaşılan C,aks değeri günde iki kez 12 mg hızlı salimli tabletten %24 daha düşüktür. Yiyeceklerin, 24 mg uzatılmış salimli kapsülün kararlı durum biyoyararlanımı üzerinde bir etkisi yoktur. REMINYL uzatılmış salimli kapsülün, sağlıklı yaşlılar ve daha genç yetişkin deneklerdeki doz-oransallık çalışmasında, her iki yaş grubunda, tüm dozlarda (8 mg, 16 mg ve 24 mg), kararlı durum plazma konsantrasyonlarına 6 günde ulaşılmıştır. Bu çalışmada, bu doz aralığında ilacın kararlı durumda lineer kinetik gösterdiği saptanmıştır. DağılımGalantamin orta derecede dağılım hacmi olan (ortalama Vdss: 175 litre) düşük klerensli (plazma klerensi yaklaşık 300 ml/dakika) bir ilaçtır. Galantaminin climinasyonu, bi-eksponansiyel olup terminal yanlanma ömrü 7-8 saattir. B i votran sformasvonAna metabolik yollar N-oksidasyon, N-demetilasyon, 0-demetilasyon, glukuronidasyon ve epimerizasyondur. O-demetilasyon hızlı CYP2D6 metabolize edicilerde çok daha önemlidir. Toplam radyoaktivitenin idrar veya feçes ile atılımı yavaş ve hızlı metabolize ediciler arasında farklı değildir. İn vitroçalışmalar galantaminin metabolizmasında yer alan en önemli sitokrom P450 izoenzimlerinin, sitokrom P4,50 2D6 ve 3A4 olduğunu doğrulamıştır.Yavaş ve hızlı metabolize edicilerin plazmasındaki radyoaktivite esas olarak değişmemiş galantamin ve glukuronidinden oluşmaktadır. Hızlı metabolize edicilerin plazmasındaki O-desmetilgalantaminin glukuronidi de aynca önemlidir. Tek doz .sonrası yavaş ve hızlı metabolize edicilerin plazmasında, galantaminin aktif metabolitlerinden (norgalantamin, 0-desmetilgalantamin ve O-desmetil-norgalantamin) hiçbiri, konjuge olmamış formlarında tespit edilememiştir. Norgalantamin çoklu dozlama sonrası hastaların plazmasında tespit edilebilmiştir ancak galantamin seviyelerinin % lO'undan fazlasını oluşturmamıştır. Eliminasvon4 mg oral tek doz 'H-galantaminden yedi gün sonra, radyoaktivitenin % 90 - 97'si idrardan, % 2,2 - 6,3'ü feçesten elde edilmiştir. İntravenöz ve oral uygulamadan sonra, dozun % 18 - 22'si, 24 saat içinde, değişmemiş galantamin olarak idrarla atılmıştır. Rcnal klerens toplam plazma klerensinin % 20 - 25'ine karşılık gelen 65 ml/dk'dır. Doğrusallık/Doğrusal Olmavan DurumGalantaminin farmakokinetiği günde iki defa 4-16 mg doz aralığında doğrusaldır. REMINYL uzatılmış salimli kapsülün kararlı durum farmakokinetiği, çalışılan doz aralığı olan 8-24 mg aralığında her iki yaş grubunda, doza bağımlıdır. REMINYL uzatılmış salimli kapsülün, sağlıklı yaşlılar ve daha genç yetişkin deneklerdeki doz-oransallık çalışmasında, her iki yaş grubunda, tüm dozlarda (8 mg, 16 mg ve 24 mg), kararlı durum plazma konsantrasyonlarına 6 günde ulaşılmıştır. Şekil 3: Ortalama Galantamin Plazma Konsantrasyonu-Zaman Profillerinin Karşılaştırmalı Doğrusal Grafiği 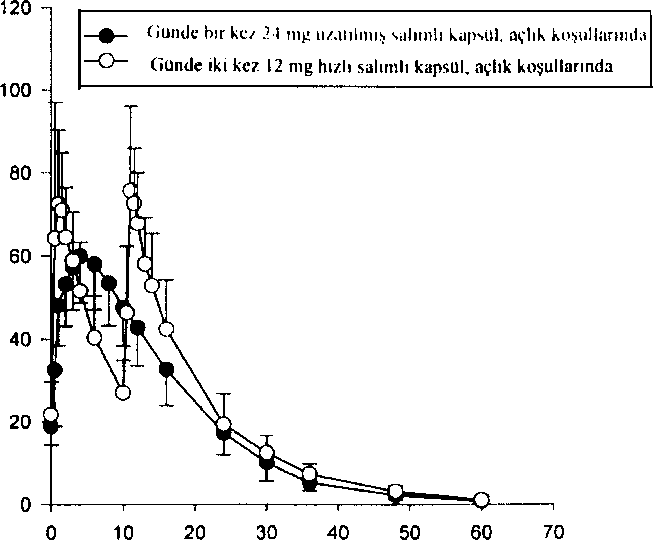 /ütıiiuı, saji
/ütıiiuı, sajiE "öt c dE 3 'O Hastalardaki karakteristik özelliklerYasKlinik çalışmalardaki hastalardan elde edilen veriler galantaminin plazma konsantrasyonlarının Alzheimer hastalığı olan hastalarda sağlıklı genç deneklere göre %30-40 daha yüksek olduğunu gö.stermiştir.Böbrek yetmezliğiGalantaminin dispozisyonu farklı derecelerde böbrek fonksiyonlu genç deneklerde çalışılmıştır. Kreatinin klerensi azaldıkça galantaminin eliminasyonu azalmıştır. Böbrek fonksiyon bozukluğu olan hastalarda galantaminin plazma konsantrasyonları, yaş ve ağırlıkça benzer olan sağlıklı denekler (C1CR>=12Iml/min) ile karşılaştırıldığında, orta derecedeki böbrek yetmezliğinde (Clc»= 52-104 ml/dakika) % 38 ve ağır böbrek yetmezliğinde (CIcr- 9-51 ml/dakika) % 67 artmıştır. Popülasyon farmakokinetik analizi ve simülasyonu, böbrek yetmezliği olan Alzheimer hastalarında, kreatinin klerensi en az 9 ml/dakika olduğu sürece doz ayarlamasına gerek olmadığını göstermiştir.Karaciğer yetmezliğiHafif derecede karaciğer yetmezliği olan hastalarda (Child-Pugh puanı 5-6) galantaminin farmakokinetiği sağlıklı kişilerdeki ile karşılaştırılabilir. Orta derecede karaciğer yetmezliği olan hastalarda (Child-Pugh puanı 7-9) galantaminin EAA'sı ve yarı ömrü %30 artmıştır (bkz. Bölüm 4.2 Pozoloji ve uygulama .şekli).Plazma proteinlerine bağlanmaGalantaminin plazma proteinlerine bağlanması düşüktür: %17,7 ± 0,8. Tam kanda galantamin başlıca kan hücreleri (% 52,7) ve plazma sıvısına (%39,0) dağılır; plazma proteinlerine bağlanan kısmı sadece % 8,4'dür. Galantaminin kan-plazma konsantrasyon oranı 1,17'dir.5.3 Klinik öncesi güveniiiik verileriGebe sıçanlarda 16 mg/kg'a kadar olan dozlarda (terapötik insan dozunun 25 katı) ve gebe tavşanlarda 40 mg/kg'a kadar olan dozlarda (terapötik insan dozunun 63 katı) yapılan üreme çalışmalarında, herhangi bir teratojenik potansiyel gözlenmemiştir. Sıçanlarda 16 mg/kg dozda minör iskelet anormalliklerinin sıklığında belirgin olmayan bir artış gözlenmiştir.6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiJelatin Dietil fitalat Etil.selüloz HipromelozPolietilen glikol Titanyum dioksit (E 171) Sükroz Mısır nişastası Kırmızı demir oksit (E172) 6.2 GeçimsizliklerBilinen herhangi bir geçimsizliği bulunmamaktadır.6.3 Raf ömrü24 ay6.4 Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız.6.5 Ambalajm niteliği ve içeriği28 kapsül içeren PVC-PE-PVDC/Alu blister.6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİJohnson &Johnson Sıhhi Malzeme San. ve Tic. Ltd. Şti., Kavacık Mah. Ertürk Sk.Keçeli Plaza No: 13 Kavacık-Beykoz/İstanbulTel: 0.216.538 20 00 Faks: 0.216.538 23 69 8. RUHSAT NUMARASI119/879. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ25.04.2006/19.08.201110. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriReminyl 16 mg uzatılmış salımlı kapsülEtken Maddesi: Galantamin hidrobromür Atc Kodu: N06DA04 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.