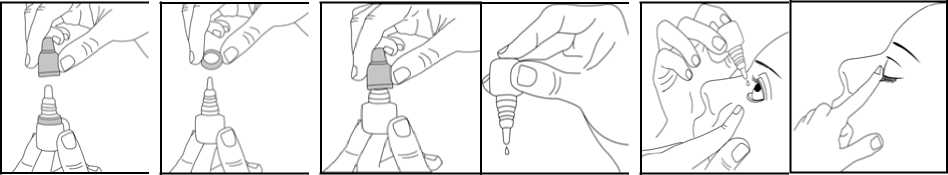
Midax %1 Göz Damlası, Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIMİDAX %1 göz damlası, çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Tropikamid 10 mg/ml Yardımcı madde:Benzalkonyum klorür 0,1 mg/ml Yardımcı maddeler için 6.1.'e bakınız. 3. FARMASÖTİK FORMGöz damlası Renksiz, berrak solüsyon 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarMİDAX şu durumlarda kullanılır: Tanı işlemleri sırasında, midriyazis ve siklopleji sağlanması için ve bazı preoperatif ve postoperatif durumlarda kısa etki süreli bir midriyatik gerektiğinde. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Sikloplejik refraksiyon için:Göze (ya da gözlere) %1'lik çözeltiden 1-2 damla damlatılır, beş dakika içinde tekrarlanır. Hasta 20 ila 30 dakika içinde muayene edilmezse, midriyatik etkiyi uzatmak için ek bir damladamlatılabilir.Göz dibi muayenesi için:Muayeneden 15-20 dakika evvel % 1'lik çözeltiden 1 damla damlatılır. Bol pigmentli bir irise sahip kişiler daha büyük dozlara ihtiyaç gösterebilirler. 1/10 Uygulama şekli:MİDAX göze uygulanır.Gözyaşı kanalını tıkayınız veya uygulamadan sonra göz kapağını nazikçe kapatmanız önerilir. Bu durum oküler yoldan uygulanan tıbbi ürünlerin sistemik geçişini azaltabilir ve sistemikadvers reaksiyonlarda düşüşe neden olur. Kullanım için aşağıdaki şekilde hareket ediniz: Kapağı açınız (Şekil 1). İlk uygulamada kapağın altındaki halkayı atınız (Şekil 2). Kapağı tekrar tamamen ve sıkıcavidalayınız (Şekil 3). Böylece damlalıktaki zar delinir ve damlalık akmaya başlar. Şişeyi baş ve orta parmaklarınız arasında tutarak ters çeviriniz. Ters çevrilmiş şişenin üzerine işaret parmağınız ile bir kerede uygulayacağınız hafif basınçile MİDAX'ın bir damlası akacaktır (Şekil 4). Kafanızı hafifçe geriye doğru yatırınız. Göz kapağı ve gözünüz arasında bir kese oluşacakkadar parmağınızla alt göz kapağınızı aşağı doğru çekiniz. Damlanın oluşan kese içinedamlatılması gerekmektedir (Şekil 5). Damlalık ucunu göze yaklaştırınız. Eğer yardımcı olacaksa bir ayna kullanınız. Damlalığı gözünüze, göz kapağınıza, gözünüzün etrafındaki yüzeylere veya diğeryüzeylere değdirmeyiniz. Değdirirseniz, damlalığa mikroorganizmalar bulaşabilir. MİDAX'ı damlattıktan sonra alt göz kapağınızı yavaşça serbest bırakınız, gözünüzükapatınız ve göz-burun arası bölgeye bir parmağınız ile hafifçe bastırınız (Şekil 6). Buönlem MİDAX'ın vücudun diğer bölgelerine yayılımını önleyecektir. Eğer damlayı iki gözünüze de kullanmanız gerekiyorsa yukarıdaki adımları diğer gözünüziçin de tekrarlayınız. Eğer damla gözünüze gelmezse tekrar deneyiniz. Kullandıktan sonra MİDAX'ın kapağını sıkıca kapatınız. Gözünüz için kullandığınız başka bir ilaç daha varsa, her iki ilaç uygulaması arasında en az5 dakikalık ara veriniz.
2/10 Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:MİDAX bu grup hastalarda çalışılmamıştır. Pediyatrik popülasyon:Ciddi advers reaksiyon riskinden ötürü infantlarda %Geriyatrik popülasyon:Göz içi basıncı yükselmiş yaşlılarda dikkatli kullanılmalıdır. 4.3. KontrendikasyonlarAşağıdaki durumlarda MİDAX kullanılmamalıdır: Tropikamid veya yardımcı maddelerden herhangi birisine karşı aşırı duyarlılık Dar açılı glokom. 4.4. Özel kullanım uyarıları ve önlemleriM İDAX topikal olarak kullanılmasına rağmen, sistemik etkiler gözlenebilir.Antikolinerjik ilaçlara aşırı duyarlılığı olan hastalarda tropikamid-indüklü psikotik reaksiyonlar ve davranış bozuklukları meydana gelebilir. Tropikamid göz içi basıncını yükseltebilir. Yaşlılarda ya da yüksek göz içi basıncına sahip olan kişilerde, midriyatikler ve sikloplejikler dikkatle kullanılmalıdır. Dar açılı glokomunindüklenmesi riskinden kaçınmak için ön kamara açı derinliğine bakmak gereklidir. Belladonna alkoidlerine duyarlı olan çocuklarda ve yetişkinlerde sistemik toksisite riski artışı nedeniyle, daha dikkatli olunması tavsiye edilir. 3/10 Hiperemi sistemik absorbsiyonunu yüksek oranda arttırdığı için inflamasyonlu gözde dikkatli kullanınız. Sistemik absorpsiyonu azaltmak için damla uygulamasından sonra en az 2 dakika süreyle punktuma dijital basınç uygulanmalıdır. Solüsyonun kontaminasyonunu önlemek için damlalık ağzını hiçbir yere değdirmeyiniz. MİDAX'da koruyucu madde olarak kullanılan benzalkonyum klorür gözde irritasyona sebebiyet verebilir ve kontakt lenslerin rengini bozabilir. Yumuşak kontakt lenslerletemasından kaçınılmalıdır. Uygulamadan önce kontakt lens çıkarılmalı ve lensi tekrar takmak için en azından 15 dakika beklenmelidir. İlaç intravenöz uygulama için değildir. İlaç intravenöz olarak uygulanırsa hayatı tehdit eden advers reaksiyonların meydana geldiği bildirilmiştir. Pediyatrik Popülasyon:İnfantlarda ve çocuklarda tehlikeli olabilecek merkezi sinir sistemi rahatsızlıklarına neden olabilir. Çocuklarda aşırı kullanımı sistemik toksik semptomlara neden olabilir. İnfantlarda, küçük veya prematüre bebeklerde veya down sendromu, spastik paralizi veya beyin hasarı olan çocuklardadaha dikkatli kullanılmalıdır. Ebeveynler bu preparatın çocuklar için oral toksisiteye sahip olduğu konusunda uyarılmalı ve uygulamadan sonra hem kendi ellerini hem de çocuklarının ellerini yıkamaları tavsiyeedilmelidir. 4.5.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriTrisiklik antidepresanlar, antipsikotikler, amantadin, fenotiyazinler, bazı antihistaminikler gibi ilaçları almakta olan hastalarda uygulanması ile antimuskarinik etkilerde artış beklenir. 4/10 Birden fazla oftalmik ilaç kullanılıyorsa; iki ilaç arasında en az beş dakika olmalıdır. Göze birden fazla ilaç uygulanması gerektiğinde pomad formu en son uygulanmalıdır Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonda etkileşimler ile ilgili bilgi mevcut değildir. Pediyatrik popülasyon:Pediyatrik popülasyonda etkileşimler ile ilgili bilgi mevcut değildir. 4.6.Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlar/doğum kontrolü üzerinde etkisi olduğunu gösteren çalışma bulunmamaktadır. Gebelik dönemiHayvanlar üzerinde yapılan çalışmalar, gebelik, embriyonel/fetal gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir. Bu nedenle MİDAXgebelerde hekim tarafından mutlak gerekli görüldüğü durumlarda kullanılmalıdır. Laktasyon dönemiTropikamid veya metabolitlerinin insan sütüne geçip geçmediği bilinmemektedir. Emzirilen çocuklardaki risk göz ardı edilemez. MİDAX tedavisinin mi, emzirmenin mi bırakılacağı kararıemzirmenin çocuk için yararı/tedavinin anne için yararı göz önünde bulundurularakverilmelidir. Üreme yeteneği/FertiliteTropikamid ile hayvanlarda üreme çalışmaları yapılmamıştır. Üreme kapasitesi üzerindeki etkisi bilinmemektedir. 5/10 4.7. Araç ve makine kullanımı üzerindeki etkiler:MİDAX, bulanık görmeye ve ışığa karşı hassasiyete neden olabilir. Bu etkiler ortadan kalkana kadar, araç ve makine kullanımından uzak durmak gereklidir. Tropikamid içeren gözdamlalarının etkisinin tam olarak ortadan kalkması için gereken süre yaklaşık 6 saattir. 4.8. İstenmeyen etkiler:Klinik çalışmalar ve satış sonrası gözetim çalışmalarından elde edilen verilere göre istenmeyen etkiler aşağıda organ sistem sınıflamasına ve sıklıklarına göre sunulmuştur. Sıklıklar şöyle tanımlanabilir: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila <1/100), seyrek (> 1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor(eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sistemi hastalıklarıBilinmiyor: Alerjik reaksiyon Psikiyatrik hastalıklarBilinmiyor: Çocuklarda bu grup ilaçlarla, psikotik reaksiyonlar, davranış bozuklukları görülebilir. Sinir sistemi hastalıklarıBilinmiyor: Baş dönmesi, baş ağrısı Göz hastalıklarıBilinmiyor: Göz içi basınç artışı, bulanık görme, geçici batma hissi, ışığa duyarlılık, göz ağrısı, uzamış uygulamalarda lokal iritasyon, hiperemi, ödem ve konjonktivit. Kardiyak hastalıklarBilinmiyor: Çarpıntı ve ritm bozukluğu ile birlikte taşikardiyi izleyen bradikardi. Çocuklarda kardiyorespiratuvar kollaps. 6/10 Vasküler hastalıklarBilinmiyor: Senkop, hipotansiyon Gastrointestinal hastalıklarBilinmiyor: Ağız kuruluğu, gastrointestinal motilitede azalma ve konstipasyon, mide bulantısı Deri ve deri altı doku hastalıklarıBilinmiyor: Deride kuruluk, deride döküntü, müköz membranlarda kuruluk, deride kızarıklık Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarBilinmiyor: Uzamış ilaç etkisi (midriyazis) Antikolinerjik ilaçların diğer belirtileri; idrara sıkışma hissi, ter bezlerinde, nazal, bronşial ve lakrimal sekresyonlarda azalmadır. Çocuklarda kusma, baş dönmesi, sersemlik ve döküntü; infantta abdominal şişkinlik görülebilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir www.titck.gov.tr[email protected] aşımı ve tedavisiTopikal kullanımı takiben, özellikle çocuklarda, sistemik toksisite ortaya çıkabilir. Ciltte kızarıklık (flushing) ve kuruma, bulanık görme, ateş, hızlı ve düzensiz nabız, infantlardaabdominal şişkinlik, konvülziyonlar, halüsinasyonlar ve nöromüsküler koordinasyon kaybıgörülebilir. Tedavi semptomatik ve destekleyicidir. İnfantlarda ve küçük çocuklarda vücut yüzeyi nemli 7/10 tutulmalıdır. İlaç kazara yutulursa; kusturma ve gastrik lavaj uygulanır. 5. FARMAKOLOJİK ÖZELLİKLER5.1.Farmakodinamik özelliklerFarmakoterapötik grup: Oftalmik ilaçlar, midriyatikler ve siklopilejikler. ATC kodu: S01FA06 MİDAX parasempatolitik bir ajandır. Tropikamid, asetilkolin ile yarışarak asetilkolinin reseptöre tutunmasını engeller ve bu şekilde asetilkolinin etkisini bloke eder. Topikalkullanımında midriyazis ve siklopleji sağlar. 5.2. Farmakokinetik özelliklerGenel özelliklerTropikamid topikal uygulandığında dokulara atropin kadar sıkı bağlanmaz. Hızlı etki gösterir, fakat etki süresi nispeten kısadır. Uygulamadan 15-20 dakika sonra başlayan midriyazis 6 saatdevam eder. Siklopleji ise 20 dakika sonra maksimal düzeye ulaşıp 2-6 saat sonunda tümüyledüzelen kısa süreli etki biçimindedir. Emilim:Tropikamidin topikal uygulamasının emilimi ile ilgili ayrıntılı bilgi mevcut değildir. Dağılım:Tropikamidin topikal uygulamasının dağılımı ile ilgili ayrıntılı bilgi mevcut değildir. Biyotransformasyon:Tropikamidin topikal uygulamasının biyotranformasyonu ile ilgili ayrıntılı bilgi mevcut değildir. Eliminasyon:Tropikamidin topikal uygulamasının eliminasyonu ile ilgili ayrıntılı bilgi mevcut değildir. 5.3. Klinik öncesi güvenlilik verileriKısa ürün bilgisinin diğer bölümlerinde yer alan klinik öncesi güvenlilik verilerine 8/10 eklenebilecek başka veri bulunmamaktadır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiBenzalkonyum klorür Disodyum EdetatSodyum klorür Hidroklorik asit (pH ayarlacıyı) Enjeksiyonluk su 6.2. GeçimsizliklerGeçerli değildir. 6.3. Raf ömrü24 ay 6.4.Saklamaya yönelik özel tedbirler25oC altındaki oda sıcaklığında saklanmalıdır. Açıldıktan sonra 25°C'nin altında tutularak 4 hafta içinde kullanılmalıdır. Soğutulmamalıdır veya dondurulmamalıdır. Şişeyi kutuda muhafaza ediniz ve kapalı turunuz. 6.5. Ambalajın niteliği ve içeriğiKutuda HDPE emniyet halkalı, vidalı kapak ile kapatılan beyaz LDPE damlalık ile beyaz opak LDPE şişede kullanma talimatı ile birlikte sunulur. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış ürünler ya da atık materyaller Tıbbi Ürünlerin Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 9/10 7. RUHSAT SAHİBİWorld Medicine İlaç Sanayi ve Ticaret A.Ş. Bağcılar, İstanbul 8. RUHSAT NUMARASI09.05.2019 - 2019/250 9. ILK RUHSAT TARIHI/ RUHSAT YENILEME TARIHIİlk ruhsat tarihi: Ruhsat yenileme tarihi: 10. KUB'UN YENİLENME TARİHİ
10/10 |
İlaç BilgileriMidax %1 Göz Damlası, ÇözeltiEtken Maddesi: Tropikamid Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.