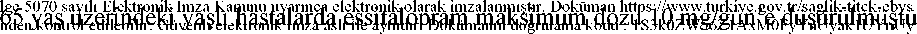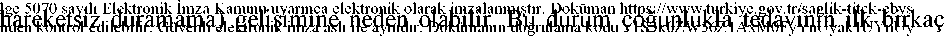Medolapram 20 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BESERİ TIBBİ ÜRÜNÜN ADIMEDOLAPRAM 20 mg film kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir tablet 20 mg essitaloprama eşdeğer 25,55 mg essitalopram oksalat içerir.Yardımcı maddeler:3. FARMASÖTİK FORMFilm tablet Beyaz renkli, yuvarlak, çentikli film tabletler. Tabletler iki parçaya bölünebilir 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarMajör depresif durumlar, Agorafobili veya agorafobisiz panik bozukluğu, Sosyal anksiyete bozukluğu (sosyal fobi), Yaygın anksiyete bozukluğu, Obsesif-Kompülsif Bozukluk (OKB) tedavilerinde kullanılır. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:20 mg'ın üzerindeki günlük dozlarda güvenliliği kanıtlanmamıştır. 65 yaş altındaki erişkinlerde maksimum doz 20 mg/gün olarak aynı şekilde kalmaktadır. Majör depresif durumlarGünde bir kez 10 mg olarak alınır. Bireysel hasta cevabına göre, doz günde maksimum 20 mg'a çıkarılabilir. 1/24 Antidepresan cevap için genelde 2-4 hafta gerekir. Belirtiler düzeldikten sonra, alınacak cevabın konsolidasyonu için en az 6 aylık tedavi süresi gerekmektedir. Agorafobili veya agorafobisiz panik bozukluğuGünlük 10 mg'lık doza geçilmeden önce, ilk hafta günde 5 mg'lık başlangıç dozu tavsiye edilir. Doz daha sonra, alınacak bireysel hasta cevabına göre, günde maksimum 20 mg'açıkarılabilir. Maksimum etki, yaklaşık 3 ay sonra alınır. Tedavi birkaç ay sürer. Sosyal anksiyete bozukluğu (sosyal fobi)Günde bir kez 10 mg olarak alınır. Semptomların giderilmesi için genellikle 2-4 hafta gereklidir. Hastanın bireysel yanıtına göre doz 5 mg'a düşürülebilir veya günde maksimum 20mg'a çıkarılabilir. Sosyal anksiyete bozukluğu, kronik seyirli bir hastalıktır ve alınacak cevabın konsolidasyonu için 12 haftalık tedavi tavsiye edilir. Tedaviye cevap verenlerin 6 aylık uzun dönemli tedavisiincelendiğinde, relapsın önlenmesi bakımından cevabın bireylere bağlı olarakdeğerlendirilmesi gerektiği görülmüştür. Tedaviden sağlanan faydaların düzenli aralıklarlatekrar değerlendirilmesi gerekir. Sosyal anksiyete bozukluğu, spesifik bir bozukluğun iyi tanımlanmış tanısal terminolojisidir ve aşırı çekingenlikle karıştırılmamalıdır. Bu bozukluğun sadece profesyonel ve sosyalaktivitelere önemli şekilde etki etmesi halinde ilaçla tedaviye başlanmalıdır. Bu tedavi, kognitif davranışsal terapi ile karşılaştırmalı olarak incelenmemiştir. İlaçla tedavi, genel tedavi stratejisinin bir parçasıdır. Yaygın anksiyete bozukluğuBaşlangıç dozu günde bir kez 10 mg'dır. Bireysel hasta cevabına göre, doz günde maksimum 20 mg'a çıkarılabilir. Tedaviye cevap veren hastalarda, uzun dönemli tedavi (20 mg/gün) en az 6 aylık çalışmalarla değerlendirilmiştir. Tedaviden sağlanan faydalar ve doz düzenli aralıklarla tekrar 2/24Obsesif Kompülsif Bozukluk (OKB)Başlangıç dozu günde bir kez 10 mg'dır. Bireysel hasta cevabına göre, doz günde maksimum 20 mg'a çıkarılabilir. OKB kronik bir hastalık olduğundan dolayı hastalar, semptomların giderildiğinden emin olmak için yeterli süre tedavi edilmelidir. Tedaviden sağlanan faydalar ve doz düzenli aralıklarla tekrar değerlendirilmelidir (bkz. Bölüm 5.1). Uygulama şekli:MEDOLAPRAM günde tek doz olarak, besinlerle birlikte veya öğün aralarında kullanılabilir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliğiHafif veya orta dereceli böbrek işlev bozukluğu olanlarda doz ayarlaması gerekmez. Böbrek işlevi ciddi olarak azalmış (CL CRKaraciğer yetmezliğiHafif veya orta dereceli karaciğer işlev bozukluğu olan hastalarda tedavinin ilk iki haftası için başlangıç dozu olarak 5 mg uygulanması önerilir. Bireysel hasta cevabına göre doz günde 10mg'a yükseltilebilir. Karaciğer işlevi ciddi olarak azalmış hastalarda, özellikle dikkatli doztitrasyonu önerilir (bkz. Bölüm 5.2). Pediyatrik popülasyon (18 yaş altı)MEDOLAPRAM çocuklarda ve 18 yaşın altındaki adolesanların tedavisinde kullanılmamalıdır (bkz.Bölüm 4.4). Geriyatrik popülasyon (65 yaş üstü)Başlangıç dozu günde 5 mg'dır. Bireysel hasta cevabına göre doz günde maksimum 10 mg'a yükseltilebilir (bkz. Bölüm 5.2). MEDOLAPRAM'ın yaşlı hastalarda sosyal anksiyete bozukluğundaki etkililiği
CYP2C19 yönünden zayıf metabolize edici olan hastalar:CYP2C19 yönünden zayıf metabolize edici olan hastalarda tedavinin ilk iki haftalık bölümünde başlangıç dozu olarak 5 mg kullanılması önerilir. Bireysel hasta cevabına göredoz, günde 10 mg'a yükseltilebilir (bkz. Bölüm 5.2). Tedavi sonlandırıldığında görülen kesilme belirtileriİlacın ani olarak kesilmesinden kaçınılmalıdır. Olası kesilme belirtilerini önlemek için; essitalopram tedavisine, en az bir veya iki haftalık süre içerisinde doz yavaşça azaltılarak sonverilmelidir (bkz. Bölüm 4.4 ve 4.8). Dozun azaltılmasının ve tedavinin kesilmesini takibentolere edilemeyen semptomlar oluşursa, bu durumda, daha önce reçete edilen doza yenidenbaşlanması göz önünde bulundurulmalıdır. Sonrasında doktor dozu azaltmaya kademeli,ancak daha yavaş olarak, devam edebilir. 4.3 KontrendikasyonlarEssitaloprama veya yardımcı maddelerinden herhangi birine (bkz. Bölüm 6.1) karşı aşırı duyarlılığı olanlarda kontrendikedir. Non-selektif irreversibl monoamin oksidaz inhibitörleriyle (MAO-inhibitörleri) birlikte kullanılması ajitasyon, tremor, hipertermi vb. belirtilerin görüldüğü serotonin sendromu riskinedeniyle kontrendikedir (bkz. Bölüm 4.5). Essitalopramın reversibl MAO-A inhibitörleriyle (örn. moklobemid) veya reversibl non-selektif MAO-inhibitörü linezolid ile birlikte kombine kullanılması serotonin sendromuna neden olma riski nedeniyle kontrendikedir (bkz. Bölüm 4.5). Essitalopram QT uzaması olduğu bilinen hastalarda ya da konjenital uzun QT sendromu olan hastalarda kontrendikedir. Essitalopramın QT aralığını uzattığı bilinen diğer tıbbi ürünlerle kullanımı kontrendikedir. Pimozid ile birlikte kullanımı kontrendikedir. 4/244.4 Özel kullanım uyarıları ve önlemleriAşağıdaki özel uyarı ve önlemler Selektif Serotonin Geri Alım İnhibitörleri (SSRI) terapötik sınıfındaki tüm ilaçları kapsar. Çocuklar ve 18 yaşın altındaki adolesanlarda kullanımıMEDOLAPRAM, çocuklar ve 18 yaşın altındaki adolesanların tedavisinde kullanılmamalıdır. Klinik çalışmalarda antidepresanlar ile tedavi edilen çocuklarda ve adolesanlarda, plasebo iletedavi edilenlerle karşılaştırıldığında intiharla ilişkili davranışlar (intihar girişimi ve intihardüşünceleri) ve düşmanlık (çoğunlukla saldırganlık, zıtlaşma davranışı ve sinirlilik) daha sıkgözlenmiştir. Klinik bir gereksinime dayanarak yine de tedavi etme kararı alınırsa, hastaintihar semptomlarının ortaya çıkmasına karşı dikkatle izlenmelidir. Ayrıca, çocuklar veadolesanlar için büyüme, olgunlaşma, kognitif ve davranışsal gelişim ile ilgili uzun dönemligüvenlilik verisi bulunmamaktadır. Paradoksikal anksiyetePanik bozukluğu olan bazı hastalar antidepresan tedavisinin başında, artan anksiyete semptomları sergileyebilir. Bu paradoksikal reaksiyon, tedaviye başlanmasından itibaren ilkiki hafta içinde çoğunlukla kaybolur. Olası anksiyojenik etkileri azaltmak için düşükbaşlangıç dozu önerilir (bkz. Bölüm 4.2). NöbetlerEğer hasta ilk kez nöbet geçirirse veya daha önce epilepsi tanısı olan hastalarda nöbet sıklığında artış varsa, essitalopram kesilmelidir. Stabil olmayan epilepsili hastalara SSRIverilmemelidir. Epilepsisi kontrol altında olan hastalar ise yakından izlenmelidir. ManiGeçmişinde mani/hipomani olan hastalarda SSRI'lar dikkatle kullanılmalıdır. Hasta manik faza girerse SSRI kesilmelidir. DiyabetDiyabetli hastalarda SSRI tedavisi glisemik kontrolü değiştirebilir (hipoglisemi veya hiperglisemi). İnsülin ve/veya oral hipoglisemik ilacın dozunun yeniden ayarlanmasıgerekebilir. 5/24İntihar/intihar düşüncesi veya klinik kötüleşmeAntidepresan ilaçların özellikle çocuklar ve 24 yaşına kadar olan gençlerdeki kullanımlarının intihar düşünce ya da davranışlarını arttırma olasılığı bulunmaktadır. Bu nedenle özellikletedavinin başlangıcı ve ilk aylarında, ilaç dozunun artırılma/azaltılma ya da kesilmedönemlerinde hastanın gösterebileceği huzursuzluk, aşırı hareketlilik gibi beklenmedikdavranış değişiklikleri ya da intihar olasılığı gibi nedenlerle hastanın gerek ailesi gereksetedavi edicilerce yakinen izlenmesi gereklidir. MEDOLAPRAM, 18 yaş ve üzeri hastalardamajör depresif durumlar, agorafobili veya agorafobisiz panik bozukluğu, sosyal anksiyetebozukluğu (sosyal fobi), yaygın anksiyete bozukluğu ve obsesif kompülsif bozukluk (OKB)tedavilerinde endikedir. MEDOLAPRAM çocuklarda ve 18 yaşın altındaki adolesanlarıntedavisinde kullanılmamalıdır. MEDOLAPRAM'ın yaşlı hastalarda sosyal anksiyetebozukluğundaki etkililiği araştırılmamıştır. Depresyon; intihar düşüncesi, kendine zarar verme ve intihar (intiharla ilişkili olaylar) riskinde artış ile kendini gösterir. Bu risk anlamlı bir iyileşme oluşuncaya kadar devam eder.Tedavinin ilk birkaç haftası veya daha fazla sürede bir düzelme oluşmayabileceği için hastalarbir düzelme oluşuncaya kadar yakından izlenmelidir. Genel klinik tecrübeye göre iyileşmeninerken evrelerinde intihar riski artabilir. Essitalopramın reçetelendiği diğer psikiyatrik durumlarda da intiharla ilgili olay riski artmış olabilir. Ayrıca bu durumlarla birlikte majör depresif bozukluk da bulunabilir. Bundan dolayımajör depresif bozukluğu olan hastalar tedavi edilirken uygulanan önlemlerin aynısı diğerpsikiyatrik bozukluğu olan hastalar tedavi edilirken de uygulanmalıdır. Öyküsünde intiharla ilişkili olay bulunan hastalar veya tedavinin başlangıcından önce anlamlı derecede intihar düşüncesi sergileyen kişilerde, intihar düşüncesi veya intihar girişimindebulunma riskinin daha fazla olduğu bilinmektedir ve tedavi sırasında dikkatli bir izlemyapılmalıdır.
haftası içinde oluşmaktadır. Bu semptomların geliştiği hastalarda, dozun arttırılması zararlı olabilir. HiponatremiMuhtemelen Uygunsuz Antidiüretik Hormon Salgılanmasına bağlı hiponatremi, SSRI kullanımıyla seyrek olarak bildirilmiştir. Bu durum genellikle tedavinin kesilmesinden sonrasona erer. Yaşlı hastalar, sirozu olanlar veya birlikte hiponatremi oluşturduğu bilinen ilaçlarkullanmakta olan hastalar gibi risk altında olanlarda SSRI'lar dikkatle kullanılmalıdır. KanamaSSRI'lar ile tedavi sırasında ekimoz, purpura gibi yüzeysel kanama bozuklukları rapor edilmiştir. Özellikle oral antikoagülanlar ve trombosit fonksiyonunu etkilediği bilinen bazıilaçlarla (örneğin; atipik antipsikotikler ve fenotiyazinler, trisiklik antidepresanların çoğu,asetilsalisilikasit ve non-steroid antienflamatuvar ilaçlar (NSAID), tiklopidin ve dipiridamol)birlikte SSRI kullananlarda ve kanama eğilimi olduğu bilinen hastalarda SSRI kullanımındadikkatli olunmalıdır. Elektrokonvülzif tedavi (EKT)SSRI'lar ile EKT'nin birlikte uygulanmasına ilişkin yayınlanmış klinik deney sınırlı olduğundan dikkatli olunması önerilir. Serotonin sendromuSumatriptan veya diğer triptanlar, tramadol ve triptofan gibi serotonerjik etkili ilaçlarla birlikte essitalopram kullanımında dikkatli olunmalıdır. SSRI'larla birlikte serotonerjik ilaçkullanan hastalarda serotonin sendromu seyrek olarak rapor edilmiştir. Ajitasyon, tremor,miyokloni ve hipertermi gibi semptomların birlikte oluşumu bu durumun gelişimine işaretedebilir. Böyle durumlarda, SSRI ve serotonerjik ilaç derhal kesilmeli ve semptomatik tedavibaşlatılmalıdır. St. John's Wortİçerisinde St. John's Wort (Hypericumperforatum)bulunan bitkisel preparatlar ile SSRI'ların birlikte kullanılması advers reaksiyonların oluşumunda artışa yol açabilir (bkz. Bölüm 4.5).7/24 Tedavi sonlandırıldığında görülen kesilme belirtileriTedavi kesildiğinde görülen belirtiler, özellikle tedavi aniden kesilmişse sıktır (bkz. Bölüm 4.8). Klinik çalışmalarda tedavinin kesilmesiyle görülen istenmeyen olaylar essitalopram iletedavi edilen hastaların yaklaşık %25'inde ve plasebo alan hastaların yaklaşık %15'indegörülmüştür. Kesilme belirtilerinin riski, tedavi süresi ve dozu ile doz azaltma hızını içeren birkaç faktöre bağlı olabilir. Sersemlik hali, duyusal bozukluklar (parestezi ve elektrik şok hissi dahil), uykubozuklukları (insomnia ve yoğun rüyalar dahil), ajitasyon veya anksiyete, bulantı ve/veyakusma, tremor, konfüzyon, terleme, baş ağrısı, diyare, palpitasyon, duygusal instabilite,irritabilite ve görsel bozukluklar en yaygın bildirilen reaksiyonlardır. Bu belirtiler genelliklehafif ve orta şiddettedir fakat bazı hastalarda şiddetli olabilirler. Çoğu zaman bunlar tedavinin kesilmesinden sonraki ilk birkaç gün içinde ortaya çıkarlar, fakat istemeden doz atlamış olan hastalarda bu tür semptomların görülmesine ilişkin çok azsayıda rapor bulunmaktadır. Bu belirtiler genellikle kendini kısıtlayıcı özelliktedir ve çoğu zaman iki hafta içinde çözümlenmesine rağmen bazı bireylerde bu süre uzayabilir (2-3 ay veya daha fazla). Bundandolayı, tedavi kesileceği zaman essitalopram hastanın ihtiyaçlarına göre birkaç hafta veyaaylık sürede yavaş yavaş azaltılmalıdır (bkz. Bölüm 4.2 Tedavi sonlandırıldığında görülenkesilme belirtileri). Koroner kalp hastalığıSınırlı klinik tecrübe nedeniyle, koroner kalp hastalığı olan hastalarda kullanımında dikkatli olunmalıdır (bkz. Bölüm 5.3). QT aralığı uzamasıEssitalopramın doza bağlı olarak QT aralığında uzamaya neden olduğu bulunmuştur. Pazarlama sonrası dönemde ağırlıklı olarak kadın hastalarda, hipokalemisi olanlarda ya daönceden QT uzaması veya başka kardiyak hastalıkları olanlarda, QT aralığı uzaması veTorsades de Pointes dahil olmak üzere ventriküler aritmi bildirimleri olmuştur (bkz. bölüm4.3,4.5,4.8,4.9 ve 5.1). 8/24Torsade de Pointes geliştirme riski yüksek olan hastalarda, örneğin konjestif kalp yetmezliği olanlar, yeni geçirilmiş miyokard enfarktüsü olanlar, bradiaritmileri olanlar ya da eş zamanlıhastalık veya ilaç kullanımı nedeniyle hipokalemi ya da hipomagnezemiye yatkınlığıolanlarda dikkatli olunması önerilmektedir. Belirgin bradikardisi olan hastalarda veya yakın zamanda akut miyokart enfarktüsü geçirmiş veya kompanse olmayan kalp yetmezliği olan hastalarda dikkatli olunması önerilir.Hipokalemi veya hipomagnezemi gibi elektrolit bozuklukları malign aritmi riskini arttırır.Essitalopram ile tedaviye başlamadan önce bunların düzeltilmesi gereklidir. Stabil kardiyak hastalığı olan hastalar tedavi ediliyorsa, tedaviye başlamadan önce elektrokardiyografi (EKG) ile değerlendirilmesi düşünülmelidir. Eğer essitalopram ile tedavi sırasında kardiyak aritmi oluşursa, tedavi sonlandırılmalıdır ve EKG uygulanmalıdır. Yenidoğanda inatçı pulmoner hipertansiyon riskiEpidemiyolojik veriler, hamilelikte, özellikle de hamileliğin geç dönemlerinde SSRI kullanılmasının yeni doğanda inatçı pulmoner hipertansiyon riskini artırabileceğinidüşündürmektedir (bkz.Bölüm 4.6). Dar Açılı Glokom Essitalopramın da dahil olduğu SSRI'lar göz bebeğinin boyutuna etki ederek midriyazise sebep olabilir. Bu midriyatik etki göz açısını daraltma potansiyeline sahip olup özellikleyatkınlığı olan hastalarda göz içi basıncının artmasına ve dar açılı glokoma sebep olur. Bunedenle essitalopram dar açılı glokomu olan hastalarda ya da glokom geçmişi olanlardadikkatle kullanılmalıdır. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriFarmakodinamik etkileşimleriKontrendike kombinasyonlar:Irreversibl non-selektif MAOI'lerNon-selektif irreversibl MAOI ile birlikte SSRI kullanan hastalarda ve SSRI tedavisine son a:V/www.turkıye.gpv.tr/saglık-tıtGk-ebysı wi reaksiyonlarla karşılaşıldığıa://www.tuFkiye.gpv.tr/saclik-titGk-ebvsi9/24 bildirilmiştir (bkz. Bölüm 4.3). Bazı hastalarda serotonin sendromu gelişmiştir (bkz. Bölüm 4.8). Essitalopramın non-selektif irreversibl MAOI'ler ile beraber kullanımı kontrendikedir.Essitalopram irreversibl MAOI tedavisi kesildikten 14 gün sonra kullanılmaya başlanabilir.Bir non-selektif irreversibl MAOI ile tedaviye başlanmadan en az 7 gün önce essitalopramtedavisine son verilmiş olmalıdır. Reversibl, selektif MAO-A inhibitörü (moklobemid)Serotonin sendromu riskinden ötürü, essitalopramın moklobemid gibi bir MAO-A inhibitörü ile birlikte kullanımı kontrendikedir (bkz. Bölüm 4.3). Eğer bu kombinasyon gerekli ise,tedaviye önerilen en küçük dozla başlanması ve mutlaka klinik izlem yapılması önerilir. Reversibl, non-selektif MAO inhibitörü (linezolid)Bir antibiyotik olan linezolid reversibl non-selektif MAO-inhibitörüdür ve essitalopram ile tedavi edilen hastalara verilmemelidir. Eğer bu kombinasyon gerekli ise, yakın klinik takip ileminimum dozda verilmelidir (bkz. Bölüm 4.3). Irrevesibl, selektif MAO-B inhibitörü (selejilin)Serotonin sendromu gelişmesi riskinden ötürü, selejilin (irreversibl MAO-B inhibitörü) ile birlikte kullanımında dikkatli olunmalıdır. 10 mg/gün'e kadar olan selejilin dozu ile birlikterasemik sitalopram güvenle kullanılmıştır. Essitalopramın pimozid ile birlikte kullanımı kontrendikedir. QTaralığı uzamasıEssitalopram ve QT aralığını uzatan diğer tıbbi ürünler arasında farmakokinetik ve farmakodinamik çalışmalar yapılmamıştır. Essitalopram ve bu ilaçların ilave etkileridışlanamamaktadır. Bu nedenle, essitalopramın Sınıf IA ve III antiaritmikler, antipsikotikler(ör:fentiyazin türevleri, pimozid, haloperidol), trisiklik antidepresanlar, bazı antimikrobiyalajanlar (ör: sparfloksasin, moksifloksasin, eritromisin IV, pentamidin, anti sıtma ilaçlarıözellikle halofantrin), bazı antihistaminikler (astemizol, mizolastin) gibi QT aralığını uzatantıbbi ürünler ile eş zamanlı uygulanması kontrendikedir. 10/24Kullanımı önlem gerektiren kombinasyonlar:Serotonerjik ilaçlarSerotonerjik ilaçlarla (örneğin tramadol, sumatriptan ve diğer triptanlar) birlikte kullanımı serotonin sendromuna yol açabilir. Nöbet eşiğini düşüren ilaçlarSSRI'lar nöbet eşiğini düşürebilir. Nöbet eşiğini düşürebilen diğer ilaçlarla [antidepresanlar (trisiklikler, SSRI'lar), nöroleptikler (fenotiyazinler, tiyoksantenler, butirofenonlar), meflokin,bupropiyon ve tramadol] birlikte kullanırken dikkatli olunmalıdır. Lityum, triptofanSSRI'ların lityum veya triptofan ile birlikte kullanıldığında, etkilerinin arttığı yönünde raporlar mevcuttur. Bu nedenle, SSRI'ların bu ilaçlarla birlikte kullanımında dikkatliolunmalıdır. St.John's WortSSRI'ların St. John's Wort (Hypericum perforatum)içeren bitkisel ürünlerle birlikte kullanımı advers reaksiyonların oluşumunda artışa yol açabilir (bkz. Bölüm 4.4).KanamaEssitalopram ile oral antikoagülanlar birlikte verildiğinde antikoagülan etkide değişiklik görülebilir. Oral antikoagülan tedavisi alan hastalarda essitalopram tedavisi başlandığındaveya kesildiğinde dikkatli koagülasyon izlemi yapılması gerekir (bkz. Bölüm 4.4). Non-steroidal antiinflamatuvar ilaçlarla (NSAID) birlikte kullanılması kanama eğilimini arttırabilir(bkz. Bölüm 4.4). AlkolEssitalopram ile alkol arasında farmakodinamik veya farmakokinetik etkileşme beklenmemektedir. Ancak diğer psikotropik ilaçlarla olduğu gibi, alkol ile birlikte kullanımıönerilmez. Hipokalemi/hipomagnezemiye sebep olan tıbbi ürünlerMalign aritmi riskini arttırdığından dolayı hipokalemi/hipomagnezemiye sebep olan tıbbi 11/24Farmakokinetik etkileşimleriDiğer ilaçların essitalopram farmakokinetiği üzerindeki etkisiEssitalopram metabolizması genellikle CYP2C19 aracılığı ile gerçekleşir. CYP3A4 ve CYP2D6 da bir dereceye kadar metabolizmaya katkıda bulunur. Esas metabolit olandemetillenmiş essitalopramın metabolize olmasının ise kısmen CYP2D6 tarafından katalizeedildiği düşünülmektedir. Essitalopramın 30 mg günde tek doz omeprazol ile (bir CYP2C19 inhibitörü) beraber kullanımı, essitalopramın plazma konsantrasyonlarında orta derecede (yaklaşık %50) artışaneden olmuştur.Essitalopramın 400 mg günde çift doz simetidin ile (orta derecede potent genel enzim inhibitörü) beraber kullanımı, essitalopramın plazma konsantrasyonlarında orta derecede(yaklaşık % 70) artışa neden olmuştur. Essitalopram, simetidin ile birlikte uygulandığındadikkatli olunması tavsiye edilir. Doz ayarlaması gerekebilir. Bu sebeple, CYP2C19 inhibitörleriyle (omeprazol, esomeprazol, fluvoksamin, lansoprazol, tiklopidin) veya simetidin ile beraber kullanıldığında dikkatli olunmalıdır. Beraber kullanımsırasında istenmeyen etkilerin izlenmesine bağlı olarak essitalopram dozunda azaltma yapmakgerekebilir. Essitalopramın diğer ilaçların farmakokinetiği üzerine etkisiEssitalopram CYP2D6 enziminin bir inhibitörüdür. Başlıca bu enzim tarafından metabolize edilen ve dar terapötik indekse sahip diğer ilaçlarla (flekainid, propafenon ve kardiyakyetmezlikte kullanıldığında metoprolol) veya başlıca CYP2D6 tarafından metabolize edilenmerkezi sinir sistemine etkin ilaçlarla (desipramin, klomipramin ve nortriptilin gibiantidepresanlar veya risperidon, tiyoridazin ve haloperidol gibi antipsikotikler) birliktekullanılırken dikkatli olunmalıdır. Doz ayarlaması gerekebilir. Desipramin veya metoprolol ile birlikte kullanımı, bu iki CYP2D6 sübstratının plazma düzeyini iki katına çıkarmıştır. 12/24Yapılan in vitroÖzel popülasyona ilişkin ek bilgiler:Herhangi bir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:MEDOLAPRAM'ın çocuklarda ve 18 yaşın altındaki adolesanların tedavisinde kullanılmaması gerektiğinden, herhangi bir etkileşim çalışması yapılmamıştır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi 'C'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Essitalopramın gebelik dönemindeki kullanımına ilişkin sınırlı klinik veri mevcuttur. Gebelik dönemiMEDOLAPRAM kesinlikle gerekli değilse ve risk/yarar oranı dikkatle değerlendirilmeden hamilelerde kullanılmamalıdır. Gebeliğin ileri evrelerine kadar (özellikle son trimester içinde) MEDOLAPRAM kullanımı devam ederse, yeni doğan gözlemlenmelidir. Gebelik süresince ilacın aniden kesilmesiönlenmelidir. Gebeliğin ileri evrelerinde SSRI/SNRI kullanımı sonrası yeni doğanlarda şu belirtiler görülebilir: Solunum güçlüğü, siyanoz, apne, nöbet, vücut sıcaklığında dengesizlik, beslenmegüçlüğü, kusma, hipoglisemi, hipertoni, hipotoni, hiperrefleksi, tremor, huzursuzluk,irritabilite, letarji, sürekli ağlama, uyuklama hali ve uyuma zorluğu. Bu belirtiler, serotonerjiketkilerden veya kesilme durumlarından kaynaklanıyor olabilir. Örneklerin çoğundakomplikasyonlar doğumdan hemen sonra veya kısa bir süre içinde (<24 saat) başlamaktadır. Epidemiyolojik veriler, hamilelikte, özellikle de hamileliğin geç dönemlerinde SSRI '070 sayılı Elektronik İmza Kanunu uyarınca elektronik olarak imzalanmıştır. ıDoküman https://www.turklanılmasının yeni doğanda inatçı pulmoner hipe'.tr/saglik-tit<qk-ebys, artırabileceğiniBu be; adresi]13/24düşündürmektedir. Gözlenen risk yaklaşık olarak 1000 hamilelikte 5 vaka şeklinde bulunmuştur. Genel popülasyonda bu değer, her 1000 hamilelik başına 1-2 vakadır. Laktasyon dönemiEssitalopramın anne sütüne geçmesi beklenir. Tedavi sırasında emzirme önerilmez. Üreme yeteneği/FertiliteYapılan hayvan çalışmaları üreme toksisitesi göstermiştir (bkz. Bölüm 5.3). Hayvan verileri sitalopramın sperm kalitesini etkilediğini göstermiştir (bkz. Bölüm 5.3). SSRI'lar ile olan insan vaka raporları sperm kalitesindeki etkilerin geri dönüşümlü olduğunugöstermiştir. İnsan fertilitesi üzerindeki etkisine ait veri yoktur. 4.7. Araba ve makina kullanımı üzerindeki etkilerEssitalopram entelektüel işlev ve psikomotor performansı etkilemez. Ancak, psikoaktif ilaç kullanan hastaların muhakeme yeteneklerinde veya becerilerinde bozulma beklenebilir. Busebeple, hastalar bu ilacın araba ve makine kullanma yeteneklerine olası etkileri konusundauyarılmalıdır. 4.8. İstenmeyen etkilerAdvers etkiler en sık tedavinin ilk veya ikinci haftası süresince ortaya çıkar ve genellikle tedavinin devam eden dönemlerinde şiddet ve sıklık açısından azalma gösterir. SSRI'ların bilinen istenmeyen yan etkileri ve ayrıca plasebo kontrollü klinik çalışmalarda essitalopram için bildirilen veya spontan olarak bildirilen pazarlama sonrası olaylar aşağıdasistem-organ sınıfı ve sıklığına göre listelenmiştir: Sıklıklar klinik çalışmalardan alınmaktadır; plaseboya göre düzeltilmemiştir. Sıklıklar şu şekilde tanımlanmaktadır; çok yaygın (>1/10); yaygın (>1/100, <1/10); yaygın olmayan(>1/1000, <1/100); seyrek (>1/10000, <1/1000); çok seyrek <1/10000) veya bilinmiyor(eldeki verilerden hareketle tahmin edilemiyor). 14/24Kan ve lenf sistemi hastalıklarıBilinmiyor: Trombositopeni Bağışıklık sistemi hastalıklarıSeyrek: Anafilaktik reaksiyon Endokrin hastalıklarıBilinmiyor: Uygunsuz ADH (antidiüretik hormon) salgısı Metabolizma ve beslenme hastalıklarıYaygın: İştah azalması, iştah artışı, kilo alma Yaygın olmayan: Kilo azalmasıBilinmiyor: Hiponatremi, anoreksi1 Psikiyatrik hastalıklarıYaygın: Anksiyete, huzursuzluk, anormal rüyalar;, libidoda azalma; Kadınlarda: anorgazmi Yaygın olmayan: Bruksizm, ajitasyon, sinirlilik, panik atak, konfüzyonel durumSeyrek: Agresyon, depersonalizasyon, halüsinasyonBilinmiyor: Mani, intihar düşüncesi, intihar davranışı Sinir sistemi hastalıklarıÇok yaygın: Baş ağrısı Yaygın: Uykusuzluk, uykululuk hali, sersemlik hali, parestezi, tremor Yaygın olmayan: Tat alma bozukları, uyku bozukluğu, senkopSeyrek: Serotonin sendromu Bilinmiyor: Diskinezi, hareket bozuklukları, konvülsiyon, psikomotor huzursuzluk/akatizi1Göz hastalıkları Yaygın olmayan: Midriyazis, görme bozukluğu Kulak ve iç kulak hastalıklarıYaygın olmayan: Çınlama 15/24Kardiyak hastalıklarıYaygın olmayan: Taşikardi Seyrek: Bradikardi Bilinmiyor: Elektrokardiyogramda QT uzaması, Torsades de Pointes dahil ventriküler aritmi Vasküler hastalıklarıBilinmiyor: Ortostatik hipotansiyon Solunum göğüs bozuklukları ve mediastinal hastalıklarıYaygın: Sinüzit, esneme Yaygın olmayan: Burun kanaması Gastrointestinal hastalıklarıÇok yaygın: Bulantı Yaygın: Diyare, konstipasyon, kusma, ağız kuruluğu Yaygın olmayan: Gastrointestinal kanamalar (rektal kanama dahil) Hepato-bilier hastalıklarıBilinmiyor: Hepatit, karaciğer fonksiyon testlerinde anormallikler Deri ve deri altı doku hastalıklarıYaygın: Terleme artışı Yaygın olmayan: Ürtiker, alopesi, döküntü, kaşıntı Bilinmiyor: Ekimoz, anjiyoödem Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Artralji, miyalji Böbrek ve idrar yolu hastalıklarıBilinmiyor: İdrar retansiyonu Üreme sistemi ve meme hastalıklarıYaygın: Erkekte: ejakülasyon bozukluğu, impotans B,u beiYapnfflaya#.. perofa^meMii alam7-ır- ,DokTTadresmdeıZlrentroredıreDmr. CıuvenTı elektronik imza aslı tfe'aymaır. TToHumamn doğrulama kodu : lS3k0ZW56ZlAxM0ryYnUyaklU YnUy16/24Bilinmiyor: Galaktore, Erkekte: priapizm Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıYaygın: Halsizlik, ateş Yaygın olmayan: Ödem 1 Bu istenmeyen etkiler SSRI'lar için bildirilmiştir. Essitalopram ile tedavi sırasında veya tedavinin kesilmesinden hemen sonra, intihar düşüncesi ve intihar davranışı sergileyen vakalar bildirilmiştir (bkz. Bölüm 4.4). QT aralığı uzamasıPazarlama sonrası dönemde, ağırlıklı olarak kadın hastalarda, hipokalemisi olanlarda ya da önceden QT uzaması veya başka kardiyak hastalıkları olanlarda, QT aralığı uzaması veTorsades de Pointes dahil olmak üzere ventriküler aritmi bildirimleri olmuştur (bkz. bölüm4.3, 4.4, 4.5, 4.9 ve 5.1). Yaşa bağlı yan etkilerDaha çok 50 yaş ve üstü hastalarda yürütülen epidemiyolojik çalışmalar, SSRI ve TCA ilaçları kullanan hastalarda kemik kırıkları açısından artmış risk göstermektedir. Bu riske yolaçan mekanizma bilinmemektedir. Tedavi kesildiğinde görülen kesilme belirtileriSSRI/SNRI'ların özellikle aniden kesilmesi genellikle kesilme belirtilerine neden olur. Sersemlik hali, duyusal bozukluklar (parestezi ve elektrik şok hissi dahil), uyku bozuklukları(insomnia ve yoğun rüyalar dahil), ajitasyon veya anksiyete, bulantı ve/veya kusma, tremor,konfüzyon, terleme, baş ağrısı, diyare, palpitasyon, duygusal dengesizlik, irritabilite ve görmebozuklukları en yaygın bildirilen reaksiyonlardır. Bu olaylar genellikle hafif ve orta şiddetteve kendini kısıtlayıcı özelliktedir ancak bazı hastalarda şiddetli olabilir ve/veya daha uzunsürebilirler. Bundan dolayı essitalopram tedavisi daha fazla gerekli görülmediğinde tedavininkesilmesi doz azaltılarak yavaş yavaş yapılmalıdır (bkz. Bölüm 4.2 ve Bölüm 4.4). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem ikjülarak imzalaıjmıştif. Doküman httgş k7ww.w.tus :lge MJ'/U sayılı Elektmnik İmza Kanunu uyarınca elektronik olarak imzalanmıştır. Doküman htitaşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesikiye.gpv.tr/sa2likntitck-ebys olarak izlenmesine 17/24olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9 Doz aşımı ve tedavisiToksisiteEssitalopram doz aşımı konusunda klinik veri sınırlıdır ve birçok vaka birlikte kullanılan diğer ilaçların doz aşımlarını içermektedir. Vakaların çoğunluğunda hafif semptomlarbildirilmiştir veya hiç semptom bildirilmemiştir. Tek başına essitalopramla doz aşımındanadiren ölüm vakaları rapor edilmiştir. Ölüm vakalarının çoğunluğu beraber kullanıldığıilaçlar ile doz aşımını içermektedir. Tek başına 400 ve 800 mg arasındaki essitalopram dozlarışiddetli herhangi bir semptom olmadan alınmıştır. SemptomlarBildirilen essitalopram doz aşımında görülen semptomlar çoğunlukla merkezi sinir sistemi (sersemlik hali, tremor ve ajitasyondan nadiren görülen serotonin sendromu vakaları,konvülsiyon ve komaya kadar gidebilen), gastrointestinal sistem (bulantı/kusma),kardiyovasküler sistem (hipotansiyon, taşikardi, QT aralığı uzaması ve aritmi) veelektrolit/sıvı dengesi (hipokalemi, hiponatremi) ile ilişkilidir. TedaviSpesifik bir antidotu mevcut değildir. Havayolu açık tutulmalı ve hastanın uygun düzeyde oksijen alarak solunum işlevlerini yerine getirmesi sağlanmalıdır. Gastrik lavaj ve aktif kömüruygulaması düşünülmelidir. Oral alımından sonra olası en kısa zaman içerisinde gastrik lavajuygulanmalıdır. Genel semptomatik destek tedavisinin uygulandığı süre boyunca kardiyak veyaşamsal belirtiler izlenmelidir. Konjestif kalp yetmezliği/bradiaritmileri olan hastalarda, QT aralığını uzatan ilaçları eş zamanlı kullanan veya metabolizması etkilenmiş (ör: karaciğer bozukluğu olan) hastalardaaşırı doz durumunda EKG izlenmesi tavsiye edilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: antidepresanlar, selektif serotonin geri alım inhibitörleri. Bu belger^Û70ısayılı Elâktpomk İmzaJCanunu uyarınca elektronik olarak imzalanmıştır. Doküman https://www.turkiye.gov.tr/saglik-titck-ebys adresiATCıkoduleNl0.6ABmi0 lektronik imza aslı ile aynıdır. Dokümanın doğrulama kodu : !S3k0ZW56ZlAxM0FyYnUyaklUYnUy 18/24Etki mekanizmasıEssitalopram, primer bağlanma yerine yüksek afinitesi olan, serotonin (5-HT) geri alımının selektif bir inhibitörüdür. Ayrıca, 1000 kat daha az afinite ile serotonin taşıyıcısı üzerindekiallosterik bölgeye de bağlanır. Essitalopramın; aralarında 5-HTıA, 5-HT2, dopamin (DA) Dı ve D2 reseptörleri ile aı, a2-, P adrenoseptörlerin, histamin H1, muskarinik (kolinerjik), benzodiazepin ve opioid reseptörlerinde bulunduğu bir grup reseptöre afinitesi azdır veya hiç yoktur. Farmakodinamik etkiler: Sağlıklı gönüllülerde yürütülen bir çift-kör, plasebo kontrollü EKG çalışmasında QTc'de (Fridericia-correction)'de başlangıç değerine göre oluşan değişiklik, 10 mg/gün dozda 4,3 ms(%90 Cl:2,2, 6,4) ve 30 mg/gün supraterapötik dozda 10,7 ms (%90 Cl: 8,6, 12,8) şeklindedir(bkz. Bölüm 4.3, 4.4, 4.5, 4.8 ve 4.9). Klinik etkililikMajör Depresif EpizodEssitalopram, dört çift kör plasebo kontrollü kısa dönem (8 hafta) çalışmanın üçünde majör depresif durumların akut tedavisinde etkili bulunmuştur. Uzun dönem relaps önleme çalışmasında günde 10 mg veya 20 mg essitalopram ile başlangıç 8 haftalık açık etiketli tedavi fazında olan 274 hasta, 36 haftaya kadar aynı dozda essitalopramveya plasebo ile devam etmek üzere randomize edilmiştir. Bu çalışmada essitalopram alanhastalar sonraki 36 haftada plasebo alanlarla karşılaştırıldığında relapsa kadar belirgin olarakdaha uzun zaman geçirdikleri görülmüştür. Sosyal Anksiyete BozukluğuEssitalopram, sosyal anksiyete bozukluğundaki hem üç kısa dönemli (12 hafta) çalışmada, hem de tedaviye cevap verenlerde yapılan 6 aylık relaps önleme çalışmasında etkilibulunmuştur. 24 haftalık doz ayarlama çalışmasında, 5, 10 ve 20 mg essitalopramın etkililiği gösterilmiştir. Yaygın Anksiyete BozukluğuGünde 10 mg ve 20 mg essitalopram dozları dört plasebo kontrollü çalışmanın dördünde de Bu belsgı 5û70ısayılı Elektronik İmza Kanunu uyarınca elektronik olarak imzalanmıştır. Doküman https://www.turkiye.gov.tr/saglik-titck-ebysetkili bulunmuştur. 19/24Benzer dizaynda yapılmış üç çalışmadan elde edilen veri havuzunda; essitalopram verilen 421 hasta ve plasebo verilen 419 hastada tedaviye cevap verenlerin oranı sırasıyla, %47,5 ve%28,9 ve remisyona girenlerin oranı %37,1 ve %20,8'dir. Essitalopramla sürekli etki 1.haftadan itibaren görülmüştür. Günde 20 mg essitalopramın etkililiğinin devamı, 24-76 haftalık, randomize, idame-etkililik çalışmasında, ilk 12 haftalık açık etiket tedaviye cevap veren 373 hastada gösterilmiştir. Obsesif Kompülsif BozuklukRandomize, çift kör bir klinik çalışmada 20 mg/gün essitalopram 12 hafta sonunda Yale Brown Obsesif- Kompülsif Bozukluk Ölçeği (Y-BOCS) toplam skoru ile plasebodanayrılmıştır. 24 hafta sonunda, 10 ve 20mg/gün essitalopram plasebo ile karşılaştırıldığındadaha üstündür. 16 haftalık açık-etiketli bir çalışmada essitaloprama yanıt veren ve 24 haftalık randomize, çift-kör, plasebo kontrollü bir çalışmaya dahil edilen hastalarda, 10 ve 20 mg/gün essitalopramla relapsın önlendiği görülmüştür. 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:Emilim tama yakın olup, besin alımından bağımsızdır. Çoklu doz sonrası maksimum plazma konsantrasyonuna ulaşma süresi ortalama (ortalama Tmaks) 4 saattir. Rasemik sitalopramda olduğu gibi essitalopramın da mutlak biyoyararlanımı yaklaşık % 80'dir. Dağılım:Oral alım sonrası sanal dağılım hacmi (Vd,p/F) yaklaşık 12-26 L/kg'dir. Essitalopramın ve ana metabolitlerinin proteine bağlanma oranı % 80'in altındadır. Biyotransformasyon:Essitalopram karaciğerde, demetillenmiş ve didemetillenmiş metabolitlerine metabolize olur. Her iki metabolit de farmakolojik olarak aktiftir. Alternatif olarak, azot oksitlenerek N-oksit
oz
MjMiftı itöksMii AnaiTa&vfiiımeJab°i^ie£h£kışmeflaSİukuroı^at!8iax4i(#t^fcr^y;aiTa&vfiiımeJab°i^ie£h£kışmeflaSİukuroı^at!8iax4i(#t^fcr^y;20/24sonrası, demetil ve didemetil metabolitlerin ortalama konsantrasyonları essitalopram konsantrasyonunun sırasıyla %28-31 ve < % 5'idir. Essitalopramın demetillenmiş metabolitebiyotransformasyonu öncelikle CYP2C19 tarafından yapılır. CYP3A4 ve CYP2D6enzimlerinin de bir miktar katkısı mümkündür.Eliminasyon:Çoklu doz sonrası eliminasyon yarılanma ömrü (t1/2p) yaklaşık 30 saattir ve oral plazma klerensi (Cloral) yaklaşık 0,6 L/dakikadır. Majör metabolitler belirgin olarak daha uzunyarılanma ömrüne sahiptir. Essitalopram ve majör metabolitlerin karaciğer (metabolik) veböbrek yollarıyla elimine edildiği düşünülür, dozun büyük kısmı idrarda metabolitler şeklindeatılır. Doğrusallık:Doğrusal farmakokinetik gösterir. Kararlı durum plazma seviyelerine yaklaşık 1 haftada erişilir. 50 nmol/litrelik ortalama kararlı durum konsantrasyonlarına (20-125 nmol/L) 10mg'lik günlük dozla ulaşılır. Hastalardaki karakteristik özelliklerYaşlı hastalar (65 yaş üstü):Essitalopram yaşlı hastalarda genç hastalara göre daha yavaş elimine edilir. Sistemik maruz kalma oranı (EAA), genç sağlıklı gönüllülere göre yaşlılarda yaklaşık % 50 daha yüksektir(bkz. Bölüm 4.2). Azalmış karaciğer işlevi:Hafif ve orta derecede karaciğer bozukluğu olan hastalarda (Child-Pugh kriterleri A ve B), essitalopram yarılanma ömrü yaklaşık iki kat daha uzundur ve normal karaciğer işlevi olanhastalara göre maruz kalma oranı yaklaşık % 60 daha yüksektir (bkz. Bölüm 4.2). Azalmış böbrek işlevi:Rasemik sitalopramla, böbrek yetmezliği olan hastalarda (CLcr 10-53 ml/dakika) daha uzun yarılanma ömrü ve maruz kalma oranında hafif artış gözlenmiştir. Metabolitlerin plazmakonsantrasyonları incelenmemiştir ancak artış gösterebilir (bkz. Bölüm 4.2). 21/24Polimorfizm:CYP2C19 yönünden zayıf metabolize edici kişilerin, hızlı metabolize edicileriyle karşılaştırıldığında, iki kat daha yüksek essitalopram plazma konsantrasyonuna sahip olduğugözlenmiştir. CYP2D6'nın zayıf metabolize edicilerinin, essitalopram maruziyetinde belirginbir değişikliğe neden olduğu görülmemiştir (bkz. Bölüm 4.2). 5.3. Klinik öncesi güvenlilik verileriEssitalopram ve sitalopram ile sıçanlarda yürütülen birbirine bağlı toksikokinetik ve toksikolojik çalışmalar benzer bir profil gösterdiğinden, essitalopram ile konvansiyonel tambir dizi preklinik çalışma yapılmamıştır. Bu nedenle, tüm sitalopram bilgileri essitalopramayansıtılabilir. Sıçanlardaki karşılaştırmalı toksikolojik çalışmalarda, genel toksisiteye yol açan dozlar kullanılırken, tedaviden birkaç hafta sonra, essitalopram ve sitalopram konjestif kalpyetmezliğinin de dahil olduğu kardiyak toksisiteye neden olmuştur. Kardiyotoksisiteninsistemik maruziyetten (EAA) çok, plazma doruk konsantrasyonları ile ilişkili olduğugörülmüştür. Essitalopram için EAA değeri terapötik dozlarından sadece 3-4 kat fazla iken,etkinin gözlenmediği seviyedeki pik plazma konsantrasyonları, terapötik dozlarından (8 kat)daha fazladır. S-enantiyomeri için sitalopram EAA değerleri, terapötik dozlarından 6-7 katdaha fazladır. Bu bulgular muhtemelen biyolojik aminler üzerindeki arttırılmış etki ileilişkilidir. Yani birincil farmakolojik etkilere ikincil olarak, hemodinamik etkiler (koronerakımında azalma) ve iskemiye sebep olmaktadır. Ancak, sıçanlardaki kardiyotoksikmekanizma iyi bilinmemektedir. Sitalopramdan elde edilen klinik deneyim ve essitalopram ileilgili klinik araştırma deneyimi ile bu bulguların klinik karşılığı bulunmamaktadır. Essitalopram ve sitalopram ile sıçanlarda uzun dönem tedaviden sonra artan fosfolipit içeriği akciğer, epididimis ve karaciğer gibi bazı dokularda gözlenmiştir. Epididimis ve karaciğerdebulunanlar insandakine benzer görülmüştür. Tedavinin kesilmesinden sonra etki geridönüşlüdür. Hayvanlarda fosfolipit birikmesinin (fosfolipidozis), birçok katyonik amfifilikilaç ile ilgili olduğu gözlenmiştir. Bu olayın insanlar açısından taşıdığı önem bilinmemektedir. Sıçanlar üzerinde yapılan gelişimsel toksisite çalışmaları sırasında terapötik dozların üzerine çıkıldığında (EAA dikkate alındığında) embriyotoksik etkiler (düşük fetüs ağırlığı ve geriye dektronikvOİarak imzalanmıştır, «Doküı_gözlenmiştir. lige. 50.70 sayık*Elektronik«İmza Kanunu uyaridönüşebilir ossifikasyontttns://www.turk1ye.20v.tr/sa2l1k-t1tck-ebys , ,lformasyon sıklığında artışadresi!22/24kaydedilmemiştir. Bir pre- ve postnatal çalışma, laktasyon döneminde klinik kullanıma mahsus dozların üzerine çıkıldığında (EAA dikkate alındığında) yaşam süresinde azalmagöstermiştir. Hayvan verileri sitalopramın fertilite indeksinde ve gebelik indeksinde düşüşe, insanın maruz kaldığı dozların üzerindeki dozlarda anormal sperm ve implantasyon sayısında azalmayaneden olduğunu göstermiştir. Essitalopram için bu durumla ilgili hayvan verisi mevcutdeğildir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiMikrokristalin selüloz Kolloidal susuz silikaKroskarmelloz sodyumTalk Magnezyum stearat Saf su Opadry® Beyaz YS-1-7003 - Hipromelloz - Titanyum dioksit - Polietilen glikol / Makrogol - Polisorbat 80 6.2 GeçimsizliklerGeçerli değildir. 6.3 Raf ömrü24 ay 6.4 Saklamaya yönelik özel uyarılar25°C'nin altındaki oda sıcaklığında saklanmalıdır. 6.5 Ambalajın niteliği ve içeriği. . jayılı ElektrıKarton kutuda BUwte_5a7o.!,l,ü..J5,,itto,^ı;C/PE^VDCIAİümÇoyumBtisteKİ|mS9jB'23/24 6.6 Beşeri tıbbi ürünlerden arta kalan maddelerin imhası ve dier özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİWorld Medicine İlaç San. ve Tic. A.Ş. Bağcılar / İstanbul 8. RUHSAT NUMARASI2019/216 9 İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 17.04.2019 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ24/24 |
İlaç BilgileriMedolapram 20 Mg Film Kaplı TabletEtken Maddesi: Essitalopram Kullanma talimatı ve kısa ürün bilgileri |
|||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.