Evoltu 20 Mg/20 Ml İnfüzyonluk Çözelti Hazırlamak İçin Konsantre Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİBu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERİ TIBBİ ÜRÜNÜNADIEVOLTU 20 mg/20 ml İnfüzyonluk Çözelti Hazırlamak İçin KonsantreSteril, sitotoksik 2. KALİTATİF VE KANTİTATİF BİLEŞİMHer bir flakon (20 mL); Etkin madde:Klofarabin 20.0 mg Yardımcı madde(ler):Sodyum klorür 180.0 mg Sodyum hidroksit ym Yardımcı maddeler için bölüm 6.1.'e bakınız. 3. FARMASÖTİK FORMİnfüzyon için konsantre çözelti içeren flakon. Flakon içerisinde, görülebilen partikül içermeyen, renksiz ve berrak infüzyon çözeltisi. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarEVOLTU, en az iki farklı kemoterapi rejimine dirençli veya bu rejimler sonrası nüks eden ve kalıcı yanıt sağlayabilecek başka bir tedavi seçeneği olmayan çocukluk çağı (< 21 yaş) akutlenfoblastik lösemi (ALL) tedavisinde kullanılır. İlacın güvenliliği ve etkililiği ilk tanıaldığında 21 yaş ve altında olan hastalarda değerlendirilmiştir. 4.2. Pozoloji ve uygulama şekliPozoloji/ uygulama sıklığı ve süresi:Tedavi, akut lösemili hastaların tedavisinde uzmanlaşmış bir hekim tarafından başlatılmalı ve kontrol edilmelidir. Yetişkinler (yaşlılar dahil);Uygulama şekli:Uygulamadan önce ilacın seyreltilmesi ile ilgili yönergeler aşağıda açıklanmıştır. Tavsiye edilen doz intravenöz infüzyon yoluyla uygulanmalıdır, aynı zamanda devam eden klinik 1çalışmalarda santral venöz katater aracılığıyla da uygulanmıştır. Klofarabin başka ilaçlarlakarıştırılmamalı veya aynı intravenöz yoldan uygulanmamalıdır. EVOLTU 20 mg/20 mL uygulamadan önce mutlaka seyreltilmelidir. 0.2 mikrometre steril şırınga filtresinden süzülmeli ve sonra 9 mg/mL (%0.9) intravenöz sodyum klorür infüzyonuile aşağıdaki örnekleri yer alan toplam hacim elde edilecek şekilde seyreltilir. Bununla birlikteson seyreltme hacmi hastanın klinik durumuna ve hekimin kararına göre değişiklikgösterebilir. (0.2 mikrometre şırınga filtresinin kullanımı mümkün değilse, konsantrat 5mikrometrelik bir filtreyle ön-filtrelemeye tabi tutulmalı, seyreltilmeli ve sonra 0.22mikrometrelik infüzyon filtresi ile uygulanmalıdır.)
Seyreltilen konsantrat berrak, renksiz bir çözelti olmalıdır. Uygulama öncesi partikül ve renklenme açısından gözle incelenmelidir. EVOLTU tek kullanımlıktır. Kullanılmamış olan ürünler atılmalıdır. Antineoplastik ajanlar için geçerli/uygun olan hazırlama prosedürleri izlenmelidir. Sitotoksik tıbbi ürünler dikkatle ele alınmalıdır. EVOLTU'nun hazırlanması sırasında tek kullanımlık eldivenlerin ve koruyucu kıyafetlerin kullanılması önerilir. Eğer ürün göz, cilt veya muköz membranla temas ederse, ilgili bölge bolmiktarda suyla yıkanmalıdır. EVOLTU hamile personel tarafından hazırlanmamalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Kreatinin klerensi azalmış hastalarda klofarabinin birikebileceğim gösteren sınırlı bir veri mevcuttur. Klofarabin şiddetli böbrek yetmezliği olan hastalarda kontrendikedir ve hafif veyaorta dereceli böbrek yetmezliği olanlarda dikkatle kullanılmalıdır. Orta dereceli böbrek yetmezliği olan (kreatinin klirensi 30 - < 60 mL/dk) hastalarda %50'lik bir doz azaltımı gerekir. Karaciğer yetmezliği:Karaciğer yetmezliği olan (serum bilirubin >1.5 x ULN artı AST ve ALT > 5 x ULN) hastalarla ilgili herhangi bir deneyim yoktur ve karaciğer toksisite açısından potansiyel olarakhedef bir organdır. Bu yüzden klofarabin şiddetli karaciğer yetmezliği olan hastalardakontrendikedir ve hafif karaciğer yetmezliği olan hastalarda dikkatli kullanılmalıdır. Pediyatrik popülasyon:Tavsiye edilen doz 52 mg/m2 vücut yüzey alanına göre hesaplanıp 5 ardışık gün boyunca 2 saatlik intravenöz infüzyonla uygulanır. Vücut yüzey alanı hastanın her kür öncesinde tespitedilen mevcut boyu ve ağırlığı kullanılarak hesaplanır. Tedavi kürleri normal hematopoezsağlandıktan (örn. MNS (mutlak nötrofil sayısı) > 0.75 x 109/L) ve organ işlevi temeldüzeyine döndükten sonra her 2 ila 6 haftada bir tekrarlanır (önceki kürün başlangıç günündenitibaren). Belirgin toksisitelerin görüldüğü hastalarda %25'lik bir doz azaltımı yapılmalıdır. 3tedavi küründen daha uzun süre klofarabin kullanan hastalardaki deneyimler henüz sınırlıdır.Tedaviye yanıt oluşan hastaların büyük bir çoğunluğunda yanıt bir veya iki tedavi kürü sonunda elde edilir. Bu nedenle 2 tedavi kürü sonunda hematolojik ve/veya klinik gelişimgöstermeyen hastalarda tedavinin devamıyla ilişkili potansiyel yarar ve zararlar tedaviyiuygulayan hekim tarafından değerlendirilmelidir. 20 kg altındaki çocuklar:Anksiyete ve iritabilite semptomlarını azaltmak ve aşırı yüksek klofarabin konsantrasyonlarının oluşmasını engellemek için 2 saatin üstünde bir infüzyonsüresi düşünülmelidir.1 yaşın altındaki çocuklar:Geriyatrik popülasyon:Geriyatrik hastalarda klofarabinin etkililiği ve güvenliliğini belirlemek için yeterli veri yoktur. Hematolojik toksisite gözlenen hastalarda doz azaltımı:Bir tedavi kürü başladıktan 6 hafta sonra MNS'de düzelme olmuyorsa, refrakter hastalık ihtimalinin saptanması için kemik iliği aspirasyonu/biyopsisi yapılmalıdır. Eğer inatçı lösemikesin değilse gelecek kür için dozun MNS > 0.75 x 109/L'ye düzeldikten sonra uygulanmasıve bir önceki küre göre % 25 azaltılması önerilir. Hastalarda son kürün başlangıcı sonrasında4 haftadan daha uzun süre MNS < 0.5 x 109/L olursa, gelecek kürde dozun yaklaşık %25düşürülmesi tavsiye edilir. Hematolojik olmayan toksisite gözlenen hastalarda doz azaltımı:Enfeksiyöz olaylar:Hastada klinik olarak belirgin bir enfeksiyon gelişirse, klofarabin tedavisi enfeksiyon klinik olarak kontrol altına alınana kadar kesilmelidir. Bundan sonra tedaviye tamdozla tekrar başlatılabilir. İkinci bir klinik olarak belirgin enfeksiyon durumunda klofarabintedavisi enfeksiyon klinik olarak kontrol altına alınana kadar kesilmelidir ve tekrarbaşlatılması gerektiğinde doz %25 azaltılabilir.Enfeksiyon dışı olaylar:Hastada bir veya daha fazla şiddetli toksisite gelişirse (bulantı ve kusma dışındaki ABD Ulusal Kanser Enstitüsü [NCI] Genel Toksisite Kriteri [CTC] Evre 3toksisiteler), tedavi toksisitelerde başlangıç parametreleri düzeyine kadar bir gerilemegerçekleşene veya şiddetli olmadığı düzeye ininceye kadar ve klofarabin tedavisinin devamıile elde edilecek yarar bu tip risklerden daha fazla ise ertelenmelidir. Sonrasında klofarabindozunda bir % 25'lik azaltım önerilmektedir.Hastada ikinci bir sefer aynı şiddette toksisite gelişirse, tedavi toksisitelerde başlangıç parametreleri düzeyine kadar bir gerileme gerçekleşene veya şiddetli olmadığı düzeyeininceye kadar ve klofarabin tedavisinin devamı ile elde edilecek yarar bu tip risklerden daha 3 / 19fazla ise ertelenmelidir. Sonrasında klofarabin dozunda %25'lik ek bir azaltım daha önerilmektedir. Üçüncü bir sefer ciddi toksisite gelişen, 14 gün içinde düzelmeyen (harici durumlar yukarıdadır) veya hayatı-tehdit edici toksisite ya da sınırlayıcı toksisite gelişen (ABD NCICTC Evre 4 toksisite) herhangi bir hastada klofarabin tedavisi kesilmelidir. 4.3. KontrendikasyonlarEVOLTU'nun aşağıdaki hastalarda kullanımı kontrendikedir: - Klofarabin ve içerdiğindeki herhangi bir maddeye karşı aşırı duyarlılığı olanlar. - Ciddi renal yetmezliği veya ciddi hepatik bozukluğu olanlar. Klofarabin tedavisi öncesinde, tedavi devam ederken veya tedavi sonrasında emzirme yapılmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleriEVOLTU hematolojik ve hematolojik olmayan toksisite potansiyeli taşıyan, güçlü bir antineoplastik ajandır. Klofarabin tedavisi uygulanacak hastalarda aşağıdaki parametreler yakından izlenmelidir: - Tam kan ve platelet sayısı, sitopeni gelişen hastalarda daha sıklıkla olmak üzere,düzenli aralıklarla kontrol edilmelidir. - Aktif tedavi öncesinde, sırasında ve sonrasında renal ve hepatik işlevler. Kreatininveya bilirubin düzeylerinde ani yükselmeler oluşursa klofarabin derhal kesilmelidir. - Solunum durumu, kan basıncı, sıvı dengesi ve ağırlık ardışık 5 günlük klofarabintedavisi boyunca ve sonrasında kontrol edilmelidir. Kemik iliği supresyonu beklenmelidir. Bu genellikle geri dönüşlüdür ve doza bağlı olduğu görülür. Klofarabin ile tedavi edilen hastalarda nötropeni, anemi ve trombositopeni dahil ciddikemik iliği supresyonu gözlenmiştir. Hemoraji, serebral, gastrointestinal ve pulmonerhemoraji olarak bildirilmiştir ve fatal olabilir. Durumların çoğu, trombositopeni ile ilişkilidir(bkz. Bölüm 4.8). Bununla birlikte klinik çalışmalardaki çoğu hastada tedavinin başlangıcında lösemi gibi hematolojik bozukluklar mevcuttur. Bu hastalarda daha önce var olan immün yetmezlikdurumu ve klofarabin nedenli uzamış nötropeni sebebiyle hastalar fatal sonuç potansiyeli olanşiddetli sepsis dahil şiddetli fırsatçı reaksiyonlar açısından artmış risk altındadır. Hastalarbelirtiler ve semptomlar açısından izlenmeli ve derhal tedavi edilmelidir. Klofarabin tedavisi süresince hastalarda, nötropenik kolit ve C. Difficilekolit dahil enterokolit oluşumu raporlanmıştır. Bu tedavinin 30 günü içerisinde ve kombinasyon tedavi uygulanmasıhalinde daha sık oluşur. Enterokolit, nekroz, perforasyon ya da sepsis komplikasyonlaraneden olabilir ve fatal sonuç ile ilişkili olabilir (bkz. Bölüm 4.8). Hastalar, enterokolit belirtive semptomları açısından izlenmelidir.Stevens-Johnson sendromu (SJS) ve toksik epidermal nekroliz (TEN), fatal durumlar dahil bildirilmiştir (bkz. Bölüm 4.8). Klofarabin, eksfoliatif ya da bülloz döküntü nedeniyle ya daSJS ya da TEN'den şüpheleniliyorsa kesilmelidir. 4 / 19Klofarabin uygulaması periferal lösemi hücrelerinde hızlı bir düşüşle sonuçlanır. Klofarabin tedavisi uygulanacak hastalar Sistemik Enflamatuvar Yanıt Sendromu (SIRS), kapiler sızıntısendromu ve/veya organ disfonksiyonuna dönüşebilecek olan tümör lizis sendromu ve sitokinsalımına (örn. taşipne, taşikardi, hipotansiyon, pulmoner ödem) belirti ve semptomlarına karşıincelenmeli ve değerlendirilmelidir. - Hiperürisemi (tümör lizis) bekleniyorsa, profilaktik allopurinol uygulamasıdüşünülmelidir. - Tümör lizis ve diğer olayların etkilerini azaltmak için 5 günlük klofarabin uygulamasısüresince hastalara intravenöz sıvı uygulanmalıdır. - Profilaktik steroid uygulaması (örn. 100 mg/m hidrokortizon 1-3 gün) SIRS veyakapiler sızıntı belirti ve semptomlarını önlemede yararlı olabilir. Hastalarda SIRS, kapiler sızıntı sendromu veya ani organ disfonksiyonu ile ilgili erken belirti ve semptomlar gözlenirse klofarabin uygulaması derhal kesilmeli ve uygun destekleyiciönlemler alınmalıdır. Bunun yanı sıra 5 günlük uygulama süresince hastada herhangi birnedenden dolayı hipotansiyon gelişirse klofarabin tedavisi kesilmelidir. Klofarabin iletedavinin devamı genellikle düşük dozlarda olmak üzere, hasta stabilize haldeyse ve organfonksiyonları normale dönmüşse düşünülebilir. Klofarabin tedavisine yanıt oluşan hastaların büyük bir kısmında 1 veya 2 tedavi kürü sonrasında yanıt elde edilir. Bu nedenle 2 tedavi kürü sonunda hematolojik veya klinikgelişim göstermeyen hastalarda tedaviye devam etmenin oluşturacağı potansiyel yarar vezararlar tedaviyi uygulayan hekim tarafından değerlendirilmelidir. Kalp hastalığı olanlar ve bunun için kan basıncını veya kardiyak işlevi etkilediği bilinen ilaç tedavisi alanlar klofarabin tedavisi boyunca dikkatle izlenmelidir (bkz. Bölüm 4.5 ve 4.8). Renal yetmezliği olan (klinik çalışmalarda serum kreatinin >2 x ULN yaşa göre olarak tanımlanmıştır) pediyatrik hastalarla ilgili hiçbir klinik deneyim yoktur ve klofarabin büyükoranda böbrekler aracılığıyla atılır. Farmakokinetik veriler düşük kreatinin klirensi olanhastalarda klofarabinin birikebileceğini belirtmektedir (bkz. Bölüm 5.2). Bu nedenleklofarabin hafif veya orta dereceli renal yetmezliği olan hastalarda dikkatle kullanılmalıdır(doz ayarı için bkz. Bölüm 4.2). Şiddetli renal yetmezliği olan veya böbrek replasman tedavisiuygulanan hastalarda klofarabinin güvenlilik profili tespit edilmemiştir (bkz. Bölüm 4.3).Renal toksisite ile ilişkilendirilen ve NSAİİ, amfoterisin B, metotreksat, aminosid,organoplatin, foskarnet, pentamidin, siklosporin takrolimus, asiklovir ve valgansiklovir gibitübüler sekresyonla atılan ilaçlarla eş zamanlı kullanımından, özellikle 5 günlük klofarabinuygulaması süresince kaçınılmalıdır, tercihen nefrotoksik olmadığı bilinen tıbbi ürünlerverilmelidir (bkz. Bölüm 4.5 ve 4.8) Klofarabin uygulanan hastalarda kusma ve diyare görülebilir; bu nedenle dehidratasyonu önleyici önlemler alınması önerilir. Hastalar sersemlik, bayılma nöbeti veya idrar çıkışındaazalma gözlenmesi halinde hastaneye başvurmaları konusunda yönlendirilmelidir. Profilaktikanti-emetik ilaçların kullanımı düşünülmelidir. Hepatik yetmezliği olan (serum bilirübin > 1.5 x ULN artı AST ve ALT >5 x ULN) hastalarla ilgili hiçbir deneyim yoktur ve karaciğer toksisite için potansiyel hedef organdır. Bunedenle hafif ve orta dereceli hepatik yetmezliği olan hastalarda klofarabin dikkatlekullanılmalıdır (bkz. Bölüm 4.2 ve 4.3). Hepatik toksisite ile ilişkilendirilen ilaçlarlaklofarabinin eş zamanlı kullanımından mümkün olduğunca kaçınılması önerilir (bkz. Bölüm4.5 ve 4.8). 3 Eğer hastada > 4 haftadan uzun süren Evre 4 nötropeni hematolojik toksisite gelişirse, bir sonraki kürde doz %25 düşürülmelidir.Üçüncü defa şiddetli hematolojik olmayan toksisite (ABD NCI CTC Evre 3 toksisite) deneyimleyen, şiddetli toksisitesi 14 gün içinde düzelmeyen (bulantı/kusma hariç) veyahayatı-tehdit edici toksisite ya da sınırlayıcı toksisite gelişen (ABD NCI CTC Evre 4 toksisite)herhangi bir hastada klofarabin tedavisi kesilmelidir (bkz. Bölüm 4.2). Daha önce hematopoetik kök hücre nakli (HSCT) uygulanan hastalar etoposid (100 mg/m ) ve siklofosfamid (440 mg/m2) ile eş zamanlı kullanılan klofarabin (40 mg/m2) tedavisinitakiben veno-oklüzif hastalığı düşündüren yüksek hepatotoksisite riski altında olabilir.Hepatotoksik olaylar, relapslı veya refrakter akut lösemili pediyatrik hastalar üzerindeklofarabinin devam eden bir Faz 1/2 kombinasyon çalışmasında bildirilmiştir. Klofarabinin 3 tedavi küründen fazla uygulanmasının etkililiği ve güvenliliği ile ilgili halihazırda sınırlı sayıda veri mevcuttur. EVOLTU, her bir flakonunda 3,08 mmol (ya da 70,78 mg) sodyum ihtiva eder. Bu durum, kontrollü sodyum diyetinde olanlar hastalar için göz önünde bulundurulmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBugüne kadar klofarabin ile ilgili resmi bir etkileşim çalışması yürütülmemiştir. Bununla birlikte diğer ilaçlarla veya laboratuvar testleriyle klinik olarak anlamlı bilinen hiçbiretkileşimi yoktur. Klofarabin sitokrom P450 (CYP) enzim sistemi ile saptanabilir düzeyde metabolize edilmemektedir. Bu nedenle, sitokrom P450 enzimlerini indükleyen veya inhibe eden aktifmaddelerle etkileşim oluşturması beklenmez. Bununla birlikte klofarabinin 52 mg/m2'likgünlük intravenöz infüzyonu sonrasında oluşan plazma konsantrasyonlarında majör 5 insanCYP formlarından (1A2, 2C9, 2D6 ve 3A4) hiçbirini inhibe etmesi veya bunların içindeki ikiizoformu indüklemesi (1A2 ve 3A4) de beklenmez. Sonuç olarak bu enzimlerin substratıolarak bilinen aktif maddelerin metabolizmasını değiştirmesi beklenmez. Klofarabin büyük oranda böbrekler aracılığıyla atılır. Bu nedenle renal toksisite ile ilişkili olan tıbbi ürünler ve NSAİİ, amfoterisin B, metotreksat, aminosid, organoplatin, foskarnet,pentamidin, siklosporin takrolimus, asiklovir ve valgansiklovir gibi tübüler sekresyonla atılanilaçlarla eş zamanlı kullanımından, özellikle 5 günlük klofarabin uygulaması süresincekaçınılmalıdır (bkz. Bölüm 4.4, 4.8 ve 5.2). Karaciğer toksisite açısından potansiyel hedef organdır. Bu nedenle hepatik toksisite ile ilişkilendirilen tıbbi ürünlerle eş zamanlı kullanımından mümkün olduğunca kaçınılmalıdır(bkz. Bölüm 4.4 ve 4.8). Kan basıncının veya kardiyak işlevi etkilediği bilinen tıbbi ürünleri kullanan hastalar klofarabin tedavisi süresine yakından izlenmelidir (bkz. Bölüm 4.4 ve 4.8). 4.6. Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi D'dir. 4 Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):Çocuk doğurma potansiyeli bulunan kadınlar tedavi süresince etkili bir kontrasepsiyon yöntemi kullanmalıdırlar. Bunun yanı sıra seksüel olarak aktif erkekler de tedavi süresince etkili bir kontrasepsiyon yöntemi kullanmalıdırlar. Gebelik dönemi:Klofarabinin gebelerde kullanımı ile ilgili herhangi bir veri yoktur. Hayvanlarda yapılan çalışmalarda teratojenite dahil üreme toksisitesi gösterilmiştir (bkz. Bölüm 5.3). Klofarabingebelik döneminde kullanıldığında ciddi doğum defektlerine neden olabilir. Bu nedenleEVOLTU gebelik döneminde, özellikle ilk trimester süresince, kullanımı mutlak suretlegerekmedikçe (örn. anneye olan potansiyel yararı fetüse olan yararından fazlaysa) kesinliklekullanılmamalıdır. Eğer hasta klofarabin ile tedavi ederken hamile kalırsa, ilacın fetüsüzerinde oluşturabileceği potansiyel zarar ile ilgili bilgilendirilmelidir. Laktasyon dönemi:Klofarabin veya metabolitlerinin anne sütüne geçip geçmediği bilinmemektedir. Klofarabinin süte atılımı hayvanlar üzerinde çalışılmamıştır. Bununla birlikte yenidoğanda ciddi yan etkioluşma potansiyeli nedeniyle emzirme tedavi öncesinde, sırasında ve sonrasında klofarabinuygulaması kesilmelidir (bkz. Bölüm 4.3). Üreme yeteneği/FertiliteFare, rat ve köpeklerin erkek üreme organlarında ve dişi farelerin üreme organlarında dozla ilgili toksisiteler gözlenmiştir (bkz. Bölüm 5.3). Klofarabin tedavisinin insan fertilitesi üzerineolan etkileri bilinmediğinden, uygun bir döneme kadar hastalar üreme ile ilgili planlamalarınıertelemelidir. 4.7. Araç ve makine kullanımı üzerindeki etkilerKlofarabinin araç ve makine kullanımı üzerindeki etkilerini inceleyen herhangi bir çalışma yapılmamıştır. Bunun yanı sıra hastalara sersemlik, baş dönmesi veya bayılma gibi yan etkilergözlemleyebilecekleri bildirilmeli ve bu tip durumlar söz konusunda olduğunda araç vemakine kullanmamaları gerektiği belirtilmelidir. 4.8. İstenmeyen etkilerYan etkilerle ilgili bilgiler en az bir defa 5 gün boyunca 52 mg/m /gün klofarabin uygulanan ALL veya akut miyeloid lösemili (AML) 115 hastanın (>1 ve <21 yaş) yer aldığı klinikçalışmalardan elde edilen verilere göre oluşturulmuştur. Yan etkiler sistem organ sınıfına vesıklığına göre (çok yaygın [>1/10]; yaygın [>1/100 ila <1/10]; yaygın olmayan [>1/1000 ila<1/100]; seyrek [>1/10000 ila 1/1000] ve çok seyrek [<1/10000]) aşağıdaki tablodasıralanmıştır. Pazarlama sonrası dönemde raporlanan yan etkiler de tabloya eklenmiş olupsıklığı bilinmiyor (eldeki verilere göre hesaplanamamaktadır) olarak belirtilmiştir. Hersıklık gruplaması içinde yan etkiler azalan önem durumlarına göre sıralanmıştır. İleri evre ALL veya AML'li hastalar, kendilerinde oluşan yan etkilerin altta yatan hastalıkları, bu hastalığın progresyonu ve birçok tıbbi ürünün eş zamanlı uygulanması ile ilgili çeşitlisemptomlara bağlı olup olmadığının değerlendirilmesini zorlaştıran karışık medikaldurumlara sahip olabilirler. 5 Hemen hemen tüm hastalar (%98) çalışmanın araştırmacısı tarafından klofarabin ile ilişkili olduğu düşünülen en az bir yan etki deneyimlemiştir. En sık raporlananlar bulantı (hastaların%61'i), kusma (%59), febril nötropeni (%35), baş ağrısı (%24), raş (%21), diyare (%20),prürit (%20), pireksi (%19), palmar-plantar eritrodisestezi sendromu (%15), yorgunluk (%14),anksiyete (%12), mukozal inflamasyon (%11) ve kızarma (%11). 68 hastada (%59) klofarabinile ilişkili en az bir ciddi yan etki oluşmuştur. Bir hasta 52 mg/m2/gün klofarabinuygulandıktan sonra, klofarabinle ilişkili olduğu düşünülen evre 4 hiperbilirübinemi nedeniyleilacı kesmiştir. Üç hasta çalışma araştırmacısı tarafından klofarabinle alakalı olduğudüşünülen yan etkiler nedeniyle ölmüştür: bir hasta solunum sıkıntısı, hepatoselüler hasar vekapiler sızıntı sendromu; bir hasta VRE sepsis ve çoklu-organ yetmezliği; ve diğer hastadaseptik şok ve çoklu organ yermezliği nedeniyle hayatını kaybetmiştir.
Kan ve lenfatik sistem bozuklukları:Klofarabin ile tedavi edilen hastalarda en sık gözlenen hematolojik laboratuvar anomalileri: anemi (%87.7; 100/114); lenfopeni (%82.3; 93/113), nötropeni (%63.7; 72/113) vetrombositopeni (%80.7; 92/114). Bu olayların büyük bir çoğunluğu evre >3'tür. Pazarlama sonrası dönemde uzun süren sitopeni (trombositopeni, anemi, nötropeni ve lökopeni) ve kemik iliği yetmezliği bildirilmiştir. Kanama olayları, trombositopenioluşumunda görülmüştür. Hemoraji, serebral, gastrointestinal ve pulmoner hemoraji olarakbildirilmiştir ve fatal olabilir. Durumların çoğu, trombositopeni ile ilişkilidir (bkz.Bölüm 4.4).Vasküler hastalıklar:115 hastanın 64'ü (%55.7) en az bir vasküler hastalık yaşamışlardır. 115 hastadan 23'ü klofarabin ile ilişkili olduğu düşünülen bir vasküler hastalık deneyimlemiş olup, en sıkraporlananlar kızarma (13 olay, ciddi olmayan) ve hipotansiyondur (5 olay; tümü ciddi olarakdeğerlendirilen) (bkz. Bölüm 4.4). Ancak bu hipotansif olayların çoğunluğu karışık ciddienfeksiyonları olanlarda bildirilmiştir. Kardiyak hastalıklar:Hastaların yüzde ellisi en az bir kardiyak bozukluk yaşamıştır. 115 hastadan 11'inde görülen bu bozuklukların klofarabin ile ilişkili olduğu düşünülmüş olup, bunlardan hiçbiri ciddideğildir ve en sık raporlanan kardiyak hastalık taşikardi (%35) (bkz. Bölüm 4.4); hastaların%6.1'inin (7/115) taşikardisi klofarabin ile ilgili olarak değerlendirilmiştir. Kardiyak adversolayların büyük bir çoğunluğu ilk iki kürde bildirilmiştir. Perikardiyal efüzyon ve perikardit hastaların %9'unda (10/115) bir advers etki olarak raporlanmıştır. Bunlardan üçü klofarabin ile ilişkili olarak değerlendirilmiştir; perikardiyalefüzyon (x 2 olay, biri ciddi) ve perikardit (1 olay, ciddi olmayan). Hastaların büyük bir 9 / 19kısmında (8/10) perikardiyal efüzyon ve perikardit asemptomatik ve ekokardiyografik değerlendirmede klinik olarak önemi olmayan veya az öneme sahip olarak düşünülmüştür.Bununla birlikte, ilgili bazı hemodinamik uyumu olan 2 hastada perikardiyal efüzyon klinikolarak önemlidir. Enfeksiyonlar ve enfestasyonlar:Hastaların %48'inde klofarabin tedavisi uygulanmadan önce bir veya daha fazla devam eden enfeksiyona sahiptir. Hastaların toplam %83'ü klofarabin tedavisinden sonra en az birenfeksiyon; fungal, bakteriyel ve viral enfeksiyonlar dahil yaşamıştır (bkz. Bölüm 4.4). 21(% 18.3) olayın klofarabinle ilgili olduğu düşünülmüştür; kateterle ilgili enfeksiyon (1 olay),sepsis (2 olay) ve septik şok (2 olay; 1 hasta ölmüştür) ciddi olarak değerlendirilmiştir. Pazarlama sonrası dönemde, bakteriyel, fungal ve viral enfeksiyonlar bildirilmiştir ve fatal olabilir. Bu enfeksiyonlar, septik şok, solunum yetmezliği ve/veya çoklu organ yetmezliğineyol açabilir. Böbrek ve idrar yolu hastalıkları:115 hastadan 41'i (%35.7) en az bir böbrek veya idrar yolu ile ilgili yan etki ile karşılaşmıştır. Pediyatrik hastalarda en prevalan yan etki kreatinin yükselmesidir. Hastaların %8'inde evre 3veya 4 kreatinin yükselmesi görülmüştür. Nefrotoksik tıbbi ürünler, tümör lizis ve tümörlizisle birlikte hiperürisemi böbrek toksisitesine katkıda bulunabilir (bkz. Bölüm 4.3 ve 4.4).Hematüri tüm hastaların %13'ünde gözlenmiştir. 115 hastada böbrekle ilgili 4 yan etkininklofarabinle ilgili olduğu düşünülmüştür, bunların hiçbiri ciddi değildir; hematüri (3 olay) veakut böbrek yetmezliği (1 olay) (bkz. Bölüm 4.3 ve 4.4). Hepato-biliyer hastalıklar:Karaciğer klofarabin toksisitesi için potansiyel hedef organdır ve hastaların %25.2'si en az bir hepato-biliyer hastalık yan etkisi ile karşılaşmıştır. 6 olayın klofarabin ile ilgili olduğudüşünülmüştür; akut kolesistit (1 olay), kolelitiyaz (1 olay), hepatoselüler hasar (1 olay; hastaölmüştür) ve hiperbilirübinemi (1 olay; hasta tedaviyi kesmiştir) ciddi olarakdeğerlendirilmiştir. Veno-oklüzif hastalığı (VOD) içeren iki pediyatrik raporun (%1.7)çalışma ilacıyla alakalı olduğu düşünülmüştür. Pazarlama sonrası dönemde pediatrik ve yetişkin hastalarda bildirilen Veno-oklüzif hastalığı (VOD) vakaları, fatal sonuç ile ilişkili olmuştur (bkz. Bölüm 4.4) Bununla birlikte, klofarabin kullanan 50/113 hastada en az şiddette (en az ABD NCI CTC Evre 3) yüksek ALT, 36/100 hastada yüksek AST ve 15/114 hastada yüksek bilirübin düzeyimevcuttur. ALT ve AST'de oluşan yükselmelerin büyük bir kısmı klofarabin uygulamasının10 günü içerisinde gerçekleşir ve 15 gün içerisinde <evre 2 düzeyine döner. Var olan takipverilerine göre bilirübin yükselmelerinin büyük bir çoğunluğu 10 gün içinde <evre 2 düzeyinedöner. Sistemik İnflamasvon Yanıt Sendromu (SIRS) veya kapiler sızıntı sendromu:SIRS, kapiler sızıntı sendromu (sitokin kinaz belirti ve semptomları örn. taşikardi, taşipne, hipotansiyon, pulmoner ödem) pediyatrik hastaların %5'inde (6/115) bir yan etki olarakraporlanmıştır (5 ALL ve 1 AML). 13 tümör lizis sendromu, kapiler sızıntı sendromu veyaSIRS raporlanmıştır; SIRS (2 olay, her ikisi de ciddi olarak değerlendirilmiştir), kapiler sızıntısendromu (4 olay, 3'ü ciddi ve ilaçla ilgili olarak değerlendirilmiştir), ve tümör lizis sendromu(7 olay, 6'sı ilaçla ilgili ve 3'ü ciddi olarak değerlendirilmiştir). 10 / 19Pazarlama sonrası dönemde bildirilen kapiller sızıntı sendromu fatal bir sonuç ile ilişkilendirilmiştir (bkz. Bölüm 4.4). Gastrointestinel hastalıklar:Klofarabin tedavisi sırasında nötropenik, kolit, çekum iltihabı ve C. difficilekoliti dahil enterokolit oluşumu bildirilmiştir. Enterokolit, nekroz, perforasyon ya da sepsiskomplikasyonlara neden olabilir ve fatal sonuç ile ilişkili olabilir (bkz. Bölüm 4.4).Deri ve derialtı doku hastalıkları:Klofarabin ile tedavi olan ya da daha önceden tedavi olmuş olan hastalarda Stevens Johnson sendromu (SJS) ve toksik epidermal nekroliz (TEN), fatal durumlar dahil bildirilmiştir.Ayrıca başka eksfoliatif durumlarda bildirilmiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiHerhangi bir doz aşımı vakası bildirilmemiştir. Bununla birlikte doz aşımı ile ilgili muhtemel semptomların bulantı, kusma, diyare ve ciddi kemik iliği baskılanması olması beklenir. Buzamana kadar insanlara uygulanan en yüksek günlük doz ardışık 5 gün uygulanmak üzere70mg/m 'dir (ALL'li 2 pediyatrik hasta). Bu hastalarda gözlenen toksik etkiler içerisindebulantı, hiperbilirubinemi, yüksek transaminaz düzeyleri ve makülo-papüler raş yeralmaktadır. Herhangi bir özel antidotu yoktur. Tedavinin derhal kesilmesi, dikkatli gözlem ve uygun destekleyici önlemlerin alınması önerilmektedir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antineoplastik ilaçlar, antimetabolitler ATC kodu: L01BB06 Etki mekanizmasıKlofarabin saf bir nükleosid anti-metabolittir. Antitümör aktivitesinin 3 mekanizmaya bağlı olduğu düşünülmektedir: DNA zinciri uzamasında ve/veya DNA sentezi/tamirinin sonlanmasıyla sonuçlananDNA polimeraz a inhibisyonu. Hücresel deoksinükleotid trifosfat (dNTP) havuzlarında düşüş ile birlikteribonükleotid redüktaz inhibisyonu. Bölünmeyen lenfositlerde bile programlanmış hücre ölümüne yol açan, sitokrom C vediğer proapoptik faktörlerin salımı ile birlikte mitokondriyal membran bütünlüğününbozulması. 11 / 19Klofarabin ilk olarak hedef hücrelere difüze olmalı veya taşınmalıdır ve burada hücre içi kinazlarla sırasıyla mono- ve bi- fosfata ve ardından son olarak aktif konjugat klofarabin 5'-trifosfata fosforile olur. Klofarabinin aktive fosforilleyici enzimlerden biri olan (doğal substratolan deoksisitidini aşan) deoksisitidin kinaza yüksek afinitesi vardır. Bununla birlikte, klofarabin bu sınıf içindeki diğer aktif maddelere göre, adenozin deaminaz aracılı hücresel bozunmaya karşı yüksek dirence ve fosforilik ayrılmaya karşı düşükhassasiyete sahipken, klofarabin trifosfatın DNA polimeraza ve ribonükleotid redüktazaafinitesi deoksiadenozin trifosfatla benzer veya ondan fazladır. Farmakodinamik etkiler:In vitroçalışmalar klofarabinin hızlı bölünen hematolojik ve solid tümör hücre hattı tiplerinde hücre büyümesini inhibe ettiğini ve bunlarda sitotoksik olduğunu ortaya koymuştur.Klofarabin ayrıca pasif lenfosit ve makrofajlara karşı da aktiftir. Bunun yanı sıra, klofarabintümör büyümesini geciktirmiş ve bazı vakalarda, ayrılmış insan ve murin ksenograflarıimplante edilen farelerde tümör gerilemesi sağlamıştır.Klinik etkililik ve güvenlilikKlinik etkililik:Hastalarda görülen yanıttan sağlanan sistemik değerlendirmede, kör olmayan bir Bağımsız Yanıt İnceleme Paneli (IRRP) Children's Oncology Group tarafındanoluşturulan tanımlara dayanan aşağıdaki yanıt oranlarını tespit etmiştir:
Klofarabinin etkililiği ve güvenliliği bir faz I, açık-etiketli, karşılaştırmasız, doz-yükseltme çalışmasında standart tedavisi başarısız olan veya kendisi için başka bir tedavi mevcutolmayan, tekrarlayan (relaps) veya inatçı (refrakter) lösemili 25 pediyatrik hasta (17 ALL, 8AML) üzerinde değerlendirilmiştir. Doz 2 ila 6 haftada bir 5 gün boyunca intravenözinfüzyonla uygulanmak üzere 11.25 mg/m2/gün olarak başlatılmış ve toksisite ile alınanyanıta bağlı olarak 15, 30, 40, 52 ve 70 mg/m /gün'e yükseltilmiştir. 17 ALL hastasının 9'u52 mg/m2/gün klofarabin ile tedavi edilmiştir. Değişen dozlarda, 17 ALL hastasından 2'sindetam remisyon (%12; CR) ve 2'sinde parsiyel remisyon (%12; PR) sağlanmıştır. Bu 12 / 19çalışmadaki doz sınırlayıcı toksisiteler hiperbilirubinemi, yükselmiş transaminaz düzeyleri ve makülopapüler raş, 70 mg/m2/gün dozunda gözlenmiştir (2 ALL hastası). Çok merkezli, faz II, açık-etiketli, karşılaştırmasız bir klofarabin çalışması ağır düzeyde ön-tedavi uygulanan Fransız-Amerikan-İngiliz sınıflandırma sistemine göre tanımlanan tekrarlayan veya inatçı ALL'li hastalarda (ilk diyagnoz <21 yaş) tüm remisyon (OR) oranınıdeğerlendirmek amacıyla yürütülmüştür. Yukarıda tanımlandığı gibi faz I çalışmasında enyüksek tolere edilebilir dozda, 52 mg/m2/gün klofarabin her 2 ila 6 haftada bir 5 ardışık günboyunca intravenöz infüzyonla uygulanmıştır. Aşağıdaki tabloda bu çalışmadaki anahtarsonuçlar özetlenmiştir. ALL'li hastalar yüksek küratif tedavi potansiyeli için seçilebilir olmamalıdırlar ve ikinci veya sonraki tekrarlayan ve/veya inatçı (örn. en az iki ön rejimden sonra başarısız remisyonaulaşmada olan) olmalıdırlar. Çalışmada yer almadan önce, 61 hastanın 58'i (%95) 2 ila 4farklı indüksiyon tedavisi almıştır ve bu hastaların 18/61'ine (%30) daha önce en az bir defahematopoetik kök hücre nakli (HSCT) uygulanmıştır. Tedavi edilen hastaların yaş ortalaması(37 erkek, 24 kadın) 12'dir. Klofarabin uygulaması, en başta ölçülebilir mutlak blast miktarına sahip olan 33 hastanın 31'indeki (%94) periferal lösemi hücrelerinde dramatik ve hızlı bir düşüş sağlamıştır. Tamremisyon (CR + PR) sağlanmış olan 12 hastada ortalama sağkalım süresi veri toplanmasınınkesildiği tarihte 66.6 hafta olarak belirlenmiştir.Yanıt, ön-B hücresi ve T-hücresi de dahilolmak üzere ALL'nin farklı immünofenotiplerinde gözlenmiştir. Nakil oranı çalışmanın birsonlanma noktası değilse bile 10/61 hasta (%16) klofarabin tedavisinden sonra (3'ü CR, 2'siCRp, 3'ü PR elde edildikten sonra, IRRP'ye göre tedavi başarısızlığı düşünülmüş olan 1 hastave IRRP'ye göre değerlendirilemez olarak düşünülmüş olan 1 hasta) HSCT uygulamasınagirmiştir. Yanıt süresi HSCT uygulanan hastalardakine katılmıştır.
* ITT= tedavi amaçlı. ** Hastalar hayattadırlar ve son takipteki remisyon, analizin bu noktasında dikkate alınmıştır.
CR ve CRp elde edilen hastalarda bireysel remisyon süresi ve sağkalım verileri
En iyi yanıt
OR süresi (hafta)
Remisyon süresi (hafta)
Tüm sağkalım (hafta)
Nakil uygulanmayan hastalar
CR
5.7
4.3
66.6
CR
14.3
6.1
58.6
CR
8.3
47.9
66.6
CRp
4.6
4.6
9.1
CR
3.3
58.6
72.4
CRp
3.7
11.7
53.7
Remisyon sürerken nakil uygulanan hastalar*
CRp
8.4
11.6+
145.1+
CR
4.1
9.0+
111.9+
CRp
3.7
5.6+
42.0
CR
7.6
3.7+
96.3+
Alternatif tedavi veya relaps sonrası nakil uygulanan hastalar
CRp
4.0
35.4
113.3+** 14 / 19
*Nakil zamanında durdurulmuş remisyon süresi **Tedavinin değişmesini takiben nakil uygulanan hasta***Relaps sonrası nakil uygulanan hasta Bu tıbbi ürün istisnai durumlar altında onaylanmıştır. Bu, hastalığın seyrek görülmesine bağlı olarak ilaçla ilgili tam bir bilginin elde edilmesinin mümkün olmadığı anlamınagelmektedir. Avrupa İlaç Ajansı her yıl elde edilen tüm yeni bilgileri inceleyecektir ve bu kısaürün bilgisi gerekli oldukça yenilenecektir. 5.2. Farmakokinetik özelliklerGenel özelliklerKlofarabinin farmakokinetiği yaşları 2 ila 19 arasında değişen tekrarlayan veya inatçı ALL veya AML'li 40 hastada değerlendirilmiştir. Hastalar tekli faz I (n= 12) veya iki faz II (n=14 /n= 14) etkililik ve güvenlilik çalışmasında yer almış ve intravenöz infüzyon yoluyla çokludozlarda klofarabin almışlardır.
15 / 19
İdrarla atılan doz
%57 Çok değişkenli analizler klofarabin farmakokinetiğinin kiloya bağlı olduğunu göstermiştir ve lökosit miktarının klofarabin farmakokinetiği üzerinde etkili olduğu belirtilmesine rağmen bu,hastaların bireysel doz rejiminin lökosit sayısı üzerinden yapılmasında yeterli görülmemiştir. 52 mg/m2 klofarabinin intravenöz infüzyonu geniş bir kilo aralığında eşdeğer maruziyet 2oluşturmuştur. Bununla birlikte, Cmaks hastanın kilosuyla ters orantılıdır ve bu nedenle her m başına aynı dozda yapılan infüzyon sonrasında küçük çocuklarda 40 kg ağırlığa sahip tipik birçocuğa göre daha yüksek Cmaks değerleri elde edilebilir. Benzer şekilde, <20 kg altındakiçocuklarda daha uzun infüzyon süresi düşünülmelidir.Klofarabin böbrek ve böbrek-dışı yollarla atılmaktadır. 24 saat sonunda uygulanan dozun yaklaşık %60'ı idrardan değişmeden atılır. Klofarabin klirens oranlarının glomerülerfiltrasyon oranından daha yüksek olduğu görülmektedir bu nedenle böbreklerden atılımmekanizmasının filtrasyon ve tübüler sekresyon olduğu belirtilmektedir. Ayrıca klofarabinsitokrom P450 (CYP) enzim sistemi ile tespit edilebilir düzeyde metabolize edilmediğindenböbrek-dışı atılım yolları henüz bilinmemektedir. ALL veya AML'li hastalarda ya da kadınla erkek arasında farmakokinetik açısından hiçbir farklılık gözlenmemiştir. Klofarabin veya klofarabin trifosfat maruziyeti arasında hiçbir ilişki yoktur ve bu popülasyonda hem etkililik hem de toksisite tespit edilmiştir. Hastalardaki karakteristik özelliklerErişkinler (>21 yaş ve <65 yaş):Hâlihazırda klofarabinin erişkinlerdeki güvenliliğini ve etkililiğini belirleyen yeterli bilgi yoktur. Bununla birlikte tekrarlayan veya inatçı AML'lihastalarda 1 saatlik intravenöz infüzyonla uygulanan tek doz 40 mg/m klofarabininerişkinlerdeki farmakokinetiği, yukarıda sözü geçen ardışık 5 gün 2 saatlik intravenözinfüzyonla 52 mg/m klofarabin uygulanan 2-19 yaş arası tekrarlayan veya inatçı ALL veyaAML'li pediyatrik hastalardaki ile karşılaştırılabilirdir.Geriyatrik hastalar (>65 yaş):Geriyatrik hastalarda klofarabinin güvenliliği ve etkililiğini değerlendiren yeterli bilgi mevcut değildir.Böbrek yetmezliği olan hastalar:Bugüne kadar kreatinin klirensi azalmış pediyatrik hastalarda klofarabin farmakokinetiği ile ilgili sınırlı veri mevcuttur. Bununla birlikte buveriler klofarabinin bu tip hastalarda birikim oluşturabileceğini belirtmektedir.Erişkin veya pediyatrik hasta popülasyonundan elde edilen farmakokinetik veriler stabil seyreden orta dereceli böbrek yetmezliği olan hastalara (kreatinin klirensi 30-60 mL/dk) %50daha az dozda uygulama yapılmasının, normal böbrek fonksiyonu olan hastalara standartdozlarda uygulanan klofarabin ile elde edilen kadar bir maraziyet oluşturduğunugöstermektedir. Yaşları 2 ila 19 arasında değişen, tekrarlayan veya refrakter ALL veya AML (n=ll / n=12) pediyatrik hastalarda çoklu dozlarda klofarabinin intravenöz infüzyon yoluyla uygulamasınıtakiben hesaplanan temel kreatinin klirensine göre klofarabin AUCo-24 saat (kreatinin klirensiSchwartz formülüne göre hesaplanmıştır). 16 / 19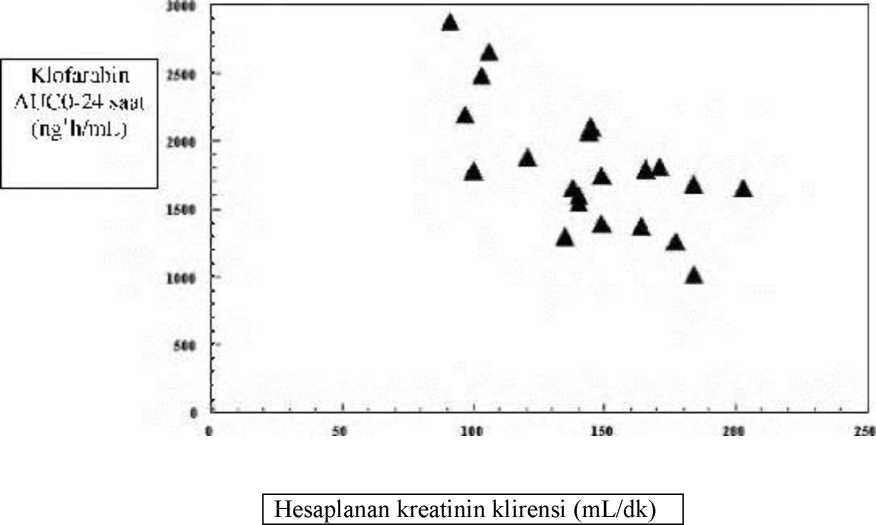
Böbrek yetmezliği olan hastalar:Bugüne kadar kreatinin klirensi azalmış pediyatrik hastalarda klofarabin farmakokinetiği ile ilgili sınırlı veri mevcuttur. Bununla birlikte buveriler klofarabinin bu tip hastalarda birikim oluşturabileceğini belirtmektedir.Erişkin veya pediyatrik hasta popülasyonundan elde edilen farmakokinetik veriler stabil seyreden orta dereceli böbrek yetmezliği olan hastalara (kreatinin klirensi 30-60 mL/dk) %50daha az dozda uygulama yapılmasının, normal böbrek fonksiyonu olan hastalara standartdozlarda uygulanan klofarabin ile elde edilen kadar bir maruziyet oluşturduğunugöstermektedir. 5.3. Klinik öncesi güvenlilik verileriKlofarabin ile fare, rat ve köpekler üzerinde yapılan toksisite çalışmalarında, toksisite için birincil hedef organın hızlı bölünen hücreler olduğu gösterilmiştir. Ratlarda gözlenen kardiyak etkiler kardiyomiyopati ile uyumludur ve tekrarlayan tedavi kürleri sonrasında kalp yetmezliği belirtilerine katkıda bulunmaktadır. Bu toksisitelerininsidansı hem uygulanan klofarabin dozuna hem de tedavinin süresine bağlıdır. Bunlar klinikuygulamalardakinden yaklaşık 7 ila 13 kat (3 veya daha fazla kür sonrası) veya 16 ila 35 kat(1 veya daha fazla kür sonrası) daha yüksek maruziyet düzeylerinde (Cmaks) raporlanmıştır.Daha düşük dozlarda gözlenen minimal etkiler kalp üzerindeki toksisiteler için bir eşikdeğerinin mevcut olduğunu ve raflardaki lineer-olmayan farmakokinetiğin, gözlenen buetkilerin oluşumunda rol oynayabileceğini düşündürmüştür. İnsanlardaki muhtemel riskbilinmemektedir. Ratlarda 6 kür klofarabin tedavisinden sonra oluşan klinik AUC'den 3 ila 5 kat yüksek maruziyet düzeylerinde glomerülonefropati bildirilmiştir. Bu, hafif bir tübüler hasarla birlikteglomerüler taban membranındaki minör kalınlaşma ile karakterize edilmiştir ve buna serumkimyasındaki değişiklikler eşlik etmez. Hepatik etkiler, klofarabinin kronik uygulanmasının ardından ratlarda görülmüştür. Bunlar, büyük olasılıkla tedavi döngüsünün bir sonucu olarak dejeneratif ve rejeneratif değişikliklerinsüperpoze olmasını gösterir ve serum kimyasındaki değişikliklerle ilişkili değildir. Hepatik 17 / 19etkilerin histopatolojik kanıtı, yüksek dozların akut uygulanmasının ardından köpeklerde görülmüştür, ancak ayrıca serum kimyasındaki değişiklikler eşlik etmemiştir. Erkek üreme organındaki dozla ilişkili toksisiteler fare, rat ve köpeklerde gözlenmiştir. Bu etkiler, ratlarda yüksek maruziyet düzeylerinde (150 mg/m /gün) spermatid tutulumunun eşlikettiği seminifer epitelyumundaki bilateral dejenerasyonu ile interstisyel hücrelerin atrofisinive köpeklerde klinik olarak ilişkili maruziyet düzeylerinde (>7.5 mg/m /gün) epidermisinhücre dejenerasyonu ile seminifer epitelyumun dejenerasyonunu içerir. Dişi farelerde sadece 225 mg/m /gün dozunda uygulanan klofarabin ile gecikmiş over atrofisi veya dejenerasyonu ve uterinin mukozal apoptozu gözlenmiştir. Klofarabin ratlarda ve tavşanlarda teratojeniktir. Ratlarda yaklaşık 2 ila 3 kat fazla klinik maruziyet oluşturan dozlarda (54 mg/m2/gün) ve tavşanlarda 12 mg/m2/gün dozunda(tavşanlarda herhangi bir maruziyet verisi bulunmamaktadır) malformasyon (yumuşak doku)sayısında artma ile birlikte postimplantasyon hasarında artışlar, fetal vücut ağırlığında azalmave doğan yavru sayısındaki azalma ile iskeletle ilgili değişiklikler (osifikasyonda yavaşlama)raporlanmıştır. Gelişimsel toksisite için eşiğin ratlarda 6 mg/m2/gün ve tavşanlarda 12 Omg/m /gün olduğu düşünülmektedir. Matemal toksisite için gözlenebilir etki oluşturmayan düzey ratlarda 18 mg/m2/gündür ve tavşanlarda 12 mg/m2/gün'ün üzerindedir. Fertilite ileilgili herhangi bir çalışma yürütülmemiştir. Genotoksisite çalışmaları klofarabinin bakteriyel ters mutasyon analizinde mutajenik olmadığını ortaya koymuştur ancak Çin Hamster Over (CHO) hücrelerinde yapılan aktiveolmayan kromozomal sapma analizinde ve in vivorat mikronükleus analizinde klastojeniketki oluşturmuştur.Herhangi bir karsinojenite çalışması yürütülmemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSodyum klorür Enjeksiyonluk suSodyum hidroksitHidroklorik asitAzot 6.2. GeçimsizliklerBu tıbbi ürün bölüm 6.6'da belirtilenlerin dışındaki tıbbi ürünlerle karıştırılmamalıdır. 6.3. Raf ömrüAçılmamış tıbbi ürün: 24 ayAçıldıktan sonra seyreltilmiş çözelti: Ürün 0.2 mikrometre steril şırınga filtresinden (0.2 mikrometre şırınga filtresinin kullanımı mümkün değilse, konsantre çözelti 5 mikrometrelikön filtreden) süzülerek %0.9 sodyum klorür çözeltisi ile konsantrasyonu 0.5 ve 0.83 mg/mLolacak şekilde seyreltme yapıldığında 2-8 °C'de ve 25 °C'de 72 saat boyunca kimyasal vefiziksel açıdan stabildir. 18 / 19Mikrobiyolojik veriler, %0.9 sodyum klorür çözeltisi ile konsantrasyonu 0.5 ve 0.83 mg/mL olacak şekilde seyreltme yapıldığında 2-8 °C'de 24 saat boyunca stabil olduğunugöstermektedir. %0.9 sodyum klorür çözeltisi ile seyreltme yapılmadan önce 0.2 mikrometresteril şırınga filtresinden süzülmüştür. 6.4. Saklamaya yönelik özel tedbirler25 °C altındaki oda sıcaklığında saklayınız. Dondurmayınız. Işıktan korumak için orijinal ambalajında saklayınız. Ürünün seyreltildikten sonraki saklama koşulları ve raf ömrü için Bölüm 6.3.'e bakınız. 6.5. Ambalajın niteliği ve içeriğiKutuda, 20 mm bromobütil gri kauçuk tıpa üzerine 20 mm flip-off şeffaf alüminyum kapaklı, 20 R Tip 1 şeffaf cam flakon, 1 adet. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİOnko İlaç San. ve Tic. A.Ş. Koşuyolu Cad. No:34, 34718Kadıköy/İstanbulTelefon: (0216) 544 90 00Faks : (0216) 545 59 92E-mail : [email protected] 8. RUHSAT NUMARASI(LARI)2019/605 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 26.11.2019 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ19 / 191/ 192/ 193/ 194/ 195/ 19 |
İlaç BilgileriEvoltu 20 Mg/20 Ml İnfüzyonluk Çözelti Hazırlamak İçin KonsantreEtken Maddesi: Klofarabin Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.