Temodal 2.5 mg/ml İnfüzyonluk Çözelti İçin Toz Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Antineoplastik İlaçlar (Kanser İlaçları) » Alkilleyici Ajanlar » Diğer Alkilleyici Ajanlar » Temozolomid KISA URUN BILGISI1. BEŞERI TIBBI ÜRÜNÜN ADITemodal 2.5 mg/ml infüzyonluk çözelti için toz2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde: 100 mg temozolomidKullanıma hazırlandıktan sonra 1 ml infüzyonluk çözelti, 2.5 mg temozolomid içerir.Yardımcı madde: 235,20 mg sodyum Yardımcı maddeler için 6.1'e bakınız.3. FARMASÖTIK FORMİnfüzyonluk çözelti için toz.Beyaz toz.4. KLİNIK ÖZELLIKLER4.1 Terapötik endikasyonlarTEMODAL 2.5 mg/ml, aşağıdaki hastalıkların tedavisinde endikedir:- glioblastoma multiforme tanısı yeni konulmuş olan erişkin hastalarda, radyoterapiyle birlikte; daha sonra da monoterapi olarak.- 3 yaşından itibaren çocuklarda, ergenlerde ve erişkin hastalarda, standart tedaviden sonra rekürran veya progresif glioblastoma multiforme veya anaplastik astrositoma gibi, malign glioma hastalarında.4.2 Pozoloji ve uygulama şekliTEMODAL sadece, beyin tümörleri konusunda uzman doktorlar tarafından reçetelendirildiği zaman kullanılmalıdır.Anti-emetik tedavi kullanılabilir (bkz bölüm 4.4).Pozoloji/uygulama sıkılığı ve süresiYeni tanı konulan glioblastoma multiformeli erişkin hastalarTEMODAL 2.5 mg/ml, fokal radyoterapiyle kombinasyon şeklinde (eşzamanlı faz) ve ardından en fazla 6 siklus olarak temozolomid monoterapisi şeklinde kullanılır.Eşzamanlı fazTemozolomid, radyoterapi (30 fraksiyonda verilen 60 Gy) ile eşzamanlı olarak, 42 gün süreyle oral yoldan günde 75 mg/m2Eşzamanlı fazda temozolomid verilmesine, aşağıdaki koşulların tümü sağlanırsa, en fazla 49 gün olmak üzere 42 günden daha uzun sure devam edilebilir:- mutlak nötrofil sayısı >1.5 x 109- trombosit sayısı >100 x 109- Ortak Toksisite Kriterleri (CTC) hematolojik olmayan toksisite <Evre 1 (alopesi, bulantıve kusma dışında)Tedavi sırasında her hafta tam kan sayımı yapılmalıdır. Eşzamanlı fazda, Tablo 1'de belirtilen hematolojik ve hematolojik olmayan toksisite kriterlerine göre temozolomid kullanılmasına ara verilmeli veya temozolomid tedavisi durdurulmalıdır.Tablo 1. Eşzamanlı temozolomid (TMZ) Tedavisi Sırasında Temozolomid Tedavisine Ara Verilmesi veya Temozolomid Tedavisinin Durdurulması
a: Eşzamanlı TMZ tedavisi aşağıdaki durumların tümü sağlandığı takdirde sürdürülebilir: mutlak nötrofil sayısı >1.5 x 109Kısaltmalar:,tmz = TEMODAL; CTC = Ortak Toksisite Kriterleri.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Toksisite |
TMZ Dozu bir düzey azaltılıra |
TMZ Tedavisi Durdurulur |
Mutlak Nötrofil Sayısı |
< 1.0 x 109 |
Bkzdipnot b |
Trombosit Sayısı |
< 50 x 109 |
Bkzdipnot b |
CTC Hematolojik-Olmayan Toksisite Kriterleri(alopesi, bulantı ve kusma dışında) |
CTC Evre 3 |
CTC Evre 4b |
a: TMZ doz düzeyleri içinbkzTablo 2. b: TMZ tedavisi durdurulmalıdır:
doz düzeyi -1 (100 mg/m2
dozun azaltılmasından sonra aynı Evre 3 hematolojik-olmayan toksisite (alopesi,bulantı, kusma dışında) yinelerse.
Rekürran veya ^proşresif malign slioma:
Erişkin hastalar
Bir tedavi siklusu 28 gündür. Daha önce kemoterapi uygulanmamış hastalarda TEMODAL, oral yoldan, ilk 5 gün boyunca günde 1 defa 200 mg/m2(bkzbölüm 4.4).
TEMODAL 2.5 mg/ml enjeksiyonluk çözelti için toz, yalnızca intravenöz infüzyonla verilmelidir. İntratekal, intramusküler veya subkütan gibi diğer uygulama yolları kullanılarak verilmemelidir.
Uygun temozolomid dozu, bir infüzyon pompasıyla intravenöz infüzyon şeklinde ve 90 dakikada verilmelidir.
Benzer diğer kemoterapötik ilaçlarda olduğu gibi, temozolomidin damar dışına çıkmaması için ihtiyatlı olunması önerilir. TEMODAL 2.5 mg/ml infüzyonluk çözelti dozu verilen hastalardaki enjeksiyon yerinde, çok büyük bir bölümü hafif ve kısa süreli olan lokal advers reaksiyonlar bildirilmiştir. Klinik-öncesi çalışmalar, kalıcı doku hasarı göstermemiştir (bkz bölüm 4.8 ve 5.3).
TEMODAL, sert kapsül formülasyonu olarak da (oral kullanım) mevcuttur. İntravenöz infüzyonla 90 dakikada verilen TEMODAL 2.5 mg/ml infüzyonluk toz, sert kapsül formülasyonuyla biyo-eşdeğerdir (bkz bölüm 5.2).
Özel popülasyonlara ilişkin ek bilgiler:
Karaciğer veya böbrek yetmezliği:
Hafif-orta şiddette karaciğer yetmezliği olan hastalardaki temozolomid farmakokinetiği, karaciğer fonksiyonu normal olan hastalardakine benzer. TEMODAL'in şiddetli (Child Sınıf III) karaciğer yetmezliği veya böbrek yetmezliği olan hastalara verilmesiyle ilgili hiçbir veri yoktur. Temozolomidin farmakokinetik özellikleri göz önünde bulundurulduğunda, şiddetli karaciğer veya herhangi bir derece böbrek yetmezliği olan hastalarda doz azaltılmasına ihtiyaç duyulması, neredeyse olanaksızdır. Ancak TEMODAL ,bu hastalarda ihtiyatla kullanılmalıdır.
Pediyatrik popülasyon:
TEMODAL, 3 yaşında veya daha büyük çocuklarda yalnızca; yineleyen veya progresyon gösteren habis glioma tedavisinde kullanılmalıdır. 1 tedavi kürü, 28 gündür. TEMODAL'in 3 yaşında küçük çocuklarda kullanılmasıyla ilişkili herhangi bir klinik tecrübe mevcut değildir; daha büyük çocuklardaki klinik tecrübeler ise ileri derecede sınırlıdır(bkzbölüm 4.4 ve 5.1).
Geriyatrik popülasyon:
Yaşları 19-78 arasında değişen hastalardaki bir popülasyon farmakokinetiği analizinin sonuçları hastanın yaşının, temozolomid klerensini etkilemediğini göstermektedir. Ancak yaşlı (> 70 yaşında olan) hastalardaki nötropeni ve trombositopeni riski, artmış gözükmektedir (bkz bölüm 4.4).
4.3 Kontrendikasyonlar
Aktif maddeye veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılık. Dakarbazine (DTIC) karşı aşırı duyarlılık.
TEMODAL, ağır miyelosupresyonu olan hastalarda kontrendikedir(bkzbölüm 4.4). TEMODAL, hamile veya çocuk emziren kadınlarda kontrendikedir(bkzbölüm 4.6).
4.4 Özel kullanım uyarıları ve önlemleri
Pneumocystis cariniipnömonisi
Uzatılmış 42 günlük eşzamanlı TEMODAL ve radyoterapi uygulanan bir kılavuz çalışmada hastalarınPneumocystis cariniipnömonisinin gelişmesi açısından özel bir risk altında oldukları gösterilmiştir. 42 (en fazla 49) günlük, eşzamanlı TEMODAL ve radyoterapi uygulanan hastalarda bu nedenle, lenfosit sayısı ne olursa olsunPneumocystis cariniipnömonisine karşı profilaksi uygulanması gerekir. Bu hastalarda lenfopeni gelişecek olursa söz konusu profilaksiye, lenfopeni evre <1'e düzelinceye kadar devam edilmelidir.
TEMODAL daha uzun süreli doz rejimleri uyarınca kullanıldığında,Pneumocystis cariniipnömonisinin insidansı yükselebilir. Ancak TEMODAL kullanan tüm hastalar, özellikle de steroid alanlar, uygulanmakta olan tedavi rejimine bakılmaksızın,Pneumocystis cariniipnömonisinin gelişmesi açısından yakın gözlem altında tutulmalıdır.
Maligniteler
Miyelodisplastik sendrom ve miyeloid löseminin de olduğu sekonder maligniteler de, çok seyrek bildirilmiştir (bkz bölüm 4.8).
Anti-emetik tedavi
Bulantı ve kusma, temozolomid tedavisine çok sık eşlik eder.
Temozolomid tedavisinden önce veya sonra, anti-emetik tedavi kullanılabilir:
Glioblastoma multiforme tanısı yeni konulmuş olan erişkin hastalar
- Eşzamanlı fazın başlangıç dozundan önce anti-emetik profilaksi önerilmektedir.
- Aynı profilaksinin, monoterapi fazı sırasında da uygulanması kuvvetle önerilir.
Rekürran veya progresif malign glioma hastaları.
Daha önceki tedavi sikluslarında şiddetli (Evre 3 veya 4) kusma görülen hastalar, anti-emetik tedaviye ihtiyaç duyabilir.
Laboratuvar parametreleri
Tedaviye başlanmadan önce mutlak nötrofil sayısı >1.5 x 109
Pediyatrik kullanım
TEMODAL'in 3 yaşında küçük çocuklarda kullanılmasıyla ilişkili herhangi bir klinik tecrübe mevcut değildir; daha büyük çocuklardaki ve ergenlerdeki klinik tecrübeler ise, ileri derecede sınırlıdır(bkzbölüm 4.2 ve 5.1).
Geriyatrik kullanım
Yaşlı (> 70 yaşındaki) hastalardaki nötropeni ve trombositopeni riski, daha genç hastalara kıyasla artmış gözüktüğünden; TEMODAL yaşlı hastalara verilirken özellikle dikkat edilmelidir.
Erkek hastalar
Temozolomid tedavisi altındaki erkek hastalara, tedavinin tamamlanmasından sonra 6 ay geçinceye kadar baba olmamaları ve spermlerini, tedaviye başlamadan önce dondurarak saklamaları önerilmelidir.
Yardımcı maddeler
Bu tıbbi ürün, her flakonda 2.4 mmol sodyum içerir. Bu özellik, kontrollü sodyum diyeti uygulayan hastalarda göz önünde bulundurulmalıdır.
4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleri
Etkileşim çalışmaları, yalnızca erişkinlerde yapılmıştır.
Ayrı bir faz I çalışmasında temozolomidin ranitidinle birlikte verilmesi, temozolomidin emilim derecesinde veya aktif metaboliti olan MTIC'ye (monometil triazenoimidazol karboksamid) maruziyetinde değişiklikler meydana gelmesiyle sonuçlanmamıştır..
Faz II çalışmalarındaki bir popülasyon farmakokinetiği analizinin verileri temel alındığında deksametazonla, proklorperazinle, fenitoinle, karbamazepinle, ondansetronla, H2
Temozolomidin diğer tıbbi ürünlerin metabolizması veya eliminasyonu üzerindeki etkilerini ortaya koymak amacıyla hiçbir çalışma yapılmamıştır. Bununla birlikte, karaciğerde metabolize edilmemesi ve plazma proteinlerine düşük oranda bağlanması nedeniyle temozolomidin, diğer tıbbi ürünlerin farmakokinetikleri üzerinde etkili olması, neredeyse olanaksızdır (bkz bölüm 5.2).
TEMODAL'in diğer miyelosupresif ilaçların birlikte kullanılması, miyelosupresyon olasılığını artırabilir.
4.6 Gebelik ve Laktasyon Genel tavsiye
Gebelik kategorisi D'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü
Çocuk doğurma potansiyeline sahip kadınlara, temozolomid tedavisi sırasında etkili doğum kontrol yöntemleri kullanmaları önerilmelidir.
Gebelik dönemi
Temodal'in gebelik ve/veya fetus/yeni dogan üzerinde zararlı farmakolojik etkileri bulunmaktadır.
Temodal gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Gebe kadınlarda hiçbir çalışma yapılmamıştır. Sıçanlara ve tavşanlara 150 mg/m2(bkzbölüm 5.3). Bu nedenle temozolomid normal olarak, gebe kadınlara verilmemelidir. Gebelik sırasında temozolomid kullanılması düşünülüyorsa hasta, fötusun karşılaşabileceği risk konusunda bilgilendirilmelidir.
Laktasyon dönemi
Temozolomidin insanlarda anne sütüne geçip geçmediği bilinmediğinden bebeğin anne sütüyle beslenmesine, temozolomid tedavisi sırasında devam edilmemelidir.
Üreme yeteneği/fertilite
Temozolomid, genotoksik etkilere sahip olabildiğinden bununla tedavi edilen erkeklere, tedavinin tamamlanmasından sonra 6 ay geçinceye kadar baba olmamaları ve temozolomid tedavisine bağlı, düzelmesi olanaksız fertilite olasılığı nedeniyle spermlerini, tedaviye başlamadan önce dondurarak saklamaları önerilmelidir.
4.7 Araç ve makine kullanma yeteneği üzerindeki etkiler
Araba ve makine kullanma yeteneği üzerindeki etkileri inceleyen hiçbir çalışma yapılmamıştır. Temozolomid ile tedavi edilen hastalarda araba ve makine kullanma yeteneği, bitkinlik ve somnolans nedeniyle bozulabilir.
4.8 İstenmeyen etkiler
Sert kapsüllerle klinik deneyim
Bulantı, kusma, kabızlık, iştahsızlık, baş ağrısı ve bitkinlik; yeni tanı konulmuş glioblastoma multiforme hastalarında radyoterapiyle kombinasyon şeklinde veya yeni tanı konulmuş glioblastoma multiforme hastalarında radyoterapiyi takiben monoterapi olarak ya da yineleyen veya progresif glioma hastalarında yine monoterapi olarak kullanılan temozolomide çok sık eşlik eden advers reaksiyonlardır. Konvülsiyonlar, monoterapi kullanan, yeni tanı konulmuş glioblastoma multiforme hastalarında çok sık bildirilmiş; deri döküntüsü, radyoterapiyle eşzamanlı olarak temozolomid alan hastalarda, ayrıca yineleyen glioma hastalarında çok sık
bildirilmiştir. Hematolojik advers etkilerin neredeyse tümü, beklendiği gibi, sık veya çok sık bildirilmiştir (Tablo 4 ve 5). Evre 3-4 laboratuvar bulgularının sıklığı, Tablo 4 ve 5'ten sonra belirtilmiştir.
Tablolardaki istenmeyen etkiler, Sistem Organ Sınıf ve sıklık göz önünde tutularak sınıflandırılmıştır. Sıklık grupları: (çok yaygın [> 1/10], yaygın [> 1/100 - <1/10], seyrek [> 1/1,000 - <1/100], seyrek [> 1/10,000 to <1/1,000], çok seyrek [< 1/10,000] veya sıklığı bilinmeyen) göre verilmektedir. Her sıklık grubunda yer alan istenmeyen etkiler, en ciddi olanlar en önce gelecek şekilde sıralanmıştır.
Yeni tanı konulmuş slioblastoma multiforme
Tablo 4, yeni tanı konulmuş glioblastoma multiforme hastalarında eşzamanlı tedavi ve monoterapi sırasında gelişen advers olayları bildirmektedir.
Tablo 4: TEMODAL ve radyoterapi:Eşzamanlı tedavi ve monoterapi sırasında gelişen advers olaylar | ||
Sistem Organ Sınıf |
TMZ + eşzamanlı radyoterapi n=288* |
Temozolomid monoterapisi n=224 |
Enfeksiyon ve EnfestasyonlarYaygın:Yaygın olmayan: |
Enfeksiyon,Herpes simplex,yara enfeksiyonu, farenjit, oral candidiasis |
Enfeksiyon, oral candidiasisHerpes simplex,Herpes zoster, influenza-benzeri semptomlar |
Kan ve lenfatik sistem bozukluklarıYaygın:Yaygın olmayan: |
Nötropeni, trombositopeni, lenfopeni, lökopeniAnemi, febril nötropeni |
Febril nötropeni, trombositopeni, anemi, lökopeniLenfopeni, peteşiler |
EndokrinbozukluklarYaygın: |
Cushing hastalığını andıran özellikler |
Cushing hastalığını andıran özellikler |
Metabolizma vebeslenmebozukluklarıÇok yaygın:
Yaygın olmayan: |
AnoreksiHiperglisemi, kilo vermeHipokalemi, alkali fosfataz yükselmesi, kilo artışı |
Anoreksi Kilo vermeHiperglisemi, kilo artışı |
PsikiyatrikbozukluklarYaygın: |
Anksiyete, emosyonel unstabilite, uykusuzluk |
Anksiyete, depresyon, emosyonel unstabilite, uykusuzluk |
Yaygın olmayan: |
Ajitasyon, apati, davranış bozukluğu, depresyon, halüsinasyon |
Halüsinasyon, amnezi |
Sinir sistemi bozukluklarıÇok yaygın:Yaygın:
|
Baş ağrısıKonvülsiyonlar, bilinç durumunda azalma, somnolans, afazi, denge bozukluğu, göz kararması, konfüzyon, bellek bozukluğu, konsantrasyon bozukluğu, nöropati, parestezi, konuşma bozukluğu, tremorStatus epilepticus, ekstrapiramidal bozukluk, hemiparezi, ataksi, kognitif bozukluk, yürüyüş anormalliği. hiperestezi, hipoestezi, nörolojik bozukluk (NOS), periferik nöropati |
Konvülsiyonlar, baş ağrısıHemiparezi, afazi, denge bozukluğu, somnolans, konfüzyon, göz kararması, bellek bozukluğu, konsantrasyon bozukluğu, disfazi, nörolojik bozukluk (NOS), nöropati, periferik nöropati, parestezi, konuşma bozukluğu, tremorHemipleji, ataksi, koordinasyon anormalliği, yürüyüş anormalliği, hiperestezi, duyusal bozukluk |
Göz bozukluklarıYaygın:
|
Bulanık görmeHemianopi, görme keskinliğinde azalma, görme alanı defekti, göz ağrısı |
Görme alanı defekti. bulanık görme, diplopiGörme keskinliğinde azalma, göz ağrısı, göz kuruluğu |
Kulak ve labirentbozukluğuYaygın:Yaygın olmayan: |
İşitme bozukluğuOtitis media, kulak çınlaması, hiperakuzi, kulak ağrısı |
İşitme bozukluğu, kulak çınlaması Sağırlık, baş dönmesi, kulak ağrısı |
KardiyakbozukluklarYaygın olmayan: |
Çarpıntı |
|
VaskülerbozukluklarYaygın:Yaygın olmayan: |
Kanama, ödem, bacak ödemi Serebral kanama, hipertansiyon |
Kanama, derin ven trombozu, bacak ödemiAkciğer ödemi, ödem, periferik ödem |
Respiratuar, torasik ve mediastinal bozukluklarYaygın:Yaygın olmayan: |
Dispne, öksürükPnömoni, üst solunum yolu enfeksiyonu, nazal konjestiyon |
Dispne, öksürükPnömoni, sinüzit, üst solunum yolu enfeksiyonu, bronşit |
GastrointestinalbozukluklarÇok yaygın: |
Kabızlık, bulantı, kusma |
Kabızlık, bulantı, kusma |
Yaygın:Yaygın olmayan: |
Stomatit, ishal, karın ağrısı, dispepsi, disfaji |
Stomatit, ishal, dispepsi, disfaji, ağız kurumasıAbdominal distansiyon, fekal inkontinans, gastrointestinal bozukluk (NOS), gastroenterit, hemoroid |
Deri ve deri-altıdokusubozukluklarıÇok yaygın:Yaygın:
|
Döküntü, alopesiDermatit, deri kuruluğu, eritem, kaşıntıDeri soyulması, fotosensitivite reaksiyonu, anormal pigmentasyon |
Döküntü, alopesiDeri kuruluğu, kaşıntıEritem, anormal pigmentasyon, terlemede artış |
Kas-iskelet ve bağdokusubozukluklarıYaygın:Yaygın olmayan: |
Kaslarda dermansızlık, eklem ağrısıMiyopati, sırt ağrısı, kas-iskelet ağrısı, kas ağrısı |
Kaslarda dermansızlık, eklem ağrısı, kas-iskelet ağrısı, kas ağrısıMiyopati, sırt ağrısı |
Renal ve üriner bozukluklarYaygın:Yaygın olmayan: |
Sık idrara çıkma, üriner inkontinans |
Üriner inkontinans Disüri |
Üreme sistemi ve meme bozukluklarıYaygın: |
İktidarsızlık |
Vaginal kanama, menoraji, amenore, vaginitis, meme ağrısı |
Genel bozukluklar ve uygulama yeri sorunlarıÇok yaygın:
|
BitkinlikAlerjik reaksiyon, ateş, radyasyon hasarı, yüz ödemi, ağrı, tat duyusu bozukluğuAsteni, yüz kızarması, sıcak basması, durumun ağırlaşması, rigor, dilde renk değişimi, parosmi, susama |
BitkinlikAlerjik reaksiyon, ateş, radyasyon hasarı, ağrı, tat duyusu bozukluğuAsteni, yüz ödemi, ağrı, durumun ağırlaşması, rigor, diş sorunları, tat duyusu bozukluğu |
Tetkik sonuçlarıYaygın:
|
ALT artışıKaraciğer enzimlerinde artış, gamma GT artışı, AST artışı |
ALT artışı |
Laboratuvar sonuçları
Temozolomid dahil hemen tüm sitotoksik ilaçlarda, dozu sınırlayan toksisite olarak bilinen miyelosupresyon (nötropeni ve trombositopeni) gözlemlenmiştir. Eşzamanlı tedavi fazında ve monoterapi fazında gelişen laboratuvar anormallikleri ve advers olaylar birleştirilerek değerlendirildiğinde; nötropenik olaylar dahil Evre 3 veya Evre 4 nötrofil anormallikleri, hastaların %8'inde görülmüştür. Trombositopenik olaylar dahil Evre 3 veya Evre 4 trombosit anormallikleri, TEMODAL kullanan hastaların %14'ünde gözlenmiştir.
Rekürran veya prog;resif malign glioma hastaları:
Klinik çalışmalar sırasında tedaviyle-ilişkili istenmeyen etkiler en fazla, özellikle bulantı (%43) ve kusma (%36) olmak üzere gastrointestinal bozukluklar olmuştur. Genellikle Evre 1 veya 2 (24 saat içerisinde 0-5 kusma atağı) şeklindeki bu etkiler ya kendiliğinden düzelmiş ya da standart anti-emetik tedaviyle kolayca kontrol altına alınabilmiştir. Şiddetli bulantı ve kusma insidansı, %4'tür.
Yineleyen veya progresif kötü huylu glioma hastalarında yapılan klinik çalışmalarda ve TEMODAL'in pazara verilmesinden sonra bildirilmiş olan istenmeyen etkiler, Tablo 5'te gösterilmektedir
Tablo 5. Tedaviyle-ilişkili, istenmeyen etkiler: Rekürran veya progresif malign glioma hastaları | |
Enfeksiyon ve enfestasyonlarSeyrek: |
Fırsatçı enfeksiyonlar,Pneumocystis cariniipnömonisi dahil |
Kan ve lenfatik sistem bozukluklarıÇok yaygın:Yaygın olmayan: |
Nötropeni veya lenfopeni (evre 3-4), trombositopeni Pansitopeni, anemi (evre 3-4), lökopeni |
Metabolizma ve beslenme bozukluklarıÇok yaygın:Yaygın: |
İştahsızlık Kilo verme |
Sinir sistemi bozukluklarıÇok yaygın:Yaygın: |
Baş ağrısıSomnolans, göz kararması, parestezi |
Respiratuvar, torasik ve mediastinal bozukluklarYaygın: |
Dispne |
Gastrointestinal bozukluklarÇok yaygın:Yaygın: |
Bulantı, kusma, kabızlık İshal, karın ağrısı, dispepsi |
Deri ve deri-altı dokusu bozukluklarıYaygın:Çok seyrek: |
Döküntü, kaşıntı, alopesiErythema multiforme, erythroderma, ürtiker,exanthema |
Genel bozukluklar ve uygulama yeri sorunlarıÇok yaygın: |
Bitkinlik |
Yaygın: Ateş, asteni, rigor, kırıklık, ağrı, tat duyusu bozukluğu
Çok seyrek:_Alerjik reaksiyonlar, anafilaksi dahil, anjiyoödem_Alerjik reaksiyonlar, anafilaksi dahil, anjiyoödem
_
Laboratuvar sonuçları
Evre 3 veya 4 trombositopeni ve nötropeni, kötü huylu glioma nedeniyle tedavi edilen hastaların sırasıyla %19 ve %17'sinde görülmüş ve hastaların sırasıyla %8 ve %4'ünde hospitalizasyona ve/veya TEMODAL tedavisinin durdurulmasına neden olmuştur. Miyelosupresyon, tahmin edilebilen bir gelişme olmuş (genellikle ilk birkaç siklusta ve en az 21.-28. günler arasında görülmüş) ve hızla, genellikle 1-2 hafta içerisinde düzelmiştir. Kümülatif miyelosupresyon kanıtları görülmemiştir. Trombositopeni, kanama riskini; nötropeni veya lökopeni ise enfeksiyon riskini artırabilir.
Cinsiyet
Klinik çalışmalarda elde edilen verilerin bir popülasyon farmakokinetiği analizinde; en düşük nötrofil sayıları bilinen 101 kadın ve 169 erkek hastayla, en düşük trombosit sayıları bilinen 110 kadın ve 174 erkek hastaların verileri değerlendirilmiştir. Tedavinin birinci siklusunda Evre 4 nötropeni (mutlak nötrofil sayısı< 500 hücre/^l) erkek hastaların %3'siyle kadın hastaların %5'inde; en düşük trombosit sayısı ise kadın hastaların %9'unda ve erkek hastaların %3'ünde saptanmıştır. 400 hastaya ait yineleyen glioma verileri; Evre 4 nötropeninin kadın hastaların %8'iyle erkek hastaların %4'ünde; Evre 4 trombositopeninin kadın hastaların yine %8'iyle erkek hastaların %3'ünde geliştiğini göstermiştir. Yeni tanı konulmuş 288 glioblastoma multiforme hastasında yapılan bir çalışmada, tedavinin birinci siklusu sırasında Evre 4 nötropeni, kadın hastaların %3'ünde gelişmiş, erkek hastalarda hiç görülmemiş; Evre 4 trombositopeni, kadın hastaların %1'inde gelişmiş, erkek hastalarda hiç görülmemiştir.
İntravenöz formülasyonla klinik deneyim
TEMODAL 2.5 mg/ml infüzyonluk çözelti için toz, karşılığı olan TEMODAL sert kapsül ile vücuda eşdeğer dozda temozolomid sağlar ve hem temozolomide, hem aktif metaboliti olan MTIC'ye eşdeğer maruziyet eşlik eder (bkz bölüm 5.2). Ağrı, irritasyon, kaşıntı, sıcaklık, şişlik ve eritem şeklindeki infüzyon yeri reaksiyonları; intravenöz formülasyonla toplam 55 denekte yapılan iki çalışmada bildirilen, ancak sert kapsül kullanıldığında bildirilmemiş olan advers reaksiyonlardır.
Pazarlama-Sonrası Deneyim
Özellikle alkilleştiriciler olmak üzere antineoplastik ilaçlara, potansiyel bir miyelodisplastik sendrom (MDS) ve lösemi dahil sekonder malignite insidansı eşlik etmiştir. Temozolomid içeren rejimlerle tedavi edilen hastalarda çok seyrek olarak MDS ve miyeloid lösemi dahil sekonder malignite geliştiği bildirilmiştir. Aplastik anemiyle sonuçlanabilen, uzun süreli pansitopeni, çok seyrek bildirilmiştir.
Toksik epidermal nekroliz ve Stevens-Johnson sendromu çok seyrek bildirilmiştir. İnterstisyel pnömonit/pnömonit çok seyrek bildirilmiştir.
4.9 Doz aşımı
500, 750, 1,000, and 1,250 mg/m2
5. FARMAKOLOJİK ÖZELLİKLER
5.1 Farmakodinamik özellikler
Farmakoterapötik özellikler;
Farmakoterapötik grup: Antineoplastik ilaçlar - Diğer alkilleştirici ilaçlar,
ATC kodu: L01A X03
Temozolomid, fizyolojik pH değerlerinde hızla, etkin bileşik olan monometil triazenoimidazol karboksamide (MTIC) dönüşen bir triazendir. Etkin maddenin (MTIC) sitotoksik etkisinin öncelikle, guaninin O6
Yeni tanı konulmuş glioblastoma multiforme
Toplam 573 hasta, temozolomid + radyoterapi (n=287) veya yalnızca radyoterapi (n=286) uygulanmak üzere randomize edilmiştir. Temozolomid + radyoterapi grubundaki hastalara radyoterapinin ilk gününde başlamak ve son gününde sona ermek üzere 42 (en fazla 49) gün boyunca günde bir defa 75 mg/m2Pneumocystis cariniipnömonisine (PCP) karşı profilaksiye ihtiyaç duyulmuştur.
Kurtarma tedavisi olarak; yalnızca radyoterapi uygulanan gruptaki (kontrol grubu) 161/282 (%57), temozolomid + radyoterapi grubundaki 62/277 (%22) hastaya temozolomid verilmiştir.
Total sağkalım konusundaki olasılık oranı (HR), temozolomid kolu lehine 1.59 (%95 güven aralığı 1.33 - 1.91; log-rank p< 0.0001) olarak hesaplanmıştır. 2 yıl veya daha uzun süre hayatta kalma olasılığının, temozolomid + radyoterapi kolunda daha yüksek (%10'a karşılık %26) olduğu görülmüştür. Yeni tanı konulmuş glioblastoma multiforme hastalarının tedavisinde radyoterapiyle eşzamanlı olarak temozolomid ilave edilmesi ve daha sonra da temozolomid monoterapisi total
ITT Population: Overall Survival
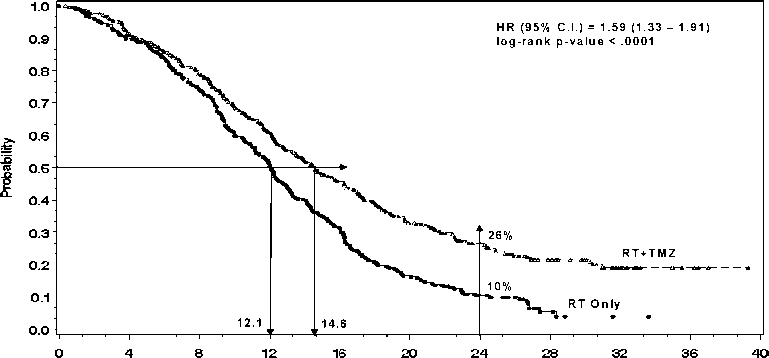
Time from mndomistion (months)
Şekil 1 Total sağkalım konusundaki Kaplan-Meier eğrileri (ITT popülasyonu)
sağkalımın, yalnızca radyoterapi uygulanmasına kıyasla istatistik anlam taşıyacak şekilde uzamasıyla sonuçlanmıştır. (Şekil 1).
ITT Population: Overall Survival =HR (95%CI) = 1.59 (1.33 - 1.91) =log-rank p-value <0.0001 =26% =RT+TMZ =
Radyoterapi + temozolomid 10% =RT only =Probability =Time from randomization (months)
= Randomizasyondan sonra geçen süre (ay)
Bu çalışmadaki, performans durumu kötü (PS=2) olan 70 hastada aynı sonuç alınmamış ve bu alt-gruptaki total sağkalım ve progresyona kadar geçen süre, her iki grupta birbirine yakın olarak belirmiştir. Ancak bu grupta, kabul edilemez bir risk mevcut gözükmemektedir.
Rekürran veya progresif malign glioma hastaları
Ameliyattan ve radyoterapiden sonra yineleyen veya progresif glioblastoma multiforme (Karnofsky performans durumu [KPS] >70) olan hastalardaki klinik etkililik verileri; oral temozolomidle yapılan iki çalışmada elde edilmiştir. Bunlardan biri, %29'u daha önce radyoterapi görmüş olan 138 hastada yapılan karşılaştırmasız bir çalışmadır. Diğer çalışma ise; %67'si daha önce nitrozüre içeren kemoterapi görmüş olan 225 hastada yapılan, randomize, referans-kontrollü bir temozolomid ve prokarbazin çalışmasıdır. MR taramalarıyla veya nörolojik durumun kötüleşmesiyle kararlaştırılan progresyon gelişinceye kadar geçen progresyonsuz sağkalım (PFS), her iki çalışmada da primer bitiş noktası olarak değerlendirilmiştir. Karşılaştırmasız çalışmada, altıncı aydaki progresyonsuz sağkalım oranı %19, progresyonsuz medyan sağkalım süresi 2.1 ay, medyan total sağkalım süresi 5.4 ay olmuştur; MR taramalarını temel alan objektif yanıt oranı, %8 olarak hesaplanmıştır.
Randomize, referans-kontrollü çalışmada altıncı aydaki PFS oranları temozolomid kullanan hastalarda, prokarbazinle tedavi edilenlerden anlamlı şekilde daha yüksek (%8'e karşılık %21,-ki-kare p = 0.008); progresyonsuz sağkalım süreleri temozolomid ve prokarbazin gruplarında sırasıyla 2.89 ve 1.88 ay (log rank p = 0.0063); medyan sağkalım süresi yine sırasıyla 7.34 ve 5.66 ay olmuştur (log rank p = 0.33). Altıncı ayda, hayatta olan hastaların temozolomid grubundaki oranı, prokarbazin grubuna kıyasla anlamlı şekilde daha yüksek (%44'e karşılık %60; chi-square p = 0.019) bulunmuştur. Daha önce kemoterapi görmüş olan hastalardan KPS puanı 80 veya daha yüksek olanlarda, fayda sağlanmıştır.
Nörolojik durumun kötüleşmesine kadar geçen süre ve performans durumu kötüleşinceye (KPS puanı <70 oluncaya veya başlangıca kıyasla en az 30 puan azalıncaya) kadar geçen süreler temozolomid kullanan hastalarda, prokarbazin verilenlerden daha uzun olmuştur. Bu bitiş noktalarında progresyona kadar geçen medyan süre temozolomid grubunda, prokarbazin grubuna kıyasla 0.7 - 2.1 ay daha uzun bulunmuştur (log rank p = <0.01 - 0.03).
Rekürran anaplastik astrositoma
Anaplastik astrositoma hastalarındaki oral temozolomidin güvenilirlik ve etkililiğini ilk nüks geliştiğinde değerlendiren, çok-merkezli, prospektif, global bir faz II çalışmasında; 6 aylık progresyonsuz sağkalım oranı %46, progresyonsuz medyan sağkalım süresi 5.4 ay, medyan total sağkalım süresi 14.6 ay olmuştur. ITT (intent-to-treat) popülasyonunda merkezi değerlendirmeyle hesaplanan yanıt oranı %35 (13 hastada tam, 43 hastada kısmi yanıt) bulunmuş; hastalığın 43 hastada stabilize olduğu bildirilmiştir. ITT popülasyonundaki 6-aylık olaysız sağkalım oranı %44, olaysız medyan sağkalım süresi 4.6 ay olmuş ve progresyonsuz sağkalım sonuçlarına yakın bulunmuştur. Uygun histoloji popülasyonundaki etkililik sonuçları, bunlar gibidir. Radyolojik objektif yanıt elde edilmesine veya progresyonsuz durumun devamına, yaşam kalitesinin bozulmaması veya iyileşmesi, güçlü bir şekilde eşlik etmiştir.
Pediatrik hastalar
Oral temozolomid; yaşları 3-18 arasında değişen ve yineleyen beyin sapı glioması veya yineleyen, yüksek evreli astrositoması olan pediatrik hastalarda; her 28 günlük dönemde 5 gün kullanılarak incelenmiştir. Temozolomide tolerans, erişkin hastalardakine yakındır.
5.2 Farmakokinetik özellikler
Temozolomid, fizyolojik pH değerlerinde kendiliğinden hidrolize olarak etkin maddesi olan 3-metil-(triazen-1-yl)imidazol-4-karboksamide (MTIC) dönüşür. MTIC, yine spontan hidroliz sonucu, purin ve nükleik asit biyosentezinin bilinen bir ara-ürünü olan 5-amino-imidazol-4-karboksamide (AIC) ve aktif alkilleştirici madde olduğuna inanılan metilhidrazine dönüşmektedir. MTIC toksisitesinin öncelikle; daha çok guaninin O6in vivo ty2değeri temozolomide olup, 1.8 saattir.
Kötü huylu primer merkez sinir sistemi tümörleri olan hastalarda oral ve intravenöz temozolomid farmakokinetiğinin biyo-eşdeğerliliğini araştıran, açık-etiketli, iki-yönlü, çapraz bir çalışmada; 90 dakikalık infüzyonla verilen TEMODAL'e eşlik eden temozolomid ve MTIC Cm
Emilim
Temozolomid intravenöz yolla uygulandığından, emilim söz konusu değildir.
Dağılım
Plazma proteinlerine düşük oranda (%10-20) bağlanması nedeniyle temozolomidin, söz konusu proteinlere yüksek oranda bağlanan maddelerde etkileşime girmesi beklenmemektedir.
İnsanlardaki PET (pozitron-emisyon tomografisi) çalışmaları ve klinik-öncesi veriler temozolomidin, kan-beyin seddinden hızla geçerek beyin-omurilik sıvısına ulaştığı izlenimini vermektedir. Temozolimidin beyin-omurilik sıvısına geçtiği; 1 hastada doğrulanmış ve bu hastada temozolomid EAA değeriyle hesaplanan beyin-omurilik sıvısındaki maruziyet yaklaşık %30 olarak hesaplanmıştır; bu rakam, hayvanlardaki verilerle bağdaşmaktadır.
Eliminasyon
Temozolomidin plazmadaki eliminasyon yarı-ömrü (t/), yaklaşık 1.8 saattir. 14
Plazma konsantrasyonları, dozla bağlantılı olarak yükselir. Plazma klerensi, dağılım hacmi ve eliminasyon yarı-ömrü, doza bağlı olarak şekillenen parametreler değildir.
Özel popülasyonlar
Temozolomidin popülasyon farmakokinetiği analizleri; plazma temozolomid klerensinin hastanın yaşına, böbrek fonksiyonuna veya tütün içip içmemesine bağlı olarak değişmediğini göstermiştir. Ayrı bir farmakokinetik çalışmada, hafif-orta şiddette karaciğer disfonksiyonu olan hastalardaki plazma farmakokinetik profillerinin, karaciğer fonksiyonu normal hastalardakine benzediği bulunmuştur.
Pediatrik hastalardaki EAA değeri, erişkin hastalardakinden yüksektir ama siklus başına MTD (tolere edilen maksimal doz), gerek çocuklarda gerekse erişkinlerde aynıdır (1000 mg/m2
5.3 Klinik-öncesi güvenlilik verileri
Sıçanlarda ve köpeklerde tek- (5 gün tedavi, 23 gün tedavisiz), üç- ve altı-sikluslu toksisite çalışmaları yapılmıştır. Kemik iliği, lenforetiküler sistem, testisler, gastrointestinal kanal, toksisitenin öncelikle incelendiği hedefler olmuş; test edilen sıçanların %60 - %100'ünün ölümüyle sonuçlanan yüksek dozlar kullanıldığında, retina dejenerasyonu görülmüştür. Toksik etkilerin çok büyük bölümü; erkek üreme sistemindekiler ve retina dejenerasyonu dışında, reversibilite kanıtı göstermiştir. Ancak ölümcül dozlara eşlik ettiğinden ve klinik çalışmalar sırasında benzer bir gelişmeyle karşılaşılmadığından retina dejenerasyonu, klinik öneme sahip kabul edilmemiştir.
Temozolomid; embriyotoksik, teratojenik ve genotoksik etkilere sahip olan, alkilleştirici bir maddedir; sıçanlarda ve köpeklerde, insana kıyasla daha toksiktir ve klinikte kullanılan doz, bu hayvanlardaki minimal letal doza yakındır. Lökosit ve trombosit sayılarında meydana gelen, dozla-ilişkili azalmalar, duyarlı toksisite göstergeleri olarak gözükmektedir. Sıçanlardaki 6-siklusluk çalışma sırasında meme kanserleri, keratoacanthoma dermis ve bazal hücreli karsinoma gibi çeşitli neoplazmalar gözlenmiş; köpeklerdeki çalışmalarda ise ne tümörlere ne de pre-neoplastik değişikliklere tanık olunmuştur. Sıçanlar, temozolomidin onkojen etkilerine özellikle duyarlı gözükmekte ve bu hayvanlarda ilk tümörler, tedavinin başlamasını izleyen ilk 3 ay içerisinde ortaya çıkmaktadır. Bu latent dönem, alkilleştirici bir madde için ile son derece kısadır.
Ames/salmonella ve İnsan Periferik Kan Lenfositi (HPBL) kromozom aberasyon testlerinin sonuçları, pozitif mutajenik yanıt göstermiştir.
İntravenöz formülasyon, gerek tavşanlarda gerekse sıçanlarda, enjeksiyon yerinde lokal irritasyona neden olmuştur. Söz konusu irritasyon geçici olmuş ve buna, uzun süreli doku hasarı eşlik etmemiştir.
6. FARMASÖTIK ÖZELLIKLER
6.1 Yardımcı maddelerin listesi
Mannitol (E421)
Treonin Polyisorbat 80
Sodyum sitrat (pH değerinin ayarlanması için)
Konsantre hidroklorik asit (pH değerinin ayarlanması için)
6.2 Geçimsizlikler
Yoktur.
6.3 Raf ömrü
Açılmamış flakon: 36 ay
Kullanıma hazırlanmış çözelti: kullanıma hazırlanarak hemen kullanılacak olan çözeltinin 25°C'de, infüzyon süresi dahil 14 saat boyunca fiziksel ve kimyasal bakımdan stabil olduğu gösterilmiştir. Kullanıma hazırlanmış çözelti hemen kullanılmayacaksa, bunun saklanma süresi ve koşulları kullanıcının sorumluluğundadır ve bu süre, çözeltinin kontrollü, geçerliliği saptanmış koşullarda hazırlanmamış olması durumunda normal olarak 24 saati aşmamalıdır.
6.4 Saklamaya yönelik özel tedbirler
Buzdolabında (2 °C - 8 °C) saklayınız.
Kullanıma hazırlanmış çözeltinin saklama koşulları için, bkz bölüm 6.3.
6.5 Ambalajın niteliği ve içeriği
Bromobutil lastik tapası ve tapanın üzerinde; portakal-rengi, kolayca ayrılabilen (flip-off) kapağı olan alüminyum bilezik bulunan, tip I berrak cam flakon. Her flakon 100 mg temozolomid içerir.
TEMODAL 2.5 mg/ml kullanıma, 1 flakon içeren ambalajlarda sunulmaktadır
6.6 Beşeri tıbbi üründen arta kalanların imhası ve diğer özel önlemler
TEMODAL 2.5 mg/ml infüzyonluk çözelti için toza ihtiyatla dokunulmalıdır. Eldiven ve aseptik teknik kullanılmasına ihtiyaç vardır. TEMODAL 2.5 mg/ml deriye veya mukozaya temas edecek olursa, temas eden yer hemen, su ve sabunla iyice yıkanmalıdır.
Her flakon kullanıma, 41 ml steril enjeksiyonluk suyla hazırlanmalıdır. Kullanıma bu şekilde hazırlanan çözelti, mililitrede 2.5 mg temozolomid içerir. Kullanıma hazırlama işlemi sırasında flakon, avuç içerisinde nazik bir şekilde yuvarlanmalı ve asla çalkalanmamalıdır. Hazırlanan çözelti, çıplak gözle incelenmeli ve gözle görünen, partiküller içeren hiçbir flakon kullanılmamalıdır. Kullanıma hazırlanmış çözeltiden, reçete edilen total doza göre en fazla 40 ml çekilerek 250 ml'lik, boş bir infüzyon torbasına aktarılmadır. PVC-dışı materyalden yapılı infüzyon torbalarıyla hiçbir çalışma yapılmamıştır. İnfüzyon pompasının tüpü torbaya daldırılmalı, tüp boşaltılmalı ve daha sonra kapatılmalıdır. TEMODAL 2.5 mg/ml yalnızca 90 dakikalık bir intravenöz infüzyonla verilmelidir.
Geçimsizlik çalışmaları yapılmamış olduğundan bu tıbbi ürün, diğer tıbbi ürünlerle
karıştırılmamalı veya aynı infüzyon yoluyla eşzamanlı olarak verilmemelidir.
Bu tıbbi ürün yalnızca bir kullanımlıktır. Kullanılmamış herhangi bir ürün veya atık maddeler, lokal gereksinimlere göre imha edilmelidir.
7. RUHSAT SAHİBİ
Merck Sharp Dohme İlaçları Ltd. Şti. Büyükdere Cad. Astoria Kuleleri No:127 B Blok Kat:8 Esentepe 34394 İSTANBUL
Tel: (0212) 336 10 00 Fax: (0212) 215 27 33
8. RUHSAT NUMARASI(LARI)
134/3
9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
sağkalımın, yalnızca radyoterapi uygulanmasına kıyasla istatistik anlam taşıyacak şekilde uzamasıyla sonuçlanmıştır. (Şekil 1).
İlk ruhsat tarihi: 14.09.2012 Ruhsat yenileme tarihi:
10. KÜB'ün YENİLENME TARİHİ
İlaç Bilgileri
Temodal 2.5 mg/ml İnfüzyonluk Çözelti İçin Toz
Etken Maddesi: Temozolomid
Atc Kodu: L01AX03
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.