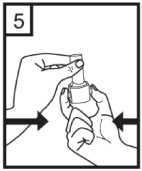
Coriva 12 Mcg İnhalasyon İçin Toz İçeren Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADICORİVA 12 mcg İnhalasyon İçin Toz İçeren Kapsül 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her inhalasyon tozu kapsülü, 12 mikrogram tiotropiuma eşdeğer, 14 mikrogram tiotropium bromür metanol solvat içermektedir. Verilen doz (inhalasyon cihazının ağızlık parçasından çıkan her bir doz) 10 mikrogram tiotropiumdur. Yardımcı madde:Yardımcı madde olarak, kapsül başına 16.686 mg laktoz monohidrat içermektedir. Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon tozu, sert kapsül Beyaz ya da sarımsı beyaz toz içeren, renksiz kapsüller. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarCORİVA, orta ve ağır KOAH (kronik obstrüktif akciğer hastalığı) olgularında düzenli kullanıldığında atak sıklığını azaltmakta, semptomları ve yaşam kalitesini düzeltebilmekte, ancakuzun dönemdeki FEV1 düşüşünü değiştirmemektedir. 4.2 Pozoloji ve uygulama şekliBu ilaç sadece inhalasyon yolu ile kullanılmalıdır. ErişkinlerPozoloji ve uygulama sıklığı:CORİVA'nın önerilen dozu, günde bir kez bir kapsül içeriğinin inhale edilmesidir. Önerilen dozdan daha fazla ilaç kullanılmamalıdır. Uygulama şekli:İnhalasyon her gün, günün aynı saatinde, inhalasyon cihazı kullanılarak yapılmalıdır. Kapsüller ağızdan alınmaz. CORİVA kapsül yutulmamalıdır.Bu ilacın doğru şekilde kullanımını sağlamak için hasta, doktor veya diğer sağlık çalışanlarınca, bu inhaleri nasıl kullanması gerektiği konusunda eğitilmelidir. İnhalasyon cihazının kullanım talimatları1- İnhalasyon cihazının kapağını çekerek çıkarın. 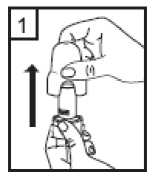 2- Bir elinizle inhalasyon cihazının alt kısmını tutarak diğer elinizle ağızlık kısmını okyönünde çevirerek açın. 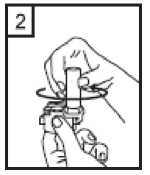 3- Şişeden bir kapsül çıkarınız (kullanmadan hemen önce çıkartılmalıdır). Kapsülü inhalasyoncihazının içindeki boşluğa yerleştirin. Kapsülün hazneye hangi yönde yerleştirildiği önemlideğildir. 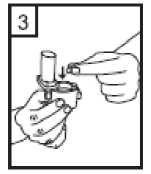
4-
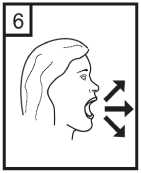
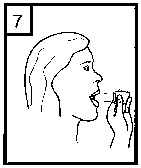
Ağızlık kısmını çevirerek kapatın.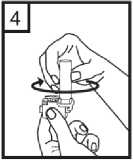 Bu bel ge5- İnhalasyon cihazını dik tutun, kenardaki düğmelere sadece bir kez tam olarak basın vebırakın. Kapsülde delikler açılacak ve nefes aldığınızda ilacın salıverilmesini sağlayacaktır. 6- Nefesinizi kuvvetlice dışarı verin. Önemli: Lütfen hiçbir zaman ağızlık parçasına doğru nefes vermeyiniz. 7- İnhalasyon cihazını ağzınıza kadar kaldırnız ve dudaklarınızı ağızlık parçasının çevresindesıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes almahızınızı, kapsülün titreştiğini duyacak ya da hissedecek şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeyebaşlayabilirsiniz. Basamak 6 ve 7'yi bir kez daha tekrarlayınız, bu kapsülün tamamen boşalmasını sağlayacaktır. 8- Kullanımdan sonra, boş kapsülü atın ve ağızlık kısmını kapatın. Kapsüller aşırı sıcaklıklara maruz bırakılmamalıdır. CORİVA kapsülleri az miktarda toz içermektedir, bu nedenle kapsüller yalnızca kısmen doludur. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrekleri bozuk olan hastalar CORİVA'yı önerilen dozlarda kullanabilirler. Orta ila şiddetli böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dk)CORİVA kullanımı yakından izlenmelidir (Bkz. bölüm 4.4 ve bölüm 5.2).Karaciğer yetmezliği:Karaciğerleri bozuk olan hastalar CORİVA'yı önerilen dozlarda kullanabilirler. (bkz. bölüm 5.2). Pediyatrik popülasyon:18 yaşından küçük hasta grubunda KOAH durumunda CORİVA'nın kullanım alanı yoktur. CORİVA'nın kistik fibrozda, çocuklar ve adolesanlardaki güvenliliği ve etkililiği belirlenmemiştir. Bu konuda veri yoktur. Geriyatrik popülasyon:Yaşlı hastalar CORİVA'yı önerilen dozlarda kullanabilirler. 4.3 KontrendikasyonlarCORİVA tiotropium bromüre, atropin veya türevlerine, örn. ipratropium ya da oksitropium veya builacınbileşenlerindenherhangi birinekarşıaşırıduyarlılıköyküsüolanhastalarda kontrendikedir (bkz. bölüm 2 ve bölüm 6.1; Yardımcı maddeler). 4.4 Özel kullanım uyarıları ve önlemleriCORİVA, günde bir kez kullanılan bir idame tedavisi bronkodilatörüdür, akut bronkospazm epizotlarının başlangıç tedavisinde, yani kurtarma tedavisi şeklinde kullanılmamalıdır. CORİVA uygulamasından sonra ani aşırı duyarlılık reaksiyonları oluşabilir. Diğer antikolinerjik ilaçlarla olduğu gibi, CORİVA dar-açılı glokomu kötüleştirebileceğinden, prostat hiperplazisi ya da mesane boynu obstrüksiyonu bulunan hastalarda idrar güçlüğüoluşturabileceğinden bu hastalarda dikkatle kullanılmalıdır. İnhalasyon yoluyla alınan ilaçlar, inhalasyonun indüklediği bronkospazma neden olabilirler. Yeni (<6 ay) miyokard enfarktüsü geçiren hastalarda; stabil olmayan veya yaşamı tehdit edici veya girişim gerektiren veya son 1 yıl içinde tedavisinde değişiklik yapılmış kardiyak aritmidurumlarında; son 1 yıl içinde kalp yetmezliği nedeniyle (NYHA Sınıf III veya IV) hastaneyeyatırılan hastalarda dikkatli kullanılmalıdır. Bu hastalar klinik çalışmalara dahil edilmemiştir vebu koşullar antikolinerjik etki mekanizmasından etkilenebilir. Renal fonksiyonlardaki azalmaya bağlı olarak plazma konsantrasyonu arttığı için, orta ile şiddetli böbrek yetmezliği olan hastalarda (kreatinin klerensi < 50 mL/dk) CORİVA, sadece beklenenyararlar potansiyel risklere göre daha üstünse kullanılmalıdır. Şiddetli böbrek yetmezliği olanhastalarda uzun süreli deneyim yoktur (bkz. bölüm 5.2). Bu b erg adresinde!ıiaOjfri^lebf^irinGk(iiaam Kontrol edilebilir. Güvemi elHastalara, CORİVA'nın doğru bir şekilde nasıl kullanılacağı öğretilmelidir. Hastalara tozun göze glokomunun ortaya çıkabileceği veya kötüye gidebileceği, konjonktivada konjesyon veya korneada ödem sonucunda gelişen göz kızarmasıyla birlikte gözde ağrı veya rahatsızlık hissi, geçici bulanık görme, haleler veya renkli görüntüler görme, akut dar açılı glokom belirtileriolabileceği konusunda hasta bilgilendirilmelidir. Bu semptomların herhangi bir kombinasyonugelişirse, hasta ilacı kesmeli ve hemen bir uzman hekime başvurmalıdır. Miyotik gözdamlalarının, etkili bir tedavi sağlamadıkları kabul edilmektedir. Antikolinerjik ilaçlarla gözlenen ağız kuruluğu uzun dönemde diş çürüklerine yol açabilir. CORİVA günde bir defadan daha sık kullanılmamalıdır. CORİVA kapsülleri yalnızca inhalasyon cihazı ile kullanılmalıdır. CORİVA kapsül başına 16.686 mg laktoz monohidrat içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olanhastaların bu ilacı kullanmamaları gerekir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDüzenli ilaç etkileşimi çalışmaları yürütülmemiş olmakla birlikte, tiotropium bromür inhalasyon tozu, KOAH tedavisinde yaygın olarak kullanılan diğer ilaçlar ile beraber, ilaç etkileşimineyönelik klinik bulgular görülmeksizin kullanılmıştır. Sempatomimetik bronkodilatatörler,metilksantinler, oral ve inhale steroidler, bu ilaçlar arasındadır. Uzun etkili beta agonistlerin veya inhale kortikosteroidlerin tiotropium maruziyetini değiştirmediği bulunmuştur. CORİVA'nın, diğer antikolinerjik içeren ilaçlarla birlikte uygulanması henüz çalışılmamıştır ve bu nedenle önerilmemektedir. Özel popülasyonlara ilişkin ek bilgiler:Özel veri bulunmamaktadır. Pediyatrik popülasyon:Özel veri bulunmamaktadır. 4.6 Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):Çocuk doğurma potansiyeli bulunan kadınlar, tedavi süresince tıbben etkili olduğu kabul edilen doğumkontrol yöntemleri kullanmalıdır.Gebelik dönemi: Gebe kadınlarda kullanımına ilişkin yeterli ve iyi kontrollü çalışmalara dayanan veri mevcut değildir. Hayvanlar çalışmaları, klinik olarak ilgili dozlarda üremeBu belge ksisiiesiEaıpsindaii dnunkUy]<Jih>?aeMidiırı^loir2iaEadinm^ilD^eümaatet^s(i^®ısajışyirg((JBkzgH5-tiifc)t-eİpysanlaraır. Dokümanın doğrulama kidu : 1S3k0RG83SHY3RG83Z1AxQ3NRQ3NR ,ır. CORİVA, olası yararlar fetüs üzerindeki olası riske adresinden krol edilebilir. Güvenli «elektronik imza aslı ilı_ --------v âmmemenden kontrol edilebilir. Güvenli «elektyönelik potansiyel risk
endir üstün olmadıkça, gebelik döneminde kullanılmamalıdır. Laktasyon dönemi:Tiotropium bromürün insanlarda süte geçip geçmediği bilinmemektedir. Laktasyondaki kemirgenlerde yapılan çalışmalarda, az miktarda tiotropiumun süte geçtiğibelirlenmiştir. Bununla birlikte, CORİVA emziren annelerde önerilmez. Tiotropium bromür uzunetkili bir maddedir. Emzirmenin kesilip kesilmeyeceği veya CORİVA tedavisine devam edilipedilmeyeceği kararı, emmenin bebeğe olan yararları ve CORİVA tedavisinin anneye yararlarıbirlikte değerlendirilerek verilmelidir.Üreme Yeteneği/Fertilite:4.7 Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma becerileri üzerindeki etkilerine yönelik bir çalışma yapılmamıştır. Baş dönmesi, bulanık görme veya baş ağrısı olaylarının ortaya çıkması, araç ve makine kullanmabecerilerini etkileyebilir. 4.8 İstenmeyen etkilerGüvenlilik profili özetiListelenmiş olan istenmeyen etkilerin çoğu, CORİVA'nın antikolinerjik özelliklerine bağlanabilir. Advers reaksiyonların tablolu özetiAşağıda listelenen advers ilaç reaksiyonları için belirlenen sıklıklar, dört hafta ile dört yıl arasında değişen tedavi dönemlerini kapsayan 28 plasebo kontrollü klinik araştırmaya aithavuzun tiotropium grubunda (9,647 hasta) gözlenen advers reaksiyonların ham (crude) insidansoranlarına (yani, tiotropiuma atfedilen olaylar) dayanmaktadır. Aşağıdaki listede belirtilen istenmeyen etkilerin sıklık oranları şöyle tanımlanır: Çok yaygın > 1/10; yaygın> 1/100 ilâ < 1/10; yaygın olmayan > 1/1.000 ilâ < 1/100; seyrek > 1/10.000 ilâ < 1/1.000; çok seyrek < 1/10.000; Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) Metabolizma ve beslenme hastalıklarıBilinmiyor: Dehidratasyon Sinir sistemi hastalıklarıYaygın olmayan: Baş dönmesi, baş ağrısı, tat alma bozuklukları Seyrek: Uykusuzluk Göz hastalıklarıYaygın olmayan: Bulanık görme Seyrek: Glokom, göz içi basıncında artış Kardiyak hastalıklarYaygın olmayan: Atriyal fibrilasyon Seyrek: Supraventriküler taşikardi, taşikardi, palpitasyonlar Solunum, göğüs bozuklukları ve mediyastinal hastalıklarYaygın olmayan: Farenjit, disfoni, öksürük Seyrek: Bronkospazm, burun kanaması, larenjit, sinüzit Gastrointestinal hastalıklarYaygın: Ağız kuruluğu Yaygın olmayan: Gastroözofajiyal reflü hastalığı, konstipasyon, orofarenjiyal kandidiyazis Seyrek: İntestinal obstrüksiyon (paralitik ileus dahil), gingivit, glossit, disfaji, stomatit, bulantı Bilinmiyor: Diş çürümesi Deri ve deri altı dokusu hastalıklarıYaygın olmayan: Döküntü Seyrek: Ürtiker, kaşıntı, anjiyoödem Bilinmiyor: Deri enfeksiyonu ve deri ülseri, deride kuruluk Bağışıklık sistemi hastalıklarıSeyrek: Aşırı duyarlılık reaksiyonları (ani reaksiyonlar dahil), Bilinmiyor: Anafilaktik reaksiyon Kas-iskelet, bağ dokusu ve kemik hastalıklarıBilinmiyor: Eklemlerde şişme Böbrek ve idrar yolu hastalıklarıYaygın olmayan: İdrar retansiyonu, idrar yapmada güçlük Seyrek: İdrar yolu enfeksiyonu Seçilmiş advers reaksiyonların açıklamasıKontrollü klinik çalışmalarda yaygın olarak gözlenen istenmeyen etkiler, hastaların yaklaşık %4'ünde ortaya çıkan ağız kuruluğu gibi antikolinerjik etkilerdir. 28 klinik çalışmada tiotropiumile tedavi edilen 9.647 hastanın 18'i (%0.2). Ağız kuruluğu nedeniyle çalışmayı bırakmıştır. Antikolinerjik etkilerle tutarlı ciddi istenmeyen etkiler arasında, glokom, konstipasyon, paralitik ileus dahil intestinal obstrüksiyon ve idrar retansiyonu bulunur. Diğer özel popülasyonlarİlerleyen yaşla birlikte antikolinerjik etkilerde artış görülebilir. Bu bel geŞüpheli advers reaksiyonların raporlanması:Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanaksağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr;[email protected];4.9 Doz aşımı ve tedavisiYüksek dozlarda CORİVA, antikolinerjik bulgu ve semptomlara yol açabilir. Ancak, sağlıklı gönüllülerde 340 mikrogram tiotropium dozuna kadar inhale edilen tek doz sonrasında, hiçbir sistemik antikolinerjik istenmeyen etki görülmemiştir. Ek olarak, sağlıklıgönüllülerde 170 mikrogram doza kadar tiotropium bromürün 7 gün uygulanmasını takiben ağızkuruluğu dışında ilgili bir advers etki gözlenmemiştir. KOAH hastalarında yapılan çoklu doz birçalışmada, 4 hafta boyunca günlük maksimum 43 mikrogram tiotropium bromür uygulanması ileönemli bir istenmeyen etki gözlenmemiştir. Sağlıklı gönüllülerde, günde bir kez 141 mg dozunda tekrarlı inhalasyonları izleyerek, ağız kuruluğu ile birlikte bilateral konjonktivit görülmüş ve bu durum tedavi halen sürmekte ikenortadan kaybolmuştur. KOAH'ı olan kişilerde dört hafta süreyle, günlük maksimum 36mikrogram tiotropium dozları ile uygulanan çok-dozlu bir çalışmada gözlenen tiotropiumabağlanabilecek tek istenmeyen olay, ağız kuruluğu olmuştur. Tiotropium kapsüllerinin oral yoldan yanlışlıkla alınması ile akut intoksikasyon pek olası değildir, çünkü oral yoldan biyoyararlanımı düşüktür. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Obstruktif akciğer hastalıkları için diğer ilaçlar, inhalerler, Antikolinerjikler, tiotropium ATC kodu:R03B B04 Etki mekanizmasıTiotropium, klinik tıpta genellikle antikolinerjik olarak adlandırılan, uzun etkili spesifik bir muskarinik reseptör antagonistidir. Tiotropium bromür, bronşiyal düz kaslarda bulunanmuskarinik reseptörlere bağlanarak, parasempatik sinir uçlarından salıverilen asetilkolininkolinerjik (bronkokonstrüktif) etkilerini inhibe eder. M1'den M5'e kadar olan muskarinik reseptöralt-tiplerine karşı benzer bir afinite gösterir. Hava yollarında, M3 reseptörlerini kompetetif vegeri dönüşümlü olarak inhibe ederek gevşeme sağlar. Antagonizmanın yarışmacı ve geri-dönüşümlü olduğu, insan ve hayvan kaynaklı reseptörlerde ve izole organ preparatlarındagösterilmiştir. Klinik öncesi in vitroin vivoçalışmalarda, bronkoprotektif etkiler dozaadresiı.üveenmsiynsdıDndomko®RSkYiiifeıftRöen M3reseptörlerinden son derecede yavaş ayrışmasına bağlıdır; ipratropium ile gözlenenden anlamlı derecede daha uzun bir ayrışma yarı ömrüne sahiptir. N-kuaterner bir antikolinerjik olaraktiotropium, inhalasyon yoluyla uygulandığında, topikal olarak (bronko-) selektiftir; sistemikantikolinerjik etkilere yol açmadan önce kabul edilebilir bir terapötik aralık gösterir. Farmakodinamik etkilerTiotropium inhalasyonunu izleyen bronkodilatasyon, esas olarak bölgeye özgü (havayolları üzerinde) bir etki olup, sistemik bir etki değildir. M2 reseptörlerinden ayrışması, M3 reseptörlerindekinden daha hızlıdır. Fonksiyonel in vitro çalışmalarda (kinetik olarak kontrol edilmiş), M3 reseptörleri için reseptör alt tip selektivitesininM2 reseptörlerinden fazla olduğu gösterilmiştir. Yüksek düzeydeki potens ve reseptörden yavaşayrışmanın klinikteki karşılığı, KOAH'lı kişilerdeki belirgin ve uzun etkili bronkodilatasyondur. Kardiyak elektrofizyolojiElektrofizyoloji: QT için özel olarak tasarlanmış ve 53 sağlıklı gönüllüyü kapsayan bir çalışmada, 12 gün boyunca 18 mcg ve 54 mcg (yani, terapötik dozun 3 katı) CORİVA uygulanması, EKG'deQT intervalini anlamlı şekilde uzatmamıştır. Klinik etkililik ve güvenlilikKlinik geliştirme programında 2663 KOAH hastası üzerinde yürütülen (1308'ine tiotropium bromür monohidrat verilmişti) dördü bir yıl süreli, ikisi ise altı ay süreli randomize, çift-körçalışma bulunmaktaydı. Bir yıllık program, iki plasebo kontrollü ve iki tane ise ipratropiumkontrollü araştırmadan oluşmuştur. Altı ay süreli araştırmalar, hem salmeterol hem de plasebo kontrollüydü. Bu çalışmalar, akciğer fonksiyonlarının, dispne, KOAH'ta alevlenme şeklindeki sağlıkla ilgili sonuçlanım ölçümlerininve sağlıkla ilişkili yaşam kalitesinin hastaların kendileri tarafından değerlendirilmesiniiçeriyordu. Akciğer fonksiyonuSözü edilen bu çalışmalarda, günde bir kez uygulanan tiotropium bromür monohidrat, akciğer fonksiyonlarında (bir saniyelik zorlu ekspirasyon hacmi, FEV1 ve zorlu vital kapasite, FVC)ilk dozu izleyen 30 dakika içinde belirgin iyileşmeye yol açmış ve bu etki 24 saat süreyle kalıcıolmuştur. Bronkodilatasyon büyük çoğunlukla üçüncü gün gözlenmeye başlanmış vefarmakodinamik kararlı duruma bir hafta içinde ulaşılmıştır. Tiotropium bromür monohidratsabah ve akşam doruk ekspiratuar akım hızı (PEFR) düzeylerini, hastalarda yapılan günlükkayıtlarda ölçüldüğü şekliyle, anlamlı olarak iyileştirmiştir. Tiotropium bromürün bronkodilatöretkisi, herhangi bir tolerans belirtisi olmaksızın, 1 yıl boyunca devam etmiştir. 105 KOAH hastasıyla yürütülen randomize, plasebo kontrollü klinik çalışmada, plasebo ile karşılaştırıldığında, sabah veya akşam uygulanmasından bağımsız olarak, 24 saat süreylebronkodilatasyon etkisinin devam ettiği gösterilmiştir. Bu bel geUzun dönem klinik çalışmalar (6 ay ve 1 yıl)Dispne, Egzersiz toleransıTiotropium bromür dispnede anlamlı iyileşmeler sağlamıştır (Geçiş Dispne Endeksi (Transition Dysponea Index) kullanılarak değerlendirilmiştir). Bu iyileşme, tedavi dönemi boyunca devametmiştir. Dispnedeki iyileşmenin egzersiz toleransı üzerindeki etkisi, 433 orta-şiddetli KOAH hastasında yürütülen, 2 randomize, çift kör, plasebo kontrollü çalışmada incelenmiştir. Bu çalışmalarda, 6hafta süreli tiotropium bromür tedavisi, bisiklet ergometrisinin semptomlarla sınırlanandayanıklılık süresini anlamlı oranda (plasebo ile karşılaştırıldığında, %75 maksimum çalışmakapasitesinde %19.7 (Çalışma A) ve %28.3 (Çalışma B) oranında) iyileştirmiştir. Sağlıkla ilişkili yaşam kalitesi492 hastada yürütülen, 9 ay süreli, randomize, çift kör, plasebo kontrollü klinik çalışmada, tiotropium bromür, St. George Solunum Anketi (St. George's Respiratory Questionnaire =SGRQ) total skoru ile değerlendirilen sağlıkla ilişkili yaşam kalitesi iyileştirilmiştir. Tiotropiumbromür ile tedavi edilen hastalardan SGRQ total skorunda anlamlı iyileşmeler (yani >4 birim)gösteren hastaların oranı, plasebo ile karşılaştırıldığında, %10.9 daha yüksek bulunmuştur.(Tiotropium bromür gruplarında %59.1'e karşı plasebo grubunda %48.2, p=0.029). Gruplararasındaki ortalama farklılık 4.19 birimdir (p=0.001; güven aralığı: 1.69-6.68). SGRQ skoru altalanlarındaki iyileşmeler, semptomlar için: 8.19 birim, aktivite için: 3.91 birim ve günlükyaşam üzerindeki etkileri için: 3.61 birimdir. Bu alt alanların tümündeki iyileşmeler istatistikselolarak anlamlıdır. KOAH alevlenmeleri1.829 orta - şiddetli KOAH hastasını içeren bir randomize, çift kör, plasebo kontrollü çalışmada, tiotropium bromür KOAH alevlenmesi yaşayan hastaların oranında istatistiksel olarak anlamlı birazalma (%32.2'den %27.8'e) sağlamış ve alevlenme sayısında da istatistiksel olarak anlamlışekilde %19 oranında azaltmıştır. (1.05 olay/maruziyet hasta yılından 0.85 olay/maruziyet hastayılına). Ayrıca, KOAH alevlenmesi nedeniyle hastaneye yatan hastaların oranı, tiotropiumbromür grubunda %7.0 ve plasebo grubunda %9.5 olmuştur (p=0.056). KOAH nedeniylehastaneye yatanların sayısı %30 oranında azalmıştır. (0.25 olay/maruziyet hasta yılından 0.18olay/maruziyet hasta yılına). Önceki yıl içinde alevlenme öyküsü olan 7.376 KOAH hastasında 1 yıl süreli randomize, çift kör, çift sağır maskeleme (double dummy), paralel gruplu çalışmada, günde bir kez 18mikrogram tiotropium bromür tedavisi ile, günce iki kez 50 mikrogram salmeterol HFA pMDItedavisinin, orta şiddetli alevlenmelerin insidansı üzerindeki etkisi karşılaştırılmıştır.
§ Zamana karşı olay analizleri, Cox orantılı tehlike regresyon modeli kullanılarak merkez (havuzlanmış) ve kovaryant olarak tedavi ile yapılmıştır; oran, tehlike oranını refere eder.Hastaların ilk çeyregi için zaman (gün) hesaplanamaz, çünkü şiddetli alevlenme yaşayanhastaların oranı çok düşüktür. *Olay yaşayan hastaların sayısı, havuzlanmış merkezle tabakalandırılmış Cochran-Mantel-Haenszel testi kullanılarak analiz edilmiştir; oran, risk oranını işaret eder. Salmeterol ile karşılaştırıldığında, tiotropium bromür ilk alevlenmeye kadar geçen zamanı uzatmış (187 güne karşı 145 gün), riskte %17 oranında düşme sağlamıştır (tehlike oranı 0.83;%95 güven aralığı (GA) 0.77-0.90; p<0.001). Tiotropium bromür aynı zamanda ilk şiddetli alevlenmeye (hastaneye yatma) kadar geçen zamanı da uzatır (tehlike oranı 0.72; %95 GA 0.61-0.85; p<0.001). Uzun dönemli klinik çalışmalar (1 yıldan uzun, 4 yıla kadar)5.993 randomize hastada yürütülen (3.006 hasta plasebo ve 2.987 hasta tiotropium bromür almıştır) 4 yıl süreli, randomize, çift kör, plasebo kontrollü klinik çalışmada, tiotropium bromürile elde edilen FEV1 iyileşmesi, plasebo ile karşılaştırıldığında, 4 yıl süreyle tutarlı bir seyirizlemiştir. Tiotropium bromür grubunda >45 ay tedaviyi tamamlayan hasta oranı plasebo ilekarşılaştırıldığında daha yüksektir (%63.8'e karşı %55.4, p<0.001). FEVfdeki azalmanın yıllıkoranı tiotropium bromür ile plasebo arasında benzerdi. Tedavi sırasında ölüm riskinde %16azalma mevcuttu. Ölüm insidans hızı plasebo grubunda 4.79/100 hasta yılına karşı tiotropium Bu beiEkritautcieitiitiiaim^^l^ıtiDoman!pi*i&3âı ikceys, %9 5adresinden kontrol edilebilirGüvenJi elektronik imza, aslı ile aynıdır. Dokümanın doğrulama kodu : 1S3k0RG83SHY3RG83Z1AxQ3N.RQ3NR .GA=0.73, 0.97). Tiotropium ile tedavi respiratuvar yetmezlik (advers olay bildirimleri ile kaydedilmiştir) riskini %19 oranında (2.09'a karşı 1.68 vaka/100 hasta yılı, rölatif risk (tiotropium/plasebo)=0.81, %95GA=0.65, 0.999) düşürmüştür. Tiotropium aktif kontrollü çalışmaUzun süreli, geniş bir randomize, çift kör, aktif kontrollü, gözlem süresi 3 yıla kadar uzayan çalışmada tiotropium inhalasyon tozu ile tiotropium inhalasyon çözeltisinin etkililiği vegüvenliliği karşılaştırmıştır (5.694 hasta tiotropium inhalasyon tozu, 5.711 hasta tiotropiuminhalasyon çözeltisi almıştır). Primer sonlanım noktaları, ilk KOAH alevlenmesine kadar geçenzaman, tüm nedenlere bağlı mortaliteye kadar geçen zaman ve bir alt çalışmada (906 hasta)çukur FEV 1'dir (dozlama öncesi). İlk KOAH alevlenmesine kadar geçen zaman, tiotropium inhalasyon tozu ve tiotropium inhalasyon çözeltisi çalışmasında sayısal olarak benzerdir (tehlike oranı (tiotropium inhalasyontozu/tiotropium inhalasyon çözeltisi) 1,02'dir, %95 GA 0,97-1,08). İlk KOAH alevlenmesinekadar geçen medyan gün sayısı, tiotropium inhalasyon tozu için 719 gün ve tiotropium Tiotropium inhalasyon tozunun bronkodilatör etkisi 120 hafta boyunca devam etmiştir ve tiotropium inhalasyon çözeltisi ile benzerdir. Tiotropium inhalasyon çözeltisine karşı tiotropiuminhalasyon tozu için çukur FEV1'deki ortalama farklılık 0,01 litredir (%95 GA -0,018-0,038 L). Tiotropium inhalasyon çözeltisi ile tiotropium inhalasyon tozunu karşılaştıran pazarlama sonrası TIOSPIR çalışmasında, vital durum takibini de içeren tüm nedenlere bağlı mortalite, çalışmasırasında tiotropium inhalasyon tozu ve inhalasyon çözeltisi için benzer bulunmuştur (tehlikeoranı (tiotropium inhalasyon tozu/tiotropium inhalasyon çözeltisi) 1,04, %95 GA 0,91-1,19). Pediyatrik popülasyonAvrupa İlaç Ajansı, KOAH ve kistik fibroz için pediyatrik popülasyonun tüm alt gruplarında tiotropium bromür ile yapılacak çalışmaların sonuçlarını sağlama zorunluluğunu kaldırmıştır(pediyatrik kullanım ile ilgili bilgiler için bkz. bölüm 4.2). 5.2 Farmakokinetik özelliklerGenel özelliklerTiotropium bromür, kiralite göstermeyen bir kuaterner amonyum bileşiğidir ve suda kısmen çözünür. Tiotropium bromür, kuru toz inhalasyonu şeklinde uygulanır. İnhalasyon yolu ileuygulamada genel olarak, verilen dozun büyük çoğunluğu gastrointestinal kanalda, daha az birkısmı ise, amaçlanan organ olan akciğerde tutulur. Aşağıda açıklanan farmakokinetik verilerinçoğu, tedavi için önerilenden daha yüksek dozlar ile elde edilmiştir. Emilim:Sağlıklı genç gönüllüler tarafından kuru toz inhalasyonundan sonra elde edilen %19.5 düzeyindeki mutlak biyoyararlanım değeri, akciğere ulaşan bölümün yüksek ölçüde Bu beliMza eleliiiıyıhcaCİiâiaatâtaaıjm^tikıştıii ü(tThttPiiı.^iye^f!ıı^tı^iitckıaterneramonyum bileşiği), tiotropiumun gastro-intestinal ökanaldan iyi absorbe ediimemesrbeKlemr.Aynı nedenle besinlerin tiotropium absorpsiyonu üzerinde etkili olması beklenmemektedir. Oral tiotropium solüsyonları, %2-3 düzeyinde bir mutlak biyoyararlanıma sahiptirler. Maksimumplazma tiotropium konsantrasyonları, inhalasyondan 5-7 dakika sonra gözlenmiştir.Kararlı durumda doruk tiotropium düzeyleri KOAH hastalarında 12.9 pg/ml'dir ve çok kompartmanlı modele uygun olarak, hızla azalır. Kararlı durum çukur plazma konsantrasyonları1.71 pg/ml'dir.Dağılım:İlaç plazma proteinlerine %72 oranında bağlanır ve 32 L/kg'lık bir dağılım hacmi gösterir. Akciğerdeki lokal konsantrasyonlar bilinmemektedir, ancak uygulama şekli, akciğerlerde önemlioranda daha yüksek konsantrasyonların varlığını düşündürmektedir. Sıçanlarda yapılançalışmalarda, tiotropiumun kan beyin bariyerini önemli bir düzeyde geçmediği gösterilmiştir.Biyotransformasyon:Biyotransformasyona uğrama derecesi küçüktür. Bu durum, sağlıklı genç gönüllülerde bir doz intravenöz uygulamadan sonra %74 oranında değişmemiş maddenin idrarla atılmasıylabelirlenmiştir. Ester yapısındaki tiotropium, enzimatik olmayan bir yol ile parçalanarak, bir alkololan N-metilskopin ve ditiyenilglikolik aside parçalanır; bu maddelerin her ikisi de muskarinikreseptörlere bağlanmazlar.İnsan karaciğer mikrozomları ve insan hepatositleriyle yapılanin vitrodeneyler bir miktar ilacın (intravenöz uygulama sonrasında dozun %20'sinden azı), sitokrom P450'ye bağımlı oksidasyonve daha sonrasında glutatyon konjügasyonu yoluyla, çeşitli Faz II metabolitlerine metabolizeolduğunu düşündürmektedir. Bu enzimatik yol CYP450 2D6 (ve 3A4) inhibitörleri olan kinidin,ketokonazol ve gestoden ile inhibe edilebilir. Böylelikle CYP450 2D6 ve 3A4, dozun küçük birbölümünün eliminasyonundan sorumlu metabolik yolda yer almaktadırlar. Tiotropium bromür,supra- terapötik konsantrasyonlarda bile, insan karaciğer mikrozomlarındaki sitokrom P4501A1, 1A2,2B6, 2C9, 2C19, 2D6, 2E1 ya da 3A'yı inhibe etmez.Eliminasyon:Tiotropiumun efektif yarılanma ömrü, KOAH hastalarında, 27-45 gündür. Sağlıklı genç gönüllülerde intravenöz uygulanan dozdan sonra total klerens 880 mL/dk, bireyler arasıdeğişkenlik ise %22 oranındaydı. İntravenöz uygulanan tiotropium, idrar yoluyla esas olarakdeğişmemiş halde atılır (%74). KOAH hastalarında kuru toz inhalasyonunundan sonra kararlıduruma kadar üriner ekskresyon, 24 saat içinde, değişmemiş ilacın %7'sidir (1.3 pg) geri kalanıbüyük oranda barsaklarda emilmemiş ilaç halinde bulunur ve feçes ile elimine edilir.Tiotropiumun renal klerensi, kreatinin klerensini geçer; bu durum idrara sekrete olduğunu işaretetmektedir. KOAH'lı kişiler tarafından, günde bir kez kronik inhalasyondan sonra,farmakokinetik kararlı duruma 7nci günde ulaşılır ve daha sonrasında herhangi bir birikimgörülmez.Bu belJ^e(5ği0jSaaı]|}]pltek!İr9n^klSn9aİö}lIlHlıa,VUyiır^u3arEİfİktronik olarak imzalanmıştır. Doküman https://www.turkiye.gov.tr/saglik-titck-ebys adresinden kontrol edılebılır."Güvenlı elektronik imza aslı ile aynıdır. Dokümanın doğrulama kodu : 1S3k0RG83SHY3RG83Z1AxQ3NRQ3NRTiotropium, gerek intravenöz uygulama, gerekse kuru toz inhalasyonu sonrasında terapötik aralıkta, formülasyondan bağımsız olarak, doğrusal farmakokinetik gösterir.Hastalardaki karakteristik özelliklerYaş:Pediyatrikpopülasyon:Bkz 4.2.Geriyatrik popülasyon:Esas olarak böbrekler yoluyla atılan bütün ilaçlardan beklendiği gibi, ileri yaş tiotropiumun renal klerensinde bir azalma ile ilişkili bulundu (<65 yaşındaki KOAHhastalarında 365 ml/dk iken, >65 yaşındaki KOAH hastalarında 271 ml/dk). Bu durum, EAAo-6,ssveya Cmaks,ssdeğerlerinde ilişkili bir artışla sonuçlanmamıştır.Böbrek yetmezliği:KOAH hastalarında tiotropiumun inhalasyonla kararlı duruma kadar günde bir kez uygulamalarını takiben, normal böbrek fonksiyonu olan hastalarla (CLCR>80 ml/dk)kıyaslandığında, hafif böbrek bozuklukları (CLCR50-80 ml/dk), hafifçe daha yüksek EAAo-6,ssdeğerleri ile (%1.8-30 daha yüksek) sonuçlanmış, Cmaks,ssdeğerleri ise benzer bulunmuştur.Böbrek fonksiyonları normal KOAH hastalarıyla kıyaslandığında, orta ile şiddetli böbrek bozukluğu (CLCR<50 mL/dak) olan KOAH hastalarında intravenöz tiotropium uygulaması,plazma konsantrasyonlarının iki katına çıkmasıyla sonuçlanmış (EAA0-4saatdeğerinde %82 artışve Cmaksdeğerinde %52 artış) ve bu durum kuru toz inhalasyonundan sonraki plazmakonsantrasyonları ile doğrulanmıştır.Karaciğer yetmezliği:Karaciğer yetersizliğinin tiotropium farmakokinetiği üzerinde önemli bir etkisinin olması beklenmemektedir. Tiotropium büyük çoğunlukla renal eliminasyon yoluyla (sağlıklı gençgönüllülerde %74) ve enzimatik olmayan basit ester parçalanmasıyla muskarinik reseptörlerebağlanmayan ürünlere ayrılarak vücuttan temizlenmektedir.Japon KOAH hastalarıÇalışmalar-arası karşılaştırmada, tiotropium inhalasyonunu takiben, kararlı durumda dozlamadan 10 dakika sonra, Japon hastalardaki ortalama doruk tiotropium konsantrasyonları, beyaz ırktanKOAH hastalarına göre, %20-70 daha yüksek bulunmuştur. Bununla birlikte, Japon hastalardabeyaz ırktan olanlara göre daha yüksek mortalite veya kardiyak risk sinyali saptanmamıştır. Diğeretnik orijinden ve ırktan kişilerle ilgili farmakokinetik veriler yetersizdir.Farmakokinetik/Farmakodinamik ilişkilerDoğrudan bir ilişki yoktur.5.3 Klinik öncesi güvenlilik verileriGüvenlilik farmakolojisi, tekrarlı doz toksisitesi ve üreme toksisitesi için yürütülen konvansiyonel çalışmalarda gözlenen birçok etki, tiotropium bromürün antikolinerjik özellikleriyle açıklanabilir.Tipik olarak, hayvanlarda, gıda tüketiminde azalma, vücut ağırlığı artışının inhibisyonu, ağız veBu beJgıüiiVt®Sİ#ılklWluİt,İnlZlkE)!ffl1asyöildıailefâPbrİMktiflkIfezSühmuŞMlhızındaadresıadrii:koftgöf;dl»i<iüifnlTl(§kirânkıımia)z?li;io^nsd(r(;Dç?aiıifinına!?ğııte^ k&^(ie3c!ı<M83(3if(3r;i(ifigilliAeiiNlei3Nsıçan vegöf;dl»i<iüifnlTl(§kirânkıımia)z?li;io^nsd(r(;Dç?aiıifinına!?ğııte^ k&^(ie3c!ı<M83(3if(3r;i(ifigilliAeiiNlei3Nsıçan vefarelerde rinit ve nazal boşluk ve larinkste epitelyal değişikliklerle ortaya çıkan hafif solunum yolu irritasyonu ile sıçanlarda proteinli depozitlerle birlikte prostatit ve idrar torbasında taş oluşumudur. Gebelik, embriyonal/fötal gelişim, doğum veya postnatal gelişim üzerindeki zararlı etkiler, sadece anneye toksik olan doz düzeylerinde gösterilmiştir. Tiotropium bromür, sıçanlar ve tavşanlardateratojenik değildir. Sıçanlarda yürütülen genel bir üreme ve fertilite çalışmasında, ilaç uygulananebeveynlerin veya yavrularının fertilite veya çiftleşme performansı üzerinde, hiçbir dozda, hiçbiradvers etki saptanmamıştır. Solunum (irritasyon) ve ürogenital (prostatit) değişiklikler ve üreme toksisitesi, terapötik maruziyetin 5 katından daha yüksek lokal veya sistemik maruziyet düzeylerinde gözlenmiştir.Genotoksisite ve karsinojenik potansiyel çalışmaları, insanlar için özel bir tehlike göstermemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiLaktoz monohidrat (inek sütünden elde edilen süt proteini) 6.2 GeçimsizliklerCORİVA'nın bilinen bir geçimsizliği yoktur. 6.3 Raf ömrü24 ay İlk açıldıktan sonra 60 gün 6.4 Saklamaya yönelik özel tedbirler25oC' nin altında oda sıcaklığında saklanmalıdır. 6.5 Ambalajın niteliği ve içeriğiCORİVA 12 mcg İnhalasyon İçin Toz İçeren Kapsül, 30 kapsül içeren çocuk emniyet kapaklı HDPE şişede, inhalasyon cihazı ve kullanma talimatı ile birlikte karton kutuda piyasayasunulmaktadır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürün ya da atık materyaller, Atık Yönetimi Yönetmeliği hükümlerine uygun olarak imha imha edilmelidir. Son kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre ve Şehircilik Bakanlığınca belirlenen toplama sistemine veriniz. adresinden kontrRUHSATvSAHİBİik imza aslı ile aynıdır. Dokümanın doğrulama kodu : 1S3k0RG83SHY3RG83Z1AxQ3NRQ3NRAbdi İbrahim İlaç San. ve Tic. A.Ş. Reşitpaşa Mah. Eski Büyükdere Cad. No.4 34467 Maslak / Sarıyer/ İSTANBULTel: 0212 366 84 00Faks: 0212 276 20 20 8. RUHSAT NUMARASI2018/328 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 13.06.2018 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriCoriva 12 Mcg İnhalasyon İçin Toz İçeren KapsülEtken Maddesi: Tiotropium Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.