Fenoster Combi 12 Mcg/200 Mcg İnhalasyon İçin Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADI FENOSTER-COMBİ 12 mcg/200 mcg İnhalasyon İçin Kapsül 2. KALİTATİF VE KANTİTATİF BİLEŞİMFORALES 12 mikrogram inhaler kapsülEtkin madde:
12,536 mcg
Formoterol fumarat dihidrat (12 mcg Formoterol fumarat'a eşdeğer) Yardımcı madde:
24,987464 mg
Laktoz monohidrat (inek sütü kaynaklı) BUDOLER 200 mcg inhalasyon için kapsül Etkin madde: 200 mcg 19,8 mg Budesonid Yardımcı madde: Laktoz monohidrat (inek sütü kaynaklı) Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORM Sert kapsülde inhalasyon tozu FORALES Beyaz veya beyazımsı toz içeren şeffaf kapsüller. BUDOLER Beyaz veya beyazımsı toz içeren 3 no'lu açık pembe renkli kapak ve şeffaf gövdeli kapsüller. 4. KLİNİK ÖZELLİKLER Astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. Orta ve ağır KOAH olgularında semptomları ve atak sıklığını azaltır. 1 / 29 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi: Astım: FENOSTER-COMBİ, astım ataklarının akut semptomlarım hafifletmek için kullanılmamalıdır. Akut atak durumunda, kısa etkili bir beta2-agonist kullanılmalıdır (bkz.bölüm 4.4.). Yetişkinler: FORALES FORALES dozu, hastanın kişisel ihtiyacına göre ayarlanmalı ve terapötik amaca ulaşılmasını sağlayan en düşük dozda uygulanmalıdır. Doz, önerilen maksimum dozu aşacakşekilde artırılmamalıdır (bkz. bölüm 4.2.). Düzenli idame tedavisi için, günde iki defa 1 inhaler kapsül (12 mikrogram formoterole eşdeğer) kullanılması önerilir. Önerilen en yüksek idame dozu günde 48 mikrogramdır. Dahaciddi vakalarda günde 2 kez 2 inhaler kapsül verilir. Gerekirse belirtilerin hafifletilmesi için, önerilen en yüksek günlük doz olan 48 mikrogramı aşmamak kaydıyla her gün 1-2 ilave kapsül kullanılabilir. Ancak haftada iki günden fazlailave dozlara ihtiyaç olduğu takdirde doktora danışılmalı ve tedavi yenidendeğerlendirilmelidir, çünkü bu durum hastalığın ağırlaştığının belirtisi olabilir. BUDOLER Tek bir kapsül içindeki en düşük doz 200 mikrogramdır. Eğer 200 mikrogramdan düşük tek bir doz gerekliyse bu ürün kullanılamaz. Hafif şiddette astımı olan yetişkinlerin tedavisine, günde bir kere 200 mikrogram olarak belirlenmiş minimum etkili dozla başlanabilir. Normal idame dozu günde iki defa 1-2(200-400 mikrogram) inhalasyon kapsülüdür (günde 400-800 mikrograma eşdeğer). Şiddetli astım atakları sırasında, hasta oral kortikosteroid tedavisinden budesonid inhalasyon tedavisine geçirilirken veya oral kortikosteroid tedavi dozu azaltıldığında günlük doz (2-4'e bölünerek) 1600 mikrograma kadar yükseltilebilir. İdame tedavisinin sağlanabilmesi için gereken en düşük düzey elde edilecek şekilde doz kişiye göre ayarlanmalıdır. BUDOLER düzenli olarak her gün alınmalıdır. Doz, bireyselolarak tekrar ayarlanmalıdır. Hastanın bir inhalasyon cihazından diğerine geçirilmesi sırasındadoz, kişiye göre tekrar ayarlanmalıdır. Çocuklar (6 yaş ve üzeri):FORALESDüzenli idame tedavisi için, günde iki defa 1 inhaler kapsül (12 mikrogram) kullanılması önerilir. Önerilen en yüksek doz günde 24 mikrogramdır. FORALES sadece bir inhalekortikosteroide (örneğin, BUDOLER) ilave olarak reçete edilmeli ve kullanılmalıdır. BUDOLER6 yaşın altındaki çocuklarda klinik deneyim olmadığından, budesonid bu yaş grubundakihastalarda kullanılmamalıdır. Hafif şiddette astımı olan çocuklarda tedavi günde bir kere 200 mikrogram ile başlatılabilir. Normal idame dozu günde iki defa 200 mikrogramdır (günde 400 mikrograma eşdeğer).Azami günlük doz 800 mikrogramdır. BUDOLER erişkinlerin denetimi altındakullanılmalıdır. Medikal cihazın kullanımı, çocuğun inhaleri doğru bir şekildekullanabilmesine bağlıdır. Kronik obstrüktif akciğer hastalığı (KOAH):Yetişkinler:FORALESDüzenli idame tedavisi için, günde iki defa 1 inhaler kapsül (12 mikrogram). Azami günlük doz 48 mikrogramdır. BUDOLERNormal idame dozu günde iki defa 200-400 mikrogramdır (günde 400-800 mikrograma eşdeğer). Gerekli olduğunda, hasta oral kortikosteroid tedavisinden BUDOLER inhalasyon tedavisine geçirilirken veya oral kortikosteroid tedavi dozu azaltıldığında günlük doz (2-4'ebölünerek) 1600 mikrograma kadar yükseltilebilir. İdame tedavisinin sağlanabilmesi için gereken en düşük düzey elde edilecek şekilde doz kişiye göre ayarlanmalıdır. BUDOLER düzenli olarak her gün alınmalıdır. Doz, bireyselolarak tekrar ayarlanmalıdır. Hastanın bir inhalasyon cihazından diğerine geçirilmesi sırasındadoz, kişiye göre tekrar ayarlanmalıdır. Uygulama şekli:FORALES ve BUDOLER kapsüller yalnızca medikal cihaz ile tatbik edilmelidir ve sadece 3 / 29 oral inhalasyon içindir. Olası bir kandida enfeksiyonu riskini azaltmak için her BUDOLER uygulamasından sonra ağzın su ile iyice çalkalanması ve tükürülmesi önerilmektedir (bkz. bölüm 4.4. ve bölüm 4.8.).Ayrıca ağzın su ile çalkalanması boğaz irritasyonunu engellemeye ve sistemik etki riskininazaltılmasına muhtemelen yardımcı olabilir. İlacın akciğerlerdeki hedef bölgelere ulaşabilmesi ve uygun şekilde kullanıldığından emin olunması için doktor veya bir başka sağlık personeli: kullanım talimatına uygun olarak medikal cihazın nasıl kullanılacağını hastalara öğretmelive göstermeli; kapsüllerin sadece medikal cihaz aracılığıyla inhalasyon yolu ile uygulanması gerektiğive yutulmaması konusunda hastayı uyarmalıdır. (bkz. Bölüm 4.4) Kullanıma ilişkin detaylı bilgi kullanma talimatında mevcuttur. Hastaların jelatin kapsülün parçalanabileceğim ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini bilmesi önemlidir.Hastaya jelatinin zararsız olduğu, ağızda yumuşayacağı ve yutulabildiği söylenmelidir.Kapsülü bir defadan fazla delmemek suretiyle parçalanma olasılığı asgari düzeyeindirilebilir. Kapsül yenilebilen jelatinden yapılmış olduğundan sindirilmesi zararlıdeğildir.Kapsüller blister ambalajından kullanımdan hemen önceçıkarılmalıdır.Medikal cihaz aşağıdaki bölümlerden oluşmaktadır: 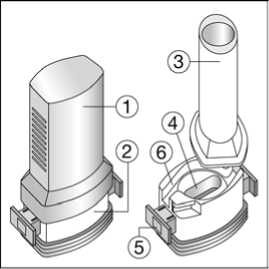 1. Ağızlığı koruyan bir kapak. 2. İlacın kapsülden düzgün olarak salınmasını sağlayan birtaban. Taban kısmı aşağıdaki kısımlardan oluşur: 3. Ağızlık. 4. Kapsül bölmesi. 5. Kapsül bölmesinin iki yanında, basıldığında çıkan iğneleraracılığıyla kapsülleri delmeye yarayan düğmeler(kulakçıkları). 6. Hava geçiş kanalı. 4 / 29 Doğru kullanım talimatları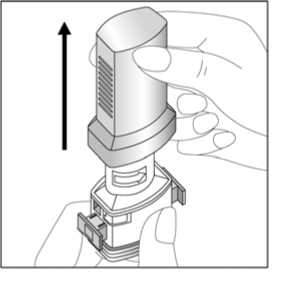
1.
Kapağı çekip çıkarınız. 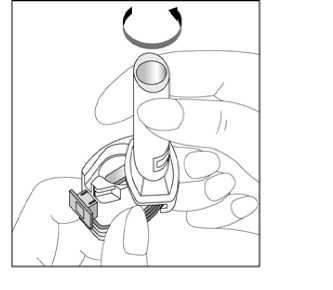 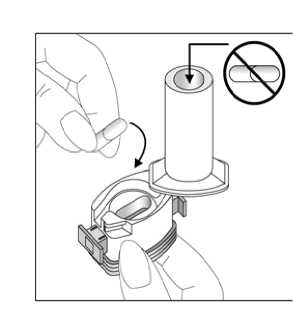 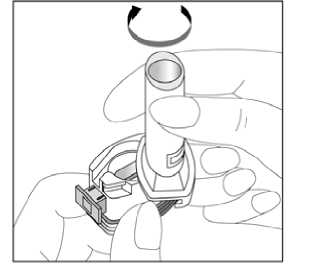 2. Kapsül bölmesini açınız. İnhalerin tabanını sıkıca tutup, açmak için ağızlığı üzerinde yer alan ok işareti yönündedöndürünüz. 3. Parmaklarınızın tamamen kuru olduğundan emin olunuz. Blisterden birkapsül çıkarınız ve bu kapsülü cihazıntabanındaki kapsül bölmesine yatık olarakyerleştiriniz. Kapsülleri, kullanımdan hemenönce blisterden çıkarmanız önemlidir. ÖNEMLİ: Kapsülü ağızlığın içerisineyerleştirmeyiniz!Ağızlığı klik sesi duyana kadar geri çevirerek kapalı duruma getiriniz.
4.
5 / 29 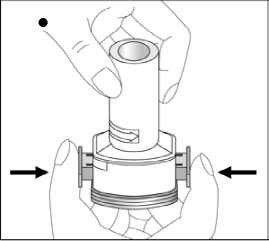 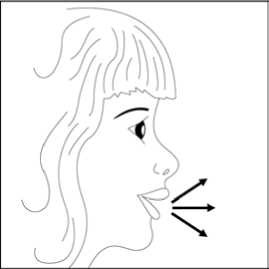 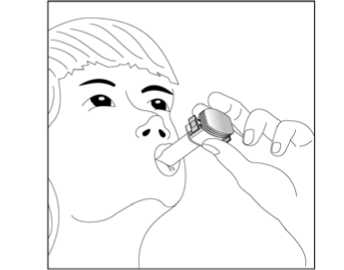 5. Tozu kapsülden serbestlemek için: - Cihazı ağızlık yukarı doğru bakacakşekilde dik olarak tutunuz. - Kenarlardaki iki kulakçığa(düğmelere) aynı andasadece birkezsıkıca basarak kapsülü deliniz.Not:Kapsül bu aşamada parçalanabilir ve küçük jelatin parçacıkları ağzınıza yada boğazınıza gelebilir. Fakat jelatinyenilebilir nitelikte olduğu için zararlıdeğildir.6. Nefesinizi olabildiğince dışarıya veriniz. 7. İlacı derin bir şekilde hava yollarınızaçekmek için: Ağızlığı ağzınıza yerleştiriniz vebaşınızı hafifçe geriye doğru eğiniz. Dudaklarınızla ağızlığın etrafını sıkıcasarınız. Hızlı, duraksamadan ve alabildiğinizkadar derin bir nefes alınız. Not:Kapsülün, kapsül bölmesinin üzerindeki alanda dönmesine bağlı olarak bir vızıldamasesi duymalısınız. Eğer bu vızıldama sesiniduymazsanız, kapsül bölmesini açınız vekapsülün, kapsül bölmesinde sıkışıpsıkışmadığını kontrol ediniz. Daha sonra 7.Basamağı tekrarlayınız. Kapsülü sıkıştığıyerden kurtarmak için düğmelere tekrar tekrarBASMAYINIZ.6 / 298. Cihazın içerisinden nefes aldıktan sonra,nefesinizi olabildiğince tutunuz ve cihazıağzınızdan çıkarınız. Sonra burnunuzdan nefesveriniz. Kapsül bölmesini açınız ve kapsüldetoz kalıp kalmadığını kontrol ediniz. Eğerkalmış ise 6-8. basamakları tekrarlayınız. 9. Tüm tozu kullandıktan sonra kapsülbölmesini açınız (bkz. basamak 2). Boş kapsülüçıkarınız. Doktorunuzun önerisi doğrultusundaaynı işlemleri diğer kapsül için de tekrarlayınız. 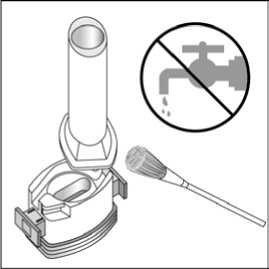 10. İçeride kalan tozları temizlemek içinkuru bir kağıt mendil ya da yumuşak bir fırçakullanınız. Not: Medikal cihazı temizlemek için SU KULLANMAYINIZ.Önce ağızlığı, ardından kapağı kapatınız. Olası bir kandida enfeksiyonu riskini azaltmak için her BUDOLER uygulamasından sonra ağzın su ile iyice çalkalanması ve tükürülmesi önerilmektedir (bkz. bölüm 4.4. ve bölüm 4.8.). Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Böbrek yetmezliği olan hastalarda doz ayarlamasına işaret eden veriler mevcut değildir. Oral budesonid ile elde edilen farmakokinetik verilere dayalı olarak, bu tip hastalarda ilacınsistemik maruziyetinin klinik açıdan anlamlı düzeylerde değişmesi olası değildir. Karaciğer yetmezliği olan hastalarda doz ayarlamasına işaret eden veriler mevcut değildir. Diğer yandan budesonid büyük oranda karaciğer metabolizması ile elimine edilmektedir.Dolayısıyla şiddetli karaciğer yetmezliği olan hastalarda BUDOLER kullanılırken dikkatliolunmalıdır. Oral budesonid ile elde edilen farmakokinetik verilere dayalı olarak hafif ila ortaşiddette karaciğer yetmezliği olan hastalarda ilaç maruziyetinde klinik açıdan anlamlı birdeğişiklik olması olası değildir. Formoterolün karaciğer veya böbrek yetmezliği olan hastalardaki kullanımına ilişkin klinik çalışma yapılmamıştır. Ancak, FORALES'in böbrek ve karaciğer yetmezliği olan 7 / 29hastalarda kullanımında doz ayarlaması gerektiği konusunda teorik bir sebep bulunmamaktadır. Pediatrik popülasyon:FORALES'in 6 yaş ve altındaki çocuklarda kullanılması tavsiye edilmez. 6 yaşın altındaki çocuklarda klinik deneyim olmadığından, BUDOLER bu yaş grubundaki hastalarda kullanılmamalıdır. Geriyatrik popülasyon:4.3. Kontrendikasyonlar Formoterole, budesonide ya da içeriğindeki yardımcı maddelerden herhangi birine karşıbilinen aşırı duyarlılıkta, Aktif akciğer tüberkülozlu hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriİnhale steroidin kombine edildiği KOAH'lı ileri yaş hastalarda pnömoni riski artabilmektedirFormoterol astımlı hastalarda tek başına monoterapi olarak kullanılmamalıdır.KOAH hastalarında pnömoniKortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoniriskinde artış kanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarakgösterilmemiştir. Kontikosteroid içeren inhale ilaçlarının pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık için kesin klinik kanıt bulunmamaktadır. Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyladikkatli olmalıdır. 8 / 29KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içimi, ileri yaş, düşük vücut kitle indeksi ve şiddetli KOAH bulunmaktadır. Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. FENOSTER-COMBİ, astım hastalığının başlangıç tedavisi için önerilmez. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır.Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediatrik ve adolesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem deuzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir. Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. FORALES'in etkin maddesi formoterol, uzun etkili beta-2-adrenerjik agonistler sınıfına dahildir. Uzun etkili diğer bir beta-2-agonist olan salmeterol ile yapılan bir çalışmada,salmeterol ile tedavi edilen hastalarda plasebo grubu ile karşılaştırıldığında astım nedeniyleölüm oranının daha yüksek olduğu gözlenmiştir (sırasıyla 13/13, 176 ve 3/13, 179). Astımlailişkili ölüm oranının formoterol ile artıp artmadığına dair yeterli çalışma yürütülmemiştir.Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilenastım ile ilgili solunum problemleri meydana gelebilir. FORALES, başka bir uzun etkili beta2-agonist ile birlikte kullanılmamalıdır. FORALES, astımda ilk tedavi seçeneği olarak kullanılmamalıdır. FORALES, hafif astım hastalığının başlangıç tedavisi olarak önerilmez. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır.Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. Astım hastalarını tedavi ederken, uzun etkili bir beta-2-agonist (LABA) olan FORALES, tek başına bir inhale kortikosteroid ile yeterli düzeyde kontrol edilemeyen ya da 9 / 29hastalığının şiddeti bir LABA ve inhale kortikosteroidin her ikisi ile tedavinin başlatılmasını kesin olarak gerektiren hastalarda, bir inhale kortikosteroide (örneğin, BUDOLER) ilaveolarak kullanılmalıdır. İnhale kortikosteroid ile uzun etkili beta-2-agonistin ayrı kullanılmasının gerekli olduğu durumlar dışında 5-12 yaş arası çocuklarda, inhale kortikosteroid ile uzun etkili beta-2-agonist (LABA) içeren bir kombinasyon preparatla tedavi uygulanması tavsiye edilir (bkz.bölüm 4.2. ve 4.8.). İnhale kortikosteroide ek olarak uzun etkili beta agonist kullananpediatrik ve adolesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhalekortikosteroid hem de uzun etkili beta agonist içeren bir kombinasyon preparatı kullanılmasıönerilir. FORALES reçete edildiğinde hastalar aldıkları antiinflamatuvar tedavinin yeterliliği açısından değerlendirilmelidirler. Hastalara, FORALES almaya başladıktan sonra,belirtilerde düzelme olsa bile antiinflamatuvar tedaviye değişiklik yapmaksızın devametmeleri öğütlenmelidir. Astım semptomları kontrol altına alındıktan sonra, FORALES dozunun kademeli olarak azaltılması düşünülmelidir. Tedavinin azaltılması sırasında hastalar yakından izlenmeli veFORALES etkili en düşük dozda kullanılmalıdır. Antiinflamatuvar tedavi: Hastalara, inhale BUDOLER tedavisinin astımdaki profilaktik niteliği ve semptomları olmadığında bile düzenli olarak kullanmaları gerektiği anlatılmalıdır. İnhale kortikosteroidler, özellikle uzun süreli olarak yüksek dozlarda kullanıldığında, sistemik etkiler ortaya çıkarabilir. Bu etkiler, oral kortikosteroidlerle yapılan tedavide görülenden çokdaha az ortaya çıkar. Bazı olası sistemik etkiler arasında adrenal supresyon,hiperadrenokortisizm/Cushing sendromu, çocuklarda ve ergenlerde büyüme geriliği, kemikmineral yoğunluğunda azalma, katarakt, glokom, aşırı duyarlılık reaksiyonları ve daha seyrekolarak, psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon ya da agresyon(özellikle çocuklarda) dahil olmak üzere bir dizi psikolojik ya da davranışsal etkiler yeralmaktadır. Bu nedenle, inhale kortikosteroid dozunun etkin astım kontrolünün sağlandığı endüşük doz olacak şekilde ayarlanması önemlidir (bkz. bölüm 4.8.). Astım atakları: Formoterol ile yapılan klinik çalışmalar, formoterol kullanan hastalarda ağır astım ataklarının sıklığının plasebo alanlara göre özellikle 5-12 yaş arasındaki hastalarda daha yüksek 10 / 29olduğunu düşündürmüştür (bkz. bölüm 4.8. İstenmeyen Etkiler). Bu çalışmalar, ağır astım atağı oranları açısından tedavi grupları arasındaki farkların doğru olarak ölçülmesine imkânvermemektedir. Semptomlar devam ettiği takdirde ya da semptomların kontrol edilebilmesi için gereken FORALES dozlarının sayısı arttığı takdirde böyle bir gelişmenin genellikle altta yatandurumun kötüleştiğini gösteriyor olması nedeniyle doktorlar kullanılan astım tedavisiniyeniden değerlendirmelidir. Hastalara astımları kötüleştiği takdirde (kısa etkili inhale bronkodilatör tedavisinin uygulanma sıklığında artış ya da inatçı solunum semptomları) doktorları ile temasa geçmeleriönerilmelidir. Astımın akut atakları sırasında BUDOLER dozunda artışa veya kısa sürelioral kortikosteroidlerle ve/veya eğer bir enfeksiyon varsa antibiyotikle ilave bir tedaviyegereksinim duyulabilir. BUDOLER, akut bronkospazmda fayda sağlamadığı gibi; status astmatikus veya diğer akut astım nöbetlerinde uygulanması gereken primer tedavi değildir. Astım atağı esnasında FORALES tedavisine başlanmamalı ya da dozu artırılmamalıdır. Hastalar alevlenme döneminde ise ya da önemli ölçüde veya akut olarak kötüye giden astımşikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. FORALES, akut astım semptomlarının rahatlatılması için kullanılmamalıdır. Akut ataklarda kısa etkili bir beta-2-agonist kullanılmalıdır. Hastalar, astımları aniden kötüleştiği takdirdehemen tıbbi tedavi almaları gerektiği konusunda bilgilendirilmelidir. Hastalar akut astım semptomlarını hafifletmek için kurtarıcı ilaç olarak her zaman yanlarında kısa etkili bir inhale bronkodilatör bulundurmalıdır. Eşlik eden şartlar: FORALES kullanan hastalarda aşağıdaki durumların varlığında, özellikle doz sınırları konusunda olmak üzere, özel dikkat ve denetleme gereklidir: İskemik kalp hastalığı, kardiyakaritmiler (özellikle üçüncü derece atriyoventriküler blok), şiddetli kardiyak dekompansasyon,idiyopatik subvalvüler aortik stenoz, şiddetli hipertansiyon, anevrizma, feokromositoma,hipertrofik obstrüktif kardiyomiyopati, tirotoksikoz, QT aralığında bilinen veya şüphe edilenuzama (QTc > 0,44 saniye; bkz. bölüm 4.5.). Daha önceden kardiyak problemleri bulunan ve teofilin ile formoterol'ü bir arada kullanan hastalarda dikkatli olunmalıdır. FORALES dahil beta-2 uyarıcıların hiperglisemik etkileri nedeniyle, diyabetik hastalarda FORALES tedavisi başlatıldığında kan glukoz değerlerinin izlenmesi tavsiye edilir. 11 / 29Sessiz seyreden akciğer tüberkülozu olan veya solunum yollarında fungal veya viral enfeksiyonu olan hastalarda dikkatli kullanılmalıdır. Bronşektazi ve pnömokonyoz gibi akciğer hastalıkları olan hastaları tedavi ederken fungal enfeksiyon olasılığı göz önüne alınmalıdır. Daha önceden bilinen kalp sorunları olan hastalarda teofilin ve formoterol eş zamanlı kullanılıyorsa dikkatli olunmalıdır. Hipokalemi: Formoterol dahil beta2-agonist tedavisi sonucunda ciddi hipokalemi görülebilir. Hipokalemi, kardiyak aritmilere duyarlılığı artırabilir. Hipoksi ve birlikte uygulanan tedavihipokalemiyi şiddetlendirebileceğinden, şiddetli astımlı hastalarda özel bir dikkat önerilir(bkz. bölüm 4.5.). Böyle durumlarda serum potasyum düzeylerinin izlenmesi tavsiye edilir. Paradoksal bronkospazm: Diğer inhalasyon tedavilerinde olduğu gibi paradoksal bronkospazm ihtimali akılda tutulmalıdır. Böyle bir durum görüldüğünde, FENOSTER-COMBİ tedavisi derhal kesilmelive alternatif tedavi başlatılmalıdır. Büyüme üzerindeki etki: Uzun süreli olarak inhale kortikosteroid tedavisi gören çocukların boylarının düzenli olarak ölçülmesi önerilmektedir. Büyümede yavaşlama olduğu takdirde inhale kortikosteroiddozunun, mümkünse astım kontrolünün etkin şekilde sağlandığı en düşük doza indirilmesiamacıyla tedavi gözden geçirilmelidir. Ayrıca, hastanın bir pediatrik solunum hastalıklarıuzmanına sevk edilmesi düşünülmelidir. Gelişim hızındaki inhale kortikosteroidlerle ilişkilibu azalmanın, yetişkinlikte ulaşılan boy üzerindeki etkisi de dahil olmak üzere, uzun vadelietkileri bilinmemektedir. Oral olarak inhale edilen kortikosteroid tedavisinin kesilmesinitakiben büyümeyi yakalama potansiyeli yeterince incelenmemiştir. Eş zamanlı tedaviler: BUDOLER ve güçlü bir CYP3A4 inhibitörünün (örneğin; itrakonazol, ketokonazol, ritonavir, nelfinavir, amiodaron, klaritromisin) uzun süre eş zamanlı uygulamasında dikkatliolunmalıdır (bkz. bölüm 4.5.). 12 / 29Steroid ile tedaviye başlanan hastalar: Terapötik etki genellikle 10 gün içerisinde elde edilmektedir. Aşırı bronşiyal mukus sekresyonu olan hastalarda, tedavinin başlangıcında, yaklaşık 2 hafta gibi kısa bir süre, oralkortikosteroid tedavisi tedaviye eklenebilir. Steroide bağımlı olan hastalar: Oral steroidlerden budesonide geçilirken, hasta görece olarak stabil bir dönemde olmalıdır. Yaklaşık 10 gün boyunca daha önceden kullanılan oral steroidle birlikte yüksek dozbudesonid kombinasyonu verilir. Daha sonra, oral doz kademeli olarak azaltılarak (örneğinher ay 2,5 mg prednizolon veya eşdeğeri oranında) mümkün olan en düşük düzeyeindirilmelidir. İlave sistemik kortikosteroidler ya da BUDOLER ile yapılan tedavi anidendeğil, yavaşça kesilmelidir. Travma, cerrahi veya ağır enfeksiyonlar gibi özel kriz durumlarına karşı koyma amacıyla hastanın adrenokortikal rezervinin yeterli düzeyde olduğundan emin olmak için sistemikkortikosteroidlerden budesonide geçilen ilk aylar boyunca özellikle dikkatli olunmalıdır.Hipotalamik-pitüiter-adrenal (HPA) eksen fonksiyonları düzenli olarak izlenmelidir. Bazıhastalar bu gibi durumlarda ekstra kortikosteroid desteğine ihtiyaç duymaktadır; bu gibihastaların potansiyel ciddi durumlarını bildiren bir uyarı kartını yanlarında taşımaları tavsiyeedilmektedir. Sistemik kortikosteroidler yerine budesonide geçilmesi daha önce sistemikkortikosteroidler tarafından baskılanmış olan alerjik rinit veya egzema gibi alerjilerin ortayaçıkmasına yol açabilir; hastalarda letarji, kas veya eklem ağrısı ve bazen de mide bulantısıve kusma görülebilir. Bu alerjiler lokal antihistaminikler veya kortikosteroidlerle uygun birşekilde tedavi edilmelidirler. İlave önlemler: Doğru olmayan uygulama yolu: 13 / 29Formoterol fumarat dihidrat ve budesonid etkin maddelerini içeren kapsülleri inhalasyon cihazına koymak yerine yanlışlıkla yutan hastalarla ilgili raporlar bulunmaktadır. Bu vakalarınbüyük kısmı yan etkilerle ilişkilendirilmemiştir. Sağlık hizmetleri uzmanları hastalarlaFENOSTER-COMBİ inhalasyon cihazının doğru şekilde kullanılmasını tartışmalıdır (bkz.Bölüm 4.2). FENOSTER-COMBİ inhalasyon cihazı reçete edilmiş bir hastanın solunumundaiyileşme olmuyorsa, sağlık hizmetleri uzmanı hastanın FENOSTER-COMBİ inhalasyoncihazını nasıl kullandığını sormalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBir arada kullanımın önerilmemesi ile sonuçlanan öngörülen etkileşimler: FORALES kullanımını etkileyen etkileşimler:Beta-adrenerjik blokerler FORALES'in etkisini zayıflatabilirler veya antagonize edebilirler. Bu yüzden FORALES, zorunlu olmadıkça, beta-adrenerjik blokerler (göz damlaları dahil)ile birlikte verilmemelidir. Göz önünde bulundurulması gereken öngörülen etkileşimler: FORALES kullanımını etkileyen etkileşimler:Diğer beta2-agonistleri gibi FORALES de; kinidin, disopiramid, prokainamid, fenotiyazinler. antihistaminikler, makrolidler, monoamin oksidaz inhibitörleri ve trisiklikantidepresanlar gibi ilaçlarla veya QTc aralığını uzattığı bilinen herhangi bir ilaçla birliktedikkatli kullanılmalıdır. Çünkü bu ilaçlar, adrenerjik agonistlerin kardiyovasküler sistemüzerindeki etkilerini güçlendirebilir. QTc-aralığını uzattığı bilinen ilaçların ventriküler aritmioluşturma riski artmıştır (bkz. bölüm 4.4.). Diğer sempatomimetik maddelerin birlikte verilmesi, FORALES'in istenmeyen etkilerini güçlendirebilir. Atomoksetin formoterolden kaynaklanan taşikardiyi artırabilir. Ksantin türevleri, steroidler veya diüretikler ile birlikte tedavi beta2-agonistlerin muhtemel hipokalemik etkisini kuvvetlendirebilir (bkz. bölüm 4.4.). Antikolinerjik ilaçlar formoterolün bronkodilatör etkisini artırabilir. BUDOLER kullanımını etkileyen etkileşimler:Budesonidin ana metabolizma yolu sitokrom P450 (CYP) izoenzim 3A4 (CYP3A4) aracılığı yladır. CYP3A4 inhibitörleri olarak bilinen ilaçlar (örneğin; itrakonazol, ketokonazol, 14 / 29ritonavir, nelfinavir, amiodaron, klaritromisin) ile eş zamanlı uygulaması budesonid metabolizmasını inhibe ederek sistemik maruziyetini artırabilir. Eğer bu ürünler birlikteuygulanıyorsa, adrenal kortikal fonksiyon izlenmeli ve budesonidin dozu yanıta göreayarlanmalıdır (bkz. bölüm 4.4. ve bölüm 5.2.). Güçlü CYP3A4 indükleyicilerle (örn. rifampisin) eş zamanlı olarak kullanılması budesonidin metabolizmasını hızlandırabilir ve sistemik maruziyetini düşürebilir (bkz. bölüm 5.2.). Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara özgü etkileşim çalışması yürütülmemiştir. Pediatrik popülasyon:Pediatrik popülasyona özgü etkileşim çalışması yürütülmemiştir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlar için FORALES tedavisi sırasında özel bir gereklilik bulunmamaktadır. Eğer gebelik tespit edilirse, devam eden FORALEStedavisinin alternatif tedavilere karşı yarar/risk oranı değerlendirilmelidir. Çocuk doğurma potansiyeli bulunan kadınlar için BUDOLER tedavisi sırasında özel bir öneri bulunmamaktadır. Gebelik dönemiGebe kadılarda Formoterol ve budesonidin kullanımına ilişkin yeterli veri bulunmamaktadır. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz.kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Daha güvenli bir alternatifolduğu takdirde gebelik dönemi süresince kullanımından kaçınılmalıdır. Gebelik sırasında glukokortikosteroid tedavisi kaçınılmazsa, oral glukokortikosteroidlerin yerine, düşük sistemik yan etkileri nedeniyle, inhale glukokortikosteroidler tercih edilmelidir.Diğer beta2-adrenerjik uyarıcılar gibi formoterol de uterus düz kası üzerine gevşetici etkisinedeniyle, doğum sürecini baskılayabilir. Laktasyon dönemiFormoterol emziren sıçanların sütünde tespit edilmiştir. İnhale budesonid anne sütü içine 15 / 29salgılanır. Bebeklerde ulaşılan plazma konsantrasyonlarının, anne plazmasında bulunan konsantrasyonların yaklaşık 1/600'üne ulaşması beklenir (bkz. bölüm 5. Farmakolojiközellikler). FENOSTER-COMBİ kullanan anneler emzirmemelidir. Üreme yeteneği/FertiliteFormoterolün insan fertilitesi üzerindeki etkisine dair veri mevcut değildir. Erkek ve dişi sıçanlar üzerinde gerçekleştirilen çalışmalarda fertilitede bozulma gözlenmemiştir. Subkutanuygulama ile budesonidin sıçanlarda fertilite üzerine advers etkisi bulunmaktadır.Budesonidin insanlarda herhangi bir teratojenite ya da üreme toksisitesi gösterdiğine ilişkin bir kanıt yoktur (bkz. bölüm 5.3.). 4.7. Araç ve makine kullanımı üzerindeki etkilerBaş dönmesi veya buna benzer yan etkiler gelişen hastalara, araç veya makine kullanmaktan kaçınmaları önerilmelidir. 4.8. İstenmeyen etkilerFORALESAdvers ilaç reaksiyonları MedDRA'daki sistem organ sınıflarına göre listelenmektedir. Her bir sistem organ sınıfı içinde, advers ilaç reaksiyonları en sık reaksiyon ilk sırada yer alacakşekilde sıklığa göre sıralanır. Her bir sistem organ sınıfı içinde advers ilaç reaksiyonlarıazalan ciddiyet sırasına göre sunulmaktadır. Ayrıca, her bir advers ilaç reaksiyonu için ilgilisıklık kategorisinde aşağıdaki dönüşüm (CIOMS III) temel alınır: Çok yaygın (>1/10); yaygın(>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000);çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sistemi hastalıklarıÇok seyrek: Aşırı duyarlılık (hipotansiyon, ürtiker, anjiyoödem, kaşıntı, deri döküntüsü dahil). Enfeksiyonlar ve enfestasyonlarYaygın: Pnömoni (KOAH'lı hastalarda). Psikiyatrik hastalıklarYaygın olmayan: Ajitasyon, anksiyete, asabiyet, uykusuzluk. 16 / 29Sinir sistemi hastalıklarıYaygın: Baş ağrısı, tremor. Yaygın olmayan: Baş dönmesi. Çok seyrek: Tat alma duyusu bozuklukları. Kardiyak hastalıklarYaygın: Palpitasyonlar. Yaygın olmayan: Taşikardi. Çok seyrek: Periferik ödem. Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: Paradoksal bronkospazm dahil bronkospazm, boğaz irritasyonu, akut astım alevlenmesi. Gastrointestinal hastalıklarYaygın olmayan: Ağız kuruluğu Çok seyrek: Bulantı. Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıYaygın olmayan: Kas krampları, miyalji. BUDOLERAdvers ilaç reaksiyonları MedDRA'daki sistem organ sınıflarına göre listelenmektedir. Her bir sistem organ sınıfı içinde, advers ilaç reaksiyonları en sık reaksiyon ilk sırada yer alacakşekilde sıklığa göre sıralanır. Her bir sistem organ sınıfı içinde advers ilaç reaksiyonlarıazalan ciddiyet sırasına göre sunulmaktadır. Ayrıca, her bir advers ilaç reaksiyonu için ilgilisıklık kategorisinde aşağıdaki dönüşüm (CIOMS III) temel alınır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor). Bağışıklık sistemi hastalıklarıSeyrek: Aşırı duyarlılık reaksiyonları (dermatit, eritem), döküntü, ürtiker, anjiyoödem, kaşıntı, anafilaktik reaksiyonlar. 17 / 29Endokrin hastalıklarSeyrek: Adrenal supresyon, Cushing sendromu, hiperadrenokortisizm, hipokortisizm, çocuklarda ve ergenlerde büyüme geriliği. Enfeksiyonlar ve enfestasyonlarYaygın: Ağız-yutakta kandida enfeksiyonu, pnömoni (KOAH'lı hastalarda). Psikiyatrik hastalıklarıSeyrek: Depresyon, huzursuzluk. Çok seyrek: Sinirlilik. Göz hastalıklarıSeyrek: Katarakt, glokom. Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: Öksürük. Seyrek: Paradoksal bronkospazm, disfoni, boğaz iritasyonu. Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıSeyrek: Kemik mineral yoğunluğunda azalma. İnhale kortikosteroidlerin, özellikle uzun süreli olarak yüksek dozlarda kullanıldığında sistemik etkileri ortaya çıkarabilir. Bazı olası sistemik etkiler arasında adrenal supresyon,hiperkortisizm/Cushing sendromu, çocuklarda ve ergenlik çağındakilerde gelişim gecikmesi,kemik mineral yoğunluğunda azalma, katarakt, glokom ve aşırı duyarlık reaksiyonları yeralmaktadır (bkz. bölüm 4.4.). Yayınlanmış literatürde uzun süreli klinik çalışmalardaki KOAH hastalarında budesonid formül asyonları ile şu istenmeyen etkiler bildirilmiştir: Deri morarmaları ve pnömoni. Pazarlama sonrası spontan bildirimlerden elde edilen istenmeyen etkiler (Sıklıklar bilinmiyor)Formoterol ile tedavi edilen hastalarda aşağıdaki pazarlama sonrası advers etkiler bildirilmiştir. Bu reaksiyonlar büyüklüğü kesin olmayan bir popülasyondan isteğe bağlı olarakbildirilmiş olduğundan, güvenilir bir şekilde sıklığı belirlemek mümkün değildir; dolayısıyla 18 / 29bilinmiyor olarak kategorize edilmiştir: Advers ilaç reaksiyonları MedDRA'daki sistem organ sınıflarına göre listelenmektedir. Her bir sistem organ sınıfı içinde advers ilaç reaksiyonlarıazalan ciddiyet sırasına göre sunulmaktadır. Metabolizma ve beslenme hastalıklarıBilinmiyor: Hipokalemi, hiperglisemi. Kardiyak hastalıklarBilinmiyor: Elektrokardiyogramda QT uzaması, anjina pektoris, atriyal fibrilasyon gibi kardiyak aritmiler, ventriküler ekstrasistol, taşiaritmi. Solunum, göğüs bozuklukları ve mediastinal hastalıklarBilinmiyor: Öksürük. Deri ve deri altı doku hastalıklarıBilinmiyor: Deri döküntüsü. AraştırmalarBilinmiyor: Kan basıncında artış (hipertansiyon dahil). Seçilmiş istenmeyen etkilerin tanımlanmasıAğır astım atakları: Formoterol ile uygulanan en az 4 haftalık plasebo-kontrollü klinik çalışmalar, Formoterol alan hastalarda ağır astım ataklarının sıklığının (günde iki kez 10-12 mikrogram için %0.9,günde iki kez 24 mikrogram için %1.9) plasebo alanlardakine (%0.3) göre daha yüksekolduğunu düşündürmüştür (özellikle 5-12 yaş arasındaki hastalarda). Astımlı adolesan ve yetişkin hastalardaki deneyimler: ABD'de ruhsatlandırma için yapılan ve 12 yaş ve üstü toplam 1095 hastanın katıldığı 12 haftalık iki önemli kontrollü çalışmada, ağır astım ataklarının (astımın hastanın hastaneyeyatırılmasını gerektiren akut kötüleşmesi) günde iki kez verilen Formoterol 24 mikrogramuygulamasında (9/271,%3.3) günde iki kez verilen Formoterol 12 mikrogram uygulamasına (1/275, %0.4), plaseboya (2/277, %0.7) ya da albuterole (2/272, %0.7) göre daha sık ortaya çıktığı gözlenmiştir. 19 / 29Bu gözlemi araştırmak amacıyla daha sonra yapılan ve 2085 hastanın katıldığı bir klinik çalışmada, yüksek ve düşük doz gruplarında astımla ilgili ciddi advers olaylarkarşılaştırılmıştır. 16 hafta süren bu klinik çalışmada elde edilen sonuçlar, Formoteroldozuyla açık bir ilişki göstermemiştir. Bu çalışmada, ağır astım ataklarının görüldüğühastaların yüzde oranının Formoterol'de plaseboya göre biraz yüksek olduğu görülmüştür(üç çift-kör tedavi grubu için: Formoterol 24 mikrogram günde iki kez (2/527, %0.4),Formoterol 12 mikrogram günde iki kez (3/527, %0.6) ve plasebo (1/514, %0.2) ve açık-etiketli tedavi grubu için: Formoterol 12 mikrogram günde iki kere ilave olarak ayrıca gündeen fazla iki ek doz (1/517, %0.2). 5-12 yaş arasındaki astımlı çocuklardaki deneyimler: Günde iki kez verilen Formoterol 12 mikrogram dozun günde iki kez verilen Formoterol 24 mikrogram doza ve plaseboya göre güvenliliği; günlük bronkodilatör veantienflamatuvar tedaviye ihtiyaç duyan astım hastası 518 çocuğun (5-12 yaş arasındaki)katıldığı 52 haftalık, çok merkezli, randomize, çift-kör büyük bir çalışmada araştırılmıştır.Günde iki kez Formoterol 24 mikrogram (11/171, %6.4) ya da günde iki kez Formoterol 12mikrogram alan (8/171, %4.7) çocuklarda görülen ağır astım ataklarının plasebo alançocuklardakine (0/176, %0.0) göre daha fazla olduğu görülmüştür. Tedavi önerileri için, bölüm 4.2. Pozoloji ve Uygulama Şekli ve bölüm 4.4. Özel kullanım uyarıları ve önlemleri'ne bakınız. Aşağıdaki advers ilaç reaksiyonları, Budesonid ile edinilmiş olan pazarlama sonrası deneyimden çıkarılmıştır. Bu reaksiyonlar, büyüklüğü belirli olmayan bir popülasyondangönüllülük bazında bildirilmiş olduğundan, bunların sıklıklarını güvenilir bir şekilde tahminetmek mümkün olmamaktadır ve bu nedenle bilinmiyor olarak sınıflandırılmaktadır. Adversilaç reaksiyonları MedDRA'daki sistem organ sınıflarına göre listelenmektedir. Her bir sistemorgan sınıfı içinde advers ilaç reaksiyonları azalan ciddiyet sırasına göre sunulmaktadır: Bağışıklık sistemi hastalıklarıBilinmiyor: Kontakt dermatit (Tip IV [gecikmiş] aşırı duyarlılık reaksiyonu). Psikiyatrik hastalıklarBilinmiyor: Psikomotor hiperaktivite, uyku bozuklukları, davranış değişiklikleri (ağırlıklı olarak çocuklarda). Yayınlanmış literatürde uzun süreli klinik çalışmalardaki KOAH hastalarında budesonid formül asyonları ile şu advers ilaç reaksiyonları bildirilmiştir: Deri morarmaları ve pnömoni. 20 / 29Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirilmeleri gerekmektedir (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiBelirtiler:Formoterol'ün aşırı dozuna bağlı olarak beta2-adrenerjik uyarıcıların tipik etkilerinin görülmesi beklenir: bulantı, kusma, baş ağrısı, tremor, sedasyon, palpitasyonlar, taşikardi,ventriküler aritmiler, metabolik asidoz, hipokalemi, hiperglisemi, hipertansiyon. Budesonid'in akut toksisitesi düşük düzeydedir. Kısa bir süre içerisinde yüksek miktarlarda ilacın inhalasyonunu takiben oluşan en büyük zararlı etki hipotalamik-pitüiter- adrenal(HPA) fonksiyonlarının baskılanmasıdır. Tedavi:FORALES:Destekleyici ve semptomatik tedavi uygulanır. Ciddi vakalarda hastalar hastaneye yatırılmalıdır. Kardiyoselektif beta-blokerlerin kullanılması düşünülebilir, ancakbronkospazma neden olabileceğinden bu tedavi yalnızca doktor gözetimi altında ve dikkatleuygulanmalıdır. BUDOLER:Özel acil durum önlemlerine gerek yoktur. Astımı kontrol etmek için önerilen dozda BUDOLER tedavisine devam edilmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFormoterolFarmakoterapötik grup: Adrenerjikler, İnhalatörler; Adrenerjik kortikosteroidler veya diğer ilaçlar ile birlikte, antikolinerjikler hariç ATC kodu: R03AK07 Formoterol, güçlü, seçici bir beta2-adrenerjik uyarıcıdır. Geri dönüşlü hava yolu tıkanmaları olan hastalarda bronkodilatör bir etki gösterir. Etkisi çabuk (1-3 dakika içinde) başlar veinhalasyondan 12 saat sonra hala belirgindir. Terapötik dozlarda kardiyovasküler etkileri 21 / 29önemsizdir ve ara sıra görülür. Formoterol, pasif olarak duyarlı hale getirilen insan akciğerlerinden lökotrienlerin ve histaminin salıverilmesini inhibe eder. Hayvanlarda yapılan deneylerde; ödemin ve iltihaphücrelerinin toplanmasının inhibisyonu gibi bazı antiinflamatuvar özellikler gözlenmiştir.Kobay trakeasındaki in vitroçalışmalar; rasemik formoterolün ve bunun (R,R)- ve (S,S)-enantiomerlerinin, ileri derecede selektif beta-2-adrenoseptör agonistleri olduklarınıgöstermiştir. (R,R)-enantiomerden 800-1000 kat daha az potent olan (S,S)-enantiomeri, (R-R)-enantiomerin trakea düz kası üzerindeki aktivitesini etkilemez. Enantiomerlerden herhangibirinin rasemik karışıma tercih edilmesini gerektirecek herhangi bir farmakolojik nedenyoktur.İnsanda inhale edilen alerjenlerin, egzersizin, soğuk hava, histamin veya metakolinin neden olduğu bronkospazmı önlemede Formoterolün etkili olduğu gösterilmiştir. Medikal cihaz ile günde iki defa 12 mikrogram ve günde iki defa 24 mikrogram dozlarda inhale edilen formoterolün, stabil kronik obstrüktif akciğer hastalığı (KOAH) olan hastalardahızlı etki ile bronkodilatasyon sağladığı, etkisinin en az 12 saat sürdüğü ve Saint GeorgeSolunum Yolları Anketi sonucuna göre yaşam kalitesi açısından kişisel faydayı beraberindegetirdiği gösterilmiştir. BudesonidBudesonid, insanlarda belirgin topikal etki göstermekle birlikte önemli bir sistemik etkisi olmayan bir kortikosteroiddir. Diğer inhale glukokortikoidlerde olduğu gibi budesonid defarmakolojik etkilerini, hücre içi glukokortikoid reseptörleri ile etkileşerek gösterir. Birçokfarklı sitokin, kemokin, enzim ve hücre adezyon molekülünün üretimi inhibe edilir.Kortikosteroid tedavisinden fayda gören hastalarda inhalasyon tozu olarak kullanıldığında,genellikle tedaviye başlandıktan sonra 10 gün içerisinde astımı kontrol altına alabilmektedir.Budesonid düzenli kullanıldığında astımlı akciğerlerdeki kronik enflamasyonu azaltmaktadır.Budesonid, ayrıca akciğer fonksiyonlarını artırmakta ve astım semptomlarının ve bronş aşırıcevaplılığının azalmasını sağlamakta, astım ataklarını önlemektedir. 5.2. Farmakokinetik özelliklerGenel özelliklerFORALES'in terapötik doz aralığı günde iki kez 12-24 mikrogramdır. Formoterolün plazma farmakokinetiği verileri sağlıklı gönüllülerde önerilen doz aralığından daha yüksekdozlar ve KOAH hastalarında terapötik dozların inhale edilmesi ile derlenmiştir. İdrardasaptanan ve sistemik maruziyetin dolaylı bir göstergesi olarak kullanılan değişime 22 / 29uğramamış formoterol düzeyleriyle, plazmadaki ilaç farmakokinetiği verileri arasında korelasyon vardır. İdrar ve plazma için hesaplanan eliminasyon yarı ömürleri birbirineyakındır. Emilim - Formoterol:Sağlıklı gönüllülerde formoterol fumaratın 120 mikrogramlık tek bir doz inhalasyonunu takiben, formoterol hızla plazmaya geçerek inhalasyonu izleyen 5 dakika içerisinde,maksimum konsantrasyon olan 266 pmol/l'ye ulaşmıştır. 12 hafta boyunca günde iki defa 12veya 24 mikrogram formoterol fumarat ile tedavi edilen KOAH hastalarında inhalasyondan10 dakika, 2 saat ve 6 saat sonraki ortalama plazma formoterol konsantrasyonları; sırasıyla11.5-25.7 ve 23.3-50.3 pmol/l arasında değişmiştir. Formoterolün ve/veya (R,R) ve (S,S) enantiomerlerinin kümülatif üriner itrahını araştıran çalışmalar, dolaşımdaki formoterol miktarının inhale edilen doz ile orantılı olarak arttığınıgöstermiştir (12-96 mikrogram). 12 hafta süreyle günde 2 defa 12 mikrogram veya 24 mikrogram inhalasyonundan sonra idrarla atılan, değişikliğe uğramamış formoterol düzeyleri, astım hastalarında %63 ve %73(ilk dozla son doz karşılaştırıldığında), KOAH hastalarında %19 ve %38 arasında değişenoranlarda yükselmiştir. Bu veriler, tekrarlanan dozlarda kullanılan formoterolün plazmadasınırlı olarak biriktiği izlenimini vermektedir. Tekrarlayan dozlardan sonra enantiomerlerdenbirinin, diğerinden daha fazla biriktiğine tanık olunmamıştır. İnhale edilen diğer ilaçlar için bildirildiği üzere inhaler aracılığıyla kullanılan formoterol dozunun çok büyük bölümü yutulmakta ve daha sonra gastrointestinal kanaldan emilmektedir.3H ile işaretlenmiş 80 mikrogram formoterol fumaratın iki gönüllüye oral olarak verilmesininardından dozun en az %65'i emilmiştir. Emilim - Budesonid:Akciğerlere ulaşan budesonid miktarı hızlı bir şekilde ve tamamen emilmektedir. Uygulamadan hemen sonra plazmada en yüksek konsantrasyona ulaşılmaktadır. Orofarenkstekalan doz için gerekli düzeltme yapıldıktan sonra mutlak biyoyararlanım %73 oranındadır.Karaciğerdeki belirgin presistemik metabolizma nedeniyle inhale edilen bir dozun yutulanfraksiyonunun sadece %10 ila 13'ü biyoyararlanıma sahiptir. Dağılım - Formoterol:Formoterolün plazma proteinlerine bağlanma oranı %61-64'tür. Bunun önemli bir kısmı (%34) insan serum albüminine bağlanır. Terapötik dozlar ile erişilen konsantrasyon aralığında 23 / 29bağlanma yerlerinde doyma olmaz. Dağılım - Budesonid:Budesonidin plazma proteinine bağlanması 1 ila 100 nmol'lük bir konsantrasyon aralığında %85-90'dır. Budesonid dokulara yaygın olarak dağılır, kararlı durumda budesonidindağılım hacmi yaklaşık 183 ila 301 lt'dir. Yapılan hayvan deneylerinde dalak ve lenfbezlerinde, timusta, adrenal kortekste, üreme organlarında ve bronşlarda yüksekkonsantrasyonlar gözlenmiştir. Budesonid, farelerde plasenta bariyerini aşmaktadır.Budesonid, yaklaşık 0.46 süt-plazma konsantrasyon oranı ile anne sütüne geçer. Bebeğinmaruz kalacağı tahmini günlük doz, günlük maternal dozun yaklaşık %0.3'üdür ve bebeklerdeortalama plazma konsantrasyonun, bebekte oral biyoyararlanımın tam olacağıvarsayıldığında dahi, maternal plazmada gözlenen konsantrasyonların yaklaşık 1/600'üolacağı tahmin edilmektedir. Biyotransformasyon - Formoterol:Formoterol başlıca metabolizma ile elimine edilir; doğrudan glukuronidasyon biyotransformasyonun ana yoludur. Glukuronidasyonun izlediği O-demetilasyon, diğer bir biyotransformasyon yoludur. Formoterolün sülfat konjügasyonu ve ardından yine sülfatkonjügasyonunun gerçekleştiği deformilasyon, minör metabolik yollarıdır. Formoterolünglukuronidasyonunda (UGT1A1, 1A3, 1A6, 1A7, 1A8, 1A9, 1A10, 2B7 ve 2B15) veO-demetilasyonunda (CYP2D6, 2C19, 2C9 ve 2A6) çok sayıda izoenzimin katalizörrolünü oynuyor olması; formoterol metabolizmasındaki spesifik bir izoenzimin inhibisyonuüzerinden ilaç-ilaç etkileşim potansiyelinin düşük olduğu izlenimini vermektedir. Terapötikdozlarla elde edilen konsantrasyonlardaki formoterol, sitokrom P450 izoenzimlerini inhibeetmemiştir veya indüklememiştir. Biyotransformasyon - Budesonid:Budesonid akciğerlerde metabolize olmaz. Emilimini takiben budesonid karaciğerde yıkıma uğrar ve 6 beta-hidroksibudesonid ve 16 alfa-hidroksiprednizolon dahil olmak üzere bir diziinaktif metabolit elde edilir. Budesonidin ana metabolizma yolu CYP3A4 aracılığıyladır ve budesonid metabolizması bu enzimin bilinen inhibitörleri ya da indükleyicileri tarafından etkilenebilir (bkz. bölüm 4.5.). 24 / 29Eliminasyon - Formoterol: 12 hafta boyunca günde 2 defa 12 veya 24 mikrogram formoterol fumaratla tedavi edilenastım ve KOAH hastalarında, verilen dozun sırasıyla yaklaşık %10'u ve %7'si değişikliğeuğramamış olarak idrarda saptanmıştır. İdrardaki, değişikliğe uğramamış formoterolün; 12120 mikrogram arasında değişen tek dozların verildiği sağlıklı gönüllülerde ve tek vetekrarlanan dozlar kullanan astım hastalarındaki %40'ının (R-R), %60'ının (S,S)-enantiomeriolduğu görülmüştür.İlaç ve metabolitleri vücuttan tamamen atılırlar; bir oral dozun yaklaşık 2/3'si idrarla ve 1/3 'i feçesle atılır. Kandaki formoterolün renal klerensi 150 ml/dakikadır. Sağlıklı gönüllülerde 120 mikrogram tek doz formoterol fumarat inhalasyonundan sonra, idrarla atılma oranlarından hesaplanan, plazmadaki eliminasyon yarı-ömrü, 10 saat; (R,R) ve(S,S)- enantiomerlerinde ise sırasıyla 13.9 ve 12.3 saat olarak ölçülmüştür. Eliminasyon - Budesonid:Radyoişaretli budesonid soluyan insan gönüllülerde (ölçülü doz inhaler ile) uygulanan dozun yaklaşık %32'si idrarda geri kazanılır ve dozun %15'i feçeste geri kazanılır. İnhalasyonutakiben budesonid idrarda tespit edilmezken, 16-alfa-hidroksiprednizolon tespit edilmiştir.Budesonid intravenöz doz uygulamasını takiben yüksek plazma klirensi (84 lt/s) gösterir.Budesonidin eliminasyon yarılanma ömrü yaklaşık 2.8 ila 5 saattir. Doğrusallık/Doğrusal olmayan durum:Formoterol ve budesonidin doğrusallık/doğrusal olmayan durumu konusunda yeterli çalışma bulunmamaktadır. Hastalardaki karakteristik özelliklerBöbrek/Karaciğer yetmezliği:Formoterolün ve budesonidin karaciğer veya böbrek yetmezliği bulunan hastalardaki farmakokinetiği incelenmemiştir. Ancak, siroz hastalarındaki oral uygulamanın ardından budesonidin sistemik yararlanımının sağlıklı kontrollere göre 2.5 kat daha yüksek olduğu bildirilmiştir. Hafif karaciğeryetmezliğinin sistemik maruziyet üzerinde az etkisi olduğu bildirilmiştir. Böbrek yetmezliğinin, oral budesonidin farmakokinetiği üzerinde herhangi bir etkisinin olmasının beklenmediği bildirilmiş olmakla birlikte, budesonid metabolitleri idrar yoluylaatılmaktadır ve dolayısıyla, şiddetli böbrek yetmezliğinde metabolitlerin birikmesine bağlı 25 / 29olarak advers olayların görülmesindeki artmış risk olasılığı göz ardı edilememektedir. Pediatrik popülasyon:5-12 yaş grubundaki astımlı çocuklara 12 hafta boyunca inhalasyon yoluyla günde iki defa 12 veya 24 mikrogram formoterol fumarat verilerek yapılan bir çalışmada; değişimeuğramaksızın idrarla atılan formoterol miktarı, ilk dozdan sonrakine kıyasla %18 ile %84arasında değişen oranda artmıştır. Çocuklardaki birikim, erişkin hastalardakinden fazlaolmamış ve %63 ile %73 arasında değişen bir oranda artmıştır (bkz. Emilim). İncelenençocuklarda verilen formoterol dozunun yaklaşık %6'sı, değişmemiş formoterol olarak idrardabulunmuştur. Budesonidin farmakokinetiği pediatrik popülasyonda çalışılmamıştır. Ancak, diğer inhale budesonid ürünlerine dair veriler, 3 yaşın üzerindeki çocuklarda beden ağırlığına normalizeedilen klirensin, yetişkinlere kıyasla yaklaşık %50 daha yüksek olduğunu göstermektedir. Geriyatrik popülasyon:Formoterolün ve budesonidin yaşlı hastalardaki farmakokinetiği incelenmemiştir. Cinsiyet:Formoterolün farmakokinetiği, hastaların kilosuna göre düzeltildikten sonra erkeklerle kadınlar arasında istatistiksel anlamlılığa sahip bir fark göstermemiştir. 5.3. Klinik öncesi güvenlilik verileriMutajenisite:FormoterolDeneysel bitiş noktaları geniş bir alanı kapsayan mutajenik etki testleri formoterol ile yapılmış; hiç bir in vitroin vivoBudesonidBir dizi in vitroin vivoKarsinojenisite:FormoterolSıçanlarda ve farelerde yapılan iki yıllık çalışmalarda, herhangi bir karsinojenik potansiyel görülmemiştir. Çok yüksek dozlarla muamele edilmiş erkek farelerde selim adrenal subkapsüler hücre 26 / 29tümörleri görülme sıklığı hafifçe yüksek bulunmuştur. Ancak bu bulgu, yüksek dozlarda dişi genital organındaki selim düz kas tümörlerinin ve her iki cinsiyette görülen karaciğertümörlerinin görülme sıklığında artış şeklinde patolojik değişikliklerin olduğu ikinci bir fareçalışmasında görülmemiştir. Düz kas tümörleri, beta-agonistlerin sıçanlarda yüksek dozlardabilinen bir etkisidir. Çeşitli doz aralıklarında sıçanlarda yapılan iki çalışmada, mezovariyal leyomiyomlarda artış görülmüştür. Bu selim neoplazmalar sıçanların beta-2-adrenerjik ilaçların yüksek dozları ileuzun süreli tedavisinde genellikle görülürler. Over kistleri ve selim granulosa/tekal hücrelitümörlerde de artış görülmüştür; beta-agonistlerin sıçanlarda overlere, çok muhtemelenkemiricilere has olan, etkileri olduğu bilinmektedir. Daha yüksek dozların kullanıldığı birinci çalışmada bildirilen diğer birkaç tip tümör, kontrol grubundakilere benzer sıklıkta görülmüş ve daha düşük doz kullanılan çalışmalardagörülmemiştir. Tümör sıklıklarının hiçbiri ikinci çalışmada kullanılan en düşük doz (insanlarda formoterolün tavsiye edilen maksimum dozundan beklenenden 10 kat daha yüksek sistemik düzeye yolaçan bir doz) da istatistiksel olarak anlamlı bir dereceye yükselmemiştir. Bu bulgulara ve mutajenik potansiyelinin olmamasına dayanarak, formoterolün terapötik dozlarda kullanımının karsinojenik bir riski olmadığı hükmüne varılmıştır. BudesonidOral yolla uygulanan budesonidin, günde 25 mikrogram/kg/gün doz düzeylerinden itibaren erkek sıçanlarda karaciğer tümörleri insidansını arttırdığı gözlenmiştir. Bu etkiler ayrıca başkasteroidleri (prednizolon ve triamsinolon asetonid) içeren bir takip çalışmasında dagözlenmiştir ve kortikosteroidlerin uygulaması ile ilişkili bir sınıf etkisi olduğu kabuledilmiştir. Üreme toksisitesi:FormoterolHayvan deneylerinde formoterolün herhangi bir teratojenik etkisi görülmemiştir. Formoterol, cinsel açıdan olgun erkek ve dişi sıçanlarda fertilite ve genel üreme performansı üzerindekietkileri açısından değerlendirilmiştir. Sıçanlara oral yoldan 60 mg/kg/gün'e kadar uygulanandozlarda fertilite bozulması veya erken embriyonik gelişim üzerinde etki gözlenmemiştir(insanlarda mg/m2 bazında maksimum önerilen günlük inhalasyon tozu dozunun yaklaşık12.000 katı) Oral uygulamayı takiben, formoterol emziren sıçanların sütüne geçmiştir. 27 / 29Budesonidİnhale budesonidin sıçan yavrularının beden ağırlığında düşüşe yol açtığı gösterilmiş ancak bildirilen herhangi bir teratojenik etki olmamıştır. Subkutan uygulanan budesonidin sıçanyavrularının yaşama yeteneği üzerindeki azaltıcı etkileri ve budesonidin sıçanlardaki anneyeözgü toksisitesi, tavşanlardaki teratojenik potansiyeli ve büyüme geriliği üzerindeki etkileri vefetal ölüm, glukokortikoidlerin hayvanlardaki bilinen teratojenik potansiyeli ile uyumludur.Budesonidin insanlarda herhangi bir teratojenite ya da üreme toksisitesi gösterdiğine ilişkinbir kanıt yoktur (bkz. bölüm 4.6.). Sıçanlarda subkutan yolla uygulanan budesonidin fertiliteüzerinde advers bir etkisi olmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiFORALESLaktoz monohidrat (inek sütü kaynaklı) Kapsül içeriğiBUDOLERMikronize laktoz monohidrat (inek sütü kaynaklı) Semi-mikronize laktoz monohidrat (inek sütü kaynaklı) Kapsül içeriğiKırmızı demir oksit (E172ii) Titanyum dioksit (E171) Jelatin (sığır kaynaklı) 6.2. Geçimsizlikler6.3. Raf ömrü24 ay. 6.4. Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız. Nemden koruyunuz. 28 / 296.5. Ambalajın niteliği ve içeriğiAlu/Alu-PVC blisterde 60 adet FORALES 12 mcg inhaler kapsül, PVC/PVDC/Alu blisterde 60 adet BUDOLER 200 mcg inhalasyon için kapsül ve 1 medikal cihaz. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİWorld Medicine İlaç Sanayi ve Ticaret A.Ş. Bağcılar / İstanbul 8. RUHSAT NUMARASI2018/225 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 27.04.2018 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ29 / 29 |
İlaç BilgileriFenoster Combi 12 Mcg/200 Mcg İnhalasyon İçin KapsülEtken Maddesi: Formoterol Fumarat-budesonid Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.