Grafalon 20mg/ml I.v. İnfüzyonluk Çözelti Konsantresi Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIGRAFALON 20 mg/mL I.V. infüzyonluk çözelti konsantresi içeren flakon Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Tavşanlardan elde edilen anti insan T- lenfosit immünoglobulini 20 mg/mL Yardımcı madde(ler):Her 1 mL'de; Sodyum dihidrojen fosfat dihidrat 1,56 mg Yardımcı maddeler için 6.1.'e bakınız. 3. FARMASÖTİK FORMBerrak ila hafif opak ve renksiz ila açık sarı infüzyon için konsantre çözelti 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarİmmün cevabın supresyonu GRAFALON, genellikle diğer immünsüpresif tıbbi ürünlerle kombine olarak immün sistemi baskılamak ve böylece organ transplantasyonlarından sonraki akut rejeksiyonu veya GraftVersus Host Hastalığını önlemek için kullanılır. Genellikle aşağıda belirtilen durumlardauygulanır: Allojenik solid organ transplantasyonu yapılmış hastalarda akut transplant rejeksiyonunun önlenmesiGRAFALON, allojenik solid organ transplantasyonunu takiben immünosupresyonu arttırmak için diğer immünsüpresif tıbbi ürünlerle (örneğin glukokortikosteroidler, purin antagonistleri,kalsinörin inhibitörleri veya mTOR inhibitörleri gibi) kombine olarak kullanılır. Allojenik solid organ transplantasyonunu takiben kortikosteroide dirençli akut rejeksiyonun tedavisiGRAFALON, allojenik solid organ transplantasyonunu takiben yapılan metilprednizolon tedavisinin terapötik etkisinin yetersiz kaldığı durumlarda kortikosteroid dirençli akutrejeksiyon krizinin tedavisinde kullanılır. 1/14 Allojenik kök hücre transplantasyonundan (SCT) sonra yetişkinlerde Graft-Versus-Host hastalığının (GVHD) önlenmesiGRAFALON, hematolojik malignitesi olan yetişkinlerde uyumlu akraba dışı donörlerden yapılan kök hücre transplantasyonunu takiben, standart Siklosporin A/metotreksat profilaksisiile kombine olarak Graft-Versus-Host hastalığının (GVHD) önlenmesinde kullanılır. 4.2. Pozoloji ve uygulama şekliGRAFALON, sadece organ transplantasyonunu izleyen veya kök hücre transplantasyonlarından önce hazırlama amacıyla yapılan immünsüpresif tedaviuygulamalarında deneyimi olan hekimler tarafından reçete edilmelidir. GRAFALON'unkalifiye tıbbi gözetim altında uygulanması gerekmektedir. Pozoloji/uygulama sıklığı ve süresiGRAFALON'un dozu endikasyona bağlıdır. Doz önerileri vücut ağırlığı temel alınarak belirlenir. Allojenik solid organ transplantasyonu yapılmış hastalarda akut transplant rejeksiyonunun önlenmesiTavsiye edilen GRAFALON doz aralığı 2 ile 5 mg/kg/gün'dür. En yaygın kullanılan dozajlar 3 ile 4 mg/kg/gün arasındadır. Tedavi, transplantasyonun yapılacağı gün, ya ameliyatöncesinde, ya ameliyat sırasında ya da derhal ameliyat biter bitmez başlamalıdır. Tavsiye edilentedavi süresi, hastanın durumuna, seçilen günlük doza ve eşzamanlı immünsüpresif rejimebağlı olarak 5 ile 14 gün arasında değişir. Allojenik solid organ transplantasyonunu takiben kortikosteroide dirençli akut rejeksiyonun tedavisiTavsiye edilen GRAFALON doz aralığı 3 ile 5 mg/kg/gün'dür. En yaygın kullanılan dozajlar 3 ile 4 mg/kg/gün arasındadır. Tedavi süresi, nakledilen organın durumuna ve vücudun verdiğiklinik tepkiye bağlı olarak genelde 5 ile 14 gün arasında değişir. Allojenik kök hücre transplantasyonundan (SCT) sonra yetişkinlerde Graft-Versus-Host hastalığının (GVHD) önlenmesiKök hücre transplantasyonuna yönelik miyeloablatif hazırlama rejimi kapsamında, tavsiye edilen GRAFALON dozu, genellikle kök hücre transplantasyonundan önceki 1-3 gün içindebaşlanarak uygulanmak üzere 20 mg/kg/gün'dür. Uygulama şekliİntravenöz kullanım (seyreltme sonrası) GRAFALON, pH değeri 3,7 ± 0,3 olan, hipotonik bir infüzyon çözeltisi konsantresidir, doğrudan enjekte edilmez. Hastaya intravenöz uygulanmadan önce 9 mg/mL (% 0,9) sodyum klorürçözeltisinde seyreltilmesi gerekmektedir. Gerekli osmolaliteyi sağlamak için 1:7 oranında birseyreltme (Her 1 mL GRAFALON'a 6 mL sodyum klorür solüsyonu eklenir) tavsiyeedilmektedir. Daha büyük oranlarda seyreltme ve buna bağlı olarak pH değerinin yükselmesidurumunda parçacık oluşumu baş gösterebilir. Gözle görülür şekilde partikül içeren çözeltilerkullanılamaz. Solid organ transplantasyonlarında standart infüzyon süresi 4 saattir, kök hücre transplantasyonlarında ise 4 ila 12 saatlik infüzyon süreleri tavsiye edilmektedir. İntraoperatifuygulamalarda genellikle 0,5 ila 2 saat arasında infüzyon süreleri uygulanmaktadır. 2/14 Uygulama esnasında hastanın aşırı duyarlılık ve anafilaksiye dair herhangi bir semptom gösterip göstermediği yakın takibe alınmalıdır. GRAFALON'un ilk dozunun verilmesi sırasında, ilk 30dakikada daha düşük bir infüzyon hızı uygulanmalıdır. Herhangi bir intolerans semptomugörülmezse infüzyon hızı arttırılabilir. Hekim, anafilaktik veya anafilaktoid reaksiyondurumlarında derhal müdahale etmeye hazır olmalı ve uygun tıbbi tedaviye başlamalıdır. Santral venöz kateter ile yapılan infüzyona alternatif olarak; büyük, debisi yüksek periferik bir damar da seçilebilir. Sistemik ve lokal toleransı arttırmak açısından infüzyondan önce metilprednisolon ve/veya antihistaminik verilmesi tavsiye edilir. Enjeksiyon yerinde standart hijyenkurallarına uyulması, infüzyon hızının azaltılması ve/veya venöz giriş noktasının değiştirilmesigibi hususlar göz önünde bulundurulmalıdır. GRAFALON'a sodyum heparin katılamaz, aynı yoldan sodyum heparin verilemez (bkz. Bölüm 6.2). Özel popülasyonlara ilişkin ek bilgiler Böbrek / karaciğer yetmezliğiBöbrek/karaciğer yetmezliği olan hastalarda özel bir doz ayarlamasına gerek yoktur. Karaciğer yetmezliğinde, trombosit ve koagülasyon parametrelerinin dikkatle izlenmesi tavsiye edilir.(Bkz. Bölüm 4.4. Özel kullanım uyarıları ve önlemleri). Pediyatrik popülasyonHalihazırda eldeki mevcut bilgiler Bölüm 4.8 ve 5.1'de açıklanmaktadır, ancak pozolojiye ilişkin bir öneride bulunmak mümkün değildir. Mevcut bilgiler, çocuk hastalarda erişkinhastalara kıyasla farklı dozlara gereksinim olmadığını göstermektedir. Geriyatrik popülasyonYaşlı hastalardaki (> 65 yaş) deneyimler sınırlıdır, ancak bu hastalarda diğer yaş gruplarına kıyasla farklı bir dozaja gereksinimi olduğuna dair bir bilgi bulunmamaktadır. 4.3. Kontrendikasyonlar- Etkin maddeye veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılık durumunda(Bkz. Bölüm 6.1.), - Yeterli terapötik kontrol altında olmayan bakteriyel, viral veya mikotik ve paraziterenfeksiyonlu hastalarda, - Ağır trombositopenili (örn. 50.000 trombosit/^L) solid organ transplantasyonu yapılanhastalarda (GRAFALON trombositopeniyi ve dolayısıyla kanama riskini arttırabilir) - Kök hücre transplantasyonlarının tedavinin bir parçası olarak gerçekleştirildiği durumlarharicinde malign tümörü olan hastalarda, kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriBulaşıcı ajanlara karşı uyarıİnsan kanından ya da plazmasından hazırlanan tıbbi ürünlerin kullanımı nedeniyle oluşacak enfeksiyonların önlenmesi için alınacak standart önlemler, donörlerin seçimi, herbir bağış ve plazma havuzlarının spesifik enfeksiyon işaretleri açısından kontrolü vevirüslerin inaktive edilmesi /uzaklaştırılması için etkili üretim adımlarının eklenmesidir.Buna rağmen, insan kanından yada plazmasından hazırlanan tıbbi ürünler uygulanacağızaman, enfeksiyon ajanlarının bulaşmasıyla ortaya çıkabilecek bulaşıcı hastalık olasılığı3/14 tam olarak önlenemez. Bu durum, henüz bilinmeyen ya da yeni görülen virüsler ve diğer patojenler için de geçerlidir.GRAFALON için alınan önlemlerin insan immün yetmezliği virüsü (HIV), Hepatit B virüsü (HBV) ve Hepatit C virüsü (HCV) gibi zarflı virüslere ve Hepatit A ve Parvovirüs B19 gibizarfsız virüslere karşı etkili olduğu kabul edilmektedir.Bu ürün insan kanından elde edildiğinden, virüsler gibi enfeksiyöz ajanların ve teorik olarak Creutzfeldt-Jacob (CJD) hastalığı ajanlarının bulaşma riskini taşıyabilir.Hekim bu ürünlerin riskleri ve yararları hakkında hastaya bilgi vermelidir.Gerektiğinde acil tedavinin sağlanabilmesi için GRAFALON uygulanan hastalar, donanım ve personel açısından yeterli laboratuvar ve tıbbi destek olanaklarına sahip kurumlarda bakılmalıdır.GRAFALON, kalifiye tıbbi gözetim altında uygulanmalı ve monitörize edilmelidir. Aşırı duyarlılık reaksiyonlarıGRAFALON kullanımı ile ilişkili aşırı duyarlılık reaksiyonları bildirilmiştir. İlk GRAFALON uygulamasından önce anamnez yoluyla hastada, özellikle tavşan proteinlerine karşı, alerjik yatkınlık olup olmadığının belirlenmesi tavsiye edilir. Tekrarlanan GRAFALON tedavileri ya da başka üreticilerin tavşan immünoglobulini preparatları ile yapılan tedaviler şeklindeki re-ekspozisyon durumlarında önceki GRAFALON tedavisindehassasiyet meydana gelmiş olabileceğinden, anafilaktik reaksiyon geliştirme riski daha yüksektir. Ağır trombositopeniGRAFALON trombositopeniyi ve dolayısıyla kanama riskini arttırabileceğinden, ağır trombositopeni geliştiren (trombosit/^L oranı 50.000'den az olan) solid organtransplantasyonu yapılan hastalarda, GRAFALON tedavisine ara verilmeli ya da tedavidurdurulmalıdır. Klinik personel gerekli acil önlemleri almak üzere hazırlıklı olmalıdır. Karaciğer hastalıklarıGRAFALON'un, karaciğer hastalığı olan hastalara dikkatli uygulanması gerekmektedir. Önceki pıhtılaşma bozuklukları daha kötüye gidebilir. Trombosit ve koagülasyon parametrelerinindikkatle izlenmesi tavsiye edilir. Kardiyovasküler hastalıklarGRAFALON'un, kardiyovasküler hastalığı olduğu bilinen veya olmasından şüphe edilen hastalara dikkatli uygulanması gerekmektedir. Hipotansiyonu olan veya ortostatik semptomu(örn.bilinç kaybı, halsizlik, kusma, mide bulantısı gibi belirtiler) olan kardiyakdekompensasyonlu hastalarda infüzyonun yavaşlatılması/kesilmesi düşünülmelidir. Enfeksiyonlarİmmünsüpresif tedavi genel olarak enfeksiyon riskini arttırır. GRAFALON uygulanan hastalarda artan bakteriyel, viral, mikotik ve/veya paraziter enfeksiyon riski söz konusudur.Takip ve tedavi ile ilgili uygun önlemlerinin alınması gerekir. Kök hücre transplantasyonu uygulanan hastalarda CMV (Sitomegalovirüs) ve EBV (Epstein-Barr Virüs) durumunun izlenmesi ve yeterli preemptif tedavi uygulanması tavsiye edilir. 4/14 AşılamaHastalar, GRAFALON ile tedavi sırasında uygulanan cansız aşıların daha az etkin olabileceği hakkında bilgilendirilmelidir. İmmün sistemi bastırılmış hastalarda zayıflatılmış canlı virüs aşılarıkontrendikedir. Sodyum: Bu tıbbi ürün her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında sodyum içermez. Kullanıma hazır infüzyon çözeltisinin sodyum içeriği daha yüksektir ve budurum seyreltme için kullanılan sodyum klorür çözeltisindeki miktardan kaynaklanmaktadır. Hayvansal kaynaklı madde: GRAFALON, etkin madde olarak tavşanlardan elde edilen anti insan T- lenfosit immünoglobulini içerir. Etkin maddenin üretim sürecinde kültür ortamı olarak sığır serumukullanılır. Son üründen sığır serumu tamamen uzaklaştırılmıştır. İzlenebilirlik Biyolojik tıbbi ürünlerin izlenebilirliğini iyileştirmek üzere, uygulanan ürünün adı ve seri numarası açıkça kaydedilmelidir. 4.5. Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriEtkileşim çalışmaları yapılmamıştır. İmmünsüpresif tıbbi ürünlerGRAFALON ile eşzamanlı olarak başka immünsüpresif tıbbi ürünler rutin olarak uygulanmaktadır. GRAFALON ile kortikosteroidler, purin antagonistleri, kalsinörin inhibitörleriveya mTOR inhibitörleri arasında doğrudan bir etkileşim gözlenmemiştir. Ancak, bu tıbbiürünlerin eşzamanlı olarak verilmesi enfeksiyon, trombositopeni ve anemi risklerini arttırabilir.Bu yüzden, kombine immünsüpresif tedavi alan hastaların dikkatle izlenmesi ve gerekenadaptasyonun yapılması tavsiye edilir. Aşılamaİmmün sistemi baskılanmış hastalarda zayıflatılmış canlı virüs aşıları kontrendikedir. Diğer aşılara karşı antikor yanıtı zayıf gerçekleşebilir (bakınız Bölüm 4.4.). Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyonÇocuk hastalarda deneyim sınırlıdır, ek bilgi bulunmamaktadır. Geriyatrik popülasyonYaşlı hastalardaki (> 65 yaş) deneyimler sınırlıdır, ek bilgi bulunmamaktadır. 4.6. Gebelik ve laktasyon GeneltavsiyeGebelik kategorisi C Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Veri bulunmamaktadır. 5/14 Gebelik dönemiGRAFALON'un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik/ ve-veya/ embriyonal / fetal gelişim/ ve-veya / doğum/ ve-veya / doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (Bkz. Bölüm5.3.). İnsanlara yönelik potansiyel risk bilinmemektedir. Tedavi için karar, hastanın durumu göz önünde bulundurularak ve ilacın yararları/riskleri değerlendirilerek ilgili hekim tarafından verilmelidir. Laktasyon dönemiGRAFALON'un emziren kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. İnsan IgG'sinin plasenta bariyerini geçebildiği veya anne sütüne geçebildiği göz önündebulundurulmalıdır. Tedavi için karar, hastanın durumu göz önünde bulundurularak ve ilacın yararları/riskleri değerlendirilerek ilgili hekim tarafından verilmelidir. Üreme yeteneği (fertilite)İnsanlardaki üreme yeteneğini (fertiliteyi) etkileyip etkilemediği bilinmemektedir. 4.7. Araç ve makine kullanımı üzerindeki etkiler4.8. İstenmeyen etkilerGüvenlilik profili özetiGRAFALON immünsüpresif özellikleri olan bir immünoglobulindir. Bu grup ürünlerle ilgili olarak iyi bilinen advers etkiler; sitokin salınımı ile ilişkili semptomlar, anafilaksi ve diğer alerjikvakalar şeklindeki aşırı duyarlılık reaksiyonları, enfeksiyon duyarlılığında artış ve malignansioluşumlarını içermektedir. Bu bölümde açıklanan advers reaksiyonlar ve sıklığı, rejeksiyon önleme endikasyonlu böbrek transplantasyonu yapılan (136 hasta) ve allojenik kök hücre transplantasyonu öncesi hazırlanan(106 hasta) toplam 242 hastanın katıldığı 6 klinik araştırmaya dayanan entegre güvenlilik analiziile incelenmiştir. İncelenen hastaların %94'ünde en az bir advers etki görülmüştür. Rapor edilenadvers reaksiyonlar kısmen ilgili prosedürlerden, yani renal transplantasyonlardan (idrar yollarıenfeksiyonu, böbrek yetmezliği) ve allojenik kök hücre transplantasyonlarından (pansitopeni,mukozal enflamasyon) sonra tipik olarak baş gösteren yaygın komplikasyonlardankaynaklanmaktadır. Aşağıdaki tabloda GRAFALON ile bildirilen advers reaksiyonlar listelenmiş ve sıklık ve sistem organ sınıfına göre sınıflandırılmıştır. Sıklık gruplandırmaları aşağıdaki skalaya göre tanımlanmıştır: Çok yaygın (>1/10); yaygın (>1/100 ile <1/10); yaygın olmayan (>1/1.000 ile <1/100); seyrek (<1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) Her sıklık gruplandırmasında istenmeyen etkiler azalan ciddiliğe göre sıraya koyulmuştur. 6/14 Advers reaksiyonların listesi Enfeksiyonlar ve enfestasyonlarÇok yaygın CMV enfeksiyonu*, idrar yolu enfeksiyonu* Yaygın Bakteriyel sepsis**, zatürre**, piyelonefrit*, herpes enfeksiyonu, influenza, oral kandidiyaz, bronşit, rinit, sinüzit, nazofarinjit, cilt enfeksiyonu Yaygın olmayan Kateter yeri enfeksiyonu, Epstein-Barr virüs enfeksiyonu, gastrointestinal enfeksiyon, erizipel, yara enfeksiyonu (Kistler ve polipler de dahil olmak üzere) iyi huylu vekötü huylu neoplazmalarYaygın Lenfoproliferatif bozukluk* Kan ve lenf sistemi hastalıklarıÇok yaygın Anemi Yaygın Pansitopeni**, trombositopeni, lökopeni Yaygın olmayan Polisitemi Bağışıklık sistemi hastalıklarıYaygın Anafilaktik şok**/anafilaktik reaksiyon, aşırı duyarlılık Metabolizma ve beslenme hastalıklarıYaygın Hiperlipidemi Yaygın olmayan Vücutta sıvı toplanması, hiperkolesterolemi Sinir sistemi hastalıklarıÇok yaygın Baş ağrısı, titreme Yaygın Parestezi Göz hastalıklarıYaygın Fotofobi Kardiyak hastalıklarYaygın Taşikardi Vasküler hastalıklarÇok yaygın YaygınYaygın olmayan Yüzde ve boyunda kızarma Hipotansiyon*, venooklüzif hastalık, hipertansiyon Şok**, lenfosel Solunum, göğüs bozuklukları ve mediastinal hastalıklarÇok yaygın Nefes darlığı Yaygın Öksürük, epistaksi Gastrointestinal hastalıklarÇok yaygın Kusma, mide bulantısı, ishal, karın ağrısı Yaygın Stomatit Yaygın olmayan Reflü özofajit, dispepsi Hepato-bilier hastalıklarYaygın Hiperbilirubinemi 7/14 Deri ve deri altı doku hastalıklarıYaygın Eritem, şiddetli kaşıntı (prürit), döküntü Yaygın olmayan İlaç erüpsiyonu Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın Miyalji, artralji, sırt ağrısı, müsküloskeletal katılık Böbrek ve idrar hastalıklarıYaygın Renal tübüler nekroz*, hematüri Yaygın olmayan Böbrek yetmezliği**, renal nekroz* Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok yaygın Yaygın Yaygın olmayan
hipertermi, mukozal inflamasyon,
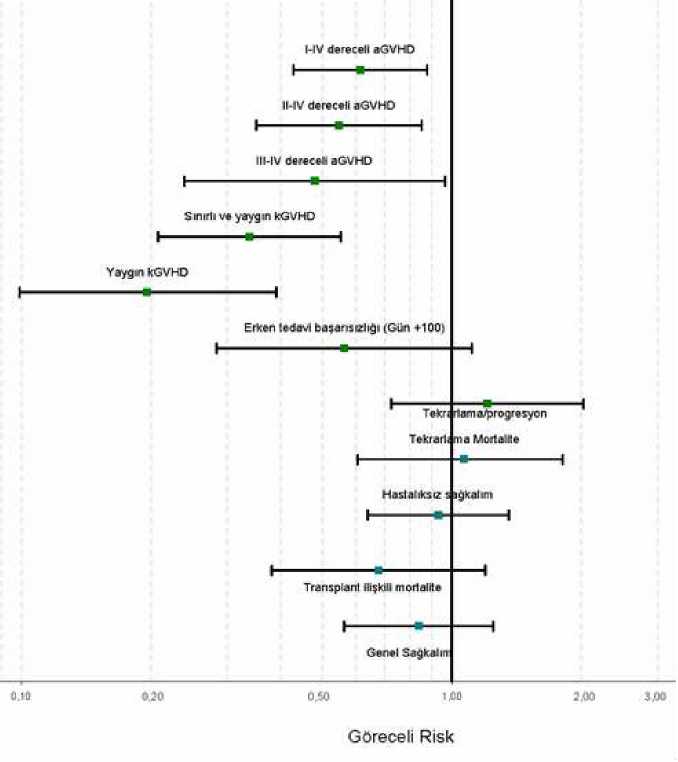
Pireksi**, grip nöbeti Güçsüzlük, göğüs ağrısı,periferik ödemlerÖdem AraştırmalarYaygın Kan kreatinininde artış*, pozitif sitomegalovirüs antijeni, C- reaktif proteinde artış Yaygın olmayan Hepatik enzimlerde artış * ciddi reaksiyon** bireysel hallerde fatal sonuç veren ciddi reaksiyonSecili advers reaksiyonların tanımı Sitokin salımı ile ilişkili semptomlarBu reaksiyonlar sitokin salınımına bağlı olarak baş gösterir ve ateş, grip nöbeti, baş ağrısı, bulantı, kusma, taşikardi ve kan dolaşımı değişimlerini içerir. Bu reaksiyonlar sitokin salımısendromu olarak özetlenebilir. GRAFALON'un uygulanması sırasında veya sonrasında sıkgörülürler. Semptomlar genellikle kolaylıkla kontrol altına alınabilir. Profilaktik ilaç tedavisiyoluyla bu semptomları hafifletmek mümkündür. Aşırı duyarlılık reaksiyonlarıCilt kızarması, döküntü, eritem, ödem, bronkospazmlı veya bronkospazmsız dispne ve öksürük, uygulama sırasında ve sonrasında yaygın olarak görülen reaksiyonlardır. Bu reaksiyonlar genelolarak tedaviye iyi yanıt verir. Uygun profilaktik ilaç tedavisi uygulayarak bu semptomlarıiyileştirmek mümkündür. Anafilaksi/anafilaktik şok görülürse, infüzyona derhal son verilmesigerekir. GRAFALON'un uzun süreli ve daha düşük dozajlı uygulandığı tedavi süreçlerindegörülen serum hastalığı nadiren ağır seyreder ve genellikle semptomatik tedaviye iyi yanıt verir. Hematolojik değişimlerGRAFALON uygulamasının ardından, trombositopeni ve lökopeni olarak gözlemlenen trombosit ve lökosit sayımındaki geçici değişimler olmaktadır. GRAFALON uygulamalarınınardından anemi de çok yaygın olarak gözlemlenir. 8/14 Enfeksiyonlarİmmünsüpresif tedavi uygulanan hastaların enfeksiyonlara karşı duyarlılığı daha yüksektir. GRAFALON uygulanan hastaların çoğu, solid organ transplantasyonunu izleyen ilk yıliçerisinde bakteriyel, viral veya mikotik kökenli enfeksiyonlar geliştirmiştir. İdrar yoluenfeksiyonları çok yaygın bakteriyel enfeksiyonlardır; çok yaygın viral enfeksiyonlar isesitomegalovirüsünün (CMV) neden olduğu enfeksiyonlardır. Yaygın olarak bildirilenenfeksiyonlar arasında bakteriyel sepsis, bakteriyel zatürre, piyelonefrit, herpetik viralenfeksiyonlar ve oral kandidiyaz vardır. EBV / Epstein-Barr enfeksiyonları, CMV zatürresi veCMV gastroenterit yaygın olmayan viral enfeksiyonlar arasındadır. Sistemik kandidiyazyaygın olmayan bir fungal enfeksiyondur. Enfeksiyonların çoğunluğu tedaviyleiyileştirilebilmektedir. Yaşamı tehdit eden ve hatta ölüme neden olan enfeksiyonların varlığı dabildirilmiştir. Hastanın uygun şekilde moniterizasyonu ve profilaktik tedavisi, enfeksiyonoranını azaltabilir. MaligniteGenel olarak araştırmalara ve yayınlara bakıldığında GRAFALON tedavilerini izleyen malignite vakaları genellikle düşük olup bu vakaların sayısı diğer immünsüpresif medikasyonkombinasyonlarında gözlenen vakaların sayısı ile hemen hemen aynıdır. Post-transplantlenfoproliferatif hastalık sadece allojenik kök hücre transplantasyonu yapılan hastalarda (%1,7)rapor edilmiştir. HemolizSeyrek (her 1000 hastada 1'den az): GRAFALON uygulamasıyla ilişkili olarak hemoliz olayları bildirilmiş ve izole vakalarda fatal seyir görülmüştür. Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyonEldeki mevcut veri sınırlıdır. Mevcut bilgiler, çocuk hastalarda GRAFALON'un güvenlik profilinin yetişkin hastalardakine göre önemli bir fark göstermediğine işaret etmektedir. Yaşlı hastalarYaşlılar (>65 yaş) geçirdikleri uzun süreli kronik hastalıklar ve buna bağlı tedaviler nedeniyle genel immünosupresyona karşı daha duyarlı olabilirler. Ayrıca, immün sistemmekanizmalarındaki biyolojik düşüş nedeniyle de yaşlıların enfeksiyon geliştirme riskinin dahayüksek olduğu düşünülmektedir. Bununla birlikte, bu popülasyonda GRAFALON kullanımındankaynaklanan herhangi bir advers reaksiyon raporlanmamıştır. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanaksağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 9/14 4.9. Doz aşımı ve tedavisiDozun aşılması durumunda, derhal geniş spektrumlu antibiyotik, antimikotik ve antiviral tedavi uygulanması tavsiye edilmektedir. GRAFALON tedavisi durdurulmalı ve eşzamanlı başkaimmünsüpresif tedaviler ise hemograma (özellikle lökositlere ve lenfositlere) göreayarlanmalıdır. Trombosit sayımı yakından izlenmeli ve uygun görüldüğü şekilde replasmantedavisi başlatılmalıdır. 5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: Antineoplastikler ve İmmünomodülatör Ajanlar/ Selektif İmmünosupresanlar ATC kodu: L04AA04 GRAFALON, bir lenfoblastoid hücre dizisi olan Jurkat hücreleriyle immünize edilmiş tavşanlardan elde edilen bir poliklonal anti-T-lenfosit immünoglobulinidir. T-hücrebelirteçlerinin Jurkat hücreleri üzerindeki ekspresyonu GRAFALON'un lenfositler üzerindekietkileriyle tutarlıdır. GRAFALON'un Jurkat hücrelerinin diğer yüzey antijenlerine karşı daantikor içerdiği belirlenmiştir. GRAFALON uygulanan hastalarda gerçekleştirilen lenfosit alt küme analizleri, Jurkat hücre dizisi tarafından ekspresyonu yapılan yüzey proteinlerini taşıyan lenfosit alt kümelerinde azalmaolduğunu göstermektedir. GRAFALON, insan lenfositlerine karşı sitotoksik etkilidir. Veriler, aktifleştirilmiş lenfositlerin daha duyarlı olduğunu göstermektedir. GRAFALON, T-hücrelerini (CD3 vasıtasıyla) veya lenfositleri aktifleştirmemiştir, ancak T-hücrelerinin bir anti-CD3 antikoru tarafından aktivasyonunu engellemiştir. GRAFALON, adezyon moleküllerine bağlanarak insan melanoma hücrelerinin göçünü azaltmıştır. Domuz böbrekleri GRAFALON ile veya GRAFALON olmadan inkübe edilmiş insan lenfositleriyle perfüze edildiğinde, GRAFALON'un ilavesi ile böbrek damarlarında vaskülerdirencin düşmesi ve böbrekte daha az lenfosit tutulması, anti-adezif özelliklerle (anti-LFA-1 veanti-ICAM-1 aktivitesi) açıklanabilir. GRAFALON, rhesus maymunlarında deri grefti ömrünü uzatmaktadır. Bu modelde immünosupresyon belirgin olup lökopeni ve lenfopeni gözlenmiştir. GRAFALON, cynomolgusmaymunlarında iskemi / reperfüzyon hasarlarında lenfosit ve nötrofil adezyonunu engelleyerekfaydalı bir etki göstermiştir. GRAFALON ile standart tedavi uygulanan renal transplant hastalarında lökosit ve trombosit sayısı önce düşmüş, ancak transplantasyonu izleyen 10 gün içerisinde tekrar normal düzeyedönmüştür. Lenfosit ve lenfosit alt popülasyonlarının sayımlarında da anlamlı bir düşüşgörülmüştür. CD2, CD3, CD4 ve CD8 sayımlarında düşüş izlenmiştir. CD8 ilk 20 post-operatif 10/14 gün içerisinde normal düzeye dönmüş, ancak CD2, CD3 ve CD4 için aynı durum geçerli olmamıştır. Böbrek transplantasyonu yapılan hastalarda, uygulanan standart GRAFALON tedavisinin lenfosit alt popülasyonları üzerinde etkili olduğu ve CD4/CD8 oranında 66 aya kadar süren birtersine dönüş gerçekleştiği bildirilmiştir. 9 mg/kg'lık tek bir yüksek GRAFALON dozunun ardından, TNF-a ve IL-10 yükselmiş, IL-12p40 hafifçe düşmüş, IL-12p70 ise stimüle olmamıştır. Kök hücre transplantasyonu çalışmasıUyumlu akraba dışı donör greftleriyle yapılan iki yıllık bir kök hücre transplantasyonu izleme çalışmasının sonuçları, standart GVHD profilaksisine ek olarak GRAFALON verilenhastalarda akut Graft-Versus-Host Hastalığı (aGVHD), kronik GVHD (kGVHD) ve GVHDilişkili mortalite sıklığının azaldığını göstermiştir. Metodlar: Araştırma Avrupa çapında 10 ülke ve 31 merkezde Faz 3 prospektif, açık ve çok merkezli bir çalışma şeklinde yürütülmüştür. Hematolojik maligniteli 202 erişkin hasta, Siklosporin veMetotreksata ilave olarak GRAFALON uygulanan veya uygulanmayan tedavi gruplarına görerandomize edilerek ayrılmıştır. Kök hücre transplantasyonundan önce Gün -3, Gün -2 ve Gün-1'de 20 mg/kg GRAFALON uygulanmıştır. Myeloablatif hazırlığın ardından akraba dışıdonörlerden periferik kan (n=164; %82) veya kemik iliği (n=37; %18) grefti nakledilen 201hasta tam analiz seti kapsamına dahil edilmiştir ve randomize olarak belirlenen tedavişekillerine göre analiz edilmiştir (GRAFALON n=103, kontrol n=98). Primer son nokta erkentedavi başarısızlığıdır: III-IV dereceli, ağır aGVHD veya transplantasyonu izleyen 100 güniçerisinde ölüm gözlenmiştir. Sonuçlar: Siklosporin A ve Metotreksat ile uygulanan standart GVHD profilaksisine GRAFALON eklendiğinde tüm GVHD şekillerinin sıklığı gerilemiştir: Akut GVHD (ağırlık grupları I-IV, II-IV ve III-IV) ve kronik GVHD (ağırlık grupları sınırlı ve yaygın). Tedavi grupları arasındatekrarlama, transplantasyonla ilişkili mortalite ve genel sağkalım bakımlarından farkgörülmemiştir. Primer son nokta: Erken tedavi başarısızlığı sıklığı, %34,7 olan kontrol grubuna kıyasla, %21,4 olarak gerçekleşmiştir (düzeltilmiş eşitsizlik oranı [odds ratio] 0,56, güven aralığı [GA] [0,281,11]; p=0,0983). GRAFALON grubunda kümülatif III-IV dereceli aGVHD sıklığı %11,7 kontrol grubunda ise %25,5 olarak gerçekleşmiştir (düzeltilmiş tehlike oranı [TO] 0,48, GA [0,24-0,96]; p=0,0392).Kümülatif II-IV dereceli aGVHD sıklığı ise GRAFALON grubunda %33,0 kontrol grubunda%52,0 dir. (düzeltilmiş TO 0,55, GA [0,35-0,85]; p=0,0077). 2 yıllık kümülatif yaygın kronik GVHD sıklığı %12,2'ye karşı %45,0 olarak belirlenmiştir (düzeltilmiş TO 0,196, GA [0,10-0,39]; p<0,0001). 11/14
Pediyatrik popülasyonGRAFALON'un çocuklarda kullanımına ilişkin birçok bildiri yayınlanmıştır. Bu bildiriler, bu ürün ile çocuk hastalardaki geniş deneyimi yansıtmakta ve çocuk hastalardaki güvenlik veetkinlik profilleri ile yetişkin hastalardakiler arasında önemli bir fark olmadığını ortayakoymaktadır. Ancak, çocuk hastalarda dozaja ilişkin tam bir fikir birliği bulunmamaktadır. Pozoloji, yetişkinlerde olduğu gibi, çocuk hastalarda da endikasyon, uygulama rejimi ve diğerimmünsüpresif ajanlarla kombinasyona bağlıdır. Hekim çocuk hastalarda uygun dozajıbelirlerken bu faktörleri göz önünde bulundurmalıdır. 5.2. Farmakokinetik özelliklerFarmakokinetik veriler toksikolojik çalışmaların toksikokinetik bölümlerinden elde edilmiştir. GRAFALON hızlı absorbe edilir ve eliminasyonu yavaştır. Sistemik maruz kalış, tüm dozdüzeylerinde orantılı olmuş ve tekrarlanan dozlarda, cinsiyete göre değişmeksizin, artmıştır.Prednisolon ile arasında herhangi bir ilaç-ilaç etkileşimi görülmemiştir. Emilim:GRAFALON, intravenöz uygulanır ve bu nedenle biyoyararlanımı %100'dür. 12/14 Dağılım:GRAFALON'un yarı ömrü yaklaşık 14 gün olup (7 gün süreyle 4 mg/kg/gün dozaj durumunda) doza ve uygulama süresine bağlı olarak bu süre 4 ile 45 gün arasında değişebilir. Biyotransformasyon:GRAFALON, diğer vücut proteinleri gibi protein metabolizmasına tabidir. Eliminasyon:Literatür araştırmaları, T-hücre spesifik antikorların total tavşan IgG'ine kıyasla daha hızlı elimine edildiğini göstermektedir. 5.3. Klinik öncesi güvenlilik verileriNon-klinik toksikoloji çalışmaları kapsamında GRAFALON'un tek-doz çalışması tavşanlarda, cynomolgus maymunlarında ve rhesus maymunlarında; tekrarlanan-doz çalışması ise rhesusmaymunlarında araştırılmıştır. GRAFALON'a karşı tolerans iyidir. Gözlemlenen bu etkilerinbazıları GRAFALON'un, immünosupresyon ve, başta T-lenfositler olmak üzere, lenfositsayısında belirgin düşüş şeklinde kendini gösteren spesifik farmakodinamik etkisindenkaynaklanmaktadır. Yüksek dozlarda (250 ile 300 mg/kg), rhesus maymunlarında anafilaktikreaksiyonlar gözlenmiştir. Prednisolon ile birlikte uygulanması GRAFALON'un toksisitesiniazaltmıştır. Serum hastalığı görülmemiş ve klinik belirtilerde GRAFALON'un tek başınauygulandığı duruma kıyasla belirgin bir düzelme olmuştur. Kedilerde yapılan bir güvenlilik farmakolojisi çalışmasında MSS, kardiyovasküler veya solunum sistemleri üzerinde bir etki görülmemiştir. Genotoksik aktivite, bölgesel tahrişler ve anti-glomerüler bazal membran antikorları gözlemlenmemiştir. Karsinojenite veya reprodüktif toksisite çalışmaları yapılmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddeler listesiSodyum dihidrojen fosfat dihidrat Fosforik asit (% 85) (pH ayarı için) Enjeksiyonluk su 6.2. GeçimsizliklerGRAFALON infüzyon çözeltisi konsantresi glukoz, kan, kan türevleri, lipit içeren çözeltiler ve sodyum heparinle karıştırılmamalıdır. 6.3. Raf ömrüRaf ömrü 36 aydır. Seyreltilmiş solüsyonların oda sıcaklığında 24 saat süreyle kimyasal ve fiziksel açıdan kullanılırlığını koruduğu kanıtlanmıştır. Ancak seyreltilen ürün, mikrobiyolojik açıdan derhal 13/14 kullanılmalıdır. Eğer derhal kullanılmazsa, kullanıma kadar geçen süreden ve saklama şartlarından uygulayıcı sorumludur. 6.4. Saklamaya yönelik özel uyarılar2°C-8°C arasında buzdolabında saklayınız. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız. Işıktan koruyunuz, bunun için flakonu kutusunda saklayınız. Seyreltilmiş tıbbi ürünün saklama koşulları için Bölüm 6.3.'e bakınız. 6.5. Ambalajın niteliği ve içeriği5 mL çözelti içeren 1 flakonluk veya 10 flakonluk ambalaj. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi atıkların kontrolü yönetmeliği ve Ambalaj atıklarının kontrolü yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİFRESENIUS MEDİKAL HİZMETLER AŞ. Rüzgarlıbahçe Mah. Cumhuriyet Cad. Hasoğlu Plaza No: 39 Kat: 7, 34805 Kavacık / İstanbul / TÜRKİYE Tel: (0216) 680 29 86 Fax: (0216) 680 29 88 Web: www.freseniusmedicalcare.com.tr 8. RUHSAT NUMARASI (LARI):25 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 16 Ocak 2008 Ruhsat yenileme tarihi: 31 Mart 2014 10. KÜB'ÜN YENİLENME TARİHİ14/14 |
İlaç BilgileriGrafalon 20mg/ml I.v. İnfüzyonluk Çözelti KonsantresiEtken Maddesi: Insan T- Lenfosit Immünoglobulini Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.