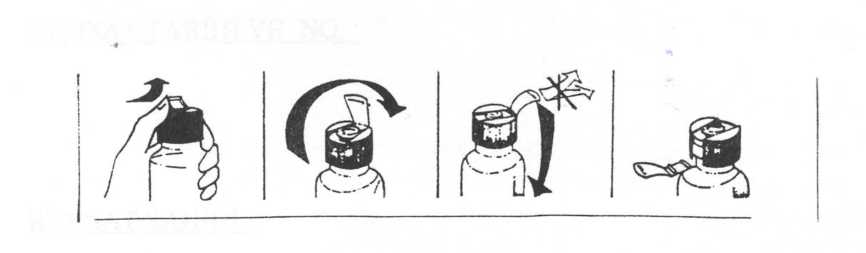
Oligofer Fol 40mg/15ml Oral Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIOLİGOFER FOL 40 mg/15 ml oral çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir 15 ml'lik flakon etken madde olarak 40 mg. Fe3+ (üç değerlikli demir)'e eşdeğer demir proteinsüksinilat ve rezervuarlı kapak içerisinde, bastırmakla çözelti içerisine giren (0.185 mg.folinik asit'e eşdeğer) 0.235 mg. kalsiyum folinat pentahidrat içerir. Yardımcı maddeler:Metil parahidroksibenzoat sodyum tuzu E219 0.045g Propil parahidroksibenzoat sodyum tuzu E217 0.015g Yardımcı maddeler için 6.1.'e bakınız. 3. FARMASÖTİK FORMOral çözelti pH'ı 6.5 ila 8.5 olan berrak, kahverengi çözelti. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarDemir ve folik asit eksikliğinin tedavisi veya önlenmesi. 4.2. Pozoloji ve uygulama şekliPozoloji/ uygulama sıklığı ve süresi:OLİGOFER FOL, yetişkinlerde günde 15 - 30 ml (40-80 mg demire eşdeğer) (1-2 flakon) iki eşit doza bölünmüş olarak ve tercihen yemeklerden önce alınır. Çocuklarda hekimin önerisine göre tercihen yemeklerden önce günde 1.5 ml./kg. şeklindeki dozaj 2 veya 3'e bölünerek uygulanır. Tedavi süresi: Vücut demir depoları normal düzeye gelinceye kadar (genellikle 2-3 ay) tedaviye devam edilmelidir. 1 Uygulama şekli:OLİGOFER FOL, oral yoldan uygulanmalıdır. Flakon üzerindeki koruyucu kapak kuvvetlice ileriye itilip kaldırıldıktan sonra kapağın tam ortasındaki hazneli kısım kuvvetlice aşağıya bastırılır ve flakon iyice çalkalanır. Daha sonra kapakaçılıp su ile ya da direkt olarak flakondan içilir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:OLİGOFER FOL, ciddi karaciğer ve böbrek hastalıklarında kullanılmamalıdır. Pediyatrik popülasyonBaşka bir şekilde önerilmediği takdirde 1.5 ml/kg/gün (4 mg/kg/gün Fe3+ ve 0.0235 mg kalsiyum folinate eşdeğer) günden iki veya üç seferde verilebilir. Geriyatrik popülasyonYaşlılardaki uygulama aynen erişkinlerdeki gibidir. 4.3. Kontrendikasyonlarİçerdiği maddelerden herhangi birine karşı aşırı duyarlılıkta; hemosiderozis; aplastik, hemolitik veya sideroakrestik anemilerde; kronik pankreatit, hemokromatozisde ve karaciğer sirozundakullanılmamalıdır. Pernisiyöz anemide eğer B12 vitamini ile beraber uygulanmıyorsa,kullanılmamalıdır. OLİGOFER FOL içeriğinde 1.4 mg sorbitol bulunmaktadır. Nadir kalıtımsal früktoz intolerans problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.4. Özel kullanım uyarıları ve önlemleriÇocukların ulaşabileceği yerden uzak tutunuz. Demir eksikliği veya demir eksikliği anemisinin temelinde yer alabilecek hastalıklar tespit edilmeli ve bu hastalıklar uygun şekilde tedavi edilmelidir. Ürünün süt proteini içermesinden dolayı, alerjik reaksiyon geliştirebilecek, süt-proteini intoleransi olan bireylerde dikkatle kullanılmalıdır. Tolerans veya bağımlılık riski açısından özel bir uyarı yoktur. Sürekli kanama, menoraji veya hamilelik durumları haricinde tedavi süresi 6 aydan uzun olmamalıdır. 2 Çocuklarda demir içeren ürünlerin yanlışlıkla alınması ölümcül zehirlenmeye yol açabilir. Çocukların erişemeyeceği yerlerde saklayınız. OLİGOFER FOL oral çözelti içeriğinde, gecikmiş alerjik reaksiyona neden olabilecek metilpara hidroksibenzoat sodyum tuzu, propilparahidroksi benzoat sodyum tuzu bulunmaktadır. İçeriğinde bulunan sorbitol E420 nedeniyle, nadir kalıtımsal früktoz intolerans problemi olan hastaların bu ilacı kullanmamaları gerekir. OLİGOFER FOL propilen glikol ve mannitol içermektedir ancak dozu nedeniyle herhangi bir uyarı gerekmemektedir. OLİGOFER FOL her flakonda 15 mg sodyum sakarin içermektedir. Bu durum, kontrollü sodyum diyetinde olan hastalar için gözönünde bulundurulmalıdır. Aşağıdaki durumlarda kullanımı dikkatle değerlendirilmelidir: Alkolizm, hepatit, aktif enfeksiyonlar, enterit, kolit, divertikülit ve ülseratif kolit gibi intestinal sistemin inflamatuvar hastalıkları, pankreatit ve peptik ülser. Dışkıda kan aranması için yapılan testler OLİGOFER FOL kullanımı sırasında yapıldığında yanıltıcı olabilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDemir türevleri tetrasiklinler, bisfosfonatlar, kinolon grubu antiinfektif ilaçlar, penisilamin, tiroksin, levadopa, karbodopa, alfa-metildopa gibi ajanların emilimini ve biyoyararlanımını azaltabilir. Builaçlar OLİGOFER FOL uygulamasından en az 2 saat önce veya sonra uygulanmalıdır. Demir emilimi, 200 mg'ın üzerinde askorbik asitin eş zamanlı uygulaması ile artabilmekte veya antiasid kullanımı ile azalabilmektedir. Kloramfenikol demir tedavisine terapötik yanıtıgeciktirebilir. H2-reseptör antagonistleri ile eş zamanlı kullanımı sırasında farmakolojik etkileşim rapor edilmemiştir. Bitkiler, süt, kahve ve çay içerisinde yer alan ve demir ile kompleks yapan ajanlar (fosfat, fitat, oksalat gibi) demir emilimini baskılar. Bu tür yiyecek ve içecekler OLİGOFER FOLuygulamasından en az 2 saat önce veya sonra uygulanmalıdır. Bazı antineoplastik ve antilösemik ilaçlar (aminopterin, metotreksat ve diğer pterinik türevleri) folik asidin kompetitif antagonistleri olarak rol oynarlar. Bu nedenle folik asit veya folinik bazlı tümpreparatlar gibi OLİGOFER FOL uygulanması da neoplastik hastalıklar veya lösemi gibi antifolinikilaçlarla tedavi gören hastalarda kullanılmamalıdır. Etkinliğin azalmasına yol açabileceğindensülfamid ve trimetoprim gibi antibakteriyel ajanlarla aynı zamanda uygulanmaması gerekir. Süt ve yumurta ile birlikte kullanılması durumunda demirin emilimi engellenir.3 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi A' dır. o Bu gebelik kategorisine rağmen hekim, gebenin ilacı kullanıp kullanmaması konusundaki nihai kararını; gebelik haftasına, gebenin var olan/tespit edilen hastalığına ve diğerözelliklerine göre ayrıntılı yarar-risk değerlendirmesi yaparak vermelidir.o Risk kategorileri ilacın gebelikteki potansiyel riski konusunda sağlık personeline yardımcıolmakla birlikte, hekimin değerlendirmesi esastır. Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda kullanılmamasına ait herhangi bir bilgi bulunmamaktadır. Gebelik dönemiİyi yönetilmiş epidemiyolojik çalışmalar etkin maddenin gebelik üzerinde ya da fetusun/yeni doğan çocuğun sağlığı üzerinde advers etkileri olmadığını göstermektedir. OLİGOFER FOL gebelik döneminde kullanılabilir. Laktasyon dönemiOLİGOFER FOL 'un emzirme döneminde kullanımında sakınca yoktur. Üreme yeteneği/ FertiliteÜreme yeteneği üzerine herhangi bir etkisi bulunmamaktadır. 4.7. Araç ve makine kullanımı üzerindeki etkilerOLİGOFER FOL'ün, araç ve makine kullanımı üzerine etkisi bildirilmemiştir. 4.8. İstenmeyen etkilerİlaca bağlı olduğu kabul edilen advers reaksiyonlar aşağıda listelenmiştir: Yaygınlık şu şekilde tanımlanır: çok yaygın (> 1/10); yaygın (> 1/100 ila < 1/10); yaygın olmayan (> 1/1.000 ila < 1/100); seyrek (> 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000), bilinmiyor(eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sistemi hastalıklarıBilinmiyor: Alerjik belirtiler Gastrointestinal hastalıklarSeyrek: Diyare, bulantı, epigastrik ağrı Demir ürünleri dışkı renginin siyah veya koyu griye dönüşmesine neden olabilir. Bu yan etkiler dozun azaltılması veya tedavinin sonlandırılmasıyla geçer. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. 4 Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi(TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta : tü[email protected]; tel: 0 800314 00 08; faks : 0312 218 35 99). 4.9. Doz aşımı ve tedavisiAkut toksisite çalışmalarında demir proteinsüksinilatın çok iyi tolere edildiği gösterilmiştir; fare ve sıçanlarda oral uygulama sonrası LD50 değerleri 4000 mg./kg. üzerindedir. Demirin yüksek dozda alınımını izleyen 6 - 8 saat süresinde hastada abdominal ağrı, bulantı, kusma, diyare ve hematemez görülebilir. Bu semptomlara uyku hali, sararma siyanoz, şok ve komahali de eşlik edebilir. Ipeka şurubu ile emesis oluşturulur; hasta komatoz ise sodyum bikarbonatla lavaj yapılır. Sıvı ve elektrolit dengesinin sağlanması ve asidoz için i.v. sodyum bikarbonat uygulanır. Antidotudeferoksamindir. Şiddetli vakalarda yavaş i.v. enjeksiyon şeklinde uygulanır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: :Folik asit ile kombine oral demir preparatı; Antianemik ilaç. ATC kodu : B03AD Demir, hemoglobin oluşumunda rol alan, etkin bir eritropoez ve kanın oksijen taşıma kapasitesi için yeterli miktarda alınması gereken esansiyel bir elemandır. Ayrıca, miyoglobulin üretiminde debenzer bir fonksiyona sahip olan demir, birçok esansiyel enzim için de bir kofaktördür. Demir proteinsüksinilat, demir III iyonlarının proteik bir taşıyıcı olan kazeine bağlı olduğu, yarı sentetik bir bileşiktir. Asit ortamda çözünmediğinden demir iyonlarının midede serbest halegeçmesi söz konusu değildir. Bu özelliği ile diğer demir preparatlarından farklı olarak gastriktolerans önemli ölçüde artmış olup, mukozanın tahrişine bağlı olarak ortaya çıkabilecek bulantı,mide yanması gibi yan etkilerin görülme insidansı son derece düşüktür. Demir proteinsuksinilatınçözünürlüğü pH = 6.5'in üzerine çıkması ve duodenumdaki pankreatik enzimlerin proteikkompleksi parçalaması ile oluşur ve serbest hale geçen demir absorbe olur. 5.2. Farmakokinetik özelliklerGenel özelliklerDemir:Emilim:Demir proteinsüksinilatın protein kısmı gastrointestinal sıvılarla sindirilince demir serbestleşerek emilir. Demir proteinsuksinilat başlıca duodenumdan absorbe olur. Demir eksikliği olmayanbireylerde alınan demirin %3 ile 10'u absorbe olurken, demir eksikliğinde bu oran, yetersizlikleorantılı olarak, % 20 - 30'lara erişir.Dağılım:Hemoglobin'e bağlanma oranı yüksektir. 5 Eliminasyon:Demirin itrahı için herhangi bir fizyolojik sistem bulunmamakla birlikte deri, saç ve tırnaklardan; feçes, terleme, anne sütü (0.5 - 1 mg./gün), menstruel kan ve idrarla, düşük miktarlarda bir kayıpsöz konusudur. Ortalama günlük kayıp, erkekler ve postmenopozal kadınlarda 1 mg.; premenopozalkadınlarda ise 1.5 mg.'dır. Folik Asit:Emilim:Serbest folik asit ince barsağın tümü boyunca absorbe edilir. Bununla beraber mideden sonraki ilk 1/3 bölümünde absorpsiyon diğer bölümlerde olduğundan daha hızlıdır. Eliminasyon:Atılım karaciğerden ve böbreklerden olur. Safra içinde barsağa gelen folik asidin bir kısmı reabsorbsiyona uğrar. 5.3. Klinik öncesi güvenlilik verileriAkut Toksisite:50 mL/kg OLİGOFER FOL oral çözelti (2000 mL/kg demir proteinsüksinilat ve 1000 gg/kg kalsiyum folinat) verilen ratlarda dispne, depresyon, hareketsizliğe yatkınlık belirtileri gözlenmiş vebu belirtilerin ilacın bırakılmasından 120 dakika sonra kaybolduğu bildirilmiştir. Ratlarda LD 50'nin 50 mL/kg (2000 mL/kg demir proteinsüksinilat ve 1000 gg/kg kalsiyum folinat)'ın üzerinde olduğu gözlenmiştir. Kronik Toksisite:Kronik toksisite çalışmaları 3 grup rat üzerinde yürütülmüştür. 1. grup: 2.5 mL/kg (100 mg demir proteinsüksinilat ve 50 gg/kg kalsiyum folinata eşdeğer) 2. grup: 1.25 mL/kg ( 50 mg demir proteinsüksinilat ve 50 gg/kg kalsiyum folinata eşdeğer) 3. grup: kontrol İlaç verilen grup ile kontrol grubu arasında vücut ağırlığı ve genel durum açısından bir farklılık gözlenmemiştir. Ayrıca nekropside ve laboratuvar çalışmalarında her iki grup arasında bir farklılıkbulunmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSorbitol Sodyum sakarin Metil parahidroksibenzoat sodyum tuzu Propil parahidroksibenzoat sodyum tuzu Mannitol Propilen glikol Vişne esansı Sodyum sakarin Saf su 6.2 Geçimsizlikler6 Bilinen bir geçimsizliği yoktur. 6.3. Raf ömrü24 ay 6.4 Saklamaya yönelik özel tedbirler30°C'nin altındaki oda sıcaklığında saklayınız. 6.5 Ambalajın niteliği ve içeriği10 x 15 ml. flakonlarda sunulur. 6.6 Tıbbi üründen arta kalan maddelerin imhası ve dier özel önlemlerKullanılmamış olan ürünler yada atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİITALFARMACO S.p.A., İtalya lisansı ile, ITF İlaç Sanayi ve Ticaret Ltd. Şti. Emniyetevleri Mah. Eski Büyükdere Cad. No: 1/1 Sapphire Binası 31. Kat No: 3101 ve 3106 Kağıthane - İstanbul 8. RUHSAT NUMARASI224/84 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 27.05.2010 Ruhsat yenileme tarihi: 22.01.2016 10. KÜB'ÜN YENİLENME TARİHİ:7 |
İlaç BilgileriOligofer Fol 40mg/15ml Oral ÇözeltiEtken Maddesi: Demir Protein Süksinilat Kalsiyum Folinat Pentahidrat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.