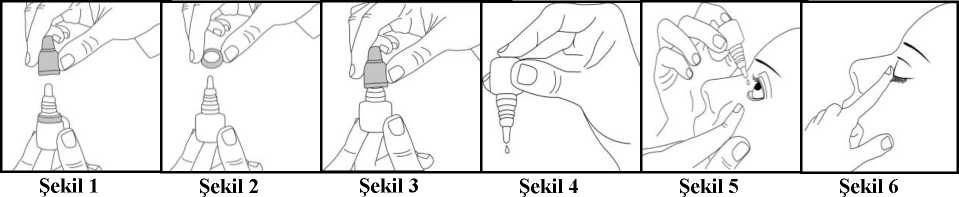
Eye-visol %0,05 Göz Damlası, Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIEYE-VİSOL % 0.05 göz damlası, çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her 1 mL'de 0,5 mg Tetrahidrozolin hidroklorür Yardımcı maddeler:Benzalkonyum klorür 0,1 mg/mL Yardımcı maddeler için 6,1'e bakınız. 3. FARMASÖTİK FORMGöz damlası Renksiz, berrak çözelti 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarEYE-VİSOL oküler alerji (bahar nezlesi gibi) veya minör irritasyonlardan (rüzgar, duman, toz, kitap okuma, televizyon izleme, yüzme gibi) kaynaklanan geçici konjonktival ödem vehiperemi semptomlarının ortadan kaldırılmasında kullanılır. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Yetişkinler ve 6 yaşından büyük çocuklar için:Günde 2 defa 1 damla ile günde en fazla 4 defa 2 damla doz aralığında uygulanmalıdır. Kullanmadan önce, varsa kontakt lensleri çıkartınız.Uygulama şekli:EYE-VİSOL göze uygulanır .EYE-VİSOL'ü kullanmadan önce ellerinizi yıkayınız .Kullanım için aşağıdaki şekilde hareket ediniz: Kapağı açınız (Şekil 1). İlk uygulamada kapağın altındaki halkayı atınız (Şekil 2). Kapağı tekrar tamamen ve sıkıcavidalayınız (Şekil 3). Böylece damlalıktaki zar delinir ve damlalık akmaya başlar. Şişeyi baş ve orta parmaklarınız arasında tutarak ters çeviriniz. 1 / 7 Ters çevrilmiş şişenin üzerine işaret parmağınız ile bir kerede uygulayacağınız hafif basınçile EYE-VİSOL'ün bir damlası akacaktır (Şekil 4). Kafanızı hafifçe geriye doğru yatırınız. Göz kapağı ve gözünüz arasında bir kese oluşacakkadar parmağınızla alt göz kapağınızı aşağı doğru çekiniz. Damlanın oluşan kese içinedamlatılması gerekmektedir (Şekil 5). Damlalık ucunu göze yaklaştırınız. Eğer yardımcı olacaksa bir ayna kullanınız. Damlalığı gözünüze, göz kapağınıza, gözünüzün etrafındaki yüzeylere veya diğeryüzeylere değdirmeyiniz. Değdirirseniz, damlalığa mikroorganizmalar bulaşabilir. EYE-VİSOL'ü damlattıktan sonra alt göz kapağınızı yavaşça serbest bırakınız, gözünüzükapatınız ve göz-burun arası bölgeye bir parmağınız ile hafifçe bastırınız (Şekil 6). Bu önlemEYE-VİSOL'ün vücudun diğer bölgelerine yayılımını önleyecektir. Eğer damlayı iki gözünüze de kullanmanız gerekiyorsa yukarıdaki adımları diğer gözünüziçin de tekrarlayınız. Eğer damla gözünüze gelmezse tekrar deneyiniz. Kullandıktan sonra EYE-VİSOL'ün kapağını sıkıca kapatınız. Gözünüz için kullandığınız başka bir ilaç daha varsa, her iki ilaç uygulaması arasında 1015 dakikalık ara veriniz. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/karaciğer yetmezliği:Özel bir uygulama gerekmemektedir. Pediyatrik popülasyon:6 yaşından küçük çocuklarda kullanılırken doktorunuza danışınız. 2 yaşından küçük çocuklarda kullanılmamalıdır. Geriyatrik popülasyon:Özel bir uygulama gerekmemektedir. 4.3 KontrendikasyonlarEYE-VİSOL Göz Damlası glokomlu hastalarda, içeriğindeki maddelerden herhangi birine karşı aşırı duyarlılığı olanlarda ve 2 yaşından küçük hastalarda kullanılmamalıdır. 4.4 Özel kullanım uyarıları ve önlemleriEYE-VİSOL Göz Damlası yalnız gözün hafif tahrişlerinde kullanılmalıdır. 48 saat içinde netice alınmazsa, kızarıklık veya tahriş azalmaz ya da artarsa, görmede değişiklik veya gözdeağrı olursa, ilaç kesilmeli ve bir hekime müracaat edilmelidir. Bazı hallerde gözlerdeki tahrişveya kızarıklık, enfeksiyon, gözde yabancı cisim, korneada mekanik veya kimyasal travma 2 / 7 gibi hekim müdahalesini gerektiren ciddi sebeplere bağlı olabilir. Ürün kullanımı geçici midriyazise neden olabilir. Eğer gözde şiddetli ağrı, konjonktiva irritasyonu, sistemik sempatikomimetik etkiler, baş ağrısı, görmede ani değişiklik, bulanıklık, görme kaybı, birdenbire yüzen lekelerin oluşması,gözlerde akut şekilde kırmızılık, ışık karşısında ağrı duyulması veya çift görme gibi durumlarmevcutsa derhal bir hekime danışılmalıdır. Ürünün uzun süreli ve aşırı kullanımındakızarıklıkta artış veya yeniden oluşma gözlenebilir. EYE-VİSOL Göz Damlası steril olduğundan şişenin kapağı açıkken ucunu göze, parmaklara veya diğer bir yüzeye dokundurmayınız. Bu göz damlasının kontamine olmasına yol açar.Kullandıktan sonra kapağını kapatınız. Bulanık, rengi değişmiş veya içinde yabancı cisimler bulunan göz damlalarını kullanmayınız. Şişe ağzında ilaç kristalleri görülen göz çözeltilerini kullanmayınız. EYE-VİSOL Göz Damlası'nın orijinal ambalajı açıldıktan sonra 15 gün içinde tüketilmesi önerilir. Ürün içeriğinde yer alan benzalkonyum klorür gözde irritasyona sebebiyet verebilir. Yumuşak kontakt lenslerle temasından kaçınınız. Uygulamadan önce kontakt lensi çıkartınız ve lensitakmak için en azından 15 dakika bekleyiniz. Yumuşak kontakt lenslerin renklerininbozulmasına neden olduğu bilinmektedir. Göz çevresinde cilt inflamasyonu veya harabiyeti olduğu durumlarda, ürünün borik asit içermesinden dolayı cildiniz ile temasından kaçınınız. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDiğer ilaçlar ile arasında anlamlı bir etkileşim bilinmemektedir. Diğer oftalmik ilaçlar ile kullanmadan önce doktorunuza danışınız. Özel popülasyonlara ilişkin ek bilgilerDiğer ilaçlar ile arasında anlamlı bir etkileşim bilinmemektedir. Pediyatrik popülasyonDiğer ilaçlar ile arasında anlamlı bir etkileşim bilinmemektedir. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda kullanımına ilişkin herhangi bir veri yoktur. Gebelik dönemiEYE-VİSOL Göz Damlası'nın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik ve/veya embriyonal/fetal gelişimve/veya doğum ve/veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. 3 / 7 İnsanlara yönelik potansiyel risk bilinmemektedir. EYE-VİSOL göz damlası, gerekli olmadıkça gebelik süresinde kullanılmamalıdır. Laktasyon dönemiTetrahidrozolin hidroklorürün anne sütüne geçip geçmediği bilinmemektedir. Emzirmenin durdurulup durdurulmayacağına ya da EYE-VİSOL Göz Damlası tedavisinin durdurulupdurdurulmayacağına / tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken,emzirmenin çocuk açısından faydası ve EYE-VİSOL Göz Damlası tedavisinin emziren anneaçısından faydası dikkate alınmalıdır. EYE-VİSOL göz damlası, emziren kadınlarda kullanılmadan önce doktora danışılmalıdır. Üreme yeteneği/FertiliteVeri bulunmamaktadır. 4.7 Araç ve makine kullanımı üzerindeki etkilerGöz damlalarının kullanımı geçici süreli bulanık görmeye neden olabilir. 4.8 İstenmeyen etkilerŞu terimler ve sıklık dereceleri kullanılmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1000 ila <1/100); seyrek (>1/10000 ila <1/1000); çok seyrek (<1/10000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor). Göz hastalıklarıÇok seyrek: Midriyazis, lakrimasyonda artış Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok seyrek: Uygulama bölgesi reaksiyonları (oküler ve perioküler yanma, eritem, irritasyon, ödem, ağrı ve kaşıntı dahil) Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr[email protected];4.9 Doz aşımı ve tedavisiPazarlama sonrası güvenlilik datalarına göre doz aşımı ile ilişkili advers ilaç reaksiyonu tanımlanmamıştır. Oftalmik kullanım ile doz aşımı semptomları meydana gelmeyebilir, fakat tetrazolinin sindirime geçmesi ciddi advers etkilere neden olabilir. 4 / 7 Amerika İlaç ve Gıda Federasyonu(FDA) tarafından 1985 ile 2012 yılları arası, yaşları 1 aylık ile 5 yıl arasında değişen çocuklarda tetrazolin, oksimetazolin veya nafazolin içeren ürünlerin,yanlışlıkla sindirim sistemine geçtiği 96 vaka tespit edilmiştir. 53 vakanın mide bulantısı,kusma, laterji, taşikardi, solunum fonksiyonların azalma, bradikardi, hipotansiyon, sedasyon,uyku hali, midriyazis, uyuşukluk, hipotermi, salya artışı ve koma semptomları ile hastaneyeyatışı raporlanmıştır. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Dekonjestan olarak kullanılan sempatomimetikler ATC kodu: S01GA02 Tetrahidrozolin hidroklorür, vazokonstriksiyon yoluyla dekonjesyon yapan imidazolin grubu sempatomimetik bir ajandır. Beta-adrenerjik reseptörler üzerinde etki göstermeyerek veya çokaz etki göstererek, sempatik sinir sistemi alfa-adrenerjik reseptörlerini direkt olarakuyarmaktadır. Konjunktival mukozaya topikal olarak uygulandığında, konjunktivalvazodilatasyonu ve ödemi azaltmak suretiyle küçük kan damarları üzerinde geçicivazokonstrüktör etki oluşturur. Tetrahidrozolin hidroklorür ile gözlerdeki kızarıklık süratlebeyazlaşır. Vazokonstriksiyon birkaç dakika içinde görülür ve etki uzun süre devam eder. EYE-VİSOL Göz Damlası, gözde alerji, hafif irritasyonlar nezlevi konjonktivitlere bağlı konjonktiva ödemi ve kızarıklığına karşı semptomatik iyileşme temin etmek üzerehazırlanmış dekonjestan bir oftalmik çözeltidir. Faydalı etkileri arasında yanma, tahriş,kaşıntı, ağrı hisleri ile göz yaşarmasının azalması sayılabilir. Bazı vazokonstriktörlerpupillada dilatasyon veya rebound hiperemisi yaparlarsa da tetrahidrozolin hidroklorür ile buiki etkinin görüldüğüne dair hiçbir delil yoktur. 5.2 Farmakokinetik özellikler10 sağlıklı gönüllüde yapılan çalışmada, oküler uygulamadan sonra hem serumda hem de idrarda tetrahidrozolin hidroklorür konsantrasyonları tespit edilmiştir. Tetrahidrozolinhidroklorürün serum yarılanma ömrü yaklaşık olarak 6 saattir. Sistemik absorpsiyonu,maksimum serum konsantrasyonları 0,068-0,38 ng/mL aralığı ile denekler arasında çeşitlilikgöstermektedir. 24 saat sonunda, tüm hastalarda tetrahidrozolin hidroklorürün idrardakikonsantrasyonları tespit edilmiştir. 5.3 Klinik öncesi güvenlilik verileriYayımlanan literatürde etkin maddelerin kombinasyonu ile gerçekleştirilen klinik olmayan çalışmalar bulunmamıştır. Bu nedenle, tek etkin maddenin klinik olmayan güvenlilik verilerigözden geçirilmiştir. İnsanlarla ilgili olabilecek herhangi bir advers olaya işaret edecek klinik öncesi veri bulunmamaktadır. Genel ToksisiteAkut oral LD50 değerlerine göre, tetrahidrozolin orta dereceli toksik olarak sınıflandırılmıştır. 5 / 7 Genetik ToksisiteTetrahidrozolinin mutajenik potansiyele sahip olup olmadığının tespit edilebilmesi için yeterli bilgi bulunmamaktadır. KarsinojeniteTetrahidrozolinin karsinojenik potansiyele sahip olup olmadığının tespit edilebilmesi için yeterli bilgi bulunmamaktadır. TeratojeniteTetrahidrozolinin teratojenik potansiyele sahip olup olmadığının tespit edilebilmesi için yeterli bilgi bulunmamaktadır. FertiliteTetrahidrozolinin üreme yetisine karşı teratojenik potansiyele sahip olup olmadığının tespit edilebilmesi için yeterli bilgi bulunmamaktadır. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiSodyum klorür Disodyum EDTABenzalkonyum klorürBorik asit Disodyum tetraborat.10H2O Sodyum hidroksitEnjeksiyonluk su 6.2 GeçimsizliklerMevcut değildir. 6.3 Raf ömrü24 ay 6.4 Saklamaya yönelik özel tedbirler30°C'nin altındaki oda sıcaklığında, ışıktan korunarak saklanmalıdır. EYE-VİSOL, kapağı açıldıktan sonra 15 gün içinde kullanılmalıdır. 6.5 Ambalajın niteliği ve içeriğiKutuda, beyaz polipropilen kapaklı, kendinden damlalıklı, şeffaf, LDPE şişede 5 mL çözelti ve kullanma talimatı ile birlikte sunulmaktadır. 6 / 7 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİBİLİM İLAÇ SAN. ve TİC. AŞ. Kaptanpaşa Mahallesi Zincirlikuyu Cad. No:18434440 Beyoğlu-İSTANBULTel: +90 (212) 365 15 00Faks: +90 (212) 276 29 19 8. RUHSAT NUMARASI147/34 9. RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 03.02.1989 Ruhsat yenileme tarihi: 14.06.2004 10. KÜB'ÜN YENİLENME TARİHİ7 / 7 |
İlaç BilgileriEye-visol %0,05 Göz Damlası, ÇözeltiEtken Maddesi: Tetrahidrozolin Hcl Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.