Ventopium Plus 0.5mg+2.5mg/2.5ml Nebülizasyon İçin İnhalasyon Çözeltisi Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIVENTOPİUM PLUS 0.5 mg+2.5 mg/2.5 mL nebülizasyon için inhalasyon çözeltisi 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir 2,5 mL çözelti içeren tek dozluk flakon; 0,5 mg ipratropium bromüre eşdeğer, 0,522 mg ipratropium bromür monohidrat ve 2,5 mg salbutamole eşdeğer, 3,01 mg salbutamol sülfat içerir. Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMNebülizasyon için inhalasyon çözeltisi içeren tek dozluk flakon Berrak partikülsüz ve renksiz çözelti 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarVENTOPİUM PLUS birden fazla bronkodilatöre gerek duyulan hastalarda, obstrüktif havayolu hastalıklarına eşlik eden geri dönüşümlü bronkospazmın tedavisinde endikedir. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Önerilen doz şu şekildedir: Yetişkinler için (12 yaşın üstündeki çocuklar ve yaşlı hastalar dahil)Günde üç ya da dört kez 1 adet tek dozluk flakon 12 yaşın altındaki çocuklarVENTOPİUM PLUS'ın 12 yaşın altındaki çocuklarda kullanımına ilişkin deneyim bulunmamaktadır. Uygulama: Nebülizör ile kullanımı için hasta uygulama talimatına bakınız. Tek dozluk birimler koruyucu içermediğinden, flakon açılır açılmaz içindeki ilaç derhal kullanılmalıdır. Mikrobiyal kontaminasyonu önlemek için her uygulamada yeni bir flakonun 1/13 kullanılması önemlidir. Bir kısmı kullanılmış, açılmış ya da hasarlı tek dozluk birimler atılmalıdır. VENTOPIUM PLUS, nebülizörde diğer ilaçlarla kesinlikle karıştırılmamalıdır. Uygulama şekli:VENTOPİUM PLUS uygun bir nebülizatörle veya intermitan pozitif basınçlı ventilatörle verilebilir. Kullanım talimatı için bölüm 6.6'dan sonraki bölüme bakınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:VENTOPİUM PLUS karaciğer ya da böbrek yetmezliği olan hastalarda incelenmemiştir. Bu hasta popülasyonlarında dikkatle kullanılmalıdır.Pediyatrik popülasyon:On iki yaşın altındaki çocuklarda bilgilerin yetersiz olması nedeniyle, VENTOPİUM PLUS pediyatrik hastalarda endike değildir.Geriyatrik popülasyon:4.3 KontrendikasyonlarVENTOPİUM PLUS hipertrofik obstrüktif kardiyomiyopatisi ya da taşiaritmisi olan hastalarda kontrendikedir. VENTOPİUM PLUS, aynı zamanda, ipratropium bromür,salbutamol sülfat ya da atropin veya türevlerine hipersensitive öyküsü olan hastalarda dakontrendikedir. 4.4 Özel kullanım uyarıları ve önlemleriSadece inhalasyon içindir. Aşırı duyarlılık reaksiyonları:İpratropium bromür/salbutamol kombinasyonunun uygulamasından sonra ani aşırı duyarlılık reaksiyonları oluşabilir. Bu reaksiyonlar seyrek olarak ortaya çıkmış ve ürtiker, anjiyoödem,döküntüler, bronkospazm ve orofarenjiyal ödem vakaları görülmüştür. Gözle ilgili sorunlar:Ölçülü doz şeklindeki aerosolde bulunan ipratropium yanlışlıkla göze sıkıldığında, seyrek olarak, oküler komplikasyonlar (midriyazis, bulanık görme, dar-açılı glokom, göz ağrısı)geliştiği bildirilmiştir. Hastalar VENTOPİUM PLUS'ın doğru bir biçimde kullanılması için eğitilmeli ve çözeltinin ya da buharın göze kaçırılmamasına dikkat edilmesi konusunda uyarılmalıdır. Bu durumözellikle glokom eğilimi olan hastalar için önemlidir. Bu hastalar, gözlerini korumaları 2/13 gerektiği konusunda özellikle uyarılmalıdır. Göz ağrısı ya da gözde rahatsızlık hissi, bulanık görme, haleler ya da renkli görüntüler görme, konjonktival konjesyondan ve korneaödeminden ötürü oluşan göz kızarıklığı ile birlikte seyrediyorsa, akut dar-açılı glokombelirtisi olabilir. Bu semptomların herhangi bir kombinasyonu gelişirse, miyotik damlalar iletedaviye başlanmalı ve derhal bir uzman hekimin görüşü alınmalıdır. Sistemik etkiler:VENTOPİUM PLUS aşağıdaki durumlarda, yalnızca dikkatli bir risk/yarar değerlendirilmesi yapıldıktan sonra kullanılmalıdır: Yeterince kontrol altında olmayan diabetes mellitus, Yakınlarda geçirilmiş miyokard infarktüsü ve/veya şiddetli organik kalp veya damarhastalıkları Hipertiroidizm, Feokromositoma, Dar açılı glokom riski, Prostat hipertrofisi, Mesane boynu obstrüksiyonu, Kardiyovasküler etkiler: VENTOPİUM PLUS da dahil, sempatomimetik ilaçlarla kardiyovasküler etkiler görülebilir. Pazarlama sonrası verilerde ve yayınlanmış literatürde ender olgular şeklinde, salbutamol ileilişkili miyokard iskemisi verileri bulunmaktadır. Solunum hastalığı için salbutamol almaktaolan ve altta yatan şiddetli kalp hastalığı (örn. iskemik kalp hastalığı, taşiaritmi ya da şiddetlikalp yetmezliği) bulunan hastalar, göğüs ağrısı ya da kalp hastalığında ağırlaşmaya ilişkinbaşka semptomlar ortaya çıktığında doktora başvurmaları konusunda uyarılmalıdır. Dispne vegöğüs ağrısı gibi semptomlar değerlendirilirken dikkatli olunmalıdır, çünkü bunlar solunumya da kalp kaynaklı olabilir. Hipokalemi: Beta 2-agonist tedavisi, potansiyel olarak ciddi bir hipokalemi ile sonuçlanabilir. Şiddetli havayolu obstrüksiyonunda özellikle dikkatli olunması önerilmektedir, çünkü bu etki ksantintürevleri, steroidler ve diüretikler ile eşzamanlı tedavi sonucunda potansiyalize olabilir.Ayrıca hipoksi, hipokaleminin kalp ritmi üzerindeki etkilerini şiddetlendirebilir (özellikledigoksin kullanan hastalarda). Bu türlü durumlarda serum potasyum düzeylerinin izlenmesiönerilmektedir.Gastrointestinal Motilite Bozuklukları:Kistik fibrozlu hastalar, gastrointestinal motilite bozukluklarına daha yatkın olabilirler. Solunum sistemi ile ilgili sorunlar (Dispne)Hastalar, akut, hızla kötüleşen dispne (solunum zorluğu) durumunda hemen bir doktora danışılması gerektiği konusunda uyarılmalıdır. Hastalar ayrıca, alınan yanıtta azalma belirginhale geldiğinde doktora başvurmaları gerektiği konusunda da uyarılmalıdır. 3/13 Diğer inhalasyon tedavilerinde olduğu gibi, paradoksal bronkospazm ortaya çıkabilir ve dozdan hemen sonra hırıltılı solunum ve nefes darlığında artış ile seyredebilir. Paradoksalbronkospazm hızlı etkili bir inhale bronkodilatöre yanıt verir ve hızla tedavi edilmelidir. Budurumda, VENTOPİUM PLUS kullanımına derhal son verilmeli, hasta değerlendirilmeli veeğer gerekiyorsa, alternatif tedavi uygulanmalıdır. Doping testi:VENTOPİUM PLUS kullanımı, klinik dışı madde suistimali için yapılan testlerde, örn. atletik performansın yükseltilmesi (doping), salbutamol nedeniyle pozitif sonuçlara yol açabilir. Laktik asidozİntravenöz ve nebulize kısa etkili beta gonistlerin özellikle şiddetli astım veya kronik obstruktif akciğer hastalığındaki bronkospazmın akut alevlenmesinin tedavisinde yüksekterapötik dozda kullanımına bağlı olarak laktik asidoz bildirilmişir (bkz bölüm 4.8 ve 4.9).Laktat seviyelerindeki atış dispne ve kompensatuvar hiperventilasyona neden olabilir. Bu daastım tedavisinde bir başarısızlık şeklinde yanlış yorumlanabilir ve gerekli olmayan kısa etkilibeta-agonist tedavisi uygulanmasına neden olabilir. Bu nedenle hastalar, serum laktatseviyelerinde artış ve buna bağlı metabolik asidoz gelişimi açısından takip edilmelidir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriVENTOPİUM PLUS'ın diğer antikolinerjik ilaçlarla birlikte, kronik kullanımı çalışılmamıştır. Bu nedenle, VENTOPİUM PLUS'ın diğer antikolinerjik ilaçlarla birliktekullanılması önerilmez. Ek olarak verilen beta-agonistlerin, ksantin türevlerinin ve kortikosteroidlerin kullanımı VENTOPİUM PLUS'ın etkisini arttırabilir. Diğer beta-mimetiklerin sistemik olarak absorbe olan antikolinerjikler ve ksantin türevlerinin birlikte kullanımı, yan etkilerin şiddetini arttırabilir. Beta-blokörlerle birlikte kullanımısırasında etkide potansiyel olarak ciddi bir azalma ortaya çıkabilir. Monoamin oksidaz inhibitörleri veya trisiklik antidepresanlar ile tedavi edilmekte olan hastalarda beta-adrenerjik agonistler dikkatle uygulanmalıdır, çünkü beta-adrenerjikagonistlerin etkileri artabilir. Halotan, trikloroetilen ve enfluran gibi halojenli hidrokarbon anestetiklerinin inhalasyonu, beta-agonistlerin kardiyovasküler etkilerine karşı duyarlılığı artırabilir. Özel popülasyonlara ilişkin ek bilgiler:Özel veri bulunmamaktadır. Pediyatrik popülasyon:Özel veri bulunmamaktadır. 4/13 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlar, tedavi süresince tıbben etkili olduğu kabul edilen doğum kontrol yöntemleri kullanmalıdır. Gebelik dönemiİpratropium bromür ve salbutamolün gebelerde kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlarda yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir.(bkz. Bölüm 5.3) İnsanlara yönelik potansiyel risk bilinmemektedir. Laktasyon dönemiSalbutamol sülfat ve ipratropium,, beklenen yararları, yenidoğan üzerindeki risklere üstün gelmediği sürece emziren annelerde kullanılmamalıdır. Üreme yeteneği/Fertiliteİpratropium bromür/salbutamol kombinasyonu ile insan fertilitesi üzerindeki etkisi konusunda çalışma yürütülmemiştir. İpratropium bromür ve salbutamol ile yapılan klinik öncesiçalışmalarda fertilite üzerinde advers etki görülmemiştir (bkz. Bölüm 5.3 Klinik öncesigüvenlilik verileri). 4.7 Araç ve makine kullanımı üzerindeki etkilerAraba ve makine kullanma becerileri üzerindeki etkileri konusunda çalışma yapılmamıştır. Ancak hastalar, VENTOPİUM PLUS tedavisi sırasında baş dönmesi, akomodasyon bozukluğu, midriyazis ve bulanık görme gibi istenmeyen etkiler geçirebilecekleri konusundauyarılmalıdır. Eğer hastalarda yukarıda sözü edilen yan etkiler ortaya çıkarsa, araba kullanmaya da makine işletme gibi tehlike potansiyeli taşıyan işlerden uzak durmalıdırlar. 4.8 İstenmeyen etkilerListelenen istenmeyen etkilerin birçoğu VENTOPİUM PLUS'ın antikolinerjik ve beta 2-sempatomimetik özelliklerine bağlanabilir. İnhalasyon yoluyla uygulanan bütün ilaçlar gibi, VENTOPİUM PLUS lokal iritasyon semptomlarına yol açabilir. Advers ilaç reaksiyonları,klinik araştırmalarda ve ilacın onay sonrası kullanım dönemindeki farmakovijilansçalışmalarında elde edilen verilerden tanımlanmıştır.Klinik araştırmalarda en sık bildirilen yan etkiler baş ağrısı, boğazda iritasyon, öksürük, ağız kuruluğu, gastrointestinal motilite bozuklukları (konstipasyon, diyare ve kusma dahil), bulantıve baş dönmesi olmuştur. 5/13 Aşağıda belirtilen istenmeyen etkilerin sıklık oranları şu şekildedir: Çok yaygın Yaygın > 1/10 > 1/100 ilâ <1/10 > 1/1.000 ilâ <1/100 > 1/10.000 ilâ <1/1.000< 1/10.000 Yaygın olmayan Seyrek Çok seyrek Bilinmiyor
Eldeki verilerden hareketle tahmin edilemiyor. Bağışıklık sistemi hastalıklarıSeyrek: Anaflaktik reaksiyon, aşırı duyarlılık, dil, dudaklar ve yüzde anjiyoödem Metabolizma ve beslenme hastalıklarıSeyrek: Hipokalemi Bilinmiyor: Laktik asidoz (bkz. Bölüm 4.4) Psikiyatrik hastalıklarYaygın olmayan: Sinirlilik Seyrek: Mental bozukluk Sinir sistemi hastalıklarıYaygın olmayan: Baş dönmesi, baş ağrısı, tremor Göz hastalıklarıSeyrek: Akomodasyon bozukluğu, kornea ödemi, glokom1, göz ağrısı1, göz içi basıncında artış1, midriyazis1, bulanık görme, konjonktivada hiperemi, haleler görme Kardiyak hastalıklarYaygın olmayan: Palpitasyonlar, taşikardi Seyrek: Aritmi, atriyal fibrilasyon, miyokard iskemisi, supraventriküler taşikardi Solunum, göğüs bozuklukları ve mediyastinal hastalıklarYaygın olmayan: Öksürük, disfoni, boğazda iritasyon Seyrek: Bronkospazm, paradoksal bronkospazm2, boğaz kuruluğu, laringospazm, farenjiyal ödem Gastrointestinal hastalıklarYaygın olmayan: Ağız kuruluğu, bulantı Seyrek: Gastrointestinal motilite bozukluğu (örn. diyare, konstipasyon, kusma), ağızda ödem, stomatit Deri ve derialtı dokusu hastalıklarıYaygın olmayan: Deri reaksiyonları Seyrek: Hiperhidroz, döküntü, ürtiker, pruritus 6/13 Kas-iskelet bozuklukları ve bağ doku ve kemik hastalıklarıSeyrek: Kas spazmları, kaslarda zayıflık, miyalji Böbrek ve idrar yolu hastalıklarıSeyrek: İdrar retansiyonu3 Genel bozukluklar ve uygulama yerine ilişkin hastalıklarSeyrek: Asteni AraştırmalarYaygın olmayan: Sistolik kan basıncında yükselme Seyrek: Diyastolik kan basıncında düşme 1 Oküler komplikasyonlar aerosol şeklindeki ipratropium bromür tek başına veya biradrenerjik beta 2-agonist ile birlikte göze kaçtığında bildirilmiştir (bkz. Bölüm 4.4).2 İnhalasyon yoluyla kullanılan diğer ilaçlarda olduğu gibi, doz uygulamasından hemen sonrahırıltılı solumada ani artış ve soluk darlığıyla kendisini gösteren paradoksal bronkospazmoluşabilir. Paradoksal bronkospazm hızlı etkili bir inhale bronkodilatöre yanıt verir ve derhaltedavi edilmelidir. VENTOPİUM PLUS'a hemen son verilmeli, hasta değerlendirilmeli vegerekiyorsa alternatif bir tedavi uygulanmalıdır. 3 İdrar retansiyonu riski, öncesinden üriner çıkış obstrüksiyonu bulunan hastalarda artabilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr[email protected];4.9 Doz aşımı ve tedavisiSemptomlarİpratropium bromürün doz aşımının akut etkileri, hafif ve geçicidir (ağız kuruluğu, görsel akomodasyon bozuklukları gibi), çünkü inhalasyonla veya oral uygulama sonrası sistemikabsorpsiyonu düşüktür. Bu nedenle, doz aşımından kaynaklanan etkiler muhtemelensalbutamol ile bağlantılı olmalıdır. Salbutamol ile meydana gelen doz aşımının belirtileri arasında şunlar bulunur: taşikardi, palpitasyon, tremor, hipertansiyon, hipokalemi, hipotansiyon, nabız basıncının genişlemesi,aritmiler, anjinal ağrı ve yüz kızarması (flushing). Salbutamol doz aşımı ile metabolik asidozda bildirilmiştir. 7/13 Salbutamol doz aşımında tercih edilen antidot, bir kardiyoselektif beta-blokör ajandır. Ancak, bronkospazm öyküsü olan hastalarda bu tür ilaçlar kullanılırken dikkatli olunmalıdır. Kısa etkili beta-agonist tedavisinin yüksek tedavi dozuyla ve doz aşımı ile ilişkili olarak bildirilen laktik asidozun dahil olduğu metabolik asidoz da salbutamolün doz aşımıylagözlenmiştir. Bu nedenle, doz aşımı halinde (özellikle de hırıltılı solunum gibi diğerbronkospazm bulgularının düzelmesine rağmen devam eden ya da kötüleşen taşipne varsa)yükselmiş serum laktat düzeylerinin ve buna bağlı olarak gelişebilecek metabolik asidozuntakibi gerekebilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Adrenerjikler ve diğer obstrüktif havayolu hastalıkları ilaçları ATC kodu: R03AK04 İpratropium bromür, antikolinerjik (parasempatolitik) özellikler taşır. Klinik öncesi çalışmalarda, vagus sinirinden salıverilen nörotransmitter olan asetilkolinin etkileriniantagonize ederek, bu sinir aracılığıyla gerçekleşen refleksleri inhibe etmiştir. İpratropium bromür inhalasyonunu izleyen bronkodilatasyon, esas olarak lokal ve akciğere özgüdür ve sistemik bir etki değildir. Salbutamol, hava yollarındaki düz kaslara etki ederek, gevşemelerine yol açan bir beta2-adrenerjik ajandır. Salbutamol, trakeadan terminal bronşiyollere kadar olan bütün düz kasları gevşetir ve bronkokonstriksiyona yol açan tüm etkilere karşı korunma sağlar. VENTOPİUM PLUS, ipratropium bromür ile salbutamol sülfatın eşzamanlı olarak salıverilmesi sonucu akciğerdeki muskarinik ve beta2-adrenerjik reseptörlerin her ikisiüzerinden etki oluşturur ve sonuç olarak her bir ajan ile elde edilenden daha üstün birbronkodilatasyon elde edilmesini sağlar. 5.2 Farmakokinetik özelliklerGenel Özellikler:İpratropium bromürEmilim:Yaklaşık %3-4 olan kümülatif ekskresyon değerine göre (CRE0-24 saat) ipratropium bromürün inhale edilen dozlarının total sistemik biyoyararlanımı %7-9 olarak tahmin edilmektedir. Dağılım:İpratropium bromürün dispozisyonunu tanımlayan kinetik parametreler, İ.V. uygulamadan sonraki plazma konsantrasyonlarından hesaplanmıştır. Plazmada hızlı bir bifazik azalmagözlenmiştir. 8/13 Karalı durumda görünür dağılım hacmi (Vdss) yaklaşık 176 L (~ 2.4 L/kg)'dır. İlaç, plazma proteinlerine minimal olarak bağlanır (%20'den daha az). Diğer kuaterner amonyumbileşiklerinde olduğu gibi, ipratropium bromür de kan-beyin bariyerini geçemez. Biyotransformasyon:İpratropiumun total klerensi 2,3 L/dk ve renal klerensi de 0,9 L/dk'dır. İnhalasyonla uygulandıktan sonra dozun yaklaşık %87-89'u, muhtemelen asıl olarak karaciğerdeoksidasyon yoluyla metabolize olur. Eliminasyon:İnhalasyonla uygulandıktan sonra ilaçla ilgili radyoaktivitenin %3,2'si (yani ana bileşen ve metabolitleri) idrarla elimine edilir. Bu uygulama yolu için toplam radyoaktivitenin atılımıfeçesle olmuştur. İnhalasyonu takiben ilaçla ilgili radyoaktivitenin eliminasyon yarı ömrü 3,2saattir. Başlıca üriner metabolitleri muskarinik reseptörlere zayıf olarak bağlanır ve etkisizolarak değerlendirilmiştir. Doğrusallık/Doğrusal olmayan durum:Özel veri bulunmamaktadır. SalbutamolEmilim:Salbutamol, gerek inhalasyon gerekse yolla olan oral uygulamayı takiben hızla ve tamamen absorbe olur ve yaklaşık %50'lik oral yolla biyoyararlanıma sahiptir. 492 pg/ml olan ortalamadoruk salbutamol konsantrasyonuna İpratropium bromür/salbutamol kombinasyonuinhalasyonundan sonra 3 saat içinde ulaşılır. Dağılım:Kinetik parametreler İ.V. uygulamadan sonra plazma konsantrasyonlarından hesaplanmıştır. Görünür dağılım hacmi (Vz) yaklaşık 156 L (~2,5 L/kg)'dir. İlacın sadece % 8'i plazmaproteinlerine bağlanır. Salbutamol kan-beyin bariyerini geçerek, plazma konsantrasyonlarınınyaklaşık %5'i kadar bir konsantrasyona ulaşır. Biyotranformasyon ve eliminasyon:Tek doz inhalasyon uygulamasını takiben, ağızlıkla alınan tahmini dozun yaklaşık %27'si, 24 saat içinde değişmeden idrarla atılır. Ortalama terminal yarı ömrü yaklaşık 4 saat ve ortalamatotal klerensi 480 ml/dk'dır. Ortalama renal klerensi ise, 291 ml/dk'dır.Salbutamol konjugasyonla salbutamol 4'-O-sülfata metabolize olur. Salbutamolün R(-)-enantiyomeri (levosalbutamol) tercihli olarak metabolize olur ve bu nedenle S(+)-enantiyomerinden daha hızlı biçimde vücuttan temizlenir. İntravenöz uygulamayı takiben üriner atılımı yaklaşık 24 saat sonra tamamlanır. Atılan dozun büyük kısmı ana bileşiktir(64,2) ve %12'ı sülfat konjugatı olarak atılır. Oral Uygulamadan sonra değişime uğramamışilaç ve sülfat konjugatın idrarla atılan miktarları sırasıyla dozun %31,8'i ve %48,2'sidir.9/13 Doğrusallık/Doğrusal olmayan durum:Özel veri bulunmamaktadır. İpratropium bromür ve salbutamol sülfat kombinasyonunun absorpsiyon özellikleri:5.3 Klinik öncesi güvenlilik verileriİpratropium bromür/salbutamol kombinasyonunun tek inhalasyon şeklinde uygulama sonrasındaki akut toksisitesi, sıçanlarda ve köpeklerde incelenmiştir. Teknik olarakincelenmesi mümkün en yüksek dozlara kadar (sıçan: 887/5397 mikrogram/kg vücut ağırlığı[ipratropium bromür/salbutamol], köpek: 165/862 mikrogram/kg vücut ağırlığı [ipratropiumbromür/salbutamol]) sistemik toksik etki belirtisi bulunmamaktaydı ve bileşik lokal olarak iyitolere edildi. Tekil maddeler için intravenöz uygulama sonrasında yaklaşık LD50değerlerinin, ipratropium bromürün test edildiği türlere bağlı olarak (fare, sıçan, köpek),ipratropium bromür için 12 ile 20 mg/kg ve salbutamol için 60 ile 70 mg/kg vücut ağırlığıarasında olduğu hesaplanmıştır. İpratropium bromür ve salbutamol kombinasyonu ile sırasıyla sıçanlar ve köpeklerde, 13 haftalık iki inhalasyon toksisitesi çalışması yürütülmüştür. Bu çalışmalarda, kalbin hedeforgan olduğu ortaya çıkmıştır. 31,3/183,4 ile 375,5/2188,4 mikrogram/kg vücut ağırlığı/günipratropium bromür/salbutamol dozlarında, sıçanların kalp ağırlıklarında doza bağlı olmayanbir artış gözlendi, ancak bu saptanabilir herhangi bir histopatolojik değişiklik ile birliktedeğildi. Köpeklerde 32,3/197,6 ile 129,2/790,4 mikrogram/kg vücut ağırlığı/gün ipratropiumbromür/salbutamol dozları, kalp hızlarını hafifçe artırdı ve daha yüksek dozlarda, solventrikül papiller kaslarında, bazen mineralizasyonun eşlik ettiği, histopatolojik olaraksaptanabilir sikatrisler ve/veya fibrozis gözlendi. Yukarıda sözü edilen çalışmalarda elde edilen bulgular, salbutamol gibi beta-adrenerjiklerin iyi bilinen etkileri olarak görülmelidir. Aynı zamanda ikinci bileşenin (ipratropium bromür) toksikolojik profili de yıllardır iyi bilinmektedir ve kafada bulunan mukozal membranlarda kuruluk, midriyazis, yalnızcaköpeklerde keratokonjonktivitis sikka (kuru göz), tonüs azalması ve gastrointestinal kanaldamotilitenin inhibisyonu (sıçan) gibi tipik antikolinerjik etkilerdir. İpratropium bromür/salbutamol kombinasyonunun iki tekil bileşeni için de üreme toksisitesi çalışmaları mevcuttur. Salbutamol farelerde yüksek dozlarda yarık damaklara neden olmuştu. Bu olay iyi bilinmektedir ve diğer beta-adrenerjik bileşiklerin uygulanmasından sonra da ortayaçıkmaktadır. Günümüzde bu etkinin annedeki kortikosteron düzeyindeki bir artış sebebiyle 10/13 ortaya çıktığı varsayılmaktadır ve başka türler için önem taşımayan bir genel stresin sonucu olduğu kabul edilebilir. Ek olarak, salbutamolün teratojenik özelliklere sahip olabileceğiyönündeki kuşkuların oluşmasına yol açan preklinik bulgular, kadınlardaki kullanımınıilgilendiren kısıtlamalarda dikkate alınmış bulunmaktadır. Bu bulguların dışında, salbutamol ve ipratropium bromür ile yapılan çalışmalar, embriyo, fetüs ve yavrularda varsa bile, yalnızca marjinal etkiler ortaya çıkarmıştır ve bu etkileryalnızca maternal toksisite aralığı içinde oluşmuştur. Her iki tekil madde de çok sayıda in-vivoin-vitrotestlerde incelenmiştir. Ne salbutamol ne de ipratropium bromür, herhangi bir mutajenik özellik belirtisi göstermemiştir.Salbutamol ve ipratropium bromür ayrı ayrı, çeşitli in vivokarsinojenisite çalışmalarında neoplastik özellikleri yönleriyle incelenmişlerdir.Farelerde, ama sıçanlarda ve köpeklerde değil, oral salbutamol uygulamasından sonra, insanlarda kullanılan inhalasyon dozlarının 100 katından daha yüksek dozlarda, mezovaryumleiomyoması insidansında artış gözlenmiştir. Leiomyoma gelişiminin eş-zamanlı beta-bloköruygulamasıyla engellenebilir özellikte olduğu bulunmuştur. Bu bulguların türe özgü olduğuve klinik önem taşımadıkları ve sonuç olarak salbutamolün klinik kullanımında herhangi birkısıtlamaya yol açmayacakları şeklinde değerlendirme yapılmıştır. İpratropium bromür farelerde ve sıçanlarda oral yoldan verildiğinde, karsinojenik potansiyel ortaya çıkmamıştır. İpratropium bromür/salbutamol kombinasyonunun ya da tekil aktif bileşenlerinin sebep olduğu herhangi bir immünotoksikolojik etkiye ilişkin herhangi bir veri bulunmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiSodyum klorür Hidroklorik asit (pH ayarlayıcı) Enjeksiyonluk su 6.2 GeçimsizliklerVENTOPİUM PLUS'ın bilinen bir geçimsizliği yoktur. 6.3 Raf ömrü24 ay 11/13 6.4 Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklanmalıdır. Direkt güneş ışığından korunmalıdır. Çözeltinin renginde değişiklik varsa kullanılmamalıdır. 6.5 Ambalajın niteliği ve içeriğiKutuda, Alu folyo paket içerisinde, 2,5 mL çözelti içeren 20 adet twist off kapaklı şeffaf LDPE flakon ve kullanma talimatı ile birlikte sunulmaktadır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atık Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrol Yönetmeliğine uygun olarak imha edilmelidir. Son kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre ve Şehircilik Bakanlığınca belirlenen toplama sistemine veriniz. Kullanım Talimatı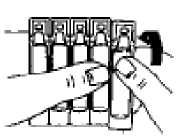 Tek dozluk flakonlar yalnızca, uygun nebülizatör cihazları ile inhalasyon şeklinde kullanılmak içindir ve oral yoldan alınmamalı ya da parenteral yoldanuygulanmamalıdır. 1. Nebülizatörü, imalatçısının ya da hekimin talimatları doğrultusundakullanıma hazırlayınız. 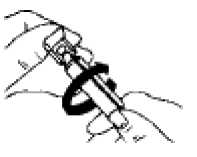 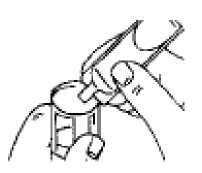 2. Tek dozluk bir flakonu şeritten koparınız. 3. Tek dozluk flakonu, uç kısmını sertçe bükerek açınız. 4. Tek dozluk flakonun içeriğini, nebülizatörün rezervuarına (depokısmına) sıkarak boşaltınız. 5. Nebülizatörün parçalarını birleştirip, önerildiği şekilde inhale ediniz. 6. Kullandıktan sonra, rezervuarda kalmış olabilecek solüsyonu atınız venebülizatörü, imalatçısının talimatları doğrultusunda temizleyiniz. Tek dozluk flakonlar koruyucu madde içermediğinden, mikroplarla bulaşmayı önlemek amacıyla, flakonun açıldıktan hemen sonra kullanılması ve heruygulamada yeni bir flakonun açılması önem taşımaktadır. Kısmen kullanılmış, açılmış veyahasar görmüş tek dozluk flakonlar atılmalıdır. 12/13 VENTOPİUM PLUS'ın, aynı nebülizatör içinde diğer ilaçlarla karıştırılmaması özellikle önerilmektedir. 7. RUHSAT SAHİBİBİLİM İLAÇ SAN. ve TİC. AŞ. Kaptanpaşa Mah. Zincirlikuyu Cad. No:184 34440 Beyoğlu-İSTANBULTel: +90 (212) 365 15 00Faks: +90 (212) 276 29 19 8. RUHSAT NUMARASI2015/444 9. RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 24.05.2015 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ13/13 |
İlaç BilgileriVentopium Plus 0.5mg+2.5mg/2.5ml Nebülizasyon İçin İnhalasyon ÇözeltisiEtken Maddesi: İpratropium Bromür Monohidrat, Salbutamol Sülfat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.