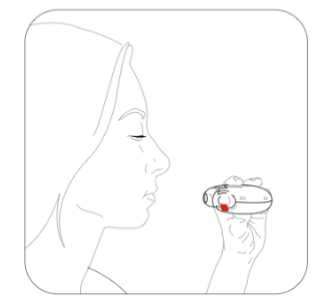
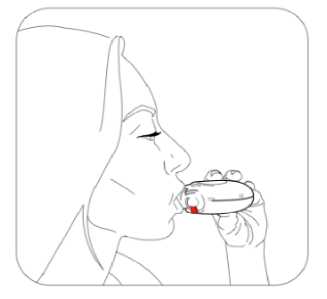
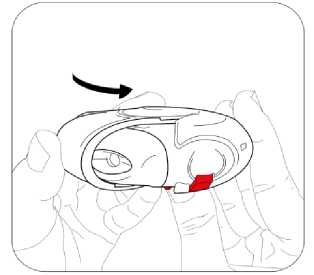
Budenosin Discair 400 Mcg İnhalasyon İçin Toz Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIBUDENOSİN® DISCAIR 400 mcg inhalasyon için toz 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Budesonid 400 mcg Yardımcı madde(ler):Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon için toz içeren blister. Blisterlenebilen alüminyum folyo içerisinde beyaz toz şeklindedir. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAstımın tüm basamaklarında antienflamatuar, bronkodilatör, semptom kontrolü ve oral steroid ihtiyacını azaltmak amaçlı kullanılır. KOAH'ta tek başına kullanılması önerilmez. 4.2. Pozoloji ve uygulama şekliPozoloji / uygulama sıklığı ve süresi:Diğer ilaçlardan BUDENOSİN DISCAIR'a geçilirken tedavi, günde bir veya iki kez dozlama olacak şekilde kişiye özgü olmalıdır. İlaç ve verilme şekli değerlendirilmelidir. Bronşiyal AstımdaBölünmüş dozlar (günde iki kez)Dozaj kişiye özgü olmalıdır. Doz daima iyi astım kontrolü sağlamak için gereken minimum düzeye indirilmelidir. Erişkinler (yaşlılar dahil) ve 12 yaş üzeri çocuklar:Tedaviye başlanırken, şiddetli astım dönemlerinde ve oral glukokortikosteroidler azaltılırken ya da kesilirken, erişkinlerdeki dozaj bölünmüş dozlar halinde günde 200-1600 mikrogramşeklinde olmalıdır. Daha az şiddetli vakalarda ve 12 yaş üzeri çocuklarda, günde 200-800 mikrogram bölünmüş dozlar halinde kullanılabilir. Şiddetli astım dönemlerinde, günlük dozaj bölünmüş dozlarhalinde 1600 mikrograma kadar arttırılabilir. 5-12 yaş arası çocuklar:Bölünmüş dozlar halinde, günde 200-800 mikrogram. Şiddetli astım dönemlerinde, günlük 1 doz 800 mikrograma kadar arttırılabilir. Günde bir defa dozDozaj kişiye özgü olmalıdır. Doz daima iyi astım kontrolü sağlamak için gereken minimum düzeye indirilmelidir. Erişkinler (yaşlılar dahil) ve 12 yaş üzeri çocuklar:Daha önceden inhale glukokortikosteroid kullanmamış, hafif ila orta düzey astımı olan hastalarda 200 mikrogram ila 400 mikrogram kullanılabilir. Önceden inhale steroidlerle (örn., budesonid veya beklometazon dipropiyonat) kontrol altına alınmış hafif ila orta düzey astımı olan hastalarda günde iki kez uygulanmak üzere 800mikrograma kadar kullanılabilir. 5-12 yaş arası çocuklar:Önceden inhale steroidlerle (örn. budesonid veya beklometazon dipropiyonat) kontrol altına alınmış veya önceden inhale glukokortikosteroid almamış hafif ila orta düzey astımı olançocuklarda günde iki kez uygulanmak üzere 200 mikrogram ila 400 mikrogram kullanılabilir. Hasta, aynı eşdeğer toplam günlük dozda günde bir kez dozlamaya geçirilmelidir; ilaç ve uygulama yöntemi değerlendirilmelidir. Doz daha sonra, iyi astım kontrolü sağlamak içingereken minimum düzeye indirilmelidir. Hastalara günlük tek dozlarını akşam almaları konusunda talimat verilmelidir. Dozun, düzenli olarak ve her akşam benzer bir vakitte alınması önemlidir. Hastalara, daha yeni inhale steroidlerden günde bir kez BUDENOSİN DISCAIR'a geçmelerini tavsiye etmek için yeterli veri yoktur. Özellikle günde bir kez tedavi alanlar olmak üzere hastalara, astımlarının kötüleşmesi (örn. bronkodilatatör kullanımının sıklığında artış veya persistan respiratuvar belirtiler) durumunda,günde iki kez uygulamak üzere steroid dozunu iki katına çıkarmaları ve mümkün olan en kısazamanda doktorla iletişime geçmeleri tavsiye edilmelidir. Terapötik etkinin artması istenen hastalarda, oral glukokortikosteroidlerle kombine tedaviye kıyasla sistemik etki riskinin daha düşük olması nedeniyle BUDENOSİN DISCAIR dozununarttırılması önerilir. Oral glukokortikosteroid idamesindeki hastalarBUDENOSİN DISCAIR, astım kontrolü sırasında oral glukokortikosteroidlerin dozajında önemli azalma veya replasman yapılmasına izin verebilir. Oral steroidlerden BUDENOSİNDISCAIR'a geçiş başlatıldığında, hasta nispeten stabil bir fazda olmalıdır. Bu sırada yaklaşık10 gün boyunca, önceden kullanılan oral steroid dozuyla kombine yüksek doz BUDENOSİNDISCAIR verilir. Bundan sonra, oral steroid dozu kademeli olarak (örneğin, ayda 2,5 mg 2 prednizolon veya eşdeğeri) mümkün olan en düşük seviyeye azaltılmalıdır. Pek çok vakada oral steroidi tamamen BUDENOSİN DISCAIR ile değiştirmek mümkündür. Oralkortikosteroidlerin kesilmesi hakkında daha fazla bilgi için Bölüm 4.4'e bakınız. Hastalara, asemptomatik olsalar bile düzenli olarak koruyucu tedavilerini almalarının önemi hatırlatılmalıdır. Akut astım semptomlarını iyileştirmek için kısa etkili inhale birbronkodilatör bulundurulmalıdır. Kronik Obstrüktif Akciğer Hastalığında (KOAH)Formoterol gibi uzun etkili bir bronkodilatatöre ek olarak verildiğinde, BUDENOSİN DISCAIR için önerilen doz, günde 2 defa 400 mikrogram'dır. BUDENOSİN DISCAIR reçete edilmiş oral glukokortikosteroid kullanan KOAH'lı hastalarda, oral doz azaltılırsa, "Pozoloji ve uygulama şekli; Bronşiyal Astımda" bölümündebelirtilen tavsiyeler verilmelidir. Uygulama şekli:BUDENOSİN DISCAIR, oral inhalasyon kullanım içindir. İnhalasyon cihazı, solunumla akışı sağlar. Bunun anlamı hastalar ağızlıkla inhale ettiğinde, etkin madde alınan nefesle havayollarına ulaşacak demektir. Not: Hastayı aşağıdaki hususlarda bilgilendirmek önemlidir: Her inhalerin beraberinde ambalajda bulunan hasta kullanma talimatındaki talimatlarıdikkatlice okuması gerektiği Akciğerlere optimal dozun ulaştığından emin olmak için ağız parçası yardımıyla kuvvetlive derin nefes alması gerektiği Ağız parçasından asla nefes vermemesi gerektiği Ağız ve boğaz bölgesinde pamukçuk (kandida enfeksiyonu) oluşma riskini en aza indirmekiçin, reçete edilen dozu inhale ettikten sonra ağzını suyla çalkalaması ve suyu yutmamasıgerektiği öğütlenmelidir. İnhaler yoluyla verilen ilaç miktarı çok az olduğundan, hasta kullanım sırasında herhangi bir tat almayabilir veya ilacı hissetmeyebilir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği: Böbrek yetmezliği olan hastalarda doz ayarlaması gerekmemektedir. Karaciğer yetmezliği:Karaciğer fonksiyonlarının azalması, kortikosteroidlerin atılımını etkileyebilir. Bununla birlikte, intravenöz yoldan uygulanan budesonidin plazma klerensi, sirozlu hastalarda vesağlıklı kişilerde benzerdir. Karaciğer fonksiyonlarının azaldığı durumlarda, ilk geçişmetabolizmasındaki azalma nedeniyle, oral yoldan alınan budesonidin sistemik yararlanımıartar. İnhalasyon yoluyla alınan budesonid için herhangi bir veri bulunmadığından, bunun 3 BUDENOSİN DISCAIR ile tedavi için klinik anlamı bilinmemektedir; ancak plazma düzeylerinin yükselmesi ve dolayısıyla sistemik advers etkiler açısından riskin artmasıbeklenebilir. Pediyatrik popülasyon:5 yaş üzeri çocuklarda belirtilen dozlarda kullanılmalıdır. Geriyatrik popülasyon:Yaşlılarda özel doz gereksinimleri yoktur. 4.3. KontrendikasyonlarBudesonide karşı aşırı duyarlılığı olan hastalarda kullanılmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleriAktif veya sessiz seyreden akciğer tüberkülozlu hastalarda ve solunum yollarında fungal ya da viral enfeksiyonu olan hastalarda özellikle dikkatli olunmalıdır. Non steroid bağımlı hastalar:Terapötik etkiye genellikle 10 gün içinde erişir. Bronşlarında aşırı mukus sekresyonu olan hastalarda, başlangıçta kısa bir süre (yaklaşık 2 hafta) ilave oralkortikosteroid rejimi verilebilir.Steroide bağımlı hastalar:Oral kortikosteroidden BUDENOSİN DISCAIR tedavisine geçildiğinde, hasta nispeten stabil fazda olmalıdır. Bu sırada yaklaşık 10 gün boyunca,önceden kullanılan oral steroid dozuyla kombine yüksek doz BUDENOSİN DISCAIR verilir.Bundan sonra, oral steroid dozu kademeli olarak (örneğin, ayda 2,5 mg prednizolon veya eşdeğeri) mümkün olan en düşük seviyeye azaltılmalıdır. Pek çok vakada BUDENOSİNDISCAIR'ın kortikosteroidin tamamının yerine geçmesi mümkündür. Oral tedaviden inhale budesonid tedavisine geçilmesi sırasında, rinit, egzema ve kas ile eklem ağrısı gibi alerjik ya da artritik semptomların görülmesine neden olabilen genellikle dahadüşük sistemik steroid etkiler görülür. Bu tür durumlar için spesifik tedavi başlatılmalıdır.Oral steroidlerin kesilmesi esnasında hastalar, solunum fonksiyonu korunmuş veya iyileşmişolsa bile non-spesifik olarak kendilerini kötü hissedebilirler. Hastalar, klinik belirtiler aksinigöstermediği sürece oral steroid kesilirken BUDENOSİN DISCAIR tedavisine devam etmeyeteşvik edilmelidir. Yorgunluk, baş ağrısı, bulantı ve kusma gibi belirtilerin görüldüğü nadirdurumlarda, genel bir glukokortikosteroid etki yetersizliğinden kuşkulanılmalıdır. Buvakalarda bazen, oral glukokortikosteroid dozunun geçici olarak yükseltilmesi gerekli olabilir. Diğer inhalasyon tedavilerinde olduğu gibi, dozlamadan hemen sonra artan hırıltılı nefes ile paradoksal bronkospazm görülebilir. Bu görülürse, inhale budesonid tedavisi derhal kesilmeli,hasta yeniden değerlendirilmeli ve gerekiyorsa alternatif tedavi başlatılmalıdır. Daha önce oral steroidlere bağımlı olan hastalar, uzun süreli sistemik steroid tedavinin bir 4 sonucu olarak, bozulmuş adrenal fonksiyon etkileri yaşayabilirler. İyileşme, oral steroid tedavisinin kesilmesinden sonra kayda değer miktarda zaman alabilir; bu nedenle oral steroidebağımlı olan ve budesonide geçirilen hastalar, önemli bir süre boyunca adrenal fonksiyonbozukluğu riski taşımaya devam edebilir. Böyle durumlarda hipotalamus-hipofiz-adrenal(HPA) aksı fonksiyonları düzenli olarak izlenmelidir. Akut astım kötüleşmelerinde, BUDENOSİN DISCAIR dozunda artış yapılması veya kısa süreli oral kortikosteroid ve/veya enfeksiyon varsa antibiyotik ile ek tedavi gerekebilir.Hastaya, akut astım semptomlarını hafifletmek için kurtarıcı ilaç olarak kısa etkili inhalebronkodilatatör kullanması önerilmelidir. BUDENOSİN DISCAIR, kısa etkili inhale bronkodilatör gerektiren astımın akut ataklarının hızlı iyileştirilmesine yönelik değildir. Hastalar kısa etkili bronkodilatör tedavisini etkisiz bulurlarsa ya da normalden daha fazla inhalasyona ihtiyaç duyarlarsa, bir sağlık kurumuna başvurmalıdırlar. Bu tür durumlarda,örneğin daha yüksek dozlarda inhale budesonid veya uzun etkili beta agonist eklenmesi ya dabir süre oral glukokortikosteroid olmak üzere, düzenli tedavilerinde bir artış ihtiyacı olupolmadığı değerlendirilmelidir. Acil yüksek doz kortikosteroid tedavisi ya da inhale kortikosteroidlerin önerilen en yüksek dozuyla uzun süreli tedavi gereken hastalar, adrenal fonksiyonu yetmezliği riski altındaolabilirler. Bu hastalar ciddi stres altında kaldıklarında, böbrek üstü bezi yetmezliği bulgu vesemptomlarını gösterebilirler. Stres veya elektif cerrahi dönemlerinde ek sistemikkortikosteroid desteği verilmesi gerekebilir. Bu hastalar, ihtiyaçlarının belirtildiği steroiduyarı kartını yanlarında taşımaları konusunda bilgilendirilmelidir. Sistemik steroid takviyesiya da BUDENOSİN DISCAIR ile tedavi birden kesilmemelidir. Tüm inhalasyon yoluyla kullanılan kortikosteroidlerde, özellikle de uzun süreler için reçetelenen yüksek dozlarda, sistemik etkiler ortaya çıkabilir. Bu etkilerin görülme olasılığıoral kortikosteroidlerdekine oranla çok daha azdır. Oluşabilecek sistemik etkilere Cushingsendromu, Cushing benzeri özellikler, adrenal baskılanma, çocuklarda ve adolesanlardabüyüme geriliği, kemik-mineral yoğunluğunda azalma, katarakt ile glokom ve çok nadiren birdizi fizyolojik ya da psikomotor hiperaktivite, uyku bozukluğu, anksiyete, depresyon ya daagresyonun (bilhassa çocuklarda) katıldığı davranışsal etkiler dahildir. Dolayısıyla, inhalekortikosteroid dozunun etkin astım kontrolünün sağlandığı en düşük doza ayarlanmasıönemlidir. Karaciğer fonksiyonlarındaki azalma düşük eliminasyon hızına ve daha yüksek maruziyete sebep olarak, kortikosteroidlerin eliminasyonunu etkiler. Olası sistemik yan etkilerin farkındaolunmalıdır. Bununla birlikte, intravenöz yoldan uygulanan budesonidin plazma klerensi, sirozlu hastalarda ve sağlıklı kişilerde benzerdir. Karaciğer fonksiyonlarının azaldığı durumlarda, ilk 5 geçiş metabolizmasındaki azalma nedeniyle, oral yoldan alınan budesonidin sistemik yararlanımı artar. İnhalasyon yoluyla alınan budesonid için herhangi bir veribulunmadığından, bunun BUDENOSİN DISCAIR ile tedavi için klinik anlamıbilinmemektedir; ancak plazma düzeylerinin yükselmesi ve dolayısıyla sistemik advers etkileraçısından riskin artması beklenebilir. CYP3A inhibitörleri ile birlikte tedavi, örn. Itrakonazol, ketokonazol, HIV proteaz inhibitörleri ve kobisistat içeren ürünlerin, sistemik kortikosteroid yan etkileri riskiniarttırması beklenmektedir. Bu nedenle, yarar artan riskten daha fazla olmadıkçakombinasyondan kaçınılmalıdır; bu durumda, hastalar sistemik kortikosteroid yan etkileriaçısından izlenmelidir. Bu, itrakonazol veya ketokonazol veya diğer güçlü CYP3Ainhibitörleri ile kısa süreli (1-2 haftalık) tedavi için sınırlı klinik önem taşımaktadır; ancakuzun süreli tedavi sırasında dikkate alınmalıdır. Budesonid dozundaki azalma da göz önündebulundurulmalıdır (Bkz. Bölüm 4.5). İnhale kortikosteroidlerle tedavi esnasında oral kandidiyazis görülebilir. Bu enfeksiyon, uygun antifungal tedavi ile tedavi edilmeyi gerektirebilir ve bazı hastalarda tedavininkesilmesi gerekebilir (Bkz. Bölüm 4.2). KOAH hastalarında pnömoniKortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil, pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoniriskinde artış kanıtları bulunmaktadır; ancak bu durum çalışmaların tamamında kesin olarakgösterilmemiştir. Kortikosteroid içeren inhale ilaçlar arasında pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık bakımından kesin klinik kanıt bulunmamaktadır. Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyladikkatli olmalıdır. KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içilmesi, ileri yaş, düşük vücut kitle indeksi ve şiddetli KOAH bulunmaktadır. İnhale steroidin kombine edildiği KOAH'lı ileri yaş hastalarda pnömoni riski artabilmektedir.Görme bozukluğu Sistemik ve topikal kortikosteroid kullanımı ile görme bozukluğu bildirilebilir. Eğer hasta bulanık görme veya diğer görme bozuklukları gibi semptomlarla karşılaşırsa, katarakt,glokom veya merkezi seröz korioretinopati (CSCR) gibi sistemik ve topikalkortikosteroidlerin kullanılması sonrasında bildirilen nadir görülen hastalıkları içerebilecekmuhtemel nedenlerin değerlendirilmesi için hastanın bir oftalmolojiste sevk edilmesi göz 6 önünde bulundurulmalıdır. Pediyatrik popülasyon Büyüme üzerine etki İnhale kortikosteroidlerle uzun süreli tedavi gören çocukların boylarının düzenli olarak izlenmesi önerilir. Büyüme yavaşlarsa, inhalasyon yoluyla kullanılan kortikosteroid dozununmümkünse etkili astım kontrolünün korunduğu en düşük doza düşürülecek şekilde azaltılmasıamacıyla tedavi yeniden değerlendirilmelidir. Büyümenin baskılanmasındaki olası risk ilekortikosteroid tedavisinin sağladığı fayda dikkatlice kıyaslanmalıdır. Ek olarak hastanın,pediyatrik solunum hastalıkları uzmanına yönlendirilmesi düşünülmelidir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBudesonid metabolizması başlıca CYP3A4 tarafından gerçekleştirilmektedir. CYP3A inhibitörleri ile birlikte tedavi, örn. Itrakonazol, ketokonazol, HIV proteaz inhibitörleri vekobisistat içeren ürünlerin sistemik yan etki riskini arttırması beklenmektedir (Bkz. Bölüm 4.4ve 5.2). BUDENOSİN DISCAIR'ın potent CYP3A inhibitörleri ile kombinasyonu, sistemik kortikosteroid yan etkilerin artmış riskinden daha fazla fayda sağlamadıkça önlenmelidir; budurumda hastalar sistemik kortikosteroid yan etkileri açısından izlenmelidir. BUDENOSİNDISCAIR anti-fungaller (itrakonazol ve ketokonazol gibi) ile birlikte uygulanıyorsa, tedavilerarasındaki periyot mümkün olduğunca uzun olmalıdır. Budesonid dozunun azaltılmasıdüşünülebilir. Yüksek doz budesonid için bu etkileşim hakkında kısıtlı veri vardır; inhale budesonid (1000 mcg tek doz) ile günde bir kez 200 mg itrakonazol birlikte kullanılırsa, plazma düzeylerindebariz artış (ortalama dört kat) görülebilir. Yüksek plazma konsantrasyonları ve kortikosteroidlerin artan etkileri, östrojenler ve kontraseptif steroidlerle tedavi edilen kadınlarda gözlenmiştir; ama budesonid ve eş zamanlıdüşük doz oral kontraseptif kombinasyonları ile herhangi bir etki gözlenmemiştir. Adrenal fonksiyon baskılanabileceğinden, hipofiz bezi yetmezliği teşhisi için ACTH stimülasyon testi hatalı sonuçlar verebilir (düşük değerler). Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:Etkileşim çalışmaları sadece yetişkinlerde yapılmıştır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: B Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Budesonid ile tedavi süresince etkin bir doğum kontrol yöntemi kullanılması 7 gerekmemektedir. Yüksek plazma konsantrasyonları ve kortikosteroidlerin artan etkileri, östrojenler ve kontraseptif steroidlerle tedavi edilen kadınlarda gözlenmiştir; ancak budesonidve eş zamanlı düşük doz oral kontraseptif kombinasyonları ile herhangi bir etkigözlenmemiştir. Gebelik dönemiİnhale budesonid ile ilgili yapılan hayvan çalışmaları, gebelik/ve-veya/embriyonal/fötal gelişim/ve-veya/doğum/ve-veya postnatal gelişme üzerindeki etkileri açısından yetersizdir(Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Kapsamlı prospektif epidemiyolojik çalışmalar ve dünya çapındaki pazarlama sonrası deneyim, gebelik döneminde inhalasyon yoluyla kullanılan budesonidin fetüs/yeni doğansağlığı üzerinde bir advers etkisini işaret etmemektedir. Hayvan çalışmalarında glukokortikosteroidlerin, malformasyonları indüklediği gösterilmiştir (Bkz. Bölüm 5.3). Bunun, önerilen dozlar düşünüldüğünde insanlar için geçerli olma ihtimalidüşüktür; ancak inhale budesonid tedavisi düzenli olarak incelenmeli ve en düşük etkili dozdatutulmalıdır. Diğer ilaçlarda olduğu gibi, budesonidin de gebelik döneminde kullanılması annedeki yararları ile fetus üzerindeki risklerin karşılaştırılmasını gerektirir. İnhaleglukokortikosteroidler, benzer pulmoner cevaplara ulaşmak için gerekli oralglukokortikosteroidlere oranla daha düşük sistemik etkileri nedeniyle göz önüne alınmalıdır. Gebe kadınlara verilirken tedbirli olunmalıdır Laktasyon dönemiBudesonid anne sütüne geçer. Ancak BUDENOSİN DISCAIR'ın terapötik dozlarında, emzirilen bebeğe etkisi olması beklenmez. BUDENOSİN DISCAIR laktasyon dönemindekullanılabilir. Astımlı emziren kadınlarda inhale budesonid (günde iki kez 200 veya 400 mikrogram) ile idame tedavisi, emzirilen infantlarda ihmal edilebilir düzeyde sistemik budesonidmaruziyetine yol açar. Farmakokinetik bir çalışmada hesaplanan günlük infant dozu, her iki doz seviyesinde günlük maternal dozun %0,3'üydü ve infantlardaki ortalama plazma konsantrasyonu, infantta oralbiyoyararlanımının tam olduğu varsayımı ile maternal plazmada gözlenen konsantrasyonların1/600'ü olduğu hesaplanmıştır. İnfant plazma örneklerindeki budesonid konsantrasyonlarınıntümü, tayin limitinin altında idi. İnhale budesonid verilerine ve budesonidin nazal, inhale, oral ve rektal uygulamalardan sonraki terapötik dozaj aralıklarında doğrusal farmakokinetik özellikler göstermesineistinaden, budesonidin terapötik dozlarında, emzirilen çocuğa maruziyetin düşük olduğu 8 öngörülür. Üreme yeteneği/FertiliteBilinmemektedir. 4.7. Araç ve makine kullanımı üzerindeki etkilerBUDENOSİN DISCAIR, araç ve makine kullanma yeteneğini etkilemez. 4.8. İstenmeyen etkilerİstenmeyen etkiler, aşağıdaki sınıflama kullanılarak sıklık gruplarına ayrılmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketletahmin edilemiyor). Enfeksiyonlar ve enfestasyonlarYaygın: Orofarenkste candida enfeksiyonu, pnömoni (KOAH'lı hastalarda) Bağışıklık sistemi hastalıklarıSeyrek: Deri döküntüsü, kontakt dermatit, ürtiker, anjiyoödem ve anafilaktik reaksiyon dahil ani ve geç aşırı duyarlılık reaksiyonları Endokrin hastalıklarıSeyrek: Adrenal baskılanma ve büyüme geriliği dahil sistemik kortikosteroidlerin bulgu ve belirtileri* Psikiyatrik hastalıklarYaygın olmayan: Anksiyete, depresyon Seyrek: Psikomotor hiperaktivite, uyku bozuklukları, sinirlilik, davranış değişiklikleri (çoğunlukla çocuklarda) Sinir sistemi hastalıklarıYaygın olmayan: Tremor*** Göz hastalıklarıYaygın olmayan: Katarakt, bulanık görme (Bkz. Bölüm 4.4) Bilinmiyor: Glokom Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: Öksürük, ses boğuklaşması, boğazda iritasyon Seyrek: Bronkospazm, disfoni, ses boğuklaşması** Deri ve deri altı doku hastalıklarıSeyrek: Morarma 9 Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın olmayan: Kas spazmı * Aşağıdaki pediyatrik popülasyona atfen. ** Klinik çalışmalarda bildirilen sıklığa dayalı. *** Çocuklarda seyrek görülür. Bazen, inhale glukokortikosteroidlerde doz, maruz kalma süresi, eş zamanlı ve önceki kortikosteroid maruziyeti ve bireysel hassasiyete bağlı olarak sistemik glukokortikosteroidyan etkilerin belirtileri veya semptomları ortaya çıkabilir (Bkz. Bölüm 4.4). Seçilmiş advers reaksiyonların tanımlanmasıOrofarenksteki kandida enfeksiyonu riskindeki artış, ilacın birikmesinden kaynaklanmaktadır. Hastaya her doz uygulamasından sonra ağzını su ile yıkamasının tavsiye edilmesi, riskiminimum düzeye indirecektir. Diğer inhalasyon tedavilerinde olduğu gibi, paradoksal bronkospazm çok seyrek olguda görülebilir (Bkz. Bölüm 4.4). Plasebo kontrollü çalışmalarda katarakt, plasebo grubunda da yaygın olmayan şekilde bildirilmiştir. Klinik çalışma inhalasyon yoluyla budesonid alan 13.119 hasta ve 7.278 plasebo alan hasta üzerinde gerçekleştirilmiştir. Anksiyete sıklığı inhale budesonid hastalarında %0,52 veplasebo hastalarında %0,63; depresyon sıklığı ise inhale budesonid hastalarında %0,67 veplaseboda % 1,15'tir. Pediyatrik popülasyon:Pediyatrik popülasyondaki büyüme geriliği riski nedeni ile büyüme, Bölüm 4.4'te belirtildiği üzere izlenmelidir. Şüpheli advers reaksiyonların raporlanması:Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; Tel: 0 800 314 00 08; Faks: 0 312 218 35 99) 4.9. Doz aşımı ve tedavisiSemptomlarAşırı dozlarda olsa dahi akut BUDENOSİN DISCAIR doz aşımının, klinik bir soruna yol açması beklenmez. Kısa bir sürede yüksek miktarlarda ilacın inhale edilmesini takiben tekzararlı etki, hipotalamus-hipofiz- adrenal (HPA) fonksiyonunun baskılanmasıdır. 10 Tedavisi Özel bir acil müdahale yapılması gerekmez. BUDENOSİN DISCAIR tedavisine, astım kontrolü için önerilen dozda devam edilmelidir. 5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik özellikler Farmakoterapötik grup: Obstrüktif akciğer hastalıklarında kullanılan diğer ilaçlar; inhalantlar, glukokortikosteroidler ATC kodu: R03BA02 Budesonid, yüksek lokal anti-inflamatuvar etkisi olan ve oral kortikosteroidlerle görülenlerden daha düşük sıklıkta ve şiddette advers etkileri olan bir glukokortikosteroiddir. Topikal antienflamatuvar etki Glukokortikosteroidlerin astım ve KOAH tedavisindeki etki mekanizmaları tam olarak aydınlatılamamıştır. Enflamatuvar mediyatörlerin salıverilmesi ve sitokinlerce yönlendirilenimmün yanıtların inhibisyonları gibi antiinflamatuvar etkiler, muhtemelen önemlidir. Astımlı hastalarda, benzer sistemik biyoyararlanım elde etmek üzere hesaplanmış dozlarda inhalasyon ve oral yoldan kullanılan budesonidin karşılaştırıldığı bir klinik çalışmada,plaseboya göre inhalasyon yoluyla kullanılan budesonidin istatistiksel açıdan anlamlı birşekilde etkili olduğu, oral yoldan kullanılan budesonid ve plasebo arasında ise anlamlı birfarkın olmadığı görülmüştür. Alışılmış dozlarda inhalasyon yoluyla kullanılan budesonidinterapötik etkisi, büyük oranda solunum yolları üzerindeki doğrudan etkisi ile açıklanabilir. Dört haftalık bir provokatif budesonid ile ön tedavi çalışmasında hem erken hem de geç astmatik reaksiyonlarda bronşiyal konstrüksiyonun azaldığı gösterilmiştir. Etkinin başlaması Oral olarak uygulanan, kuru toz inhaler ile dağıtılan tek bir doz budesonidden sonra bir kaç saat içinde akciğer fonksiyonlarında iyileşme sağlanır. Kuru toz inhaler ile dağıtılan, oralolarak inhale edilen budesonidin terapötik kullanımından sonra maksimum yararın eldeedilmesi 4 haftaya dek olabilirken, akciğer fonksiyonunda iyileşmenin tedavi başlangıcındansonra 2 gün içinde görüldüğü gösterilmiştir. Solunum yolu reaktivitesi Budesonidin aşırı duyarlılığı olan hastalarda solunum yolunun histamin ve metakoline karşı reaktivitesini azalttığı da gösterilmiştir. Astımın alevlenmesi Günde bir veya iki kez uygulanan inhale budesonidin hem çocuk hem de erişkinlerde astımın alevlenmesini etkili olarak önlediği gösterilmiştir. 11 Egzersizle ortaya çıkan astım İnhalasyon yoluyla uygulanan budesonid tedavisi, egzersizle ortaya çıkan astımın önlenmesinde etkili bir şekilde kullanılmıştır. Büyüme Kısa dönemli çalışmalarda, büyümede küçük ve genel olarak geçici bir azalma gözlenmiştir ve bu genellikle tedavinin ilk yılında görülür. Uzun dönemli gözlem çalışmaları, inhalekortikosteroidlerle tedavi edilen çocukların ve adolesanların ortalama olarak erişkin hedefboylarına ulaştıklarına işaret etmektedir. Ancak bir çalışmada en düşük etkili doza titrasyonyapılmadan 6 yıla kadar yüksek doz inhale budesonid (günlük 400 mikrogram) ile tedaviedilen çocukların, aynı süre boyunca plasebo tedavisi alan çocuklardan erişkinlikte ortalama1,2 cm daha kısa oldukları bulunmuştur. En düşük etkili doza titrasyon ve çocuklardabüyümenin izlemi için Bölüm 4.4'e bakınız. Pediyatrik popülasyon 3-6 yıl boyunca günlük ortalama 504 pg doz ile tedavi edilen 157 çocukta (5-16 yaş) yarık lamba muayeneleri yapılmıştır. Bulgular 111 tane yaşa göre eşleştirilmiş astımlı çocuklakıyaslanmıştır. İnhale budesonid, posterior subkapsüler katarakt görülmesinde artış ileilişkilendirilmemiştir. Plazma kortizol düzeyi üzerine etkisi Sağlıklı gönüllülerde kuru toz inhaleri ile yürütülen çalışmalarda, plazma ve idrar kortizolü üzerinde doz ile orantılı bir etki göstermiştir. Önerilen dozlarda, kuru toz inhaleri ACTH testiile gösterildiği üzere, adrenal fonksiyonu üzerine 10 mg prednizolondan belirgin olarak dahaaz etkiye yol açar. 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:Kuru toz inhalerin oral inhalasyonunu takiben budesonidin pik plazma konsantrasyonları (800 mcg dozdan sonra 4 nmol/L) 30 dakika içinde görülür. Maksimum plazma konsantrasyonu veplazma konsantrasyonu zaman profili altı alanı dozla lineer olarak artar; ama tekrarlayandozlarda (3 hafta tedavi) tek bir dozdan sonrakinden çok az (%20-30) daha yüksektir. Sağlıklıkişilerde, ağızlıkta kalan %22'si, kalanı (ölçülen dozun yaklaşık %45'i) yutulurken, akciğerbirikmesi ölçülen dozun (aritmetik ortalama ± SD) % 34±%10'u olarak hesaplanmıştır. Budesonidin 1 miligramının inhalasyonunu takiben maksimum plazma konsantrasyonu, takriben 20 dakika sonra yaklaşık 3,5 nmol/L'dir. Dağılım:Budesonidin dağılım hacmi yaklaşık 3 L/kg'dır. Plazma proteinlerine ortalama %85-90 oranında bağlanır. 12 Biyotransformasyon:Budesonid, karaciğerde yüksek oranda (~%90) ilk geçiş metabolizmasına uğrayarak glukokortikosteroid aktivitesi düşük metabolitlerine dönüşür. En önemli metabolitleri 6B-hidroksibudesonid ve 16a-hidroksiprednizolonun glukokortikosteroid aktivitesi, budesonidinaktivitesinin %1'inden azdır. Budesonid metabolizması temel olarak sitokrom P450'nin altsınıfı olan CYP3A aracılığıyla olur. Eliminasyon:Budesonidin metabolitleri, aynen ya da konjuge edilerek, temel olarak böbrekler aracılığıyla atılır. İdrarda değişime uğramamış halde budesonid bulunmaz. Budesonidin sistemik klerensiyüksektir (dakikada yaklaşık 1,2 L) ve sağlıklı yetişkinlerde intravenöz yoldanuygulandığında plazma yarılanma süresi ortalama 2-3 saattir. Doğrusallık/Doğrusal olmayan durum:Klinikte kullanılan doz sınırları içinde, budesonidin kinetiği doz ile doğru orantılıdır. Bir çalışmada günde iki kez alınan 100 mg ketokonazol, eşzamanlı olarak uygulanan oral budesonidin (10 mg'lık tek doz) plazma seviyelerini ortalama 7,8 kat arttırmıştır. Bu etkileşimbilgisi inhale budesonid için yoktur; ama plazma düzeylerinde dikkate değer artışlarbeklenebilir. Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Böbrek yetmezliği olan hastalarda doz ayarlaması gerekmemektedir. Karaciğer yetmezliği:Karaciğer fonksiyonlarının azalması, kortikosteroidlerin atılımını etkileyebilir. Bununla birlikte, intravenöz yoldan uygulanan budesonidin plazma klerensi, sirozlu hastalarda vesağlıklı kişilerde benzerdir. Karaciğer fonksiyonlarının azaldığı durumlarda, ilk geçişmetabolizmasındaki azalma nedeniyle, oral yoldan alınan budesonidin sistemik yararlanımıartar. İnhalasyon yoluyla alınan budesonid için herhangi bir veri bulunmadığından, bununBUDENOSİN DISCAIR ile tedavi için klinik anlamı bilinmemektedir; ancak plazmadüzeylerinin yükselmesi ve dolayısıyla sistemik advers etkiler açısından riskin artmasıbeklenebilir. Pediyatrik güvenlilik verileri:Budesonidin 4-6 yaş astımlı çocuklardaki sistemik klerensi 0,5 L/dak'dır. Klerens kg vücut ağırlığı başına yetişkinlerde olduğundan %50 fazladır. İnhalasyon sonrasında budesonidinterminal yarılanma ömrü astımlı çocuklarda yaklaşık 2,3 saattir. Bu, sağlıklı yetişkinlerleneredeyse aynıdır. Budesonid kuru toz inhaler (800 mcg tek doz) ile tedavi edilen astımlıçocuklarda plazma konsantrasyonları, inhalasyondan sonra 13,8 dakikada Cmaks'a (4,85nmol/L) erişir ve sonra hızla azalır ve EAA 10,3 nmol.sa/L'dir. EAA değeri genellikleyetişkinlerle aynı dozda gözlenen ile benzerdir; ancak Cmaks değeri, çocuklarda daha yüksekolma eğilimindedir. Çocuklardaki akciğer birikimi (nominal dozun %31'i) sağlıklıerişkinlerde ölçülen ile benzerdir (nominal dozun %34'ü). 13 5.3. Klinik öncesi güvenlilik verileriBudesonidin akut toksisitesi düşüktür ve incelenen referans glukokortikosteroidlerle (beklometazon dipropiyonat, fluoksinolon asetonid) aynı büyüklükte ve tiptedir. Subakut ve kronik toksisite çalışmalarının sonuçları, vücut ağırlığındaki artışın azalması ve lenfoid dokular ile adrenal korteks atrofisi gibi budesonidin sistemik etkilerinin, diğerglukokortikosteroidlerin uygulanmasında gözlenenlerden daha hafif ya da benzer düzeydeolduğunu göstermektedir. Yapılan bir karsinojenik etki araştırmasında erkek sıçanlarda gözlenen beyin glioma insidans artışı, tekrarlanan çalışmada doğrulanamamıştır. Tekrarlanan bu çalışmada, glioma insidansı,aktif tedavi (budesonid, prednizolon, triamsinolon asetonid) gruplarında ve kontrolgruplarında aynı bulunmuştur. İlk karsinojenite çalışmasında erkek sıçanlarda gözlenen karaciğer değişiklikleri (primer hepatoselüler tümörler), yinelenen iki çalışmanın birinde de, budesonid yanında referansglukokortikosteroidlerin uygulandığı gruplarda da görülmüştür. Bu etkilerin bir reseptöretkisine bağlı olması ve bir sınıf etkisini göstermesi kuvvetle muhtemeldir. Mevcut klinik deneyimlere göre, budesonid ya da diğer glukokortikosteroidlerin insanlarda beyin gliomalarını ya da primer hepatoselüler tümörleri uyardığına dair hiçbir işaret yoktur. Üreme ile ilgili hayvanlar üzerinde yürütülen çalışmalarda, budesonid gibi kortikosteroidlerin malformasyonları (yarık damak, iskelet malformasyonları) indüklediği gösterilmiştir. Bununlabirlikte, önerilen dozlarda hayvanlara ait bu deneysel bulgular insanlar için anlamlıgörünmemektedir. Hayvan çalışmaları ile ayrıca, teratojenik doz aralığının altındaki maruziyetlerde aşırı prenatal glukokortikosteroidlerin rahim içi büyüme geriliği, erişkinlerde kardiyovasküler hastalık veglukokortikosteroid reseptör yoğunluğunda, nörotransmitter döngüsünde ve davranışındakalıcı değişiklik riskini artırdığı saptanmıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiLaktoz (İnek sütü kaynaklı) 6.2. GeçimsizliklerBilinmiyor. 6.3. Raf ömrü24 ay 14 6.4. Saklamaya yönelik özel tedbirler 25°C altındaki oda sıcaklığında saklayınız. 6.5. Ambalajın niteliği ve içeriği BUDENOSİN DISCAIR 400 mcg 60 dozluk inhalasyon için toz içeren Alü/Alü blister, inhalasyon cihazında, koruyucu ambalaj içerisinde, karton kutuda, kullanma talimatı ilebirlikte sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİ Celtis İlaç San. ve Tic. A.Ş. Esenler / İSTANBUL Tel: 0 850 201 23 23Faks:0 212 481 61 11 E-mail: [email protected] 8. RUHSAT NUMARASI (LARI) 234/57 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ İlk ruhsat tarihi: 18.08.2011 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ 15 İnhalasyon cihazı kullanım talimatlarıKarton kutuda piyasaya sunulan inhalasyon cihazı güvenlik amaçlı koruyucu ambalaj içerisinde yer almaktadır. İnhalasyon cihazınızı kullanmadan önce şekilde gösterildiği gibi ambalajından çıkarınız. İnhalasyon cihazı, ambalajdan çıkardığınızda kapalı durumda olacaktır. Kullanılmamış bir inhalasyon cihazı içinde ayrı ayrı korunmuş olarak toz halde 60 dozluk ilaç bulunur. Doz göstergesi, inhalasyon cihazı içinde kaç doz ilaç kaldığını gösterir. Her doz tamolarak ölçülmüş olup hijyenik şartlara uygun olarak korunmaktadır. Bakıma ve ya yenidendoldurmaya gerek yoktur. İnhalasyon cihazını kullanmak kolaydır. İlacı alacağınız zaman yapacaklarınız aşağıdaki üç basamakta gösterilmiştir. 1. Açma 2. İçine çekme 16 3. Kapatma BUDENOSİN DISCAIR İnhalasyon Cihazı Nasıl Çalışır?Kırmızı düğmeye (çocuk kilidi) basılarak dış kapak itilir. Dış kapak itilince ağızlık içinde küçük bir delik açılır ve bir dozluk ilaç inhale edilmek için hazırdır. İnhalasyon cihazıkapatılınca dış kapak ilk pozisyonuna döner ve bir sonraki kullanım için hazır hale gelir. Dışkapak, kullanılmadığı zamanlarda inhalasyon cihazını korur. 1. Açma-İnhalasyon cihazını nasıl kullanmalısınız?İnhalasyon cihazını açmak ve inhalasyon için hazır hale getirmek için kırmızı düğmeye basarak dış kapağı itmeniz yeterli olacaktır. İnhalasyon cihazını ağızlığı size dönük olacakşekilde tutunuz. İnhalasyon cihazı artık kullanıma hazırdır. Dış kapağın her açılışındainhalasyon için bir doz hazır hale gelir. Bu doz göstergesinde görülür. İlacı ziyan etmemekiçin dış kapak ile oynamayınız. 2. İçine çekmeİlacı içinize çekmeden önce bu bölümü dikkatli bir şekilde okuyunuz. İnhalasyon cihazını ağzınızdan uzak tutunuz. Nefesinizi rahatça yapabileceğiniz kadar dışarı veriniz. Unutmayınız-asla inhalasyon cihazının içine nefes vermeyiniz. Ağızlığı dudaklarınıza yaslayınız. Uzun ve derin nefes alınız-nefesi burnunuzdan değil, inhalasyon cihazının içinden alınız. 17 İnhalasyon cihazını ağzınızdan uzaklaştırınız. 10 saniye veya rahatça tutabildiğiniz kadar uzun bir süre nefesinizi tutunuz. Yavaşça nefes veriniz. 3. Kapatma İnhalasyon cihazını kapatmak için dış kapağı ilk pozisyonuna kaydırmanız yeterlidir. İnhalasyon cihazı yeniden kullanıma hazır hale gelmiştir. UNUTMAYINIZ!İnhalasyon cihazını kuru tutunuz. Kullanılmadığı zaman kapalı tutunuz. İnhalasyon cihazının içine asla nefes vermeyiniz. Dış kapağı ilacı almaya hazır olduğunuzda açınız.Söylenen dozdan daha fazla almayınız. 18 |
İlaç BilgileriBudenosin Discair 400 Mcg İnhalasyon İçin TozEtken Maddesi: Budesonid Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.