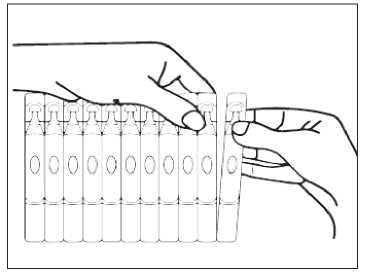
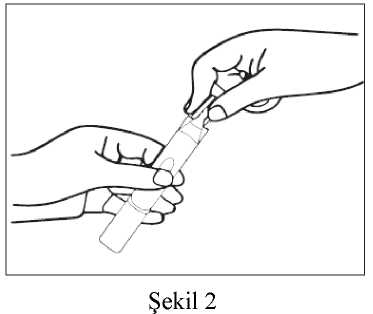
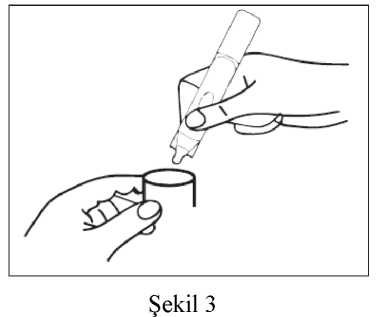
Brecur 2.5 Mg/2.5 Ml Nebülizasyon İçin İnhalasyon Çözeltisi Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIBRECUR® 2.5 mg/2.5 mL nebülizasyon için inhalasyon çözeltisi 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her 2,5 mL'lik tek dozluk flakon etkin madde olarak 2,5 mg salbutamole eşdeğer 3,01 mg salbutamol sülfat içerir. Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMNebülizasyon için inhalasyon çözeltisi içeren tek dozluk flakon Alüminyum folyoya sarılmış tek kullanımlık yarı saydam düşük yoğunluklu polietilen vial içerisine doldurulmuş berrak ve hemen hemen renksiz inhalasyon çözeltisi 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAstımda bronkokonstriksiyonu azaltarak semptom giderici olarak kullanılan rahatlatıcı ilaçlardır. Kontrol edici ilaç olarak kullanılmamalıdırlar. KOAH'ta semptomları azaltmak için ve kurtarıcı ilaç olarak kullanılırlar. Düzenli tedavide tercih edilmezler. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:BRECUR'un birçok hastada etki süresi 4 - 6 saattir. Salbutamolün başlangıç dozu nemli inhalasyon yolu ile 2,5 mg'dır. Bu doz 5 mg'a artırılabilir. Tedavi günde 4 kez tekrarlanabilir. Çok ağır havayolu tıkanmalarında, yetişkinlere günde 40 mg'a kadar yüksek dozlar çok sıkı medikal gözetimaltında hastanede uygulanabilir. Artan beta-2 agonist kullanımı astımın kötüleştiğinin bir işareti olabilir. Bu durumda hastanın tedavi planının yeniden değerlendirilmesi gerekebilir ve beraberinde glukokortikosteroidtedavisi düşünülmelidir. Aerosol bir yüz maskesi, "T" parçası veya endotrakeal tüp ile verilebilir. Aralıklı pozitif basınçlı ventilasyon kullanılabilir, fakat bu nadiren gereklidir. Hipoventilasyondan ötürü anoksi riskiolduğunda, inspire edilen havaya oksijen ilave edilmelidir. 1 Aşırı doz ile yan etkiler görülebileceğinden doz veya uygulama sıklığı sadece doktor tavsiyesi ile artırılabilir. Birçok nebülizer devamlı akış esasına göre çalıştırıldığından, nebülize ilacın yerel çevreye salınması muhtemeldir. Bu bakımdan, özellikle birçok hastanın aynı anda nebülizerlerikullandığı hastanelerde, BRECUR uygulaması iyi şekilde havalandırılan odalarda yapılmalıdır. Uygulama şekli:BRECUR hekim gözetimi altında bir nebulizer ile kullanılmak içindir. BRECUR seyreltilmeden kullanılmak için hazırlanmıştır. Bununla birlikte, uzun sürede verilmesi istenirse (10 dakikadan fazla) enjeksiyonluk fizyolojik serum ile seyreltilmesigerekebilir. Çözelti enjekte edilmemeli veya yutulmamalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Veri yoktur. Pediatrik popülasyon:12 yaş ve üzeri çocuklar: Yetişkin dozuna göre. 4-11 yaş arası çocuklar: 2,5 mg ila 5 mg (günde 4 defaya kadar) 4 yaş altındaki çocuklarda uygulanması için diğer farmasötik formlar daha uygun olabilir. 18 ayın altındaki bebekler: 18 ayın altındaki bebeklerde nebülize salbutamolün klinik etkililiği belirsizdir. Geçici hipoksemi meydana gelebileceğinden destekleyici oksijen tedavisidüşünülmelidir. BRECUR, seyreltilmeden kullanılmaktadır. Ancak, daha uzun uygulama süresi (10 dakikadan fazla) gerekiyorsa, solüsyon steril normal salin ile seyreltilebilir. Geriyatrik popülasyon:Veri yoktur. 4.3. KontrendikasyonlarBRECUR'un bileşimindeki maddelerden herhangi birine karşı aşırı duyarlılık hikayesi olan hastalarda kontrendikedir. İntravenöz olmayan salbutamol formülasyonları komplike olmayan erken doğum tehdidini gidermek için kullanılmamalıdır. Salbutamol preparatları düşük tehditlerinde kullanılmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleriAstımın tedavisinde basamaklı tedavi programı takip edilmeli ve hastanın cevabı klinik olarak ve akciğer fonksiyon testleri ile gözlenmelidir. 2 Semptomları kontrol için kısa etkili inhale beta-2 agonist kullanımının artışı astım kontrolünün kötüleştiğini gösterir. Bu durumda hastanın tedavi planı yeniden değerlendirilmelidir. Astımkontrolündeki ani ve ilerleyici kötüleşme potansiyel olarak yaşamı tehdit edicidir vekortikosteroid tedavisine başlanılması veya dozunun arttırılması düşünülmelidir. Risk altındakihastalarda günlük doruk akım (peak flow) kontrollerine başlanabilir. BRECUR sadece inhalasyon yoluyla kullanılmalıdır, ağız yoluyla solunmalı ve enjekte edilmemeli ya da yutulmamalıdır. Evlerinde BRECUR ile tedavi gören hastalar, ilaçtan sağladıkları rahatlama azalır veya her zamanki etki süresi kısalırsa, dozu veya uygulama sıklığını arttırmamalı, fakat doktorabaşvurmaları konusunda uyarılmalıdır. Yüksek dozlarda diğer sempatomimetik ilaçları aldığı bilinen hastalarda dikkatli kullanılmalıdır. BRECUR tirotoksikozlu hastalara dikkatle uygulanmalıdır. Az sayıda vakada, ipratropium bromür ve nebülize salbutamolü birlikte kullanan hastalarda akut kapalı açılı glokom bildirilmiştir. Bu nedenle nebülize salbutamol ile nebülizeantikolinerjiklerin kombine kullanımında dikkatli olunmalıdır. Hastalar ilaçların doğruuygulaması konusunda bilgilendirilmeli ve çözelti veya nebülize damlacıkların gözekaçmamasına dikkat etmeleri konusunda uyarılmalıdır. Başlıca parenteral ve nebülize uygulamalar olmak üzere beta-2 agonist tedavisi sonucu potansiyel olarak ciddi hipokalemi gelişebilir. Akut şiddetli astımda bu etki beraberinde ksantintürevleri, steroidler, diüretik kullanımı ve hipoksi nedeniyle şiddetlenebileceğinden özel dikkatgösterilmelidir. Bu gibi durumlarda serum potasyum düzeylerinin gözlenmesi önerilir. Diğer inhalasyon tedavilerinde olduğu gibi inhalasyonu takiben hemen hışıltılı solunumda artış ile paradoksal bronkospazm görülebilir. Bu durum alternatif bir sunum şekli veya farklı bir hızlıetkili bronkodilatör ile tedavi edilmelidir. BRECUR hemen kesilmeli, gerekirse sürekli tedaviiçin farklı bir hızlı etkili bronkodilatör kullanılmalıdır. Diğer beta adrenoseptör agonistlerinde olduğu gibi, BRECUR geri dönüşümlü metabolik değişikliklere neden olabilir, ör: kan şeker düzeyinin artışı. Diyabetik hastalar bu durumudengeleyemeyebilirler ve ketasidoz gelişimi bildirilmiştir. Beraberinde kortikosteroiduygulanması bu etkiyi alevlendirebilir. Başlıca akut astım alevlenmelerini tedavi etmek için intravenöz veya nebülize kısa etkili beta agonist tedavisini yüksek terapötik dozlarda alan hastalarda çok seyrek olarak laktik asidozbildirilmiştir (Bkz. Bölüm 4.8.). Laktat seviyesindeki artış dispne ve dengeleyicihiperventilasyona neden olabilir; bu durum, astım tedavi başarısızlığının bir belirtisi gibi yanlışyorumlanarak kısa etkili beta agonist tedavisinin yersiz bir şekilde yoğunlaşmasına yol açabilir. 3 Bu nedenle bu hastaların serum laktat düzeyi artışı ve sonuçta metabolik asidoz gelişimi bakımından izlenmesi tavsiye edilir. Salbutamol dahil sempatomimetik ilaçların kullanımıyla kardiyovasküler etkiler görülebilir. Salbutamol ile ilişkili olarak, miyokard iskemisinin nadir oluşumuna dair pazarlama sonrasıveriler ve yayınlanmış literatürler bulunmaktadır. Şiddetli kalp hastalığı (örneğin iskemik kalp hastalığı, aritmi veya şiddetli kalp krizi) olan hastalar salbutamol aldıklarında; göğüslerinde ağrı veya kalp hastalığının kötüleştiğine dairbelirtiler olduğunda tıbbi yardım almaları gerektiği konusunda uyarılmalıdır. Dispne ve göğüsağrısı gibi belirtiler hem respiratuvar hem de kardiyak orjinli olabileceğinden bu belirtilerdeğerlendirilirken dikkatli olunmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBRECUR ve propranolol gibi selektif olmayan beta-bloker ilaçlar genellikle beraber verilmemelidir. BRECUR, monoamin oksidaz inhibitörleri (MAOI) ile tedavi edilen hastalarda kontrendike değildir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (kontrasepsiyon) uygulayanlarda kullanımına ilişkin herhangi bir veri yoktur. Gebelik dönemiHayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal / fetal gelişim /ve-veya/doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir(Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Gebelikte ilaç kullanımı ancak anneye sağlaması beklenen yararı, fetüse olan olası riskten fazla ise düşünülmelidir. Kesin gerekli olmadıkça hamilelik sırasında kullanılmamalıdır. Dünya genelindeki pazarlama deneyimleri süresince, salbutamol ile tedavi edilen hastaların bebeklerinde yarık damak ve kol/bacak kusurları dahil çeşitli konjenital anomalilerbildirilmiştir. Bazı anneler gebelikleri boyunca birçok ilaç kullanmıştır. Bu kusurlarda tutarlı bir patern görülmediği ve konjenital anomaliler için bazal oran %2-3 olduğu için, salbutamol kullanımı ile aralarında bir bağlantı kurulamamıştır. 4 Laktasyon dönemiSalbutamol muhtemelen anne sütüne geçtiğinden beklenen yararları herhangi bir potansiyel riskini dengelemedikçe emziren annelerde kullanımı tavsiye edilmez. Anne sütündekisalbutamolün yenidoğana zararlı bir etkisinin olup olmadığı bilinmemektedir. Üreme yeteneği / FertiliteSalbutamolün insan fertilitesi üzerindeki etkilerine ilişkin bilgi bulunmamaktadır. Hayvanlardaki fertilite üzerinde istenmeyen bir etkisi bulunmamaktadır. 4.7. Araç ve makine kullanımı üzerindeki etkilerVeri yoktur. 4.8. İstenmeyen etkilerAşağıdaki advers etkiler organ sistemi sınıflandırması ve sıklığa göre verilmiştir. Sıklık sınıflandırması: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketletahmin edilemiyor) Çok yaygın ve yaygın olaylar genellikle klinik çalışma verilerinden belirlenmiştir. Seyrek ve çok seyrek olaylar genellikle spontan verilere dayanmaktadır. Bağışıklık sistemi hastalıklarıÇok seyrek: Anjiyoödem, ürtiker, bronkospazm, hipotansiyon ve kollaps dahil aşırı duyarlılık reaksiyonları Metabolizma ve beslenme hastalıklarıSeyrek: Hipokalemi Beta-2 agonist tedavisi potansiyel olarak ciddi hipokalemiye neden olabilir. Çok seyrek: Laktik asidoz. Akut astım veya astım alevlenmelerini tedavi etmek için intravenöz veya nebülize salbutamol tedavisi alan hastalarda çok seyrek olarak laktik asidoz bildirilmiştir. Sinir sistemi hastalıklarıYaygın: Baş ağrısı, titreme Çok seyrek: Hiperaktivite Kardiyak hastalıklarYaygın: Taşikardi Yaygın olmayan: Çarpıntı Çok seyrek: Atrial fibrilasyon, supraventriküler taşikardi ve ekstrasistoller dahil kardiyak aritmiler 5 Bilinmiyor: Miyokard iskemisi* (Bkz. Bölüm 4.4.) * Pazarlama sonrası verilerde spontan olarak bildirilmiştir, bu nedenle sıklığı bilinmemektedir. Vasküler hastalıklarSeyrek: Periferal vazodilatasyon Solunum, göğüs bozuklukları ve mediastinal hastalıklarÇok seyrek: Paradoksal bronkospazm Gastrointestinal hastalıklarYaygın olmayan: Ağızda ve boğazda iritasyon Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Kas krampları Seyrek: Kaslarda gerginlik hissi Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: [email protected];4.9. Doz aşımı ve tedavisiSalbutamol doz aşımında en yaygın gözlenen bulgu ve belirtiler farmakolojik olarak beta agonistlerinin aracılık ettiği taşikardi, tremor, hiperaktivite ve laktik asidozun eşlik ettiği geçiciolaylardır (Bkz. Bölüm 4.4 ve 4.8) BRECUR aşırı dozunu takiben hipokalemi oluşabilir. Serum potasyum düzeyleri gözlenmelidir. Hem yüksek terapötik dozlarla hem de kısa etkili beta-agonist tedavisinin doz aşımıyla ilişkili olarak laktik asidoz bildirildiğinden; doz aşımı halinde (özellikle de hışıltılı solunum gibi diğerbronkospazm bulgularının düzelmesine rağmen devam eden ya da kötüleşen taşipne varsa)yükselmiş serum laktat düzeylerinin ve buna bağlı olarak gelişebilecek metabolik asidozuntakibi önerilebilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Selektif beta-2 adrenerjik reseptör agonistleri ATC kodu: R03AC02 Etki mekanizması: Salbutamol, selektif beta-2 adrenoseptör agonistidir. Terapötik dozlarda bronş düz kaslarındaki beta-2 adrenoseptörler üzerine etkilidir. 6 Farmakodinamik etkiler: Salbutamol, bir selektif beta-2 adrenoseptör agonistidir. Terapötik dozlarda, reversibl havayolu obstrüksiyonunda hızlı etki ile (5 dakika içinde) birlikte kısa etkili (4 ila 6 saat) bronkodilasyonsağlayarak bronş kasındaki beta-2 adrenoseptörler üzerine etki eder. 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:İnhale yoldan uygulamayı takiben dozun %10-20'si alt havayollarına ulaşır. Geri kalanı ilaç uygulama sisteminde veya orofarinkste birikir ve buradan yutulur. Havayollarında birikenkısım pulmoner dokulara ve dolaşıma absorbe olur, fakat akciğerde metabolize olmaz. Dağılım:Salbutamol plazma proteinlerine %10 oranında bağlanır. Biyotransformasyon:Sistemik dolaşıma ulaştığında karaciğerde metabolize olur ve başlıca idrarla değişmemiş ilaç ve fenolik sülfat şeklinde atılır. Yutulan kısım gastrointestinal kanaldan emilir ve önemli ölçüde ilk geçiş metabolizmasına uğrayarak fenolik sülfata dönüşür. Eliminasyon:Değişmemiş ilaç ve konjugatı başlıca idrar ile atılır. Salbutamol, intravenöz olarak uygulandığında yarılanma ömrü 4-6 saattir ve kısmen böbrekler yolu ile ve kısmen de başlıcaidrarla atılan inaktif 4'-O-sülfata (fenolik sülfat) metabolize olarak temizlenir. Feçes atılımdaminör yoldur. İntravenöz, oral veya inhalasyon ile verilen salbutamolün büyük kısmı 72 saatiçinde atılır. Doğrusallık/Doğrusal olmayan durum:Veri yoktur. Hastalardaki karakteristik özelliklerVeri yoktur. 5.3. Klinik öncesi güvenlilik verileriDiğer güçlü selektif beta-2 reseptör agonistleri gibi salbutamolün de subkütan yolla uygulandığında farelerde teratojenik olduğu gösterilmiştir. Reprodüktif bir çalışmadamaksimum oral insan dozunun 4 katı olan 2,5 mg/kg dozunda verildiğinde fetüslerin %9,3 'ündeyarık damak tespit edilmiştir. Sıçanlarda gebelik boyunca oral yolla yapılan 0,5; 2,32; 10,75 ve50 mg/kg/gün'lük uygulama fetüste belirgin anormallik oluşturmamıştır. Tek toksik etki, enyüksek doz seviyelerinde görülen neonatal ölümlerdir, bu da annenin bakımındaki azalmadankaynaklanır. Tavşanlar üzerinde yapılan reprodüktif çalışmada maksimum oral insan dozunun 7 78 katı olan 50 mg/kg/gün uygulandığında fetüslerin %37'sinde kraniyal malformasyon oluşmuştur. Bir oral fertilite ve genel reprodüktif performans çalışmasında, sıçanlarda, 2 ve 50 mg/kg/gün dozlarında, 50 mg/kg/gün dozda doğum sonrasında 21. günde hayatta olan sütten kesilmişhayvanların sayısındaki bir azalma hariç, fertilite, embriyofetal gelişim, yavru boyutu, doğumağırlığı veya gelişim hızı üzerine bir yan etkisi bulunmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSaf su Sodyum klorür Sülfürik asit 6.2. GeçimsizliklerBilinen bir geçimsizliği bulunmamaktadır. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız. Direkt gün ışığından koruyunuz. 6.5. Ambalajın niteliği ve içeriğiBRECUR 2.5 mg/2.5 mL nebülizasyon için inhalasyon çözeltisi, kutuda, 20 adet 2,5 mL'lik düşük yoğunluklu polietilen tek dozluk flakon şeklinde kullanma talimatı ile berabersunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerSeyreltme: BRECUR, normal serum fizyolojik ile seyreltilebilir. Nebülizör içindeki kullanılmayan solüsyon imha edilmelidir. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİNeutec İnhaler İlaç San. ve Tic. A.Ş. Arifiye / Sakarya Tel: 0850 201 23 23 Faks: 0 212 481 61 11 E-mail: [email protected] 8. RUHSAT NUMARASI (LARI)2015/24 8 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 27.01.2015 Ruhsat yenileme tarihi: 30.03.2020 10. KÜB'ÜN YENİLENME TARİHİ:17.06.2020 9 Uygulama Talimatı1. Nebülizatörü, imalatçısının ya da hekimin talimatları doğrultusunda kullanıma hazırlayınız. 2. Tek dozluk bir flakonu şeritten koparınız. Şekil 1 3. Tek dozluk flakonu, uç kısmını sertçe bükerek açınız. 4. Tek dozluk flakonun içeriğini, nebülizatörün rezervuarına (depo kısmına) sıkarak boşaltınız. 5. Nebülizatörün parçalarını birleştirip, önerildiği şekilde inhale ediniz 6. Kullandıktan sonra, rezervuarda kalmış olabilecek solüsyonu atınız ve nebülizatörü,imalatçısının talimatları doğrultusunda temizleyiniz. 10 Tek dozluk flakonlar koruyucu madde içermediğinden, mikroplarla bulaşmayı önlemek amacıyla, flakonun açıldıktan hemen sonra kullanılması ve her uygulamada yeni bir flakonunaçılması önem taşımaktadır. Kısmen kullanılmış, açılmış veya hasar görmüş tek dozlukflakonlar atılmalıdır. 11 |
İlaç BilgileriBrecur 2.5 Mg/2.5 Ml Nebülizasyon İçin İnhalasyon ÇözeltisiEtken Maddesi: Salbutamol Sülfat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.