N-cort %0,055 Nazal Sprey, Süspansiyon Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIN-CORT %0,055 nazal sprey, süspansiyon 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:(% a/a)Triamsinolon asetonid 0,055 Her uygulama 55 mikrogram triamsinolon asetonid içerir. Yardımcı maddeler:Benzalkonyum klorür %50 0,03 Her uygulama 15 mikrogram benzalkonyum klorür içerir. Diğer yardımcı maddeler için 6.1 'e bakınız. 3. FARMASÖTİK FORMBurun spreyi N-CORT, her dozunda 55 mikrogram triamsinolon asetonid içeren beher şişede 120 dozluk homojen görünümlü opak süspansiyondur. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarPerineal rinit ve mevsimsel alerjik rinit semptomlarının tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekliBurun yoluyla kullanım içindir. Pozoloji:Yetişkinler ile 12 yaş ve üzerindeki çocuklar için: Tavsiye edilen başlangıç dozu her gün bir kez, her burun deliğine 2 püskürtme şeklinde uygulanan 220 mikrogramdır. Semptomlar kontrol altına alınınca, hastalar 110mikrogramla devam edebilirler (günde bir kez, her burun deliğine bir püskürtmeşeklinde). Bazı hastalarda tedavinin ilk günlerinde semptomlarda iyileşme görülebilir. Ancak en yüksek yararın elde edilebilmesi için birkaç günlük tedaviye ihtiyaç duyulabilir. 6 ile 12 yaş arasındaki çocuklar için: Tavsiye edilen doz her gün bir kez, her burun deliğine 1 püskürtme şeklinde verilen 110 mikrogramdır. Daha şiddetli semptomları olanlarda 220 mikrogramlık doz kullanılabilir.Ancak semptomlar kontrol altına alınınca, hastaların tedavisi en düşük etkili doz iledevam ettirilmelidir. Uygulama sıklığı ve süresi:Bazı hastalarda tedavinin ilk günlerinde semptomlarda iyileşme görülebilir. Ancak en yüksek yararın elde edilebilmesi için birkaç günlük tedaviye ihtiyaç duyulabilir. 1 / 10 Uygulama şekli:N-CORT sadece burun yoluyla alınır ve optimal etkinlik için düzenli olarak kullanılmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:N-CORT'un böbrek/karaciğer yetmezliği olan hastalardaki güvenlilik ve etkililiği incelenmemiştir. Pediyatrik popülasyon:N-CORT'un 2 yaşın altındaki çocuklarda etkililiği ve güvenliliği kanıtlanmamıştır. Bu nedenle 2 yaşın altındaki çocuklarda kullanımı önerilmemektedir. 2-6 yaş arası kullanım tecrübesi sınırlı olması nedeni ile bu yaş grubunda kullanılması önerilmez. Daha fazla kanıt elde edilene kadar 12 yaşın altındaki çocuklarda 3 aydan uzun süre kullanılması önerilmez. Geriyatrik popülasyon:N-CORT'un yaşlı hastalardaki güvenliliği ve etkililiği incelenmemiştir. 4.3. Kontrendikasyonlarİlacın bileşimine giren maddelerden herhangi birine karşı aşırı duyarlılığı olanlarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriAdrenal fonksiyonda bozulma olasılığı nedeniyle, hastalarda sistemik steroid tedavisinden N-CORT'a geçerken dikkatli olmak gerekir. Tavsiye edilenden daha yüksek doz kullanılması sonucu klinik olarak anlamlı adrenal supresyon meydana gelebilir. Tavsiye edilenden daha yüksek doz kullanıldığına dair kanıtlarvarsa stres veya elektif cerrahi sırasında ilave sistemik kortikosteroid korumasıdüşünülmelidir. N-CORT gibi topikal kortikosteroidlerle tedaviye geçmeden önce uzun süreli sistemik kortikosteroidlerle tedavi edilmiş hastalar, strese yanıt durumunda ortaya çıkabilecek akutadrenal yetmezlik açısından dikkatle izlenmelidir. Triamsinolon asetonid ile yapılan klinik çalışmalarda, nadiren Candida albicansile burunda ve farenkste lokalize enfeksiyon oluştuğu görülmüştür. Böyle bir enfeksiyon oluşursa, uygunbir lokal tedavi yapılması ve N-CORT uygulamasına geçici olarak son verilmesi gerekir.Kortikosteroidlerin yara iyileşmesi üzerine olan inhibitör etkisi nedeniyle, kısa süre önce nazal septal ülser, burun ameliyatı veya travması geçiren hastalarda iyileşme gerçekleşinceyekadar N-CORT' un dikkatle kullanılması gereklidir. Onaylı dozlarda, N-CORT da dahil olmak üzere nazal kortikosteroid kullanan çocuklarda büyüme geriliği rapor edilmiştir. Nazal kortikosteroid ile tedavi alan çocukların boyölçümlerinin düzenli olarak izlenmesi tavsiye edilmektedir. Tedavi, nazal kortikosteroiddozunu düşürme amacıyla programlanmalı ve mümkünse semptomları etkin şekildekontrol altında tutabilecek en düşük dozla tedavi sürdürülmelidir. Buna ilaveten, hastanın 2 / 10 bir uzmana yönlendirilmesi gerekir. Nazal kortikosteroidlerin büyüme hızı üstündeki uzun vadeli etkileri ve nihai erişkin boyuna tesiri bilinmemektedir (Bkz. Bölüm 5.1). Nazal kortikosteroid kullanan hastalarda glokom ve/veya katarakt olguları rapor edilmiştir. Bu nedenle görme yeteneğinde bir değişiklik olan hastaların ve geçmişte göz içi basıncındaartış, glokom ve/veya katarakt öyküsü bulunan hastaların yakından takip edilmesi gereklidir. Özellikle uzun süreli tedavi süresince yüksek dozlarda reçetelenen nazal kortikosteroidlerde sistemik etki meydana gelebilir. Bu etkiler oral kortikosteroidlere göre çok daha az görülür vehastalar ve farklı kortikosteroid preparatları arasında değişkenlik gösterir. Potansiyel sistemiketkiler Cushing sendromu, Cushingoid özellikler, adrenal süpresyon, çocuk ve ergenlerdebüyüme geriliği, katarakt, glokom ve daha seyrek olarak psikomotor hiperaktivite, uykubozuklukları, anksiyete, depresyon ya da agresyon (özellikle çocuklarda) gibi psikolojik yada davranışsal etkileri içerir. Benzalkonyum klorür içerdiğinden deri reaksiyonlarına sebep olabilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDiğer ilaçlarla bilinen bir etkileşimi yoktur. Özel popülasyonlara ilişkin ek bilgiler:Özel popülasyonlar üzerinde herhangi bir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:Pediyatrik popülasyon üzerinde herhangi bir etkileşim çalışması yapılmamıştır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Veri bulunmamaktadır. Gebelik dönemiHamile kadınlarda triamsinolon asetonid kullanımı ile ilgili klinik deneyim sınırlıdır. Hayvanlar üzerinde yapılan araştırmalarda, triamsinolon asetonidi de içerenkortikosteroidlerin teratojenik etkileri olduğu görülmüştür. Triamsinolon asetonid, anneyeolan yararı, fetüse/bebeğe gelebilecek risklerden daha önemli olmadığı sürece hamileliksüresinde kullanılmamalıdır. Laktasyon dönemiTriamsinolon asetonid de diğer kortikosteroidler gibi insan sütüne geçebilir. N-CORT'un anneye olan yararı ve bebeğe gelebilecek risklerden daha önemli olmadığı sürece emzirmesüresinde kullanılmamalıdır. 4.7. Araç ve makine kullanımı üzerindeki etkilerN-CORT'un araba veya makine kullanma üzerinde bilinen bir etkisi yoktur. 3 / 10 4.8. İstenmeyen etkilerAdvers ilaç reaksiyonları aşağıdaki sıklık derecesine göre belirtilmiştir: Çok yaygın (> 1/10); yaygın (> 1/100 ila < 1/10); yaygın olmayan (> 1/1.000 ila < 1/100); seyrek (> 1/10.000 ila < 1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor). Klinik çalışmalarda rapor edilen advers olayların sıklığı genel olarak çok düşüktür, çoğunlukla burun ve boğazdaki mukoz membranlarla alakalıdır. Yetişkinlerde ve 6 yaşın üzerindeki çocuklarda bildirilen en yaygın istenmeyen etkiler şunlardır:Enfeksiyonlar ve enfestasyonlar:Yaygın: Rinit, farenjit, soğuk algınlığı sendromu Bağışıklık sistemi hastalıkları:Bilinmiyor: Hipersensitivite (döküntü, ürtiker, kaşıntı ve yüzde ödem dahil) Psikiyatrik hastalıklar:Bilinmiyor: Uykusuzluk Sinir sistemi hastalıkları:Yaygın: Baş ağrısı Bilinmiyor: Baş dönmesi, tat ve koku değişiklikleri Göz hastalıkları:Bilinmiyor: Katarakt, glokom, oküler basınç artışı Solunum, göğüs ve mediastinal hastalıklar:Yaygın: Burun kanaması, öksürük, bronşit Seyrek: Nazal septum perforasyonu Bilinmiyor: Nazal irritasyon, mukoz membranlarda kuruluk, nazal konjesyon, hapşırma, dispne Gastrointestinal hastalıklar:Yaygın: Dispepsi, dişlerle ilgili bozukluklar Bilinmiyor: Bulantı Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:Bilinmiyor: Yorgunluk Araştırmalar:Bilinmiyor: Kanda kortizol düzeyinde azalma Pediatrik hastalarda görülen diğer advers etkilerN-CORT ile yapılan pazarlama sonrası bir klinik çalışmada, çocuklarda büyüme hızında azalma gözlenmiştir (Bkz. Bölüm 5.1). Nazal yolla uygulanan diğer kortikosteroidlerle olduğu gibi, seyrek olarak nazal septum perforasyonları ve nazal konjesyon bildirilmiştir. 4 / 10 Nazal kortikosteroidlerin özellikle yüksek dozda uzun süre kullanıldığında sistemik etkileri ortaya çıkabilir. İntranazal steroid kullanan çocuklarda büyüme geriliği bildirilmiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr;a: [email protected];4.9. Doz aşımı ve tedavisiNazal yolla uygulanan diğer kortikosteroidlerde olduğu gibi, mevcut aktif maddenin toplam miktarı dikkatle alındığında, akut doz aşımı beklenmez. Şişe muhtevasının bir kerede, ağızveya burun yoluyla alınması durumunda, klinik olarak önemli sistemik olumsuz etkilermuhtemelen görülmeyecektir. Eğer ağız yoluyla alınırsa hastada mide-barsak rahatsızlıklarıgörülebilir. Doz aşımından şüphe edilirse, tedavi destekleyici ve ilgili semptomlarınkontrolüne yönelik olmalıdır. Yüksek dozların kronik kullanımı hiperkortisizm ve adrenal süpresyonu gibi sistemik kortikosteroid etkilerinin görülmesine yol açabilir. Eğer böyle değişiklikler görülürse, oralsteroid tedavisinin bırakılması için kabul edilen işlemlere uygun olarak, N-CORT yavaşçakesilmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Kortikosteroid (Topikal nazal) ATC Kodu: R01AD11 Enflamasyonda, triamsinolon asetonid triamsinolonun daha etkili bir türevidir ve hayvan modellerinde prednizondan yaklaşık 8 kat daha potenttir. Kortikosteroidlerin anti-alerjik etki mekanizması kesin olarak bilinmemekle birlikte, alerjik hastalıkların tedavisinde klinik olarak çok etkili oldukları saptanmıştır. Triamsinolon asetonid alerjik belirtiler ve semptomlar üzerinde anında etki yapmaz. Triamsinolon asetonid tedavisi gören bazı hastaların semptomlarında ilk gün içinde iyileşmegörülebilir ve 3 ya da 4 gün içinde semptomların ortadan kalkması beklenebilir. Triamsinolonasetonid uygulaması vaktinden önce kesilirse semptomlar birkaç gün içinde yeniden ortayaçıkmayabilir. Yetişkinlerde ve 6 yaşın üzerindeki çocuklarda yapılan klinik çalışmalarda, intranazal olarak günde 440 mikrograma ve 2-5 yaş arasındaki çocuklarda intranazal olarak günde 110mikrograma kadar uygulanan triamsinolon asetonid dozlarıyla, hipotalamik-hipofiz-adrenalaksında (HPA) hiçbir baskılanma gözlenmemiştir. Yaşları 2-11 arasında değişen 140 çocuğun katıldığı altı haftalık plasebo kontrollü bir klinik çalışmada, günde bir kez 110 mikrogram veya 220 mikrogram dozunda uygulananN-CORT'un HPA aksı üzerindeki etkisi, 24 saatlik serum kortizol EAA (Eğri Altındaki Alan)değeri ile değerlendirilmiştir. Çalışmada plaseboya kıyasla istatistiksel olarak anlamlı bir farkgözlenmemiştir. 5 / 10 N-CORT'un 2-5 yaş grubundaki çocukların adrenal fonksiyonları üzerindeki etkisi göz ardı edilemez. Yaşları 3-9 arasında değişen ve tedavi uygulanan 298 pediatrik hastada yürütülen bir yıllık, çift kör, plasebo kontrollü, paralel gruplu bir çalışmada, günde bir kez 110 mikrogramdozunda uygulanan N-CORT'un büyüme hızına etkisi stadiometri ile değerlendirilmiştir.Değerlendirilebilir hastaların (N-CORT 134; plasebo 133) birincil analizi, N-CORT grubundatahmin edilen büyüme hızının, plasebo grubuna kıyasla 0,45 cm/yıl daha düşük olduğunugöstermiştir (%95 GA plasebodan 0,11-0,78 cm/ yıl daha düşüktür). Tedavi grupları arasındakifark, ilaca başladıktan 2 ay sonra başlamıştır. Tedavi kesildikten sonraki 2 aylık izlemperiyodunda, tedavi grubunda ortalama büyüme hızının başlangıç (tedavi öncesi) değerlerinedöndüğü gözlenmiştir. 5.2. Farmakokinetik özelliklerGenel özelliklerTriamsinolon asetonid, nazal kortikosteroiddir. N-CORT, her dozunda 55 mikrogram triamsinolon asetonid içeren beher şişede 120 dozluk homojen görünümlü opaksüspansiyondur. Emilim:Normal yetişkinlerde ve alerjik rinit bulunan yetişkin hastalarda, triamsinolon asetonidin 220 mikrogramlık tek dozunun intranazal uygulanması sonucunda, triamsinolon asetonidabsorpsiyonunun düşük olduğu görülmüştür. Dağılım:Ortalama doruk plazma konsantrasyonu yaklaşık olarak 0,5 ng/mL (aralığı, 0,1 ila 1 ng/mL)'dir ve dozdan 1,5 saat sonra gerçekleşmiştir. Ortalama plazma ilaç konsantrasyonu12'inci saatte 0,06 ng/mL'den az, 24'üncü saatte deney tespit limitinin altında olmuştur.Ortalama terminal yarılanma ömrü 3,1 saattir. İntranazal olarak 110 mikrogram veya 220 mikrogramlık tek doz triamsinolon asetonid verilen sağlıklı gönüllülerde ve hastalarda doz oransallığı görülmüştür. Pediyatrik hastalaraverilen birkaç dozdan sonra (440 mikrogram/gün), plazma ilaç konsantrasyonlarının, EAA,Cmaks ve Tmaks'ın yetişkin hastalarda görülen değerlere benzer olduğu görülmüştür. Biyotransformasyon:İnsan plazmasında triamsinolon asetonidin üç metaboliti belirlenmiştir. 6B-hidroksitriamsinolon asetonid, 21-karboksitriamsinolon asetonid ve 21-karboksi-6B-hidroksitriamsinolon asetonid. Ana bileşikle karşılaştırıldığında, her üç metabolitin de belirgin farmakolojik aktivitesi yoktur. Eliminasyon:Triamsinolon asetonid idrar ve feçesten konjuge olmamış metabolitler halinde atılır. Oral olarak alınan radyolojik işaretli bileşiğin yaklaşık %94'ünün idrar ve feçes ile atıldığı tespitedilmiştir. Bunun da yaklaşık %40'ı idrar ve yaklaşık %54'ü feçeste saptanmıştır. Özel popülasyonlarPediyatrik hastalarAlerjik riniti olan pediyatrik hastalarda (6-12 yaş grubu çocuklar) en yüksek doz düzeyi olan günde 440 mikrogram triamsinolon asetonid nazal sprey tedavisinden 6 hafta sonrafarmakokinetik parametreler plazma ilaç düzeyinde hızlı bir düşüş göstermiştir; birikim çok 6 / 10 az olmuş ya da birikim saptanmamıştır. 5.3. Klinik öncesi güvenlilik verileriKlinik öncesi çalışmalarında sadece glukortikoidler için tipik olan etkiler gözlenmiştir. Karsinojenite:Rodentlerde yürütülen çalışmalar, tedaviyle ilişkili triamsinolon asetonidin kanserojen olduğu gösterilememiştir. Mutajenite:İn vitro testlerde (Salmonella bakterilerinde ters mutasyon testi ve Çin hamster over hücrelerinde ileri mutasyon testi) hiçbir mutajenisite bulgusuna rastlanmamıştır. Teratojenite:Diğer kortikosteroidlerde olduğu gibi, triamsinolon asetonidin hayvanlarda teratojenik olduğu ve (sıçan ve tavşanlarda) yarık dudak ve/veya internal hidrosefali ve aksiyel iskeletdefektlerine neden olduğu gösterilmiştir. İnsan türünden olmayan primatlarda, MSS vekraniyal malformasyonlar dâhil olmak üzere, diğer teratojenik etkiler gözlemlenmiştir. Fertilite bozuklukları:Triamsinolon asetonid, rodentlerde fetal rezorpsiyon, ölü doğma olgularında artış, yavru ağırlığı ve sağ kalım oranında azalmaya neden olmuştur, ancak gebelik oranlarında birdeğişikliğe neden olmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiDisodyum edetat Dekstroz monohidrat Mikrokristalin selüloz ve karboksimetilselüloz sodyum Polisorbat 80 Benzalkonyum klorür %50 Seyreltik hidroklorik asitSeyreltik sodyum hidroksitSaf su 6.2. GeçimsizliklerGeçimlilik araştırmaları bulunmadığından, bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır. 6.3. Raf Ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında, kuru bir yerde ve orijinal ambalajında saklayınız. Açıldıktan 2 ay sonra atılmalıdır. Çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız. 7 / 10 6.5. Ambalajın niteliği ve içeriğiHer püskürtme; 55 mikrogram triamsinolon asetonid içeren ölçülü doz kapağı ve nazal adaptörden oluşan 120 sıkımlık 16,5 g'lık süspansiyon6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerN-CORT'un uygulanması:N-CORT sadece burun içine püskürtülerek kullanılır.N-CORT'u kullanmadan önce, burun deliklerinizi temizleyiniz.1. Şişeyi hazırlama Kapağı yukarı doğru iterek çıkarınız. Kullanmadan önce şişeyi yavaşça çalkalayınız.2. Nazal Spreyi ilk defa kullanmadan önce Şişeyi dik tutunuz. Bu sırada spreyi kendinizden uzağa yönlendiriniz. Baş kısmını aşağıya doğru bastırarak pompayı doldurunuz. 5 defa basıp bırakınız. İnce bir sprey elde edene kadar püskürtme yapınız. Sprey artık kullanıma hazırdır.3. Spreyin kullanımı Burun deliklerinizden birini parmağınızlabastırarak kapatınız. Şişeyi dik tutunuz ve baş kısmını sizi rahatsızetmeyecek seviyeye kadar burun deliğiniziniçine sokunuz. Ağzınız kapalı iken ve burnunuzdan hafifçenefes alırken şişenin baş kısmına basarakbir püskürtme yapınız.4. Sonrasında ağzınızdan nefes veriniz.5. Yukarıdaki 3. ve 4. maddede yazılı olan işlemleri diğer burun deliğinize uygulayınız.6. Spreyi kullandıktan sonra Her kullanımdan sonra yumuşak bir bez veya mendille başlığı dikkatlice siliniz ve Püskürtme başlığının üstüne kapağını takınız.8 / 10 Eğer nazal spreyi 2 haftadan daha uzun süredir kullanmadıysanız: Püskürtme başlığını sprey ile doldurmak içinkullanıma hazırlamak gerekir. Bu uygulama sırasında başlığın püskürtme noktasını kendinizden uzak tutunuz. Sprey Kullanmaya başlamadan önce bir defa havaya püskürtmepüskürtme yapınız. 4 Her kullanımdan önce şişeyi yavaşça çalkalayınız. Spreyin temizlenmesiEğer sprey çalışmazsa, başlık tıkanmış olabilir. Tıkanıklığı aslaaçmaya çalışmayınız. İğne veya sert bir nesne ile ufak sprey deliğini genişletmeye çalışmayınız, çünkü spreymekanizması bozulabilir.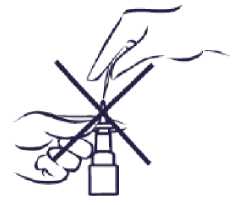 Nazal sprey haftada en az bir kez temizlenmelidir. Eğer tıkanırsa daha sık temizlenebilir. Spreyin temizlenmesi için talimatlar: 1. Kapağını çıkarınız. 2. Sadece sprey başlığını nazikçe çekiniz. 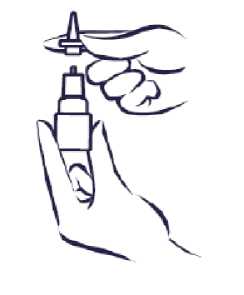 9 / 10 3. Kapağı ve sprey başlığını birkaç dakika sıcak suda ıslatınız. 4. Daha sonra soğuk akan musluk suyunda durulayınız. 5. Sallayarak veya hafifçe vurarak, fazla suyu uzaklaştırınız . 6. Kurumaya bırakınız. 7. Sprey başlığını tekrar takınız. 8. İnce sprey gelinceye kadar üniteyi püskürtünüz. 9. Normal biçimde kullanınız. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imhaedilmelidir. 7. RUHSAT SAHİBİBerko İlaç ve Kimya Sanayi A.Ş. Yenişehir Mah. Özgür Sok. No: 16-18 Ataşehir/İstanbul 0 216 456 65 70 (Pbx) 0 216 456 65 79 (Faks) [email protected]8. RUHSAT NUMARASI250/86 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 06.05.2013 Ruhsat yenileme tarihi: 09.10.2019 10. KÜB'ÜN YENİLENME TARİHİ10 / 10 |
İlaç BilgileriN-cort %0,055 Nazal Sprey, SüspansiyonEtken Maddesi: Triamsinolon Asetonid Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.
