Evaxmus 10 Mg Tablet Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIEVAXMUS 10 mg tablet 2. KALITATIF VE KANTITATIF BILEŞIMEtkin madde:
10 mg 19,6 mg 277,7 mg Everolimus Yardımcı maddeler:Laktoz monohidrat Susuz laktoz Yardımcı maddeler için 6.1.'e bakınız. 3. FARMASÖTİK FORMTablet Beyaz, oblong, düz, kenarı eğimli tabletlerdir. Tabletlerin bir yüzünde EV, diğer yüzünde 10 baskılıdır. 4. KLİNİK ÖZELLIKLER4.1. Terapötik endikasyonlarEVAXMUS, Daha önce relaps/metastatik meme kanseri için sadece bir seri kemoterapi ve bir seri non-steroidal aromataz inhibitörü kullanmış ve sonrasında progresyon göstermiş, HER 2/neu negatif, postmenopozal, semptomatik visseral hastalığı olmayan, hormon reseptörü kuvvetlipozitif (>%40), hastalarda sadece eksemestanla birlikte progresyona kadar kullanımı endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji:EVAXMUS tedavisi yalnızca, kanser tedavisi konusunda deneyim sahibi doktorlar tarafından başlatılmalı ve devam ettirilmelidir. Erişkinlerde önerilen doz günde bir defa 10 mg'dır. Doz ayarlamaları: Advers reaksiyonlar:Şiddetli ve/veya tolere edilemeyen advers reaksiyonların görülmesi durumunda EVAXMUS dozunun azaltılması ve/veya EVAXMUS tedavisine geçici ara verilmesigerekebilir. Derece 1 advers reaksiyonlar için genellikle doz ayarlaması gerekli değildir. Eğer dozazaltılması gerekliyse, günlük 5 mg doz önerilir ve günlük doz olarak 5 mg'ın altına düşülmemesigerekmektedir (bkz. Bölüm 4.4). En düşük doz gücünün altında doz gereksinimlerinde gün aşırıuygulama düşünülebilir.EVAXMUS tedavisi sırasında, yan etkilerin yönetimi amacıyla doz düşürülmesi, tedaviye ara verilmesi veya durdurulması ile ilgili öneriler Tablo 1'de belirtilmektedir. Genel öneriler deverilmiştir. Hekim dozlama planına karar verirken her hasta için bireysel yarar/risk 1 değerlendirmesini göz önünde bulundurmalıdır. Tablo 1. Yan etkilerin yönetimi konusunda doz değişikliği önerileri
2 / 21
Uygulama sıklığı ve süresi:Tedavi klinik yarar gözlendiği sürece ya da kabul edilemez bir toksisite meydana gelene kadar devam ettirilmelidir. Uygulama şekli:EVAXMUS tablet bir bardak su ile yutulmalıdır. Tabletler ısırılmamalı ya da parçalanmamalıdır. Tabletleri yutamayan hastalar için EVAXMUS tablet(ler) içmeden hemen önce bir bardak suda (yaklaşık 30 mL içeren) yavaşça karıştırarak çözülmelidir. Bardak aynı hacimdeki suylaçalkalanmalı ve bu su tüm dozun tamamen yutulmasını sağlamak üzere içilmelidir. EVAXMUS, ya sürekli olarak açlık durumunda ya da sürekli olarak yemeklerle birlikte oral yoldan günde bir kere ve her gün aynı saatte uygulanmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Doz ayarlaması gerekli değildir (bkz. Bölüm 5). 3 / 21 Karaciğer yetmezliği:- Hafif şiddette karaciğer yetmezliği olan hastalar için (Child-Pugh A); önerilen doz günde7,5 mg'dır. - Orta şiddette karaciğer yetmezliği olan hastalar için (Child-Pugh B); önerilen doz günde 5mg'dır. - Şiddetli karaciğer yetmezliği (Child-Pugh C) olan hastalarda önerilmemektedir. Beklenenfaydanın risklere ağır bastığı durumlarda günlük 2,5 mg doz aşılmamalıdır. Tedavi sırasında hastanın hepatik durumu (Child-Pugh sınıfı) değişirse doz ayarlaması yapılmalıdır (bkz. Bölüm 4.4 ve Bölüm 5.2). CYP3A4/P-glikoprotein (PgP) İnhibitörleriGüçlü CYP3A4/PgP inhibitörlerinin (örneğin ketakonazol, itrakonazol, klaritromisin, atazanavir, nefazodon, sakinavir, telitromisin, ritonavir, indinavir, nelfinavir, vorikonazol) kullanımındankaçınılmalıdır (bkz. Bölüm 4.4). Orta güçte CYP3A4/PgP inhibitörleri (örneğin, amprenavir, fosamprenavir, aprepiant, eritromisin, flukonazol, verapamil, diltiazem) ile eşzamanlı uygulandığında dikkatle kullanılmalıdır. Hastalarorta güçte bir CYP3A4/PgP inhibitörü ile eşzamanlı uygulamaya ihtiyaç duyarsa, EVAXMUSdozu günlük 2,5 mg'a azaltılmalıdır. Azaltılmış EVAXMUS dozunun AEE inhibitör yokluğundagözlenen aralığa düzeleceği öngörülmektedir. EVAXMUS dozunda hasta toleransı temelinde 2,5mg'dan 5 mg'a artırma düşünülebilir. Orta güçte inhibitör bırakılırsa, EVAXMUS dozuartırılmadan önce yaklaşık 2 ila 3 günlük bir arınma periyoduna izin verilmelidir. Orta güçteinhibitör bırakılırsa, EVAXMUS dozu orta güçte CYP3A4/PgP inhibitörü başlatılmadan öncekullanılan doza döndürülmelidir. Greyfurt, greyfurt suyu ve sitokrom P450 ve PgP aktivitesini inhibe ettiği bilinen diğer gıdalar everolimus maruziyetini artırabilir ve tedavi sırasında bunlardan kaçınılmalıdır. Güçlü CYP3A4/PgP İndükleyicileriEşzamanlı güçlü CYP3A4/PgP indükleyicilerinin (örneğin, fenitoin, karbamazepin, rifampin, rifabutin, rifapentin, fenobarbital) kullanımından kaçınılmalıdır. Hastalar güçlü bir CYP3A4/PgPindükleyicisi ile eşzamanlı uygulamaya ihtiyaç duyarsa, günlük EVAXMUS dozu 5 mg'lık veyadaha düşük artırmalarla iki katına çıkarılmalıdır. EVAXMUS dozunun, farmakokinetik verilertemelinde AEE'yi indükleyici yokluğunda gözlenen aralığa düzelteceği öngörülmektedir. Bununlabirlikte güçlü CYP3A4/PgP indükleyicilerini kullanan hastalarda bu doz düzenlemesine ilişkin birklinik veri bulunmamaktadır. Güçlü indükleyici bırakılırsa, EVAXMUS dozu güçlü CYP3A4/PgPindükleyicisinin başlatılmasından önce kullanılan doza döndürülmeden önce 3 ila 5 günlük birarınma periyodu dikkate alınmalıdır (bkz. Bölüm 4.4). Sarı kantaron (Hypericum perforatum)everolimus maruziyetini öngörülemeyecek bir şekilde azaltabileceğinden kaçınılmalıdır.Pediyatrik popülasyon:EVAXMUS pediyatrik hastalarda ve adolesanlarda (0-18 yaş) güvenlilik ve etkililik çalışmalarının yetersiz olması nedeniyle önerilmemektedir. Geriyatrik popülasyon:Doz ayarlaması gerekli değildir (bkz. Bölüm 5). 4.3. KontrendikasyonlarEVAXMUS, etkin madde (everolimus), diğer rapamisin türevleri ya da yardımcı maddelerden herhangi birine karşı bilinen aşırı duyarlılığı olan hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriEnfeksiyöz olmayan pnömoniEnfeksiyöz olmayan pnömoni, EVAXMUS da dahil olmak üzere rapamisin türevlerinin bilinen bir sınıf etkisidir. Enfeksiyöz olmayan pnömoni (interstisyel akciğer hastalığı da dahil),everolimus kullanan hastaların %19'unda tanımlanmıştır (bkz. Bölüm 4.8). Bazı vakalar şiddetliolup, nadir durumlarda ölümcül bir sonuç gözlenmiştir. Hipoksi, plevral efüzyon, öksürük ya dadispne gibi spesifik olmayan akciğer belirti ya da semptomları olan ya da uygun tetkiklerleenfeksiyöz, neoplastik ya da diğer tıbbi olmayan nedenlerin olasılık dışı bırakıldığı hastalardaenfeksiyöz olmayan pnömoni tanısı düşünülmelidir. Enfeksiyöz olmayan pnömoninin ayırt edicitanısında pneumocystis jirovecii (carinii)pnömonisi gibi fırsatçı enfeksiyonlar ekarte edilmelidir(bkz. Bölüm 4.4 - Enfeksiyonlar). Hastalara yeni ya da kötüleşen akciğer semptomlarını acilenbildirmeleri söylenmelidir.Enfeksiyöz olmayan pnömoniye işaret eden radyolojik değişikliklerin geliştiği ve birkaç semptomun gözlendiği ya da herhangi bir semptomun gözlenmediği hastalar doz ayarlamasıyapmadan EVAXMUS tedavisine devam edebilirler. Eğer semptomlar orta şiddetteyse (derece 2)ya da şiddetliyse (derece 3) klinik semptomlarda iyileşme sağlanana kadar kortikosteroid tedavisiuygulanabilir. Enfeksiyöz olmayan pnömoninin tedavisi için kortikosteroidlere gereksinim duyan hastalarda pneumocystis jirovecii (carinii)pnömonisi için profilaksi düşünülebilir.EnfeksiyonlarEVAXMUS'un immünosüpresif özellikleri olduğundan, hastaları bakteriyel, fungal, viral veya protozoal enfeksiyona (fırsatçı patojenlerin neden olduğu enfeksiyonlar da dahil) daha yatkın halegetirebilir (bkz. Bölüm 4.8). EVAXMUS tedavisi uygulanan hastalarda, pnömoni, diğer bakteriyelenfeksiyonlar ve invazif fungal enfeksiyonlar (aspergiloz ya da kandidiyaz) veya pneumocystisjirovecii (carinii)pnömonisi ve Hepatit B virüsünün reaktivasyonu da dahil olan viralenfeksiyonlar gibi lokalize ve sistemik enfeksiyonlar gözlenmiştir. Bu enfeksiyonların bazılarışiddetlidir (örn. sepsis, solunum veya karaciğer yetmezliğine neden olmaktadır) ve nadiren ölümeyol açabilmektedir.Hekimler ve hastalar, artan enfeksiyon riski karşısında dikkatli olmalı, EVAXMUS kullanılırken enfeksiyon semptom ve belirtilerine dikkat etmelidir. Bir enfeksiyon tanısı konulursa derhal uyguntedavi hızlı bir şekilde başlatmalı ve EVAXMUS ile tedaviye ara verilmesi veya tedavininbırakılması düşünülmelidir (bkz. Bölüm 4.2 - Tablo 1). Önceden var olan enfeksiyonlar, EVAXMUS ile tedaviye başlamadan önce uygun şekilde tedavi edilmeli ve tam olarak iyileşmelidir. İnvaziv sistemik mantar enfeksiyonu teşhis edildiği takdirdeEVAXMUS tedavisi derhal ve kalıcı olarak kesilmeli ve hasta uygun antifungal tedavi ile tedaviedilmelidir. Everolimus kullanmış olan hastalarda bazıları ölümle sonuçlanan pneumocystis jirovecii (carinii)pnömonisi olguları bildirilmiştir. Bu olgular, kortikosteroidlerin veya bağışıklık sisteminibaskılayıcı diğer ajanların eşzamanlı kullanımı ile ilişkili olabilir.5 / 21 Kortikosteroidlerin veya bağışıklık sistemini baskılayıcı diğer ajanların eşzamanlı kullanımı gerekli olduğunda söz konusu durum için profilaksi göz önünde bulundurulmalıdır. Aşırı duyarlılık reaksiyonlarıEverolimus kullanımında, anafilaksi, dispne, yüzde ve boyunda ani kızarıklık, göğüs ağrısı veya anjiyoödem (örn. solunum fonksiyon bozukluğu ile veya solunum fonksiyon bozukluğuolmaksızın hava yollarının veya dilin şişmesi) içeren ancak bunlarla sınırlı olmayan semptomlarlakendini gösteren aşırı duyarlılık reaksiyonları gözlenmiştir (bkz. Bölüm 4.3). Anjiyotensin dönüştürücü enzim (ADE) inhibitörlerinin eşzamanlı kullanımıEşzamanlı olarak ADE inhibitörü (örn. ramipril) tedavisi alan hastalar anjiyoödem (örn., solunumbozukluğunun eşlik ettiği veya etmediği, solunum yollarında veya dilde şişme) açısından dahayüksek risk altında olabilirler (bkz. Bölüm 4.5).StomatitEVAXMUS ile tedavi edilen hastalarda ağız ülserleri ve oral mukozit de dahil olmak üzere stomatit, en sık bildirilen advers reaksiyondur (bkz. Bölüm 4.8). Stomatit çoğunlukla tedavinin ilk8 haftasında oluşur. Everolimus artı eksemestan ile tedavi edilen postmenopozal meme kanserihastalarında yapılan tek kollu bir çalışma, ilk 8 hafta tedavisi sırasında gargara halinde verilenalkolsüz kortikosteroid oral çözeltisinin stomatit insidansını ve ciddiyetini azaltabileceğinigöstermektedir. (bkz. Bölüm 5.1). Bu nedenle, stomatit tedavisi, gargara olarak alkolsüzkortikosteroid oral çözeltisi gibi profilaktik ve/veya topikal tedavilerin terapötik kullanımınıiçerebilir. Bununla birlikte, durumu şiddetlendirdiği için alkol, hidrojen peroksit, iyot ve kekiktürevleri içeren ürünlerden kaçınılmalıdır. Özellikle steroid bazlı ilaçlarla tedavi edilen hastalardamantar enfeksiyonunun izlenmesi ve tedavisi önerilmektedir. Fungal enfeksiyon tanısıkonulmadıkça antifungal ajanlardan kaçınılmalıdır (bkz. Bölüm 4.5). Böbrek yetmezliği olaylarıEVAXMUS ile tedavi edilen hastalarda, bazıları ölümcül bir sonuca sahip böbrek yetmezliği (akut böbrek yetmezliği dahil) vakaları gözlenmiştir (bkz. Bölüm 4.8; ayrıca bkz. Laboratuvar testlerive takip). Bu nedenle özellikle böbrek fonksiyonunu olumsuz etkileyecek ek risk faktörleri olanhastalarda böbrek fonksiyonlarının takibi önerilmektedir (bkz. Bölüm 4.8; ayrıca bkz. Laboratuvartestleri ve takip). Laboratuvar testleriBöbrek fonksiyonuEverolimus kullanan hastalarda serum kreatinin düzeyinde genellikle hafif şiddette yükselme ve proteinüri bildirilmiştir (bkz. Bölüm 4.8). EVAXMUS tedavisi başlatılmadan önce ya dabaşlatıldıktan sonra düzenli olarak, kan üre azotu (BUN), idrarda protein ya da serum kreatinindüzeyi ölçümleri de dahil olmak üzere böbrek fonksiyonunun takibi önerilmektedir. Kan glukozuEverolimus kullanan hastalarda hiperglisemi bildirilmiştir (bkz. Bölüm 4.8). EVAXMUS tedavisi başlatılmadan önce ya da başlatıldıktan sonra düzenli olarak açlık serum glukoz düzeyinin takipedilmesi önerilmektedir. EVAXMUS, hiperglisemiye sebep olabilecek başka ilaçlarla beraberkullanıldığında özellikle takip edilmelidir. EVAXMUS tedavisi başlatılmadan önce optimalglisemik kontrol sağlanmalıdır. 6 / 21 Kan lipidleriEverolimus alan hastalarda dislipidemi (hiperkolesterolemi ve hipertrigliseridemiyi içeren) bildirilmiştir. EVAXMUS ile tedaviye başlamadan önce ve daha sonra periyodik olarak kankolesterolü ve trigliseridlerinin takibi ve uygun ilaçlarla tedavi önerilir. Hematolojik parametrelerEverolimus kullanan hastalarda hemoglobin, lenfosit, nötrofil ve trombosit düzeylerinde azalma bildirilmiştir (bkz. Bölüm 4.8). EVAXMUS tedavisi başlatılmadan önce ya da başlatıldıktan sonradüzenli olarak tam kan sayımı takibi önerilmektedir. Fonksiyonel karsinoid tümörlerRandomize, çift kör, çok merkezli bir klinik çalışmada, fonksiyonel karsinoid tümörlü hastalarda everolimus ile depo oktreotid ve plasebo ile depo oktreotid karşılaştırması yapılmıştır. Çalışmada,primer etkililik sonlanım noktası (progresyonsuz sağkalım [PFS]) karşılanmamış ve genelsağkalım ara analizi sayısal olarak plasebo ve depo oktreotid kolu lehine sonuçlanmıştır. Bunedenle, fonksiyonel karsinoid tümörü olan hastalarda EVAXMUS güvenlilik ve etkililiğikanıtlanmamıştır. Gastrointestinal veya akciğer kökenli nöroendokrin tümörlerin prognostik faktörleriFonksiyonel olmayan gastrointestinal veya akciğer nöroendokrin tümörleri olan ve iyi prognostikbaşlangıç faktörleri (örneğin primer tümör yeri ileum ve kromogranin A değerleri normal olanveya kemik tutulumu olmayan) olan hastalarda bireysel yarar/risk değerlendirilmesi EVAXMUStedavisine başlamadan önce yapılmalıdır. Primer tümörü ileumda olan alt grup hastalarda PFSyararına dair kısıtlı bulgu rapor edilmiştir (bkz. Bölüm 5.1).İlaç-ilaç etkileşimleriCYP3A4 inhibitörleri ve indükleyicileri ve/veya çoklu ilaç akış pompası P-glikoproteini (PgP) ile eş zamanlı uygulamadan kaçınılmalıdır (bkz. Bölüm 4.5). Orta derecede güçlü CYP3A4 ve/veya PgP inhibitörü ile eşzamanlı uygulamada dikkatli olunmalıdır. Eğer orta derecede güçlü CYP3A4 ve/veya PgP inhibitörü veya indükleyicisi ileeşzamanlı uygulama yapılması gerekiyorsa, öngörülen EAA değerine dayalı olarak EVAXMUSdozunda ayarlama gerekebilir (bkz. Bölüm 4.5). Güçlü CYP3A4 inhibitörleri ile eşzamanlı tedavi, everolimusun plazma konsantrasyonlarında önemli artışa neden olur (bkz. Bölüm 4.5). Bu durumda doz önerilerinde bulunabilmek için henüzyeterli veri mevcut değildir. Bu nedenle EVAXMUS ve kuvvetliCYP3A4 inhibitörlerinineşzamanlı kullanımı önerilmemektedir.EVAXMUS, ilaç etkileşimleri potansiyeli nedeniyle, dar terapötik indekse sahip oral yoldan uygulanan CYP3A4 substratları ile kombinasyon halinde alınırken dikkatli olunmalıdır. EğerEVAXMUS, dar terapötik indekse sahip oral uygulanan CYP3A4 substratları (örneğin, pimozid,terfenadin, astemizol, sisaprid, kinidin veya ergot alkaloid türevleri) ile birlikte alınıyorsa hasta,oral yoldan uygulanan CYP3A4 substratının ürün bilgisinde tarif edilen istenmeyen etkileraçısından takip edilmelidir (bkz. Bölüm 4.5). Karaciğer yetmezliğiEverolimusa maruziyet, hafif şiddette (Child-Pugh A), orta şiddette (Child-Pugh B) ve şiddetli (Child-Pugh C) karaciğer bozukluğu olan hastalarda artış göstermiştir (bkz. Bölüm 5.2). 7 / 21 Potansiyel yarar riskten ağır basmadıkça, şiddetli karaciğer bozukluğu (Child-Pugh C) olan hastalarda everolimusun kullanılması önerilmemektedir (bkz. Bölüm 4.2 ve Bölüm 5.2). Karaciğer yetmezliği olan hastalarda yan etkilerin yönetimi için doz ayarlamasını destekleyecek klinik güvenliliği ya da etkililiğine ait veriler henüz bulunmamaktadır. AşılarEVAXMUS tedavisi esnasında canlı aşıların kullanımından ve canlı aşı uygulanmış kişilerle yakın temastan kaçınılmalıdır (bkz. Bölüm 4.5). Yara iyileşmesi komplikasyonlarıBozulmuş yara iyileşmesi, EVAXMUS dahil rapamisin türevlerinin bir sınıf etkisidir. Bu nedenle cerrahi öncesi ve sonrası dönemde EVAXMUS kullanımında dikkatli olunmalıdır. Laktoz: Tabletler laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriEverolimus CYP3A4'ün bir substratı ve çoklu ilaç atım pompası P-glikoproteinin (PgP) orta düzeyde bir substratı ve inhibitörüdür. Everolimusun emilim ve takip eden eliminasyonu, CYP3A4ve/veya PgP'yi etkileyen ürünlerden etkilenebilir. İn vitrokoşullarda everolimus, CYP3A4'ünkompetitif inhibitörü ve CYP2D6'nın karma inhibitörüdür.Seçilmiş CYP3A4 ve PgP inhibitörleri ve indükleyicileriyle ile bilinen ve teorik etkileşimler aşağıda Tablo 2'de listelenmiştir. Everolimus konsantrasyonlarını yükselten CYP3A4 ve PgP inhibitörleri:CYP3A4 ya da PgP inhibitörleri olan maddeler, everolimusun metabolizmasını ya da intestinal hücrelerden dışa atılımını azaltarak kandaki everolimus konsantrasyonlarını yükseltebilirler. Everolimus konsantrasyonlarını düşüren CYP3A4 ve PgP indükleyicileri:CYP3A4 ya da PgP indükleyicileri olan maddeler, everolimusun metabolizmasını ya da intestinal hücrelerden dışa atılımını artırarak kandaki everolimus konsantrasyonlarını düşürebilirler. Tablo 2. Diğer etkin maddelerin everolimus üzerindeki etkileri
8 / 21
9 / 21
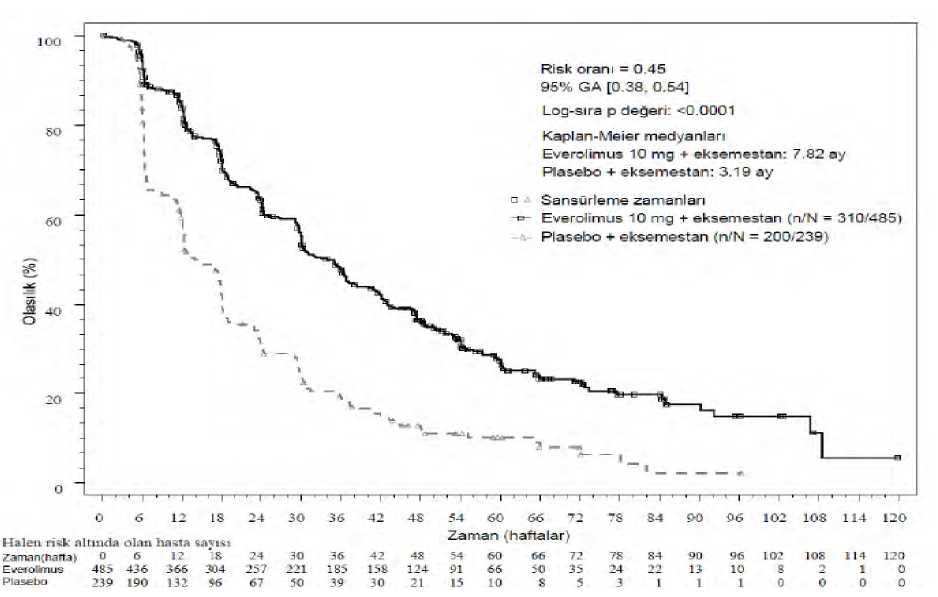
Plazma konsantrasyonları everolimus tarafından değiştirilebilecek ajanlar: İn vitrosonuçlara dayalı olarak, 10 mg'lık günlük oral dozların alınmasından sonra elde edilen sistemik konsantrasyon PgP, CYP3A4 ve CYP2D6 inhibisyonunu olasılık dışı bırakmaktadır.Diğer yandan bağırsakta CYP3A4 ve PgP inhibisyonu ekarte edilememektedir.Sağlıklı gönüllülerdeki bir etkileşim çalışması, duyarlı bir CYP3A substrat probu olan midazolamın oral dozunun everolimus ile eşzamanlı uygulanmasının, midazolamın Cmaksdeğerinde %25'lik bir artışa ve midazolamın EAA(0-inf) değerinde %30'luk bir yükselmeye yolaçtığını göstermiştir. Bu etki olasılıkla intestinal CYP3A4'ün everolimus tarafından inhibeedilmesinden kaynaklanmaktadır. Bu nedenle everolimus, oral yolla eşzamanlı uygulananCYP3A4 substratlarının biyoyararlanımını etkileyebilir. Bununla birlikte sistemik uygulananCYP3A4 substratlarının maruziyeti üzerinde klinik açıdan anlamlı bir etki beklenmez (bkz. Bölüm4.4). 10 / 21 Everolimus ve depo oktreotidin eşzamanlı olarak uygulanması, oktreotid Cmin değerini 1,47'lik geometrik ortalama oranıyla (everolimus/plasebo) artırmış olup, bu durumun ilerlemişnöroendokrin tümörleri olan hastalarda everolimusa etkililik yanıtı üzerinde klinik olarak anlamlıetkileri saptanamamıştır. Everolimus ile eksemestanın bir arada uygulanması, eksemestanın Cmin ve C2s değerlerini sırasıyla %45 ve %64 yükseltmiştir. Diğer yandan, estradiolun aynı değerleri kararlı durumda (4 hafta) ikitedavi kolu arasında farklılık göstermemiştir. Kombinasyonu almakta olan, hormon reseptörüpozitif ilerlemiş meme kanserli hastalarda eksemestan ile bağlantılı olarak advers olaylarda birartış gözlenmemiştir. Eksemestan düzeylerindeki artışın etkililik ya da güvenlilik üzerinde biretkisi olması olası değildir. Anjiyotensin dönüştürücü enzim (ADE) inhibitörlerinin eşzamanlı kullanımı:Eşzamanlı olarak ADE inhibitörü (örn. ramipril) tedavisi alan hastalar anjiyoödem açısından daha yüksek risk altında olabilirler (bkz. Bölüm 4.4). Aşılar: Aşılara verilen immün yanıt etkilenebilir ve bu nedenle EVAXMUS ile yapılan tedavi sırasında aşılamanın etkisi azalabilir. EVAXMUS ile yapılan tedavi sırasında canlı aşılarınkullanılmasından kaçınılmalıdır. Canlı aşılara örnekler: burun içi grip, kızamık, kabakulak,kızamıkçık, oral polio, BCG, sarı humma, su çiçeği ve TY21a tifo aşıları. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin veri bulunmamaktadır. Pediyatrik popülasyon:Pediyatrik popülasyonlara ilişkin veri bulunmamaktadır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi D'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeline sahip kadınlar, everolimus kullanırken ve tedavinin sona ermesini takiben 8 haftaya kadar, yüksek etkililiğe sahip bir doğum kontrol yöntemi kullanmalıdır (örn.,oral, enjekte veya implante östrojen içermeyen hormonal doğum kontrol yöntemi, progesteronbazlı doğum kontrol hapları, histerektomi, tübal ligasyon, tam kaçınma, bariyer yöntemleri, rahimiçi araç [RIA] ve/veya kadının/erkeğin kısırlaştırılması). EVAXMUS kullanan erkek hastalar babaolma girişiminde bulunmaktan alıkonmamalıdır. Gebelik dönemiEverolimusun hamile kadınlarda kullanımına ilişkin yeterli veri bulunmamaktadır. Hayvanlar üzerinde yapılan çalışmalar embriyotoksisite ve fetotoksisiteyi içeren üreme toksisite etkilerinigöstermektedir (bkz. Bölüm 5.3). İnsanlar için potansiyel risk bilinmemektedir. Everolimus kullanımı gebelik döneminde ve kontrasepsiyon kullanmayan gebe kalma potansiyeline sahip kadınlarda önerilmemektedir. EVAXMUS gerekli olmadıkça gebelik döneminde kullanılmamalıdır. 11 / 21 Laktasyon dönemiEverolimusun insan sütüyle atılıp atılmadığı bilinmemektedir. Hayvanlar üzerinde yapılan çalışmalar, everolimusun ve/veya metabolitlerinin sütle atıldığını göstermektedir. EVAXMUSkullanan kadınlar, bu nedenle bebeklerini tedavi süresince ve son dozdan sonraki 2 hafta süresinceemzirmemelidir (bkz. Bölüm 5.3). Üreme yeteneği/FertiliteEverolimusun kadın ve erkek hastalarda infertiliteye sebebiyet verme potansiyeli bilinmemektedir ancak kadın hastalarda adet düzensizlikleri, sekonder amenore ve ilişkili lüteinleyici hormon(LH)/folikül stimüle edici hormon (FSH) oran dengesizliği gözlenmiştir. Klinik olmayan bulgulara göre, EVAXMUS ile yapılan tedavi erkek ve dişi fertilitesini olumsuz yönde etkileyebilmektedir (bkz. Bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkilerEVAXMUS'un araç ve makine kullanımı üzerinde hafif ya da orta dereceli bir etkisi olabilir. Hastalara EVAXMUS ile tedavi sırasında yorgunluk ve baş dönmesi hissetmeleri halinde araç vemakine kullanırken dikkatli olmaları tavsiye edilmelidir. 4.8. İstenmeyen etkilerGüvenlilik profilinin özetiGüvenlilik profili, onaylı endikasyonlara yönelik beşi randomize, çift kör, plasebo kontrollü faz III çalışma ve beşi açık etiketli faz I ve faz II çalışmalar olan on klinik çalışmada everolimus iletedavi edilen 2.672 hastanın birleştirilmiş verilerine dayanmaktadır. En yaygın advers ilaç reaksiyonları (ADR) (insidansı >1/10 olan ve araştırıcı tarafından tedaviyle ilişkili olduğundan şüphe duyulan) şunlar olmuştur (azalan sırada): stomatit, döküntü, yorgunluk,diyare, enfeksiyonlar, bulantı, iştah azalması, anemi, disguzi, pnömonit, periferik ödem,hiperglisemi, asteni, kaşıntı, ağırlıkta azalma, hiperkolesterolemi, epistaksis, öksürük ve baş ağrısı. En yaygın derece 3/4 ADR'ler (insidansı >1/100 ila <1/10 olan ve araştırıcı tarafından tedaviyle ilişkili olduğundan şüphe duyulan), stomatit, anemi, hiperglisemi, enfeksiyonlar, yorgunluk,diyare, pnömonit, asteni, trombositopeni, nötropeni, dispne, proteinüri, lenfopeni, hemoraji,hipofosfatemi, döküntü, hipertansiyon, pnömoni, alanin aminotransferaz (ALT) artışı, aspartataminotransferaz (AST) artışı ve diyabet olmuştur. Klinik çalışmalardan elde edilen advers ilaç reaksiyonları:Aşağıda, güvenlik analizinde bildirilen ADR'lerin sıklık kategorilerine göre sınıflaması verilmektedir. Advers reaksiyonlar MedDRA sistem organ sınıfına ve sıklığına göre listelenmiştir:Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek(>1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Her sıklık grubu ADR'ler azalan sıklık sırasına göre sunulmuştur. Enfeksiyonlar ve enfestasyonlarÇok yaygın: Enfeksiyonlar4 12 / 21 Kan ve lenf sistemi hastalıklarıÇok yaygın: AnemiYaygın: Trombositopeni, nötropeni, lökopeni, lenfopeni Yaygın olmayan: PansitopeniSeyrek: Saf kırmızı hücre aplazisi Bağışıklık sistemi hastalıklarıYaygın olmayan: Aşırı duyarlılık Metabolizma ve beslenme hastalıklarıÇok yaygın: İştah azalması, hiperglisemi, hiperkolesterolemiYaygın: Hipertrigliseridemi, hipofosfatemi, diabetes mellitus, hiperlipidemi, hipokalemi, dehidrasyon, hipokalsemi Psikiyatrik hastalıklarYaygın: Uykusuzluk Sinir sistemi hastalıklarıÇok yaygın: Disguzi, baş ağrısı Yaygın olmayan: Aguzi GÖZhastalıklarıYaygın: Göz kapağı ödemi Yaygın olmayan: Konjonktivit Kardiyak hastalıklarYaygın olmayan: Konjestif kalp yetmezliği Vasküler hastalıklarYaygın: Hemorajib, hipertansiyonYaygın olmayan: Baş, boyun ve göğüs bölgesinde kızarıklık ve sıcak basması, derin ven trombozu Solunum, göğüs hastalıkları ve mediastinal hastalıklarÇok yaygın: Pnömonitc, epistaksis, öksürük Yaygın: Dispne Yaygın olmayan: Hemoptizi, pulmoner embolizm Seyrek: Akut solunum sıkıntısı sendromu Gastrointestinal hastalıklarÇok yaygın: Stomatitd, diyare, bulantıYaygın: Kusma, ağızda kuruma, karın ağrısı, mukozal inflamasyon, ağız ağrısı, dispepsi, disfaji Hepatobiliyer hastalıklarYaygın: Yükselmiş aspartat aminotransferaz, yükselmiş alanin aminotransferaz Deri ve deri-altı doku hastalıklarıÇok yaygın: Döküntü, kaşıntıYaygın: Kuru cilt, tırnak bozuklukları, hafif saç dökülmesi, akne, eritem, tırnak kırılması, el-ayak sendromu (palmar-plantar eritrodisestezi sendromu), deride dökülme, cilt lezyonları 13 / 21 Seyrek: Anjiyoödem Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Artralji Böbrek ve idrar yolu hastalıklarıYaygın: Proteinüri*, kanda kreatinin artışı, böbrek yetmezliği*Yaygın olmayan: Günlük idrarda artış, akut böbrek yetmezliği* Üreme sistemi ve meme hastalıklarıYaygın: Adet düzensizliğie Yaygın olmayan: Amenoree Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok yaygın: Yorgunluk, asteni, periferik ödem Yaygın: Pireksi Yaygın olmayan: Kalp dışı göğüs ağrısı, bozulmuş yara iyileşmesi AraştırmalarÇok yaygın: Ağırlık azalması * Seçilmiş istenmeyen etkiler ile ilgili açıklamalar kısmına da bakınız a 'Enfeksiyonlar ve enfestasyonlar ' sistem organ sınıfı içindeki tüm reaksiyonları içerir ve yaygın olarakpnömoni, idrar yolu enfeksiyonu; yaygın olmayan olarak da bronşit, herpes zoster, sepsis,apse ve izole fırsatçı enfeksiyonları (örn. aspergillozis, kandidiyazis, pneumocystis jirovecii(carinii) pnömonisi (PJP, PCP) ve hepatit B) ve seyrek olarak viral miyokardit içerir.bFarklı sitelerden tek tek listelenmemiş farklı kanama olaylarını içerir.cYaygın: pnömonit, interstisyel akciğer hastalığı, akciğer infiltrasyonu, seyrek: alveolit, pulmoner alveolar hemoraji ve pulmoner toksisiteyi içerir.dÇok yaygın: stomatit, yaygın: aftöz stomatit, ağız ve dil ülserasyonu, yaygın olmayan: glossit, glossodiniyi içerir.eSıklık, birleştirilmiş verilerde 10 ila 55 yaşındaki kadınların sayısına dayanmaktadır.Seçilmiş istenmeyen etkiler ile ilgili açıklamalarKlinik çalışmalarda ve pazarlama sonrası spontan raporlarda everolimus, ölümcül sonucu da içeren ciddi hepatit B reaktivasyonu vakaları ile ilişkilendirilmiştir. Enfeksiyonların reaktivasyonu,immünsupresan periyotları sırasında beklenen bir olaydır (bkz. Bölüm 4.4). Klinik çalışmalarda ve pazarlama sonrası spontan raporlarda, everolimus böbrek yetmezliği olayları (ölümcül olanlar dahil) ve proteinüri ile ilişkilendirilmiştir. Böbrek fonksiyonunun takipedilmesi önerilmektedir (bkz. Bölüm 4.4). Klinik çalışmalar ve pazarlama sonrası spontan raporlarda, everolimus kullanımı amenore vakaları (sekonder amenore dahil) ile ilişkilendirilmiştir. Klinik çalışmalarda ve pazarlama sonrası spontan bildirimlerde everolimus, bazıları ölümle sonuçlanan pneumocystis jirovecii (carinii)pnömonisi (PJP, PCP) olguları ile ilişkilendirilmiştir(bkz. Bölüm 4.4).14 / 21 Klinik çalışmalarda ve pazarlama sonrası spontan raporlarda, eşzamanlı ADE inhibitörü kullanımı ile birlikte ya da tek başına anjiyödem bildirilmiştir (bkz. Bölüm 4.4). Geriyatrik hastalarBirleştirilmiş güvenlilik veritabanında everolimus ile tedavi edilen hastaların %37'sinin >65 yaşında olduğu saptanmıştır. Everolimus tedavisinin bırakılmasına yol açan ADR'li onkoloji hasta sayısı >65 yaşındaki hastalarda daha yüksek bulunmuştur (%20'ye karşı %13). Tedavinin bırakılmasına neden olan enyayın ADR'ler pnömonit, yorgunluk, dispne ve stomatit olmuştur. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanaksağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr;[email protected];4.9. Doz aşımıİnsanlarda doz aşımıyla ilgili olarak bildirilen veriler son derece sınırlıdır. 70 mg'a kadar tekli dozların kabul edilebilir bir akut tolere edilebilirlik ortaya koyduğu gösterilmiştir. Tüm doz aşımı vakalarında, destekleyici genel önlemler alınmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antineoplastik ilaçlar, protein kinaz inhibitörleri ATC kodu: L01XE10 Etki mekanizması Everolimus, seçici bir mTOR (rapamisinin memeli hedefi) inhibitörüdür. mTOR, aktivitesi insanlarda görülen çok sayıda kanserde arttığı bilinen önemli bir serin treonin kinazdır.Everolimus, intraselüler bir protein olan FKBP-12'ye bağlanıp, mTOR kompleksi-1 (mTORC1)aktivitesini inhibe eden bir kompleks oluşturur. mTORCl sinyal yolağının inhibisyonu, hücrebüyümesinin düzenlenmesinde görev alan S6 ribozomal protein kinazın (S6K1) aktivitesiniazaltmak suretiyle ve hücre döngüsü, anjiyogenez ve glikoliz ile alakalı olan proteinleridüzenleyen ökaryotik uzatma faktörü 4E bağlayıcı proteinin (4EBP-1) aktivitesini azaltarakproteinlerin translasyonunu ve sentezini engeller. Everolimus, tümörün anjiyogenik süreçlerinipotansiyalize eden vasküler endotelyal büyüme faktörü (VEGF) düzeylerini azaltır. Everolimus,tümör hücreleri, endotelyal hücreler, fibroblastlar ve vasküler düz kas hücrelerinin büyümesi veproliferasyonunun potent bir inhibitörüdür ve solid tümörlerde in vitroin vivoglikolizi azalttığıgösterilmiştir.Klinik etkililik ve güvenlilikHormon reseptörü pozitif meme kanseriBOLERO-2 (CRAD001Y2301), önceki letrozol veya anastrozol ile tedavi sonrası nüks veya progresyonlu östrojen reseptörü pozitif, HER 2-neu/amplifiye olmayan ilerlemiş meme kanseriolan postmenopozal kadınlarda plasebo + eksemestan karşısında everolimus + eksemestana ilişkin 15 / 21 randomize, çift kör, çok merkezli faz III çalışmadır. Hastalar, açık etiketli eksemestana (25 mg/gün) ek olarak everolimus (10 mg/gün) veya plasebo için 2:1 oranında randomize edilmiştir.Önceki hormonal tedaviye hassasiyet (var/yok) ve iç organ metastazı varlığına (var/yok) görekatmanlama yapılmıştır. Önceki hormonal tedaviye hassasiyet (1) ilerlemiş koşullarda önceki enaz bir hormonal tedaviden sonra belgelenmiş klinik fayda (tam yanıt [CR], kısmi yanıt [PR], > 24hafta stabil hastalık) veya (2) nüks öncesi en az 24 ay adjuvan hormonal tedavidir. Birincil sonlanımı araştırmacı lokal radyoloji değerlendirmesine göre Solid Tümörlerde Yanıt Değerlendirme Kriterlerine (RECIST) göre progresyonsuz sağkalım (PFS) olarak belirlenmiş,Destekleyici PFS analizleri, bağımsız merkezi radyoloji değerlendirmesine dayanmıştır. İkincil sonlanımı genel sağkalım (OS), Genel Yanıt Oranı (ORR), Klinik Fayda Oranı (CBR), Güvenlilik, Yaşam Kalitesi (QoL) değişikliği ve ECOG PS bozulmasına kadar geçen süredir.Diğerleri 6 ve 12. hafta kemik döngü değişiklikleridir. Ek olarak 724 hasta 2:1 everolimus (10 mg/gün) + eksemestan (25 mg/gün) kombinasyonu (n= 485) veya plasebo + eksemestana (25 mg/gün) (n= 239) randomize edilmiştir. Nihai OS analizizamanında, medyan everolimus tedavisi süresi 24 haftadır (aralık 1 - 199,1 hafta). Medyaneksemestan tedavisi süresi everolimus + eksemestan grubunda 29,5 hafta (1 - 199,1) iken; plasebo+ eksemestan grubunda 14,1 haftadır (1 - 156). Birincil etkililik sonlanım noktası için etkililik bulguları nihai PFS analizinden elde edilmiştir (bkz. Tablo 3 ve Şekil 1). Plasebo + eksemestan kolundaki hastalar progresyon zamanındaeverolimusa çapraz geçiş yapmamıştır. Tablo 3. BOLERO-2 etkililik bulguları
16 / 21
Hesaplanmış PFS tedavisi etkisi araştırmacı değerlendirmesine göre planlanmış PFS alt grup analizi ile desteklenmiştir. Analiz edilen tüm alt gruplar için (yaş, önceki hormonal tedaviyeduyarlılık, tutulan organ sayısı, başlangıçta sadece kemik lezyonları durumu ve viseral mestastazvarlığı ve majör demografik ve prognostik alt gruplar arasında), plasebo + eksemestana karşı 0,25ila 0,6 arasında değişen bir hesaplanmış tehlike oranı ile everolimus + eksemestan ile pozitif birtedavi etkisi görülmüştür. QLQ-C30'un genel ve fonksiyonel alt birim skorlarında >%5 bozulmaya kadar geçen süre açısından iki kol arasında bir fark gözlenmemiştir. Diğer çalışmalarStomatit, everolimus ile tedavi edilen hastalarda en sık bildirilen advers reaksiyondur (bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri ve Bölüm 4.8 İstenmeyen etkiler). Postmenopozal memekanseri kadınlarda (N=92) yapılan pazarlama sonrası tek kollu bir çalışmada, stomatit insidansınıve ciddiyetini azaltmak için, deksametazon 0,5 mg/5 mL alkolsüz oral solüsyonü ile topikal tedavi,gargara olarak (tedavinin ilk 8 haftasında günde 4 kez) everolimus (everolimus, 10 mg/gün) artıeksemestan (25 mg/gün) ile tedavi edilen hastalara uygulanmıştır. 8. haftada derece >2 stomatitinsidansı %2,4'tür (n=2/85 değerlendirilebilir hasta) ve bu rakam geçmişte bildirilenlerden dahadüşüktür. Derece 1 stomatit insidansı %18,8'dir (n=16/85) ve derece 3 veya 4 stomatit vakasıbildirilmemiştir. Bu çalışmadaki genel güvenlilik profili, hastaların %2,2'sinde (n=2/92) raporedilen oral kandidiyazın hafifçe artan sıklığı dışında, onkoloji ve TSC düzleminde everolimus içinbelirlenen güvenlilik profili ile tutarlıdır. 5.2. Farmakokinetik özelliklerGenel özelliklerEverolimus, doğal ürün rapamisinden kimyasal modifikasyonla türetilen bir makrolitik laktondur. 17 / 21 Everolimusun farmakokinetik özellikleri aşağıda ayrıntılı olarak belirtilmektedir. Emilim:İlerlemiş solid tümorlü hastalarda everolimus alımından sonra doruk everolimus konsantrasyonlarına (Cmaks) açlık durumunda ya da hafif, yağ içermeyen bir öğün ile birlikte,günlük 5 ve 10 mg everolimus uygulamasından sonra 1 saatte ulaşılır. Cmaks, 5 ve 10 mg'lık günlükdozlamada dozla orantılıdır. Everolimus bir PgP substratı ve orta derecede potent inhibitörüdür. Besinlerin etkisi: Sağlıklı gönüllülerde yüksek yağlı öğünler everolimus 10 mg'a sistemik maruziyeti (EAA ile ölçülen) %22 oranında ve doruk plazma konsantrasyonu Cmaks değerini %54 oranında azaltmıştır.Düşük yağlı öğünler EAA'yı %32 ve Cmaks değerini %42 azaltmıştır. Ancak besinler emilimsonrası faz konsantrasyonu - zaman profili üzerinde belirgin bir etkiye sahip olmamıştır. Dağılım:5 ila 5000 ng/mL aralığında konsantrasyona bağlı olan everolimusun kan-plazma oranı %17 ile %73 arasındadır. 10 mg/gün everolimus verilen kanser hastalarında, plazmada bulunan everolimusoranı, kan konsantrasyonunun yaklaşık %20'si olmuştur. Plazma proteinine bağlanma oranısağlıklı gönüllülerde ve orta şiddette karaciğer yetmezliği olanlarda yaklaşık %74'tür. İlerlemişsolid tümörleri olan hastalarda dağılım hacmi (Vd), sanal merkezi kompartıman için 1911 ve sanalperiferik kompartıman için 5171 olarak saptanmıştır. Biyotransformasyon:Everolimus bir CYP3A4 ve PgP substratıdır. Oral uygulamayı takiben, everolimus insan dolaşımındaki temel bileşen olmaktadır. İnsanlarda altı temel metabolit belirlenmiştir; bunlar üçtane monohidroksile metabolit, iki hidrolitik açık halkalı ürün ve everolimusun fosfatidilkolinkonjugatıdır. Bu metabolitler toksisite çalışmalarında kullanılan hayvan türlerinde detanımlanmıştır ve aktiviteleri, ana bileşenden 100 kat daha düşüktür. Bu nedenle, everolimusungenel farmakolojik aktivitesine en büyük katkıyı ana ilacın yaptığı düşünülmektedir. Eliminasyon:Everolimusun ilerlemiş solid tümörleri olan hastalardaki 10 mg'lık günlük dozundan sonraki ortalama Kl/F (oral klerens) değeri 24,5 L/saattir. Everolimusun ortalama eliminasyon yarılanmaömrü yaklaşık olarak 30 saattir. Kanser hastalarında spesifik atılım çalışmaları gerçekleştirilmemiştir; organ nakli ile ilgili yapılan çalışmalardan elde edilen veriler mevcuttur. Siklosporin ile birlikte tek doz radyoaktif işaretlieverolimus uygulamasını takiben, radyoaktivitenin %80'i dışkı ile %5'i idrar ile atılmıştır. Anailaç dışkı ya da idrarda belirlenmemiştir. Kararlı durum farmakokinetiği:İlerlemiş solid tümörleri olan hastalarda everolimus uygulamasından sonra, kararlı durum EAA0-t değeri, günlük uygulama için 5-10 mg doz aralığında olmuştur. Kararlı durum koşullarına, günlük doz rejimi ile 2 haftada ulaşılmaktadır. Cmaks 5 ve 10 mg arasında dozla orantılıdır. tmaks değerinedoz uygulamasından 1 ila 2 saat sonra ulaşılmıştır. Kararlı durumda EAA0-T ve doz öncesi çukurkonsantrasyon arasında anlamlı bir korelasyon gözlenmiştir. 18 / 21 Hastalardaki karakteristik özelliklerKaraciğer yetmezliği olan hastalar:İki tekli oral dozun kullanıldığı everolimus çalışmasında, normal karaciğer fonksiyonuna sahip gönüllülere göre bozulmuş karaciğer fonksiyonuna sahipgönüllülerde everolimusun güvenlilik, tolerabilite ve farmakokinetiği değerlendirilmiştir. Birçalışmada; orta düzeyde karaciğer bozukluğu (Child-Pugh sınıf B) bulunan 8 gönüllüdeeverolimusun ortalama EAA değeri normal karaciğer fonksiyonuna sahip 8 gönüllüde saptananıniki katı olmuştur. İkinci bir çalışmada farklı karaciğer bozukluklarına sahip 34 gönüllü normalgönüllülerle karşılaştırıldığında, hafif şiddette (Child-Pugh A), orta şiddette (Child-Pugh B) veşiddetli (Child-Pugh C) karaciğer bozukluğu olan hastalarda maruziyette (yani, EAA(0-sons))sırasıyla 1,6 kat, 3,3 kat ve 3,6 kat artış meydana gelmiştir. Çoklu doz farmakokinetiğisimülasyonları Child-Pugh durumuna göre karaciğer bozukluğu olan gönüllülerde doz uygulamasıönerilerini desteklemektedir. İki çalışmanın meta analizine dayanılarak karaciğer bozukluğu olanhastalarda doz ayarlaması önerilmektedir (bkz. Bölüm 4.2 Pozoloji ve uygulama şekli ve Bölüm4.4 Özel kullanım uyarıları ve önlemleri).Böbrek yetmezliği olan hastalar:İlerlemiş kanseri olan 170 hasta üzerinde gerçekleştirilen bir popülasyon farmakokinetiği çalışmasında, kreatinin klerensinin (25-178 mL/dak) everolimusunoral klerensi üzerinde anlamlı bir etkisi gözlenmemiştir. Nakil sonrası böbrek yetmezliği (kreatininklerensi aralık 11-107 mL/dak) nakil hastalarında everolimusun farmakokinetiğini etkilememiştir.Pediyatrik hastalar:Pediyatrik kanser popülasyonunda everolimus kullanılması ile ilgili bir endikasyon yoktur (bkz. Bölüm 4.2 Pozoloji ve uygulama şekli).Yaşlı hastalar:Kanser hastaları üzerinde yapılan bir popülasyon farmakokinetiğideğerlendirmesinde, yaşın (27 ila 85) everolimusun oral klerensi üzerinde anlamlı bir etkisi gözlenmemiştir. Irk:Benzer karaciğer fonksiyonlarına sahip Japon ve Batılı kanser hastalarında oral klerens değerleri benzer olmuştur. Popülasyon farmakokinetiği analizlerine dayalı olarak, siyah ırktantransplantasyon hastalarında oral klerens değerinin ortalama %20 daha yüksek olduğugörülmüştür.Maruziyet-yanıt ilişkileri:5.3. Klinik öncesi güvenlilik verileriEverolimusun klinik öncesi güvenlilik profili sıçanlarda, farelerde, mini-domuzlarda, maymunlarda ve tavşanlarda değerlendirilmiştir. Temel hedef organlar şunlardır: Birçok türdeerkek ve dişi üreme sistemleri (testiküler tübüler bozulma, epididimiste sperm içeriğinin azalmasıve uterus atrofisi), sıçanlarda ve farelerde akciğerler (alveolar makrofajlarda artış), maymun vemini-domuzlarda pankreas (ekzokrin hücresinin sırasıyla degranülasyon ve vaküolasyonu ve 19 / 21 maymunda adacık hücrelerinin dejenerasyonu), yalnızca sıçanlarda gözler (lentiküler ön sütür çizgisi opasiteleri). Sıçanların (tübüler epitelde yaşa bağlı lipofusin artışı ve hidronefrozda artışlar)ve farelerin (altta yatan lezyonların alevlenmesi) böbreklerinde küçük değişiklikler gözlenmiştir.Maymunlarda veya mini-domuzlarda, böbrek toksisitesine rastlanmamıştır. Arka plandaki hastalıkların (sıçanlarda kronik miyokardit, maymunların plazmasında ve kalbinde coxsackievirüs infeksiyonu, mini-domuzların gastrointestinal kanalında koksidiyoz, farelerde vemaymunlarda deri lezyonları), everolimus tedavisiyle alevlendiği gözlenmiştir. Bu bulgulargenellikle terapötik maruziyet aralığının içindeki ya da üstündeki sistemik maruziyet düzeylerindegözlenmiştir; buna tek istisna, yüksek doku dağılımının gözlendiği sıçanlardır; sıçanlarda budurum terapötik maruziyet aralığının altında bir düzeyde meydana gelmiştir.Erkek sıçanlarda yapılan bir fertilite çalışmasında, 0,5 mg/kg ve daha yüksek everolimus dozları testis morfolojisinde değişikliğe neden olmuş, 5 mg/kg everolimus, sperm motilitesini, spermsayısını ve plazma testosteron düzeylerini azaltarak erkek fertilitesinde azalmaya yol açmıştır. Buetkinin geri dönüşümlü olduğu yolunda kanıtlar bulunmuştur. Hayvan üreme çalışmalarında dişi fertilitesi etkilenmemiştir. Ancak dişi sıçanlarda >0,1 mg/kg düzeyinde oral everolimus dozları (günde 10 mg'lık dozu alan hastalarda EAA0-24sa düzeyininyaklaşık %4'ü) implantasyon öncesindeki kaybın artmasıyla sonuçlanmıştır. Everolimus, plasentadan geçerek fetüste toksik etki göstermiştir. Everolimus sıçanlarda, terapötik düzeyin altındaki sistemik maruziyet düzeylerinde, embriyo/fetotoksisiteye neden olmuştur. Bumortalite olarak belirtilmektedir ve fetal ağırlığı düşürmektedir. 0,3-0,9 mg/kg arasındaki dozlardaiskelet değişikliklerinin ve malformasyonların (örneğin sternal yarık) insidansı artmıştır.Tavşanlarda geç dönem emilimin artmasına bağlı olarak embriyotoksisite kaçınılmaz olmuştur. 0,15 mg/kg/gün kadar düşük dozlarda yapılan juvenil sıçan toksisitesi çalışmasında sistemik toksisite azalmış kilo alımı ve besin tüketimini ve tüm dozlarda bazı gelişimsel özelliklerdegecikmeyi, doz uygulaması kesildikten sonra tam ve kısmi iyileşmeyi içermiştir. Sıçana özgümercek bulgularının haricinde (genç hayvanların daha duyarlı olduğu görülen), günde 0,5 ila 5mg/kg'lık dozlarda yetişkin hayvanlara kıyasla juvenil hayvanlarda everolimusun advers etkilerineduyarlılık açısından anlamlı bir farklılık görülmemiştir. 4 hafta boyunca 0,5 mg/kg/güne kadarolan dozlarda juvenil maymunlarda ilgili toksisite belirgin olmamıştır. İlgili genotoksisite sonlanım noktalarının değerlendirildiği genotoksisite çalışmalarında herhangi bir klastojenik ya da mutajenik etkiye rastlanmamıştır. Sıçanlara ve farelere 2 yıla kadareverolimus uygulaması, 10 mg'lık günlük dozdan hesaplanan klinik maruziyetin 3,9 ve 0,2 katınatekabül eden en yüksek dozlarda bile herhangi bir onkojenik etki meydana getirmemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiBütilhidroksitoluen (E321) Hipromelloz Laktoz monohidrat (inek sütünden ve buzağı peynir mayasından elde edilir) Laktoz susuz (inek sütünden ve buzağı peynir mayasından elde edilir) Krospovidon Magnezyum stearat 20 / 21 6.2. GeçimsizliklerYeterli veri yoktur. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız. Işık ve nemden korumak için orijinal ambalajında saklayınız. 6.5. Ambalajın niteliği ve içeriği30 tabletlik OPA/Al/PVC-Al blisterlerde kullanma talimatı ile birlikte karton kutuda sunulur. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklar Kontrolü Yönetmeliği" ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİTeva İlaçları San. ve Tic. A.Ş. Ümraniye/İstanbul 8. RUHSAT NUMARASI2017/838 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 01.11.2017 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ21 / 21 / 21 |
İlaç BilgileriEvaxmus 10 Mg TabletEtken Maddesi: Everolimus
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.