Ginera 75 Mcg/30 Mcg Kaplı Tablet Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIGINERA® 75 mcg/30 mcg kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin maddeler:Her bir kaplı tablet etkin madde olarak 0,075 mg gestoden ve 0,03 mg etinilestradiol içerir.Yardımcı maddeler:Her bir kaplı tablet 37,43 mg laktoz (sığır kaynaklı) ve 19,66 mg sukroz içerir.Yardımcı maddelerin tam listesi için bölüm 6.1'e bakınız 3. FARMASÖTİK FORMKaplı tablet Beyaz kaplı tablet 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarOral kontrasepsiyon (doğum kontrolü) GINERA reçete etme kararı, venöz tromboembolizmi (VTE) olan kadınlar başta olmak üzere, her kadının mevcut risk faktörleri ve GINERA ile ortaya çıkan VTE riskinin diğerkombine hormonal kontraseptifler (KHK) ile karşılaştırması (bkz. bölüm 4.3 ve bölüm 4.4)dikkate alınarak verilmelidir. 4.2. Pozoloji ve uygulama şekliPozoloji / uygulama sıklığı ve süresi:Kombine oral kontraseptifler (KOK), doğru şekilde kullanıldıklarında yılda yaklaşık %1 başarısızlık oranına sahiptir. İlaç unutulduğunda ya da yanlış kullanıldığında başarısızlık oranıartabilir.Tabletler, paketin üstünde gösterildiği yönde, her gün yaklaşık aynı zamanda bir miktar suyla alınmalıdır. Birbirini izleyen 21 gün boyunca her gün bir tablet alınır. Her bir sonraki pakete 7günlük, sıklıkla çekilme kanamasının izlendiği, tablet alınmayan dönemi takiben geçilir. Bukanama genellikle son tabletin alınmasını takiben 2.-3. gün başlar ve bir sonraki paketebaşlandığında kesilmemiş olabilir. Uygulama şekli:Oral kullanım içindir. GINERA'ya başlangıç Bir önceki ay hormonal kontraseptif kullanımı yoksa: Tablet alımına kadının normal siklusunun ilk günü (kanamasının ilk günü) başlanmalıdır. Tabletlere 2. ile 5. günler arasındabaşlanması da kabul edilebilir, ancak bu durumda ilk siklus için tablet alınmayabaşlanmasından itibaren 7 gün boyunca ilave olarak bir bariyer kontrasepsiyon yöntemikullanılmalıdır. Bir KHK'dan geçiş (KOK, vajinal halka, transdermal flaster): Tercihen önceki KOK'un son aktif tabletini (hormon içeren son tablet) izleyen gün GINERA alımına başlanmalıdır. En geçise tabletsiz dönemi ya da hormon içermeyen tablet döneminin ertesi gününde başlanabilir.Vajinal halka ya da transdermal flaster kullanılması durumunda, kullanıcı döngü paketindeki 1son halkanın ya da flasterin çıkarıldığı gün ya da en geç bir sonraki uygulamanın yapılması gereken gün GINERA'ya başlamalıdır. Yalnız progestagen içeren bir yöntemden (minipil, enjeksiyon, implant) ya da progesteron salımlı rahim içi sistemden (RİS) geçiş: Minipilden herhangi bir günde, (implant veya RİS'inçıkarıldığı gün, enjeksiyonda ise bir sonraki enjeksiyonun yapılması gereken gün) geçişyapılabilir. Ancak tüm bu koşullarda tablet alımının ilk 7 günü ek bir bariyer yöntemikullanılması önerilir. İlk trimestr düşüğünü takiben: Hemen başlanabilir. Ek kontraseptif önlemler alınmasına ihtiyaç duyulmaz. Doğumu veya ikinci trimestr düşüğünü takiben: Emziren kadınlar için bkz. 4.6 Gebelik ve laktasyon. Emzirmeyen kadınların doğumu veya ikinci trimestr düşüğünü takiben 21.-28. günlerde başlanması önerilir. Daha sonra başlandığı takdirde tablet alımının ilk 7 günü ek bir bariyeryöntemi kullanılmalıdır. Eğer o zamana kadar ilişki gerçekleştiyse, KOK kullanımıbaşlamadan önce gebelik ekarte edilmeli veya ilk menstruel kanama beklenmelidir. Tablet alımı unutulduğunda: Eğer kullanıcı tabletini almakta, 12 saatten daha az geç kalmışsa kontraseptif koruyuculuk azalmaz. Hatırlanır hatırlanmaz tablet alınmalı ve sonraki tabletlerde her zamanki gibi alınmaya devam edilmelidir. Eğer 12 saatten daha fazla gecikme olmuşsa kontraseptif koruyuculuk azalmış olabilir. Bu durumda 2 temel kural uygulanır: 1. Tablet alımına hiçbir zaman 7 günden fazla ara verilmez. 2. Hipotalamus-hipofiz-over aksının uygun şekilde baskılanması için 7 gün boyunca aralıkvermeden tablet alınması gereklidir. Buna bağlı olarak günlük uygulamada şu öneriler verilebilir: 1. Hafta: Aynı zamanda iki tablet almak anlamına gelse de, kullanıcı unuttuğu tableti hatırlarhatırlamaz içmelidir. Kalan tabletlerini normal zamanında kullanmaya devam edebilir. Takipeden 7 gün boyunca kondom gibi ek bir bariyer yöntemi kullanmalıdır. Tablet alımınınunutulduğu günden önceki 7 gün içinde cinsel birleşme olmuşsa gebelik olasılığı göz önünealınmalıdır. Ne kadar çok tablet unutulursa ve bu tabletlerin unutulduğu gün tabletsiz dönemene kadar yakınsa gebelik riski o kadar yüksektir. 2. Hafta: Aynı zamanda iki tablet almak anlamına gelse de, kullanıcı son unuttuğu tabletihatırlar hatırlamaz içmelidir. Kalan tabletlerini normal zamanında kullanmaya devam edebilir.Eğer ilk unutulan tablete kadar 7 gün boyunca tabletler doğru olarak alınmışsa ek korunmayöntemi kullanmaya gerek yoktur. Aksi takdirde ya da kadın birden fazla tablet unutmuşsasonraki 7 gün boyunca ek önlemler alınmalıdır. 3. Hafta: Tabletsiz dönemin yaklaşıyor olması nedeni ile güvenilirlikte azalma riski yüksektir.Yine de, tablet alımında ayarlamalar yapılarak kontraseptif korumada azalma önlenebilir.Eğer unutulan tabletten önceki 7 gün boyunca tabletler doğru olarak alındıysa, aşağıdaki ikiseçenekten birinin uygulamasıyla ek bir kontraseptif yönteme gerek kalmaz. Aksi takdirde buseçeneklerden ilki seçilip, ayrıca 7 gün boyunca ek önlemler almak gerekir. 21. Aynı zamanda iki tablet almak anlamına gelse de kullanıcı son unuttuğu tableti hatırlarhatırlamaz içmelidir. Kalan tabletlerini normal zamanda kullanmaya devam edebilir. Birsonraki kutuya 7 gün ara vermeden mevcut kutu biter bitmez başlanmalıdır. Kullanıcıdaikinci kutunun sonuna kadar bir çekilme kanaması beklenmez. Ancak tablet alındığıgünlerde lekelenme veya kırılma kanaması görülebilir. 2. Kullanmakta olduğu kutuyu bırakması önerilebilir. 7 günlük (tableti unuttuğu günler dahil)aradan sonra yeni kutuya başlanır. Tablet almayı unutan kullanıcıda ilk tabletsiz dönemde beklenen çekilme kanaması görülmezse gebelik olasılığı göz önüne alınmalıdır. Mide-bağırsak bozuklukları durumunda: Şiddetli mide-bağırsak bozukluklarının olması durumunda emilim tam olmayabilir ve ek kontraseptif önlemler alınmalıdır. Eğer tablet alımını takiben 3-4 saat içinde kusma olursa unutulan tabletler için verilen öneriler (bkz. 4.2 Pozoloji ve uygulama şekli - tablet alımı unutulduğunda) geçerlidir. Eğer kadınnormal tablet alma programını değiştirmek istemezse, gereken ekstra tabletleri başka birkutudan almalıdır. Menstruasyonun öne alınması veya ertelenmesi: Menstruasyonu ertelemek için kullanıcı tablet alınmayan dönem olmadan başka bir GINERA paketi ile devam etmelidir. Uzatma, eğer istenirse ikinci paketin sonuna kadar yapılabilir.Uzatma sırasında kullanıcı kırılma kanaması ya da lekelenme yaşayabilir. Daha sonra 7günlük tablet alınmayan dönemin ardından düzenli GINERA alımına devam edilir. Kullanıcının adet dönemini haftanın başka bir gününe kaydırmak için tablet alınmayan dönemini istediği gün kadar kısaltması önerilir. Aralık ne kadar kısa olursa, kadının çekilmekanaması olmama ve ikinci paket sırasında kırılma kanaması ve lekelenme yaşama riski okadar yüksektir (adet geciktirirken olduğu gibi). Özel popülasyonlara ilişkin ek bilgiler:Karaciğer yetmezliği:GINERA şiddetli karaciğer hastalıkları olan kadınlardakontrendikedir. Ayrıca 4.3 bölümüne bakınız. Böbrek yetmezliği:GINERA böbrek yetmezliği olan hastalarda özel olarak araştırılmamıştır. Mevcut veriler bu hasta popülasyonun tedavisinde bir değişiklik yapılmasını ilerisürmemektedir.Pediyatrik popülasyon:GINERA yalnızca menarştan sonra endikedir.Geriyatrik popülasyon:4.3. KontrendikasyonlarKOK'lar aşağıda belirtilen durumlarda kullanılmamalıdır. KOK kullanırken aşağıdaki durumlardan herhangi birinin ilk kez görülmesi halinde kullanım derhal durdurulmalıdır. Etkin ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılık VTE varlığı veya riski o Venöz tromboembolizm - mevcut VTE (antikoagülanlar üzerinde) veya öyküsü (örn. derin ven trombozu [DVT] veya pulmoner embolizm [PE]) o APC direnci (Faktör V Leiden dahil), antitrombin III eksikliği, protein C eksikliği, protein S eksikliği gibi VTE için bilinen kalıtımsal veya kazanılmış yatkınlık o Uzun süreli hareketsizliğe neden olan majör cerrahi müdahale (bkz. bölüm 4.4) 3o Çoklu risk faktörlerinin varlığından kaynaklanan yüksek VTE riski (bkz. bölüm 4.4) Arteriyel tromboembolizm (ATE) varlığı veya riski o Arteriyel tromboembolizmi - mevcut ATE, ATE öyküsü (örn. miyokard infarktüsü) veya prodromal durum (örn. anjina pektoris) o Serebrovasküler hastalık - mevcut inme, inme veya prodromal durum öyküsü (örn. geçici iskemik atak, TIA) o Hiperhomosisteinemi ve antifosfolipid antikorlar (antikardiyolipin antikorlar, lupus antikoagülanı) gibi ATE için bilinen kalıtımsal veya kazanılmış yatkınlık o Fokal nörolojik semptomlu migren öyküsü. o Çoklu risk faktörlerinden kaynaklanan yüksek ATE riski (bkz. bölüm 4.4) veya aşağıdaki gibi bir ciddi risk faktörü varlığı: vasküler semptomlu diabetes mellitus şiddetli hipertansiyon şiddetli dislipoproteinemi Karaciğer fonksiyon değerlerinin normale dönmediği, aktif viral hepatit ve ağır sirozgibi ağır karaciğer hastalığı varlığı veya öyküsü, Karaciğer tümörü varlığı ya da öyküsü (iyi veya kötü huylu) Eğer seks steroidlerinden etkileniyorsa genital organların veya memenin bilinen ya daşüpheli malign hastalıkları Tanı konulmamış vajinal kanama Bilinen gebelik varlığı ya da gebelik şüphesi GINERA'nın ombitasvir, paritaprevir, ritonavir veya dasabuvir içeren tıbbi ürünler ile eş zamanlı kullanımı kontraendikedir (bkz. bölüm 4.4 ve 4.5). 4.4. Özel kullanım uyarıları ve önlemleriUyarılarAşağıda belirtilen durum veya risk faktörlerinden herhangi biri varsa, GINERA'in uygun olup olmadığı kadın ile tartışılmalıdır. Bu durumlardan veya risk faktörlerinden herhangi birinin şiddetlenmesi veya ilk defa ortaya çıkması halinde, kadının GINERA kullanımının sonlandırılmasının gerekli olup olmadığınınbelirlenmesi için doktoru ile iletişime geçmesi tavsiye edilmelidir. Dolaşım bozuklukları VTE RiskiKHK kullanan kadınlarda VTE riski kullanmayanlara göre artar. Levonorgestrel, norgestimat veya noretisteron içeren ürünler en düşük VTE riski ile ilişkilendirilmiştir.GINERA gibi diğer ürünlerde ise bu riskin iki katına kadar çıkabilir. En düşük VTEriskine sahip olduğu bilinenlerden farklı bir ürünün kullanılması kararı, ancak kadınınGINERA ile ilişkili VTE riskini, mevcut risk faktörlerinin bu riski nasıl etkilediğini veVTE riskinin kullanımınım ilk yılında en yüksek olduğunu anladığından emin olduktansonra alınmalıdır. Ayrıca KHK kullanımına 4 hafta veya daha uzun süre ara verildiktensonra tekrar başlandığında riskin arttığını gösteren bazı kanıtlar vardır.4KHK kullanmayan ve gebe olmayan kadınlarda, 10.000 kişiden yaklaşık 2'si bir yıllık süre içinde VTE geliştirir. Bununla birlikte, herhangi bir kadında altta yatan risk faktörlerine bağlıolarak söz konusu risk çok daha yüksek olabilir (aşağı bakınız). Gestoden içeren KHK kullanan 10.000 kadından 9 ila 12'sinin bir yıl içinde VTE geliştireceği tahmin edilmektedir1; bu oran levonorgestrel içeren KHK kullanan kadınlarda 62 civarındadır. Düşük dozlu KHK'ler ile bir yıldaki VTE sayısı gebelikte veya postpartum dönemde kadınlarda beklenen sayıdan düşüktür. VTE, bu vakaların %1-2'sinde ölümcül olabilir. Bir yıl içinde her 10.000 kadında görülen VTE vakası sayısıVTE vaka sayısı A: i8 - I2- ¦o -I-T-1-^KHK kullanmayanlar Levonorgestrel içerenGestoden içeren KHK(2 vaka) KHK (5-7 vaka)(9-12 vaka)Son derece nadir olarak, KHK kullanıcılarında diğer kan damarlarında (örn. hepatik, mesenter, böbrek veya retinal toplardamarlar ve atardamarlar) tromboz meydana geldiği raporedilmiştir. VTE risk faktörleriVenöz tromboembolik komplikasyon riski KHK kullanıcılarında özellikle çoklu risk faktörleri olduğunda, ilave risk faktörleri olan kadınlarda ciddi ölçüde artabilir (bkz. Tablo:VTE Risk faktörleri). Yüksek venöz tromboz riski oluşturan çoklu risk faktörleri mevcut olan kadında GINERA kullanımı kontrendikedir (bkz. bölüm 4.3). Bir kadın birden fazla risk faktörüne sahipse riskartışı tüm faktörlerin ayrı ayrı toplamından fazla olabilir ve bu durumda toplam VTE riskidikkate alınmalıdır. Fayda ve risk dengesinin negatif olduğu düşünülüyorsa KHK reçeteedilmemelidir (bkz. bölüm 4.3). 5
Variköz venlerin ve yüzeysel tromboflebitin venöz tromboembolideki olası rolü konusunda görüş birliği yoktur. Gebelikte ve özellikle 6 haftalık puerperium periyodunda tromboemboli riskindeki artış dikkate alınmalıdır (bkz. bölüm 4.6). VTE semptomları (Derin Ven Trombozu-DVT ve Pulmoner Emboli-PE)Semptomlar olması halinde, kadınlara acil tıbbi yardım almaları ve sağlık çalışanlarını KHK aldıkları konusunda bilgilendirmeleri tavsiye edilmelidir. DVT semptomları aşağıdakileri kapsayabilir: - bacakta/ayakta tek taraflı ya da bacaktaki bir damar boyunca şişme; - bacakta yalnızca ayakta dururken ya da yürürken hissedilebilen ağrı ya da hassasiyet, - etkilenen bacakta sıcaklık artışı; bacakta ciltte kırmızılık ya da renk değişmesi. Pulmoner embolizm (PE) semptomları aşağıdakileri kapsayabilir: - aniden ortaya çıkan, açıklanamayan nefes darlığı ya da hızlı soluma; - kanın söz konusu olabileceği ani öksürük; - keskin göğüs ağrısı; - şiddetli dengesizlik ya da baş dönmesi; - hızlı veya düzensiz kalp atışı. 6Bu semptomlardan bazıları (ör, nefes darlığı, öksürük) özgün değildir ve daha yaygın ya da daha az şiddetli olaylar (ör, solunum yolu enfeksiyonları) şeklinde yanlış yorumlanabilir.Vasküler oklüzyona ilişkin diğer belirtiler; bir ekstremitedeki ani ağrı, şişme ya da mavi tondahafif renk değişikliği olabilir. Gözde tıkanma meydan geldiği takdirde, semptomlar ağrısız bulanık görme ile başlayıp görme kaybına kadar ilerleyebilir. Bazen, görme kaybı aniden meydana gelebilir. ATE riskiEpidemiyolojik çalışmalarda, KHK kullanımı ATE (miyokard enfarktüsü) veya serebrovasküler olay (örn. geçici iskemik atak, inme) riskinde artışla ilişkilendirilmiştir. ATEölümcül olabilir. ATE risk faktörleriArteriyel tromboembolik komplikasyon veya serebrovaksüler olay riski, risk faktörleri olan KHK kullanan kadınlarda artar (bkz. Tablo: ATE Risk faktörleri).Yüksek arteriyel tromboz riskine maruz bırakan ciddi ya da çoklu ATE risk faktörleri mevcut olan kadında GINERA kullanımı kontrendikedir (bkz. bölüm 4.3). Bir kadında birden fazlarisk faktörü varsa, riskteki artışın ayrı ayrı faktörlerin toplamından daha yüksek olmasıolasılığı vardır. Bu durumda VTE toplam riski dikkate alınmalıdır. Fayda ve risk dengesininnegatif olduğu düşünülüyorsa, KHK reçete edilmemelidir (bkz. bölüm 4.3).
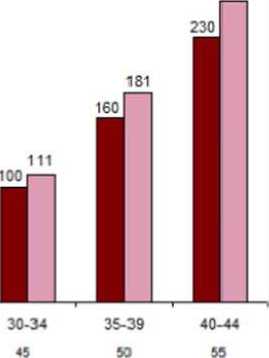
7ATE semptomlarıSemptomlar görüldüğünde, kadınlar en kısa sürede tıbbi yardıma başvurmaları ve KHK kullandıklarını sağlık uzmanına bildirmek konusunda bilgilendirilmelidir. Serebrovasküler bir olaya ilişkin semptomlar şunlardır: - yüzde, bacak veya kolda, özellikle vücudun bir tarafında ani hissizlik ya da güçsüzlük; - ani yürümede güçlük, baş dönmesi, denge ya da koordinasyon kaybı; - ani konfüzyon, konuşma ya da kavramada güçlük; - bir ya da her iki gözde ani görme güçlüğü; ani yürüme güçlüğü, - bilinen nedeni olmayan ani, şiddetli veya uzun süren baş ağrısı; - bilinç kaybı ya da nöbetin eşlik ettiği ya da tek başına bayılma. Geçici belirtiler olayın geçici iskemik atak olduğunu göstermektedir. Miyokard enfarktüsü (MI) semptomları şunları kapsayabilir: - göğüs, kol ya da göğüs kemiği altında ağrı, rahatsızlık, basınç, ağırlık, sıkışma ya dadolgunluk hissi; - sırt, çene, boğaz, kol ve mideye yayılan rahatsızlık; - dolgunluk, hazımsızlık ya da sıkıştırma hissi; - terleme, bulantı, kusma ya da baş dönmesi; - aşırı güçsüzlük, anksiyete, nefes darlığı; - hızlı veya düzensiz kalp atışı. Tıbbi muayene/konsültasyon Hastanın oral kontraseptif kullanmaya başlamadan önce ve sonrasında düzenli aralıklarla tıbbi öyküsü (aile öyküsünü de içerecek şekilde) değerlendirilmelidir ve gebelik ekarte edilmelidir.Kan basıncı ölçülmeli ve fiziksel muayene kontrendikasyonlar (bkz. bölüm 4.3) ile uyarılar(bkz. bölüm 4.4) doğrultusunda gerçekleştirilmelidir. VTE ve ATE semptomları, bilinen riskfaktörleri ve şüpheli tromboz durumunda ne yapılacağı, GINERA'nın diğer KHK'lara kıyaslariski de dahil olmak üzere venöz ve arteriyel tromboz bilgilerine kadının dikkatini çekmekönemlidir. Kadına ayrıca kullanma talimatını dikkatlice okuması ve verilen tavsiyelere uyması talimatı verilmelidir. Muayenenin niteliği ve sıklığı belirlenmiş uygulama kılavuzlarına dayanmalı vekadına özel olarak uyarlanmalıdır. Kullanıcılar oral kontraseptiflerin HIV enfeksiyonları (AIDS) ve diğer cinsel yolla bulaşan hastalıklara karşı koruyucu olmadığı konusunda bilgilendirilmelidir. Altta yatan durumlar için şüpheli tanısı konmamış vajinal kanama araştırılmalıdır. Dikkatli tıbbi gözetim gerektiren durumlar KOK reçete edilmesi konusu klinik karar kullanılarak ve hastanın fikri alınarak kararlaştırılmalıdır. Bu durum veya risk faktörlerinden birinin ilk kez ortaya çıkması veyaalevlenmesi oral kontraseptif kullanımının kesilmesi gerektiğine işaret edebilir. Hastadoktoruna danışmalı, doktor da KOK kullanımına son verilip verilmemesine ilişkin kararvermelidir: Hafif vasküler hastalık veya hafif nefropati, retinopati veya nöropatinin eşlik ettiğidiyabet Yeterli kontrol altında olan (sistolik >140 ila159 mm Hg veya diyastolik >90 ila 94 mmHg) hipertansiyon Porfiri 8 Obezite Migren Kardiyovasküler hastalıklar Oral kontrasepsiyon kullanımını derhal kesme nedenleri:Oral kontrasepsiyon kullanımım keserken, kontraseptif korumanın devam edebilmesi için hormonal olmayan kontrasepsiyon kullanılmalıdır. 1. Migrenli baş ağrılarının veya normal olmayan sıklıktaki/şiddetteki baş ağrılarının ilk kezortaya çıkması veya mevcut olanların şiddetlenmesi. 2. Görmede veya işitmede ani bozulmalar veya diğer algı bozuklukları 3. Tromboz veya kan pıhtılaşması ilk belirtileri (örneğin, bacakta/bacaklarda olağan dışıağrılar veya şişme, gözle görülür bir neden olmaksızın nefes alırken veya öksürürken bıçakgibi saplanan ağrılar). Göğüste ağrı veya sıkışma hissi 4. Elektif majör operasyondan (örn. abdominal, ortopedik), herhangi bir bacak ameliyatından,varisli damarlar veya uzun süreli hareketsizlik (örn. kazalar veya ameliyattan sonra) için tıbbitedaviden altı hafta önce. Tam yürür hale geldikten sonra 2 hafta geçinceye kadar yenidenbaşlamayın. Acil cerrahi durumunda genellikle trombotik profilaksi endikedir, örn.subkutanöz heparin. 5. Sarılık başlangıcı, hepatit, tüm vücutta kaşıntı 6. Kan basıncında önemli artış 7. Şiddetli üst abdominal ağrı veya karaciğer büyümesi 8. Oral kontrasepsiyon veya gebelik sırasında kötüleşebildiği bilinen koşulların açık birşekilde şiddetlenmesi (bkz. bölüm 4.4 'Diğer durumlar' içinde 'Gebelikte veya önceki KOKkullanımı sırasında kötüleşen durumlar'). Tümörler Kombine oral kontraseptif kullanan kadınlarda yumurtalık, endometrial, rahim ağzı ve meme kanseri riskleri konusunda çok sayıda epidemiyolojik çalışma bildirilmiştir. Yüksek dozlukombine oral kontraseptiflerin hem yumurtalık hem de endometrial kansere karşı önemli birkoruma sağladığı açıkça kanıtlanmıştır. Bununla birlikte, düşük doz KOK'ların aynı seviyedekoruyucu etki sağlayıp sağlamadığı açık değildir. Meme Kanseri 54 epidemiyolojik çalışmanın meta analizi sonucu halen KOK kullanan kadınlarda tanı konan meme kanseri bağıl riskinde hafif bir artış saptanmıştır (Bağıl risk =1.24). Bu artmış riskKOK'un kesilmesini takiben on yıl içinde azalarak kaybolmaktadır. Meme kanseri 40 yaşınaltındaki kadınlarda nadir olduğundan, halen KOK kullanan ya da kullanmış olanlardakonulan meme kanseri tanılarındaki artış, tüm meme kanseri riski ile karşılaştırıldığındadüşüktür. Anılan çalışmalar nedensellik ilişkisi konusunda kanıtlar getirmemektedir.Gözlenen artmış risk paterni, KOK kullanıcılarında meme kanserinin daha erken tanınmasına,KOK'ların biyolojik etkilerine veya ikisinin kombinasyonuna bağlı olabilir. KOK kullanmışolanlarda tanı konan meme kanserleri hiç kullanmamış olanlara göre klinik olarak daha azilerlemiş olma eğilimi gösterir. Meme kanseri, KOK kullanıyor olsun veya olmasın 40 yaşın altındaki kadınlarda nadirdir. Bu arka plan risk yaşla birlikte artsa da, halihazırda ve yakın zamanlı KOK kullanıcılarındakifazladan meme kanseri teşhisi sayısı, genel meme kanseri riskine göre küçüktür (bkz. çubukgrafik). 9KOK kullanıcılarında meme kanseri için en önemli risk faktörü, kadınların KOK kullanımını bırakma yaşıdır. Kadınlar ilacı ne kadar geç yaşta keserse, o kadar daha fazla meme kanseriteşhisi konulmaktadır. Kullanım süresi daha az önemli olup KOK kullanımını kestiktensonraki 10 yıl boyunca fazladan risk kademeli olarak kaybolmaktadır. Öyle ki, görünüşe göre10. yıl itibariyle fazladan risk kalmamaktadır. Meme kanseri riskindeki olası artış kullanıcı ile tartışılmalı ve diğer bazı kanserlerin (örneğin, yumurtalık kanseri ve endometriyal kanser) gelişme riskine karşı önemli bir korumasunduğuna dair kanıtlar dikkate alınarak, KOK'ların faydasıyla karşılaştırılmalıdır. 5 yıl KOK kullanan ve KOK kullanımını keseli en fazla 10 yıl olmuş 10.000 kadın başına düşen tahmini kümülatif meme kanseri teşhisi sayısı ile hiç KOK kullanmamış 10.000kadında görülen meme kanserleri teşhisi sayısının karşılaştırması300
250 -200*Meme kanserisayısı150
Servikal Kanser Servikal kanser için en önemli risk faktörü süregelen human papilloma virus (HPV) enfeksiyonudur. Bazı epidemiyolojik çalışmalarda uzun süre KOK kullanımının servikalkanser riskinde artışa neden olabileceği bildirilmiştir ancak bu bulguların KOK kullanımınınhangi etkilerine bağlı olabileceği (servikal inceleme, bariyer kontraseptif kullanımı dahilolmak üzere seksüel davranış) halen tartışılmaktadır. Karaciğer Kanseri GINERA'da bulunanlara benzer hormonal maddelerin kullanımın ardından izole vakalarda hayatı tehdit eden izole abdominal kanamalara neden olan nadir olarak iyi huylu, daha nadirolarak da kötü huylu karaciğer tümörleri gözlemlenmiştir. Ciddi üst abdominal şikayetler,karaciğer büyümesi veya intra-abdominal hemoraji emareleri meydana gelirse, ayırt edicitanıya karaciğer tümörü olasılığı dahil edilmelidir. Diğer durumlar 10Kombine oral kontraseptiflerin kullanımı sırasında bazı kronik hastalıkların zaman zaman kötüleşme olasılığı göz ardı edilemez. Bilinen hiperlipidemiler Hipertrigliseridemisi veya aile öyküsü olan kadınların KOK kullanımı sırasında pankreatit riski artabilir. Hiperlipidemisi olan kadınlar, daha fazla arteriyel hastalık riski altındadır (bkz.bölüm 4.4 'Dolaşım bozuklukları'). Bununla birlikte, rutin olarak KOK kullanan kadınlarıntaranması uygun değildir. Kan Basıncı Hipertansiyon; inme ve miyokard enfarktüsü için bir risk faktörüdür (bkz. bölüm 4.4 'Arteriyel tromboembolikle ilgili durumlar'). Her ne kadar KOK kullanan birçok kadında kanbasıncında küçük artışlar bildirilmiş olsa da, klinik olarak ilgili artışlar nadirdir. Ancak, KOKkullanımı sırasında sürekli hipertansiyon gelişirse, normalde komplikasyonsuz hastalarda160/100 mm Hg seviyesinde ve hedef organ hasarı, teşhis konmuş kardiyovasküler hastalık,diyabet veya kardiyovasküler risk faktörleri artmış hastalarda ise 140/90 mm Hg seviyesindeantihipertansif tedavi yapılmalıdır. KOK kullanımının devamıyla ilgili kararlar daha düşükBP seviyelerinde verilmelidir. Alternatif kontrasepsiyon önerilebilir. Gebelikte veya önceki KOK kullanımı sırasında kötüleşen durumlar Aşağıdaki durumların hem gebelik hem de KOK kullanımıyla ortaya çıktığı veya kötüleştiği bildirilmiştir. Kullanım sırasında aşağıdakilerden herhangi biri olursa, GINERA'yı kesmekdeğerlendirilmelidir: kolestazla ilişkili sarılık ve/veya pruritus KOK'lar safra taşı oluşumu riskini artırabilir ve mevcut hastalığı kötüleştirebilir sistemik lupus eritematozus herpes gestasyones otoskleroz ile ilgili işitme kaybı orak hücre anemisi böbrek yetmezliği kalıtsal anjiyoödem gebelik veya önceki KOK kullanımı sırasında kadının yaşadığı yeni veya kötüleşen mevcutdurumlar. Karaciğer fonksiyonu bozuklukları Karaciğer fonksiyonlarının akut veya kronik bozulmaları, karaciğer fonksiyon testlerinin normale dönmesine kadar KOK kullanımının kesilmesini gerektirebilir. Ilk kez gebelikte yada daha önce seks steroidlerinin kullanımı sırasında oluşmuş olan kolestatik sarılığıntekrarlaması KOK kullanımının sonlandırılmasını gerektirir. Diyabet (vasküler tutulum olmadan) Vasküler hastalığı olmayan insüline bağımlı diyabet hastaları KOK kullanabilir. Ancak, tüm diyabet hastalarının arteriyel hastalık riskinin yüksek olduğu ve bunun KOK reçete ederkendikkate alınması gerektiği unutulmamalıdır. Mevcut vasküler hastalığı olan diyabethastalarında KOK kullanımı kontrendikedir (bkz. bölüm 4.3). KOK'ların periferik insülindirenci ve glukoz toleransı üzerinde etkisinin olma ihtimaline rağmen, düşük dozda KOK(0,05 mg etinilestradiolden az) kullanan diyabet hastalarında tedavi rejiminin değiştirilmesinigerektirecek hiçbir kanıt yoktur. Ancak, diyabet hastası kadınların KOK kullanımı sırasındadikkatli bir şekilde gözlemlenmesi gerekir. 11Psikiyatrik Bozukluklar Depresif ruh hali ve depresyon, hormonal kontraseptif kullanımının iyi bilinen istenmeyen etkileridir (bkz. bölüm 4.8). Depresyon ciddi olabilir ve intihara meyilli davranış ve intihar için iyi bilinen bir risk faktörüdür. Kadınların, duygudurum değişiklikleri ve tedaviye başladıktan hemen sonraortaya çıkan depresyon belirtileri durumunda doktorlarına başvurmaları önerilir. Kloazma Kloazma, özellikle kloazma gravidarum öyküsü olan kadınlarda bazen gelişebilir. Kloazmaya eğilimi olan kadınlar KOK kullandıkları sürece güneşe veya ultraviyole ışınlarına maruzkalmaktan kaçınmalıdırlar. Adet Değişiklikleri Adet akışının azalması: Bu anormal değildir ve bazı hastalarda olması beklenir. Aslında, daha önce yoğun adet yaşanan durumlarda faydalı bile olabilir. Adet gecikmesi: Bazen çekilme kanaması hiç meydana gelmeyebilir. Tabletler doğru alınmışsa, gebelik olası değildir. İkinci paketin sonunda çekilme kanaması gerçekleşmezse,bir sonraki pakete geçmeden önce gebelik olasılığının elenmesi gerekir. İntermenstrüel kanama: Özellikle ilk aylarda düzensiz kanama (lekelenme veya ani kanama) oluşabilir. Bu nedenle düzensiz kanamaların değerlendirmesi, ancak yaklaşık üç döngülük biradaptasyon süresinden sonra anlamlıdır. Önceden düzenli olan döngülerden sonra kanamadüzensizlikleri oluşursa veya devam ederse, hormonal olmayan nedenler göz önündebulundurulmalı malignite veya gebeliği dışlamak için gereken testler yapılmalıdır. Bunlararasında kürtaj da bulunabilir. Bazı kadınlar, oral kontraseptiflerin kesilmesinden sonra bilhassa bu koşulların kullanımdan önce mevcut olduğu durumlarda amenore veya oligomenore yaşayabilir. Kadınlara bu olasılıkhakkında bilgi verilmelidir. Dolaşım bozuklukları ile ilgili advers etkilerin ortaya çıkma riski özellikle 35 yaş üzeri ve sigara içen kadınlarda yüksektir. ALT artışları Hepatit C virüsü (HCV) enfeksiyonları için tedavi gören hastalarda, ribavirin ile veya ribavirin olmadan, ombitasvir/paritaprevir/ritonavir ve dasabuvir içeren tıbbi ürünlerle yapılanklinik çalışmalar sırasında, normalin üst sınırının (ULN) 5 katından fazla transaminaz (ALT)yükselmeleri, kombine hormonal kontraseptifler (CHC'ler) gibi etinilestradiol içeren ilaçlarkullanan kadınlarda önemli ölçüde daha sık meydana gelmiştir (bkz. bölüm 4.3 ve 4.5). 1 Bu insidanslar, levonorgestrel içeren KOK'lara kıyasla farklı ürünlere ait göreceli riskler kullanılarakepidemiyolojik çalışma verilerinin toplamından hesaplanmştır.2 10.000 yıl/kadın başına 5-7 aralığının orta noktası, levonorgestrel içeren KOK'lara karşılık ilaç kullanmamaiçin göreceli riske dayalı olarak yaklaşık 2,3 ila 3,6.Laktoz: Her bir tablet 37,430 mg laktoz içerir. Galaktozemi gibi ender bir kalıtımsal tablo olan galaktoz intoleranslı hastalar bu ilacı kullanmamalıdır. Nadir kalıtımsal galaktoz intoleransı, 12Lapp laktoz yetmezliği ya da glukoz galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmaması gerekir. Sukroz: Her bir tablet 19.660 mg sukroz içerir. Nadir kalıtımsal fruktoz intoleransı, glikoz-galaktoz malabsorpsiyon veya sükraz-izomaltaz yetmezliği problemi olan hastaların bu ilacıkullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriEnzim İndükleyicileri Mikromozal enzimleri indükleyen ilaçlar (özellikle sitokrom P450 3A4) ile arasındaki etkileşimler seks hormonu klerensinde artışa neden olabilir, bu durum da ara kanamayave/veya kontraseptif başarısızlığa yol açabilirler. Birkaç günlük tedavinin ardından enzim indüksiyonu gözlemlenebilir. En fazla enzim indüksiyonu genellikle birkaç hafta içinde görülür. Enzim indüksiyonu, ilaç tedavisininkesilmesinin ardından 4 hafta kadar sürebilir. Belirtilen ilaçlardan herhangi biri ile tedavi edilmekte olan kadınlar, KOK'a ek geçici bir bariyer yöntemi kullanmalı ya da başka bir kontrasepsiyon yöntemi seçmelidirler. İlaçlar ilebirlikte kullanımları süresince ve tedavinin kesilmesini takiben 28 gün boyunca bariyeryöntemi kullanmalıdırlar. Eğer bariyer yöntemi kullanılan dönem KOK kutusundakitabletlerin bitiminden sonra devam ediyorsa, bir sonraki kutuya ara vermeden devamedilmelidir. Bu durumda, ikinci paketin sonuna kadar çekilme kanaması beklenmemelidir.Hasta, ikinci paketin bitiminden sonraki tablet kullanılmayan dönemde çekilme kanamasıyaşamazsa, sonraki pakete devam etmeden önce gebelik olasılığının elenmesi gerekir. Enzim indükleyicilerle uzun süreli tedavi alan kadınlar için, başka bir kontrasepsiyon yöntemi kullanılmalıdır. Aşağıdakilerin KOK'larla klinik olarak anlamlı etkileşimlerinin olduğu gösterilmiştir: Antikonvülsanlar: barbitüratlar (fenobarbital dahil), primidon, fenitoin, karbamazepin, okskarbazepin, topiramat. Antibiyotikler/antifungaller: griseofulvin, rifampisin. Bitkisel ilaçlar: St John's wort (kantaron - Hypericum perforatum) Antiretroviral ajanlar: ritonavir, nelfinavir, nevirapin. Not: Cinsiyet hormonlarının plazma konsantrasyonunu artırabilen başka antiretroviral ajanlar da vardır. KOK klerensini azaltan maddeler (enzim inhibitörleri): Azol antifungaller (örn. itrakonazol, vorikonazol, flukonazol), verapamil, makrolidler (örn. klaritromisin, eritromisin), diltiazem ve greyfurt suyu gibi kuvvetli ve orta düzeyde CYP3A4inhibitörleri östrojen veya progesteron veya her ikisinin de plazma konsantrasyonunuartırabilir. 1360 - 120 mg/gün etorikoksib dozlarının 0,035 mg etinilestradiol içeren KHK ile eş zamanlı olarak alındığı takdirde etinilestradiolün plazma konsantrasyonlarını sırasıyla 1,4 - 1,6 katarttırdığı görülmüştür. KOK'ların diğer tıbbi ürünler üzerine etkisi: Oral kontraseptifler diğer bazı ilaçların metabolizmasını etkileyebilir. Buna bağlı olarak plazma ve doku konsantrasyonları artabilir (örn. siklosporin, tizanidin, teofilin) ya daazalabilir (örn. lamotrigin). Farmakodinamik etkileşimler Ribavirinli veya ribavirin içermeyen; Ombitasvir, paritaprevir, ritonavir ve dasabuvirin, kombinasyonlarını içeren tıbbi ürünlerin birlikte uygulanması ALT seviyelerinde artmariskini yükseltebilir (bkz. bölüm 4.3 ve bölüm 4.4). Bu nedenle, GINERA kullanıcıları, bu kombinasyon ilaç rejimiyle tedaviye başlamadan önce alternatif bir kontrasepsiyon yöntemine (örneğin, sadece progestajenle kontrasepsiyon veyahormonal olmayan yöntemler) geçmelidir. GINERA, bu kombinasyon ilaç rejimi ile tedavitamamlandıktan 2 hafta sonra yeniden başlatılabilir. Diğer etkileşim şekilleri: Laboratuvar Testleri Oral kontraseptiflerin kullanılması, örn. kortikosteroid bağlayıcı globulin ve lipid/lipoprotein fraksiyonları, karbonhidrat metabolizması parametreleri ve koagülasyon ve fibrinolizparametreleri gibi karaciğer, tiroid, adrenal ve renal fonksiyonun biyokimyasal parametreleridahil olmak üzere belirli laboratuvar testlerinin sonuçlarını etkileyebilir. Bu nedenlelaboratuvar testleri istendiğinde, laboratuvar personeline oral kontraseptif kullanımı hakkındabilgi verilmelidir. Not: Olası etkileşmeleri belirlemek amacıyla eşzamanlı kullanılacak ilacın prospektüsüne (kullanma talimatına) başvurulmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Özel popülasyonda etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:Pediyatrik popülasyonda etkileşim çalışması yapılmamıştır. 4.6. Gebelik ve laktasyonGenel Tavsiye:Gebelik kategorisi X. Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon):GINERA doğum kontrolü amacıyla kullanılmaktadır. Kullanıldığı sürece fertiliteyi engeller. Gebelik dönemi:GINERA'nın gebelikte kullanımı kontrendikedir. Gestoden ve etinilestradiol gebelik döneminde uygulandığı takdirde ciddi doğum kusurlarına yol açmaktadır. GINERA kullanımı sırasında gebelik meydana gelmesi durumunda kullanım durdurulmalıdır. Ancak, yaygın epidemiyolojik çalışmalar ne gebeliğinden önce KOK kullanmış olan 14kadınların çocuklarında doğumsal kusur riskinde herhangi bir artışı ne de erken gebeliği süresince yanlışlıkla KOK kullanıldığında oluşan bir teratojenik etkiyi göstermemiştir.GINERA kullanımına yeniden başlarken postpartum dönemi sırasında artan VTE riski dikkatealınmalıdır (bkz. bölüm 4.2 ve bölüm 4.4.) Laktasyon dönemi:GINERA'nın emzirme döneminde kullanılması üretilen süt hacminde azalmaya ve bileşiminde değişikliğe neden olabilir. Etkin maddelerin çok küçük bir miktarı sütle atılır. Bumiktar, çocuğu özellikle doğumdan sonraki ilk 6 hafta içinde etkiler. Emziren annelere, başkabir kontrasepsiyon yöntemi kullanmaları önerilebilir. Üreme yeteneği / Fertilite:GINERA bir KHK'dır. Kullanıldığı sürece fertiliteyi engeller. 4.7. Araç ve makine kullanımı üzerindeki etkilerGINERA'nın araç ve makine kullanma becerileri üzerinde bilinen bir etkisi bulunmamaktadır. 4.8. İstenmeyen etkilerGINERA ile en yaygın olarak bildirilen advers reaksiyonlar mide bulantısı, abdominal ağrı, kilo artışı, baş ağrısı, depresif ruh hali, duygu durum bozukluğu, meme ağrısı, memehassasiyetidir. Kullanıcıların > %1'inde meydana gelir. Ciddi advers reaksiyonlar ATE ve VTE'dir. Pazarlama sonrası raporlanan advers reaksiyonlarBağışıklık sistemi hastalıklarıKalıtsal anjiyoödemin alevlenmesi Sinir sistemi hastalıklarıKorenin alevlenmesi Gastrointestinal hastalıklarÜlseratif kolit Hepatobiliyer hastalıklarKaraciğer fonksiyon bozuklukları Deri ve deri altı doku bozuklukları:Kloazma Üreme sistemi ve meme hastalıklarıAzalmış adet kanaması, lekelenme, ani kanama, çekilme kanaması yoksunluğu, tablet sonrası amenore Advers reaksiyonlar, aşağıda sistem-organ sınıfı (MedDRA) ve sıklık derecesine göre listelenmektedir. Sıklık dereceleri şu şekilde tanımlanmaktadır; çok yaygın (>1/10), yaygın(>1/100, <1/10), yaygın olmayan (>1/1.000, <1/100), seyrek (>1/10.000 ila <1/1.000), çokseyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). 15Bağışıklık sistemi hastalıklarıSeyrek: Aşırı duyarlılık Metabolizma ve beslenme hastalıklarıYaygın olmayan: Sıvı tutulumu Psikiyatrik hastalıklarYaygın: Depresif duygu durumu, duygu durum değişiklikleri Yaygın olmayan: Libido azalmasıSeyrek: Libido artışı Sinir sistemi hastalıklarıYaygın: Baş ağrısı Yaygın olmayan: Migren Göz hastalıklarıSeyrek: Kontakt lens intoleransı Gastrointestinal hastalıklarYaygın: Bulantı, karın ağrısı Yaygın olmayan: Kusma, diyare Vasküler hastalıklarıSeyrek: Venöz tromboembolizm (VTE), arteryel tromboembolizm (ATE) Deri ve deri altı doku hastalıklarıYaygın olmayan: Döküntü, ürtikerSeyrek: Eritema nodozum, eritema multiforme Üreme sistemi ve meme hastalıklarıYaygın: Meme ağrısı, meme hassasiyeti Yaygın olmayan: Memede hipertrofiSeyrek: Vajinal akıntı, memede akıntı AraştırmalarYaygın: Kiloda artış Seyrek: Kilo kaybı Seçilmiş advers reaksiyonların tanımı KHK kullanan kadınlarda 4.4 Özel kullanım uyarıları ve önlemleri bölümünde daha ayrıntılı olarak ele alınmış miyokard infarktüsü, inme, geçici iskemik ataklar, venöz tromboz vepulmoner emboli dahil olmak üzere arteriyel ve venöz trombotik ve tromboembolik olaylardaartış riski gözlemlenmiştir. KOK kullanan kadınlarda bildirilen, 4.4 Özel kullanım uyarıları ve önlemleri bölümünde bahsi geçen ciddi advers olaylar: Venöz tromboembolik bozukluklar Arteriyel tromboembolik bozukluklar İnme (örneğin geçici iskemik atak, iskemik inme, hemorajik inme) Hipertansiyon 16 Hipertrigliseridemi Karaciğer tümörleri (benign ve malign) Meme kanseri tanı sıklığı oral kontraseptif kullananlarda çok hafif düzeyde artmıştır. Meme kanseri 40 yaşın altındaki kadınlarda nadir görüldüğünden, aşırı rakam genel meme kanseririskiyle ilişkili olarak küçüktür. KOK kullanımıyla neden sonuç ilişkisi bilinmemektedir.Ayrıca bkz. bölüm 4.3 ve 4.4. Gebelikte veya önceki KOK kullanımı sırasında bildirilen kötüleşen durumlar Kolestazla ilgili sarılık ve/veya kaşıntı; safra taşı oluşumu; sistemik lupus eritematozus;herpes gestasyonis; duyma kaybıyla ilişkili otoskleroz; crohn hastalığı; orak hücreli anemi;böbrek yetmezliği; kalıtsal anjiyoödem; porfiri; rahim ağzı kanseri. KOK kullanan kadınlarda glukoz toleransındaki değişiklikler veya periferik insülin direnci üzerindeki etki bildirilmiştir (bkz. bölüm 4.4). Şüpheli advers reaksiyonların raporlanması:Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: [email protected] ; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiDoz aşımına bağlı bildirilen ciddi yan etki yoktur. Görülebilecek belirtiler, bulantı, kusma ve çekilme kanamasıdır. Çekilme kanaması, ilacı yanlışlıkla almaları halinde kız çocuklarındamenarştan önce bile görülebilir. Antidotu yoktur ve tedavisi semptomatik olmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Östrojenler ve progestojenler, fiks kombinasyonlar ATC kodu: G03AA10 Etki mekanizması Bu östrojen-progestojen kombinasyonu, luteinizan hormonun orta döngü artışını bastırarak yumurtlamayı inhibe etmek, rahim ağzı mukusunu dehidrasyon yoluyla koyultarak sperm içinbir bariyer oluşturmak ve endometriyumu implantasyona kapalı hale getirmek suretiyle etkigösterir. Ruhsatlandırma sonrası güvenlilik çalışması (PASS) VTE tanısı sıklığının düşük östrojen dozlu (<50 pg etinilestradiol) KOK kullanıcılarında yılda 7 ila 10/10000 aralığında olduğugösterilmiştir. En yeni veriler VTE tanısı sıklığının gebe olmayan KOK kullanmayan kişilerdeyılda yaklaşık 4/10000, gebe kadınlarda ya da post partum süreçte ise 20 ila 30/10 000olduğunu ileri sürmektedir. KOK kullanımı ile ilişkili VTE riski östrojen bileşeninden kaynaklanır. KOK'ların progesteron bileşeni tarafından VTE riski üzerinde herhangi bir modüle etki ettiği halentartışılmaktadır. Etinilestradiol/gestoden içeren KOK'ların levonorgestrel içeren KOK'larakıyasla VTE risk artışını gösteren epidemiyolojik çalışmalar VTE riskinin hiç artmadığınıveya 3 kata kadar arttırdığını gösteren farklı sonuçlar bildirmiştir. 17KOK'lar gebelikten korumalarının yanı sıra, sahip oldukları bazı olumsuz özellikler dışında (Bkz. 4.4 Özel kullanım uyarıları ve önlemleri, 4.8. İstenmeyen Etkiler) doğum kontrolyöntemi seçmede yönlendirici olabilecek ek yararlar sunabilmektedir. Sikluslar daha düzenli,kanamalar sıklıkla daha az ağrılı ve daha hafiftir. Kanamaların daha hafif olması demiryetmezliği görülme olasılığını azaltır. Bunların dışında, endometriyum ile ovaryumkanserlerinde azalma gösterilmiştir. Ayrıca, daha yüksek dozlu KOK'ların (0.,05 mgetinilestradiol), ovaryum kistlerinde, pelvik inflamatuvar hastalık, benign meme hastalığı veektopik gebelik görülme sıklıklarında azalma sağladığı gösterilmiştir. Bunların düşük dozKOK'lar için de geçerli olduğu henüz gösterilmemiştir. 5.2. Farmakokinetik özelliklerGenel özelliklerGestoden Emilim:Ağızdan alınan gestoden hızla ve tamamen emilir. Tek alımı takiben yaklaşık 1 saat sonra 4 ng/ml olan enyüksekplazma konsantrasyonlarına ulaşılır. Gestodeninmutlak biyoyararlanımı, uygulanan dozun %99'u olarak belirlenmiştir. Dağılım:Gestodenin belirgin dağılım hacmi 0,7 l/kg olarak belirlenmiştir. Gestoden serum albuminine ve seks hormonubağlayıcıglobuline (SHBG) bağlanır. Yaklaşık olarak % 50-70oranında spesifik olarak SHBG'lere bağlanır ve total serum düzeylerinin yalnızca %1-2'siserbest steroid halinde bulunur. Bağıl dağılım (serbest,albümine bağlı, SHBG'ye bağlı) serumdakiSHBG konsantrasyonlarına bağlıdır. Bağlayıcı proteinin indüklenmesinin ardından, bağlanmamış ve albümine bağlı fraksiyonlar azalırken, SHBG'ye bağlı fraksiyon artar. Biyotransformasyon:Biyotransformasyon, steroid metabolizmasının bilinen yolaklarını takip eder. Bilinen farmakolojik olarak aktif metabolit bulunmamaktadır. Serumdan metabolik klerens oranıyaklaşık 0.8 ml/dak/kg olarak belirlenmiştir. Eliminasyon:Gestoden serum düzeyleri iki fazda azalır. Terminal dispozisyon fazı 12-15 saatlik bir yarılanma ömrü ile karakterize edilir. Gestoden, değişmemiş formda değil, yaklaşık 1 günlükbir yarılanma ömrü ile elimine edilen metabolitler olarak atılır. Gestoden metabolitleriyaklaşık 6: 4 olan idrar/safra oranında atılır. Doğrusallık / doğrusal olmayan durum:Günlük GİNERA uygulamasının tekrarlanmasının ardından, serumdaki gestoden konsantrasyonları 2.8 kat artmaktadır. Ortalama serum seviyeleri, tedavi döngüsünün ikinciyarısı boyunca ulaşılan kararlı durum koşullarında dört kat daha fazladır. Gestodenfarmakokinetiği SHBG serum seviyelerinden etkilenir. GİNERA ile tedavi sırasında, ilktedavi döngüsünde serum SHBG seviyelerinde üç katlık bir artış gözlemlenmiştir. Gestoden,SHBG'ye spesifik olarak bağlandığı için SHBG seviyelerindeki artışa neredeyse paralel olarakgestoden serum seviyelerinde artış oluşur. Üç tedavi döngüsünden sonra, döngü başına SHBGindüksiyonunun kapsamı artık değişmez. 18Etinile stradiol Emilim:Oral olarak alınan etinilestradiol hızla ve tamamen emilir. GINERA'nın alınmasının ardından 1,4 saat içinde 82 pg/ml'lik maksimum ilaç seviyesi konsantrasyonuna erişilir. Dağılım:Etinilestradiol için yaklaşık 5 L/kg'lık görünür dağılım hacmi ve serumdan yaklaşık 5 ml/dak/kg'lik metabolik bir klerens hızı belirlenmiştir. Etinilestradiol, serum albüminineyüksek düzeyde bağlanır ancak spesifik olarak bağlanmaz. Yaklaşık %2'lik ilaç seviyeleribağlanmamış olarak kalır. Biyotrasformasyon:Etinilestradiol, absorpsiyon ve ilk karaciğer geçişi sırasında metabolize olarak mutlak ve değişken oral biyoyararlanımı azalır. Eliminasyon:Etinilestradiol serum seviyeleri, 1-2 saat ve yaklaşık 20 saatlik yarı ömür ile karakterize iki aşamada düşer. Analitik nedenlere bağlı olarak bu parametreler ancak daha yüksek dozlarınuygulanmasından sonra hesaplanabilir. Değişmeyen ilaç atılmaz. Etinilestradiol metabolitleri, yaklaşık 1 günlük bir yarı ömürle 4:6 olan idrar/safra oranında atılır. Doğrusallık / doğrusal olmayan durum:Serum ve günlük alım terminal dispozisyon evresinin yarılanma ömrüne göre, kararlı durum serum seviyelerine 3-4 gün sonra ulaşılmakta olup, kararlı durum seviyeleri tekli bir dozakıyasla %30-40 daha yüksektir. Laktasyon döneminde, günlük anne dozunun %0,02'si yenidoğana süt ile aktarılabilir. Etinilestradiolün sistemik yararlanımı, diğer ilaçlarca her iki yönde etkilenebilir. Bununla birlikte, yüksek dozlarda C vitamini ile etkileşim yoktur. Etinilestradiol, sürekli kullanımsırasında SHBG ve CBG'nin (kortikoid bağlayıcı globülin) hepatik sentezini indükler. AncakSHBG indüksiyonunun kapsamı, kimyasal yapıya ve eşzamanlı olarak uygulananprogestojenin dozuna göre değişir. GİNERA ile tedavi sırasında, serumdaki SHBGkonsantrasyonları, 69 nmol/L'den başlayıp birinci döngüde 198 nmol/L'ye ve üçüncü döngüde210 nmol/l'e yükselmiştir. Serum CBG konsantrasyonları 37 [jg/ml'den başlayıp ilk döngüde85 ^g/ml'ye çıkmış ve bundan sonra sabit kalmıştır. 5.3 Klinik öncesi güvenlilik verileriDiğer kontraseptif steroidlerle olduğu gibi etinilestradiol ve gestoden kombinasyonu, sıçan karaciğerinde artan neoplastik nodül insidansı ile ilişkilidir. Bunun insanla ilişkisibilinmemektedir. Uzun süreli oral kontraseptif kullananlarda nadiren kötü huylu karaciğertümörleri bildirilmiştir. İlacı reçete edeni ilgilendirebilecek ve KÜB'ün diğer ilgili bölümlerine henüz dahil edilmemiş olan başka klinik öncesi güvenlik verisi mevcut değildir. 196. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiLaktoz (sığır kaynaklı) Mısır nişastası Povidon 25.000 (PVP 25) Kalsiyum disodyum edetat Magnezyum stearatSukroz (şeker) Povidon 700.000 (PVP K 90) PEG 6000 Kalsiyum karbonatTalk Vaks E (Hoechst - Wachs) 6.2. GeçimsizliklerGeçerli değil. 6.2. Raf ömrü48 ay 6.4. Saklamaya yönelik özel tedbirler25°C altında oda sıcaklığında saklayınız. 6.5. Ambalajın niteliği ve içeriği:21 tabletlik takvimli Al/PVC blister ambalaj 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler:Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİBayer Türk Kimya San. Ltd. Şti. Fatih Sultan Mehmet Mah. Balkan Cad. No:53 34770 Ümraniye/İstanbulTel:(0216) 528 36 00 Faks: (0216) 645 39 50 8. RUHSAT NUMARASI2015/549 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsatlandırma tarihi : 06.02.1991 Ruhsat yenileme tarihi : 10.07.2015 10. KÜB'ÜN YENİLENME TARİHİ20 |
İlaç BilgileriGinera 75 Mcg/30 Mcg Kaplı TabletEtken Maddesi: Gestoden+etinilestradiol Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.