Oftamycin-dx %0.3 + %0.1 Steril Göz Damlası, Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIOFTAMYCİN-DX %0.3 + %0.1 steril göz damlası, çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMHer 1 m LEtkin madde:Tobramisin..............................................3 mg Deksametazon*.......................................1 mg 1 mg deksametazona eşdeğer 1,32 mg deksametazon sodyum fosfat Yardımcı madde(ler):Benzalkonyum klorür.........................0,1 mg Yardımcı maddeler için bölüm 6.1'e bakınız. 3. FARMASOTİK FORMSteril göz damlası Partikül içermeyen berrak ve renksiz çözelti. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarBir kortikosteroidin endike olduğu, süperfisyal bakteriyel infeksiyon veya bakteriyel oküler infeksiyon riski bulunan, steroidlere duyarlı inflamatuvar oküler vakalarda (örneğin palpebralve bulber konjonktivada, korneada ve göz küresinin ön segmentinde görülen inflamatuvardurumlar, kronik anterior üveit ve kimyasal, radyasyon ya da termal yanmalardankaynaklanan korneal yaralanma veya yabancı cisimlerin penetrasyonu) endikedir. Ayrıca katarakt ameliyatı sonrasında inflamasyon tedavisinde ve infeksiyon profilaksisinde de kullanılmaktadır. 4.2 Pozoloji ve uygulama şekliGöze uygulanır. Pozoloji/uygulama sıklığı ve süresi:Her dört ila altı saatte bir konjonktival keseye bir ya da iki damla damlatılır. İlk 24 ila 48 saatte doz her iki saatte bir ya da iki damlaya çıkartılabilir. Klinik belirtilerde düzelmegörülürse sıklık kademeli olarak azaltılır. Tedavinin erken bırakılmamasına dikkat edilmelidir. Ağır hastalıkta inflamasyon kontrol edilene kadar her saat bir ya da iki damla damlatılır ve 3 gün boyunca sıklık kademeli olarak her iki saatte bir ya da iki damlaya düşürülür; sonra 5 ila8 gün boyunca her 4 saatte bir ya da iki damla ve sonunda gerekli görülürse son 5 ila 8 günboyunca günde bir ya da iki damla damlatılır.
1 / 14 Katarakt ameliyatı sonrasında doz, ameliyattan sonraki günden itibaren 24 güne kadar günde dört kere bir damladır. Tedaviye ameliyattan önceki gün, günde dört kere bir damlaylabaşlanılabilir ve ameliyattan sonra bir damla, 23 güne kadar ise günde dört kere bir damlayladevam edilebilir. Gerekirse tedavinin ilk iki gününde sıklık her iki saatte bir damlayaçıkartılabilir. Göz içi basıncının düzenli olarak gözlenmesi tavsiye edilir. Uygulama şekli:Kullanmadan önce şişe iyice çalkalanmalıdır. Oküler kullanım içindir. OFTAMYCIN-DX göze damlatılarak kullanılır, göze enjekte edilmez. Kontaminasyonu önlemek için damlalık ucunun ve çözeltinin, göz kapağına, çevresine veya diğer yüzeylere değdirmemeye dikkat edilmelidir. Damlatmadan sonra göz kapağının yavaşça kapatılması ve nazolakrimal kanalın oklüzyonu tavsiye edilir. Bu önlem, oküler yoldan uygulanan tıbbi ürünün sistemik absorbsiyonunuazaltabilir ve sistemik yan etkilerin azalmasını sağlar.
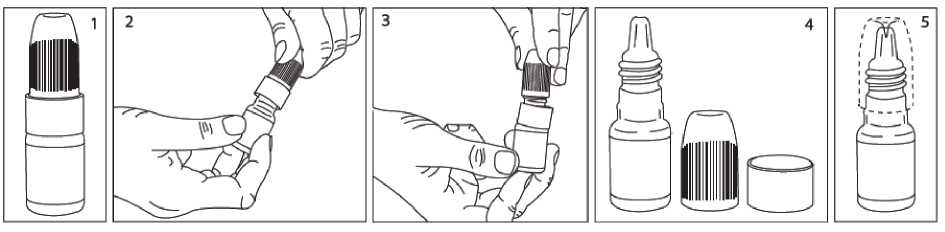
Hasta, ellerini yıkamalıdır. Şişenin kapağını açmalıdır. Kapağın altında bulunan halkayı çıkarmalıdır (bkz. Resim 3 ve Resim 4). Kapağı halka olmadan tekrar kapatmalıdır. Kapak içerisindeki plastik pin şişenin ucunu delecektir (bkz. Resim 5)
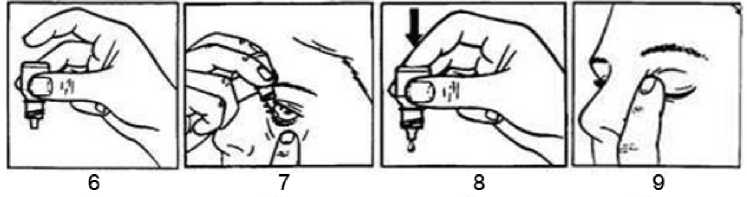
1. Kapak açılmalıdır. 2 / 14 3. Hasta başını arkaya yatırmalıdır. Göz kapağını temiz bir parmakla göz ve gözkapağı arasında bir 'cep' oluşana kadar aşağı çekmelidir. Damlalar buraya akacaktır (Resim 7). 4. Şişe ucu göze yaklaştırılmalıdır. Gerekirse ayna kullanılmalıdır. 5. Damlalık göze ya da gözkapağına, göz çevresine ve diğer yüzeylere değdirmemelidir. Damlaları etkileyebilir. 6. İşaret parmağının ters dönmüş kabın altına hafif bir baskısı bir defada bir damla OFTAMYCİN-DX'i düşürecektir (Resim 8). 7. OFTAMYCİN-DX'i kullandıktan sonra alt gözkapağı bırakılmalıdır, göz kapatılmalı vegözün burun tarafındaki köşesine parmakla hafif bastırılmalıdır (Resim 9). Bu,OFTAMYCİN-DX'in dışarı akmasını engeller. 8. Eğer iki göze de damlatılıyorsa, diğer göz için aynı adımlar tekrarlanmalıdır. 9. Kullandıktan hemen sonra şişenin kapağı sıkıca kapatılmalıdır. Eğer damla göze gelmezse, hasta yeniden denemelidir. Topikal yoldan uygulanan diğer oküler tıbbi ürünlerle birlikte kullanılması halinde, art arda iki uygulama arasında 5 dakikalık ara verilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:OFTAMYCİN-DX bu hasta popülasyonlarında çalışılmamıştır. Yine de, ürünün topikal uygulamasından sonra deksametazon ve tobramisinin sistemik absorbsiyonu düşükolacağından doz ayarlaması gerekli değildir. Pediyatrik popülasyon:Pediyatrik hastalarda kullanılmaz. (Bkz. Bölüm 4.4.) Bakteriyel kaynaklı eksternal oküler inflamasyon nedeniyle 7 gün süreyle tedavi edilen 2 yaşın altındaki çocuklardan elde edilen güvenlilik ve etkililik verileri mevcut değildir. OFTAMYCİN-DX'in, süt çocuğu ve küçük çocuklarda zorunlu kalınmadıkça kullanımı önerilmemektedir. Katarakt ameliyatı gerekecek pediyatrik hastalarda kullanma olasılığı değerlendirilebilir. Geriyatrik popülasyon:Yaşlılarda özel bir doz ayarlamasına gerek yoktur. 4.3 Kontrendikasyonlar Tobramisin, deksametazon veya bölüm 6.1'deki yardımcı maddelerden herhangi birinekarşı aşırı duyarlılık durumlarında, Epitelyal herpes simpleks keratiti (dendritik keratit), çiçek, suçiçeği ve kornea vekonjonktivanın diğer viral hastalıklarında,
3 / 14 Mycobacterium tuberculosis, Mycobacterium lepraeMycobacterium aviumgibi asidedirençli basiller nedeniyle oluşan, ancak bunlarla sınırlı olmayan mikobakteriyel gözenfeksiyonlarında, Oküler yapıların fungal hastalıklarında, Gözde tedavi edilmemiş iltihaplı infeksiyon durumlarında kontrendikedir. 4.4 Özel kullanım uyarıları ve önlemleriSadece topikal oftalmik kullanım içindir. Göze enjekte edilmez. Uzun süreli kullanım (klinik deneylerde kullanılan maksimum süreden [24 gün] daha uzun) ya da artırılan uygulama sıklığı, optik sinirde hasar ve görme keskinliği ile görme alanındaazalma ile sonuçlanan oküler hipertansiyon/glokom ve posterior subkapsüler kataraktoluşumuyla sonuçlanabilir. Sistemik ve topikal kortikosteroid kullanımıyla birlikte görmebozukluğu bildirilebilir. Hastada bulanık görme veya diğer görme bozuklukları gibisemptomlar görülürse, sistemik ve topikal kortikosteroidlerin kullanımından sonra bildirilenkatarakt, glokom veya santral seröz koryoretinopati (CSCR) gibi nadir hastalıklarındeğerlendirilmesi için hastanın bir göz doktoruna yönlendirilmesi düşünülmelidir. Duyarlıhastalarda artan göz içi basıncı alışılmış dozlarda bile ortaya çıkabilir. Uzun sürelikortikosteroid tedavisi alan hastaların intraoküler basıncı düzenli ve sık kontrol edilmelidir.Bu durum kortikosteroidle uyarılmış oküler hipertansiyon riskinin özellikle çocuklarda dahayüksek olması ve yetişkinlere göre daha erken ortaya çıkma nedeniyle önemlidir.OFTAMYCİN-DX pediyatrik hastalarda kullanım için onaylanmamıştır. Kortikosteroid kaynaklı artmış göz içi basınç ve/veya katarakt oluşumuna yatkın hastalarda (ör: diyabetik hastalarda) bu vakaların görülme riski daha fazladır. Oküler deksametazonun sistemik emilimi ile ilişkili Cushing sendromu ve/veya adrenal baskılanma, CYP3A4 inhibitörleri (ritonavir ve kobisistat dahil) ile tedavi edilen hastalar veçocuklar dahil yatkın hastalarda yoğun veya uzun süreli kesintisiz tedaviden sonra meydanagelebilir. Bu durumlarda tedavi dereceli olarak bırakılmalıdır. Diğer aminoglikozidler ile çapraz reaksiyonlar oluşabilir ve topikal oküler tobramisine duyarlı olan hastaların ayrıca diğer topikal ve/veya sistemik aminoglikozidlere duyarlı olabileceğidüşünülmelidir. Sistemik tobramisin tedavisi alan hastalarda nörotoksisite, ototoksisite ve nefrotoksisiteyi içeren ciddi advers reaksiyonlar görülmüştür. Eş zamanlı kullanılacaksa dikkatli olunmalıdır. Steroid tedavisinin kullanıldığı inatçı korneal ülserlerde fungal infeksiyon gelişmiş olma olasılığı dikkate alınmalıdır. Eğer fungal enfeksiyon gelişirse, steroid tedavisi kesilmelidir.Diğer antibiyotiklerde olduğu gibi, tobramisinin uzun süre kullanımı, mantarlar dahil tedaviyeduyarlı olmayan organizmaların aşırı üremesiyle sonuçlanabilir. Süperinfeksiyon oluşursa,uygun bir tedavi hemen başlatılmalıdır.
4 / 14 Uzun süreli kullanım, konak hücre yanıtını baskılamasından ötürü sekonder oküler infeksiyonlara da sebebiyet verebilir. Kortikosteroidler bakteriyel, viral, fungal veya parasitikinfeksiyonlara direnci azaltabilir, oluşumuna yardımcı olabilir ve infeksiyonun klinikbelirtilerini maskeleyebilir. İmmün cevabın baskılanmasının ardından sekonder bakteriyel oküler infeksiyon da görülebilmektedir. Kortikosteroid ilaçlar ile tedavi, gözün akut iltihaplı enfeksiyonlarınıgizleyebilir ya da azdırabilir. Kornea ya da skleranın incelmesine neden olan hastalıklarda,topikal steroidlerin kullanımıyla perforasyon meydana geldiği bilinmektedir. Bazı hastalarda topikal olarak uygulanan aminoglikozitlere karşı hassasiyet görülebilir. Hassasiyetin şiddeti, lokal etkilerden genel reaksiyonlara (örn. eritem, kaşınma, ürtiker, deridöküntüsü, anafilaktik reaksiyonlar ya da bullöz reaksiyonlar gibi) kadar değişkenlikgösterebilir. Eğer bir duyarlılık reaksiyonu oluşursa, ürünün kullanımı kesilmelidir. Göze topikal yoldan uygulanan kortikosteroidler, korneal yara iyileşmesini geciktirebilir. Topikal Non-Steroidal Antienflamatuvar İlaçlar'ın (NSAID) iyileşme üzerinde yavaşlatıcı vegeciktirici etkisi bilinmektedir. Topikal NSAID ve topikal steroid ilaçlar ile birlikte kullanımıpotansiyel iyileşme problemlerini arttırabilir. Kornea ya da skleranın incelmesine sebebiyetveren hastalıklarda topikal kortikosteroidlerin kullanımı ile perforasyonların görüldüğübilinmektedir. Hastalara oküler infeksiyon varken kontakt lens takmamaları tavsiye edilmelidir. OFTAMYCİN-DX göz damlası koruyucu olarak benzalkonyum klorür maddesiniiçerdiğinden, tahrişe neden olabilir ve yumuşak kontakt lenslerin renklerini bozduğu dabilinmektedir. Bu nedenle, hastalar OFTAMYCİN-DX uygulamasından önce kontakt lensleriçıkarmalı ve OFTAMYCİN-DX damlattıktan sonra kontakt lensleri takmadan önce 15 dakikabeklemeleri konusunda uyarılmalıdırlar. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriTopikal NSAID ve topikal steroid ilaçlar ile birlikte kullanımı potansiyel iyileşme problemlerini artırabilir. Ritonavir ile tedavi edilen hastalarda deksametazonun plazmakonsantrasyonları artabilir (Bkz. Bölüm 4.4). CYP3A4 inhibitörleri (ritonavir ve kobisistat dahil): deksametazon klirensini azaltarak artmış etkiler ve adrenal baskılanma/Cushing sendromu ile sonuçlanabilir. Faydalar artmış sistemikkortikosteroid yan etkileri riskine ağır basmadığı sürece kombinasyondan kaçınılmalıdır;kullanılması durumunda hastalar sistemik kortikosteroid etkileri açısından izlenmelidir. Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin hiçbir etkileşim çalışması yapılmamıştır.
5 / 14 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Tobramisin/deksametazon kombinasyonunun gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Çocuk doğurma potansiyeli olan kadınlar tedavi süresince etkili doğumkontrolü uygulamak zorundadır. Gebelik dönemiTobramisin/deksametazon kombinasyonunun gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik ve/veya embriyonel/fetal gelişim ve/veya doğum ve/veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (Bkz. Bölüm5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. OFTAMYCİN-DX gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Gebelik sırasında sadece potansiyel yarar, potansiyel fötal riskten fazlaysa kullanılmalıdır. Gebe kadınlara oral ve parenteral yoldan uygulanan aminoglikozitlerle (tobramisin dahil) ilgili bir çalışma, saptanabilir fötal risk olmadığını göstermiştir. Ancak, eğer gebelikdöneminde aminoglikozit alınmışsa, aminoglikozitlerin plasentaya geçmesi ya da fötus veyayeni doğanlar üzerinde etki etmesi göz önünde bulundurulmalıdır. Aminoglikozitlerin fötustateratojenik, ototoksik veya nefrotoksik olduğuna dair kesin kanıtlar olmasa bile, bu etkilerinolası olduğu varsayılmalıdır. Gebelik sırasında uzun süreli veya tekrarlanan kortikosteroidkullanımı, artmış intra-uterin büyüme geriliği riski ile ilişkilendirilmiştir. Gebelik esnasındaanlamlı dozlarda kortikosteroid kullanan gebelerin yenidoğan bebekleri hipoadrenalizminbelirtileri açısından dikkatle gözlemlenmelidir. Laktasyon dönemiSistemik olarak uygulanan kortikosteroidler insan sütüne geçmektedir ve büyümeyi baskılayabilir, endojen kortikosteroid üretimi ile etkileşebilir ya da diğer istenmeyen etkilereneden olabilir. Kortikosteroidlerin topikal uygulamasının insan sütünde tespit edilebilirmiktarlar üretmeye yeterli sistemik absorpsiyon sağlayıp sağlamayacağı bilinmemektedir.OFTAMYCİN-DX, potansiyel faydaları potansiyel riske ağır basmadıkça emzirme süresincekullanılmamalıdır. Üreme yeteneği/FertiliteTobramisinin insan ve hayvan fertilitesi üzerindeki etkilerini değerlendirmek için çalışma yapılmamıştır. Deksametazonun erkek veya dişi fertilitesi üzerindeki etkisini değerlendirmekiçin klinik veri sınırlıdır. Deksametazon, önceden koryonik gonadotropin uygulaması yapılansıçan modelinde fertilite üzerinde advers etkiye sahip olmamıştır.
6 / 14 4.7 Araç ve makine kullanımı üzerindeki etkilerOFTAMYCİN-DX'in araç ve makine kullanımı üzerine önemli bir etkisi yoktur. Diğer göz damlalarında olduğu gibi, geçici olarak bulanık görme ya da diğer görsel bozukluklar araba yada makine kullanımını etkileyebilir. İlaç damlatıldıktan sonra bulanık görme gelişirse hastaarabayı ya da makineyi kullanmadan önce görüntü netleşene kadar beklemelidir. 4.8 İstenmeyen etkiler1600'ün üzerinde hastanın katıldığı klinik çalışmalarda tobramisin/deksametazon kombinasyonu günde 6 defaya kadar uygulanmıştır. Yapılan bu klinik çalışmalardaTobramisin/deksametazon kombinsyonu ya da yardımcı maddeleri ile ilgili hiçbir ciddioftalmik ya da sistemik advers reaksiyon bildirilmemiştir. Tobramisin/deksametazonkombinasyonu ile ilgili en sık raporlanan advers etkiler; göz ağrısı, artmış göz içi basınç,gözde tahriş (damlatma sonrası yanma) ve göz kaşıntısıdır (hastaların %1'inden azındagelişmiştir). Aşağıdaki advers reaksiyonlar tobramisin/deksametazon kombinasyonu ile ilgili klinik çalışmalar ve pazarlama sonrası edinilen deneyimler esnasında rapor edilmiştir. Advers etkilerçok yaygın (>1/10), yaygın (>1/100 ila < 1/10), yaygın olmayan (>1/1.000 ila < 1/100), seyrek(>1/10.000 ila < 1/1.000), çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor) olarak listelenmiştir. Bağışıklık sistemi hastalıkları:Bilinmiyor: Hipersensivite, anafilaktik reaksiyonlar Sinir sistemi hastalıkları:Yaygın olmayan: Baş ağrısı Bilinmiyor: Sersemlik Göz hastalıkları:Yaygın olmayan: Seyrek: Bilinmiyor: Göz ağrısı, oküler kaşıntı, oküler rahatsızlık (damlatma sonrası geçici yanma ya da iğnelenme), oküler hipertansiyon, konjonktival ödem,artmış göz içi basıncı, gözde irritasyon Keratit, gözde alerji, bulanık görme (bkz. Bölüm 4.4), göz kuruluğu, oküler hiperemi Göz kapağında ödem, göz kapağı eritemi, midriyazis, gözyaşında artış Endokrin hastalıkları:Bilinmiyor: Adrenal baskılanma, Cushing sendromu (bkz. bölüm 4.4) Solunum, göğüs bozuklukları ve mediastinal hastalıklar:Yaygın olmayan: Rinore, laringospazm lelgeGastrointestinal hastalıklar:Belge Dcgeyrekodu: lRG83SHY3ZmTafcalmabo(zukluğu (disguzi)lge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys7 / 14 Bulantı, karında rahatsızlık
Bilinmiyor: Deri ve deri altı doku hastalıkları:Bilinmiyor: Döküntü, yüzde şişlik, eritema multiforme, pirürit Seçili Advers Reaksiyonların TanımıAşağıda belirtilen advers reaksiyonlar Deksametazon oftalmik süspansiyon kullanımım takiben gözlenmektedir:
Aşağıda belirtilen advers reaksiyonlar Tobramisin oftalmik süspansiyon kullanımını takiben gözlenmektedir:
Topikal oftalmik kortikosteroidlerin uzun süreli kullanımı, göz sinirinin hasar görmesi ile göz içi basıncının artması, görme keskinliğinin azalması ve görüş alanı kusurları, posteriorsubkapsüler katarakt oluşumu ve yara iyileşmesinin gecikmesi ile sonuçlanabilmektedir. Kortikosteroid bileşeni nedeniyle, korneanın ya da skleranın incelmesine neden olan hastalıklarda, özellikle uzun tedavilerden sonra olmak üzere daha yüksek bir perforasyon riskibulunmaktadır (Bkz Madde 4.4). Kortikosteroid ve antimikrobiyaller içeren kombinasyonların kullanımından sonra ikincil enfeksiyon gelişimi gerçekleşmiştir. Mantara bağlı kornea enfeksiyonları özellikle uzun sürelisteroid uygulamaları ile rastlantısal olarak gelişmeye yatkındır. Nörotoksisite, ototoksisite ve nefrotoksisite de dahil olmak üzere ciddi advers reaksiyonlar sistemik tobramisin tedavisi alan hastalarda görülmüştür.
8 / 14 Bazı hastalarda da topikal olarak uygulanan aminoglikozitlere karşı duyarlılık görülebilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr[email protected] Doz aşımı ve tedavisiBu ürünün özelliklerinden ötürü doz aşımı halinde (şişe içeriğinin kazara içilmesi halinde bile) toksik bir etki beklenmemektedir. OFTAMYCİN-DX'in doz aşımının klinik olarakbelirgin belirti ve semptomları (punktat keratit, eritem, gözyaşında artış, ödem ve gözkapağında kaşınma) bazı hastalarda görülen advers reaksiyon etkilerine benzeyebilir.OFTAMYCİN-DX'in topikal doz aşımı, gözlerden ılık suyla yıkanarak giderilebilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Göz ilaçları- antiinflamatuvar ve antiinfektif kombinasyonu; kortikosteroid ve antiinfektif kombinasyonları. ATC kodu: S01CA01 Deksametazon: Gözün inflamatuvar durumlarının tedavisinde kortikosteroidlerin etkililiği tespit edilmiştir. Kortikosteroidler anti-inflamatuvar etkilerini, vasküler endotel hücre adezyon moleküllerinin,siklooksijenaz I veya II'nin ve sitokin ekspresyonunun baskılanması yoluyla gösterir. Bu etki,pro-inflamatuvar mediyatörlerin azalmasıyla ve dolaşımdaki lökositlerin vasküler endoteleadezyonunun baskılanmasıyla sonuçlanır böylece iltihaplı oküler dokuda toplanmalarını önler.Deksametazon diğer bazı steroidlere kıyasla mineralokortikoid etkinliği daha az olan belirginbir anti-inflamatuvar etki gösteren en güçlü anti-inflamatuvar ajanlardan biridir. Tobramisin: Tobramisin güçlü, geniş spektrumlu, hızlı bakterisidal bir aminoglikozid antibiyotiktir. Ribozomda polipeptitlerin bir araya gelmesini ve sentezini inhibe ederek, bakteri hücreleriüzerindeki esas etkisini gösterir. Bu kombinasyonda tobramisin, duyarlı bakterilere karşıantibakteriyel koruma sağlamaktadır. Duyarlı organizmaları orta duyarlı organizmalardan, orta duyarlı organizmaları da dirençli organizmalardan ayıran aşağıdaki MIC kırılma noktalarının S (< 4 mcg/mL, R (> 8 mcg/mL)olduğu varsayılır: Direnç prevalansı, coğrafi olarak ve belli türler için zamana göre farklılıkgösterebilir ve özellikle ciddi enfeksiyonların tedavisinde direnç ile ilgili yerel bilgi istenir.Direncin lokal prevalansının, en azından bazı enfeksiyon tiplerinde ajanın yararlılığınınsorgulanabileceği şekilde olduğu durumlarda, gerektiğinde uzman tavsiyesi alınmalıdır.
9 / 14 Aşağıdaki bilgi, bakterilerin tobramisin/deksametazon kombinasyonunda bulunan tobramisine karşı duyarlı olup olmayacağı olasılıkları ile ilgili sadece tahmini bir yönlendirmede bulunur.İzolatları duyarlı ya da dirençli olarak sınıflandıran kırılma noktası tanımları, sistemik olarakuygulanan antibiyotiklerin klinik etkinliğini tahmin etmede faydalıdır. Bununla birlikte,antibiyotikler doğrudan enfeksiyon yerine topikal olarak çok yüksek konsantrasyonlardauygulandığında, bu kırılma noktaları geçerli olmayabilir. Sistemik kırılma noktaları tarafındandirençli olarak sınıflandırılacak çoğu izolat, gerçekte topikal olarak başarıyla tedavi edilir. İn vitroçalışmalar tobramisinin, aşağıdaki Tabloda listelenen yaygın oküler patojenler ile yaygın deri flora bakterilerinin çoğu cinsine karşı aktif olduğunu göstermiştir.
Metisiline direnç (R) sıklığı, bazı Avrupa ülkelerinde tüm stafilokokların %50'sine kadar olabilir. Pediyatrik Popülasyon:Tobramisin/deksametazon kombinasyonunun çocuklardaki güvenliliği ve etkinliği, geniş klinik deneyimler ile belirlenmiştir; ancak sadece sınırlı sayıda veri mevcuttur. Bakteriyelkonjonktivitlerin tedavisi için tobramisin/deksametazon kombinasyonu ile yapılan bir klinikçalışmada, yaşları 1 ila 17 arasında değişen 29 çocuk hasta, 5 ila 7 gün süreyle her 4 ila 6saatte bir 1 veya 2 damla tobramisin/deksametazon kombinasyonu ile tedavi edilmiştir. Buçalışmada, yetişkin ve çocuk hastalar arasında güvenlilik profilinde farklılık gözlenmemiştir. Diğer bilgiler:Gentamisin ve tobramisin gibi aminoglikozidler arasındaki çapraz direnç enzim modifikasyonları, Adeniltransferaz (ANT) ve Asetiltransferazın (ACC) özgüllüğüne bağlıdır.Bununla birlikte, aminoglikozid antibiyotikler arasındaki çapraz direnç, çeşitli modifiye edicienzimlerin farklılaşan özgüllüklerine bağlı olarak değişkenlik gösterir. Aminoglikozidlerekarşı kazanılmış direncin en yaygın mekanizması, plazmid ve transpozonla kodlanmışmodifiye edici enzimlerin antibiyotik inaktivasyonudur. 5.2 Farmakokinetik özelliklerGenel özelliklerTobramisin, suda kolayca çözünen ve kloroform ve eter gibi organik çözücülerde hemen hemen hiç çözünmeyen beyaz ya da beyazımsı tozdur. Deksametazon, suda hemen hemen hiç çözünmeyen beyaz ya da beyazımsı, kristal tozdur. Tobramisin:Hayvanlar üzerinde yapılan çalışmalar tobramisinin, oküler uygulamayı takiben korneadan absorbe olduğunu göstermiştir. Renal fonksiyonu normal olan hastalara sistemik uygulamasonrasında, yaklaşık 2 saatlik bir plazma yarılanma ömrü gözlenmiştir. Tobramisin, varsa çokaz biyotransformasyon ile neredeyse sadece glomerüler filtrasyon ile elimine edilir. 2 günlüktopikal oküler tobramisin/deksametazon kombinasyonu rejimi sonrasında tobramisinin plazma
11 / 14 konsantrasyonları, çoğu gönüllüde ölçüm sınırının altında ya da düşük düzeyde (<0,25 mikrogram/ml) olmuştur. Deksametazon:Oküler uygulamayı takiben, deksametazon, korneada ve göz sıvısında 1-2 saat içinde ulaşılan maksimum konsantrasyonlar ile göze absorbe olur. Deksametazonun plazma yarılanma ömrüyaklaşık 3 saattir. Deksametazon metabolitler gibi geniş ölçüde elimine edilir.Tobramisin/deksametazon kombinasyonu topikal oküler uygulamasını takiben deksametazonasistemik maruziyet düşüktür. Son topikal dozdan sonraki deksametazon pik plazma seviyeleri,art arda iki gün boyunca günde dört kere her göze birer damla tobramisin/deksametazonuygulanmasının ardından 220 ila 888 pg/ml (ortalama 555 ± 217 pg/ml) arasında değişmiştir. Doğrusallık / Doğrusal olmayan durum:Tobramisinin topikal oküler uygulamasının ardından artan tobramisin doz konsantrasyonlarıyla oküler veya sistemik maruziyet test edilmemiştir. Bu nedenle, topikal oküler dozla maruziyetin doğrusallığı belirlenememiştir. %0,3 tobramisinle %0,033 topikaloküler doz konsantrasyonunda Deksametazon için ortalama Cmaks, yaklaşık 25 ng/mLdeğerinde tobramisin/deksametazonun daha düşük görünmüştür; fakat bu düşüş dozla orantılıolmamıştır. Hastalardaki karakteristik özellikler Böbrek/karaciğer yetmezliğiBu hasta gruplarında tobramisinin ve deksametazonun farmakokinetiği çalışılmamıştır. Pediyatrik popülasyonTopikal oküler tobramisin dahil olmak üzere, aminoglikozitler çocuklar, bebekler ve yenidoğanlarda ciddi gram-negatif enfeksiyonları tedavi etmek için yaygın olarakkullanılmıştır. Tobramisinin çocuklardaki klinik farmakolojisi, sistemik uygulamanınardından tanımlanmıştır. İntravenöz dozlama ardından, deksametazon pediyatrik hastalardaki farmakokinetiğinin, yetişkinlerden farklılık göstermediği görülmektedir. Geriyatrik popülasyonYetişkinler ve yaşlılar arasında klinik açından herhangi bir güvenlilik ve etkililik farkı gözlemlenmemiştir. 5.3 Klinik öncesi güvenlilik verileriKlinik dışı veriler, geleneksel yinelenen doz topikal oküler toksisite çalışmaları, genotoksisite veya karsinojenisite çalışmalarına dayanılarak, tobramisin veya deksametazona topikal okülermaruziyetin insanlar için özel bir tehlike oluşturmadığını göstermiştir. Tobramisin vedeksametazon ile klinik dışı reprodüktif ve gelişimsel çalışmalardaki etkiler, sadecemaksimum insan oküler dozajından yeterli ölçüde fazla olduğu düşünülen maruziyetlerde
12 / 14 gözlemlenmiştir ve düşük dozda kısa süreli tedavi seyirleri için klinik kullanım açısından az oranda anlamlılık ortaya koymuştur. Tobramisinin, sıçanlarda veya tavşanlarda teratojenisiteye neden olduğu gösterilmemiştir. % 0,1 deksametazonun oküler uygulaması tavşanlarda fötal anomaliye neden olmuştur.Deksametazonun koryonik gonadotropin ile aşılanmış sıçan modelinde kadın fertilitesiüzerinde olumsuz bir etkisi yoktur. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiBenzalkonyum klorür TiloksapolSodyum klorürSusuz sodyum sülfatBorik asit Sodyum hidroksit (pH ayarı için) Sülfürik asit (pH ayarı için) Enjeksiyonluk su 6.2 GeçimsizliklerGeçerli değildir. Geçimsizlik konusunda spesifik çalışmalar yapılmamıştır. 6.3 Raf ömrü24 ay 6.4 Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız. Buzdolabına koymayınız. Şişe bir kez açıldıktan sonra 28 gün içerisinde kullanılmalıdır. Şişe dik konumda saklanmalıdır. Kullandıktan sonra şişe sıkıca kapatılmalıdır. 6.5 Ambalajın niteliği ve içeriğiDamlalıklı iç tıpa, 5 mL'lik düşük yoğunluklu polietilen (LDPE) beyaz şişe ve çevirmeli beyaz kapak kullanılmıştır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİDEVA HOLDİNG A.Ş. Halkalı Merkez Mah. Basın Ekspres Cad. No: 1 34303 Küçükçekmece / İSTANBUL Tel: 0 212 692 92 92
13 / 14 E-mail: [email protected] 8. RUHSAT NUMARASI(LARI)2018/28 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 23.01.2018 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ14 / 14 |
İlaç BilgileriOftamycin-dx %0.3 + %0.1 Steril Göz Damlası, ÇözeltiEtken Maddesi: Tobramisin + Deksametazon Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.