Agrilor 60 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIAGRİLOR® 60 mg film kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Tikagrelor 60 mg Yardımcı maddeler:Yardımcı maddeler için bölüm 6.1' e bakınız. 3. FARMASÖTİK FORMFilm kaplı tabletPembe renkli bir yüzü 60T yazılı yuvarlak film kaplı tablet. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAsetil salisilik asit (ASA) ile birlikte uygulanan AGRİLOR®, yetişkinlerde; miyokard infarktüsü (Mİ) hikayesi olan (1-3 yıl içinde) ve aterotrombotik olay açısından yüksek risktaşıyan hastalarda aterotrombotik olayların önlenmesinde endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:AGRİLOR® kullanan hastalar ayrıca, spesifik olarak kontrendike olmadıkça günde bir kez ASA'nın 75-150 mg'lık düşük idame dozunu da kullanmalıdır. Miyokart infarktüsü öyküsü:1-3 yıl içinde Mİ öyküsü olan ve bir aterotrombotik olay açısından yüksek riskin söz konusuolduğu hastalarda uzatılmış tedavi gerektiğinde günde iki kez AGRİLOR® 60 mg doz önerilir(bkz. Bölüm 5.1). Aterotrombotik olay açısından yüksek riske sahip AKS hastalarındaAGRİLOR® 90 mg veya başka adenozin difosfat (ADP) reseptör inhibitörü ile ilk bir yıllıktedaviden sonra tedaviye ara vermeden devam tedavisi olarak başlanabilir. Tedaviye ayrıca Mİgeçirdikten sonraki 2 yıla kadar veya önceki ADP reseptör inhibitörü tedavisi durdurulduktansonraki bir yıl içinde de başlanabilir. 3 yılın ötesinde uzatılmış tedavide tikagrelor'ün etkililiğive güvenliliği ile ilgili sınırlı veri bulunmaktadır.Eğer tedavinin değiştirilmesi gerekli olursa ilk AGRİLOR® dozu, diğer antitrombositik ilacın son dozundan 24 saat sonra uygulanmalıdır. 1 / 26 Unutulan dozTedavide kesintilerden de kaçınılmalıdır. AGRİLOR®'un bir dozunu almayı unutan hastalar, planlanmış olan zamanda yalnızca bir adet tablet olan bir sonraki dozu almalıdır. Uygulama şekli:Oral kullanım içindir. AGRİLOR® yemeklerle birlikte veya aç karnına alınabilir. Tablet(ler)i bir bütün olarak yutamayan hastalar için, tabletler ince toz haline gelecek şekilde ezilip yarım bardak suda karıştırılarak hemen içilebilir. Takibinde boş bardak yarım bardak suile çalkalanıp kalan içerik de içilmelidir. Karışım ayrıca nazogastrik tüp (CH8 veya dahabüyüğü) ile uygulanabilir. Karışımın uygulanmasından sonra nazogastrik tüpü su ile durulamakönemlidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda doz ayarlaması gerekli değildir (bkz. Bölüm 5.2).Karaciğer yetmezliği:Ağır derecede karaciğer yetmezliği olan hastalarda tikagrelor çalışılmamıştır ve tikagrelorun bu hastalarda kullanılması kontrendikedir (bkz. Bölüm 4.3). Orta derecede karaciğer yetmezliğiolan hastaların tedavisinde sınırlı bilgi mevcuttur. Doz ayarlamasına gerek yoktur, ancaktikagrelor dikkatli kullanılmalıdır (bkz. Bölüm 4.4 ve 5.2). Hafif karaciğer yetmezliği olanhastalarda doz ayarlaması gerekli değildir (bkz. Bölüm 4.4 ve Bölüm 5.2). Pediyatrik popülasyon:Tikagrelorun 18 yaşın altındaki çocuklarda güvenliliği ve etkililiği belirlenmemiştir. Herhangi bir veri mevcut değildir. Geriyatrik popülasyon:Yaşlı hastalarda doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). 4.3. Kontrendikasyonlar Tikagrelore veya Bölüm 6.1'de listelenen yardımcı maddelerin herhangi birine karşıaşırı duyarlılık (bkz. Bölüm 4.8), Aktif patolojik kanama, İntrakraniyal hemoraji öyküsü (bkz. Bölüm 4.8), Ağır derecede karaciğer yetmezliği (bkz. Bölüm 4.2, Bölüm 4.4 ve Bölüm 5.2). Eşzamanlı uygulama tikagrelore maruziyette belirgin bir artışa neden olabileceği için,güçlü CYP3A4 inhibitörleri (örn., ketokonazol, klaritromisin, nefazodon, ritonavir veatazanavir) ile tikagrelorun birlikte kullanılması. 2 / 26 4.4. Özel kullanım uyarıları ve önlemleriKanama riski:Bilinen kanama riski artmış olan hastalarda tikagrelor kullanımı, aterotrombotik olayların önlenmesinden elde edilecek yarara karşı dengelenmelidir (bkz. Bölüm 4.8 ve Bölüm 5.1). Eğerklinik olarak endike ise, tikagrelor aşağıdaki hasta gruplarında dikkatli kullanılmalıdır: Kanama eğilimi olan hastalar (örn., yeni travma, yeni ameliyat, koagülasyonbozuklukları, aktif veya yeni gastrointestinal kanama). Aktif patolojik kanaması olanhastalarda ve intrakraniyal hemoraji öyküsü ve ağır derecede karaciğer yetmezliğiolanlarda tikagrelor kullanımı kontrendikedir (bkz. Bölüm 4.3). Kanama riskini artırabilen tıbbi ürünleri (örn., nonsteroidal antiinflamatuvar ilaçlar(NSAİİ'ler), oral antikoagülanlar ve/veya fibrinolitikler) tikagrelor dozundan sonra 24saat içinde eşzamanlı kullanan hastalar. Trombosit transfüzyonu sağlıklı gönüllülerde tikagrelorun antitrombosit etkisini tersine çevirmez ve kanaması bulunan hastalarda klinik yarar sağlaması mümkün değildir.Tikagrelorun desmopressin ile eşzamanlı olarak uygulanması temel kanama zamanınıazaltmadığı için, desmopressinin klinik kanama olaylarının tedavisinde etkili olması mümkündeğildir (bkz. Bölüm 4.5). Antifibrinolitik tedavi (aminokaproik asit veya traneksamik asit) ve/veya rekombinant faktör VIIa tedavisi hemostazı artırabilir. Kanamanın sebebi tanımlanıp kontrol altına alındıktan sonratikagrelor tedavisi yeniden başlatılabilir. Cerrahi:Hastalara, herhangi bir cerrahi işlem planlanmadan önce ve herhangi bir yeni tıbbi ürün kullanmadan önce, tikagrelor aldıkları konusunda hekimlerini ve diş hekimlerinibilgilendirmeleri konusunda tavsiye verilmelidir. Koroner arter bypass greft (KABG) operasyonu geçiren PLATO hastalarında, ameliyattan önceki birinci gün içinde ilaç kullanımı durdurulduğunda tikagrelor ile, klopidogrelden dahafazla kanama meydana gelmiş; ancak ameliyattan 2 veya daha fazla gün önce tedavidurdurulduktan sonra majör kanama olaylarının oranı klopidogrel ile karşılaştırıldığında benzerolmuştur (bkz. Bölüm 4.8). Eğer hastaya elektif cerrahi uygulanacaksa ve antitrombositik etkiistenmiyorsa, tikagrelor ameliyattan 5 gün önce kesilmelidir (bkz. Bölüm 5.1). Daha önce iskemik inme geçirmiş hastalar:Daha önce iskemik inme geçirmiş AKS hastaları, 12 aya kadar tikagrelor ile tedavi edilebilir (PLATO çalışması). PEGASUS çalışmasına daha önce iskemik inme geçirmiş Mİ öyküsü olan hastalar dahil edilmemiştir. Bu nedenle, veri yokluğu nedeniyle bu hastalarda bir yılı aşan tedaviönerilmemektedir. Karaciğer yetmezliği:Tikagrelor kullanımı ağır derecede karaciğer yetmezliği olan hastalarda kontrendikedir (bkz. Bölüm 4.2 ve Bölüm 4.3). Orta derecede karaciğer yetmezliği olan hastalarda tikagrelor ile 3 / 26 deneyim sınırlı olduğundan bu hastalarda dikkatli olunması tavsiye edilmektedir (bkz. Bölüm 4.2 ve Bölüm 5.2). Bradikardik olaylar için risk altında olan hastalar:Holter EKG takibi klopidogrele kıyasla tikagrelor ile uygulanan tedavi sırasında genellikle asemptomatik olan ventriküler duraklamaların sıklığında artış olduğunu göstermiştir.Bradikardik olay riski artan hastalar (örn., hasta sinüs sendromu, 2. veya 3. derece AV blokveya bradikardiye bağlı senkop gözlenen pacemaker olmayan hastalar) tikagrelorunetkililiğinin ve güvenliliğinin değerlendirildiği ana çalışmalardan hariç tutulmuştur. Bu sebeplesınırlı klinik deneyim nedeniyle, tikagrelor bu hastalarda dikkatli kulanılmalıdır (bkz. Bölüm5.1). Ek olarak, tikagrelor, bradikardiyi uyardığı bilinen tıbbi ürünlerle eşzamanlı olarak uygulandığında dikkatli olunmalıdır. Bununla birlikte, PLATO çalışmasında bradikardiyiuyardığı bilinen bir ya da daha fazla tıbbi ürünün (örn., %%33 kalsiyumkanal blokörleri diltiazem ve verapamil ve % 4 digoksin) eşzamanlı uygulanmasının ardındanklinik açıdan anlamlı advers reaksiyon kanıtı gözlenmemiştir (bkz. Bölüm 4.5).PLATO'da Holter alt çalışması sırasında, AKS'lerin akut fazı süresince klopidogrele kıyasla tikagrelor ile daha fazla hastada >3 saniyelik ventriküler duraklamalar ortaya çıkmıştır.Tikagrelor ile Holter tespitli ventriküler duraklamalardaki artış, genel çalışma popülasyonu ilekarşılaştırıldığında AKS'nin akut fazı sırasında kronik kalp yetmezliği (KKY) olan hastalardadaha yüksek bulunmuştur; fakat bu etki, tikagrelor ile birinci ayda ya da klopidogrel ilekarşılaştırıldığında gözlenmemiştir. Bu hasta popülasyonundaki bu dengesizlik ile ilişkili(senkop ya da pacemaker yerleştirmesi dahil) advers klinik sonuç bulunmamaktadır (bkz.Bölüm 5.1). Dispne:Dispne, tikagrelor ile tedavi edilen hastalarda bildirilmiştir. Şiddeti genellikle hafif ila orta arasında değişmiş ve sıklıkla tedavinin kesilmesini gerektirmeden düzelmiştir. Astım/KOAH(Kronik Obstrüktif Akciğer Hastalığı) hastalarında tikagrelor ile dispne olayının meydanagelmesindeki mutlak risk artmış olabilir. Tikagrelor, astım ve/veya KOAH öyküsü olanhastalarda dikkatle kullanılmalıdır. Mekanizma henüz aydınlatılmamıştır. Bir hastanın yeni,uzun süreli veya ağırlaşan dispne olayını bildirmesi durumunda, bu olay detaylıca araştırılmalıve tolere edilemezse tikagrelor tedavisi durdurulmalıdır. Daha fazla bilgi için Bölüm 4.8'ebakınız. Kreatinin yükselmeleri:Tikagrelor ile tedavi sırasında kreatinin düzeyleri yükselebilir. Mekanizma henüz aydınlatılmamıştır. Rutin tıbbi uygulamalara göre böbrek fonksiyonları kontrol edilmelidir.Ayrıca AKS hastalarında böbrek fonksiyonlarının, tikagrelor ile tedaviye başlandıktan bir aysonra, > 75 yaş hastalara, orta/şiddetli böbrek yetmezliği olan hastalara ve bir anjiyotensinreseptör blokörü (ARB) ile eşzamanlı tedavi alan hastalara özel dikkat gösterilerek kontroledilmesi önerilir. Ürik asit artışı:Tikagrelor ile tedavi sırasında hiperürisemi oluşabilir (bkz. Bölüm 4.8). Hiperürisemi ya da gut artriti öyküsü olan hastalarda dikkat edilmesi önerilir. İhtiyati tedbir olarak ürik asit nefropatisiolan hastalarda tikagrelor kullanımı tavsiye edilmez. 4 / 26 Trombotik Trombositopenik Purpura (TTP):Tikagrelor kullanımıyla ilgili olarak çok nadiren Trombotik Trombositopenik Purpura (TTP) bildirilmiştir. Nörolojik bulgular, böbrek disfonksiyonu ya da ateş ile ilişkili olabilentrombositopeni ve mikroanjiyopatik hemolitik anemi ile karakterizedir. TTP, plazmaferez dedahil acil tedavi gerektiren potansiyel olarak ölümcül bir durumdur. Diğer:İdame ASA dozu ve klopidogrele kıyasla tikagrelorun bağıl etkililiğinin araştırıldığı PLATO çalışmasında gözlenmiş olan bir ilişki temel alınarak, tikagrelor ve 300 mg üzerindeki ASA'nınyüksek idame dozunun eşzamanlı uygulanması önerilmemektedir (bkz. Bölüm 5.1). Tedavinin erken kesilmesi:AGRİLOR® dahil herhangi bir antitrombositik tedavinin erken kesilmesi, hastanın altta yatan hastalığına bağlı olarak kardiyovasküler (KV) ölüm, Mİ veya inme riskinde artışa nedenolabilir. Bu nedenle tedavinin erken kesilmesinden kaçınılmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriTikagrelor esasen bir CYP3A4 substratıdır ve zayıf bir CYP3A4 inhibitörüdür. Tikagrelor aynı zamanda bir P-glikoprotein (P-gp) substratı ve zayıf bir P-gp inhibitörüdür ve P-gpsubstratlarına maruziyeti artırabilir. Tıbbi ve diğer ürünlerin tikagrelor üzerindeki etkisiCYP3A4 inhibitörleri%%56 azaltmıştır. Diğer güçlüCYP3A4 inhibitörlerinin (klaritromisin, nefazadon, ritonavir ve atanazavir) benzer etkigöstermesi beklenmektedir ve bu nedenle güçlü CYP3A4 inhibitörlerinin tikagrelor ileaynı anda kullanılmaları kontrendikedir (bkz. Bölüm 4.3). Orta dereceli CYP3A4 inhibitörleri - Diltiazemin tikagrelor ile birlikte uygulanmasıtikagrelorun Cmaks değerini % 69, EAA değerini 2,7 kat artırmıştır ve aktif metabolitinCmaks değerini % 38 azaltmış, EAA değerini değiştirmemiştir. Tikagrelorun diltiazeminplazma düzeyleri üzerinde etkisi bulunmamaktadır. Diğer orta dereceli CYP3A4inhibitörlerinin (örn., amprenavir, aprepitant, eritromisin ve flukonazol) benzer biretkiye sahip olacağı beklenmektedir ve tikagrelor ile aynı anda uygulanabilirler. Her gün yüksek miktarlarda (3x200 ml) greyfurt suyu tüketimlerinin ardından tikagrelormaruziyetinde 2 kat artış gözlenmiştir. Bu boyutta bir maruziyet artışının çoğu hastadaklinik anlama sahip olması beklenmemektedir. CYP3A indükleyicileriRifampisinin tikagrelor ile birlikte uygulanması, tikagrelorun Cmaks ve EAA değerlerini sırasıyla % 73 ve % 86 azaltmıştır. Aktif metabolitin Cmaks değeri değişmemiş ve EAA değeri % 46azalmıştır. Diğer CYP3A indükleyicilerinin (örn., fenitoin, karbamazepin ve fenobarbital) 5 / 26 tikagrelore maruziyeti azaltması beklenmektedir. Tikagrelorun güçlü CYP3A indükleyicileri ile birlikte uygulanması, tikagrelor maruziyetini ve etkililiğini azaltabilir; bu nedenle tikagrelorile eşzamanlı olarak uygulanmaları tercih edilmez. Siklosporin (P-gp ve CYP3A inhibitörü)Tikagrelor ile siklosporinin (600 mg) birlikte uygulanması, tikagrelorun Cmaks ve EAA değerlerini sırasıyla 2,3 kat ve 2,8 kat artırmıştır. Siklosporin varlığında aktif metabolitin EAAdeğeri %32 artarken, Cmaks değeri % 15 azalmıştır.Tikagrelorun, potent P-glikoprotein (P-gp) inhibitörleri ve orta dereceli CYP3A4 inhibitörleri (örn., verapamil, kinidin) olan ve tikagrelor maruziyetini de artırabilecek diğer etkin maddelerleeşzamanlı kullanımına ilişkin veri mevcut değildir. Eğer bu tür bir birlikteliktenkaçınılamıyorsa, eşzamanlı uygulama dikkatle yapılmalıdır. DiğerleriKlinik farmakoloji etkileşim çalışmaları, tikagrelorun heparin, enoksaparin ve ASA veya desmopressin ile birlikte uygulanmasının, tek başına tikagrelor uygulanmasına kıyaslatikagrelor ya da aktif metabolitinin farmakokinetiği üzerinde veya ADP'nin (adenozin difosfat)indüklediği trombosit agregasyonu üzerinde herhangi bir etkisinin olmadığını göstermiştir.Klinik olarak endike olduğu takdirde, hemostazı değiştiren tıbbi ürünler tikagrelor ilekombinasyon halinde uygulanırken dikkatle kullanılmalıdır. Morfinle tedavi uygulanan AKS'li hastalarda tikagrelor ve aktif metabolitinin de aralarında olduğu oral P2Y 12 inhibitörlerine gecikmiş ve azalmış maruziyet gözlenmiştir (tikagrelormaruziyetinde % 35 azalma). Bu etkileşim azalmış gastrointestinal motiliteyle ilişkili olabilirve diğer opioidler için de geçerli olabilir. Bu durumun klinik önemi bilinmemektedir fakatveriler tikagrelor ve morfinin eşzamanlı uygulandığı hastalarda tikagrelorun etkililiğindeazalma olması potansiyeline işaret etmiştir. Morfinin durdurulamayacağı ve hızlı P2Y 12inhibisyonunun gerekli görüldüğü AKS'li hastalarda parenteral bir P2Y 12 inhibitörününkullanılması düşünülebilir. Tikagrelorun diğer tıbbi ürünler üzerinde etkisiCYP3A4 ile metabolize olan tıbbi ürünler Simvastatin- Tikagrelor ile simvastatinin birlikte uygulanması, simvastatinin Cmaksdeğerini % 81, EAA değerini % 56 artırmıştır ve bazı bireysel 2 ila 3 kat artışlarlabirlikte simvastatin asidin Cmaks değerini % 64 ve EAA değerini % 52 artırmıştır.Tikagrelorun günlük 40 mg'ı aşan simvastatin dozları ile birlikte uygulanması,simvastatinin advers etkilerinin ortaya çıkmasına yol açabilir ve böyle uygulamalarapotansiyel yararlarla karşılaştırma yapılarak karar verilmelidir. Simvastatinin tikagrelorplazma düzeyleri üzerinde etkisi bulunmamaktadır. Tikagrelor lovastatin üzerinde debenzer etki gösterebilir. Tikagrelorun 40 mg'ın üzerindeki simvastatin veya lovastatindozları ile eşzamanlı kullanılması önerilmez. Atorvastatin -Atorvastatin ve tikagrelorun birlikte uygulanması, atorvastatin asidinCmaks değerini % 23 ve EAA değerini % 36 artırmıştır. Tüm atorvastatin asitmetabolitleri için EAA ve Cmaks'ta benzer artışlar gözlenmiştir. Bu artışların klinikaçıdan anlamlı olmadığı düşünülmektedir.6 / 26 CYP3A4 tarafından metabolize olan diğer statinler üzerinde benzer bir etki çıkması ayrı tutulamaz. PLATO çalışmasında yer alan ve tikagrelor kullanan hastalar çeşitli statinlerkullanmış olup, bu tıbbi ürünleri alan PLATO kohort grubunun %93'ünde statingüvenliliği ile ilişkili endişe söz konusu olmamıştır.Tikagrelor hafif bir CYP3A4 inhibitörüdür. Tikagrelor ile dar terapötik indekse sahip CYP3A4 substratlarının (yani sisaprid veya ergot alkaloidleri) birlikte uygulanması önerilmez; çünkütikagrelor bu tıbbi ürünlere maruziyeti artırabilir. P-glikoprotein (P-gp) substratları (digoksin, siklosporin dahil)Eşzamanlı tikagrelor uygulaması digoksinin Cmaks değerini % 75 ve EAA değerini % 28 artırmıştır. Tikagrelor ile eşzamanlı uygulamanın ardından ortalama taban digoksin düzeyleriyaklaşık olarak % 30 artmış, bazı kişilerdeki artış maksimum 2 kata kadar ulaşmıştır. Digoksinvarlığında tikagrelorun ve aktif metabolitinin Cmaks ve EAA değerleri etkilenmemiştir. Bunedenle, digoksin gibi dar terapötik indekse sahip olan ve P-gp bağımlı tıbbi ürünlerin tikagrelorile eşzamanlı uygulanmasında uygun klinik ve/veya laboratuvar takibinin yapılmasıönerilmektedir. Tikagrelorun siklosporin kan düzeyleri üzerinde etkisi olmamıştır. Tikagrelorun diğer P-gp substratları üzerindeki etkisi çalışılmamıştır. CYP2C9 ile metabolize olan tıbbi ürünlerTikagrelorun tolbutamid ile birlikte uygulanması, her iki tıbbi ürünün de plazma düzeylerini değiştirmemiş, bu da tikagrelorun CYP2C9 inhibitörü olmadığı ve varfarin ve tolbutamid gibiCYP2C9 bağımlı metabolize olan tıbbi ürünlerin metabolizmasını değiştirmeyeceği izleniminivermiştir. Oral kontraseptiflerTikagrelorun levonorgestrel ve etinil estradiol ile birlikte uygulanması etinil estradiol maruziyetini yaklaşık % 20 artırmış; fakat levonorgestrelin farmakokinetiğini değiştirmemiştir.Levonorgestrel ve etinil estradiol tikagrelor ile birlikte uygulandığında oral kontraseptifinetkililiği üzerinde klinik olarak ilişkili bir etki beklenmemektedir. Bradikardiyi indüklediği bilinen tıbbi ürünlerÇoğunlukla asemptomatik olan ventriküler duraklamalar ve bradikardi gözlemleri nedeniyle, tikagrelorun bradikardiyi uyardığı bilinen tıbbi ürünler ile eşzamanlı uygulanması sırasındadikkatli olunmalıdır (bkz. Bölüm 4.4). Bununla birlikte, PLATO çalışmasında bradikardiyiuyardığı bilinen bir ya da daha fazla tıbbi ürünün (örn., % 96 beta blokörler, % 33 kalsiyumkanal blokörleri diltiazem ve verapamil ve % 4 digoksin) eşzamanlı uygulanmasının ardındanklinik açıdan anlamlı advers reaksiyon kanıtı gözlenmemiştir. Diğer eşlik eden tedaviKlinik çalışmalarda tikagrelor, uzun vadede eşzamanlı hastalıklar için gerekli oldukça ASA, proton pompası inhibitörleri, statinler, beta-blokörler, anjiyotensin dönüştürücü enzim (ADE)inhibitörleri ve anjiyotensin reseptör blokörleri ile birlikte ve heparin, düşük molekül ağırlıklıheparin ve intravenöz GpIIb/IIIa inhibitörleri ile birlikte kısa süreler için yaygın şekilde 7 / 26 uygulanmıştır (bkz. Bölüm 5.1). Bu tıbbi ürünlerle klinik olarak anlamlı advers etkileşimler gözlendiğine dair bulgu yoktur. Tikagrelorun heparin, enoksaparin veya desmopressin ile eşzamanlı uygulanmasının aktive parsiyel tromboplastin zamanı (aPTZ), aktive pıhtılaşma zamanı (APZ) veya faktör Xa miktartestleri üzerinde etkisi olmamıştır. Bununla birlikte, potansiyel farmakodinamik etkileşimlernedeniyle tikagrelorun, hemostazı değiştirdiği bilinen tıbbi ürünler ile bir arada uygulanmasısırasında dikkatli olunmalıdır. Selektif serotonin gerialım inhibitörleri (SSRI) (örn., paroksetin, sertralin ve sitalopram) ile kutanöz kanama anomalilerini içeren raporlar nedeniyle, kanama riskini artırabileceğindentikagrelor ile SSRI'lar uygulanırken dikkatli olunması önerilmektedir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli olan kadınlar, tikagrelor ile tedavi süresince gebe kalmamak için uygun doğum kontrol yöntemleri kullanmalıdır. Gebelik dönemiTikagrelorun gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesi bulunduğunu göstermiştir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Tikagrelor gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiHayvanlardan elde edilen mevcut farmakokinetik/toksikolojik veriler, tikagrelorun ve aktif metabolitlerinin süte geçtiğini göstermektedir (bkz. Bölüm 5.3). Yenidoğanlar/bebekler içinrisk göz ardı edilemez. Çocuk için emzirmenin yararları ve kadın için tedavinin yararları dikkatealınarak, emzirmenin kesilmesine ya da tikagrelor tedavisinin kesilmesine/bu tedavidenkaçınılmasına karar verilmelidir. Üreme yeteneği / FertiliteTikagrelorun deney hayvanlarında erkek veya dişi fertilitesi üzerinde etkisi bulunmamaktadır (bkz. Bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkilerTikagrelorun araç ve makine kullanma yetisi üzerinde etkisi yoktur ya da göz ardı edilebilir etkilere sahiptir. Tikagrelor ile tedavi süresince sersemlik ve konfüzyon bildirilmiştir. Bunedenle, bu semptomların görüldüğü hastalar araç veya makine kullanırken dikkatli olmalıdır. 8 / 26 4.8. İstenmeyen etkilerGüvenlilik profili özetiTikagrelorun güvenlilik profili 39,000'in üzerinde hastayı içeren iki büyük faz 3 sonuç çalışmasında (PLATO ve PEGASUS) değerlendirilmiştir (bkz. Bölüm 5.1). PLATO çalışmasında tikagrelor tedavisi alan hastalarda advers olaylar sebebiyle tedaviyi bırakma insidansı, klopidogrel kullanan hastalara göre daha yüksek olmuştur (% 7,4'e karşın %5,4). PEGASUS çalışmasında tikagrelor tedavisi alan hastalarda advers olaylar sebebiyletedaviyi bırakma insidansı, tek başına ASA tedavisi ile karşılaştırıldığında daha yüksektir(tikagrelor 60 mg + ASA için % 16,1'e karşın tek başına ASA tedavisi için % 8,5). Tikagrelorile tedavi edilen hastalarda en yaygın bildirilen advers reaksiyonlar kanama ve dispnedir (bkz.Bölüm 4.4).Advers reaksiyonların tablolanmış özetiAşağıdaki advers reaksiyonlar, tikagrelor ile yapılan çalışmaları takiben ya da pazarlama sonrası deneyimde bildirilmiş olanlara göre tanımlanmıştır. Advers reaksiyonlar MedDRA Sistem Organ Sınıfına (SOC) göre listelenmiştir. Advers reaksiyonlar, her bir SOC içinde sıklık kategorilerine göre sıralanmıştır ve azalan ciddiyetsırasına göre sunulmaktadır. Sıklıklar şu şekilde tanımlanmaktadır: Çok yaygın (> 1/10); yaygın(> 1/100 ila < 1/10); yaygın olmayan (> 1/1000 ila < 1/100); seyrek (> 1/10.000 ila < 1/1000);çok seyrek (< 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). İyi huylu, kötü huylu ve belirtilmemiş neoplazmalar (Kist ve polipler de dahil olmak üzere)Yaygın olmayan: Tümör kanamalarıa Kan ve lenf sistemi hastalıklarıÇok yaygın: Kan hastalığı kanamalarıb Bilinmiyor: Trombotik Trombositopenik Purpurac Bağışıklık sistemi hastalıklarıYaygın olmayan: Anjiyoödemic içeren hipersensivite Metabolizma ve beslenme hastalıklarıÇok yaygın: Hiperürisemid Yaygın: Gut/Gut artriti Psikiyatrik hastalıklarYaygın olmayan: Konfüzyon Sinir sistemi hastalıklarıYaygın: Sersemlik, senkop, başağrısı Yaygın olmayan: İntrakraniyal hemoraji Göz hastalıklarıYaygın olmayan: Göz hemorajisie 9 / 26 Kulak ve iç kulak hastalıklarıYaygın: VertigoYaygın olmayan: Kulak hemorajisi Vasküler hastalıklarYaygın: Hipotansiyon Solunum, göğüs bozuklukları ve mediastinal hastalıklarÇok yaygın: DispneYaygın: Solunum sistemi kanamalarıf Gastrointestinal hastalıklarYaygın: Gastrointestinal hemorajig, diyare, bulantı, dispepsi, konstipasyon Yaygın olmayan: Retroperitoneal hemoraji Deri ve deri altı doku hastalıklarıYaygın: Deri altı veya deride kanamah, kaşıntı, döküntü Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın olmayan: Kasta kanamalar1 Böbrek ve idrar yolu hastalıklarıYaygın: İdrar yolunda kanamaj Üreme sistemi ve meme hastalıklarıYaygın olmayan: Üreme sistemi kanamalarık AraştırmalarYaygın: Kan kreatininde artışd Yaralanma, zehirlenme ve prosedüre ait komplikasyonlarYaygın: Post-prosedürel hemoraji, travmatik kanamalar 1 a örn., mesane kanseri, gastrik kanser, kolon kanseri nedeniyle kanama. b örn., morarmaya, spontan hematoma, hemorajik diatez eğilimde artış.c Pazarlama sonrası teşhis edilmiş deneyim %50 kreatinin artışları) ve ham advers olay bildirim sıklığı değildir.e örn., konjonktival, retinal, intraoküler kanama.f örn., burun kanaması, hemoptizi.g örn., dişeti kanaması, rektal hemoraji, gastrik ülser hemorajisi. h örn., ekimoz, cilt hemorajisi, peteşi. 1 örn., hemartroz, kas hemorajisi. j örn., hematüri, hemorajik sistit. k örn., vajinal hemoraji, hematospermi, post-menopozal hemoraji. 1 örn., kontüzyon, travmatik hematom, travmatik hemoraji. Seçilen advers reaksiyonların tanımıKanamaPLATO çalışmasındaki kanama bulguları10 / 26 PLATO çalışmasındaki genel kanama oranları sonuçları Tablo 1'de gösterilmektedir. Tablo 1 - Genel kanama olaylarının analizi, 12 ayda Kaplan-Meier tahminleri (PLATO)
Kanama kategorisi tanımları:Majör Ölümcül/Yaşamı Tehdit Edici Kanama:veyaveyaveyaveyapresörler veya ameliyat gerektiren şiddetlihipotansiyon veya hipovolemik şokun eşlik ettiği.Majör Diğer:veyaanlamlı derecede engelleyici.Minör Kanama:TIMI Majör Kanama:veyaintrakraniyal hemoraji ile klinikolarak belirgin. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tablo 2 - Genel kanama olaylarının analizi, 36 ayda Kaplan-Meier tahminleri(PEGASUS)____ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
12 / 26
Kanama kategorisi tanımları:
TIMI Majör:%
15'lik düşme ile ilişkili klinik olarak belirgin hemoraji bulguları.Ölümcül:
7 gün içinde doğrudan ölüme yol açan bir kanama olayı.İK:
İntrakraniyal Kanama (İntrakraniyal hemoraji).Diğer TIMI Majör:
Ölümcül olmayan İK dışı TIMI Majör kanama.TIMI Minör:
Hemoglobinde 30-50 g/L azalma ile klinik olarak belirgin.Tıbbi müdahale gerektiren TIMI:
Müdahale gerektiren VEYA hastaneye yatışa yol açan VEYA değerlendirmeyi gerektiren.PLATO Majör Ölümcül/Yaşamı tehdit edici:
Ölümcül kanama VEYA herhangi bir intrakraniyal kanama VEYA kardiyak tamponad ile intraperikardiyal VEYA presör/inotropveya ameliyat gerektiren hipovolemik şok veya şiddetli hipotansiyon ile VEYA hemoglobinde>50 g/L azalma ile klinik olarak belirgin VEYA > 4 ünite eritrosit transfüzyonu.PLATO Majör Diğer:
Anlamlı derecede engelleyici VEYA hemoglobinde 30-50 g/L azalma ile klinik olarak belirgin VEYA 2-3 ünite eritrosit transfüzyonu.PLATO Minör:
Kanamayı durdurmak veya tedavi etmek için tıbbi girişim gerektiren. PEGASUS çalışmasında, günde iki kez tikagrelor 60 mg için TIMI Majör kanama tek başınaASA için olandan daha yüksektir. Ölümcül kanama için kanama riskinde artış görülmemiş vetek başına ASA tedavisine kıyasla sadece intrakraniyal hemorajilerde küçük bir artışgözlenmiştir. Çalışmada birkaç ölümcül kanama olayı yaşanmıştır: Tikagrelor 60 mg için 11(% 0,3) ve tek başına ASA tedavisi için 12 (% 0,3). Tikagrelor 60 mg ile TIMI Majör kanamariskinde gözlenen artışın nedeni, başlıca gastrointestinal sistem organ sınıfındaki olaylardankaynaklanan Diğer TIMI Majör kanama sıklığının daha yüksek olmasıdır.TIMI Majöre benzer kanama paternlerinde artış, TIMI Majör veya Minör ve PLATO Majör ve PLATO Majör veya Minör kanama kategorileri için görülmüştür (bkz. Tablo 2). Kanamanedeniyle tedavinin kesilmesi tek başına ASA tedavisine kıyasla tikagrelor 60 mg ile dahayaygındır (sırasıyla % 6,2 ve % 1,5). Bu kanamaların büyük çoğunluğu burun kanaması,morarma ve hematomlar gibi daha düşük ciddiyette (TIMI tıbbi müdahale gerektiren olaraksınıflandırılmış) kanamalardır.
Tikagrelor 60 mg'ın kanama profili TIMI Majör, TIMI Majör veya Minör ve PLATO Majör kanama olayları için çoklu önceden tanımlanmış alt gruplar arasında (örn., yaş, cinsiyet, kilo,ırk, coğrafik bölge, eşzamanlı rahatsızlıklar, eşzamanlı tedavi ve tıbbi öykü) tutarlıbulunmuştur.
İntrakraniyal kanama:
Spontan intrakraniyal hemorajiler tikagrelor 60 mg ve tek başına ASA tedavisi için benzer oranlarda bildirilmiştir (her iki tedavi grubunda da n=13, % 0,2). Travmatikve prosedürle ilişkili intrakraniyal hemorajiler tek başına ASA tedavisine (n=10, % 0,1) kıyaslatikagrelor 60 mg tedavisi ile küçük bir artış göstermiştir (n=15, % 0,2). Tikagrelor 60 mg ile 6ölümcül intrakraniyal kanama ve tek başına ASA tedavisi ile 5 ölümcül intrakraniyal kanamameydana gelmiştir. İntrakraniyal kanama insidansı, araştırma altındaki popülasyonun anlamlıkomorbidite ve kardiyovasküler risk faktörleri dikkate alındığında her iki tedavi grubunda dadüşük olmuştur.Dispne
Tikagrelor ile tedavi edilen hastalarda bir tür nefessizlik hissi olan dispne bildirilmiştir. PLATO çalışmasında dispne advers olayları (AO'lar) (dispne, istirahat halinde dispne, efora bağlıdispne, paroksismal noktürnal dispne ve noktürnal dispne) bir arada ele alındığında, tikagrelor
13 / 26
ile tedavi edilen hastaların
%%
7,8'si tarafından bildirilmiştir. Tikagrelor kullanan hastaların % 2,2'sinde ve klopidogrel kullananhastaların % 0,6'sında araştırmacılar dispnenin PLATO çalışmasındaki tedavi ile nedensellikilişkisi içinde olduğunu ve azının ciddi olduğunu (% 0,14 tikagrelor; % 0,02 klopidogrel)düşünmüştür (bkz. Bölüm 4.4). En çok bildirilen dispne semptomları hafif ila orta şiddette olupçoğu tedavi başlangıcından kısa bir süre sonra tek bir epizot olarak bildirilmiştir.Klopidogrel ile karşılaştırıldığında tikagrelor ile tedavi edilen astım/KOAH hastalarında ciddi olmayan dispne (tikagrelor ile % 3,29'a karşın klopidogrel ile % 0,53) ve ciddi dispne(tikagrelor ile % 0,38'e karşın klopidogrel ile % 0,00) yaşama riski artmış olabilir. Mutlakterimlere göre, bu risk genel PLATO popülasyonundakinden daha yüksek bulunmuştur.Tikagrelor, astım ve/veya KOAH öyküsü olan hastalarda dikkatle kullanılmalıdır (bkz. Bölüm4.4).
Epizotların yaklaşık % 30'u 7 gün içerisinde düzelmiştir. PLATO çalışmasına başlangıçta konjestif kalp yetmezliği, KOAH veya astımı olan hastalar dahil edilmiştir; bu hastalar veyaşlılarda dispne bildirme olasılığı daha muhtemeldir. Klopidogrel alanlar için % 0,1 oranı ilekarşılaştırıldığında tikagrelor için hastaların % 0,9'u dispne nedeniyle çalışma ilacınıbırakmıştır. Tikagrelor ile daha yüksek dispne insidansına yeni veya kötüleşen kalp veyaakciğer hastalığı eşlik etmemiştir (bkz. Bölüm 4.4). Tikagrelor pulmoner fonksiyon testlerinietkilemez.
PEGASUS çalışmasında dispne, günde iki kez tikagrelor 60 mg alan hastaların % 14,2'sinde ve tek başına ASA alan hastaların % 5,5'inde bildirilmiştir. PLATO çalışmasında en çokbildirilen dispne olayları hafif ila orta şiddete olmuştur (bkz. Bölüm 4.4). Dispne bildirenhastalar daha yaşlı olma ve daha sık olarak da temelde dispne, KOAH veya astım hastası olmaeğilimindedir.
Araştırmalar
Ürik asit yükselmeleri: PLATO çalışmasında, klopidogrel alan hastalar ile % 13 olan oran ile kıyaslandığında tikagrelor alan hastaların % 22'sinde serum ürik asit, normalin üst sınırındandaha fazla yükselmiştir. PEGASUS çalışmasında karşılık gelen değerler tikagrelor 90 mg, 60mg ve plasebo için sırasıyla % 9,1, % 8,8 ve % 5,5 olmuştur. Ortalama serum ürik asitklopidogrel ile yaklaşık % 7,5 olan oran ile karşılaştırıldığında tikagrelor ile yaklaşık % 15artmış ve tedavi durdurulduktan sonra tikagrelor tedavisinde yaklaşık % 7'ye düşmüştür; ancakklopidogrel ile bir azalma gözlenmemiştir. PEGASUS çalışmasında tikagrelor 90 mg ve 60 mgiçin ortalama serum ürik asit düzeylerinde sırasıyla % 6,3 ve
%
5,6'lık geri dönüşlü yükselmelerbulunmuş, plasebo grubunda ise % 1,5'lik bir azalma yaşanmıştır. PLATO çalışmasında gutartriti sıklığı tikagrelor için % 0,2'ye karşın klopidogrel için % 0,1 bulunmuştur. PEGASUSçalışmasında gut/gut artriti için karşılık gelen değerler tikagrelor 90 mg, 60 mg ve plasebo içinsırasıyla % 1,6, % 1,5 ve % 1,1'dir.Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir
(www.titck.gov.tr[email protected]
; tel: 0 800 314 00 08; faks: 0 312 218 35 99).14 / 26
4.9. Doz aşımı ve tedavisi
Tikagrelor 900 mg'a kadar olan tekli dozlarda iyi tolere edilir. Gastrointestinal toksisitenin, tekli yükselen doz çalışmasında doz sınırlayıcı olduğu belirlenmiştir. Doz aşımı ile ortayaçıkabilecek diğer klinik olarak anlamlı advers reaksiyonlar arasında dispne ve ventrikülerduraklamalar mevcuttur (bkz. Bölüm 4.8).
Doz aşımı durumunda yukarıdaki potansiyel advers reaksiyonlar meydana gelebilir ve bu durumda EKG takibi düşünülmelidir.
Tikagrelorun etkilerini tersine çevirecek bilinen bir antidot halihazırda mevcut değildir ve tikagrelor diyalizle temizlenebilir değildir (bkz. Bölüm 5.2). Doz aşımı tedavisinde yerelstandart tıbbi uygulamalar takip edilmelidir. Aşırı tikagrelor dozunda, beklenen etki trombositinhibisyonu ile ilişkili olarak kanama riski süresinin uzamasıdır. Trombosit transfüzyonununkanama bulunan hastalarda klinik yarar sağlaması mümkün değildir (bkz. Bölüm 4.4). Eğerkanama gözlenirse, uygun destekleyici tedbirler alınmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Trombosit agregasyon inhibitörleri (Heparin hariç)
ATC kodu: B01AC24 Etki mekanizması:
AGRİLOR®, oral, doğrudan etkili, P2Yi2 reseptör antagonistine selektif ve geri dönüşümlü olarak bağlanan ve ADP-aracılı P2Yi2'ye bağımlı trombosit aktivasyonunu ve agregasyonunuengelleyen, siklopentiltriazolopirimidin (SPTP) kimyasal sınıfının bir üyesi olan tikagreloriçermektedir. Tikagrelor ADP'nin bağlanmasını engellemez; ancak P2Yi2 reseptörünebağlandığı zaman ADP-uyarılı sinyal iletimini engeller. Trombositler aterosklerotik hastalığıntrombotik komplikasyonlarının başlaması ve/veya gelişmesinde yer aldıklarından, trombositfonksiyon inhibisyonunun ölüm, Mİ veya inme gibi KV olay riskini azalttığı gösterilmiştir.
Tikagrelor aynı zamanda, dengeleyici nükleozit taşıyıcısı-1 'i (ENT-1) inhibe ederek lokal endojen adenozin düzeylerini de artırır.
Tikagrelorun sağlıklı gönüllülerde ve AKS hastalarında adenozin kaynaklı aşağıdaki etkileri güçlendirdiği belirlenmiştir: vazodilatasyon (sağlıklı gönüllülerde ve AKS hastalarında koronerkan akışı artışları ile ölçülür; baş ağrısı), trombosit fonksiyonu inhibisyonu (in vitro koşullardainsan tam kanında) ve dispne. Bununla birlikte, adenozinde gözlenen artışlar ve klinik sonuçlar(örn., morbidite-mortalite) arasındaki bağ henüz tam olarak açıklığa kavuşturulmuş değildir.
Farmakodinamik etkiler:
Etkinin başlaması
Tikagrelor için 180 mg yükleme dozundan 0,5 saat sonra yaklaşık
%
41'lik ortalama trombosit agregasyon inhibisyonu (TAİ) değeri ile gösterildiği üzere, ASA tedavisi görmekte olan stabilkoroner arter hastalığı (KAH) olan hastalarda tikagrelor hızlı bir farmakolojik etki başlangıcı15 / 26
gösterir;
%
89'luk maksimum TAİ etkisi dozdan 2-4 saat sonra ortaya çıkar ve 2-8 saat arasında sürer. Hastaların % 90'ında son uzatılmış TAİ, dozdan 2 saat sonra > % 70 olmuştur.Etkinin sonlanması
Eğer bir KABG prosedürü planlanıyorsa, tikagrelorun prosedürden önce 96 saatten daha kısa bir süre içerisinde kesilmesi durumunda tikagrelor kanama riski klopidogrele göre artmaktadır.
Geçiş verileri
Klopidogrel 75 mg'dan günde iki kez tikagrelor 90 mg'a geçiş, % 26,4 mutlak TAİ (IPA) artışı ile sonuçlanır ve tikagrelordan klopidogrele geçiş % 24,5 mutlak TAİ azalması ile sonuçlanır.Hastalar antitrombositik etkide herhangi bir kesinti olmaksızın klopidogrelden tikagreloregeçebilir (bkz. Bölüm 4.2).
Klinik etkililik ve güvenlilik:
Tikagrelorun etkililiği ve güvenliliği için klinik bulgular iki faz 3 çalışmasından elde edilmiştir:
PLATO [PLATelet Inhibition and Patient Outcomes] çalışması, her ikisi de ASA ve diğerstandart tedavi ile kombinasyon halinde verilen tikagrelorun klopidogrel ile karşılaştırılması
PEGASUS TIMI-54 [PrEvention with TicaGrelor of SecondAry Thrombotic Events in High-RiSk AcUte Coronary Syndrome Patients] çalışması, ASA ile kombinasyon halinde tikagrelortedavisinin tek başına ASA tedavisi ile karşılaştırılması
PLATO çalışması (AkutKoroner Sendromlar)
PLATO çalışmasına stabil olmayan anjina (UA), ST yükselmesiz miyokart infarktüsü (NSTEMI) veya ST yükselmeli miyokart infarktüsü (STEMI) semptomları başladıktan sonraki24 saat içerisinde gelen ve ilk tedavisi medikal veya perkütan koroner müdahale (PKM) ya daKABG olan 18.624 hasta dahil edilmiştir.
Klinik etkililik
Arka plan tedavisi olarak günde bir kez ASA kullanıldığında, günde iki kez tikagrelor 90 mg, KV ölüm, Mİ veya inmeden oluşan birleşik sonlanım noktasını önlemede günde bir kez 75 mgklopidogrele göre üstünlük göstermiş, oluşan farka ise KV ölüm ve Mİ sebebiyet vermiştir.Hastalar 300 mg klopidogrel yükleme dozu (PKM varsa 600 mg olması mümkündür) veya 180mg tikagrelor dozu almıştır.
Bu sonuç erken dönemde ortaya çıkmış (30 günde mutlak risk azalması [MRA] % 0,6 ve nispi risk azalması [NRA] % 12), 12 aylık dönemin tamamında sabit bir tedavi etkisi söz konusuolmuş, % 16'lık NRA ile yıl başına % 1,9 MRA verimini sağlamıştır. Bu bulgu, hastaların 12ay süreyle günde iki kez tikagrelor 90 mg ile tedavisinin uygun olduğunu düşündürmektedir(bkz. Bölüm 4.2). 54 AKS hastasının klopidogrel yerine tikagrelor ile tedavi edilmesi 1aterotrombotik olayı önleyecektir; 91 hastanın tedavisi ile bir KV ölüm önlenecektir (bkz. Şekil1 ve Tablo 3).
Tikagrelorun, klopidogrelin üzerindeki tedavi etkisi kilo; cinsiyet; diabetes mellitus, geçici iskemik atak veya hemorajik olmayan inme veya revaskülarizasyon dahil tıbbi öykü;heparinler, GpIIb/IIIa inhibitörleri ve proton pompa inhibitörlerini içeren eşzamanlı tedaviler
16 / 26
(bkz. Bölüm 4.5); son indeks olay tanısı (STEMI, NSTEMI veya UA); ve randomizasyonda hedeflenen tedavi yolağı (invazif veya medikal) dahil bir çok alt grup arasında tutarlı olmuştur.
Bölge ile zayıf anlamlılığa sahip bir tedavi etkileşimi gözlenmiş olup bunun neticesinde birincil sonlanım noktasının tehlike oranı (TO), dünyanın geri kalanında tikagrelor lehine ikenincelenen toplam popülasyonun yaklaşık
%
10'unu temsil eden Kuzey Amerika'da klopidogrellehinedir (etkileşim p-değeri=0.045). Keşif amaçlı analizler ASA dozu ile olası bir etkileşimakla getirmektedir: Artan ASA dozları ile tikagrelorda azalan etkililik gözlenmiştir. Tikagrelorile verilecek kronik günlük ASA dozları 75-150 mg olmalıdır (bkz. Bölüm 4.2 ve Bölüm 4.4).Şekil 1'de bileşik etkililik sonlanım noktasında herhangi bir olayın ilk meydana gelmesine aitriskin tahmini gösterilmektedir.Şekil 1 - KV ölüm, Mİ ve inmenin birincil klinik bileşik sonlanım noktası analizi (PLATO)
 |
O 60120ISO240300360Risk taşıyan hasta sayısı Randomizasyondan sonra günler |
|
|
(T) |
[364!9333] |
-----Klopidogret |
|
[1014t9291] |
Tikagrelor hem UA/NSTEMI hem de STEMI popülasyonunda (Tablo 3) klopidogrel ile karşılaştırıldığında birincil bileşik sonlanım noktasının oluşma oranını azaltmıştır. Dolayısıyla,medikal tedavi gören hastalar ve perkutan koroner müdahale (PKM) ya da koroner bypass grefti(CABG) ile tedavi edilen hastalar dahil olmak üzere AKS hastalarında (stabil olmayan anjina,ST yükselmesiz Miyokart İnfarktüsü [NSTEMI] ve ST yükselmeli Miyokart İnfarktüsü[STEMI]) düşük doz ASA ile birlikte günde iki kez AGRİLOR® 90 mg kullanılabilir.
17 / 26
Tablo 3 - Birincil ve ikincil etkililik sonlanım noktalarının analizi (PLATO) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
aMRA=mutlak risk azalması; NRA=nispi risk azalması= 1-tehlike oranı) x %100. Negatif NRA nispi risk artışını gösterir.bSessiz Mİ hariç. cCRİ=ciddi reküren iskemi; Rİ=reküren iskemi; GİA=geçici iskemik atak; ATO=arteriyel trombotik olay. Toplam Mİ, sessiz Mİ'yi içerir ve olayın tarihi, keşfedildiği tarih olarak belirlenir.dNominal anlamlılık değeri; tüm diğerleri önceden belirlenmiş hiyerarşi testlerine göre resmi olarak veistatistiksel olarak anlamlıdır. |
PLA TO genetik alt çalışması
PLATO çalışmasında 10,285 hastanın CYP2C19 ve ABCB1 genotiplerinin belirlenmesi, genotip grupları ile PLATO sonuçları arasındaki ilişkileri göstermiştir. Majör KV olaylarıazaltmada tikagrelorun klopidogrele üstünlüğü, hasta CYP2C19 veya ABCB1 genotipinden
18 / 26
anlamlı derecede etkilenmemiştir. Genel olarak PLATO çalışmasına benzer şekilde, toplam PLATO Majör kanama, CYP2C19 veya ABCB1 genotipinden bağımsız olarak tikagrelor veklopidogrel arasında farklılık göstermemiştir. CABG olmayan PLATO Majör kanama, bir veyadaha fazla CYP2C19 işlev kaybı alleline sahip hastalarda klopidogrel ile karşılaştırıldığındatikagrelor ile artmıştır fakat işlev kaybı alleli olmayan hastalarda klopidogrel ile benzerolmuştur.
Kombine etkililik ve güvenlilik bileşimi
Kombine etkililik ve güvenlilik bileşimi (KV ölüm, Mİ, inme veya PLATO tanımlı Toplam Majör kanama), klopidogrel ile karşılaştırıldığında tikagrelorun etkililiğindeki faydanın,AKS'den sonraki 12 ayda majör kanama olayları ile dengelenmediğini göstermektedir (MRA% 1,4, NRA % 8, TO 0,92; p=0,0257).
Klinik güvenlilik
Holter alt çalışması
PLATO çalışması sırasında ventriküler duraklamaların ve diğer aritmik epizotların ortaya çıkışını incelemek üzere araştırmacılar yaklaşık 3000 hastadan oluşan bir alt grupta Holterizlemi yapmıştır; bu hastaların yaklaşık 2000'nininde hem AKS'lerinin akut fazında hem de biray sonrasında kayıtlar mevcuttur. İncelenen ana değişken >3 saniyelik ventrikülerduraklamaların meydana gelmesi olmuştur. Akut fazla klopidogrel (%3,5) ile
karşılaştırıldığında tikagrelor (% 6,0) ile daha fazla hastada ventriküler duraklamalar olmuştur; ve 1 ay sonrasında sırasıyla % 2,2 ve % 1,6 olmuştur (bkz. Bölüm 4.4). AKS'nin akut fazındaventriküler duraklamalardaki artış, KKY öyküsü olan tikagrelor hastalarında daha belirginolmuştur (KKY öyküsü olmayan hastalarda % 9,2'ye karşın % 5,4; klopidogrel hastaları için,% 4,0'a karşın KKY öyküsü olmayan hastalarda % 3,6'dır). Bu dengesizlik bir ayda meydanagelmemiştir: tikagrelor hastalarında KKY öyküsü olan ve olmayanlarda sırasıyla % 2,0'a karşın% 2,1 ve klopidogrel ile % 3,8'e karşın % 1,4'tür. Bu hasta popülasyonunda bu dengesizlik ileilişkili advers klinik sonuçlar söz konusu olmamıştır (pacemaker yerleştirilmesi durumlarıdahil).
PEGASUS Çalışması (Miyokart İnfarktüsü Öyküsü)
PEGASUS TIMI-54 çalışması, Mİ öyküsü ve aterotromboz açısından ek risk faktörleri olan hastalarda tek başına ASA tedavisi ile karşılaştırıldığında düşük doz ASA (75-150 mg) ilekombinasyon halinde 2 doz şeklinde (ya günde iki kez 90 mg ya da günde iki kez 60 mg) verilentikagrelor ile aterotrombotik olayların önlenmesini değerlendiren 21,162 hastalı, olayların yönverdiği, randomize, çift kör, plasebo kontrollü, paralel gruplu, uluslararası çok merkezli birçalışmadır.
50 yaş veya üzeri, Mİ öyküsü (randomizasyondan 1 ila 3 yıl önce) ve aşağıdaki aterotromboz risk faktörlerinden en azından birine sahip hastalar çalışmaya katılım açısından uygunbulunmuştur: >65 yaş, ilaç tedavisi gerektiren diabetes mellitus, önceden geçirilmiş ikinci birMİ, çoklu damar KAH bulgusu veya son evre olmayan kronik böbrek fonksiyon bozukluğu.
Hastalar şu durumlarda çalışmaya katılım açısından uygunsuz bulunmuştur: Çalışma süresince P2Y12 reseptör antagonisti, dipiridamol, silostazol veya antikoagülan tedavisi planlanmışsa;pıhtılaşma bozukluğu varsa veya iskemik inme veya intrakraniyal kanama öyküsü varsa, santralsinir sistemi tümörü veya bir intrakraniyal vasküler anomali varsa; önceki 6 ay içindegastrointestinal kanamaları olmuşsa veya önceki 30 gün içinde majör ameliyat geçirmişlerse.
19 / 26
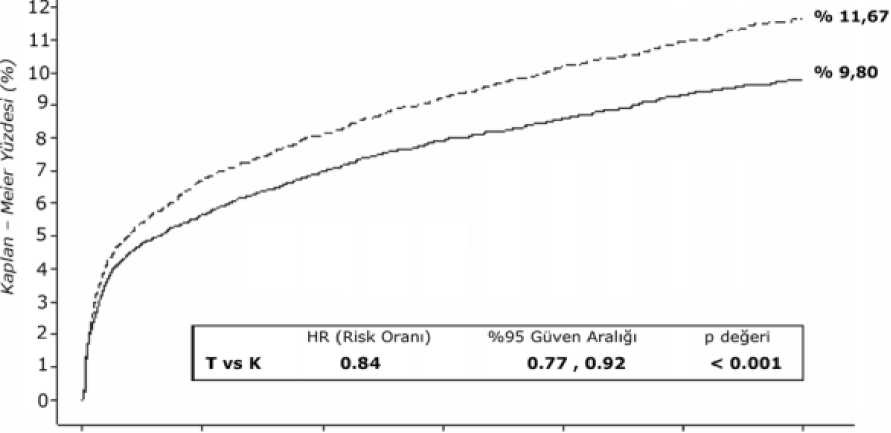
Klinik etkililikŞekil 2 - KV ölüm, MI ve inmenin birincil klinik bileşik sonlanım noktası analizi (PEGASUS)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
12üRisk taşıran hasta savısı240360480 600720840Randoınizasyondan sonra günler96010801200 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1320
6357
6315
2055
2028
3698
3646
4926
4899
5904
5876
6711
6658
Tl 60 rng 7045 Placebo 7067
6784
6761
6857
6842
6948
6950
710
714
Tablo 4 - Birincil ve İkincil Etkililik Sonlanım Noktalarının Analizi (PEGASUS) | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
20 / 26
Tablo 4 - Birincil ve İkincil Etkililik Sonlanım Noktalarının Analizi (PEGASUS) (Devam) | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
Tehlike oranı ve p-değerleri, tek açıklayıcı değişken olarak tedavi grubu ile Cox orantılı tehlikeler modelinden hareketle tek başına ASA tedavisine karşın tikagrelor için ayrı ayrıhesaplanır.
36. ayda hesaplanan Kaplan-Meier yüzdesi. Not: KV ölüm, Mİ ve İnme bileşenleri için ilk olayların sayısı her bir bileşen için ilk olayların gerçek sayısı olup, bileşik sonlanımnoktasındaki olay sayısına ilave edilmez. (s) İstatistiksel anlamı belirtir.
GA=Güven aralığı; KV=Kardiyovasküler; TO=Tehlike oranı; KM=Kaplan-Meier; Mİ=Miyokard infarktüsü.
ASA ile kombinasyon halinde hem günde iki kez 60 mg hem de günde iki kez 90 mg tikagrelor rejimleri çalışma periyodu boyunca tutarlı bir tedavi etkisi ile aterotrombotik olaylarınönlenmesinde (bileşik sonlanım noktası: KV ölüm, Mİ ve inme) tek başına ASA'dan üstünolup, tikagrelor 60 mg için
%%
1,27 mutlak risk azalması(MRA) ve tikagrelor 90 mg için % 15 NRA ve % 1,19 MRA değerlerini vermektedir.90 mg ve 60 mg'ın etkililik profili benzer olmasına rağmen, daha düşük dozun kanama ve dispne riski ile ilişkili olarak daha iyi güvenlilik profiline ve tolerabiliteye sahip olduğuna dairkanıtlar bulunmaktadır. Bu nedenle, ASA ile birlikte yalnızca günde iki kez uygulananAGRİLOR® 60 mg Mİ öyküsü olan ve aterotrombotik olay gelişimi açısından yüksek risktaşıyan hastalarda aterotrombotik olayların (KV ölüm, Mİ ve inme) önlenmesi içinönerilmektedir.
Tek başına ASA'ya göre günde iki kez tikagrelor 60 mg KV ölüm, Mİ ve inme birincil bileşik sonlanım noktasını anlamlı olarak azaltır. Bileşenlerin her biri birincil bileşik sonlanımnoktasında azalmaya katkıda bulunmuştur (KV ölüm % 17 NRA, Mİ % 16 NRA ve inme % 25NRA).
Birinci günden 360. güne kadar (% 17 NRA) ve 361 gün ve sonrasındaki (% 16 NRA) bileşik sonlanım noktası NRA'ları benzerdir. Uzatılmış tedaviden 3 yıl sonrasında tikagrelore aitetkililik ve güvenlilik verileri sınırlıdır.
Mİ'den 2 yıldan fazla bir sürede klinik olarak stabil olan hastalarda veya önceki ADP reseptör inhibitörü tedavisi bırakıldıktan sonra bir yıldan fazla süre geçtiğinde günde iki kere tikagrelor60 mg uygulandığında fayda olduğu yönünde kanıt söz konusu olmamıştır (KV ölüm, Mİ ve
21 / 26
inmede birincil bileşik sonlanım noktasında azalma yoktur: ancak majör kanamada artış vardır (ayrıca bkz. Bölüm 4.2.).
Klinik güvenlilik
Kanama ve dispne nedeniyle tikagrelor 60 mg ile tedaviyi kesme oranı, >75 yaş hastalarda (% 42), daha genç hastalar ile karşılaştırıldığında daha yüksek olmuş (% 23 - % 31 aralığında), >75yaş hastalarda plaseboya karşın fark % 10'dan yüksek bulunmuştur (% 42'ye karşın % 29).
Pediyatrik popülasyon
Avrupa İlaç Ajansı, akut koroner sendromlar (AKS) ve miyokard enfarktüsü (Mİ) öyküsüne sahip pediyatrik popülasyonun tüm alt kümelerinde tikagrelor ile çalışma sonuçlarını sunmazorunluluğunu iptal etmiştir (pediyatrik kullanım hakkında bilgi için bkz. Bölüm 4.2).
5.2. Farmakokinetik özelliklerGenel özellikler:
Emilim
:Tikagrelorun emilimi, medyan tmaks değeri ile yaklaşık 1,5 saat olup hızlıdır. Tikagrelorun dolaşımdaki başlıca metaboliti AR-C124910XX'in (aynı zamanda aktif metaboliti) oluşumuyaklaşık 2,5 saat medyan tmaks değeri ile hızlıdır. 90 mg tikagrelorun sağlıklı gönüllülere açkarnına oral yolla uygulanmasının ardından Cmaks değeri 529 ng/mL ve EAA değeri 3451ng*s/mL'dir. Ana metabolit oranları Cmaks için 0.28 ve EAA için 0,42'dir. Mİ öyküsü olanhastalarda tikagrelor ve AR-C124910XX'in farmakokinetiği, AKS popülasyondaki ile genelolarak benzer olmuştur. PEGASUS çalışmasının popülasyon farmakokinetik analizine dayalıolarak, medyan tikagrelor Cmaks değeri 391 ng/mL ve tikagrelor 60 mg için kararlı durumdaEAA değeri 3801 ng*s/mL'dir. Tikagrelor 90 mg için kararlı durumda Cmaks 627 ng/mL veEAA 6255 ng*s/mL'dir.
Tikagrelorun ortalama mutlak biyoyararlanımı % 36 olarak tahmin edilmektedir. Yüksek oranda yağ içeren bir öğünün alınması, tikagrelor EAA değerinde % 21'lik artışa ve aktifmetabolitin Cmaks değerinde % 22'lik düşüşe neden olmuştur; fakat tikagrelorun Cmaks değerindeveya aktif metabolitin EAA değeri üzerinde herhangi bir etkisi olmamıştır. Bu küçükdeğişikliklerin minimal klinik öneme sahip olduğu düşünülmektedir; bu nedenle tikagrelor açveya tok karnına alınabilir. Gerek tikagrelor gerekse aktif metaboliti P-gp substratlarıdır.
Ezilmiş ve suyla karıştırılmış tikagrelor tabletler, oral olarak ya da bir nazogastrik tüp aracılığıyla mideye uygulandığında, tikagrelorun ve aktif metabolitin EAA ve Cmaks değerlerigöz önünde bulundurulduğunda tam tabletlerle benzer bir biyoyararlanıma sahip olduklarıgörülmektedir. Ezilmiş ve suyla karıştırılmış tikagrelor tabletlerden başlangıç maruziyeti(dozdan 0.5 ve 1 saat sonra) tam tabletlere kıyasla daha yüksek olmuş, daha sonra (2 ila 48 saat)genellikle benzer bir konsantrasyon profili ortaya çıkmıştır.
Dağılım
:Tikagrelorun kararlı durum dağılım hacmi 87,5 litredir. Tikagrelor ve aktif metaboliti insan plazma proteinine büyük ölçüde bağlanır (>% 99,0).
22 / 26
Biyotransformasyon:
CYP3A4, tikagrelorun metabolizmasından ve aktif metabolitin oluşumundan sorumlu majör enzimdir ve diğer CYP3A substratları ile etkileşimleri aktivasyondan inhibisyona kadardeğişebilir.
Tikagrelorun majör metaboliti AR-C124910XX olup, aynı zamanda trombosit P2Yi2 ADP-reseptörüne in vitro bağlanması değerlendirildiğinde aktif olduğu da belirlenmiştir. Aktif metabolite sistemik maruziyet, tikagrelor için elde edilenin yaklaşık olarak
%
30-40'ıdır.Eliminasyon
:Tikagrelor eliminasyonunun primer yolu hepatik metabolizmadır. Radyoaktif işaretli tikagrelor uygulandığında, radyoaktivitenin ortalama geri eldesi yaklaşık olarak % 84'tür (feçeste % 57,8,idrarda % 26,5). Tikagrelor ve aktif metabolitinin her ikisinin de idrardan geri eldesi dozun %1'inden daha azdır. Aktif metabolit için primer eliminasyon yolu ağırlıklı olarak safra ileatılımdır. Ortalama tı/2 tikagrelor için yaklaşık olarak 7 saat ve aktif metabolit için 8,5 saattir.
Doğrusallık/doğrusal olmayan durum:
Tikagrelor doğrusal farmakokinetik sergiler ve tikagrelore ve aktif metabolite (AR-C124910XX) maruziyet 1260 mg'a kadar yaklaşık olarak dozla orantılıdır.
Özel popülasyonlar
Yaşlı hastalarda:
Popülasyon farmakokinetik analizine göre yaşlı (>75 yaş) AKS hastalarında daha genç hastalara kıyasla tikagrelore (Cmaks ve EAA'nın her ikisi için yaklaşık % 25) ve aktif metabolitedaha yüksek maruziyetler gözlenmiştir. Bu farklılıkların klinik olarak anlamlı olduğudüşünülmemektedir (bkz. Bölüm 4.2).
Pediyatrik hastalarda:
Tikagrelor pediyatrik popülasyonda değerlendirilmemiştir (bkz. Bölüm 4.2 ve Bölüm 5.1).
Cinsiyet:
Erkeklere kıyasla kadınlarda tikagrelore ve aktif metabolitine daha yüksek maruziyetler gözlenmiştir. Bu farklılıkların klinik olarak anlamlı olduğu düşünülmemektedir.
Böbrek yetmezliği:
Böbrek fonksiyonları normal olan gönüllülerle karşılaştırıldığında ağır derecede böbrek yetmezliği olan hastalarda (kreatinin klerensi <30 mL/dakika) tikagrelore maruziyet yaklaşık% 20 daha düşüktür ve aktif metabolite maruziyet yaklaşık % 17 daha yüksektir.
Hemodiyaliz uygulanmakta olan terminal evre böbrek hastalığına sahip hastalarda diyaliz uygulanmayan bir günde uygulanan tikagrelor 90 mg'nin EAA ve Cmaks değerinin normalböbrek fonksiyonuna sahip gönüllülerdekine kıyasla % 38 ve % 51 daha yüksek olduğugörülmüştür. Tikagrelorun diyalizle temizlenebilir olmadığını gösterir şekilde, tikagrelordiyalizden hemen önce uygulandığında maruziyette benzer bir artış gözlenmiştir (sırasıyla %
23 / 26
49 ve
%%
13-14, Cmaks % 17-36). Terminal evre böbrek hastalığı bulunan hastalarda tikagrelorun trombositagregasyonu inhibisyonu (IPA) etkisinin diyalizden bağımsız olduğu ve normal böbrekfonksiyonuna sahip gönüllülerdekiyle benzer olduğu görülmüştür (bkz. Bölüm 4.2).Karaciğer yetmezliği:
Eşlenmiş sağlıklı gönüllülerle karşılaştırıldığında hafif derecede karaciğer yetmezliği olan hastalarda tikagrelor için Cmaks ve EAA değerleri sırasıyla % 12 ve % 23 daha yüksektir;bununla birlikte tikagrelorun TAİ etkisi iki grup arasında benzerdir. Hafif derecede karaciğeryetmezliği olan hastalarda doz ayarlaması gerekli değildir. Tikagrelor, ağır derecede karaciğeryetmezliği olan hastalarda çalışılmamış olup, orta derecede karaciğer yetmezliği olan hastalarlailgili farmakokinetik bilgi bulunmamaktadır. Başlangıçta bir veya daha fazla karaciğerfonksiyonu testinde orta veya şiddetli yükselmesi olan hastalarda tikagrelor plazmakonsantrasyonları, başlangıçta yükselmeleri olmayan hastalar ile karşılaştırıldığında ortalamaolarak benzer veya hafif şekilde daha yüksek olmuştur. Orta derecede karaciğer yetmezliği olanhastalarda herhangi bir doz ayarlaması önerilmemektedir (bkz. Bölüm 4.2 ve Bölüm 4.4).
Irk:
Beyaz ırktan hastalarla kıyaslandığında Asya kökenli hastalarda ortalama biyoyararlanım % 39 daha yüksektir. Beyaz ırktan hastalarla kıyaslandığında tikagrelorun biyoyararlanımıkendilerini siyah ırk olarak tanımlayan hastalarda % 18 daha düşük; klinik farmakolojiçalışmalarında beyaz ırkla kıyaslandığında Japon gönüllülerde tikagrelore maruziyet (Cmaks veEAA) yaklaşık % 40 (vücut ağırlığı için ayarlandıktan sonra % 20) daha yüksektir. Kendileriniİspanyol veya Latin kökenli olarak tanımlayan hastalarda maruziyet beyaz ırk ile benzerdir.
5.3. Klinik öncesi güvenlilik verileri
Tikagrelor ve majör metaboliti için klinik öncesi veriler, güvenlilik farmakolojisi, tek ve tekrarlanan doz toksisitesi ve genotoksik potansiyel konvansiyonel çalışmalarına dayalı olarakinsanlar için kabul edilemez riskli advers etkiler göstermemiştir.
Çeşitli hayvan türlerinde klinik açıdan anlamlı maruziyet düzeylerinde gastrointestinal iritasyon gözlenmiştir (bkz. Bölüm 4.8).
Dişi sıçanlarda yüksek dozda tikagrelor uterus tümörleri (adenokarsinomalar) insidansında artış ve hepatik adenomların insidansında artış göstermiştir. Uterus tümörlerinin mekanizmasıolasılıkla sıçanlarda tümörlere neden olan hormonal dengesizliktir. Hepatik adenomlarınmekanizması olasılıkla karaciğerde kemirgenlere özgü enzim indüksiyonudur. Dolayısıyla,karsinojenisite bulgularının insanlarla ilişkisinin olası olmadığı düşünülmektedir.
Sıçanlarda maternal toksik dozda (güvenlilik sınırı 5,1) minör gelişimsel anomaliler görülmüştür. Tavşanlarda yüksek dozda dişilerin fetüslerinde, maternal toksisite görülmeksizin(güvenlilik sınırı 4,5) karaciğer olgunlaşmasında ve iskelet gelişiminde hafif bir gecikmegörülmüştür.
Sıçanlar ve tavşanlar üzerinde yürütülen çalışmalar, anne vücut ağırlığı artışında hafif azalma ve gecikmiş doğum ile yenidoğan yaşama kapasitesi ve doğum ağırlığında azalma ile üremetoksisitesi göstermiştir. Tikagrelor dişi sıçanlarda düzensiz siklüslere (genellikle uzamışsiklüsler) neden olmuş; fakat erkek ve dişi sıçanlarda genel fertiliteyi etkilememiştir.
24 / 26
Radyoaktif işaretli tikagrelor ile yürütülen farmakokinetik çalışmalar, ana bileşiğin ve metabolitlerinin, sıçanların sütü ile atıldığını göstermiştir (bkz. Bölüm 4.6).
6. FARMASÖTİK ÖZELLİKLERİ6.1. Yardımcı maddelerin listesi
Mannitol 25 C Sodyum Nişasta GlikolatDibazik Kalsiyum Fosfat DihidratMagnezyum StearatHidroksipropil Metil SelülozTitanyum Dioksit
Polietilen Glikol 400/ Makrogol 400 Talk
Kırmızı Demir Oksit
6.2. Geçimsizlikler
Bilinen herhangi bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
24 ay
6.4.Saklamaya yönelik özel tedbirler
30C altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
Kutuda, PVC/PVDC (250 |im /40 g/m2) Şeffaf - Alu Folyo (20 |im) blister ambalajlarda 56 film tablet.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir.
7. RUHSAT SAHİBİ
Ali Raif İlaç San. A.Ş.
Yeşilce Mahallesi Doğa Sokak No: 434418 Kağıthane / İSTANBUL
8. RUHSAT NUMARASI:
2019/16
25 / 26
9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ
İlk ruhsatlandırma tarihi: 10.01.2019 Son yenileme tarihi:
10. KÜB'ÜN YENİLENME TARİHİ:
26 / 26
İlaç Bilgileri
Agrilor 60 Mg Film Kaplı Tablet
Etken Maddesi: Tikagrelor
Kullanma talimatı ve kısa ürün bilgileri
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.