Orniject 500 Mg/3ml İ.v İnfüzyonluk Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIORNİJECT® 500 mg/3 ml IV İnfüzyonluk Çözelti Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Bir ampul 500 mg ornidazol içerir. Yardımcı maddeler:Etanol................900 mg Propilen glikol......1600 mg Yardımcı maddeler için, Bkz. 6.1. 3. FARMASÖTİK FORMİnfüzyon için çözelti 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAnaerob bakterilere bağlı enfeksiyonlarda; septisemi, menenjit, peritonit, postoperatif yara enfeksiyonları, doğum sonrası septisemi, septik abortus ve söz edilen bakterilerin ispatlandığıveya varlığından şüphelenilen endometrit vakalarında. Özellikle kolon ve jinekolojikoperasyon geçirecek vakalar başta olmak üzere, cerrahi müdahalelerde profilaksi amacıyla. Amebiasis, amipli dizanteri dahil, Entamoeba histolyticd'nın neden olduğu tüm intestinal enfeksiyonlarda, amebiasis'in tüm ekstraintestinal formlarında, özellikle amebik karaciğerabsesinde.4.2. Pozoloji ve uygulamaekliPozoloji/ uygulama sıklıı ve süresi:Doktor tarafından başka şekilde tavsiye edilmediği takdirde; Önemli: Ampul içeriği kısa infüzyon şeklinde verilmeli, seyreltilmeden hiçbir şekilde enjekte edilmemelidir. 1. Anaerob bakterilere bağlı enfeksiyonlar a) Anaerob bakterilere bağlı enfeksiyonların tedavisi: 500-1000 mg'lık (1-2 ampul)infüzyonla başlanır, daha sonra her 12 saatte bir 500 mg'lık (1 ampul) veya 5-10 günboyunca her 24 saatte bir 1000 mg'lık enfüzyon yapılır. Hastanın durumu izin verdiğizaman parenteral tedavi yerini oral tedaviye bırakmalıdır. Örn. Her 12 saatte bir 500 mg (2tablet). b) Anaerob bakterilere bağlı enfeksiyonların profilaksisi: Ameliyattan yaklaşık yarım saatönce 1000 mg (2 ampul) infüzyon şeklinde uygulanır. Karışık enfeksiyonların 1 profilaksisinde ORNİJECT bir aminoglikozit, bir penisilin veya bir sefalosporinle kombine edilerek kullanılmalıdır. İlaçlar ayrı ayrı uygulanmalıdır. Ancak 250 ml serum fizyolojikveya dekstroz çözeltisinde 1000 mg ornidazol ve 2000 mg seftriakson fiziksel ve kimyasalolarak geçimlidir. 2. Amebik karaciğer absesi ve ciddi amipli dizanteri; Başlangıçta 500-1000 mg IV infüzyon şeklinde (1-2 ampul) verilip her 12 saatte bir ortalama 3-4 gün boyunca 500 mg'lıkinfüzyonlar halinde uygulanır. Uygulamaekli:Kullanıma hazır infüzyon çözeltisinin hazırlanması: ORNİJECT'in kullanıma hazır çözeltisini hazırlamak için 500 mg'lık ampul aşağıdaki infüzyon çözeltilerinden birinin en az 100 ml'si ile seyreltilmelidir: % 5 dekstroz, % 10dekstroz, Hartmann çözeltisi, Ringer çözeltisi, %%%2,5 dekstroz.Çözelti kısa IV infüzyon seklinde 15-30 dakikada uygulanır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği hastalarında dozaj değişikliğine gereksinim yoktur. Karaciğer yetmezliği:Tavsiye edilen doz uygulandığında 3 ml'lik ampullerden 900 mg etanol alınmaktadır. Bu nedenle karaciğer hastalığında uygulanan özel doz aşıldığında sağlık riski oluşmaktadır. Ağırkaraciğer yetmezliği olan hastalarda doz aralığı iki kat fazla olmalıdır. Pediyatrik popülasyon:Anaeroblara bağlı enfeksiyon endikasyonunda çocuklar için günlük doz 5-10 gün süreyle ikiye bölünmüş olarak 20 mg/kg vücut ağırlığındadır. Amibe bağlı karaciğer absesi ya da ciddi amip dizanterisinde çocuklar için günlük doz 20-30 mg/kg vücut ağırlığıdır. Geriyatrik popülasyon:Yaşlılar için özel dozaj önerileri bulunmamaktadır. 4.3. KontrendikasyonlarOrnidazol, diğer nitroimidazol türevleri veya ilacın içerdiği diğer yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda ORNİJECT kullanımıkontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriMerkezi sinir sistemi hastalığı (örn. epilepsi veya multipl skleroz) olan hastalarda ve ağır karaciğer hastalığı olanlarda dikkatli olmak gerekir. 2 Ampuller etanol içermektedir. Tavsiye edilen doz uygulandığında 3 ml'lik ampullerden 900 mg etanol alınmaktadır. Bu nedenle karaciğer hastalığında, epilepsisi olanlarda, alkoliklerde, epileptiklerde, beyin hasarı görenlerde, gebelerde, emziren annelerde ve çocuklarda uygulanan özel doz aşıldığındasağlık riski oluşmaktadır. Diğer ilaçların etkisi artabilir veya azalabilir. Duyarlı kişilerde aşırı duyarlılık reaksiyonları gelişebilir. 4.5. Diğer tıbbi ürünlerle etkileşim ve diğer etkileşim şekilleriOrnidazol kullanırken ve ilaç kesildikten sonra en az 3 gün boyunca alkol alınmamalıdır. Ancak, ornidazol kumarin-tipi oral antikoagülanların etkisini potansiyalize eder.Antikoagülanın dozu bu doğrultuda ayarlanmalıdır. Simetidin (antihistaminik), fenitoin ve fenobarbital gibi antiepileptik ilaçlar ve lityum ile birlikte kullanılırken dikkatli olunmalıdır. Ornidazol vekuronyum bromürün adale gevşetici etkisini uzatır. 4.6. Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Ornidazol için, gebeliklerde maruz kalmaya ilişkin klinik veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik / embriyonal / fetal gelişim / doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunugöstermemektedir. Ornidazol'ün çocuk doğurma potansiyeli bulunan kadınlara ve doğum kontrolü yöntemlerine etkisi bilinmemektedir. Gebelik dönemiDeğişik türlerde yapılan yaygın çalışmalarda ilaç herhangi bir teratojenik veya fetotoksik etki göstermemiştir. Bununla beraber gebe kadınlarda kontrollü bir çalışma yapılmamıştır. Genelbir prensip olarak ORNİJECT gebeliğin erken dönemlerinde gerekli olmadıkçaverilmemelidir. Laktasyon dönemiORNİJECT genel bir prensip olarak emziren annelere gerekli olmadıkça verilmemelidir. Üreme yeteneği/FertiliteOrnidazol, erkek farelerde 400 mg/kg/gün gibi yüksek dozda uygulandığında, düşük sperm hızı bakımından epididimal sperm motilitesini inhibe ederek infertilite meydanagetirmektedir. İnsanlar üzerinde yapılan çalışmalarından elde edilmiş veri bulunmamaktadır. 3 4.7. Araç ve makine kullanma üzerindeki etkilerORNİJECT alan hastalarda uyku hali, baş dönmesi, tremor, rijidite, koordinasyon bozuklukları, nöbet, vertigo veya geçici bilinç kaybı görülebilir. Eğer bu etkiler meydanagelirse, bu gibi etkiler araç ve makine kullanımı gibi dikkat gerektiren işleri etkileyebilir. 4.8. İstenmeyen etkilerÇok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor). Kan ve lenf sistemi hastalıklarıSeyrek: Lökopeni Sinir sistemi hastalıklarıÇok seyrek: Uyku hali, baş ağrısı, baş dönmesi, tremor, rijidite, koordinasyon bozuklukları, nöbet, yorgunluk, vertigo, geçici bilinç kaybı ve duyusal veya karışık periferal nöropati Gastrointestinal hastalıklarYaygın olmayan: Bulantı, kusma, ishal, epigastrik rahatsızlık, ağız kuruluğu ve iştahsızlık. Seyrek: Tat alma bozukluğu Hepato-biliyer hastalıklarBilinmiyor: Sarılık, anormal karaciğer fonksiyon testleri Deri ve deri altı doku hastalıklarıSeyrek: Kaşıntı ve cilt reaksiyonları Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıBilinmiyor: ORNİJECT'in intravenöz infüzyonu sırasında, aşırı duyarlılık ve lokal ağrı bazen kaydedilmiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr;[email protected];4.9. Doz aşımı ve tedavisiDoz aşımında istenmeyen etkiler kısmında kayıtlı semptomlar daha ciddi olarak seyreder. Spesifik antidotu yoktur. Kramp oluştuğunda diazepam verilmesi tavsiye edilir. 4 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: Enfeksiyona karşı kullanılan ilaçlar ATC kodu: P01AB03 Ornidazol 5-nitroimidazol türevi antibakteriyel ve antiprotozoal bir ilaçtır. İnvazif nitelikteki amibiyazis olgularında güçlü etkinlik gösterirler. ORNİJECT, BacteroidesClostridiumFusobacteriumEntamoebahistolytica'ya5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:İntravenöz yolla parenteral uygulanmaktadır. Dağılım:IV uygulamadan sonra ortalama dağılım hacmi kg başına 1 litredir. Ornidazolün plazma proteinlerine bağlanma oranı %13'tür. ORNİJECT'in etken maddesi serebrospinal sıvıya,vücut sıvılarına ve dokulara etkili konsantrasyonlarda geçer. Değişik endikasyonlara göreplazma konsantrasyonlarının (6-36 mg/l) optimal aralıkta olduğu tahmin edilmektedir.Sağlıklı gönüllülerde 12 saatte bir tekrarlanan uygulamalardan sonra birikme faktörü 1,5-2,5olarak hesaplanmıştır.Biyotransformasyon:Ornidazol karaciğerde başlıca 2-hidroksimetil ve a-hidroksimetil metabolitlerine metabolize olur. Değişmeyen ornidazole göre, bu iki metabolit Trichomonas vaginalisve anaerobikbakterilere karşı daha az etkilidir.Eliminasyon:Yarı-ömrü yaklaşık 13 saattir. Alınan tek dozun, % 85'i çoğu metabolize olarak ilk 5 gün içinde atılır. Dozun % 4'ü değişmeyen bileşik olarak idrarla atılmaktadır. Klinik öncesi güvenilirlik verileriGeçerli değil. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiEtanol Propilen glikol 6.2. GeçimsizliklerGeçerli değil. 5 6.3. Raf ömrü36 ay 6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. Işıktan koruyunuz. 6.5. Ambalajın niteliği ve içeriğiORNİJECT ampul, 3 ml, 1 adet. Tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler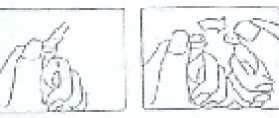
Nokta yukarıda bulunacak şekilde tutulur. Ampulün baş kısmı ok yönünde aşağıya doğru çekilir. Testere kullanılmasına gerek yoktur. Kullanılmamış olan ürünler ya da artık maddeler Tıbbi Atıkların Kontrolü Yönetmeliği' ve Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİTÜM EKİP İLAÇ AŞ. İstanbul Tuzla Kimya Organize Sanayi Bölgesi Aromatik Cad. No: 55 Tuzla-İSTANBUL Tel. No: 0216 593 24 25 (Pbx) Faks No: 0216 593 31 41 8. RUHSAT NUMARASI220/96 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 28.09.2009 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ6 |
İlaç BilgileriOrniject 500 Mg/3ml İ.v İnfüzyonluk ÇözeltiEtken Maddesi: Ornidazol Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.