Cervarix 0.5 mL Enj. Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » Aşılar » AŞI KOMBİNASYONLARI KISA URUN BILGISI 1. BEŞERİ TIBBI ÜRÜNÜN ADICERVARIX 0.5 mL İM enjeksiyon için süspansiyon içeren kullanıma hazır enjektör [Human Papillomavirüs (Tip 16 ve 18) Rekombinant AS04 adjuvanlı Aşı]2. KALITATIF VE KANTİTATIF BILEŞIM ETKIN MADDELER:1 doz (0.5 mL) içinde:İnsan Papillomavirüs1 tip 16 L1 proteini2,3,4..................................20 mikrogram İnsan Papillomavirüs1 tip 18 L1 proteini2,3,4..................................20 mikrogram 1İnsan Papillomavirüs = HPV r\AS04 ile adjuvanı içeriğinde: 3-0-desaçil-4' - monofosforil lipid A (MPL)3.................................50 mikrogram 3alüminyum hidrokside adsorbe edilmiş, hidrate (Al (OH)3) toplamda 0.5 miligram Al3+ '4elde edilen Hi-5 Rix4446 hücrelerinin kullanıldığı bir Baculovirus ekspresyon sistemi kullanılarak yapılan rekombinant DNA teknolojisi ile üretilen enfeksiyöz olmayan virüs benzeri partiküller (VLP'ler) formunda L1 protein.Yardımcı maddeler:Sodyum klorür....................................................................................4.4 mgSodyum dihidrojen fosfat dihidrat.....................................................0.624 mg Yardımcı maddelerin tam listesi için bölüm 6.1'e bakınız. 3. FARMASÖTIK FORMEnjeksiyon İçin Süspansiyon İçeren Kullanıma Hazır Enjektör CERVARIX bulanık, beyaz renkli bir süspansiyondur.Muhafaza sırasında berrak, renksiz süpernatant ile birlikte ince beyaz çökelti gözlenebilir. 4. KLİNIK ÖZELLIKLERI4.1. Terapötik endikasyonlarCERVARIX aşısı, 9 yaşından itibaren belli onkojenik Human Papilloma Virüs (HPV) tipleri ile nedensel ilişkisi olan yüksek evredeki servikal lezyonların ve servikal kanserin önlenmesi için endikedir. Bu endikasyonu destekleyen verilere ilişkin önemli bilgiler için Bkz. Bölüm 4.4 ve 5.1..CERVARIX resmi öneriler doğrultusunda kullanılmalıdır. 4.2. Pozoloji ve uygulama şekli Pozoloji:Primer aşılama programı 0,5 mL'lik 3 ayrı dozdan oluşur.Bir rapel dozu gereksinimi belirlenmemiştir (bkz. Bölüm 5.1). Uygulama sıklığı ve süresi:Önerilen aşılama programı 0, 1, 6 aylık takvime göre uygulanır.Aşılama programında esneklik gerekli ise, ikinci doz ilk dozdan sonraki 1 ay ile 2.5 ay arasında ve üçüncü doz da ilk dozdan sonraki 5 ila 12 ay arasında uygulanabilir. İlk CERVARIX dozunu alan hastaların 3 dozluk CERVARIX aşılama programını tamamlaması önerilmektedir (bkz. Bölüm 4.4). Uygulama şekli:CERVARIX intramüsküler enjeksiyon içindir, üst kolun deltoid bölgesine uygulanır.Kullanmadan önce iyice çalkalanması gerekir. Çalkalandıktan sonra bulanık, beyaz renkli sıvı halini alır. Özel populasyonlara ilişkin ek bilgilerCERVARIX'in güvenilirlik, immünojenite ve etkinliği, HIV ile enfekte bireylerde ve immunosupresif tedavi alan hastalarda kapsamlı biçimde incelenmemiştir.Böbrek/Karaciğer yetmezliği:CERVARIX'in böbrek ve karaciğer yetmezliği olan kişilerdeki güvenilirlik ve etkinliği incelenmemiştir.Pediyatrik popülasyon:CERVARIX 9 yaş altı grupta immünojenite ve güvenilirliğe ilişkin veri eksikliği nedeniyle bu yaş grubundaki kız çocuklarında kullanımı önerilmemektedir.Geriyatrik popülasyon:CERVARIX'in 55 yaşın üzerindeki erişkinlerdeki güvenilirlik ve etkinliği incelenmemiştir.4.3. KontrendikasyonlarCERVARIX, aşının bileşenlerinden herhangi birine karşı aşırı duyarlılığı olduğu bilinen kişilere uygulanmamalıdır(bkz.Bölüm 2).Akut şiddetli ateşli hastalığı olanlarda CERVARIX uygulaması ertelenmelidir. Ancak, soğuk algınlığı gibi hafif bir enfeksiyon varlığı aşılama için bir kontrendikasyon oluşturmaz. 4.4. Özel kullanım uyarıları ve önlemleriBireysel olarak bir kadının aşılanmasına yönelik kararda kadının daha önce HPV'ye maruz kalmış olma riski ve aşılamadan elde edeceği potansiyel yarar dikkate alınmalıdır.Tüm enjeksiyonluk aşılarda olduğu gibi aşının uygulanmasını takiben seyrek olarak görülebilecek anafilaktik olaylar için her zaman gerekli tıbbi tedavi ve gözetim hazır bulundurulmalıdır. Özellikle adolesanlarda, iğne ile enjeksiyona karşı bir psikojenik yanıt olarak, aşılamanın ardından, hatta aşılama öncesinde, senkop (bayılma) görülebilir. Buna geçici görme bozukluğu, parestezi ve iyileşme sırasında tonik-klonik hareketler gibi birçok nörolojik belirti eşlik edebilir. Bayılma sebebiyle oluşabilecek yaralanmaları önlemek için gerekli prosedürlerin hazır olması önemlidir. CERVARIX hiçbir durumda intravasküler veya intradermal yolla uygulanmamalıdır. CERVARIX'in subkütan yolla uygulaması ile ilgili veri bulunmamaktadır. İntramüsküler yoldan uygulanan diğer aşılar gibi, CERVARIX'in intramüsküler uygulanması sonrasında kanama olabileceğinden trombositopeni ya da koagülasyon bozukluğu olanlarda, dikkatle yapılmalıdır. Diğer aşılarda olduğu gibi, aşılanan kişilerin tümünde koruyucu immun yanıt sağlanamayabilir. CERVARIX sadece HPV tip 16 ve 18 nedenli hastalıklara karşı ve belli oranda da bazı onkojenik HPV tiplerinin neden olduğu hastalıklara karşı koruma sağlar (bakınız Bölüm 5.1). Dolayısıyla, cinsel yolla bulaşan hastalıklara karşı uygun yöntemlerin kullanılmasına devam edilmelidir. CERVARIX sadece profilaktik kullanıma yöneliktir ve aktif HPV enfeksiyonlarına veya kanıtlanmış klinik hastalığa karşı bir etkisi yoktur. CERVARIX'in tedavi edici bir etkisi olduğu kanıtlanmamıştır. Dolayısıyla, aşı servikal kanserin veya servikal intraepitalyal neoplazinin (CIN) tedavisi için endike değildir. Ayrıca kanıtlanmış HPV ile ilişkili lezyonların veya aşı uygulanmış ya da uygulanmamış mevcut HPV enfeksiyonlarının ilerlemesinin engellenmesinde de endike değildir (Bkz. Bölüm 5.1 Çalışma başlangıcında HPV-16 veya HPV-18 enfeksiyonu olduğu kanıtlanmış kadınlarda etkinlik). Aşılama rutin servikal taramanın yerini tutmaz. Hiçbir aşı %100 etkili olmadığından ve CERVARIX tüm HPV tiplerine karşı veya mevcut HPV enfeksiyonlarına karşı koruma sağlamadığından, rutin servikal tarama kritik önem taşımaya devam etmektedir ve yerel öneriler izlenmelidir. Korunmanın süresi henüz tamamiyle saptanmamıştır. Rapel doz(larının) zamanlaması ve gerekliliği araştırılmamıştır. HIV ile enfekte hastalar veya immunsupresif tedavi gören hastalar gibi immün yanıtı bozulmuş hastalarda CERVARIX kullanımı ile ilgili veri bulunmamaktadır. Diğer aşılarda olduğu gibi, bu bireylerde yeterli immün yanıt elde edilemeyebilir. Diğer HPV aşıları ile CERVARIX'in birbiri yerine kullanılabilirliğini destekleyen hiçbir güvenilirlik, immünojenisite veya etkinlik verisi bulunmamaktadır. CERVARIX 0,5 mL'lik dozunda 23 mg'dan daha az sodyum (sodyum klorür, sodyum dihidrojen fosfat dihidrat) içerir. Sodyum miktarına bağlı herhangi bir olumsuz etki beklenmez. Tüm klinik çalışmalarda, ilk aşı dozunun uygulanmasından önceki 3 ay içinde immunoglobülin veya kan ürünleri almış olan bireyler çalışmadan çıkarılmıştır. Diğer Aşılarla Birlikte Kullanım: CERVARIX, aşağıdaki aşı bileşenlerinden herhangi birine karşı klinik olarak anlamlı antikor yanıtı interferansı olmaksızın inaktive poliomiyelit (IPV) ile veya bu olmaksızın difteri (d), tetanoz (T) ve pertussis [asellüler] (pa) (dTpa, dTpa-IPV aşıları) ile eş zamanlı olarak uygulanabilir. Kombine dTpa-IPV aşısının bir ay sonra CERVARIX ile sıralı olarak uygulanması tek başına CERVARIX'e kıyasla daha düşük anti-HPV-16 ve anti-HPV-18 GMT meydana getirme eğilimindedir. Bu bulgunun klinik anlamlılığı bilinmemektedir. CERVARIX eş zamanlı olarak bir hepatit A (inaktive) ve hepatit B (rDNA) kombine aşısı (Twinrix) veya hepatit B (rDNA) aşısı (Engerix B) ile birlikte uygulanabilir. CERVARIX'in eş zamanlı olarak Twinrix ile birlikte uygulanması HPV ve hepatit A antijenlerine karşı klinik olarak anlamlı herhangi bir interferans sergilememiştir. Anti-HB'nin geometrik ortalama antikor konsantrasyonları eş zamanlı uygulamada önemli ölçüde düşüktür; ancak koruyucu antikor oranları etkilenmeden kaldığı için bu gözlemin klinik anlamlılığı bilinmemektedir. >10mIU/ml anti-HB'ye erişen kişilerin oranı eş zamanlı aşılamada %98.3 ve tek başına Twinrix ile %100'dür.CERVARIX Engerix B ile eş zamanlı olarak uygulandığında benzer sonuçlar gözlenmiştir; >10mIU/ml anti-HB'ye erişen kişilerin oranı eş zamanlı aşılamada %97.9 ve tek başına Engerix B ile %100'dür. Eğer CERVARIX başka bir aşı ile eşzamanlı verilecek ise aşılar her zaman farklı enjeksiyon bölgelerine uygulanmalıdır. Hormonal Kontraseptifler ile Birlikte Kullanım: Klinik etkinlik çalışmalarında, CERVARIX alan kadınların yaklaşık %60'ı hormonel kontraseptif kullanmıştır. Hormonel kontraseptif kullanımının CERVARIX etkinliği üzerine bir etkisi olduğuna dair hiçbir kanıt bulunmamaktadır. Sistemik İmmünosupresif İlaçlar ile Birlikte Kullanım: Diğer aşılarda da olduğu gibi, immunosupresif tedavi gören hastalarda elde edilemeyebilir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)CERVARIX'in embriyofötal, perinatal ve postnatal hayatta kalma ve gelişim üzerine etkisi sıçanlar üzerinde değerlendirilmiştir. Bu hayvan çalışmaları fertilite, gebelik, embriyonal/fötal gelişim, doğum veya postnatal gelişim üzerine doğrudan veya dolaylı olarak zararlı etkilerinin olduğunu göstermemektedir.Hormonal kontraseptif kullanımının CERVARIX'in etkinliğini değiştirdiğine dair herhangi bir kanıt yoktur (bkz.Bölüm 4.5).Gebelik dönemiHayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir(bkz.Bölüm 5.3).Gebe kadınlarda aşı ile ilgili spesifik çalışmalar yürütülmemiştir. Bununla birlikte, klinik geliştirme programı sırasında toplamda 3993 gebelik rapor edilmiş olup, bu gebeliklerden 2009'u CERVARIX almış kadınlarda idi. Sonuçta, spesifik sonuçlar (örn., normal bebek, konjenital anomalileri de içeren anormal bebekler, prematüre doğum ve spontan düşük) yaşayan gebe kişi oranları tedavi grupları ile benzer bulunmuştur. Bu veriler, gebelik sırasında CERVARIX kullanımını önermek için yeterli değildir. CERVARIX, gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Dolayısıyla, aşılama gebeliğin tamamlanmasından sonraya ertelenmelidir. Laktasyon dönemiEmziren annelere uygulanan CERVARIX'in bebekler üzerine etkisi klinik çalışmalarda değerlendirilmemiştir.CERVARIX laktasyon döneminde yalnızca olası avantajlar olası risklerden üstünse kullanılmalıdır. Üreme yeteneği / FertiliteHayvan çalışmaları fertilite üzerine doğrudan veya dolaylı olarak zararlı etkilerinin olduğunu göstermemektedir.4.7. Araç ve makine kullanımı üzerindeki etkilerCERVARIX'in araç ve makine kullanma becerisini etkilediğini gösteren hiçbir veri yoktur.4.8. İstenmeyen etkilerKlinik çalışmalar:10 ila 72 yaş arası kız çocukları ve kadınların dahil edildiği klinik çalışmalarda, 16142 gönüllü CERVARIX alırken, 13811 gönüllü kontrol almıştır (Çalışmaya dahil edilenlerin %79.2'si çalışmaya dahil edilme zamanında 10-25 yaş arasındadır). Bu gönüllüler tüm çalışma dönemi boyunca ciddi advers olaylar için izlenmişlerdir. Önceden tanımlanmış bir alt grubundaki gönüllülerde (CERVARIX = 8130, kontrol = 5786), advers olaylar her enjeksiyon sonrasındaki 30 gün boyunca izlenmiştir. Aşı uygulaması sonrasında en sık gözlenen yan etki, tüm dozların % 78'inde görülen enjeksiyon yerinde ağrıdır. Bu reaksiyonların çoğu, hafif ve orta şiddetli olmakla birlikte uzun süreli değildir. En azından aşılama ile ilişkili olma ihtimali olan istenmeyen etkiler, görülme sıklıklarına göre kategorize edilmiştir. Sıklık sınıflaması aşağıdaki gibi bildirilmiştir: Çok yaygın (> 1/1o) Yaygın (> 1/100 <1/10) Yaygın olmayan (> 1/1.000 <1/100) Seyrek (> 1/10.000 <1/1.000) Çok seyrek (< 1/10.000) Enfeksiyon ve enfestasyonlarYaygın olmayan: Üst solunum yolu enfeksiyonuSinir sistemi bozukluklarıÇok yaygın: Baş ağrısıYaygın olmayan: Sersemlik Gastrointestinal bozukluklarYaygın: Bulantı, kusma, diyare ve karında ağrı dahil gastrointestinal belirtilerDeri ve derialtı doku bozukluklarıYaygın: Kaşıntı/pruritus, deride döküntü, ürtiker.Kas-iskelet bozuklukları, bağ doku ve kemik bozukluklarıÇok yaygın: Kaslarda ağrıYaygın: Eklemlerde ağrı Genel ve uygulama bölgesine ilişkin bozukluklarÇok yaygın: Enjeksiyon bölgesinde: ağrı, kızarıklık, şişlik; yorgunluk.Yaygın: Ateş (>38o C) Yaygın olmayan: Enjeksiyon bölgesinde sertlik, bölgesel uyuşma. Geçmiş veya mevcut HPV enfeksiyonu olan hastalar ile onkojenik HPV DNA negatif veya HPV-16 ve HPV-18 antikorları için seronegatif olan gönüllülerde benzer bir güvenilirlik profili gözlenmiştir. Pazarlama sonrası izlem: Bu olaylar spontane olarak bildirildiğinden, bunların sıklığının güvenilir bir şekilde hesaplanması mümkün değildir. Kan ve lenfatik sistem bozukluklarıLenfadenopatiimmün sistem bozukluklarıAlerjik reaksiyonlar (Anafilaktik ve anafilaktoid reaksiyonlar dahil), anjiyodemSinir sistemi bozukluklarıZaman zaman tonik klonik hareketlerle seyreden senkop veya vazovagal yanıtlar (bkz. Bölüm 4.4)4.9. Doz aşımı ve tedavisiDoz aşımı ile ilgili herhangi bir bildirim yapılmamıştır.5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: Viral aşı ATC Kodu: J07B M02Etki mekanizmasıCERVARIX, onkojenik HPV tip-16 ve tip-18'in majör kapsit proteini olan L1'in yüksek oranda saflaştırılmış virüs benzeri partiküllerden (VLP) hazırlanmış, non-enfeksiyöz, AS04 adjuvanlı rekombinant bir aşıdır. VLP'ler viral DNA içermediğinden hücreleri enfekte edemezler, üreyemezler veya hastalığa neden olamazlar. Hayvan çalışmaları L1 VLP aşılarının etkinliğine büyük oranda hümoral immun yanıt gelişiminin aracılık ettiğini göstermiştir. HPV-16 ve HPV-18 'in tüm dünya genelindeki servikal kanser olgularının yaklaşık % 70'inden sorumlu olduğu düşünülmektedir. Diğer onkojenik HPV tipleri de servikal kansere sebep olabilir (yaklaşık %30) HPV 45, -31 ve -33 tipleri, skuamöz hücreli servikal kanserlerde (%12.1) ve adenokarsinomlarda (%8.5) en sık saptanan 3 aşı-dışı HPV tipidir. İnvazif servikal kanser, skuamöz hücreli servikal kanseri (%84) ve adenokarsinomu (tarama programları olan gelişmiş ülkelerde %16-20) kapsamaktadır. Bölüm 4.1'de geçen yüksek evredeki servikal lezyon terimi yüksek evredeki İntraepiteliyal Neoplaziye karşılık gelmektedir. (CIN2/3). Klinik çalışmalarYaşları 15 ile 25 arasında olan toplam 19778 kadının dahil olduğu kontrollü, çift kör, randomize, faz II ve faz III iki klinik çalışmasında CERVARIX'in etkinliği değerlendirilmiştir. Faz II çalışmasına (çalışma 001/007) yalnızca aşağıdaki özellikleri taşıyan kadınlar dahil edilmiştir: - Onkojenik HPV DNA tip 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 ve 68 için test sonucunun negatif olması, - HPV-16 ve HPV-18 için seronegatif olması, - Normal sitolojiye sahip olması. Birincil etkinlik sonlanma noktası HPV-16 ve/veya HPV-18'e bağlı gelişen enfeksiyondur. On iki ay devam eden inatçı enfeksiyon ilave bir etkinlik sonlanma noktası olarak değerlendirilmiştir. Faz III çalışmasına (çalışma 008) başlangıç sitolojisi, HPV serolojisi ve DNA durumu gibi, HPV enfeksiyonunun varlığı için ön tarama yapılmayan kadınlar dahil edilmiştir. Birincil etkinlik sonlanma noktası HPV-16 ve/veya HPV-18 (HPV-16/18) ile ilişkili CIN2+'dir. Servikal İntraepitelyal Neoplazi (CIN) evre 2 ve 3 (CIN2/3) ve servikal adenokarsinoma in situ (AIS) klinik çalışmalarda servikal kanser için bir belirteç olarak kullanılmıştır. Sekonder sonlanma noktaları 6 ve 12 aylık inatçı enfeksiyonu kapsamaktadır. En az 6 ay süren inatçı enfeksiyonun servikal kanser için anlamlı bir alternatif belirteç olduğu gösterilmiştir. OnkojenikHPVtiplerine maruz kalmamışp^;pülasy^^daHPV-16/18'e karşı koruyucu etkinlikÇalışma 001'de kadınlar (N=1113) aşılanmış ve 27. aya kadar etkinlik yönünden değerlendirilmiştir. Çalışma 007'de, çalışma 001 sırasında aşılanan kadınlardan oluşan bir alt küme (N=776), ilk uygulanan dozu takiben 6.4 yıl (yaklaşık 77 ay) kadar izlenmiştir (ortalama takip süresi 5.9 yıldır). Çalışma 001'de kontrol grubunda 12 ay devam eden inatçı HPV-16/18 enfeksiyonu olan 5 vaka (4 HPV-16; 1 HPV-18) ve aşı grubunda da bir HPV-16 vakası bulunmuştur. Çalışma 007'de 12 ay devam eden inatçı HPV-16/18 enfeksiyonuna karşı CERVARIX'in etkinliği % 100 olarak belirlenmiştir (% 95 Cl: 80.5; 100). Tümü kontrol gruplarında olmak üzere, 16 inatçı HPV-16 enfeksiyonu vakası ve 5 kalıcı HPV-18 enfeksiyonu vakası bulunmuştur. HPV-023 çalışmasında, 001/007 çalışmasının Brezilya grubunda (N=437) yer alan kişiler, ilk dozdan sonra ortalama 8.9 yıl (standart sapma 0.4 yıl) takip edilmiştir. Çalışma tamamlandığında, HPV-023 çalışması aşı grubunda HPV-16 veya HPV 18 ile ilişkili hiç bir enfeksiyon veya histopatolojik lezyon vakası olmamıştır. Plasebo grubunda 4 adet 6 aylık inatçı enfeksiyon vakası ve 1 adet 12 aylık enfeksiyon vakası olmuştur. Bu çalışma bu sonlanma noktaları için aşı ve plasebo grupları arasındaki farkı göstermek için tasarlanmamıştır. HPV-16 ve/veya HPV-18 'e maruz kalmamış olan kadınlarda koruyucu etkinlikHPV-008 çalışmasında, Kohort Çalışma Protokolüne göre primer etkinlik analizleri gerçekleştirilmiştir (ATP (According to Protocol) Kohortu: 3 aşı dozu alan kadınlar ve analizde 0. ayda DNA negatif ve seronegatif ve 6. ayda analizde dikkate alınan HPV tipi yönünden negatif olan kadınlar) Bu gruba başlangıçta normal veya düşük (popülasyonun %0.5'i). ATP grubu için vaka sayımı 1. günde, üçüncü aşı dozunun ardından başlamıştır. Genel olarak, HPV-16 ve HPV-18 maruziyeti olmayan kadınların %74'ü çalışmaya dahil edilmiştir (yani çalışmaya girişte DNA negatif ve seronegatif olan kadınlar). HPV-008 çalışmasına ait iki analiz gerçekleştirilmiştir: ATP kohortunda HPV-16/18 ile ilişkilendirilen en az 36 CIN2+ vakası biriktiğinde gerçekleştirilen olayla-tetiklenen analiz ve çalışma-sonu analizi. Primer sonlanma noktası CIN2+'ye karşı aşı etkinliği Tablo 1'de gösterilmiştir. Bir destek analizinde, CERVARIX'in etkinliği HPV-16/18'le ilişkili CIN3+'e karşı değerlendirilmiştir. HPV-16/18 sonlanım noktasıCERVARIX(N=7338)Etkinlik %'si (%95 GA)Kontrol(N=7305):(2yn%94.9 (87.7;98.4)
CIN2+
5
97 %91.7 (66.6;99.1)
CIN3+
2
24 (3)-
(1)ATP: 3 doz aşı yapılmış, ilgili HPV tipi 0. ayda DNA negatif ve seronegatif; 6 ayda ise DNA negatif olan kadınlar (HPV-16 veya HPV-18) . doz sonrası ortalama 40 ay izlem (2)-Olayla-tetiklenen analizde etkinlik sonuçları 6 aylık inatçı enfeksiyona karşı %94.3 (%96.1 GA:91.5;96.3) ve 12 aylık inatçı enfeksiyona karşı %91.4 (%96.1 GA:89.4;95.4) idi. Çalışma başlangıcında HPV-16 veya HPV-18 bulgusu olan kadınlarda HPV-16/18'e karşı etkinlik.Kişilerin çalışma başlangıcında HPV DNA pozitif olduğu HPV tipi virüslere karşı koruma sağlandığına ilişkin bulgu yoktur. Ancak, halihazırda aşılama öncesinde aşıyla ilişkili HPV tiplerinden biriyle enfekte olmuş (HPV DNA pozitif) kişiler diğer aşı HPV tipinin neden olduğu klinik hastalıktan korunmuştur. Daha önceden enfeksiyon veya hastalığı olan ya da olmayan kadınlarda HPV tiplerine karşı koruma.Toplam Aşılanan Grup (TVC) başlangıçtaki HPV DNA durumu, sitoloji ve seolojik durumdan bağımsız olarak en az bir doz aşı uygulanan tüm kişileri kapsamaktadır. Bu grup şu anda veya önceden HPV enfeksiyonu olan ve olmayan kadınları kapsamaktadır. TVC için vaka sayımı 1. günde, birinci aşı dozunun ardından başlamıştır. Bu grup CERVARIX tarafından etkilenmesi beklenmeyen, önceden mevcut enfeksiyonların/lezyonların görüldüğü kadınları kapsadığından, etkinlik hesapları daha düşüktür. TVC 15-25 yaş aralığında genel kadın popülasyonu ile orantılı olabilir. Çalışma sonunda TVC'de gözlenen HPV-16/18 ile ilişkilendirilen yüksek evredeki servikal lezyonlara karşı aşının etkinliği Tablo 3'te gösterilmiştir.
Tablo 4: HPV-16/18 ile ilişkili virolojik sonlanım noktalarına karşı aşı etkinliği (TVC)
Aşının HPV hastalık yükü üzerindeki toplam etkisiHPV-008 çalışmasında, yüksek evredeki servikal lezyonların insidansı, lezyondaki HPV DNA tipine bakılmaksızın plasebo ve aşı grubu arasında karşılaştırılmıştır. Çalışma sonunda TVC ve daha önce TVC dışında kalan gruplarda, yüksek evredeki servikal lezyonlara karşı aşının etkinliği gösterilmiştir (tablo 5). Daha önceden TVC dışında kalan kişiler, normal sitolojisi olan, başlangıçta 14 onkojenik HPV tipi açısından HPV DNA negatif olan ve HPV-16 ve HPV 18 açısından seronegatif olan kadınları kapsayan bir TVC alt grubudur. Çalışma sonu analizi5CERVARIXKontrolOlgularOlgularNNEtkinlik %'si(%95 GA)CIN2+
TVC-naif^1)
5466
61
5452
172 T2T
TVC
8694
287
8708
428 %64.9 (52.7;74.2)%33.1 (22.2;42.6)CIN3+
TVC-naif^1)
5466
3
5452
44 T2T
TVC
8694
86
8708
158 %93.2 (78.9;98.7)%45.6 (28.8;58.7)
İmmünojeniteCERVARIX ile primer aşılama programı sonrası immün yanıtHPV aşıları için, aşı HPV tipleri ile ilişkili inatçı enfeksiyona ya da 2. veya 3. evredeki CIN'a karşı koruma ile ilişkili hiçbir minimal antikor düzeyi saptanmamıştır. HPV-16 ve HPV-18'e karşı oluşan antikor yanıtları, psödoviriona dayalı nötralizasyon tayini ile korelasyon içinde olan tip spesifik ELISA yöntemi ile hesaplanmıştır. 3 CERVARIX dozu ile indüklenen immünojenite, yaşları 9 ile 55 arasında olan 5465 kadın gönüllü üzerinde değerlendirilmiştir. Klinik çalışmalarda başlangıçta seronegatif olan gönüllülerin % 99'dan fazlası üçüncü dozdan 1 ay sonra hem HPV-16 hem de HPV-18 için serokonversiyon göstermiştir. Aşının indüklediği IgG Geometrik Ortalama Titreleri (GMT) daha da önce enfekte olmuş ancak HPV enfeksiyonu ortadan kalkmış (doğal enfeksiyon) kadınlarda gözlenen titrelerin hayli üzerindedir. Başlangıçta seronegatif ve seropozitif olan gönüllüler aşılamadan sonra benzer titrelere ulaşmıştır. CERVARIXiçin immün yanıt sürekliliğiHPV-001/007 Çalışması'nda yaşları 15 ile 25 arasında olan kadınlarda birinci dozun uygulanmasını takiben 76 ay boyunca HPV-16 ve HPV-18'e karşı verilen immün yanıt değerlendirilmiştir. 023 çalışmasında (001/007 çalışmasının alt grubu), immün yanıt 113. aya kadar değerlendirilmeye devam edilmiştir. Aşı grubundaki 92 kişinin ortalama 8.9 yıllık izlem ile [M107-M113] aralığı sonrasında immünojenisite verileri mevcuttur. Bu kişilerin %100'ü (%95 GA: 96.1; 100) ELISA tayininde HPV-16 ve HPV-18 yönünden seropozitif olarak kalmıştır. 7.ayda doruğa ulaşıp sonrasında 18. aydan [M107-M113] aralığına kadar bir platoya ulaşmak üzere azalmış olan her iki HPV-16 ve HPV-18 tipi için de aşının indüklediği IgG Geometrik Ortalama Titreleri (GMT), doğal HPV enfeksiyonu geçiren kadınlarda gözlenen ELISA GMT'ye kıyasla en az 10 kat daha fazladır. Çalışma 008'de, 48 aya kadarki gözlenen immünojenite çalışma 001'de gözlenen yanıta benzerdir. Nötralize edici antikorlarla benzer bir kinetik profil gözlenmiştir. 15 ile 55 yaş arasındaki kadınlarda yapılan bir başka klinik çalışmada (çalışma 014), tüm gönüllüler üçüncü dozun ardından hem HPV tip 16'ya hem de tip 18'e serokonversiyon göstermiştir (7. ayda). Ancak 25 yaş üzeri kadınlarda GMT değerleri daha düşük bulunmuştur. Bununla birlikte tüm hastalar takip fazı boyunca (18. aya kadar) doğal enfeksiyondan sorumlu olan antikor düzeylerinin üzerinde bir antikor düzeyini koruyarak her iki tip için de seropozitif olmayı sürdürmüştür. Anamnestik Yanıt (İmmün Bellek) BulgusuÇalışma 024'de (001/007 çalışmasının alt grubu) ilk aşı dozu uygulamasından sonra ortalama 6.8 yıl aralığında 65 kişiye CERVARIX dozu uygulanmıştır. Bu dozun ardından bir hafta ve bir ay sonra HPV-16 ve HPV-18'e anamnestik immün yanıt verilmiştir; doz uygulamasının bir ay sonrasındaki GMT'ler ilk 3 dozluk aşının bir ay sonrasında gözlenenleri aşmıştır. Genç erişkin kadınlarla adolesanlar arasında CERVARIXetkinliği bağlantısının kurulmasıHavuzlanmış bir analizde,3. dozdan sonra (7. ayda) 9 yaşındaki kadınların %99.7 ve %100'ü sırasıyla HPV16 ve HPV 18 için serokonversiyon göstermiştir. 10-14 ve 15-25 yaşları arasındaki kadınlarla kıyaslandığında bunların GMT değerleri sırasıyla en az 1.4 kat ve 2.4 kat daha yüksek bulunmuştur. 10 - 14 yaş arasındaki kızlar ve adolesanlar üzerinde yapılan iki klinik çalışmada, tüm gönüllüler üçüncü dozdan sonra (7. ayda) HPV-16 ve HPV-18 için serokonversiyon göstermiştir. 15 - 25 yaşları arasındaki kadınlarla kıyaslandığında bunların GMT değerleri en az iki kat daha yüksek bulunmuştur. Bu immünojenite verileri baz alındığında, 9 ile 14 yaş arasında CERVARIX'in etkili olduğu sonucuna varılmıştır. 5.2. Farmakokinetik özelliklerAşılar için farmakokinetik özelliklerin değerlendirilmesi gerekmemektedir.5.3. Klinik öncesi güvenlilik verileriGüvenlilik farmakolojisi, akut ve tekrarlanan doz toksisitesi, lokal tolerans, fertilite, embriyofetal ve doğum sonrası toksisite (laktasyon döneminin sonuna kadar) çalışmalarına dayanarak klinik öncesi veriler insanlarda özel tehlike göstermediğini ortaya koymaktadır.Serolojik veriler sıçanlarda laktasyon dönemi boyunca süt aracılığıyla anti-HPV-16 ve anti-HPV-18 antikorlarının geçtiğini düşündürmektedir. Bununla birlikte, aşı ile indüklenen antikorların anne sütü ile atılıp atılmadığı bilinmemektedir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSodyum klorürSodyum dihidrojen fosfat dihidrat Enjeksiyonluk su AS04 adjuvanı içeriğinde: 3-0-desaçil-4' - monofosforil lipid A (MPL) Alüminyum hidrokside adsorbe edilmiş, hidrate (Al (OH)s) 6.2. GeçimsizliklerBu tıbbi ürüne ait geçimlilik çalışmaları olmadığından diğer tıbbi ürünlerle karıştırılarak kullanılmamalıdır.6.3. Raf ömrü48 aydır.CERVARIX buzdolabından çıkartıldıktan sonra mümkün olan en kısa sürede uygulanmalıdır. Bununla birlikte, üretilen stabilite verileri CERVARIX'in buzdolabının dışında 8°C ile 25°C derece arasındaki sıcaklıklarda üç güne kadar ya da 25 °C ile 37 °C derece arasındaki sıcaklıklarda bir güne kadar saklanması halinde stabil kaldığını ve aşının uygulanabileceğini göstermektedir. Bu aşının bu parametreler dışında saklanmış olması halinde firmamız ile irtibata geçiniz. 6.4. Saklamaya yönelik özel uyarılar2 °C - 8 °C arası sıcaklıklarda (buzdolabında) saklayınız.Dondurmayınız. Donmuş ürünü çözüp kullanmayınız. Ambalajında, ışıktan koruyarak saklayınız. 6.5. Ambalajın niteliği ve içeriğiPiston tıpası (kauçuk butil) olan, kullanıma hazır, dolu enjektör içinde (Tip I cam) 0.5 mL süspansiyon bulunan, iğneli, tekli ambalajlar halinde sunulmaktadır.6.6. Tıbbi ürünlerden arta kalan maddelerin imhası ve diğer özel önlemlerDepolama sırasında kullanıma hazır şırınga içinde berrak renksiz süpernatant ile birlikte ince beyaz çökelti gözlenebilir. Bu durum bozulma belirtisi değildir.Uygulama öncesi, şırınga içeriği çalkalanmadan önce ve çalkalandıktan sonra herhangi bir partikül oluşumu ve/veya anormal fiziksel görüntü yönünden görsel olarak kontrol edilmelidir. Herhangi birinin varlığı gözlendiğinde aşı imha edilmelidir. Aşı kullanılmadan önce iyice çalkalanmalıdır. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. Kullanıma hazır enjektör içindeki aşının uygulanmasına yönelik talimatlar Enjektör gövdesi
Enjektör gövdesi1. Enjektörün gövdesini bir elinizde tutup (pistonu tutmayınız) enjektör kapağını saat yönünün tersine çevirerek açınız.
Enjektör Kapağı 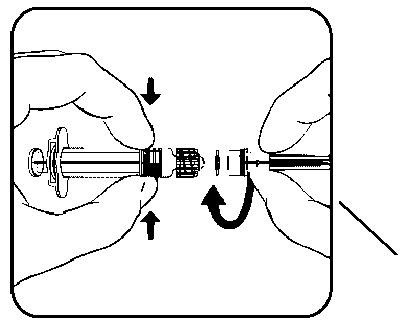 İğne kılıfı
İğne kılıfı2. İğneyi enjektöre takmak için, iğneyi sabitlendiğini hissedene kadar saat yönünde enjektörün içinde döndürünüz. 3. İğne kılıfını çıkarınız, kılıf bazen sert şekilde kapalı olabilir. 4. Aşıyı uygulayınız. 7. RUHSAT SAHİBİGlaxoSmithKline İlaçları Sanayi ve Ticaret A.Ş. Büyükdere Cad. No:173 1.Levent Plaza B Blok 34394, 1.Levent / İSTANBUL Tel no: 0 212 339 44 00 Faks no: 0 212 339 45 008. RUHSAT NUMARASI :49. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ |
İlaç BilgileriCervarix 0.5 mL Enj.Etken Maddesi: Human papillomavirus Atc Kodu: J07BM Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.