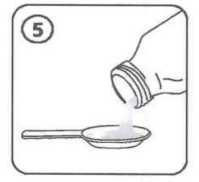
Cefaks 250 Mg/5 Ml Oral Süspansiyon Hazırlamak İçin Granül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADICEFAKS 250 mg/5 ml oral süspansiyon hazırlamak için granül 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her 5 ml' lik süspansiyon; 250 mg Sefuroksim' e eşdeğer Sefuroksim aksetil içermektedir. Yardımcı maddeler:Her 5 ml'sinde; Sukroz...............................3056,505 mg Aspartam..........................30 mg içerir. Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMSüspansiyon hazırlamak için granül Kuru toz: Aromatik kokulu (çilek), hemen hemen beyaz granül. Sulandırılmış ürün: Etiketinde belirtildiği şekilde sulandırıldığında homojen görünüşlü, aromatik kokulu (çilek), hemen hemen beyaz renkli süspansiyon. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarCEFAKS duyarlı mikroorganizmaların sebep olduğu enfeksiyonların tedavisinde endikedir. Endikasyonları aşağıdakileri içerir: Üst solunum yolu enfeksiyonları:Kulak, burun, boğaz enfeksiyonları, otitis media, sinüzit, tonsillit, farenjit gibi.Alt solunum yolu enfeksiyonları:Akut bronşit ve kronik bronşitin akut alevlenmeleri ve pnömoni gibi.Genito-üriner sistem enfeksiyonları:Pyelonefrit, sistit ve üretrit gibi.Deri ve yumuşak doku enfeksiyonları:Fronkül, piyoderma, impetigo gibi.Gonore:Akut ve komplike olmayan gonokokal üretrit ve servisit.Erken Lyme hastalığı tedavisinde ve takiben yetişkin ve 12 yaştan büyük çocuklarda geç Lyme hastalığı profilaksisinde. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresiOlağan tedavi süresi 7 gündür (5-10 gün). 1 / 14
Ardışık tedaviSefuroksim aynı zamanda sefuroksim sodyum tuzu (CEFAKS Enjektabl) şeklinde parenteral uygulama için mevcuttur. Bu, parenteral tedaviden oral tedaviye geçişin klinik olarak endikeolduğu durumlarda sefuroksim ile parenteral tedaviye oral (CEFAKS) tedavi ile devamolanağı sağlar. Parenteral ve oral tedavi süreleri enfeksiyonun şiddeti ve hastanın klinik durumuna göre belirlenir. Pnömoni:48 - 72 saat boyunca günde 3 veya 2 kez i.v. veya i.m. yolla uygulanan 1.5 g sefuroksim sodyum uygulamasını takiben 7-10 gün boyunca günde 2 kez oral yollauygulanan 500 mg sefuroksim aksetil tedavisi.Kronik bronşitin akut alevlenmeleri:Çocuklarda;Reçetelemede sabit doz tercih edildiğinde, birçok enfeksiyon için önerilen doz günde iki kez 125 mg'dır. Otitis mediası olan 2 yaşında veya daha büyük çocuklarda veya uygun olduğundadaha şiddetli enfeksiyonlarda doz maksimum günde 500 mg olmak üzere günde iki kez 250mg'dır. Bebekler ve çocuklarda, dozu ağırlık veya yaşa göre ayarlamak tercih edilebilir. 3 ay-12 yaş arası bebek ve çocuklarda çoğu enfeksiyon için doz, günde maksimum 250 mg olmak üzere10 mg/kg'dır. Otitis media veya daha şiddetli enfeksiyonlarda önerilen doz, maksimum günde500 mg olmak üzere günde iki kez 15 mg/kg'dır. Aşağıdaki yaş ve kiloya göre hazırlanan dozaj tablosunda kolay uygulamayı sağlayacak kaşık ölçüleri (5ml'lik bir ölçek 250 mg sefuroksim içerir) de verilmiştir. 2 / 14
Uygulama şekli:CEFAKS oral yolla alınır. Optimal absorpsiyon için sefuroksim aksetil yiyecekle birlikte alınmalıdır. Her dozu almadan önce süspansiyon şişenin içinde hareket ettiği görülene kadar çalkalanmalıdır. Arzu edilirse sulandırılmış süspansiyon soğuk meyve suyu, süt gibiiçeceklere ilave edilerek verilebilir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Sefuroksim aksetilin güvenlilik ve etkililiği böbrek yetmezliği olan hastalarda belirlenmemiştir.Sefuroksim başlıca böbreklerle atılır. Benzer bütün antibiyotiklerde olduğu gibi, önemli derecede böbrek yetmezliği olan hastalarda yavaş atılımın kompanse edilmesi için sefuroksimdozunun azaltılması önerilir. Sefuroksim diyaliz ile etkin şekilde uzaklaştırılmaktadır.
Karaciğer yetmezliği:Veri yoktur.Pediatrik popülasyon:Sefuroksimin 3 aydan küçük çocuklarda kullanımı ile ilgili klinik çalışma verisi bulunmamaktadır. Bu yaş grubunda kullanımı önerilmez.3 / 14 Geriyatrik popülasyon:4.3. KontrendikasyonlarSefuroksim veya ilacın içerdiği diğer yardımcı maddelere karşı aşırı duyarlılık. Sefalosporin antibiyotiklerine aşırı duyarlılığı bilinen hastalarda kontrendikedir. Beta laktam antibiyotiklere (penisilin, monobaktamlar, karbapenemler gibi) karşı aşırı duyarlılık öyküsü olanlarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriCEFAKS'a, diğer sefalosporinlere, penisilinlere veya diğer ilaçlara karşı aşırı duyarlılık geçmişi olan hastalarda tedaviye başlamadan önce dikkatli bir değerlendirmeyapılmalıdır. Beta laktam antibiyotiklere karşı çapraz aşırı duyarlılık reaksiyonugelişebileceğinden penisilin alerjisi olan hastalara verildiğinde, bu hastaların %10kadarında çapraz aşırı duyarlılık reaksiyonu gelişebileceği bildirilmiştir. Klinik olarakanlamlı düzeyde alerjik reaksiyon gelişirse ilaç kullanımı kesilmeli ve uygun bir tedaviyebaşlanmalıdır. Ciddi ve akut hipersensitivite reaksiyonları geliştiğinde epinefrin tedavisive klinik olarak gerekli diğer acil uygulamaların (Oksijen, intravenöz sıvılar, intravenözantihistaminler, kortikosteroidler, presör aminler, hava yollarına uygulanacak işlemlergibi uygulamalar) yapılması gerekli olabilir.Diğer antibiyotiklerde olduğu gibi sefuroksim aksetil kullanımı aşırı Candidaenterekoklar ve Clostridium difficile)aşırı çoğalmasına neden olarak tedavinin kesilmesinigerektirebilir.Antibiyotiklerin kullanımında psödomembranöz kolit vakaları bildirilmiştir, bu vakalar hafif ile şiddetli arasında değişiklik gösterebilir. Bu nedenle antibiyotik kullanımı sırasında veyadaha sonra diyare gelişen hastalarda, bu tanının göz önünde tutulması çok önemlidir.Psödomembranöz kolit tanısını takiben uygun bir tedaviye başlanmalıdır. Hafifpsöudomembranöz kolit vakaları genellikle sadece ilaç kullanımının kesilmesine yanıtverirler. Ancak orta dereceli ve şiddetli vakalarda sıvı ve elektrolit uygulamaları, proteintakviyesi, Clostridium difficile'yekarşı etkili antibiyotik kullanımı gibi yöntemlerinkullanılması gerekli olabilir. Eğer hastada uzun süreli ya da ciddi diyare gelişirse veya hastadakarın krampları gözlenirse tedavi derhal kesilmeli ve hasta daha detaylı incelenmelidir.Lyme hastalığının CEFAKS ile tedavisini takiben Jarisch-Herxheimer reaksiyonu (ateş, titreme, kas ağrısı, baş ağrısı, taşikardi gibi belirtileri vardır) görülebilir. Bu reaksiyonCEFAKS'ın Lyme hastalığına neden olan Borrelia burgdoferi mikroorganizması üzerindekibakterisid etkisinin sonucudur. Hastalara bu reaksiyonun sık görülen ve genellikle Lymehastalığının antibiyotiklerle tedavisinin kendi kendini kısıtlayıcı bir sonucu olduğuanlatılmalıdır. 4 / 14 Sefuroksim ile ilişkili pozitif bir Coomb Testi gelişmesi kanın çapraz eşleştirilmesini etkileyebilir (bkz. Bölüm 4.8). Ferrisiyanür testinde hatalı negatif bir sonuç meydana gelebileceğinden, sefuroksim aksetil kullanan hastalarda kan/plazma glukoz düzeylerini belirlemek üzere ya glukoz oksidaz ya daheksokinaz yöntemlerinin kullanılması önerilmektedir. CEFAKS süspansiyon aspartam içerir ve aspartam fenilalanin kaynağı olduğundan fenilketonürisi olan insanlar için zararlı olabilir. CEFAKS süspansiyon sukroz içerir. Bu sebeple, nadir kalıtımsal früktoz intoleransı, glikoz-galaktoz malabsorbsiyon veya sükraz-izomaltaz yetmezliği problemi olan hastaların builacı kullanmamaları gerekir. Diyabetik hastaların tedavisinde sefuroksim aksetil süspansiyon ve granüllerin sukroz içeriği göz önünde bulundurulmalıdır (bkz. Bölüm 6.1) ve gerekli tavsiyelerde bulunulmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriMide asiditesini azaltan ilaçlar CEFAKS'ın açlık durumundaki biyoyararlanımını azaltabilir ve CEFAKS'ın yemek sonrası absorpsiyonundaki artışı ortadan kaldırabilir. Diğer antibiyotiklerde de olduğu gibi sefuroksim aksetil bağırsak florasını etkileyerek östrojen reabsorbsiyonunun azalmasına ve kombine oral kontraseptiflerinin etkililikazalmasına yol açabilir. Sefuroksim glomerüler filtrasyon ve tübüler sekresyon ile atılır. Eşzamanlı probenisid kullanımı önerilmemektedir. Eşzamanlı probenesid kullanımı, sefuroksimin pikkonsantrasyonunu, serum konsantrasyonu zaman eğrisi altındaki alanı ve eliminasyonyarılanma ömrünü anlamlı olarak artırır. Eşzamanlı oral antikoagülan kullanımı artmış Uluslararası Normalleştirilmiş Oran (INR)'ye yol açabilir. Ferrisiyanid testinde yanlış negatif sonuçlar oluşabileceğinden sefuroksim alan hastalarda kan/plazma glukoz düzeylerini belirlemek için glukoz oksidaz veya heksokinaz metodlarınınkullanılması önerilmektedir. Sefuroksim aksetil kreatinin için yapılan alkalin pikrat deneyinietkilemez. Sefalosporin grubu ilaçlar kırmızı kan hücrelerinin membranlarından absorbe olma ve ilaca karşı gelişen antikorlarla reaksiyona girme eğilimi göstererek Coombs testinin pozitif sonuçvermesine ve çok seyrek olarak da hemolitik anemiye yol açabilirler. 5 / 14 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: B Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Diğer antibiyotiklerde de olduğu gibi, sefuroksim bağırsak florasını etkileyerek östrojen emiliminin ve kombine oral kontraseptiflerin etkilerinin azalmasına neden olabilir. Gebelik dönemiSefuroksim aksetilin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar gebelik/embriyonal/fetal gelişim/doğum ya da doğumsonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunugöstermemektedir. Gebe kadınlara verilirken tedbirli olunmalıdır. Sefuroksimin intramüsküler veya intravenöz yolla anneye verilmesini takiben plasentayı geçip amniyotik sıvıda ve kordon kanında terapötik seviyelere eriştiği gösterilmiştir. Laktasyon dönemiSefuroksim anne sütü ile de atılmaktadır. Emzirmenin durdurulup durdurulmayacağına ya da sefuroksim aksetil tedavisinin durdurulup durdurulmayacağına karar verilmelidir. Üreme yeteneği/FertiliteVeri yoktur. 4.7 Araç ve makine kullanımı üzerindeki etkilerCEFAKS baş dönmesine yol açabileceğinden hastalar araç veya makine kullanırken dikkatli olmaları konusunda uyarılmalıdır. 4.8. İstenmeyen etkilerSefuroksim aksetilin yan etkileri genellikle hafif ve geçici özelliktedir. En yaygın istenmeyen etkiler Candidaçoğalması, eozinofili, baş ağrısı, baş dönmesi, gastrointestinal bozukluklar ve karaciğer enzimlerinde geçici artıştır.Yan etkiler için belirlenen sıklık kategorileri tahminidir, plasebo kontrollü çalışmalarda da olduğu gibi birçok reaksiyonda insidansı hesaplamak için elverişli veri (örneğin plasebokontrollü çalışmalardan sağlanan veriler) bulunmamaktadır. Ayrıca sefuroksim aksetile bağlıyan etkilerin insidansları, endikasyona göre değişebilmektedir. Çok yaygından seyreğe, istenmeyen etkilerin sıklıklarının belirlenmesinde geniş klinik çalışmalardan elde edilen veriler kullanılmıştır. Bunun dışında kalan istenmeyen etkilerinsıklıkları (<1/10.000), esas olarak pazarlama sonrası deneyimlerden yola çıkarakbelirlenmiştir ve rapor edilme oranına işaret etmektedir. Plasebo kontrollü çalışma verileri 6 / 14 mevcut değildir. İnsidanslar klinik çalışma verilerinden hesaplanmıştır ve bunlar ilaç ile ilişkili verilere dayanmaktadır. Sıklıklar, çok yaygın (>1/10 ), yaygın (>1/100 ve <1/10), yaygın olmayan (>1/1.000 ve <1/100), seyrek (>1/10.000 ve <1/1.000), çok seyrek (<1/10.000) ve bilinmiyor (eldekiverilerden tahmin edilemiyor) şeklinde tanımlanmıştır. Enfeksiyon ve EnfestasyonlarYaygın: Candida çoğalması Bilinmiyor: Clostridium difficileKan ve lenfatik sistem bozukluklarıYaygın: Eozinofili Yaygın olmayan: Pozitif Coomb's testi, trombositopeni, lökopeni (bazen şiddetli) Bilinmiyor: Hemolitik anemi Sefalosporin grubu antibiyotikler alyuvar membranının yüzeyine absorbe olmaya ve ilaca yönelmiş antikorlarla etkileşmeye eğilimlidir; böylece pozitif Coomb's testi (kanın çaprazetkileşmesini etkileyebilir) ve çok nadiren hemolitik anemi oluşturabilirler. Bağışıklık sistemi bozukluklarıBilinmiyor: İlaç ateşi, serum hastalığı, anafilaksi, Jarisch-Herxheimer reaksiyonu Sinir sistemi bozukluklarıYaygın: Baş ağrısı, Baş dönmesi Gastrointestinal bozukluklarYaygın: Diyare, bulantı, karın ağrısıgibi gastrointestinal rahatsızlıklar Yaygın olmayan: Kusma Bilinmiyor: Psödomembranözkolit(bkz. Bölüm4.4) Karaciğer ve safra kesesi bozukluklarıYaygın: Hepatik enzim düzeylerinde (LDH, ALT (SGPT), AST (SGOT)) geçici yükselmeler Bilinmiyor: Sarılık (ağırlıklı olarak kolestatik), hepatit Deri ve derialtı doku bozukluklarıYaygın olmayan: Deri döküntüleri Bilinmiyor: Ürtiker, kaşıntı, eritemmultiforme,Stevens-Johnson sendromu, toksik epidermal nekroliz (ekzantematik nekroliz), anjiyonörotik ödem (Bkz. Bağışıklık sistemi bozuklukları) 7 / 14 Pazarlama sonrası deneyimlerden edinilen verilere göre ürolojik bozukluklardan biri olan böbrek fonksiyon bozukluğu da görülen yan etkiler arasında bulunmaktadır. Sefalosporinler kırmızı hücre membranlarının yüzeyine emilme ve pozitif Coomb testine (bu da kanın çapraz eşleştirilmesini etkileyebilir) ve çok nadiren hemolitik anemiye neden olacakşekilde ilaca karşı üretilen antikorlarla reaksiyona girme eğilimine sahip bir sınıftır. Serum karaciğer enzimlerinde geçici artışlar gözlenmiş olup, bunlar genellikle geri dönüşümlüdür. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr;e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9 Doz aşımı ve tedavisiSefalosporinler aşırı dozda serebral irritasyon sonucu ensefalopati, konvülsiyon ve komaya neden olabilirler. Sefuroksimin serum düzeyleri hemodiyalizle ya da periton diyalizi iledüşürülebilir. Ağır doz aşımı durumlarında destekleyici tedavi uygulanmalı ve hasta yakındanizlenmelidir. Konvülsiyon oluşması halinde tedavi derhal kesilmeli, gerektiğindeantikonvülsif tedavi uygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: İkinci kuşak sefalosporinler ATC kodu: J01D C02 Etki mekanizmasıSefuroksim aksetil, bakterisid bir antibiyotik olan sefuroksimin oral ön ilacıdır. Sefuroksim, bakteriyel beta-laktamazlara karşı iyi bir stabilite gösterir ve sonuç olarak ampisilin veyaamoksisiline dirençli suşların pek çoğuna etkilidir. Sefuroksim önemli hedef proteinlerebağlanarak bakterilerde hücre duvarı sentezini önleyerek bakterisid etki gösterir. Farmakodinamik etkilerEdinilmiş direnç prevalansı, coğrafyaya ve zamana bağlıdır ve belirli türlerde çok yüksek olabilir. Başta şiddetli enfeksiyonların tedavisinde olmak üzere, lokal direnç bilgisi istenilirbir durumdur. Mikroorganizmaların Sefuroksime in vitroduyarlılığıSefuroksim aksetilin klinik etkililiğinin klinik çalışmalarda gösterilmiş olduğu yerler (*) 8 / 14
işareti ile belirtilmiştir. Yaygın Olarak Duyarlı Olan TürlerGram-Pozitif Aeroblar:Staphylococcus aureus (metisiline duyarlı)* Koagulaz negatif staphylococcus (metisiline duyarlı) Streptococcus pyogenes* Beta-hemolitik streptokoklar Gram-Negatif Aeroblar:Haemophilus influenzae *; ampisiline dirençli suşlar dâhil Haemophilus parainfluenzae* Moraxella catarrhalis* Neisseria gonorrhoea*; penisilinaz üreten ve üretmeyen suşlar dâhil Gram-Pozitif Anaeroblar:Peptostreptococcus türleri Propionibacterium türleri Spiroketler:Borrelia burgdorferi* Edinilmiş direncin sorun olabileceği organizmalarGram-Pozitif Aeroblar:Streptococcus pneumoniae* Gram-Negatif Aeroblar:Citrobacter türleri; C. freundii hariç Enterobacter türleri E. Aerogenler ve E. Cloacae hariç Escherichia coli* Klebsiella türleri; Klebsiella pneumoniae dâhil* Proteus mirabilis Proteus türleri; P. penneri ve P. vulgaris hariç Providencia türleri Gram-Pozitif Anaeroblar:Clostridium türleri; C. difficile hariç Gram-Negatif Anaeroblar:Bacteroides türleri; B. fragilis hariç Fusobacterium türleri Doğal dirençli organizmalarGram-Pozitif Aeroblar:Enterococcus türleri; E. faecalis ve E. faecium hariç Listeria monocytogenes Gram-Negatif Aeroblar:Acinetobacter türleri Burkholderia cepaciaCampylobacter türleriCitrobacter freundii
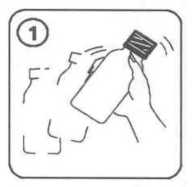
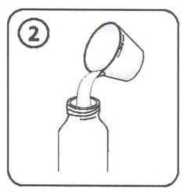
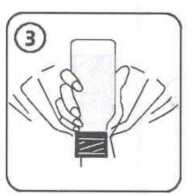
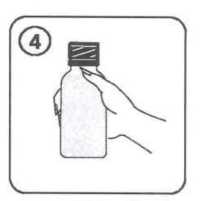
9 / 14 Enterobacter aerogenes Enterobacter cloacaeMorganella morganiiProteus penneriProteus vulgaris Pseudomonas türleri; Pseudomonas aeruginosa dâhil Serratia türleri Stenotrophomonas maltophilia Gram-Pozitif Anaeroblar:Clostridium difficile Gram-Negatif Anaeroblar:Bacteroides fragilis Diğerleri:Chlamydia türleri Mycoplasma türleriLegionella türleri 5.2. Farmakokinetik özellikleriGenel özelliklerEmilim:Sefuroksim aksetil oral yoldan alınmayı takiben gastrointestinal kanaldan absorbe olur ve intestinal mukozada ve kanda süratle hidrolize uğrayarak serbest sefuroksimi kan dolaşımınabırakır. Sefuroksim aksetil süspansiyonun absorpsiyonu yiyecekle artar. Sefuroksim aksetil tabletleri yemeklerden sonra alındığında, yaklaşık 2 - 3 saat sonra ulaşılan doruk plazma düzeyleri 125 mg'lık doz için 2,1 mg/l, 250 mg'lık doz için 4,14 mg/l, 500mg'lık doz için 7 mg/l ve 1 g'lık doz için 13,6 mg/l olarak saptanmıştır. Sefuroksimsüspansiyonun absorpsiyon hızı tabletlere nazaran daha az olup, doruk serum seviyeleri dahadüşüktür ve sistemik biyoyararlanımı azalmıştır (% 4 - 17 daha az). Dağılım:Proteine bağlanma oranı kullanılan metodolojiye göre %33 - 50 arasında değişir.Biyotransformasyon:Sefuroksim metabolize olmaz Eliminasyon:Serum yarılanma ömrü 1 - 1,5 saattir. Sefuroksim glomerular filtrasyon ve tubüler sekresyon ile elimine edilir. Probenesid ile birlikte verilmesi ortalama serum konsantrasyonları - zaman eğrisinin altında kalan alanı % 50oranında artırır. 10 / 14 Hastalardaki karakteristik özelliklerCinsiyetErkekler ve kadınlar arasında sefuroksim farmakokinetiği açısından bir fark gözlenmemiştir. GeriyatrikGünde 1 g'lık normal maksimuma kadar olan dozajlarda normal renal fonksiyona sahip yaşlı hastalarda özel bir önlem gerekli değildir. Yaşlı hastaların renal fonksiyonunun azalmışolması daha muhtemeldir; bu nedenle doz yaşlılarda renal fonksiyonla uyumlu olarakayarlanmalıdır (bkz. Bölüm 4.2). PediatrikDaha büyük bebeklerde (>3 yaşında) ve çocuklarda, sefuroksim farmakokinetiği yetişkinlerde gözlenene benzerdir. 3 aylıktan küçük çocuklarda sefuroksim aksetil kullanımına ilişkin klinik çalışma verisi mevcut değildir. Renal bozuklukRenal bozukluğu olan hastalarda sefuroksim aksetilin güvenlilik ve etkililiği belirlenmemiştir. Sefuroksim başlıca böbreklerle atılır. Bu nedenle tüm bu tip antibiyotiklerle olduğu gibi renalfonksiyonu bozulmuş hastalarda (yani kreatinin klerensi <30 mL/dakika) sefuroksim dozunundaha yavaş atılımını telafi etmek üzere azaltılması önerilmektedir (bkz. Bölüm 4.2).Sefuroksim diyalizle etkili bir şekilde uzaklaştırılır. Hepatik bozuklukHepatik bozukluğu olan hastalar için veri mevcut değildir. Sefuroksim başlıca böbreklerden elimine edildiğinden, hepatik fonksiyon bozukluğu varlığının sefuroksimin farmakokinetiğiüzerinde bir etkiye sahip olması beklenmemektedir. FK/FD ilişkisiSefalosporinler için in vivo5.3. Klinik öncesi güvenlilik verileriHayvan toksisite çalışmaları sefuroksim aksetilin anlamlı bir bulgu olmaksızın düşük toksisitesi olduğunu göstermiştir. 11 / 14 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiStearik asit SukrozÇilek aromasıPVP K-25 Asesulfam potasyum Aspartam 6.2. GeçimsizliklerVeri yoktur. 6.3. Raf ömrü48 ay Hazırlanan süspansiyon buzdolabında 2-8 oC arasında 10 güne kadar saklanabilir. 6.4. Saklamaya yönelik özel tedbirlerİlaç toz halde iken 25 oC'nin altındaki oda sıcaklığında, sulandırdıktan sonra da buzdolabında 2 - 8 oC arasında saklanmalıdır. 6.5 Ambalajın niteliği ve içeriğiCEFAKS, sulandırıldığında 100 ml süspansiyon veren kuru granül içeren, çocuk emniyetli polipropilen kapaklı amber renkli cam şişelerde bulunmaktadır. Beraberinde 1,25 ml ve 2,5ml'ye işaretli polipropilenden üretilmiş 5 ml'lik ölçü kaşığı ve 41 ml'ye işaretlipolipropilenden yapılmış ölçü kabı bulunmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanma TalimatıDiğer bütün ilaçlarda olduğu gibi CEFAKS'ı hekimin tavsiye ettiği miktarda almanız çok önemlidir. CEFAKS süspansiyon her kullanımdan önce kuvvetle sallanarak çalkalanmalıdır. Hazırlanan süspansiyon buzdolabında 2 - 8 oC arasında 10 gün saklanabilir. 12 / 14 SÜSPANSİYONUN HAZIRLANIŞ! CEFAKS toz halindedir, bu yüzden ilk önce sulandırmak gerekir. Arzu edilirse sulandırılmış süspansiyon soğuk meyve suyu, süt gibi içeceklere ilave edilerek verilebilir. Süspansiyon haline getirildikten sonra buzdolabında 2 - 8 °C arasında 10 güne kadar saklanabilir. 1. Sulandırmadan önce granülleri gevşetmek için şişeyi şekilde gördüğünüz gibi çalkalayınız. 2. Ölçekteki 41 ml işaretine kadar kaynatılıp soğutulmuş su koyup şişe muhteviyatına ilaveediniz ve kapağını kapatınız. 3. Şişeyi baş aşağı çeviriniz ve şekilde görüldüğü gibi sağa ve sola (homojen bir süspansiyonelde edilene kadar, en az 15 saniye) kuvvetlice sallayınız. 4. Şişeyi dik duruma getirerek tekrar kuvvetle çalkalayınız. 5. Hazırlanan süspansiyon derhal 2 - 8 °C arasında buzdolabına konulmalıdır. 6. Hazırlanan süspansiyonu ilk dozdan önce bir saat bekletilmelidir. 13 / 14 7. İlacınız şimdi kullanıma hazırdır. 8. Süspansiyon ölçü kaşığı ile uygulanabilir. Her kullanımdan önce şişeyi çalkalamayı unutmayınız.7. RUHSAT SAHİBİDeva Holding A.Ş. Halkalı Merkez Mah. Basın Ekspres Cad. No: 1 34303 Küçükçekmece/İSTANBUL Tel: 0212 692 92 92Faks: 0212 697 00 24E-mail:[email protected] 8. RUHSAT NUMARASI213/30 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 16.11.2007 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ14 / 14 |
İlaç BilgileriCefaks 250 Mg/5 Ml Oral Süspansiyon Hazırlamak İçin GranülEtken Maddesi: Sefuroksim Aksetil Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.