Respiro-d 50 Mcg/250 Mcg İnhalasyon İçin Toz İçeren Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIRESPİRO-D 50 mcg/250 mcg inhalasyon için toz içeren kapsül 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir kapsül 50 mcg salmeterole eşdeğer 72,6 mcg salmeterol ksinafoat ve 250 mcg flutikazon propiyonat içermektedir. Yardımcı madde(ler):Yardımcı maddeler için bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon için toz içeren kapsül Beyaz veya beyazımsı toz içeren şeffaf gövdeli kapsül 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarAstım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. Orta ve ağır KOAHolgularında semptomları ve atak sıklığını azaltır. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:RESPİRO-D sadece inhalasyon yolu ile uygulanır. Hastalar, belirtileri olmasa dahi optimum fayda için RESPİRO-D'yi düzenli olarak kullanmaları gerektiği konusunda uyarılmalıdır. Hastaların düzenli olarak doktor kontrolünde bulundurularak aldıkları RESPİRO-D dozunun optimum düzeyde kalması sağlanmalı ve sadece doktor önerisi ile değiştirilmelidir. Tavsiye edilen dozlar AstımErişkinler ve 12 yaş ve üzeri adölesanlar¦ Günde 2 kez tek inhalasyon halinde 50 mcg salmeterol ve 100 mcg flutikazon propiyonat ¦ Günde 2 kez tek inhalasyon halinde 50 mcg salmeterol ve 250 mcg flutikazon propiyonat ¦ Günde 2 kez tek inhalasyon halinde 50 mcg salmeterol ve 500 mcg flutikazon propiyonat Doz, semptomların etkin kontrolünün sürdürüldüğü en düşük doza göre ayarlanmalıdır. Günde iki kez verilen kombinasyonun en düşük dozu ile semptomlarınkontrolü sürdürüldüğünde ve/veya sürdürüldüğü durumlarda, sonraki adım tek başınainhale kortikosteroid testini içerebilir. 1 / 25 Alternatif olarak, reçete eden hekimin görüşüne göre hastalık kontrolünün sağlanmasında yeterli olacağı düşünülüyorsa, uzun etkili p2 agonist kullanılması gereken hastalar için gündebir kez Respiro-D ayarlaması yapılabilir. Hastada gece görülen semptom öyküsü varsa vegünde bir kez dozlam uygulanıyorsa, doz geceleri verilmeli; hastada genellikle gündüzgörülen semptom öyküsü varsa doz sabahları verilmelidir. Astımının hızlı şekilde kontrol edilmesi gereken, orta dereceli inatçı astımı olan erişkin veya adolesan hastalarda (hastanın günlük semptomlarına, günlük kurtarma ilacı kullanımına veorta ila şiddetli havayolu sınırlamasına göre tanımlanır) kısa süreli bir RESPİRO-D denemesibaşlangıç tedavisi olarak kabul edilebilir. Bu durumlarda, önerilen başlangıç dozu günde ikikez iki inhalasyon olarak 50 mcg salmeterol ve 100 mcg flutikazon propiyonattır. Astımkontrolü sağlandığında, tedavi tekrar gözden geçirilmeli ve hastaların tek başına inhalekortikosteroid alacak şekilde dozlarının azaltılması düşünülmelidir. Tedavide doz azaltılırkenhastaların düzenli olarak incelenmesi önemlidir. Bir veya iki hastalık şiddeti kriteri eksik olduğunda, başlangıç tedavisi olarak tek başına inhale flutikazon propiyonat kullanımına kıyasla net bir yarar gösterilmemiştir. Genel olarakinhale kortikosteroidler hastaların büyük çoğunluğunda birinci basamak tedavi olmayadevam etmektedir.RESPİRO-D'ninhafif astımın ilk tedavisinde kullanımı amaçlanmamaktadır. RESPİRO-D'nin 50 mcg/100 mcg dozu, şiddetli astımı olan çocuklarda ve erişkinlerde kullanıma uygun değildir; şiddetli astım hastalarında herhangi bir sabitkombinasyonun kullanılmasından önce uygun inhale kortikosteroid dozunun gösterilmesiönemlidir. 4 yaş ve üzeri çocuklar¦ Günde 2 kez tek inhalasyon halinde 50 mcg salmeterol ve 100 mcg flutikazon propiyonat Kronik Obstrüktif Akciğer Hastalığı (KOAH)Erişkinler ¦ Günde 2 kez tek inhalasyon halinde 50 mcg salmeterol ve 500 mcg flutikazon propiyonatUygulama şekli: RESPİRO-D, sadece inhalasyon yoluyla kullanılır. İnhalasyon her gün, günün aynı saatinde, inhalasyon cihazı kullanılarak yapılmalıdır. İnhalerin kapağını açtıktan sonra, ağızlık kısmı ağıza yerleştirilir ve dudaklar kapatılır. Doz inhale edildikten sonra cihazın kapağı tekrardan kapatılır. 2 / 25
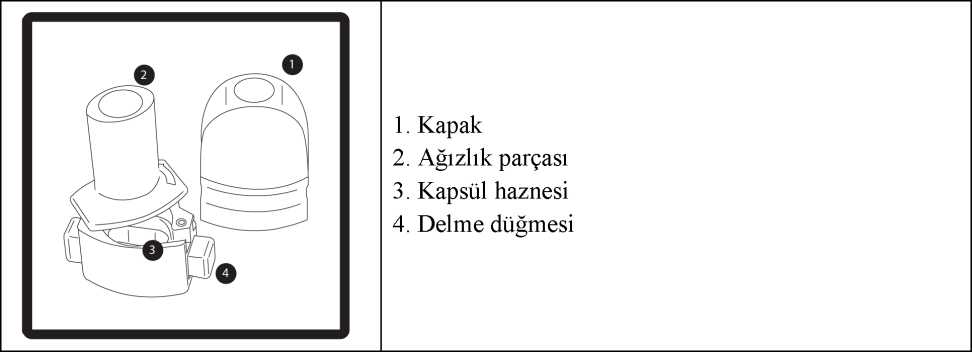
İnhaler Kullanım Talimatları:İnhaler cihazı, RESPİRO-D kapsüllerinin inhalasyonu için özel olarak tasarlanmış bir inhalasyon cihazıdır. Başka hiçbir ilacı almak için kullanılmamalıdır. 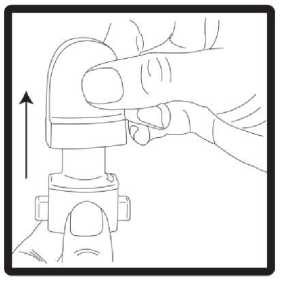
1 .Kapak çekerek çıkarılmalıdır.  2. Cihazın alt kısmı sıkıca tutulurken ağız parçası ok yönünde çevrilerek açılmalıdır. 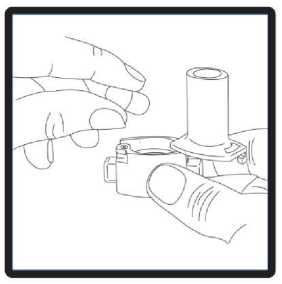 3. Kapsül, ambalajından kullanılmadan hemen önce çıkarılmalıdır. Cihazın tabanındaki kapsül şeklindeki hazneyebir kapsül yerleştirilmelidir. 3 / 25 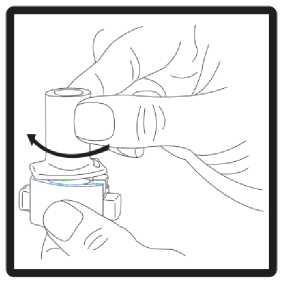
4. Ağız parçası kapalı konuma getirmek için çevrilmelidir. 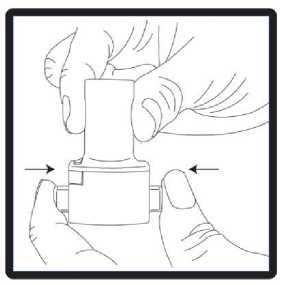 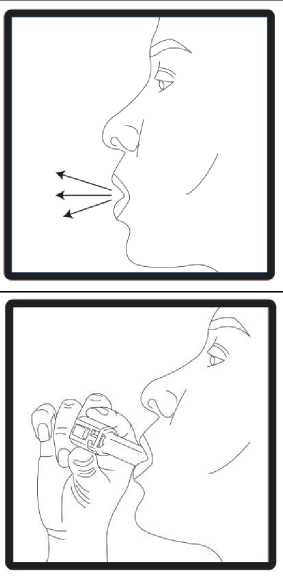 5. Cihaz dik tutulmalı (ağız parçası yukarıda olacak şekilde) ve kenardaki çıkıntılara eş zamanlı olarak SADECE BİR KEZbasılmalıdır. Bu şekilde kapsül delindikten sonra kenarçıkıntıları bırakılmalıdır. Lütfen dikkat: Bu işlemi yaparkenjelatin kapsül parçalanabilir ve soluma sırasında küçük jelatinparçalarının ağız ve boğaza kaçma olasılığı vardır. Jelatinparçaları zararsızdır ve yutulduktan sonra hazmedilir. Kapsülünkullanımdan hemen önce ambalajından çıkarılması ve kapsülüpatlatmak için kenar çıkıntılarına sadece bir kez basılmasıjelatin kapsülün parçalanma riskini en aza indirir (bkz. 3.basamak).
6. Nefes kuvvetlice dışarı verilmelidir. 7. Ağız parçası ağıza yerleştirilmeli ve baş hafifçe geriye doğru eğilmelidir. Ağız parçası etrafında dudaklar sıkıca kapatılmalıve olabildiğince hızlı ve derin bir nefes alınmalıdır. Tozdağılırken kapsülün bölmesinde dönmesinden kaynaklanan bir''vızıltı'' sesi duyulur. Bu ses duyulmadıysa kapsülbölmesinde sıkışmış olabilir. Bu durumda cihaz açılmalı vekapsül bölmesinde oynatarak gevşetilmelidir.Kapsülü gevşetmek için düğmelere birden fazla BASILMAMALIDIR. 8. Vızıltı sesi duyulduktan sonra hasta cihazı ağzından çıkarırken nefesini rahatsız olmadanolabildiğince uzun süre içinde tutmalıdır. Daha sonra hasta normal şekilde nefes almayadevam etmelidir. Cihaz açılarak kapsülün içinde toz kalıp kalmadığını kontrol edilmelidir.Kapsülün içinde toz kalmışsa, 6, 7 ve 8. basamaklar tekrarlanmalıdır. 9. Kullandıktan sonra boş kapsül atılmalı ve ağız parçası kapatılmalıdır.
4 / 25 Cihazın TemizlenmesiToz kalıntılarım temizlemek için ağız parçası ve kapsül haznesi KURU ve temiz bir bezle silinmelidir. Temiz yumuşak bir fırça da bu amaçla kullanılabilir. Kapsüller aşırı sıcaklıklara maruz bırakılmamalıdır. RESPİRO-D kapsülleri az miktarda toz içermektedir, bu nedenle kapsüller yalnızca kısmen doludur. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği Böbrek yetmezliği olan hastalarda dozun ayarlanmasına gerek yoktur. Karaciğer yetmezliğiKaraciğer yetmezliği olan hastalarda RESPİRO-D kullanımına ilişkin bilgi yoktur. Pediyatrik popülasyonÇocukların alması gereken flutikazon propiyonat dozu maksimum günde iki kez 100 mcg'dır. 4 yaş altındaki çocuklarda veri yoktur. Geriyatrik popülasyonDoz ayarlaması gerekli değildir. 4.3 KontrendikasyonlarEtkin maddelere veya bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine aşırı duyarlılık. 4.4 Özel kullanım uyarıları ve önlemleriUzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. RESPİRO-D astım hastalığının başlangıç tedavisi için önerilmez. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır.Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediyatrik ve adölesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem deuzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir. 5 / 25 Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. Salmeterol, astımlı hastalarda tek başına monoterapi olarak kullanılmamalıdır.Hastalığın kötüleşmesiRESPİRO-D hızlı ve kısa etkili bir bronkodilatörün (örneğin salbutamol) kullanımını gerektiren akut belirtileri rahatlatmak için değildir. Hastalara rahatlamak için kullanmalarıgereken ilaçları her zaman yanlarında bulundurmaları tavsiye edilmelidir. Hastalarda bir alevlenme sırasında veya anlamlı şekilde kötüleşen veya akut şekilde şiddetlenen astım hastalıkları varsa RESPİRO-D tedavisi başlatılmamalıdır. RESPİRO-D ile tedavi sırasında astımla ilişkili ciddi advers olaylar ve alevlenmeler görülebilir. Bu gibi durumlarda hastaya tedaviye devam etmeleri, ancak RESPİRO-D iletedaviye başladıktan sonra astım semptomları kontrol altına alınamadığında ya dakötüleştiğinde tıbbi destek almaları gerektiği öğütlenmelidir. Belirtileri gidermek için rahatlatıcı ilacın (kısa etkili bronkodilatörler) kullanımının artması veya bu ilaçlara verilen cevabın azalması astım kontrolünün kötüleştiğini gösterir ve budurumda olan hastalar bir hekim tarafından tekrar muayene edilmelidir. Astım kontrolünün ani ve progresif bir kötüleşmesi potansiyel anlamda hayatı tehdit edicidir ve hastanın bir hekim tarafından tekrar muayene edilmesi gereklidir. Kortikosteroid dozununartırılması düşünülmelidir. Astım semptomları kontrol altına alındıktan sonra RESPİRO-D dozunun kademeli olarak azaltılması düşünülebilir. Tedavinin azaltılması sırasında hastalar yakından izlenmeli veRESPİRO-D etkili en düşük dozda kullanılmalıdır (bkz. Bölüm 4.2). Alevlenme yaşayan KOAH hastalarında genellikle sistemik kortikosteroid tedavisi endikedir. Bu nedenle hastaya, RESPİRO-D ile tedavi sırasında semptomları kötüleşirse tıbbi destekalması önerilmelidir. Astımlı hastalarda alevlenme riski nedeniyle RESPİRO-D tedavisi ani olarak kesilmemelidir, tedavi dozu hekim gözetiminde kademeli olarak azaltılmalıdır. KOAH'lı hastalarda tedavininkesilmesine semptomatik dekompanzasyon eşlik edebilir ve tedavinin kesilmesi bir hekimgözetiminde yapılmalıdır. Kortikosteroid içeren tüm inhale ilaçlarla olduğu gibi, aktif veya sessiz akciğer tüberkülozu ve hava yolunda fungal, viral veya başka bir enfeksiyon olan hastalarda RESPİRO-D dikkatlikullanılmalıdır. Gerekirse uygun tedaviye hemen başlanmalıdır. 6 / 25 Kardiyovasküler etkilerYüksek dozlarda uygulandığında RESPİRO-Dnadiren kardiyak aritmiye (örn. supraventriküler taşikardi, ekstrasistol ve atriyal fibrilasyon ile serum potasyum düzeylerinde hafif, geçici azalma) neden olabilir. RESPİRO-D, ciddi kardiyovasküler hastalığı veya kalpritim anomalisi; diabetes mellitus,tirotoksikoz, tedavi edilmemiş hipokalemisi veya düşükserum potasyum seviyesine eğilimi olan hastalarda dikkatli kullanılmalıdır.HiperglisemiNadiren kan glukoz düzeylerinde artış rapor edilmiştir (bkz. Bölüm 4.8) ve diabetes mellitusöyküsü olan hastalara reçete edilirken bu husus göz önünde bulundurulmalıdır.Paradoksal bronkospazmDiğer inhalasyon tedavilerinde olduğu gibi, dozlamadan sonra hırıltılı solunum ve nefes darlığında ani artış ile birlikte paradoksal bronkospazm görülebilir. Paradoksal bronkospazmhızlı etkili bronkodilatörlere cevap verir ve derhal tedavi edilmelidir. RESPİRO-D hemenkesilmelidir, gerekli olduğu durumda hasta değerlendirilmeli ve başka bir tedaviyebaşlanmalıdır. Beta2-agonist tedavisinin tremor, palpitasyon ve baş ağrısı gibi farmakolojik yan etkileri raporlanmıştır, ancak bu yan etkiler geçicidir ve düzenli tedavi ile azalma eğilimi gösterir. Sistemik kortikosteroid etkilerHerhangi bir inhale kortikosteroid özellikle yüksek dozlarda, uzun süre kullanıldığında sistemik etkiler oluşabilir. Oral kortikosteroid uygulamasına göre bu etkilerin oluşma olasılığıçok daha azdır. Olası sistemik etkiler; Cushing sendromu, Cushing benzeri belirtiler, adrenalsupresyon, kemik mineral dansitesinde azalma, katarakt ve glokom ve daha seyrek olarakpsikomotor hiperaktiviteyi içeren fizyolojik ve davranışsal etkiler, uyku bozuklukları,anksiyete, depresyon veya agresyondur (özellikle çocuklarda) (çocuklarda ve adolesanlardainhale kortikosteroidlerin sistemik etkileri hakkında bilgi için aşağıdaki Pediyatrik popülasyonalt başlığına bakınız). Bu nedenle, astımı olanlarda inhale kortikosteroid dozunun, etkilikontrolü sağlayan en düşük doza ayarlanması ve hastanın düzenli takibi önemlidir. Uzun süreli, yüksek doz kortikosteroid tedavisi hastalarda adrenal supresyon ya da akut adrenal krize neden olabilir. 500 ila 1000 mikrogram flutikazon propiyonat dozlarında adrenalsupresyon ve akut ani kriz vakaları çok seyrek bildirilmiştir. Travma, ameliyat, enfeksiyon,veya dozun ani olarak azaltılması akut adrenal krizi tetikleyen durumlardır. Semptomlargenellikle belirsizdir ve anoreksi, abdominal ağrı, kilo kaybı, yorgunluk, baş ağrısı, bulantı,kusma, hipotansiyon, bilincin azalması, hipoglisemi ve nöbet görülebilir. Stres veya elektifoperasyon durumlarında ek sistemik kortikosteroid tedavisi düşünülmelidir. İnhale flutikazon propiyonat tedavisi, oral steroidlere olan gereksinimi minimize etmesi beklenir, ancak oral steroidlerden inhale flutikazon propiyonat tedavisine geçiş yapanhastalarda adrenal yetmezlik riski önemli bir süre devam edebilir. Bu nedenle, bu hastalaryakından izlenerek tedavi edilmeli ve adrenal fonksiyon düzenli olarak takip edilmelidir. 7 / 25 Geçmişte acil olarak yüksek dozda kortikosteroid tedavisi almış hastalar da risk altında olabilir. Stres yaratması muhtemel olan acil durumlarda ve elektif cerrahi durumlarında,adrenal yanıt bozukluğu göz önünde bulundurulmalı ve uygun bir kortikosteroid tedavisidüşünülmelidir. Elektif cerrahiden önce adrenal yetmezliğin derecesini belirlemek için doktortavsiyesi gerekebilir. Ritonavir plazmadaki flutikazon propiyonat konsantrasyonunu büyük ölçüde arttırabilir. Bu nedenle, hastaya potansiyel yararı, sistemik kortikosteroid yan etkilerinin görülme riskindenfazla olmadıkça eş zamanlı olarak kullanılmamalıdır. Ayrıca, diğer güçlü CYP3Ainhibitörleriyle flutikazon propiyonatın beraber kullanımı, sistemik yan etki riskini artırır(bkz. Bölüm 4.5). KOAH hastalarında pnömoniKortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoniriskinde artış kanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarakgösterilmemiştir. Kortikosteroid içeren inhale ilaçlarının pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık için kesin klinik kanıt bulunmamaktadır. Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyladikkatli olmalıdırlar. KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içimi, ileri yaş, düşük vücut kitle indeksi ve şiddetli KOAH bulunmaktadır. Güçlü CYP3A4 inhibitörleri ile etkileşimlerBirlikte kullanılan sistemik ketokonazol, salmeterole sistemik maruziyeti önemli ölçüde arttırır. Bu sistemik etkilerin görülme sıklığında bir artışa yol açabilir (örneğin; QTcaralığında uzama ve çarpıntı). Bu nedenle ketokonazol veya diğer güçlü CYP3A4 inhibitörleriile birlikte tedavisinden, salmeterol tedavisinin sistemik yan etkileri potansiyel riski artışınıgeçmediği sürece kaçınılmalıdır (bkz. bölüm 4.5). Görsel rahatsızlıkSistemik ve topikal kortikosteroid kullanımında görme bozuklukları rapor edilebilir. Eğer hastalarda sistemik ve topikal kortikosteroid kullanımıyla oluşmuş bulanık görme ya da diğergörme bozuklukları gibi semptomlar gösterirse; katarakt, glokom veya santral serözkorioretinopati (SSKR) gibi olası nedenlerin değerlendirilmesi için hasta oftalmolojiuzmanına başvurulmalıdır. 8 / 25 Pediyatrik popülasyonYüksek doz flutikazon propiyonat (genel olarak >1000 mikrogram/gün) kullanan 16 yaşından küçük çocuklar ve adolesanlar belirgin risk altında olabilir. Özellikle uzun süre yüksek dozkullanan hastalarda sistemik etkiler görülebilir. Olası sistemik etkiler; Cushing sendromu,Cushing benzeri belirtiler, adrenal supresyon, akut adrenal kriz, çocuklarda ve adolesanlardabüyüme geriliği ve daha seyrek olarak psikomotor hiperaktivite, uyku bozuklukları, anksiyete,depresyon veya agresyonu içeren psikolojik ve davranışsal etkilerdir. Hastanın pediyatrikgöğüs hastalıkları uzmanına yönlendirilmesi düşünülmelidir. İnhale kortikosteroidlerle uzun süreli tedavi gören çocukların boyları düzenli olarak kontrol edilmelidir. İnhale kortikosteroidlerin dozu, etkili astım kontrolü sağlanan en düşükdoza ayarlanmalıdır. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBeta adrenerjik blokerler salmeterolün etkisini antagonize edebilir veya zayıflatabilir. Kullanımı zorunlu olmadıkça, selektif veya selektif olmayan beta-blokerlerinkullanılmasından kaçınılmalıdır. Beta2-agonist ile tedavi potansiyel olarak ciddi hipokalemiyeneden olabilir. Ksantin türevleri, steroidler ve diüretiklerle eş zamanlı kullanımı bu etkiyiarttıracağından akut ciddi astımda dikkatli kullanılmalıdır. Diğer beta adrenerjik içeren ilaçların eşzamanlı kullanımı potansiyel aditif etkiye sahip olabilir. Flutikazon propiyonatNormal şartlar altında, flutikazon propiyonat inhalasyon yolu ile uygulandıktan sonra, büyük ölçüde ilk geçiş metabolizması ve karaciğer ve bağırsakta sitokrom CYP3A4'ün aracılık ettiğiyüksek sistemik klirens sonucu, düşük plazma konsantrasyonlarına ulaşılır. Bu nedenle,flutikazon propiyonatın aracılık ettiği klinik olarak anlamlı ilaç etkileşimi olası değildir. Sağlıklı gönüllüler üzerinde yapılan bir ilaç etkileşim çalışması, günde 2 kez 100 mg verilen ritonavirin (oldukça güçlü sitokrom CYP3A4 inhibitörü), intranazal flutikazon propiyonatınplazma konsantrasyonlarını birkaç yüz kat artırabildiğini ve serum kortizolkonsantrasyonlarında anlamlı azalmaya yol açtığını göstermiştir. Bu etkileşim ile ilgili bilgiinhale flutikazon propiyonat için yeterli değildir ama flutikazon propiyonat plazmaseviyesinde belirgin bir artış beklenir. Cushing sendromu ve adrenal supresyon vakalarıbildirilmiştir. Bu nedenle, hastaya olan potansiyel yararı sistemik kortikosteroid yan etkileririskinden fazla olmadıkça, ritonavir ve flutikazon propiyonatın birlikte kullanımındankaçınılmalıdır. Sağlıklı gönüllülerle yapılan küçük ölçekli bir çalışmada kısmen daha düşük potente sahip bir CYP3A inhibitörü olan ketokonazol, tek doz flutikazon propiyonat inhalasyonundan sonramaruziyeti %150 arttırmıştır. Flutikazon propiyonatın tek başına uygulanmasıylakarşılaştırıldığında plazma kortizol seviyesinde daha büyük bir azalma olmuştur. İtrakonazolve kobisistat içeren ilaçlar gibi diğer potent CYP3A inhibitörleri ve eritromisin gibi orta 9 / 25 kuvvetli CYP3A inhibitörleriyle beraber kullanımının da sistemik flutikazon propiyonat maruziyetini ve sistemik yan etki riskini arttırması beklenir. Yararı sistemik kortikosteroidyan etkileri riskinden fazla olmadıkça, birlikte kullanımdan kaçınılmalıdır. Birliktekullanımda hastalar sistemik kortikosteroid yan etkileri açısından takip edilmelidir. SalmeterolPotent CYP3A4 inhibitörleri15 sağlıklı gönüllüde 7 gün süreyle yürütülen bir ilaç etkileşim çalışmasında eşzamanlı sistemik ketokonazol (günde bir kez 400 mg) ve salmeterol (günde iki kez inhale 50mikrogram) kullanımının plazma salmeterol maruziyetini anlamlı derecede artırdığıgözlenmiştir (Cmaks 1,4 kat, EAA 15 kat). Bu durum, salmeterol ya da ketokonazolün tekbaşına uygulanmasıyla karşılaştırıldığında, salmeterolün diğer sistemik etkilerinin (örn. QTcaralığının uzaması ve palpitasyonlar) artmasına neden olabilir (bkz. Bölüm 4.4). Kan basıncı, kalp atım hızı, kan glikoz ve kan potasyum seviyeleri üzerinde klinik olarak anlamlı etki görülmemiştir. Ketokonazol ile birlikte kullanımı salmeterolün eliminasyon yarıömrünü veya tekrarlı doz sonrası salmeterol birikimini arttırmamı ştır. Ketokonazol ile eşzamanlı kullanımından, tedavinin yararları salmeterolün artan sistemik yan etkiler riskinden daha yüksek olmadığı sürece kaçınılmalıdır. Diğer potent CYP3A4inhibitörleri ile benzer bir etkileşim riskinin olması muhtemeldir (örn, itrakonazol,telitromisin, ritonavir). Orta dereceli CYP3A4 inhibitörleri15 sağlıklı gönüllüde 6 gün süreyle birlikte salmeterol (inhalasyon yoluyla günde iki kez 50 mikrogram) ve eritromisin (oral yolla günde üç kez 500 mg) uygulanımı salmeterolmaruziyetinde küçük ancak istatistiksel açıdan anlamlı olmayan bir artışa neden olmuştur(Cmaks 1,4 kat, EAA 1,2 kat). Eritromisin ile birlikte kullanımı, her hangi bir ciddi advers etkiile ilişkilendirilmemiştir. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)RESPİRO D'nin doğum kontrol yöntemleri üzerine etkisi olup olmadığına dair herhangi bir bilgi bulunmamaktadır. Gebelik dönemiGebe kadınlardaki verinin büyük bölümü (1000'den fazla gebe vakası) salmeterol ksinafoat ve flutikazon propiyonat ile ilgili herhangi bir malformasyon veya feto/neonatal toksisiteolmadığını göstermiştir. Hayvan çalışmaları, beta2-adrenoreseptör agonistlerin veglukokortikoidlerin uygulanmasından sonra üreme toksisitesi göstermiştir (bkz. Bölüm 5.3). 10 / 25 RESPİRO-D kullanımı ancak anneye sağlaması beklenen yararı fetusa olan olası bir riskten fazla ise düşünülmelidir. Gebe kadınlarda, yeterli astım kontrolünü sağlayacak en düşük flutikazon propiyonat etkili dozu kullanılmalıdır. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/ fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz.bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. RESPİRO-D, gerekli olmadıkça (bunun koşulları belirtilmelidir) gebelik döneminde kullanılmamalıdır. Laktasyon dönemiSalmeterol ve flutikazon propiyonat/metabolitlerin insan sütüne geçip geçmediği bilinmemektedir. Çalışmalar, salmeterol ve flutikazon propiyonat ve metabolitlerinin emziren sıçanların sütüne geçtiği göstermiştir. Emzirilen yenidoğan/infant için risk göz ardı edilemez. Anne sütü almanın çocuk açısından yararı ve tedavinin anne açısından yararı göz önüne alınarak, RESPİRO-D tedavisinin ya daemzirmenin durdurulması arasında bir karar verilmelidir. Üreme yeteneği/Fertiliteİnsanlar için veri bulunmamaktadır. Bununla birlikte, hayvanlar üzerindeki çalışmalarında salmeterol veya flutikazon propiyonatın fertilite üzerine etkisi gösterilmemiştir. 4.7 Araç ve makine kullanımı üzerindeki etkilerRESPİRO-D'nin araç ve makine kullanımı üzerine etkisi yoktur veya etkisi göz ardı edilebilir. 4.8 İstenmeyen etkilerRESPİRO-D, salmeterol ve flutikazon propiyonat içerdiğinden her iki bileşenle de ilişkili olan tipte ve şiddette advers reaksiyonlar görülebilir. Bu iki bileşiğin birlikte verilmesiyle ilaveadvers etki bildirilmemiştir. Salmeterol/flutikazon propiyonat ile ilgili advers olaylar aşağıda Sistem Organ Sınıfı (SOC) ve sıklığa göre verilmiştir. Advers ilaç reaksiyonları aşağıdaki sıklık derecesine göre belirtilmiştir: Çok yaygın (>1/10); yaygın (>1/100 ila < 1/10); yaygın olmayan (>1/1.000 ila < 1/100); seyrek (>1/10.000 ila < 1/1.000), çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor). 11 / 25 Sıklıklar klinik çalışma verilerinden belirlenmiştir. Plasebo insidansı hesaba göz önünde bulundurulmamı ştır. Enfeksiyonlar ve enfestasyonlar13 5 Yaygın: Ağız ve boğazda kandidiyazis,pnömoni (KOAH hastalarında) ' ' , 1 3 bronşit Seyrek: Özofageal kandidiyazis Bağışıklık sistemi hastalıklarıAşağıdaki belirtileri de içeren aşırı duyarlılık reaksiyonları: Yaygın olmayan: Kütanöz duyarlılık reaksiyonları, dispne Seyrek: Anjiyoödem (genellikle yüzdeve orofarinksde ödem), solunum semptomları (bronkospazm), anafilaktik şok dahil, anafilaktik reaksiyonlar Endokrin hastalıklarıSeyrek4: Cushing sendromu, Cushingoid benzeri özellikleri, adrenal süpresyonu, çocuklar ve adolesanlarda gelişim geriliği, azalan kemik mineral yoğunluğu Metabolizma ve beslenme hastalıklarıYaygın: Hipokalemi3 Yaygın olmayan: Hiperglisemi4 Psikiyatrik hastalıklarYaygın olmayan: Anksiyete, uyku bozuklukları Seyrek: Psikomotor hiperaktivite ve iritabilite (çoğunlukla çocuklarda) dahil davranış değişiklikleri Bilinmiyor: Depresyon, agresyon (çoğunlukla çocuklarda) Sinir sistemi hastalıklarıÇok yaygın: Baş ağrısı1 Yaygın olmayan: Tremor Göz hastalıklarıYaygın olmayan:Seyrek: Bilinmiyor: Katarakt Glokom4Bulanık görme4 Kardiyak hastalıklarYaygın olmayan: Taşikardi, palpitasyon, atriyal fibrilasyon, anjina pektoris Seyrek: Kardiyak aritmi (supraventriküler taşikardi ve ekstrasistol dahil) 12 / 25 Solunum, göğüs hastalıkları ve mediastinal hastalıklar2 3 Çok yaygın: Nazofarenjit ' 1 3 Yaygın: Boğaz irritasyonu, ses kısıklığı/disfoni, sinüzit ' Seyrek: Paradoksal bronkospazm4 Deri ve deri altı doku hastalıklarıYaygın: Kontüzyonlar1,3 Kas-iskelet bozuklukları, bağdoku ve kemik hastalıkları1,3 Yaygın: Kas krampları, travmatik kırıklar , , artralji, miyalji 1. Yaygın olarak plaseboda bildirilmiştir. 2. Çok yaygın olarak plaseboda bildirilmiştir. 3. 3 yıldan uzun süren bir KOAH çalışmasında bildirilmiştir. 4. Bkz. Bölüm 4.4 5. Bkz. Bölüm 5.1 Seçili advers reaksiyonların tanımlanmasıBeta2-agonist tedavisinin tremor, palpitasyon ve baş ağrısı gibi farmakolojik yan etkileri raporlanmıştır. Fakat bu yan etkiler geçicidir ve düzenli tedavi ile azalma eğilimi gösterir. Diğer inhalasyon tedavilerinde olduğu gibi, dozlamadan sonra hırıltılı solunum ve nefes darlığında ani artış ile birlikte paradoksal bronkospazm görülebilir. Paradoksal bronkospazmhızlı etkili bronkodilatörlere cevap verir ve derhal tedavi edilmelidir. RESPİRO-D hemenkesilmelidir, gerekli olduğu durumda hasta değerlendirilmeli ve başka bir tedaviyebaşlanmalıdır. Flutikazon propiyonat içeriğinden dolayı bazı hastalarda ses kısıklığı ve ağızda, boğazda ve nadiren özofagusta kandidiyazis (pamukçuk) görülebilir. Hem ses kısıklığı hem dekandidiyazis ürün kullanıldıktan sonra ağız su ile çalkalanarak ve/veya dişler fırçalanarakiyileşebilir. Semptomatik ağız ve boğaz kandidiyazisi, RESPİRO-D kullanımına devamedilirken topikal anti-fungal ile tedavi edilebilir. Pediyatrik popülasyonOlası sistemik etkiler Cushing sendromu, Cushing benzeri belirtiler, adrenal supresyon ve çocuklarda ve adolesanlarda büyüme geriliğini içerir (bkz. Bölüm 4.4). Ayrıca çocuklardaanksiyete, uyku bozuklukları ve hiperaktivite ve irritabilite gibi davranışsal bozukluklargözlenmiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye 13 / 25 Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; tel: 0800 314 0008; faks: 0312 218 35 99) 4.9 Doz aşımı ve tedavisiRESPİRO-D ile doz aşımına ilişkin klinik çalışmalardan elde edilmiş veri yoktur ancak her iki madde ile doz aşımına yönelik veriler aşağıda sunulmaktadır: Salmeterol doz aşımının belirti ve semptomları baş dönmesi, sistolik kan basıncı, titreme, baş ağrısı ve taşikardidir. İlacın P agonist bileşeninin aşırı dozu nedeniyle RESPİRO-Dtedavisinin bırakılması gerekiyorsa, uygun yerine koyma steroid tedavisi sağlanmasıdüşünülmelidir. Ayrıca hipokalemi meydana gelebilir ve potasyum seviyeleri izlenmelidir. Potasyum replasmanı düşünülmelidir. Akut:Önerilenden yüksek flutikazon propiyonat dozlarının akut inhalasyonu adrenal fonksiyonunda geçici supresyona neden olabilir. Adrenal fonksiyonu plazma kortizolölçümleri ile doğrulandığı gibi birkaç günde normale döndüğünden bu doz acil tedavigerektirmemektedir.İnhale flutikazon propiyonatın kronik aşırı dozu: Adrenal rezerv izlenmeli ve sistemik bir kortikosteroid ile tedavi gerekli olabilir. Stabilize edildiğinde, önerilen dozda inhalekortikosteroid ile devam edilebilir. Bkz. Bölüm 4.4: adrenal supresyon riski.Hem akut hem de kronik flutikazon propiyonat doz aşımında, semptom kontrolü için RESPİRO-D tedavisine uygun dozda devam edilmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Adrenerjikler kortikosteroidler veya diğer ilaçlarla kombinasyon halinde, Antikolinerjikler hariç ATC Kodu: R03AK06 Etki mekanizması ve farmakodinamik etkilerRESPİRO-D farklı etki mekanizmalarına sahip salmeterol ve flutikazon propiyonat içerir. Her iki ilacın da etki mekanizmaları aşağıda verilmiştir: Salmeterol Salmeterol, reseptörün ekzo bölgesine bağlanan uzun bir yan zinciri olan, selektif uzun etkili (12 saat) bir beta 2-adrenoseptör agonistidir.Salmeterol kısa etkili konvansiyonel beta2-agonistlerin önerilen dozlarına göre en az 12 saat süren, daha uzun süreli bronkodilatasyon sağlar. Flutikazon propiyonat Flutikazon propiyonat, tavsiye edilen dozlarda inhalasyon yoluyla verildiğinde akciğerlerde 14 / 25 güçlü bir antienflamatuvar etki gösteren ve sistemik olarak verilen kortikosteroidlerle gözlenen yan etkiler olmadan astımın belirtilerini ve alevlenmelerini azaltan birglukokortikoidtir. Klinik etkililik ve güvenlilikSalmeterol/flutikazon propiyonat kombinasyonunun astım klinik çalışmaları Persistan astımı olan 3416 erişkin ve adolesan hastayı kapsayan 12 aylık bir çalışmada(Optimal Astım Kontrolünün Sağlanması, OAKS), astım tedavisi hedeflerinin erişilebilir olupolmadığını belirlemek üzere salmeterol/flutikazon propiyonat kombinasyonu ve tek başınainhale kortikosteroidin (flutikazon propiyonat) güvenlilik ve etkililiği karşılaştırılmıştır. **Tam olarak kontrolsağlanana kadar veya çalışma ilacının en yüksek dozuna ulaşılanakadar tedavi 12 haftada bir artırılmıştır. OAKS çalışması, tek başına inhale kortikosteroidlerile karşılaştırıldığında, salmeterol/flutikazon propiyonat kombinasyonu ile tedavi edilen dahafazla sayıda hastada astım kontrolünün sağlandığını ve bu sonuca daha düşük birkortikosteroid dozunda erişildiğini göstermiştir.* İyi kontrol altına alınmışiyi kontrol altına alınmışhaftaya ulaşmak için hastaların %50'sinin tedavi alma süresi salmeterol/flutikazon propiyonatkombinasyon grubunda 16 gün, tek başına inhale kortikosteroid grubunda 37 gündür. Dahaönce steroid kullanmamış olan astmatik alt grupta, kişisel iyi kontrollü haftaya ulaşmak içingerekli süre salmeterol/flutikazon propiyonat kombinasyon tedavi grubunda 16 günken, inhalekortikosteroid tedavi grubunda 23 gündür.
15 / 25 etkilerin olmaması **Tam kontrol altına alınan astım; semptomların olmaması, KEBA kullanımının olmaması, > %80 öngörülen sabah pik ekspiratuar akışı, gece uyanmalarının olmaması, alevlenmelerinolmaması ve tedavi değişikliği gerektiren yan etkilerin olmaması Bu çalışmanın bulguları, günde iki kere salmeterol/flutikazon propiyonat 50/100 mcg kombinasyonunun, hızlı astım kontrolünün gerekli olduğu kabul edilen orta derece persistanastımı olan hastalarda, başlangıç idame tedavisi olarak kullanılabileceğini göstermektedir(bkz. Bölüm 4.2). >18 yaş persistan astımı olan 318 hastayı kapsayan çift-kör, randomize bir paralel grup çalışmasında, salmeterol/flutikazon propiyonat kombinasyonunun iki hafta süre ile günde ikikere iki inhalasyon şeklinde (çift doz) uygulanmasının güvenlilik ve tolerabilitesideğerlendirilmiştir. Çalışma, günde iki defa bir inhalasyonla karşılaştırıldığında, hersalmeterol/flutikazon propiyonat dozu inhalasyonunun 14 gün süre ile iki katınaçıkarılmasının, beta-agonistle ilişkili advers olaylarda küçük bir artışa neden olduğunu(tremor; 0'a karşı 1 hasta (%1), palpitasyon; 1 hastaya (<%1)'e karşı 6 hasta (%3), kaskrampları; 1(<%1)'e karşı 6 hasta (%3)) ve inhale kortikosteroidle ilişkili advers olaylaraçısından insidansın benzer olduğunu (oral kandidiyazis; 16 (%8)'ya karşı 6 hasta (%6), seskısıklığı; 4 (%2)'e karşı 2 hasta (%2)) göstermiştir. Kısa süreli ek inhale kortikosteroid tedavi(14 güne kadar) gerektiren erişkin hastalarda, doktor tarafından salmeterol/flutikazonpropiyonat kombinasyon dozunun iki katına çıkartılması düşünülüyorsa, beta-agonistle ilişkiliadvers olaylardaki küçük artış göz önünde bulundurulmalıdır. Salmeterol/flutikazon propiyonat kombinasyonuyla KOAH çalışmaları TORCH (TOwards a Revolution in COPH Health, KOAH'ta devrime doğru), KOAH olanhastalarda, günde iki kere 50/500 mikrogram salmeterol/flutikazon propiyonat,kombinasyonugünde iki kere 50 mikrogram salmeterol , günde iki kere 500 mikrogram flutikazonpropiyonat (FP) veya plasebo ile tedavinin, tüm nedenlere bağlı mortalite üzerindeki etkisinideğerlendirmek için yapılmış 3 yıllık bir çalışmadır. Başlangıç (bronkodilatatör öncesi) FEV 1değeri öngörülen normal değerin %60'ından düşük olan KOAH hastaları, çift kör ilaç almaküzere randomize edilmişlerdir. Çalışma esnasında, başka inhale kortikosteroid, uzun etkilibronkodilatatör ve uzun süreli sistemik kortikosteroid haricinde, hastaların olağan KOAHtedavisini almalarına izin verilmiştir. 3 yıl sonra sağkalım durumu, çalışmadan çıkıpçıkmadıklarına bakılmaksızın bütün hastalar için değerlendirilmiştir. Primer sonlanım noktası,plasebo ile karşılaştırıldığında salmeterol/flutikazon propiyonat için 3. yılda tüm nedenlerebağlı mortalitede azalmadır.16 / 25
Plasebo ile karşılaştırıldığında, 3. yılda, salmeterol/flutikazon propiyonat kombinasyonu ile tedavi edilen olgularda sağkalımın artış eğilimi gösterdiği ancak bu artış istatistiksel olarakseviye p<0,05'e ulaşmamıştır. Üç yıl içinde, KOAH ile ilişkili nedenlere bağlı olarak ölen hastaların oranı plasebo için %6, salmeterol için %6,1, FP için %6,9 ve salmeterol/flutikazon propiyonat kombinasyonu için%4,7 olarak bulunmuştur. Salmeterol/flutikazon propiyonat kombinasyon tedavisi; salmeterol, FP ve plasebo ile karşılaştırıldığında, yılda ortalama orta ila şiddetli alevlenme sayısı anlamlı derecede azalttığıgörülmüştür (ortalama oran salmeterol/flutikazon propiyonat kombinasyon grubunda 0,85,salmeterol grubunda 0,97, FP grubunda 0,93 ve plasebo grubunda 1,13). Bu durum, orta-ciddialevlenme oranında plasebo ile karşılaştırıldığında %25 (%95 GA: %19-%31; p<0,001),salmeterol ile karşılaştırıldığında %12 (%95 GA: %5-%19, p=0,002) ve FP ilekarşılaştırıldığında %9 (%95 GA: %1-%16, p=0,024) oranında azalmıştır. Salmeterol ve FP,plasebo ile karşılaştırıldığında, alevlenme oranlarını, sırası ile %15 (%95 GA: %7-%22;p<0,001) ve %18 (%95 GA: %11-%24, p<0,001) oranında anlamlı derecede düşürmüştür. St George Solunum Anketi (SGRQ) ile ölçülen Sağlıkla İlişkili Yaşam Kalitesi, plasebo ile karşılaştırıldığında bütün aktif tedavilerle artmış olarak saptanmıştır. Plasebo ilekarşılaştırıldığında, 3 yılda salmeterol/flutikazon propiyonat kombinasyonu için ortalama artış-3,1 birim (%95 GA: -4,1 - -2,1, p<0,001), salmeterol için -2,2 birim (p<0,001) ve FP için - 1,2 birim (p=0,017) olarak saptanmıştır. 4 birimlik bir düşüş klinik olarak önemli kabul 17 / 25 edilmiştir. Üç yılda advers olay olarak bildirilen pnömoni geçirme olasılığı plasebo için %12,3, salmeterol için %13,3, FP için %18,3 ve salmeterol/flutikazon propiyonat kombinasyonu için%19,6 olarak saptanmıştır (plasebo ile karşılaştırıldığında salmeterol/flutikazon propiyonatkombinasyonu için risk oranı: 1,64, %95 GA: 1,33-2,01, p<0,001). Pnömoni ile ilişkiliölümlerde artış olmamıştır; primer olarak pnömoniye bağlı olduğuna karar verilen tedaviesnasındaki ölüm sayısı plasebo için 7, salmeterol için 9, FP için 13 ve salmeterol/flutikazonpropiyonat kombinasyonu için 8 olarak saptanmıştır. Kemik kırığı olasılığında anlamlı farksaptanmamıştır (plasebo için %5,1, salmeterol için %5,1, FP için %5,4 vesalmeterol/flutikazon propiyonat kombinasyonu için %6,3; plasebo ile karşılaştırıldığındasalmeterol/flutikazon propiyonat kombinasyonu için risk oranı: 1,22, %95 GA: 0,87-1,72,p=0,248). 6 ve 12 aylık plasebo kontrollü klinik çalışmalar, 50/500 mikrogram salmeterol/flutikazon propiyonat kombinasyonunun düzenli kullanımının, akciğer fonksiyonunu artırdığını ve nefesdarlığını ve kurtarıcı ilaçlarının kullanımını azalttığını göstermiştir. SCO40043 ve SCO100250 çalışmaları, yıllık orta/ciddi alevlenmelerin oranı üzerindeki etkilerini karşılaştırılmak üzere FEV1 değeri öngörülenin %50'sinden az olan ve alevlenmeöyküsü bulunan KOAH hastalarında, 50/250 mikrogram salmeterol/flutikazon propiyonatkombinasyonu (Avrupa Birliği'nde KOAH tedavisi için lisanslı olmayan doz) ve 50mikrogram salmeterolün kullanıldığı randomize, çift-kör, paralel grup, tekrarlanançalışmalardır. Orta/ciddi alevlenme, oral kortikosteroid ve/veya antibiyotiklerle tedavi veyahastaneye yatırılmayı gerektiren semptom kötüleşmesi olarak tanımlanmıştır. Çalışmaların 4 haftalık bir tedavisiz dönemi olmuştur ve bu dönemde, bütün hastalar, 52 hafta süre boyunca körlenmiş çalışma ilacını kullanmak üzere randomize edilmeden önce, KOAHfarmakoterapisini standardize etmek ve hastalığı stabilize etmek üzere açık etiketli 50/250salmeterol/FP kombinasyonu almışlardır. Hastalar, 50/250 mcg salmeterol/FP kombinasyonu(total ITT n=776) veya salmeterol (total ITT n=778) gruplarına 1:1 oranında randomizeedilmiştir. Tedavisiz dönem öncesinde, hastalar kısa etkili bronkodilatörler haricinde dahaönceki KOAH ilaçlarını kesmişlerdir. Tedavi dönemi esnasında, eş zamanlı olarak inhaleuzun etkili bronkodilatörlerin (beta2 agonist ve antikolinerjik), ipratropium/salbutamolkombinasyonunun, oral beta2 agonistlerinin ve teofilin preparatlarının kullanılmasına izinverilmemiştir. Oral kortikosteroidlere ve antibiyotiklere, kılavuzla uyumlu olarak kullanılmasışartıyla KOAH alevlenmelerinin akut tedavisi için izin verilmiştir. Hastalar, çalışmalardasalbutamolü gerektiğinde kullanmışlardır. Salmeterol/flutikazon propiyonat 50/250 mcg kombinasyonu içeren tüm çalışmaların sonuçları, salmeterole göre anlamlı derecede daha düşük yıllık orta/ciddi alevlenme oranı ilesonuçlandığını göstermiştir ( SCO40043: hasta başına yılda, sırası ile 1,06 ve 1,53, hız oranı0,7, %95 GA: 0,58-0,83, p<0,001; SCO100250: hasta başına yılda, sırası ile 1,1 ve 1,59, hızoranı 0,7, %95 GA: 0,58-0,83, p<0,001). Sekonder etkililik ölçümleri ile ilgili bulguların (ilk 18 / 25 orta/ciddi alevlenmeye kadar geçen süre, oral kortikosteroid gerektiren yıllık sabah alevlenme oranı ve doz öncesi FEV1), salmeterolle karşılaştırıldığında, salmeterol/flutikazon propiyonat50/250 mcg kombinasyonunun anlamlı derecede lehine olduğu saptanmıştır. Advers olayprofilleri salmeterolle karşılaştırıldığında, salmeterol/flutikazon propiyonat 50/250 mcgkombinasyon grubunda, daha yüksek pnömoni insidansı ve bilinen lokal yan etkiler(kandidiyazis ve disfoni) haricinde, benzer bulunmuştur. Pnömoni ile ilişkili olaylar,salmeterol/flutikazon propiyonat 50/250 mcg kombinasyon grubunda 55 hastada (%7) vesalmeterol grubunda 25 hastada (%3) bildirilmiştir. Salmeterol/flutikazon propiyonat 50/250mcg kombinasyon grubunda bildirilen pnömoni insidansı artışı, TORCH'da 50/500 mcgsalmeterol/flutikazon propiyonat kombinasyonu tedavisi sonrası bildirilen insidans değerinebenzer saptanmıştır. AstımSalmeterol Çok-Merkezli Astım Araştırma Çalışması (SMART)Salmeterol, ABD'de; çok merkezli astım araştırma çalışması (SMART) yetişkin ve ergen bireylerde, olağan terapiye eklenen plaseboya kıyasla salmeterolün güvenliliğinideğerlendiren 28 haftalık bir çalışmadır. Solunum ilişkili ölüm ve solunum ile ilişkili yaşamıtehdit edici deneyimlerin toplamı birincil sonlanım noktası açısından önemli bir fark olmasınarağmen, çalışma salmeterol alan hastalarda astıma bağlı ölümlerde önemli bir artışgöstermiştir (salmeterol ile tedavi edilen 13.176 hastadan 13'ü ölmüşken, plaseboda 13.179hastadan 3'ü ölmüştür). Çalışma, eşzamanlı solunan kortikosteroid kullanımının etkisinideğerlendirmek için tasarlanmamıştır ve gönüllülerin sadece %47'si temel olarak inhaleglukokortikosteroid kullanımını bildirmiştir. Salmeterol/flutikazon propiyonat kombinasyonuna karşı flutikazon propiyonatın güvenliliği ve etkinliliğiSalmeterol/flutikazon propiyonat kombinasyonu ile tek başına flutikazon propiyonat'ın güvenliliği ve etkililiğini karşılaştırmak için biri yetişkin ve ergen gönüllülerde (AUSTRIçalışması), diğeri 4-11 yaşlarında pediyatrik gönüllülerde (VESTRI çalışması) olmak üzere ikitane çok merkezli 26 haftalık çalışma yürütülmüştür. Her iki çalışma için, kayıtlı gönüllüler;bir önceki yılda astıma bağlı hastaneye yatış veya astım alevlenmesi öyküsü olan orta ilaşiddetli kalıcı astıma sahiptir. İki çalışmanın da primer hedefi tek başına İKS'ye (inhalekortikosteroid) (flutikazon propiyonat) kıyasla İKS tedavisine LABA (uzun etkili P agonist)eklenmesinin (salmeterol/flutikazon propiyonat kombinasyonu) astımla ilişkili olaylar(astımla ilişkili hastaneye yatış, endotrakeyal entübasyon ve ölüm) açısından noninferioriteyideğerlendirmektir. Çalışmanın ikincil hedefi ciddi astım alevlenmesi (astımın kötüye gitmesinedeniyle en az 3 gün sistemik kortikosteroid kullanımına gerek olması veya sistemikkortikosteroid kullanımı gerektiren astım nedenli hastaneye veya acile yatış olaraktanımlanmıştır) açısından İKS+LABA'nın (salmeterol/flutikazon propiyonat kombinasyonu)tek başına İKS tedavisine (flutikazon propiyonat) üstünlüğünü değerlendirmektir. Toplam 11.679 ve 6.208 hasta, randomize edilmiş ve sırasıyla; AUSTRI ve VESTRI denemelerinde tedavi edilmiştir. Birincil güvenlik bitim noktası için, her iki çalışmada danoninferiorite çalışmaları elde edilmiştir (aşağıdaki tabloya bakınız). 19 / 25
a Göreceli riski 2'den az olmasıyla eğer %95 GA üst sonuçları hesaplanırsa, eşdeğerlik çalışmaları neticelendirilir. b Göreceli riski 2,675'den az olmasıyla eğer %95 GA üst sonuçları hesaplanırsa, eşdeğerlik çalışmaları neticelendirilir. İkincil etkinlik sonlanım noktası için, her iki çalışmada da salmeterol-flutikazon propiyonata ilişkin olan flutikazon propiyonat ilk astım alevlenmesinin zamanında azaltılmasıgörülmüştür, ancak sadece AUSTRI'nin istatistiki önemi bulunmuştur:
20 / 25 Pediyatrik popülasyonSemptomatik astımı olan 6-16 yaş aralığındaki 158 hasta ile yürütülen SAM101667 çalışmasında, salmeterol/flutikazon propiyonat kombinasyonu, semptom kontrolü ve akciğerfonksiyonu açısından flutikazon propiyonatın dozunun iki katına çıkarılmasıyla eşit etkililiktebulunmuştur. Bu çalışma, alevlenmeler üzerindeki etkiyi araştırmak üzere tasarlanmamıştır. 4 ile 11 yaş arasındaki çocuklarda (n=257) yürütülen,salmeterol/flutikazon propiyonat 50/100 mcg kombinasyonu veya günde iki kere salmeterol (50 mcg) /flutikazon propiyonat (100mcg) kombinasyonu ile tedavi edildiği 12 haftalık bir çalışmada, her iki tedavi grubunda, pikekspiratuvar akım hızında %14 oranında artış ve semptom skoru ve kurtarıcı salbutamolkullanımında düzelme gözlenmiştir. İki tedavi grubu arasında fark saptanmamıştır. İki tedavigrubu arasında güvenlik parametreleri açısından fark saptanmamıştır. Persistan astımı olan ve inhale kortikosteroid tedavisi sırasında semptomatik olan 4 ile 11 yaş arasındaki çocuklarla (n=203) yürütülen 12 haftalık bir paralel grup çalışmasında, güvenlilikprimer hedef olmuştur. Çocuklara günde iki kere salmeterol/flutikazon propiyonat (50/100mcg) kombinasyonu veya tek başına flutikazon propiyonat (100 mcg) verilmiştir.Salmeterol/flutikazon propiyonat kombinasyonu alan 2 çocuk ve flutikazon propiyonat alan 5çocuk, astımın kötüleşmesi nedeni ile çalışmadan ayrılmıştır. 12 hafta sonrasında, her ikitedavi kolunda 24 saatlik üriner kortizol atılımı anormal olan çocuk saptanmamıştır. Çalışmakolları arasında güvenlik profili açısından başka fark saptanmamıştır. Gebelik sırasında flutikazon propionat içeren astım ilacıMajör konjenital malformasyon (MKM) riskini değerlendirmek için, Birleşik Krallık elektronik sağlık kayıtları kullanılarak birinci trimesterde tek başına inhale flutikazonpropiyonat ve salmeterol/flutikazon propiyonat kombinasyonu ile flutikazon propiyonatiçermeyen İKS maruziyetinin karşılaştırıldığı, gözlemsel retrospektif epidemiyolojik kohortçalışması yürütülmüştür. Bu çalışmaya karşılaştırma amaçlı plasebo dahil edilmemiştir. Astım kohortunda 5.362 ilk trimester İKS'ye maruz kalan gebeliklerin 131'inde major konjenital malformasyon (MKM) riski tespit edilmiştir; 1612'si (%30) flutikazon propiyonatveya salmeterol/flutikazon propiyonat kombinasyonuna maruz kalmıştır ve 42'sinde majormalformasyon riski tespit edilmiştir. 1. yılda flutikazon propiyonat ile flutikazon propiyonatolmayan İKS maruziyeti karşılaştırıldığında kadınlarda tanı konulmuş MKM'ler içinayarlanmış olasılık oranı orta şiddette astımlılarda 1,1 (%95 GA: 0,5 - 2,3) ve şiddetliastımlılarda 1,2 (%95 GA: 0,7 - 2) olmuştur. İlk trimesterde tek başına flutikazon propiyonatile salmeterol/flutikazon propiyonat kombinasyon maruziyeti karşılaştırıldığında MKMriskinde farklılık görülmemiştir. Astım şiddet basamaklarında mutlak MKM riskleriflutikazon propiyonat maruziyeti olan 100 gebelikte 2 ila 2,9 arasında değişmektedir. Bu daKlinik Uygulama Araştırma Veritabanında astım tedavisine maruziyeti olmayan 15.840gebelikte yürütülen çalışmanın sonuçlarıyla karşılaştırılabilir olmuştur (100 gebelikte 2,8MKM). 21 / 25 5.2. Farmakokinetik özellikler Genel özelliklerFarmakokinetik açıdan her iki bileşen ayrı ayrı düşünülebilir. Salmeterol Salmeterol akciğerlerde lokal olarak etki eder, bu nedenle plazma seviyeleri terapötik etkinin belirleyicisi değildir. Terapötik dozlarda inhalasyondan sonra çok düşük plazmakonsantrasyonları gösterdiği için (yaklaşık 200 pikogram/ml veya daha az) plazmadaki ilaçmiktarının tayini teknik olarak zor olduğundan salmeterolün farmakokinetiği ile ilgili sadecesınırlı veriler bulunmaktadır. Emilim:Veri bulunmamaktadır. Dağılım:Veri bulunmamaktadır. Biyotransformasyon:Veri bulunmamaktadır. Eliminasyon:Veri bulunmamaktadır. Dosrusallık/Dosrusal olmayan durum:Veri bulunmamaktadır. Flutikazon propiyonat Emilim:Sağlıklı gönüllülerde inhalasyon yoluyla alınan tek doz flutikazon propiyonatın mutlak biyoyararlanımı, kullanılan inhalasyon cihazına göre nominal dozun yaklaşık %5-11'iarasında değişmektedir. Astım ya da KOAH hastalarında flutikazon propiyonata sistemikmaruziyetin daha az derecede olduğu görülmüştür. Sistemik absorpsiyon başlıca akciğerlerden gerçekleşir ve başlangıçta hızlı olup daha sonra yavaşlamaktadır. Kalan inhale doz yutulabilir, fakat yutulan kısım sudaki düşükçözünürlüğü ve % 1'den daha az oral biyoyararlanımla sonuçlanan presistemikeliminasyonundan dolayı sistemik maruziyete çok az katkıda bulunmaktadır. İnhale dozunartırılmasıyla sistemik maruziyet arasında doğrusal artış olur. Dağılım:Flutikazon propiyonatın dispozisyonu, yüksek plazma klirensi (1150 mL/dak), kararlı durumda yüksek hacmi (yaklaşık 300 L) ve yaklaşık 8 saat olan eliminasyon yarılanma ömrüile karakterizedir. 22 / 25 Plazma protein bağlanma oranı %91'dir. Biyotransformasyon:Flutikazon propiyonat başlıca sitokrom P450 enzimi CYP3A4 tarafından inaktif karboksilik asite metabolize edilir. Eliminasyon:Flutikazon propiyonat sistemik dolaşımdan çok hızlı elimine edilmektedir. Flutikazon propiyonatın renal klirensi önemsiz düzeydedir. Dozun %5'inden daha azı idrarda temeldemetabolitler olarak atılmaktadır. Dozun büyük bir bölümü feçeste metabolitler ve değişmemişolarak atılmaktadır. Doğrusallık/Doğrusal olmayan durum:Veri bulunmamaktadır. Hastalardaki karakteristik özellikler Böbrek/Karaciğer yetmezliği:Veri bulunmamaktadır. Pediyatrik popülasyon:Farklı cihazlarla (ölçülü kuru toz inhaler cihazı) gerçekleştirilen, 4 ila 77 yaşında 350 hastanın (4 ila 11 yaş arası 174 hasta) dahil edildiği 9 kontrollü klinik çalışmadan elde edilen verilerinkullanıldığı popülasyon farmakokinetik analizinde, flutikazon propiyonat 100mcg kuru tozinhaler ile karşılaştırıldığında, salmeterol/flutikazon propiyonat 50/100 mcg kuru toz inhalerkombinasyonu tedavisinde daha yüksek flutikazon propiyonat sistemik maruziyetigörülmüştür. Çocuklar ve adolesan/yetişkin popülasyonlarında salmeterol/flutikazon propiyonat kombinasyonuna karşı flutikazon propiyonat kuru toz inhaler için Geometrik Ortalama Oran (Güven Aralığı - GA %90)
21 günlük salmeterol/flutikazon propiyonat 25/50 mcg kombinasyon tedavisi (spacer ile birlikte veya spacer olmadan günde 2 inhalasyon) veya salmeterol/flutikazon propiyonat50/100 mcg kuru toz inhaler kombinasyon (günde 2 kez, 1 inhalasyon) tedavisinin etkisi, ortadereceli astımı olan 4 ila 11 yaş arasındaki 31 çocukta değerlendirilmiştir.Salmeterol/flutikazon propiyonat inhaler kombinasyonu, spacer ile birlikte 23 / 25 salmeterol/flutikazon propiyonat inhaler kombinasyonuve salmeterol/flutikazon propiyonat kombinasyonu için salmeterol sistemik maruziyeti benzer olmuştur (sırasıyla 126 pikogramsa/mL [%95 GA: 70, 255]; 103 pikogram sa/mL [%95 GA: 54, 200] ve 110 pikogram sa/mL[%95 GA: 55, 219]). Flutikazon propiyonat için sistemik maruziyet, spacer ile birliktesalmeterol/flutikazon propiyonat inhaler kombinasyonu (107 pikogram sa/mL [%95 GA: 45,7,252,2]) ve salmeterol/flutikazon propiyonat kuru toz inhaler kombinasyonu (138 pikogramsa/mL [%95 GA: 69,3, 273,2]) arasında benzer bulunmuş, ancak salmeterol/flutikazonpropiyonat inhaler kombinasyonu için daha azdır (24 pikogram sa/mL [%95 GA: 9,6, 60,2]). 5.3. Klinik öncesi güvenlilik verileriSalmeterol ve flutikazon'un ayrı ayrı uygulandığı hayvan çalışmalarından, insanlar için çıkarım yapılan güvenlilik konuları sadece artmış farmakolojik etkiyle ilgili durumlardır. Hayvan üreme çalışmalarında, glukokortikoidlerin malformasyonlara (yarık damak, iskelet bozuklukları) neden olduğu gösterilmiştir. Ancak, hayvan çalışmalarından elde edilen busonuçlar, insanlara uygulanan tavsiye edilen dozlar için anlamlı değildir. Salmeterol'lehayvan çalışmalarında embriyofetal toksisite sadece yüksek maruziyet seviyelerindegösterilmiştir. Birlikte uygulanımı takiben bilinen glukokortikoid kaynaklı anomalilerleilişkilendirilen dozlarda sıçanlarda artan transpoze umblikal arter ve ossipital kemikte eksikosifikasyon insidansı tespit edilmiştir. Salmeterol ksinafoat veya flutikazon propionat genetiktoksisite potansiyeli göstermemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiLaktoz monohidrat (İnhalac 230) (sığır sütünden üretilir) Laktoz monohidrat (Laktohale 300) (sığır sütünden üretilir) Kapsül (No:3)Hipromelloz 6.2 GeçimsizliklerGeçerli değildir. 6.3 Raf ömrü24 ay 6.4 Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında nemden koruyarak saklanmalıdır. 6.5 Ambalajın niteliği ve içeriğiRESPİRO-D OPA/ALU/ PVC blister ve Alüminyum Folyo ile ambalajlanır. Blisterler karton kutular içerisinde paketlenir. Bir karton kutu içerisinde 60 kapsül ile inhaler kullanımınınamacına uygun bir şekilde gerekli dozu sağlaması için bir adet Monodoz kuru toz inhalercihazı ve kullanma talimatı ile birlikte sunulmaktadır. 24 / 25 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelik lerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİDeva Holding A.Ş. Halkalı Merkez Mah. Basın Ekspres Cad. 34303 No:1 Küçükçekmece/İstanbul Tel: 0212 692 92 92Faks: 0212 697 00 24E-mail: [email protected]8. RUHSAT NUMARASI(LARI)2017/856 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi :10.11.2017 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ25 / 25 |
İlaç BilgileriRespiro-d 50 Mcg/250 Mcg İnhalasyon İçin Toz İçeren KapsülEtken Maddesi: Salmeterol Ksinafoat, Flutikazon Propiyonat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.