Detofen %0.025 Göz Damlası, Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİLERİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIDETOFEN % 0.025 göz damlası, çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:1 ml çözeltide; Ketotifen hidrojen fumarat.........345 mcg (250 mcg Ketotifen'e eşdeğer) Yardımcı maddeler:1 ml çözeltide; Benzalkonyum klorür............0,1 mg Sodyum hidroksit................k.m (pH: 5.2-5.5 olacak şekilde) Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMSteril göz damlası, çözelti Partikül içermeyen berrak, renksiz çözelti 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAlerjik konjunktivit semptomlarının tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Yetişkinler, yaşlılar ve çocuklarda (3 yaş ve üzeri): Konjunktival kese içine günde 2 defa 1 damla damlatılır. Uygulama şekliYalnız oftalmik kullanım içindir. Göze damlatılarak uygulanır. Orjinal kapak açılıncaya kadar sterilitesini korur. Hastalar, damlalık ucuna dokunulmasının solüsyonu kontamine edebileceği konusunda uyarılmalıdırlar. 1/7 Ellerinizi yıkayınız. Şişenin kapağını açınız. Kapağın altında bulunan halkayı çıkarınız (bkz. Resim 3 ve Resim 4). Kapağı halka olmadan tekrar kapatınız. Kapak içerisindeki plastik pin şişenin ucunudelecektir (bkz. Resim 5) Aşağıda belirtildiği şekilde gözünüze uygulayınız:  1. Başınızı arkaya doğru eğiniz; birelinizle alt göz kapağınızı yavaşça aşağıçekerek gözünüz ile göz kapağınızarasında bir çukur oluşturunuz.  2. Diğer elinizle şişeyi baş aşağı,gözünüzün üstünde dik olarak tutunuz. Yavaşça sıkarak bir damla damlatınız. 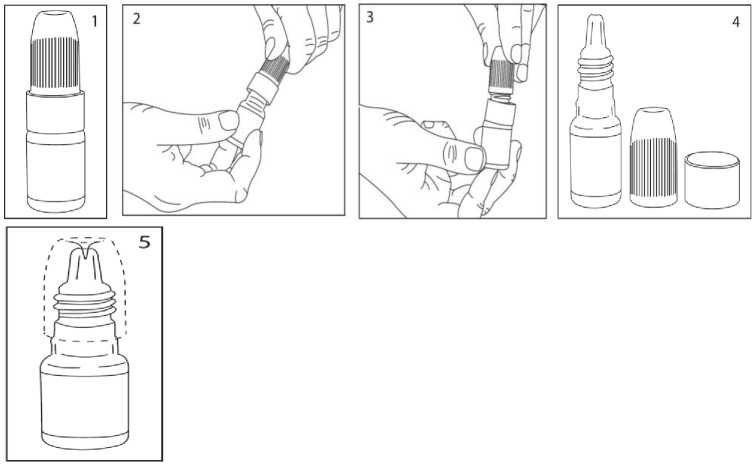  Damlalığın ucunu eliniz veya gözünüze değdirmemeye dikkat ediniz. 3. Damlattıktan sonra gözünüzün iç ucunaparmak ucunuz ile 1-2 dakika bastırınız. Bu, ilacın gözyaşı kanallarından buruna akmasını önler. Özel popülasyonlara ilişkin ek bilgilerBöbrek/Karaciğer yetmezliği:DETOFEN'in böbrek veya karaciğer yetmezliğinde etkinlik ve güvenliliği çalışılmamıştır. Pediyatrik popülasyon:DETOFEN'in 3 yaşın altındaki çocuklarda etkinlik ve güvenliliği gösterilmemiştir. Geriyatrik popülasyon:Yaşlılarda özel bir doz ayarlamasına gerek yoktur. 4.3. KontrendikasyonlarKetotifen veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriDETOFEN koruyucu olarak yumuşak kontakt lenslerde birikebilen bir madde olan benzalkonyum klorür ihtiva eder; bu nedenle, ilacın damlatılması esnasında gözde kontaktlens bulunmamalıdır. İlaç damlatıldıktan en az 15 dakika sonra kontakt lensler tekrar gözetakılabilir. Benzalkonyum klorür ihtiva eden tüm göz damlaları yumuşak kontakt lenslerin rengini soldurabilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDETOFEN'e ek olarak başka göz ilaçları kullanılması gerektiğinde, iki ilaç en az 5 dakika ara ile uygulanmalıdır. Oral yolla ketotifen fumarat kullanımı, santral sinir sistemi depresanlarının, antihistaminikierin ve alkolün etkisini potansiyalize edebilir. Bu olgunun ketotifen fumaratihtiva eden göz ürünleri açısından önemi bilinmemektedir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (kontrasepsiyon) uygulayanlarda ilacın kullanımı yönünden bir öneri bulunmamaktadır. Gebelik dönemiKetotifenin gebe kadınlara kullanımına ilişkin yeterli veri mevcut değildir. Oral kullanım ve toksik dozlar için yapılmış hayvan çalışmalarında pre ve postnatal mortalitede artış 3/7gözlenirken teratojenitede böyle bir durum gözlenmemiştir (bkz. Bölüm 5.3). Oküler kullanımı takiben sistemik düzeyler genellikle limitlerin altındadır. DETOFEN gerekliolmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiOral uygulamayı takiben elde edilen hayvan verilerine göre ilacın anne sütüne geçtiği bildirilmiş olmasına rağmen, insanda topikal uygulamayı takiben anne sütünde tespitedilebilir miktarlarda bulunmamıştır. Yine de, DETOFEN emzirme dönemindekullanılırken dikkatli olunmalıdır. Üreme yeteneği/FertiliteDETOFEN'in üreme yeteneği üzerindeki etkisi sıçanlar üzerinde araştırılmıştır (bkz. Bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkilerBulanık gören veya uyku hali olan hastalar araç ve makine kullanmamalıdırlar. 4.8. İstenmeyen etkilerÖnerilen dozda aşağıdaki yan etkiler gözlenmiştir. İstenmeyen etkiler çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1000 ila <1/100); seyrek (>1/10.000 ila<1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor) olarak listelenmiştir. Oküler yan etkiler:Göz bozukluklarıYaygın: Gözde yanma/batma, noktasal korneal epitel erozyonu. Sistemik yan etkiler:Bağışıklık sistemi bozukluklarıYaygın olmayan: Alerjik reaksiyon, ağız kuruluğu Sinir sistemi bozukluklarıYaygın olmayan: Baş ağrısı, somnolans Deri ve deri alti doku bozukluklarıYaygın olmayan: deride döküntü, ekzema, ürtiker 4/7 Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonuTürkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr;4.9. Doz aşımı ve tedavisiDoz aşımı bildirilmemiştir. 5 ml'lik göz damlasının içilmesi halinde alınan ketotifen miktarı, 3 yaşındaki bir çocuk için oral yolla önerilen günlük dozun %60'ı olan 1.25 mg 'a eşdeğerdir. Klinik sonuçlar 20 mg'akadar ketotifenin oral yolla alımını takiben hiçbir ciddi belirti ya da semptomungözlenmediğini göstermiştir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Oftalmolojikler, diğer antialerjikler ATC kodu: S01GX08Etki mekanizması: Ketotifen bir histamin Hl-reseptör antagonistidir. Ayrıca ketotifen tip-1 alerjik reaksiyonlarda etkin olan hücrelerden (mast hücreleri, eozinofil, bazofil ve nötrofilhücreleri) mediatör salıverilmesini (örn. histamin, lökotrien, prostaglandin ve PAF) deinhibe eder. Fosfodiesteraz inhibisyonu ile artan cAMP düzeyleri ketotifenin hücrestabilizasyonuna etkisine katkıda bulunabilir. 5.2. Farmakokinetik özelliklerGenel ÖzelliklerEmilim18 sağlıklı gönüllüye ketotifen uygulanması ile yapılan farmakokinetik çalışmalarda, damlanın 14 gün için tek doz ve çok doz oküler uygulamasını takiben ketotifenin plazmadüzeyleri limitin altında bulunmuştur (20 pg/ml). DağılımOral uygulamadan sonra ketotifen bifazik şekilde elimine edilmekte olup başlangıç yarı 5/7ömrü 3 ila 5 saat, terminal yarı ömrü ise 21 saattir. BiyotransformasyonAna metaboliti pratikte inaktif ketotifen-N-glukuroniddir. Eliminasyon48 saat içinde maddenin yaklaşık %1'i değişmemiş ve %60 ila %70'i metabolitleri olarak idrarla atılmaktadır. Doğrusallık/Doğrusal olmayan durum:Doğrusallık/Doğrusal olmayan durum hakkında veri bulunmamaktadır. Hastalardaki karakteristik özelliklerFarklı hasta gruplarında bilinen önemli bir farmakokinetik değişiklik yoktur. 5.3 Klinik öncesi güvenlilik verileriKonvansiyonel emniyet, farmakoloji, tekrarlanan doz toksisiteleri, genotoksisite, karsinojenik potansiyel ve üreme üzerindeki toksisite çalışmalarına dayanan preklinikveriler insanlar üzerinde zararlı etkisi olmadığını göstermiştir. Karsinojenez, Mutajenez, Fertilite Bozukluğu Bir dizi in vitro ve in vivo çalışmada ketotifen fumaratın mutajenik olmadığı belirlenmiştir. Bu çalışmalar: Ames testi, V79 Çin hamsterı hücreleri ile in vitro kromozomal aberasyontesti, farelerde in vivo mikronükleus testi ve fare dominant letal testidir. Erkek sıçanların çiftleşme öncesinde 70 gün süreyle > 10 mg/kg/gün (önerilen maksimum insan oküler dozu olan 0.0015 mg/kg/gün dozunun 6.667 katı (MRHOD)) oral ketotifendozları ile tedavisi mortaliteyle ve fertilitede azalma ile sonuçlanmıştır. Ketotifenuygulaması çiftleşme öncesi 15 güne kadar 50 mg/kg/gün (MRHOD'un 33.333 katı) oralketotifen verilen dişi sıçanlarda fertiliteyi olumsuz etkilememiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiBenzalkonyum klorür Gliserol Sodyum hidroksit Enjeksiyonluk su 6/76.2. GeçimsizliklerBilinen herhangi bir geçimsizliği bulunmamaktadır. 6.3. Raf ömrü24 ay Şişe açıldıktan sonra 28 gün içinde kullanılmalıdır. 6.4. Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız.6.5. Ambalajın niteliği ve içeriğiPrimer ambalaj malzemesi 5 mL'lik, damlalıklı, opak, düşük yoğunluklu beyaz polietilen şişe ve beyaz çevirmeli kapaktan oluşmaktadır. İçerisinde kullanma talimatı olan baskılıkarton kutu içerisinde sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerÖzel bir kullanma talimatı yoktur. Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİDeva Holding A.Ş. Halkalı Merkez Mah. Basın Ekspres Cad. 34303 No:1 Küçükçekmece/İSTANBUL Tel :0212 692 92 92Faks:0212 697 00 248. RUHSAT NUMARASI2015/295 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsatlandırma tarihi: 02.04.2015 Son yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ7/7 |
İlaç BilgileriDetofen %0.025 Göz Damlası, ÇözeltiEtken Maddesi: Ketotifen Hidrojen Fumarat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.