Victoza 6 Mg/ml Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Kalem Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIVİCTOZA® 6 mg/mL enjeksiyonluk çözelti içeren kullanıma hazır kalem Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Liraglutid 6 mg/mL (Saccharomyces cerevisiae'derekombinant DNA teknolojisi ile üretilen insan glukagon benzeri peptid-1 (GLP-1) analogu)Bir kullanıma hazır kalem, 3 mL içerisinde 18 mg liraglutid içermektedir. Yardımcı maddeler:Sodyum hidroksit (pH ayarı için) y.m. Disodyum fosfat dihidrat 1,42 mg/mL Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMKullanıma hazır kalem içinde enjeksiyonluk çözelti. Berrak, renksiz veya renksize yakın, izotonik çözelti; pH=8,15. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarVİCTOZA®, Tip 2 diabetes mellitus'u yeterince kontrol edilemeyen yetişkinlerin, adölesanların ve 10 yaş ve üzeri çocukların tedavisinde, diyet ve egzersize tamamlayıcı olacakşekilde aşağıdaki durumlarda endikedir; - İntolerans veya kontrendikasyon sebebiyle metformin kullanımının uygun olmadığıdurumlarda monoterapi olarak, - Diyabet tedavisinde kullanılan diğer tıbbi ürünlere ek olarak VICTOZA® Tip2 diabetes mellitus ve bilinen kardiyovasküler hastalığı bulunan yetişkinlerde majör kardiyovasküler olayların risk azaltılmasında endikedir. Kombinasyonlar, glisemik kontrol ve kardiyovasküler olaylar üzerindeki etkiler ve incelenen popülasyonlar ile ilgili çalışma sonuçları için bölüm 4.4, 4.5 ve 5.1'e bakınız. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:oji/uygulama sıklığı ve süresi:
1 Gastrointestinal tolere edilebilirliği artırmak için, başlangıç dozu günlük 0,6 mg liraglutidtir. En az bir hafta sonra, doz 1,2 mg'a artırılmalıdır. Bazı hastalarda dozun 1,2 mg'dan 1,8 mg'aartırılmasından fayda sağlanması beklenmektedir ve klinik cevaba bağlı olarak, en az bir haftasonra doz glisemik kontrolün daha fazla iyileştirilmesi için 1,8 mg'a artırılabilir. 1,8 mg'dandaha yüksek günlük dozlar tavsiye edilmemektedir. VİCTOZA®, sülfonilüre veya insülin tedavisine eklendiğinde, hipoglisemi riskini azaltmak amacıyla sülfonilüre veya insülin dozunun düşürülmesi düşünülmelidir (bakınız bölüm 4.4).Sülfonilüre ile kombinasyon tedavisi sadece yetişkin hastalar için geçerlidir. VİCTOZA® dozunun ayarlanması için hastanın kendi kendine kan glukozu ölçümleri yapması gerekmemektedir. Özellikle VİCTOZA® tedavisi başlandığında ve insülin dozu azaltıldığında,sülfonilüre ve insülin dozunu ayarlamak için hastanın kendi kendine kan glukoz ölçümleriyapması gerekmektedir. İnsülin doz azaltımı için aşamalı bir yaklaşım tavsiye edilir. Uygulama şekli:VİCTOZA® intravenöz (ven içine) veya intramüsküler (kas içine) uygulan mamalıdır.VİCTOZA® günde bir kez olmak üzere herhangi bir zamanda, öğünlerden bağımsız olarak subkütan (deri altına) uygulama ile karın, uyluk veya üst kola enjekte edilebilir. Enjeksiyonyeri ve zamanı doz ayarlamasına gerek kalmaksızın değiştirilebilir. Ancak, enjeksiyon içingünün en uygun vakti seçildiğinde, VİCTOZA®'nın her gün yaklaşık olarak aynı vakitteenjekte edilmesi tavsiye edilir. Uygulama ile ilgili ayrıntılı bilgi için, bölüm 6.6'ya bakınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Hafif, orta derecede veya ağır böbrek yetmezliği olan hastalarda doz ayarlaması gerekmemektedir. Son dönem böbrek yetmezliği olan hastalarda terapötik deneyimbulunmamaktadır ve bu nedenle, bu hastalarda kullanım için VİCTOZA® önerilmemektedir(bakınız bölüm 5.1 ve 5.2). Karaciğer yetmezliği:Hafif veya orta derece karaciğer yetmezliği olan hastalar için doz ayarlaması tavsiye edilmez. Ağır karaciğer yetmezliği olan hastalarda VİCTOZA® kullanımı önerilmez (bakınız bölüm5.2). Pediyatrik popülasyon:Adölesanlar ve 10 yaş ve üzeri çocuklar için doz ayarlaması gerekli değildir. 10 yaş altı çocuklar için veri bulunmamaktadır (bakınız bölüm 5.1 ve 5.2). Geriyatrik popülasyon (> 65 yaş):65 yaşın üzerindeki hastalarda, yaşa bağlı olarak doz ayarlaması gerekmemektedir (bakınız bölüm 5.2). 4.3. KontrendikasyonlarEtkin madde ve/veya bölüm 61'de yer alan yardımcı maddelerden herhangi birine karşı aşm duyarlılık durumlarında kontrendikedir. Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys2 Kendisinde veya aile öyküsünde medüler tiroid karsinomu olan hastalarda veya çoklu endokrin neoplazma sendromu tip 2 olan hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriVİCTOZA®, tip 1 diabetes mellitus'lu hastalarda veya diyabetik ketoasidozun tedavisinde kullanılmamalıdır. VİCTOZA® insülin yerine geçmez. İnsülin kullanan hastalarda insülinin birden kesilmesi veya dozunun azaltılmasından sonra diyabetik ketoasidoz bildirilmiştir (bakınız bölüm 4.2). Konjestif kalp yetmezliği NYKD (New York Kalp Derneği) sınıf IV olan hastalarda terapötik deneyim bulunmamaktadır ve bu nedenle liraglutidin bu hastalarda kullanımıönerilmemektedir. İnflamatuvar bağırsak hastalığı ve diyabetik gastroparezisi olan hastalarda sınırlı deneyim bulunmaktadır. Bu hastalarda liraglutid kullanımı önerilmemektedir, çünkü bulantı, kusma vediyare gibi geçici gastrointestinal advers reaksiyonlarla ilişkilendirilmektedir. Akut pankreatitAkut pankreatit, GLP-1 reseptör agonistleri kullanımıyla gözlenmiştir. Hastalar akut pankreatitin karakteristik semptomları ile ilgili bilgilendirilmelidirler. Pankreatittenşüpheleniliyorsa, liraglutid kullanımı durdurulmalıdır; eğer akut pankreatit teşhisi koyulduysa,liraglutide tekrar başlanmamalıdır (bakınız bölüm 4.8 ve 5.1). Tiroid hastalığıKlinik çalışmalarda ve özellikle önceden tiroid hastalığı geçirmiş hastalarda, guatr gibi tiroid ile ilgili advers olaylar rapor edilmiştir. Bu nedenle liraglutid bu hastalarda dikkatlikullanılmalıdır. HipoglisemiSülfonilüre grubu ilaç veya insülin ile birlikte liraglutid kullanan hastalarda hipoglisemi riski artabilir (bakınız bölüm 4.8). Hipoglisemi riski, sülfonilüre veya insülin dozunundüşürülmesiyle azaltılabilir. DehidratasyonLiraglutid ile tedavi edilen hastalarda renal bozukluk ve akut renal yetmezlik dahil olmak üzere dehidratasyon (su kaybı) belirti ve bulguları rapor edilmiştir. Liraglutid ile tedavi edilenhastalar, gastrointestinal yan etkiler ile ilişkili oluşabilecek potansiyel dehidratasyon riskinekarşı uyarılmalı ve sıvı kaybına karşı önlem almaları önerilmelidir. Takip EdilebilirlikBiyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir. Bu tıbbi ürün her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında sodyum içermez. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
3 In vitroçalışmalarda liraglutidin diğer etkin maddeler ile, sitokrom P450 ve plazma proteinlerine bağlanma ile ilgili, farmakokinetik etkileşimlere girme potansiyelinin çok düşükolduğu gösterilmiştir.Liraglutid ile gastrik boşalmadaki küçük gecikme, eş zamanlı uygulanan oral tıbbi ürünlerin emilimini etkileyebilmektedir. Etkileşim çalışmaları emilimde klinik olarak ilişkili herhangi birgecikme göstermemiştir ve dolayısıyla herhangi bir doz ayarlaması gerekmemektedir.Liraglutid ile tedavi edilen birkaç hastada en az bir ağır diyare atağı rapor edilmiştir. Diyare,birlikte uygulanan diğer oral tıbbi ürünlerin emilimini etkileyebilmektedir. Varfarin ve diğer kumarin türevleri Herhangi bir etkileşim çalışması yapılmamıştır. Varfarin gibi çözünürlüğü düşük veya terapötik indeksi dar olan etkin maddeler ile klinik olarak anlamlı etkileşimler göz ardıedilememektedir. Varfarin veya başka kumarin türevlerini kullanan hastalarda liraglutidtedavisine başlandığında daha sık INR (Uluslararası Standartlaştırılmış Oran) takibiönerilmektedir. Parasetamol 1000 mg tek dozu takiben liraglutid toplam parasetamol maruziyetini değiştirmemiştir. Parasetamol C maksmaks15 dakikaya kadar gecikmiştir. Eşlik edenparasetamol uygulamasında doz ayarlaması gerekmemektedir.Atorvastatin 40 mg tek doz atorvastatin uygulamasını takiben liraglutid, toplam atorvastatin maruziyetini klinik olarak anlamlı bir dereceye kadar değiştirmemiştir. Bu nedenle, liraglutid ile birlikteverildiğinde, atorvastatin için doz ayarlaması gerekmemektedir. Liraglutid ile atorvastatinC maksmaks1 ila 3 saate kadar gecikmiştir.Griseofulvin 500 mg tek doz griseofulvin uygulamasını takiben liraglutid, toplam griseofulvin maruziyetini değiştirmemiştir. Griseofulvin C maksmaksdeğişmemiştir. Griseofulvinile düşük çözünürlük ve yüksek geçirgenliğe sahip diğer bileşiklerin dozunun ayarlanmasıgerekmemektedir.Digoksin Tek bir doz 1 mg digoksinin liraglutid ile birlikte uygulanması, digoksinin EAA'sında %16 azalma göstermiştir. C maksmaks'ı 1 ila 1,5 saat gecikmiştir.Bu sonuçlara göre digoksin dozunda herhangi bir ayarlamaya gerek yoktur.Lizinopril Tek bir doz 20 mg lizinoprilin liraglutid ile birlikte uygulanması, lizinoprilin EAA'sında %15 azalma göstermiştir. C maksmaks'ı liraglutid ile 6 ila 8 saatgecikmiştir. Bu sonuçlara göre lizinopril dozunda herhangi bir ayarlamaya gerek yoktur.
4 Oral kontraseptifler Oral kontraseptif bir ürünün tek doz uygulanmasını takiben liraglutid, etinilöstradiol ve levonorgestrel C maksmaks, liraglutid ile her iki ürün için1,5 saat kadar gecikmiştir. Etinilöstradiol veya levonorgestrelin her birine toplam maruziyetüzerinde klinik olarak anlamlı etki yoktur. Bu nedenle, liraglutid ile beraber uygulandığında,kontraseptif etkinin etkilenmemesi beklenmektedir.İnsülin Tip 2 diyabetli hastalara kararlı durumda tek doz 0,5 U/kg insülin detemir ve 1,8 mg liraglutid uygulandığında, liraglutid ve insülin detemir arasında farmakokinetik veya farmakodinamiketkileşim gözlenmemiştir. Pediyatrik Popülasyon Etkileşim çalışmaları sadece yetişkinlerde gerçekleştirilmiştir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)VİCTOZA ®Gebelik dönemiVİCTOZA ®'nın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlarda yapılan çalışmalar üreme toksisitesinin bulunduğunu göstermiştir (bakınız bölüm 5.3).İnsanlara yönelik potansiyel risk bilinmemektedir.VİCTOZA ®®Laktasyon dönemiLiraglutidin anne sütüne geçip geçmediği bilinmemektedir. Hayvan çalışmaları liraglutid ve yakın yapısal benzerlikteki metabolitlerinin süte geçişlerinin düşük olduğunu göstermiştir.Klinik dışı çalışmalarda, emzirme dönemindeki sıçan yavrularının neonatal gelişimindetedaviyle ilişkili azalma görülmüştür (bakınız bölüm 5.3). Yeterli deneyim olmadığından,VİCTOZA ®Üreme yeteneği/FertiliteAşılama yoluyla elde edilmiş olan fetüs sayısında hafif azalma dışında, hayvan çalışmaları fertiliteyle ilgili zararlı etkiler göstermemiştir. 4.7. Araç ve makine kullanımı üzerindeki etkilerVİCTOZA®'nın araç ve makine kullarnmı üzerinde rtkM y°ktur veya etki ihmal edilebilir.
5 VİCTOZA® özellikle sülfonilüre grubu ilaç veya insülin ile birlikte kullanıldığında hastalar, araba sürme ve makine kullanımı esnasında hipoglisemiye girmemeleri için gerekli önlemlerialmaları konusunda uyarılmalıdır. 4.8. İstenmeyen etkilerGüvenlilik profilinin özeti 2500 yetişkin hastayı kapsayan beş adet kapsamlı, uzun-dönemli, faz 3a klinik çalışmalarda hastalar sadece VİCTOZA® veya metformin, sülfonilüre grubu ilaç (metformin ile birlikte veyadeğil) veya metformin artı rosiglitazon kombinasyonu almışlardır. Klinik çalışmalar sırasında en sık raporlanan advers reaksiyonlar, gastrointestinal bozukluklardır: bulantı ve diyare çok yaygın, kusma, kabızlık, karın ağrısı ve dispepsi yaygınolarak görülmüştür. Tedavinin başlangıcında, bu gastrointestinal advers reaksiyonlar daha sıkoluşabilir. Bu reaksiyonlar tedavinin devamında birkaç günde veya haftada genellikle azalır.Baş ağrısı ve nazofarenjit de yaygın olarak görülmüştür. Hipoglisemi yaygın olarakgörülmüştür ve liraglutid, sülfonilüre grubu ilaçlar ile kombine kullanıldığında çok yaygıngörülmüştür. Ciddi hipoglisemi öncelikle sülfonilüre grubu ilaç ile kombine edildiğindegözlenmiştir. Advers reaksiyonların listesi Uzun-dönemli kontrollü faz 3a çalışmalarında, LEADER çalışmasında (uzun-dönemli bir kardiyovasküler sonuç çalışması) ve spontan (ürün pazara sunulduktan sonra ortaya çıkan)raporlarda bildirilen advers reaksiyonlar Tablo 1 olarak aşağıda listelenmektedir. Ürünün tümadvers olayları için sıklıklar, faz 3a klinik çalışmalarda görülen sıklıklar baz alınarakhesaplanmıştır. Sıklıklar şu şekilde tanımlanmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000);bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her bir sıklık gruplamasında,istenmeyen etkiler, azalan ciddiyet sırasına göre bildirilmektedir. Tablo 1 Uzun dönemli kontrollü faz 3a çalışmalarından, uzun dönemli kardiyovasküler sonuç çalışmasından (LEADER) ve spontan (pazarlamasonrası) raporlardan elde edilen advers reaksiyonlar
6
Seçili advers reaksiyonların tanımı Liraglutidin monoterapi olarak kullanıldığı bir klinik çalışmada, liraglutid ile raporlanan hipoglisemi oranları, aktif karşılaştırma ilacı (glimepirid) ile tedavi edilen hastalara göre dahadüşük seviyede bulunmuştur. En sık raporlanmış advers reaksiyonlar gastrointestinalrahatsızlıklar, enfeksiyonlar ve enfestasyonlardır. Hipoglisemi Klinik çalışmalarda konfirme edilmiş hipoglisemi ataklarının çoğu minördür. Liraglutidin monoterapi olarak kullanıldığı çalışmada hiçbir ciddi hipoglisemi atağı gözlenmemiştir. Ciddihipoglisemi yaygın değildir ve primer olarak liraglutid, sülfonilüre grubu ilaç ile kombineedildiğinde gözlenmiştir (0,02 olay/hasta yılı). Liraglutidin sülfonilüre harici bir oralantidiyabetik ile kombine uygulanması halinde çok az sayıda atak (0,001 olayrhasta yılı)gözlenmiştir. Bazal insülin!e Hfaglııtidm tomhino kullarnmında hipoglisemi riski düşüktür (1,°Belge Do ile yapılan uzun-dönemli, kontrollü faz 3 klinik çalışmalarında az sayıda akut pankreatit vakası (<%0,2) bildirilmiştir. Pankreatit ilacın pazarda kullanımı sırasında daraporlanmıştır. LEADER çalışmasında, akut pankreatit sıklığı sırasıyla liraglutid için %0,4 veplasebo için %0,5 olarak alınan karar ile onaylanmıştır (bakınız bölüm 4.4 ve 5.1). Alerjik reaksiyonlar VİCTOZA®'nın pazarda kullanımı sırasında ürtiker, döküntü ve kaşıntıyı içeren alerjik reaksiyonlar raporlanmıştır. VİCTOZA®'nın pazarda kullanımı ile hipotansiyon, çarpıntı, dispne ve ödem gibi ilave semptomların eşlik ettiği az sayıda anafilaktik reaksiyon raporlanmıştır. VİCTOZA® ileyapılan tüm uzun-dönemli klinik çalışmalar sırasında az sayıda (%0,05) anjiyoödem vakasıraporlanmıştır. Pediyatrik popülasyon Bu belg£; elektronik imza ile imzalanmıştır.
8 Genel olarak, adölesanlar ve 10 yaş ve üzeri çocuklardaki advers reaksiyonların sıklığı, tipi ve ciddiyeti, yetişkin popülasyonunda gözlenenler ile karşılaştırılabilirdir. Doğrulanmışhipoglisemik epizotların oranı, plaseboya kıyasla (0,29 olaylar/hasta yılı) liraglutid (0,58olaylar/hasta yılı) ile daha yüksek olmuştur. Doğrulanmış bir hipoglisemik epizottan önceinsülin ile tedavi edilen hastalarda bu oran, plaseboya (0,91 olaylar/hasta yılı) kıyasla liraglutid(1,82 olaylar/hasta yılı) ile daha yüksek olmuştur. Liraglutid tedavi grubunda ciddihipoglisemik epizotlar görülmemiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9. Doz aşımı ve tedavisiPazarda kullanım ve klinik çalışmalarda, tavsiye edilen idame dozunun 40 katına kadar (72 mg) ulaşan doz aşımı vakaları raporlanmıştır. Bildirilen olaylar şiddetli bulantı, kusma, diyareve şiddetli hipoglisemiyi içermektedir. Doz aşımı durumunda, hastanın klinik belirti ve semptomlarına göre gerekli destek tedavisi başlatılmalıdır. Hasta, dehidratasyonun klinik belirtileri açısından gözlemlenmelidir ve kanglukozu izlenmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Diyabette kullanılan ilaçlar, glukagon-benzeri peptid-1 (GLP-1) analogları ATC kodu: A10BJ02 Etki mekanizması Liraglutid insan GLP-1'ine %97 diziliş homolojisi gösteren, GLP-1 reseptörlerine bağlanarak aktive eden bir GLP-1 analogudur. Pankreatik beta hücrelerinden glukoza-bağımlı insülinsekresyonunu uyaran endojen bir inkretin hormonu olan doğal GLP-1'in hedefi, GLP-1reseptörüdür. Doğal GLP-1'den farklı olarak, liraglutid insanlarda günde bir kez uygulamayauygun farmakokinetik ve farmakodinamik profile sahiptir. Subkütan uygulamayı takiben,uzamış etki profili üç mekanizmaya dayanmaktadır: yavaş emilime yol açan birbirinebağlanma, albumine bağlanma ve uzun plazma yarılanma ömrü ile sonuçlanan dipeptidilpeptidaz-4 (DPP-4) ve nötral endopeptidaz (NEP) enzimlerine karşı daha yüksek enzimatikstabilite. Liraglutid etkisi, GLP-1 reseptörleri ile spesifik bir etkileşim sonucu siklik adenozin monofosfat (cAMP) seviyesinde bir artışa aracılık etmektedir. Liraglutid insülin sekresyonunuglukoza-bağımlı bir şekilde artırır. Aynı zamanda, liraglutid uygunsuz artmış yüksek glukagonseviyelerini de glukoza bağımh bir şekilde azaltın Böylece kan glukozu yüksek olduğundainsülin salımı uyarılır ve glukagon salımı inhibe edilir. Hipoglisemi sırasında ise tam tersine 9 liraglutid insülin salımını azaltır, glukagon salımını baskılamaz. Kan glukozunu azaltan mekanizma, ayrıca gastrik boşalmada küçük bir gecikmeye de sebep olur. Açlığın azalması veenerji alımının azalmasını sağlayan mekanizma ile liraglutid vücut ağırlığını ve vücut yağkütlesini azaltır. GLP-1 iştah ve gıda alımının fizyolojik bir düzenleyicisidir, ancak etki mekanizması tümüyle netleşmiş değildir. Hayvan çalışmalarında, periferik uygulama sonrası liraglutidin iştahındüzenlendiği spesifik beyin bölgelerine alındığı gösterilmiştir. Bu beyin bölgelerinde liraglutid,GLP-1 reseptörünün (GLP-1R) spesifik aktivasyonu ile temel tokluk sinyalinde artışa, temelaçlık sinyallerinde azalmaya, böylece vücut ağırlığında azalmaya sebep olur. GLP-1 reseptörleri, kalp, damarlar, bağışıklık sistemi ve böbreklerdeki spesifik lokasyonlarda konumlanmaktadır. Aterosklerotik fare modellerinde liraglutid, aortik plak progresyonunuönlemiştir ve plaktaki enflamasyonu azaltmıştır. Ayrıca liraglutidin, plazma lipidleri üzerine defaydalı etkisi olmuştur. Liraglutid, halihazırda yerleşmiş plakların boyutunu azaltmamıştır. Farmakodinamik etkiler Liraglutid 24-saatlik etkiye sahiptir ve tip 2 diabetes mellitus'lu hastalarda açlık ve tokluk kan şekerini azaltarak glisemik kontrolü iyileştirir. Klinik etkililik ve güvenlilik Hem glisemik kontrolün iyileştirilmesi hem de kardiyovasküler morbidite ve mortalitenin azaltılması tip 2 diyabet tedavisinin bütünleyici parçalarıdır. Liraglutidin glisemik kontrol üzerindeki etkilerini değerlendirmek üzere 5 tane çift-kör, randomize, kontrollü, yetişkinlerde faz 3a klinik çalışma yürütülmüştür (Tablo 2). Liraglutidile tedavi, glikozillenmiş hemoglobin A1c (HbA1c), açlık plazma glukozu ve post-prandiyal(yemek sonrası) glukoz bakımından, plaseboyla karşılaştırıldığında, klinik olarak veistatistiksel olarak anlamlı gelişmeler sağlamıştır. Bu çalışmalarda tip 2 diabetes mellituslu 3978 hasta tedavi görmüştür (2501 hasta liraglutid ile tedavi edilmiştir), bunlardan %53,7'si erkek ve %46,3'ü kadın, 797 hasta (508'i VİCTOZA®ile tedavi edilmiş) 65 yaş ve üzerinde ve 113 hasta (66'sı VİCTOZA® ile tedavi edilmiş) 75 yaşve üzerindedir. Liraglutid ile yapılan ek çalışmalar, 1901 hasta içeren dört körlenmemiş, randomize, kontrollü klinik çalışma (çalışma başına 464, 658, 323 ve 177 hasta içeren) ve tip 2 diabetes mellitusluve orta derecede böbrek yetmezliği olan hastalarda (279 hasta) gerçekleştirilmiş bir çift-kör,randomize, kontrollü klinik çalışma olarak yürütülmüştür. Liraglutid ile ayrıca, yüksek kardiyovasküler risk altındaki tip 2 diabetes mellitus'lu 9340 hastanın katıldığı büyük bir kardiyovasküler sonuç çalışması (LEADER çalışması)gerçekleştirilmiştir. Glisemik kontrol Monoterapi 52 haftalık liraglutid monoterapi tedavisi, önceden diyet ve egzersizle ya da °ral antidiyabetik
10 monoterapisi ile maksimumun yarı dozundan daha fazla olmamak üzere tedavi edilen hastalarda 8 mg glimepirid (karşılaştırma ilacına karşı 1,2 mg için %-0,84, 1,8 mg için - %1,14 ve % -0,51) ile karşılaştırıldığında istatiksel olarak anlamlı ve sürdürebilir HbAlc düşüşüile sonuçlanmıştır.Oral antidiyabetiklerle kombinasyon 26 hafta süreyle, metformin, glimepirid veya metformin ve rosiglitazon veya SGLT2i ± metformin ile kombinasyon tedavisinde VİCTOZA®, plasebo alan hastalarlakarşılaştırıldığında, HbA^'de istatistiksel olarak anlamlı ve sürdürülebilir düşüşler sağlamıştır(Tablo 2). Tablo 2 Oral antidiyabetiklerle kombinasyon (26 hafta) ve liraglutid klinik faz 3a
İnsülin ile kombinasyon 104 haftalık bir klinik çalışmada, metformin ve insülin degludek kullanan tip 2 diyabetli hastaların %57'si HbAu <%7 hedef değerine ulaşmıştır, diğer hastalar 26 haftalık açık etiketliçalışmaya devam etmiş ve liraglutid ya da tek doz insülin aspart (en büyük öğüne) kollarınarandomize edilmişlerdir. İnsülin degludek + liraglutid kolunda hipoglisemi riskini minimumaindirmek için insülin dozu %20 azaltılmıştır. Tedaviye liraglutid eklenmesi istatistiksel olarakdaha fazla HbAu düşüşü (liraglutid için %-0,73'e karşılık, karşılaştırma için %-0,40) ve kiloazalması (-3,03'e karşılık, 0,72 kg) ile sonuçlanmıştır. Hipoglisemi atağı oranı (hasta maruziyetyılı başına) tedaviye eklenen tek doz insülin aspart ile karşılaştırıldığında liraglutid eklenenhastalarda istatistiksel olarak daha düşük bulunmuştur (1,0'e karşılık 8,15; oran: 0,13; %95GA: 0,08 - 0,21). 52 haftalık bir klinik çalışmada, 1,8 mg liraglutid ve metformin tedavisi ile glisemik hedeflere ulaşamayan hastalarda tedaviye insülin detemir eklenmesi HbAu'de %0,54 düşüş ilesonuçlanmıştır; 1,8 mg liraglutid ve metformin tedavisi alan kontrol grubunda HbAu azalması%0,20'dir. Kilo kaybı devam etmiştir. Minör hipoglisemi atağı oranında küçük bir artışolmuştur (hasta yılı başına 0,23'e karşı 0,03 olay). LEADER çalışmasında (bkz. aşağıdaki Kardiyovasküler değerlendirme başlıklı alt bölüm) 873 hasta başlangıçta ve takip eden en az 26 hafta boyunca premiks insülin (OAD'li veyaOAD'siz) tedavisi görmüştür. Başlangıçta ortalama HbA1 c%95CIolmuştur. Premiksinsülin ile kombinasyon halinde liraglutidin güvenlilik profili, premiks insülin ile kombinasyonhalinde plasebo için gözlemlenen ile genel olarak benzer durumdadır (bkz. Bölüm 4.8).Böbrek yetmezliği olan hastalarda kullanımı Tip 2 diyabeti ve orta derecede böbrek yetmezliği olan hastalarda insülin ve/veya OAD ilaçlara ek tedavi olarak liraglutid 1,8 mg'ın plasebo karşısında etkililik ve güvenliliğininkarşılaştırıldığı çift-kör çalışmada, liraglutid 26 hafta sonrasında HbAu seviyesini düşürmedeplaseboya göre üstün bulunmuştur (%-1,05'e karşı % -0,38). Liraglutid kullanarak HbAu seviyesi %7'nin altına düşen hasta sayısı, plasebo ile karşılaştırıldığında belirgin olarak fazladır (%52,8'e karşı %19,5). Her iki grupta da kiloazalması gözlenmiştir: liraglutid ile -2,4 kg'a karşı plasebo ile -1,09. İki tedavi grubununarasında karşılaştırılabilir bir hipoglisemi atağı riski bulunmaktadır. Liraglutidin güvenlilikprofili, genel olarak liraglutid ile yapılan diğer çalışmalarla benzerdir. 4 Metformin, glimepirid, metformin ve rosiglitazon veya SGLT2İ ± metformin ile kombine edilen liraglutid tedavisi, bu ajanları tek başına kullanan hastalarla karşılaştırıldığında 26haftada istatistiksel açıdan anlamlı olarak daha büyük oranda hastanın HbÂ1c<%6,5 düzeyineulaşması ile sonuçlanmıştır. Açlık plazma glukozu Liraglutid ile tek başına ve bir veya iki oral antidiyabetikle kombinasyon tedavisi açlık plazma glukozunda 13-43,5 mg/dl (0,72-2,42 mmol/l) azalma ile sonuçlanmıştır. Bu azalma, tedavininilk iki haftası içinde gözlenmiştir. Post-prandiyal glukoz Liraglutid gün boyunca alınan üç öğünde de post-prandiyal glukozu 31-49 mg/dl (1,68-2,71 mmol/l) azaltmaktadır. Beta-hücre fonksiyonu Liraglutid ile yapılan klinik çalışmalar, beta-hücre fonksiyonu için homeostaz model değerlendirmesi (HOMA-B) ve proinsülin/insülin oranı gibi ölçümlere dayanarak beta-hücrefonksiyonunun arttığını göstermektedir. Tip 2 diyabetli hasta grubunda (n=29) liraglutid ile 52haftalık tedavi sonrasında birinci ve ikinci faz insülin sekresyonunun arttığı gösterilmiştir. Vücut ağırlığı Liraglutid ile metformin, metformin ve glimepirid, metformin ve rosiglitazon veya SGLT2i ile metformin (birlikte veya değil) ile kombinasyon tedavisi, plasebo ile karşılaştırıldığında 0,86kg ila 2,62 kg aralığında kalıcı kilo azalması ile ilişkilendirilmiştir. Başlangıçta yüksek beden kitle indeksine (BKİ) sahip hastalarda daha fazla kilo azalması gözlenmiştir. Kardiyovasküler değerlendirme 3651'i liraglutid tedavisi almış 5607 hastayı kapsayan orta ve uzun dönemli faz 2 ve faz 3 çalışmalarda (26 ila 100 hafta süreli) ciddi majör kardiyovasküler olayların (kardiyovaskülerölüm, miyokard enfarktüsü, inme) post-hoc analizi sonucu, karşılaştırma ajanlarına kıyaslaliraglutid tedavisinin kardiyovasküler riskte bir artışa yol açmadığı tespit edilmiştir (insidans:0,75 (%95 GA 0,35; 1,63). Liraglutid'in Diyabetteki Etkisi ve Etkinliği - Kardiyovasküler Sonuçların Değerlendirilmesi: LEADER çalışması çok merkezli, plasebo kontrollü, çift-kör bir klinik çalışmadır. 9340 hasta, kardiyovasküler (CV) risk faktörleri ve HbA1c için standart tedaviye ek olarak liraglutid (4668)ya da plasebo (4672) koluna randomize edilmiştir. Çalışma sonunda liraglutid ve plaseboyarandomize katılımcıların sırasıyla %99,7 ve %99,6'sı için vital durum veya primer sonuçbilgisi elde edilmiştir. Gözlem süresi minimum 3,5 yıl ve maksimum 5 yıla kadardır. Çalışmapopülasyonuna >65 yaş (n=4329) ve >75 yaş (n=836) hastalar ile hafif (n=3907), orta(n=1934) ve ciddi (n=224) böbrek yetmezliği olan hastalar dahil edilmiştir. Yaş ortalaması 64olup, ortalama BKİ 32,5 kg/m2'dir. Ortalama diyabet süresi 12,8 yıldır. Primer sonlanım noktası, randomizasyondan itibaren herhangi bir majör kardiyovasküler advers olayın ((MACE): CV ölüm, ölümcül olmayan miyokard enfarktüsü veya ölümcülolmayan inme) ilk meydana geldiği zamana dek geçen süredir. Liraglutid plaseboya kıyasla
13 MACE riskini anlamlı derecede önlemiştir (Şekil 1). Tahmin edilen risk oranı 3 MACE bileşeni için de tutarlı olarak 1'in altındadır. Liraglutid aynı zamanda genişletilmiş MACE riskini (primer MACE, hastaneye yatırmaya sebep olan stabil olmayan anjina pektoris, koroner revaskülarizasyon veya kalp yetmezliğinedeniyle hastaneye yatış) ve diğer sekonder sonlanım noktalarını da anlamlı olarak azaltmıştır(Şekil 2). Şekil 1: İlk MACE'ye dek geçen sürenin Kaplan-Meier Analizi-Tam Analiz Seti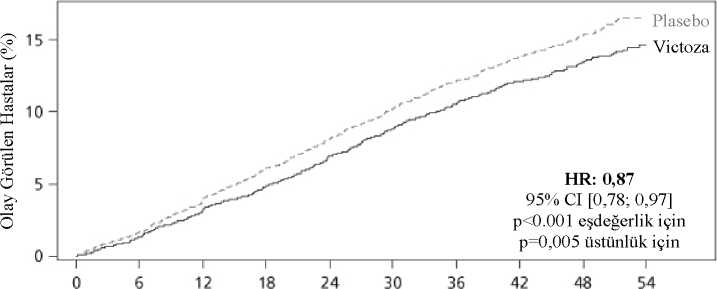 Randomizasyon zamanı (ay)Riskli HastalarPlasebo 467245874473435242374123401039141543407Victoza 466845934496440042804172407239821562424Şekil 2: Görülen Kardiyovasküler Olayların Her Biri İçin Forest Grafiği- Tam Analiz Seti
14 Standart tedaviye eklenen liraglutide karşı plasebo ile, başlangıçtan 36. aya kadar HbA icdüzeyinde anlamlı ve kalıcı azalma (%-1,16'ya karşı %-0,77; tahmini tedavi farklılığı [TTF]%-0,40 [-0,45; -0,34]) gözlenmiştir. Başlangıçta insülin tedavisi almayan hastalarda insülin iletedavinin yoğunlaştırılması ihtiyacı plaseboya karşı liraglutid ile %48 azalmıştır (HR 0,52[0,48; 0,57]). Kan basıncı ve kalp hızı Liraglutid, faz 3a çalışmaları boyunca sistolik kan basıncını başlangıca kıyasla ortalama 2,3 ila 6,7 mmHg azaltmış olup, bu azalma aktif karşılaştırma ilacına kıyasla ortalama 1,9 ila 4,5mmHg olmuştur. Liraglutid ile, LEADER dahil uzun dönem klinik çalışmalarında nabızda, başlangıçtan itibaren dakikada ortalama 2 ila 3 atım artış gözlenmiştir. LEADER çalışmasında nabız artışınınkardiyovasküler olay riski üzerine uzun dönemde klinik etkisi gözlenmemiştir. Mikrovasküler değerlendirme LEADER çalışmasında mikrovasküler olaylar nefropati ve retinopati sonuçlarını kapsar. Liraglutide karşı plasebo için ilk mikrovasküler olaya kadar olan zamanın analizinde HR 0,84[0,73, 0,97] olarak hesaplanmıştır. Liraglutide karşı plasebo için HR, ilk nefropati olay zamanıiçin 0,78 [0,67, 0,92] ve ilk retinopati olay zamanı için 1,15 [0,87, 1,52]'dir. İmmunojenisite Protein veya peptid içeren tıbbi ürünlerin potansiyel immunojenik özellikleriyle tutarlı olarak, hastalar liraglutid tedavisini takiben anti-liraglutid antikorları geliştirebilir. Ortalama olarak,hastaların %8,6'sı antikor üretmiştir. Antikor oluşumu ile liraglutid etkinliğinin azalmasıilişkilendirilmemiştir. Pediyatrik popülasyon Tip 2 diyabetli 10 yaş ve üzeri çocuk ve adölesanlarda metformin ± insulin üzerine eklenen, plaseboya karşı VİCTOZA ®®®ile sürdürülebilir glisemik kontrolüdoğrulamıştır. |
İlaç BilgileriVictoza 6 Mg/ml Enjeksiyonluk Çözelti İçeren Kullanıma Hazır KalemEtken Maddesi: Liraglutid Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.