Tegeline 5 G/100ml Iv İnfüzyon İçin Liyofilize Toz İçeren Flakon Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ¡Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERİ TIBBİ ÜRÜNÜN ADITEGELINE 5 g/100 mL I.V. infüzyon için liyofilize toz içeren flakon Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMToz içeren her flakonda: Etkin madde:100 mL'de 5 g normal insan immunoglobulini* * Toz, maksimum 17 mg/g proteinlik IgA ve az miktarda hayvan kaynaklı pepsin (domuzbağırsağı mukozasından elde edilmiş pepsin) içerir. Ig G seviyesi en az %95'tir. İmmunoglobulin G'nin alt gruplarına göre dağılımı şöyledir: Ig G1 : % 50 - 68, Ig G2 : % 27 - 43, Ig G3 : % 2.6 - 4.2, Ig G4 : % 1.7 - 3.3 Yardımcı maddeler:Sodyum klorür 0,2 g Sukroz10 g Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMIV infüzyon çözeltisi hazırlamak için liyofilize toz ve çözücü Çözelti berrak ya da hafif opaktır. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlar1. İmmün yetmezlik durumlarında replasman tedavisi için; a) Antikor üretiminin bozulduğu primer (konjenital) immün yetmezliklerde, b) Şiddetli veya tekrarlayan enfeksiyonlar gelişen, antimikrobiyal tedavinin yetersizkaldığı ve kanıtlanmış spesifik antikor yetmezliği (SAE)* olan ya da serum IgG düzeyi<4 g/L olan hastalarda sekonder immün yetmezliklerde (SİY) kullanılır. * Kanıtlanmış SAE: lgG antikor titresinde pnömokokal polisakkarit ve polipeptit antijenaşılarına en az 2 kat artış sağlanamaması 2. İmmünomodülatör etki için; a) Kanama riski yüksek olan veya cerrahi müdahale öncesi trombosit sayısının yükseltilmesigereken immün trombositopeni (İTP) olgularında, b) Guillain- Barre sendromunda,
1/14 c) Kawasaki hastalığında, d) Multifokal Motor Nöropati (MMN) hastalığında, e) Kronik İnflamatuvar Demiyelinizan Polinöropatinin akut tedavisinde (KIDP) f) Bulber tutulumu olan Myastenia Gravis tedavisinde uygulanır. 4.2. Pozoloji ve uygulama şekliPozoloji ve uygulama şekli:Replasman tedavisi immün yetmezlikler konusunda deneyimli bir uzman hekimin denetiminde başlatılmalı ve izlenmelidir. Pozoloji ve uygulama sıklığı ve süresi:Pozoloji ve uygulama sıklığı endikasyona göre değişir. Replasman tedavisinde hastanın farmakokinetik ve klinik yanıta bağlı olarak dozun bireysel şekilde ayarlanması gerekebilir. Primer immün yetmezliklerde replasman tedavisiDoz, bir sonraki infüzyondan önce ölçülen serum IgG düzeyinin en az 500 - 600 mg/dL düzeyinde kararlı olarak sürdürülmesini sağlayacak şekilde ayarlanmalıdır. Bu dengeninsağlanabilmesi için tedavinin başlangıcından itibaren 3 - 6 ay gereklidir. Önerilen başlangıç dozu bir seferde verilen 0,4 - 0,8 g/kg infüzyonu takiben her 3 - 4 haftada bir uygulanan 0,2 g/kg'dır. Serum immünoglobulin düzeyinin 500 - 600 mg/dL olacak şekilde sabit tutulabilmesi için gereken doz ortalama 0,2 - 0,8 g/kg düzeyindedir. Kararlı serum düzeyi sağlandıktan sonra doz aralığı 3 ile 4 hafta arasında değişir. Hastanın klinik yanıtı ile birlikte kararlı serum düzeyleri ölçülmeli ve değerlendirilmelidir. Klinik yanıta bağlı olarak (ör. enfeksiyon sıklığı) daha yüksek kararlı serum düzeylerinin sağlanması amacıyla doz ve/veya doz aralığının ayarlanması düşünülebilir. Sekonder immün yetmezlikte replasman tedavisi:Sekonder immün yetmezlikte replasman tedavisinde tavsiye edilen doz 3-4 haftada bir uygulanan 0,2-0,4 g/kg'dır. Primer immün trombositopeniİki alternatif doz şeması vardır. Birinci gün 0,8-1 g/kg dozunda uygulanır; doz, 3 gün içerisinde bir kez tekrarlanabilirveya 2-5 gün süreyle 0,4 g/kg/gün dozunda uygulanır. Relaps olduğunda tedavi tekrarlanabilir. Guillain Barre Sendromu5 gün süreyle 0,4 g/kg/gün dozunda uygulanır.
2/14 Kawasaki hastalığı8-12 saat süreyle tek doz olarak uygulanan 2 g/kg'dır ve asetil salisilik asit ile kombine olarak verilir Multifokal Motor Nöropati (MMN) hastalığıBaşlangıç dozu: 2-5 gün süreyle bölünmüş dozlarda toplam 2g/kg İdame dozu: 2-6 haftada bir 1-2 g/kg Kronik inflamatuvar demiyelinizan polinöropati (KIDP)Önerilen başlangıç dozu: 2-5 Ardışık günde bölünmüş dozlarda toplam 2 g/kg'dır. Yanıt alınamaması durumunda 3 haftada bir 1 g/kg total doz 1-2 günde verilir ve 2 ay sonunda yanıtalınamazsa tedavi kesilir. İdame dozu: Başlangıç tedavisine yanıt alınmışsa 3 haftada bir 0,4-1 g/kg total doz 1-2 günde uygulanır. Maksimum yarar elde edilen doz önerilir ve doz doktor tarafından belirlenir. Endüşük etkin idame dozu belirlenene kadar doz azaltılır ve uygulama sıklığı ayarlanır. Myastenia GravisDiğer özel tedavilere cevap vermeyen kritik fazda 5 gün süreyle 0,4 g/kg/gün dozunda uygulanır. Pediyatrik popülasyonÇocuklar ve adölesanlardaki (0-18 yaş) pozoloji her bir endikasyon için erişkinlerden farklı değildir ve yukarıda belirtilen durumlardaki klinik sonlanımlara göre ayarlanır. Uygulama şekli:İntravenöz yoldan uygulanır. Azami infüzyon hızı her bir ürün için klinik çalışma protokollerine göre belirlenmelidir. Özel popülasyonlara ilişkin ek bilgilerBöbrek/Karaciğer yetmezliği:IVIg tedavisi uygulanan hastalarda akut böbrek yetmezliği vakaları rapor edilmiştir. Böbrek yetmezliği riski bulunan hastalarda, IVIg preperatlarıuygulanabilir en düşük infüzyon hızında ve dozda kullanılmalıdır (Bkz. Bölüm 4.4).Karaciğer yetmezliği olan hastalarla ilişkin ek bir bilgi bulunmamaktadır. Pediyatrik popülasyon:Yukarıda bahsedilen her durumda pozoloji vücut ağırlığına göre ve klinikte alınan yanıta göre verildiğinde, çocuklarda ve adölasanlarda (0-18 yaş) pozolojideğişmez.Geriyatrik popülasyon:IVIg tedavisi uygulanan hastalarda akut böbrek yetmezliği vakaları bildirilmiştir. Bu vakaların çoğunda, kişinin 65 yaşın üzerinde olması dahil belirli riskfaktörlerinin olduğu bildirilmiştir.Ayrıca IVIg uygulaması ile yüksek riskli hastalarda tromboembolik olaylar arasında bağlantıyı gösteren klinik kanıtlar mevcuttur. Bu nedenle ileri yaş dahil trombotik olayaçısından risk faktörlerini taşıyan hastalarda IVIg reçetelenip infüzyonu uygulanırken dikkatli 3/14 hareket edilmeli, uygulanabilir en düşük infüzyon hızında ve dozda kullanılmalıdır (Bkz. Bölüm 4.4). 4.3. Kontrendikasyonlar Özellikle Ig A eksikliği olan kişiler arasında insan immunoglobulinlerine aşırı duyarlığıolanlar ve anti-Ig A antikoru geliştiren, TEGELINE'in bileşimindeki etkin madde ve yardımcı maddelere karşı aşırı duyarlığı olankişilerde kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriVirüs güvenliğiTEGELINE, insan plazmasından elde edilmektedir. İnsan plazmasından elde edilen ilaçlar, virüsler ve teorik olarak Varyant Creutzfeldt-Jacob (v-CJD) gibi çeşitlihastalıklara yol açabilen enfeksiyon yapıcı ajanlar içerebilirler. TEGELINE'deVaryant Creutzfeldt-Jacob hastalığının bulaşma riski teorik olarak minimumken,klasik Creutzfeldt-Jacob hastalığının bulaşma riski hiçbir kanıtla desteklenmez.Alınan önlemlere rağmen, bu tür ürünler halen potansiyel olarak hastalıkbulaştırabilir.Bu tip ürünlerin enfeksiyon yapıcı ajanları bulaştırma riski, plazma verenlerin belirli virüslere önceden maruz kalıp kalmadığının izlenmesi, belirli virüs enfeksiyonlarınınhalihazırda varlığının test edilmesi ve belirli virüslerin yok edilmesi ve/veyainaktivasyonu ile azaltılmıştır. Bütün bu önlemlere rağmen, bu ürünler halapotansiyel olarak hastalık bulaştırabilirler. Ayrıca, henüz bilinmeyen enfeksiyonyapıcı ajanların bu ürünlerin içerisinde bulunma ihtimali mevcuttur.HIV, HBV, HCV gibi zarflı virüsler ve HAV gibi zarflı olmayan virüslerin etkisi için önlemlerin alınmasına dikkat edilmelidir. Parvovirüs B19 gibi zarflı olmayanvirüslere karşı alınan tedbirler sınırlı sayıda olabilir. Parvovirüs B19 enfeksiyonu,gebelikte (fetal enfeksiyon) ve immün yetmezlik ya da kırmızı kan hücre üretimindeartış olan hastalarda tehlikeli olabilir (hemolitik anemi gibi).Doktor, bu ilacı hastaya reçete etmeden veya uygulamadan önce hastası ile risk veyararlarını tartışmalıdır.Ayrıca; TEGELINE kullanılması gerekiyorsa hekim tarafından, hastalık yapıcı etkenlerin hastaya bulaşmasını önlemek için uygun asıların (Hepatit A, Hepatit B vb.) yaptırılması önerilebilir. Hastalar açısından TEGELINE her uygulandığında, hastayla ürünün seri numarası arasındaki bağlantının korunabilmesi için, ürünün adı ve seri numarası kaydedilmelidir. Multifokal motor nöropati (MMN) ile kronik inflamatuvar demiyelinizan poliradikülonöropati (KIDP) teşhisleri ilgili uzman hekim tarafından konulmalı ve TEGELINE ile tedaviye ilgiliuzman hekimin tavsiyesi üzerine başlanmalıdır. Tedavi başladıktan sonra myastenia gravis'in akut alevlenmelerinin tedavisi için periferal nöropatiler veya nöromusküler hastalıklar konusunda uzman bir doktorun yer aldığı onaylı birmerkeze danışılmalıdır.
4/14 İstenmeyen etkiler, infüzyon hızına bağlı olabilir. 4.2 Pozoloji ve uygulama şekli bölümünde verilen sürelere mutlaka uymak gereklidir. Ayrıca, infüzyon sırasında hastaistenmeyen etkiler açısından yakından izlenmelidir. Anafilaktik reaksiyonlar veya hatta şok aşağıdaki durumlarda daha sık oluşabilir: Hızlı intravenöz infüzyon (Bkz. Bölüm 4.2) IgA yetmezliği olan ya da olmayan hipogammaglobulinemi ya da agamaglobulinemi Özellikle ilk kez normal insan immunoglobulini uygulaması yapılacak hastalar ya da enson uygulamadan sonra 8 hafta geçmişse. Potansiyel komplikasyonları aşağıdaki önlemlere dikkat ederek, sıklıkla önlemek mümkündür: - İnfüzyon hızının dikkatle izlenmesi, -Yavaş infüzyon (1mL/kg/saat) yoluyla başlangıç IVIg dozu toleransının kontrolü. - Geçici glukozüri gelişebilen latent diabetes mellitus, diabetes mellitus ya da düşük şekerlidiyette sükroz miktarının (2 g/g Ig G ) hesaba katılması. - Potansiyel intolerans etkilerine karşı infüzyon boyunca hastanın dikkatlice izlenmesi..Hastalar infüzyon sonrası en az 20 dakika, ilk IVIg infüzyonu alan veya son infüzyondan buyana uzun bir süre olması durumunda, hastalar infüzyondan sonra en az 1 saat gözlem altındatutulmalı. - Allerjik veya anafilaktik reaksiyon gelişirse infüzyon hemen durdurulmalıdır. Gerekli tedavibu reaksiyonun niteliğine ve şiddetine bağlıdır. Şok durumunda semptomatik tedavibaşlanmalıdır. Tüm hastalarda, IVIg uygulanması için şunlar gereklidir: - TEGELINE infüzyonunun başlangıcından önce yeterli hidratasyon sağlamak, - Tedavi dönemi boyunca günlük idrar miktarının izlenmesi, - Tedaviye başlamadan ve tedavi dönemi boyunca serum kreatinin ve üre seviyelerininölçülmesi, - Kıvrım diüretikleri veya nefrotoksik ilaçlar ile beraber kullanımının engellenmesi (Bkz.Bölüm 4.5). HipersensitiviteGerçek aşırı duyarlılık reaksiyonları seyrektir. Anti-IgA antikoru olan IgA yetmezlikli vakalarda immünoglobulin intoleransı gelişebilir. IgA eksikliğinin tedavi edilecek tek fonksiyon bozukluğu olduğu seçici IgA eksikliği olan hastalarda IVIg endike değildir. Seyrek olarak normal insan immunoglobulini, daha önce insan immunoglobulin tedavisi uygulanmış ve tedaviyi tolere edebilmiş hastalarda bile anafilaktik reaksiyonla birlikte kanbasıncında ani düşmeye neden olabilmektedir. TrombolizmIVIg uygulaması ile miyokard enfarktüsü, serebrovasküler olay, pulmoner emboli ve derin . t , Bu b£İgek,.güvenli elektroniksiniz a ile imzalanmıştır.^ ... ........Bdge DoveRmtrembozu5gi^y^rftmbofmbolik3£saks^onlar arasta ^ağJ^Eıy^wgö§1t§fen^lınik-^ân^ar 5/14 mevcuttur. Bu olayların, risk altındaki hastalarda yüksek immünoglobulin akışı yoluyla kan viskozitesinde göreceli bir artışla ilişkili olduğu varsayılmaktadır. Obez hastalarda vetrombotik olaylar açısından risk faktörlerini taşıyan hastalarda (ileri yaş, hipertansiyon,diabetes mellitus ve vasküler hastalık ya da trombotik atak öyküsü olan hastalar, edinsel ya dakalıtsal trombotik bozukluğu olan hastalar, uzun sürelerle immobilize olan hastalar, ağırhipovolemisi bulunan hastalar ve kan viskozitesinin artmış olduğu hastalıkları olanlar gibi)IVIg reçetelenip infüzyonu uygulanırken dikkatli hareket edilmelidir. Trombolitik reaksiyon riski olan hastalarda, IVIg minimum doz ve infüzyon hızı ile uygulanmalıdır. Akut böbrek yetmezliğiIVIg tedavisi alan hastalarda akut böbrek yetmezliği vakaları rapor edilmiştir. Birçok vakada, daha önceden var olan böbrek yetmezliği, diyabet, hipovolemi, obezite, nefrotoksik ilaçlarınbirlikte kullanımı veya 65 yaş üzerindeki hastalar gibi risk faktörleri belirlenmiştir. Böbrek yetmezliği risk faktörü olan hastalarda, TEGELINE'in en düşük etkili dozu minimum infüzyon hızında uygulanmalıdır. Klinik endikasyona bağlı olarak, özellikle en yüksek dozkullanılan endikasyonlarda, TEGELINE bölünmüş dozlar şeklinde verilebilir ve tedavidönemleri arasındaki zamanın artırılması göz önüne alınmalıdır. Böbrek yetmezliği durumlarında TEGELINE kullanımının durdurulması dikkate alınmalıdır. Böbrek fonksiyon bozukluğu ya da akut böbrek yetmezliğinin sukroz, glukoz ve maltoz gibi farklı yardımcı maddeler içeren değişik IVIg preparatlarının kullanımıyla ilişkili olabileceğibildirilmiş olmasına rağmen, olguların çoğundan, stabilizatör olarak sukroz içeren preparatlarsorumlu tutulmaktadır. Risk altındaki hastalarda, sukroz içermeyen preparatların kullanımıdüşünülmelidir. TEGELINE mL'de 0,1 g sukroz içermektedir. Aseptik menenjit sendromu (AMS) IVIg tedavisine bağlı oluşan aseptik menenjit sendromu rapor edilmiştir. IVIg tedavisinin kesilmesi ile AMS herhangi bir sekel oluşmadan birkaç günde gerilemiştir. Sendrom genellikle IVIg tedavisini takiben bir kaç saat ila 2 gün içinde başlar. Serebrospinal sıvı incelemeleri sıklıkla, özellikle granülositik seride olmak üzere mm3'de bir kaç binhücreye kadar pleositoz ile bir kaç yüz mg/dL'ye kadar protein yükselmesi şeklinde pozitifbulunur. Yüksek dozda (2g / kg) IVIg tedavisi ile ilişkili olarak AMS daha sık görülebilir Hemolitik anemi IVIg ürünleri, hemolizinler olarak davranabilen ve kırmızı kan hücrelerinin immünoglobulin ile in vivo olarak kaplanmasına yol açabilen ve pozitif direkt antoglobulin reaksiyonuna(Coombs testi) ve nadiren hemolize neden olan kan grubu antikorları içerebilir. Gelişmişkırmızı kan hücreleri (RBC) sekestrasyonuna bağlı olarak IVIg tedavisinden sonra hemolitikanemi gelişebilir. IVIg kullanan hastalar klinik olarak ve hemoliz semptomları açısındanizlenmelidir (Bkz. Bölüm 4.4.). Nötropeni /Lökopeni IVIg'ler ile tedavi edildikten sonra nötrofil sayısında ciddi bir düşüş ve / veya bazen ciddi nötropeni atakları bildirilmiştir. Bu tipik olarak IVIg uygulamasından saatler veya günlersonra ortaya çıkar ve 7 ila 14 gün içinde kendiliğinden düzelir
Serolojik testler ile etkileşimİmmunoglobulin enjeksiyonundan sonra hastanın kanına pasif olarak transfer edilmiş antikorların hastanın kanında geçici olarak yükselmesi, serolojik testlerde yanıltıcı pozitifsonuçlara neden olabilir. Bu ürünün anti-eritrosit antikorlar içermesi nedeniyle antiglobulin (Coombs) testi, uygulama sonrasında geçici olarak pozitif sonuç verebilir. Bu tıbbi ürün 100 mL'de 10 g sukroz içerir. Bu durum diyabet hastalarında göz önünde bulundurulmalıdır. TEGELINE 10 mL'de 8 mg sodyum içerir (100 mL=80 mg). Kontrollü sodyum diyetinde olan hastalarda bu durum dikkate alınmalıdır. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri Nefrotoksik ilaçlar ile birlikte kullanımı:Renal toksisite yapan ilaçlar ile birlikte kullanımı akut böbrek yetmezliği riskini artırır. Eğer IVIg tedavisi sırasında bu tür bir kombinasyon gerekliyse, dozun bölünmesi ve minimuminfüzyon akış hızının uygulanması dikkate alınmalı ve yeterli hidrasyon ve böbrekparametrelerinin biyolojik olarak izlendiğinden emin olunmalıdır. Nefrotoksik potansiyeli olan ilaçlar iyodinli kontrast ajanlar, nonsteroid anti-enflamatuvar ilaçlar, aminoglikozidler, organik-platin bileşikler, yüksek doz metotreksat, siklosporin,takrolimus, pentamidin gibi çeşitli antiparazitler veya foskarnet sodyum gibi çeşitliantiviraller (siklovirler) şeklinde sunulmaktadır. Kıvrım diüretikleri ile kombinasyonda, özellikle enzim-dönüştürücü inhibitör, anjiyotensin II reseptör blokerleri veya direkt renin inhibitör ile birlikte tedavi başlangıcında veyapozolojisinin artırılmasında akut böbrek yetmezliği riski artmaktadır (Bkz. Bölüm 4.4). Canlı virüs aşıları ile etkileşim: IVIg uygulaması, kızamık, kızamıkçık, kabakulak ve su çiçeği gibi canlı virüs aşılarının etkinliğini, en az 6 haftadan en çok 3 aya kadar bozabilir. Bu tip aşıların uygulanabilmesi içinIVIg infüzyonundan sonra 3 aylık bir süre geçmelidir. Kızamık hastalarında bu durum 1 yılakadar sürebilir. Eğer hasta infüzyondan önceki 2 hafta içinde bu aşılardan birini olmuşsa, aşı tekrarı gerekip gerekmediğini tayin etmek için aşı sonrası koruyucu antikor düzeyinin kontrolü gerekebilir. Özel popülasyonlara ilişkin ek bilgilerPediyatrik popülasyon4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)Bilinen bir olumsuz etkisi bulunmamaktadır.
7/14 Gebelik dönemiTEGELINE'in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik/ve-veya/embriyonal/fetal gelişim/ve-veya/doğum/ve-veya/doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir. TEGELINE gerekli olmadıkça gebe kadınlarda kullanılmamalıdır. Laktasyon dönemiTEGELINE'in hamilelerde güvenli kullanımı kontrollü klinik çalışmalarla değerlendirilmemiştir. Bu nedenle emziren annelerde dikkatli kullanılmalıdır.İmmünoglobulinler anne sütü ile atılmaktadır (süte geçmektedir). Ancak immünoglobulinlerinemzirilen çocuk üzerinde herhangi bir olumsuz etkisi öngörülmemektedir. Üreme yeteneği /FertiliteHayvan üreme çalışmaları yürütülmemiştir. Hamile kadına verildiğinde fetal hasara neden olup olmadığı ve üreme kapasitesini etkileyip etkilemediği bilinmemektedir. 4.7. Araç ve makine kullanımı üzerindeki etkilerIVIg' nin araç veya diğer makinelerin kullanılması üzerine gözlenen herhangi bir etkisi bulunmamaktadır. 4.8. İstenmeyen etkilerİnsan normal immunoglobulininin intravenöz uygulamasında aşağıdaki yan etkiler bildirilmiştir: Güvenlik profili özeti İnsan normal immünoglobülinleri intravenöz olarak uygulandığında, titreme, baş ağrısı, baş dönmesi hissi, ateş, kusma, alerjik reaksiyonlar, mide bulantısı, artralji, kan basıncındaazalma ve orta şiddette bel ağrısı gibi duyarlılık/hassasiyet reaksiyonları bazen ortayaçıkabilir. Seyrek olarak, insan normal immünoglobulinleri, hasta daha önceki uygulamasırasında aşırı duyarlılık reaksiyonu göstermemiş olsa bile, kan basıncında ani düşüş ve izoleolaylarda anafilaktik şoka neden olabilir. İnsan normal immünoglobulinleri ile geri dönüşümlü aseptik menenjit vakaları ve nadir görülen geçici kutanöz reaksiyonlar (bilinmeyen sıklıkta kutanöz lupus eritematozus içeren)gözlenmiştir. Özellikle A, B ve AB kan grubuna sahip bazı hastalarda geri dönüşümlühemolitik reaksiyonlar gözlenmiştir. Seyrek olarak, yüksek doz IVIg tedavisinden sonratransfüzyon gerektiren hemolitik anemi gelişebilir (bkz. bölüm 4.4.). Serum kreatinin seviyelerinde artış ve/veya akut böbrek yetmezliği vakaları gözlenmiştir Çok seyrek olarak, miyokard infarktüsü, inme, pulmoner emboli, derin ven trombozu gibi tromboembolik olayları gözlenmiştir. Bulaşıcı ajanlar açısından güvenlikle ilgili olarak 4.4 Özel kullanım uyarıları ve önlemleri bölümüne bakınız. Bu belgeİstenmeyen etkiler tablosu 8/14 Aşağıdaki tablo MedDRA sistem organı sınıfını ifade eder. Bu tablo, 533 hastanın TEGELINE'e maruz kaldığı 8 klinikte gözlenen advers ilaç reaksiyonlarını ve pazarlamasonrası gözlemlenen tespitleri göstermektedir Şu terimler ve sıklık dereceleri kullanılmıştır: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila <1/100), seyrek (>1/10.000 ila <1/1.000); çok seyrek(<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Pazarlama sonrası gözlemlenen advers ilaç reaksiyonlarının sıklıkları hesaplanamaz ve sıklıkları bilinmiyor olarak rapor edilmiştir.
9/14
Böbrek yetmezliğiÖzellikle yüksek dozda TEGELINE alan hastalarda serum kreatinin seviyelerinde artış ve/veya akut tübüler nekroz ile birlikte akut böbrek yetmezliği vakaları rapor edilmiştir.Birçok vakada daha önce böbrek yetmezliği, diabetes mellitus, hipovolemi, aşırı kilo, arteriyelhipertansiyon, nefrotoksik ilaçlar ile birlikte uygulama veya 65 yaş üstü hastalar riskfaktörleri olarak belirlenmiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye
10/14 Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr4.9. Doz aşımı ve tedavisiTEGELINE için bildirilmiş aşırı doz durumu olmamasına rağmen, doza bağlı bazı yan etkiler (istenmeyen etkiler bölümüne bakınız) olabilir: beyin zarı iltihabı (aseptik menenjit), böbrekyetmezliği, kanda viskozite artışı. 5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: İmmun Sera ve İmmunoglobulinler: İmmunoglobulin, normal insan, intravenöz uygulama için ATC kodu: J06BA02 Etki mekanizması: TEGELINE tüm immunoglobulin G (Ig G) tiplerini içermektedir. En az 1000 donörden alınan insan plazma havuzundan hazırlanır. Bu preparat ile uygun dozlarda yapılan tedavi, anormalderecede düşük immunoglobulin G seviyelerini normal değerlere yükseltebilir. Bu preparat, enfeksiyon ajanlarına karşı geniş bir antikor spektrumuna sahiptir. İmmunoglobulinlerin biyolojik fonksiyonlarının değişmediği Fc fonksiyon testi ile doğrulanmıştır. İmmunoglobulinlerin immunomodülatör şeklinde tanımlanan etki mekanizması hümoral ve hücresel bağışıklığı içeren multifaktöryel bir mekanizmadır. 5.2.Farmakokinetik özellikler Genel özelliklerEmilim:İntravenöz uygulamadan sonra Ig IV hemen ve tümüyle kana geçer. Dağılım:Ig IV plazma, damar dışı sıvı, ayrıca damar içi ve dışı kompartmanlarda hızla dağılır ve 3 -5 gün içinde denge durumuna geçer. Biyotransformasyon:İmmunoglobulinler ve immunoglobulin kompleksler retiküloendoteliyal sistemin hücrelerinde yıkılırlar. Eliminasyon:TEGELINE'in primer immun yetmezliği olan hastalarda hesaplanan yarı ömrü 36,4±16,5 gündür. Ig IV nin yarı ömrü hastanın immün durumuna göre değişir. Doğrusallık /Doğrusal Olmayan DurumDoğrusallık ve doğrusal olmayan durum ile ilgili yeterli veri mevcut değildir.
11/14 5.3.Klinik öncesi güvenlilik verileriKlinik öncesi güvenlilik verileri, TEGELINE'in hiçbir mutajenik potansiyeli olmadığını doğrulamaktadır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSodyum klorür Sukroz Enjeksiyonluk su 6.2. GeçimsizliklerNormal insan immunoglobulini başka ilaçlarla karıştırılmamalıdır. 6.3. Raf ömrü36 ay İlaç hazırlandıktan sonra hemen kullanılmalıdır (çözelti hazırlandıktan sonra 24 saatlik süre içinde uygulanabilir). 6.4. Saklamaya yönelik özel tedbirlerAşırı ışıktan korunarak 25°C'nin altında saklanır. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız. 6.5. Ambalajın niteliği ve içeriği1 flakon (cam) toz + holobutil kauçuk tıpa ile kapatılmış flakon (cam) da 100 mL çözücü, dışında sterilizasyon filtresi tutturulmuş bir transfer sistemi ve filtre - iğne (10 mL) veyafiltre (100 mL) eklenmiş infüzyon kiti. 6.6. Beşeri Tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanma TalimatıPreparatın Hazırlanması:TEGELINE, kullanım öncesinde enjeksiyonluk su ile hazırlanacak olan toz formundadır. Aseptik prosedür kuralları altında kullanınız.Eğer ambalaj bozulmuş ya da koruyucu kapaklar yerlerinde değilse sağlanan aksesuarları kullanmayınız. Her iki flakonu da (toz ve çözücü) oda sıcaklığına gelmesi için bekletiniz.
12/14 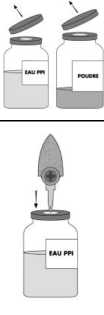 Çözücü ve toz flakonunun koruyucu kapaklarını çıkartınız. Kauçuk tıpaların yüzeyini alkollü bir pamukla silerek dezenfekteediniz. Transfer sisteminin buzlu cam görünümlü koruyucu başlığını çıkartıp, çözücü flakonunun tıpasından içeri döndürerek batırınız. Transfer sisteminin diğer ucundaki ikinci koruyucu kapağı daçıkartınız. İki flakonu da yatay konuma getiriniz ve iğnenin serbest ucunutoz flakonunun kapağının ortasına hızla batırınız. Çözücüflakonunun içindeki iğnenin sürekli çözücü içinde kalmasınadikkat ediniz.   Transfer iğnesi takılı durumda iken, her iki flakonu da dikeykonuma getiriniz. Çözücü toza gidecek şekilde, çözücü flakonutoz flakonunun üstünde olmalıdır. Transfer sırasında çözücü toz yüzeyinin her yanınapüskürtülmelidir. Çözücünün tamamının gitmiş olduğundan eminolun. Boş flakonu (çözücü) ve transfer sistemini çıkartınız. Toz tamamen çözünene kadar ve köpürtmeden flakonu hafifçedöndürerek sallayınız.  Toz 30 dakikadan kısa bir sürede tamamen çözünmelidir. Hazırlanan ürün çıplak gözle incelenerek partikül içerip içermediği kontrol edilir. Bu şekilde hazırlanan çözelti berrak ya da hafif opaktır. Bulanık veya çökeltisi olan çözeltiler kullanılmaz. Uygulama:100 mL için: *Hazırlanan çözeltiyi içeren şişeye, kutuda bulunan 15 gm'lik non sterilizan filtreli uygulama seti bağlanır. *İnfüzyon oranı ilk yarım saat için 1 mL/kg/saat' i aşmayacak şekilde hastanın klinik toleransına göre ayarlanır, daha sonra kademeli olarak 4mL/kg/saat' i aşmayacak şekildeartırılır. *TEGELINE hazırlandıktan hemen sonra intravenöz olarak tek doz halinde uygulanmalıdır. 13/14 Arta kalan hazırlanmış çözelti atılmalıdır. Kullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİEr-Kim İlaç Sanayi ve Ticaret A.Ş. Zorlu Center, Levazım Mah. Koru Sk. No:2 D-Blok 342-345 34340, Beşiktaş-İstanbul Tel: (0212) 275 39 69 Faks: (0212) 211 29 77 e-mail: [email protected] 8. RUHSAT NUMARASI110 9. İLK RUHSAT TARİHİ/ RUHSAT YENİLEME TARİHİ06.08.2013 / 26.12.2018 10. KÜB'ÜN YENİLENME TARİHİ
14/14 |
İlaç BilgileriTegeline 5 G/100ml Iv İnfüzyon İçin Liyofilize Toz İçeren FlakonEtken Maddesi: İnsan İmmunoglobulini Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.