|
|
KISA ÜRÜN BİLGİSİ
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
WELM 500 mg İnfüzyonluk Çözelti Hazırlamada Kullanılacak Konsantre İçin Toz Steril, sitotoksik
2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:
Her bir 50 ml'lik flakon 500 mg pemetrekset'e eşdeğer miktarda pemetrekset disodyum hemipentahidrat içerir.
Sulandırıldıktan sonra (bkz. bölüm 6.6.) her bir 50 ml'lik flakon 25 mg/ml pemetrekset içerir. Yardımcı maddeler:
Sodyum hidroksit k.m (pH ayarı için)
Yardımcı maddeler için 6.1.'e bakınız.
3. FARMASÖTİK FORM
İnfüzyon çözeltisi için toz
Beyaz-açık sarı ya da yeşilimsi liyofilize toz kek.
Sulandırmanın ardından oluşan çözelti su gibi berraktır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Malign plevral mezotelyoma
WELM, daha önce kemoterapi almamış, rezeke edilemeyen malign plevral mezotelyoması olan hastaların tedavisinde platin ile kombine olarak endikedir.
Non-skuamöz küçük hücreli dışı akciğer kanseri (KHDAK)
WELM lokal ileri hastalık ya da metastatik evredeki küçük hücreli dışı akciğer kanserli hastaların, sadece non-skuamöz histolojik alt gruplarında olanlarında sisplatinle kombineolarak başlangıç tedavisinde endikedir (Bkz. Bölüm 5.1.).
WELM, birinci seri platin bazlı kemoterapiden sonra hastalığı progrese olmamış relaps veya metastatik küçük hücreli dışı akciğer kanserinin sadece non-skuamöz histolojik alt tiplerindeidame tedavisinde tek başına endikedir (Bkz. Bölüm 5.1.).
WELM, daha önce pemetrekset bazlı tedavi kullanmamış relaps veya metastatik non-skuamöz küçük hücreli dışı akciğer kanseri hastalarının ikinci basamak tedavisinde endikedir (Bkz.Bölüm 5.1.).
Belge Do 14.2.Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresi:
WELM sadece, antikanser kemoterapi uygulamasında deneyimli bir hekimin gözetimi altında uygulanmalıdır.
WELM sisplatinle kombine olarak:
Önerilen WELM dozu, her 21 günlük kürün ilk gününde 10 dakikalık intravenöz infüzyon şeklinde uygulanmak üzere, 500 mg/m2 (vücut yüzey alanı "VYA" nın metre karesi başına 500mg)'dır. Önerilen sisplatin dozu, her 21 günlük kürün ilk gününde pemetrekset infüzyonununtamamlanmasından yaklaşık 30 dakika sonra, iki saatlik bir süreyle infüzyon ile uygulanmaküzere, 75 mg/m2'dir. Hastalara sisplatin verilmeden önce ve/veya sonra yeterli antiemetiktedavi ve uygun hidrasyon uygulanmalıdır(özel dozlama için ayrıca sisplatin Kısa ÜrünBilgisi'ne bakınız).
WELM tek ajan olarak:
Önceden kemoterapi almış non-skuamöz küçük hücreli dışı akciğer kanseri için tedavi edilen hastalarda, önerilen WELM dozu her 21 günlük kürün ilk gününde 10 dakikalık intravenözinfüzyon şeklinde uygulanmak üzere 500 mg/m2'dir.
Premedikasyon rejimi:
Cilt reaksiyonlarının sıklık ve şiddetini azaltmak için, pemetrekset uygulamasından 1 gün önce, uygulama gününde ve uygulamadan sonraki günde kortikosteroid verilmelidir. Verilenkortikosteroid oral olarak günde iki kez uygulanan 4 mg deksametazona eşdeğer olmalıdır (Bkz.Bölüm 4.4.).
Toksisiteyi azaltmak için pemetrekset ile tedavi edilen hastalara vitamin desteği de verilmelidir (bkz. Bölüm 4.4). Hastalar günlük olarak, oral folik asit veya folik asit içeren (350-1000mikrogram) multivitamin kullanmalıdırlar. İlk pemetrekset dozundan önceki 7 günde en az 5doz folik asit alınmalı ve bu doz uygulaması tüm tedavi kürü boyunca ve son pemetreksetdozundan sonra da 21 gün daha devam ettirilmelidir. Hastalara ilk pemetrekset dozundanönceki haftada ve bunun ardından her üç kürde bir intramusküler B 12 vitamini (1000mikrogram) enjeksiyonu yapılmalıdır. Pemetrekset uygulaması ile aynı günde B 12 vitaminienjeksiyonları da uygulanabilir.
Monitorizasyon:
Pemetrekset uygulanan hastalar, her dozdan önce diferansiyel lökosit ve trombosit sayımını da içeren, tam kan sayımı ile izlenmelidir. Her kemoterapi uygulamasından önce, renal ve hepatikfonksiyonları değerlendirmek için kan biyokimya testleri yapılmalıdır. Herhangi bir kemoterapikürüne başlamadan önce hastanın aşağıdaki değerlere sahip olması gereklidir:
Mutlak nötrofil sayısı (MNS) >1.500 hücre/mm3 ve trombosit sayısı >100.000 hücre/mm3 olmalıdır. Kreatinin klerensi >45 ml/dak olmalıdır.
Toplam bilirubin, normal değer üst limitinin <1,5 katı olmalıdır. Alkalen fosfataz (AP), aspartat amino transferaz (AST veya SGOT) ve alanin amino transferaz (ALT veya SGPT) normal değerüst limitinin <3 katı olmalıdır. Eğer karaciğerde tümör metastazı varsa, alkalen fosfataz, ASTve ALT'nin normal değer üst limitinin <5 katı olması kabul edilebilir.
Doz ayarlamaları:
Bir sonraki kürün başlangıcındaki doz ayarlaması, bir önceki tedavi küründeki en düşük hematolojik sayımlara veya maksimum hematolojik olmayan toksisiteye dayanarakyapılmalıdır. Laboratuvar bulguları düzelene kadar tedavi ertelenebilir. Düzelme sağlandıktansonra hastalar, WELM'in tek ajan veya sisplatin ile kombinasyon halinde kullanımı için geçerliolan Tablo 1, 2 ve 3'teki kılavuzlara göre yeniden tedavi edilmelidir.
TABLO 1 - WELM (tek ajan veya kombine olarak) ve sisplatin için doz ayarlama
tablosu - Hematolojik toksisiteler |
|
En düşük MNS <500 /mm3 ve en düşük trombosit >50.000 /mm3
|
Önceki dozun %75'i (hem WELM hem sisplatin)
|
|
En düşük MNS'ye bakmaksızın, en düşük trombosit <50.000 /mm3
|
Önceki dozun %75'i (hem WELM hem sisplatin)
|
|
En düşük MNS'ye bakmaksızın, kanamalıa en düşük trombosit <50,000/mm3
|
Önceki dozun %50'si (hem WELM hem sisplatin)
|
|
|
Kısaltmalar: MNS: Mutlak nötrofil sayısı
a Bu kriter Ulusal Kanser Enstitüsü Genel Toksisite Kriterleri (GTK) (v2.0; NCl 1998) >GTK Grade 2 kanama tanımına uyar
|
Eğer hastalarda (nörotoksisite hariç) >Grade 3 hematolojik olmayan toksisite gelişirse, hastanın tedavi öncesi değerlerinden daha düşük veya eşit değerlere geri dönülünceye dek WELMuygulaması durdurulmalıdır. Tedavi, Tablo 2'deki kılavuzlara uygun olarak sürdürülmelidir.
TABLO 2 - WELM (tek ajan veya kombine olarak) ve sisplatin için doz ayarlama tablosu - Hematolojik olmayan toksisitelera,b |
|
|
Pemetrekset Dozu (mg/m2 ) |
Sisplatin Dozu (mg/m2 ) |
|
Mukozit haricinde her türlü Grade 3 veya 4 toksisiteler
|
Önceki dozun %75'i
|
Önceki dozun %75'i
|
|
Hospitalizasyon gerektiren tüm diyareler (düzeyine bakılmaksızın)veya Grade 3 veya 4 diyare
|
Önceki dozun %75'i
|
Önceki dozun %75'i
|
|
Grade 3 veya 4 mukozit
|
Önceki dozun %50'si
|
Önceki dozun %100'ü
|
|
|
a Ulusal Kanser Enstitüsü Genel Toksisite Kriterleri (GTK v2.0; NCI 1998) b Nörotoksisite hariç
|
Nörotoksisite gelişmesi halinde, WELM ve sisplatin için önerilen doz ayarlamaları Tablo 3'te verilmiştir. Eğer Grade 3 veya 4 nörotoksisite gözlenirse, hastalarda tedavi kesilmelidir.
TABLO 3 - WELM (tek ajan veya kombinasyon olarak) ve sisplatin için doz ayarlama
tablosu - Nörotoksisite |
GTK Grade |
Pemetrekset Dozu (mg/m2 ) |
Sisplatin Dozu (mg/m2 ) |
0 - 1
|
Önceki dozun %100'ü
|
Önceki dozun %100'ü
|
2
|
Önceki dozun %100'ü
|
Önceki dozun %50'si
|
|
a Ulusal Kanser Enstitüsü Genel Toksisite Kriterleri (GTK; v2.0; NCl 1998)
|
WELM tedavisi, hastanın iki doz azaltılması sonrasında herhangi bir hematolojik veya hematolojik olmayan Grade 3 veya 4 toksisite görülmesi halinde bırakılmalı veya Grade 3 veya4 nörotoksisite görülmesi halinde ise derhal kesilmelidir.
Uygulama şekli
WELM çözeltisi bölüm 6.6'da verilen talimatlara uygun olarak hazırlanmalıdır.
WELM her 21 günlük periodun ilk gününde 10 dakikayı aşkın intravenöz infüzyon şeklinde uygulanır. Uygulamadan önce WELM'in sulandırılması ve seyreltme talimatları için bölüm6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
(Standard Cockcroft ve Gault formülü veya Tc99m-DPTA serum klerens metodu ile ölçülen Glomerüler Filtrasyon Oranı): Pemetrekset esas olarak değişmemiş halde böbrek yoluyla atılır.Klinik çalışmalarda, kreatinin klerensi >45 ml/dak olan hastalar, tüm hastalar için önerilenlerdışında bir doz ayarlamasına gereksinim duymamışlardır. Kreatinin klerensi 45 ml/dak'nınaltında olan hastalarda pemetrekset kullanımı ile ilgili yeterli veri mevcut değildir; bu nedenlebu hastalarda pemetrekset kullanılması önerilmemektedir (Bkz. Bölüm 4.4.).
Karaciğer yetmezliği:
AST (SGOT), ALT (SGPT) veya toplam bilirubin ve pemetrekset farmakokinetiği arasında bir ilişki saptanmamıştır. Bununla beraber, bilirubin değeri normal değer üst limitinin >1,5 katıve/veya aminotransferaz normal değer üst limitinin >3,0 katı (hepatik metastazın olmadığı)veya normal değer üst limitinin >5,0 katı (hepatik metastazın olduğu) olan karaciğer yetmezliğibulunan hastalar spesifik olarak araştırılmamıştır.
Pediyatrik popülasyon:
WELM'in malign plevral mezotelyoma ve küçük hücreli dışı akciğer kanserinde pediyatrik popülasyonda kullanımı yoktur. 18 yaş altındaki hastalarda önerilmemektedir.
Geriyatrik popülasyon:
Klinik çalışmalarda, 65 yaş veya üzerindeki hastaların 65 yaşın altındaki hastalarla karşılaştırıldığında artmış bir advers olay riski altında bulunduklarına dair bir bulgusaptanmamıştır. Genel olarak tüm hastalar için önerilenler dışında, doz azaltılması gereklideğildir.
4.3. Kontrendikasyonlar
Pemetrekset veya ilacın bölüm 6.1'de içerdiği maddelerden herhangi birine karşı bilinen aşırı duyarlılığı bulunan hastalarda kontrendikedir.
Pemetrekset ile tedavi sırasında emzirme kesilmelidir (Bkz. Bölüm 4.6.).
Sarıhumma aşısı ile birlikte kullanımı kontrendikedir (Bkz. Bölüm 4.5.).
4.4 Özel kullanım uyarıları ve önlemleri
J T3u belge, güvemi elektronik imza ile imzalanmıştır. T3u belge, güvemi elektronik imza ile imzalanmıştır.
Belge Do 4
Pemetrekset, nötropeni, trombositopeni ve anemi (veya pansitopeni) ile kendini gösteren kemik iliği supresyonu yapabilir (Bkz. Bölüm 4.8.). Miyelosupresyon genellikle doz kısıtlayıcıtoksisitedir. Hastalar tedavi süresince miyelosupresyon açısından izlenmeli ve hastalara, mutlaknötrofil sayıları (MNS) >1.500 hücre/mm3 ve trombosit sayısı >100.000 hücre/mm3 düzeyinedönünceye kadar pemetrekset uygulanmamalıdır. Bir sonraki kürler için doz azaltılması birönceki kürde gözlenen en düşük MNS, trombosit sayısı ve hematolojik olmayan maksimumtoksisiteye dayanarak ayarlanır (Bkz. Bölüm 4.2.).
Folik asit ve B 12 vitamini ile premedikasyon uygulandığında, daha az toksisite ve nötropeni, febril nötropeni ve Grade 3/4 nötropeni ile birlikte enfeksiyon gibi Grade 3/4 hematolojik vehematolojik olmayan toksisitelerde azalma bildirilmiştir. Bu nedenle pemetrekset ile tedaviedilen tüm hastalar, tedaviyle ilişkili toksisiteyi azaltabilmek için profilaktik olarak folik asitve B 12 vitamini almaları konusunda bilgilendirilmelidir (bkz. Bölüm 4.2).
Kortikosteroid ile premedikasyon görmemiş hastalarda cilt reaksiyonları bildirilmiştir. Deksametazon (veya eşdeğeri) ile premedikasyon cilt reaksiyonlarının sıklık ve şiddetiniazaltabilir (Bkz. Bölüm 4.2.).
Araştırmalara katılmış, kreatinin klerensi 45 ml/dak'nın altında olan hasta sayısı yeterli değildir. Bu nedenle, kreatinin klerensi 45 ml/dak'nın altında olan hastalarda pemetreksetin kullanımıönerilmemektedir (Bkz. Bölüm 4.2.).
Hafif ile orta derecede böbrek yetmezliği bulunan hastalar (kreatinin klerensi 45-79 ml/dak), pemetrekset uygulamasının 2 gün öncesinden itibaren, uygulama gününde ve uygulamadansonra 2 gün süreyle ibuprofen ve asetilsalisilik asit (günlük >1,3 g) gibi nonsteroidalantiinflamatuar ilaçlar (NSAİİ) almaktan kaçınmalıdır (Bkz. Bölüm 4.5.).
Pemetrekset tedavisi için düşünülen orta ya da hafif böbrek yetmezliği olan hastalarda, eliminasyon yarılanma ömrü uzun olan NSAİİ'ler pemetrekset uygulamasının en az 5 günöncesinden itibaren, uygulama gününde ve uygulama gününden sonra en az 2 gün süresincekesilmelidir (Bkz. Bölüm 4.5.).
Pemetrekset tek başına ya da diğer kemoterapötik ajanlarla birlikte kullanıldığında akut böbrek yetmezliği dahil ciddi böbrek bozuklukları bildirilmiştir. Bu hastaların çoğunda böbrekbozukluklarının gelişmesine neden olabilecek dehidrasyon, önceden var olan hipertansiyonveya diyabet gibi risk faktörleri mevcuttur. Pazarlama sonrası dönemde tek başınapemetreksetle ya da diğer kemoterapötik ajanlarla birlikte nefrojenik diyabetes insipidus verenal tübüler nekroz bildirilmiştir. Bu olayların çoğu pemetreksetin bırakılmasından sonraçözülmüştür. Hastalar akut tübüler nekroz, azalan böbrek fonksiyonu ve nefrojenik diyabetesinsipidusun belirti ve semptomları (örn. hipernatremi) için düzenli olarak izlenmelidir.
Plevral efüzyon veya assit gibi vücut boşluklarındaki sıvıların pemetrekset üzerine olan etkileri tam olarak tanımlanmamıştır. Sıvı birikimi olan 31 solid tümör hastasında yapılan bir faz 2çalışmada, sıvı birikimi olmayan hastalarla kıyaslandığında pemetreksetin plazmakonsantrasyonu ya da klerensi bir farklılık göstermemiştir. Bu nedenle pemetrekset tedavisiöncesinde toplanmış sıvı birikimlerinin drenajı değerlendirilmelidir ama gerekli olmayabilir.
Pemetreksetin, sisplatin ile kombine olarak verildiğindeki gastrointestinal toksisitesine bağlı olarak şiddetli dehidrasyon gözlenmiştir. Bu nedenle, hastalara tedavi öncesinde ve/veyasonrasında yeterli antiemetik tedavi ve uygun hidrasyon uygulanmalıdır.
5
Pemetrekset klinik çalışmalarında, genellikle diğer bir sitotoksik ajan ile kombine verildiği durumlarda, yaygın olmayan miyokardiyal enfarktüs ve serebrovasküler olaylar dahil ciddikardiyovasküler olaylar bildirilmiştir. Bu olayların gözlendiği hastaların çoğu önceden var olankardiyovasküler risk faktörlerine sahiptir (Bkz. Bölüm 4.8.).
Kanser hastalarında bağışıklık sistemi çoğunlukla baskılanmış durumdadır. Sonuç olarak, zayıflatılmış canlı aşılarla birlikte kullanılması önerilmez (Bkz. Bölüm 4.3. ve 4.5.).
Pemetreksetin, genetik olarak hasar verici etkileri olabilir. Cinsel olgunluktaki erkeklere, tedavi sırasında ve sonraki 6 aya kadar çocuk sahibi olmamaları önerilir. Kontraseptif yöntemler veyailişkiden kaçınma tavsiye edilir. Pemetrekset tedavisinin geri dönüşümsüz infertiliteye sebepolabilme ihtimalinden dolayı erkeklere, tedaviye başlamadan önce sperm saklanması hakkındadanışmanlık almaları önerilir.
Doğum yapma potansiyeli olan kadınlarda pemetrekset ile tedavi sırasında etkin kontraseptif yöntemler kullanılmalıdır (Bkz. Bölüm 4.6.).
Pemetrekset tedavisi sırasında, tedavisini takiben veya tedaviden önce radyasyon tedavisi gören hastalarda radyasyon pnömönisi bildirilmiştir. Bu hastalarda ve diğer radyosensitif (radyasyonaduyarlaştırıcı) ajanların kullanıldığı hastalarda özellikle dikkat edilmesi gerekir.
Haftalar veya yıllar öncesi radyasyon tedavisi gören hastalarda radyasyon anımsatma dermatiti vakaları bildirilmiştir.
Bu tıbbi ürün her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında sodyum içermez.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Pemetrekset büyük bir oranda değişmeden tübüler sekresyon ve daha az olarak da glomerüler filtrasyon ile böbrek yoluyla atılır. Nefrotoksik ilaçların (ör. aminoglikozid, kıvrım diüretikleri,platin bileşikleri, siklosporin) eş zamanlı olarak kullanılması, potansiyel olarak pemetreksetinklerensinin gecikmesine neden olabilir. Bu kombinasyon dikkatle kullanılmalıdır. Gerekiyorsa,kreatinin klerensi yakından izlenmelidir.
Pemetreksetin, tübüler sekresyonla atılan maddeler (ör. probenesid, penisilin) ile de eş zamanlı olarak kullanılması potansiyel olarak klerensinin gecikmesine neden olabilir. Bu ilaçlarpemetrekset ile kombine kullanıldığında dikkatli olunmalıdır. Gerekiyorsa, kreatinin klerensiyakından izlenmelidir.
Normal böbrek fonksiyonu olan hastalarda (kreatinin klerensi >80 ml/dak), yüksek dozlarda nonsteroidal antiinflamatuar ilaçlar (NSAİİ, ör. ibuprofen >1.600 mg/gün) ve daha yüksekdozda asetilsalisilik asit (günde >1,3 g) pemetrekset atılımını azaltabilir ve sonuç olarakpemetrekset advers etkilerinin oluşumunu artırabilir. Bu nedenle, pemetrekset ile eş zamanlıolarak yüksek dozlarda NSAİİ ve asetilsalisilik asit alan normal böbrek fonksiyonu olanhastalarda (kreatinin klerensi >80 ml/dak) dikkatli olunmalıdır.
Hafif ile orta derecede böbrek yetmezliği bulunan hastalarda (kreatinin klerensi 45-79 ml/dak), pemetrekset uygulamasının 2 gün öncesinden itibaren, uygulama gününde ve uygulamadansonra en az 2 gün süreyle NSAİİ (ör. ibuprofen) veya yüksek dozlarda asetilsalisilik asit ilepemetreksetin eş zamanlı uygulamasından kaçınılmalıdır (Bkz. Bölüm 4.4.).
6
Pemetreksetin, piroksikam veya rofekoksib gibi uzun yarılanma ömürlü NSAİİ ile potansiyel etkileşimine ilişkin veri bulunmadığı için hafif ya da orta derecede böbrek yetmezliği olanhastalarda bunların, pemetrekset uygulamasının en az 5 gün öncesinden itibaren, uygulamagününde ve uygulamadan sonra en az 2 gün süreyle eş zamanlı kullanımı kesilmelidir (Bkz.Bölüm 4.4.). Eğer NSAİİ ile eş zamanlı kullanım gerekli ise hastalar özellikle miyelosupresyonve gastrointestinal toksisite nedeniyle yakından izlenmelidir.
Pemetreksetin hepatik metabolizması sınırlıdır. İnsan karaciğer mikrozomları ile yapılan in vitroçalışmaların sonuçları, pemetreksetin CYP3A, CYP2D6, CYP2C9 ve CYP1A2 ilemetabolize edilen ilaçların metabolik klerenslerinde klinik olarak anlamlı bir inhibisyona nedenolmasının beklenmediğini göstermiştir.
Tüm sitotoksiklerde görülen etkileşimler:
Kanserli hastalarda tromboz riskinin artmış olması nedeniyle, antikoagülan tedavi kullanımı sıktır. Hastalık sırasında, koagülasyon durumunun bireysel olarak değişkenliğinin yüksekolması ve oral antikoagülanlar ile antikanser kemoterapisi arasındaki olası etkileşim, hastanınoral antikoagülanlar ile tedavisine karar verilmesi halinde daha sık INR (UluslararasıNormalleştirilmiş Değer) izlenmesini gerektirir.
Kontrendike eş zamanlı kullanım: Sarıhumma aşısı: Ölümcül jeneralize aşı hastalığı riski (Bkz. Bölüm 4.3.).
Önerilmeyen eş zamanlı kullanım: Zayıflatılmış canlı aşılar (eş zamanlı kullanımı kontrendike olan sarıhumma dışında): Sistemik, olasılıkla ölümcül hastalık riski. Altta yatan hastalıklarınedeniyle bağışıklık sistemi baskılanmış bireylerde risk artmaktadır. Bulunabilirse bir inaktifaşı kullanılmalıdır (çocuk felci) (Bkz. Bölüm 4.4.).
Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:
Herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyonGenel tavsiye
Gebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Doğum yapma potansiyeli olan kadınlarda pemetrekset ile tedavi sırasında etkin kontraseptif yöntemler kullanılmalıdır.
Pemetreksetin, genetik olarak zarar verici etkileri olabilir. Cinsel olgunluktaki erkeklere, tedavi sırasında ve sonraki 6 aya kadar çocuk sahibi olmamaları önerilir. Kontraseptifyöntemler veya ilişkiden kaçınma tavsiye edilir.
Gebelik dönemi
Pemetreksetin hamile kadınlarda kullanımına ait veri yoktur ancak pemetreksetin diğer anti-metabolitler gibi, gebelik döneminde uygulandığında ciddi doğum kusurlarına neden olmasından kuşkulanılmaktadır. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesininbulunduğunu göstermiştir (Bkz. Bölüm 5.3). Pemetreksetin gebelik ve/veya fetus/yeni doğan
7
üzerinde zararlı farmakolojik etkileri bulunmaktadır. WELM, annenin gereksinimleri ve fetüs için riskin dikkatle değerlendirmesinden sonra, belirgin şekilde gerekli olmadıkça gebelikdöneminde kullanılmamalıdır (Bkz. Bölüm 4.4.).
Laktasyon dönemi
Pemetreksetin insan sütüyle atılıp atılmadığı bilinmemektedir ve emzirilen çocuk üzerindeki advers reaksiyonları göz ardı edilemez. WELM ile tedavi boyunca emzirme durdurulmalıdır.(Bkz. Bölüm 4.3.).
Üreme yeteneği/Fertilite
Pemetrekset tedavisinin geri dönüşümsüz infertiliteye sebep olabilme olasılığı nedeniyle erkeklere, tedaviye başlamadan önce sperm saklanması konusunda danışmanlık almalarıönerilir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Pemetreksetin, araç ve makine kullanma yeteneği üzerine olan etkileri ile ilgili bir çalışma gerçekleştirilmemiştir. Bununla birlikte, yorgunluğa neden olabileceği bildirilmiştir. Buetkinin ortaya çıkması durumunda, hastalar araç sürme veya makine kullanma konusundauyarılmalıdır.
4.8. İstenmeyen etkilerGüvenlilik profili özeti
Pemetreksete ilişkin en yaygın bildirilen istenmeyen etkiler, ister monoterapi olarak ya da kombine olarak kullanılsın, kendini anemi, nötropeni, lökopeni, trombositopeni ile belli edenkemik iliği baskılanması; ve kendini anoreksi, bulantı, kusma, diyare, konstipasyon, farenjit,mukozit ve stomatit ile gösteren gastrointestinal toksisitelerdir. Diğer istenmeyen etkiler renaltoksisiteler, aminotransferaz düzeylerinde artış, alopesi, yorgunluk, dehidrasyon, döküntü,enfeksiyon/sepsis ve nöropatiyi içerir. Seyrek olarak görülen olaylar Steven-Johnson sendromuve toksik epidermal nekrolizi içerir.
Advers reaksiyonların tablolanmış listesiMezotelyoma çalışması:
Aşağıdaki tablo, sisplatin ve pemetrekset uygulanmak üzere randomize edilmiş mezotelyomalı 168 hasta ve tek ajan sisplatin uygulanmak üzere randomize edilmiş mezotelyomalı 163hastanın %5'inden fazlasında bildirilmiş olan istenmeyen etkilerin sıklık ve şiddetlerinigöstermektedir. Her iki tedavi grubunda da, daha önce kemoterapi almamış hastalara tam birfolik asit ve B12 vitamini takviyesi verilmiştir.
Advers reaksiyonlar:
Sıklık derecesi: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor).
Her bir sıklık grubu içinde, istenmeyen etkiler ciddiyetindeki azalmaya göre sıralanmıştır.
8
Sistem organ sınıfı |
Sıklık |
Olay* |
Pemetrekset/Sisplatin |
Sisplatin |
(N=168) |
(N=163) |
Tüm
gradelerde toksisite (%) |
Grade 3-4 toksisite (%) |
Tüm
gradelerde toksisite (%) |
Grade 3-4 toksisite(%) |
|
Kan ve lenf sistemi hastalıkları
|
Çok yaygın
|
Nötrofil/Granülosit
azalması
|
56,0
|
23,2
|
13,5
|
3,1
|
Lökosit azalması
|
53,0
|
14,9
|
16,6
|
0,6
|
|
Hemoglobin
azalması
|
26,2
|
4,2
|
10,4
|
0,0
|
Trombosit azalması
|
23,2
|
5,4
|
8,6
|
0,0
|
|
Metabolizma ve beslenmehastalıkları
|
Y aygın
|
Dehidrasyon
|
6,5
|
4,2
|
0,6
|
0,6
|
|
Sinir sistemi hastalıkları
|
Çok yaygın
|
Sensoriyel nöropati
|
10,1
|
0,0
|
9,8
|
0,6
|
|
Y aygın
|
Tat alma bozukluğu
|
7,7
|
0,0***
|
6,1
|
0,0***
|
|
Göz hastalıkları
|
Y aygın
|
Konjunktivit
|
5,4
|
0,0
|
0,6
|
0,0
|
|
Gastrointestinal
hastalıklar
|
Çok yaygın
|
Diyare
|
16,7
|
3,6
|
8,0
|
0,0
|
Kusma
|
56,5
|
10,7
|
49,7
|
4,3
|
Stomatit/Farenjit
|
23,2
|
3,0
|
6,1
|
0,0
|
Bulantı
|
82,1
|
11,9
|
76,7
|
5,5
|
Anoreksi
|
20,2
|
1,2
|
14,1
|
0,6
|
Konstipasyon
|
11,9
|
0,6
|
7,4
|
0,6
|
|
Y aygın
|
Dispepsi
|
5,4
|
0,6
|
0,6
|
0,0
|
|
Deri ve deri altı doku hastalıkları
|
Çok yaygın
|
Döküntü
|
16,1
|
0,6
|
4,9
|
0,0
|
Alopesi
|
11,3
|
0,0***
|
5,5
|
0,0***
|
|
Böbrek ve idrar yolu hastalıkları
|
Çok yaygın
|
Kreatinin yükselmesi
|
10,7
|
0,6
|
9,8
|
1,2
|
Kreatinin
klerensinde
azalma**
|
16,1
|
0,6
|
17,8
|
1,8
|
|
Genel bozukluklar ve uygulamabölgesine ilişkinhastalıklar
|
Çok yaygın
|
Yorgunluk
|
47,6
|
10,1
|
42,3
|
9,2
|
* Her toksisite grade'i için, "kreatinin klerensinde azalma" terimi dışındakiler için Ulusal Kanser Enstitüsü GTK 2. baskı referans alınmıştır.
** "renal/genitoüriner diğer" teriminden türetilmiştir.
*** Ulusal Kanser Enstitüsü Genel Toksisite Kriterlerine (GTK) (v2.0; NCl 1998) göre tat alma bozukluğu ve alopesi yalnız Grade 1 ve 2 olarak rapor edilmelidir.
Bu tablonun amacı dotusunda, raportörün pemetrekset ve sisplatin ile olası bir ilişki olduğunu düşündüğü tüm olayların dahil edilmesi için %5'lik bir sınır değer kullanılmıştır.
Sisplatin ve pemetrekset kullanmak üzere randomize olan hastaların >%1 ve <%5'inde bildirilmiş olan klinik olarak anlamlı Genel Toksisite Kriterleri (GTK) toksisiteleri: böbrekyetmezliği, enfeksiyon, yüksek ateş, febril nötropeni, AST, ALT ve GGT düzeylerinde artış,ürtiker ve göğüs ağrısını içermektedir.
9
Sisplatin ve pemetrekset kullanmak üzere randomize olan hastaların <%1'inde bildirilmiş olan klinik olarak anlamlı GTK toksisiteleri aritmi ve motor nöropatiyi içermektedir.
Aşağıdaki tablo tek ajan olarak pemetrekset beraberinde folik asit ve B 12 vitamini takviyesi uygulanmak üzere randomize edilmiş 265 hastanın % 5'inden fazlasında ve tek ajan olarakdosetaksel uygulanmak üzere randomize edilmiş 276 hastanın %5'inden fazlasında bildirilmişolan istenmeyen etkilerin sıklık ve şiddetlerini göstermektedir. Tüm hastalara lokal olarakilerlemiş veya metastatik küçük hücreli dışı akciğer kanseri tanısı konmuş olup, daha öncekemoterapi almışlardır.
Sistem organ sınıfı |
Sıklık |
Olay* |
Pemetrekset
N=265 |
Dosetaksel
N=276 |
Tüm
gradelerde
toksisite
(%) |
Grade 3-4 toksisite (%) |
Tüm
gradelerde
toksisite
(%) |
Grade 3-4 toksisite(%) |
|
Kan ve lenf sistemi hastalıkları
|
Çok yaygın
|
Nötrofil/Granülosit
azalması
|
10,9
|
5,3
|
45,3
|
40,2
|
|
Lökosit azalması
|
12,1
|
4,2
|
34,1
|
27,2
|
|
Hemoglobin
azalması
|
19,2
|
4,2
|
22,1
|
4,3
|
|
Y aygın
|
Trombosit azalması
|
8,3
|
1,9
|
1,1
|
0,4
|
|
Gastrointestinal
hastalıklar
|
Çok yaygın
|
Diyare
|
12,8
|
0,4
|
24,3
|
2,5
|
|
Kusma
|
16,2
|
1,5
|
12,0
|
1,1
|
|
Stomatit/Farenjit
|
14,7
|
1,1
|
17,4
|
1,1
|
|
Bulantı
|
30,9
|
2,6
|
16,7
|
1,8
|
|
Anoreksi
|
21,9
|
1,9
|
23,9
|
2,5
|
|
Y aygın
|
Konstipasyon
|
5,7
|
0,0
|
4,0
|
0,0
|
|
Hepato-bilier
hastalıklar
|
Y aygın
|
SGPT (ALT) yükselmesi
|
7,9
|
1,9
|
1,4
|
0,0
|
SGOT (AST) yükselmesi
|
6,8
|
1,1
|
0,7
|
0,0
|
|
Deri ve deri altı doku hastalıkları
|
Çok yaygın
|
Döküntü/deskuamasy on (pul pul dökülme)
|
14,0
|
0,0
|
6,2
|
0,0
|
|
Y aygın
|
Kaşıntı
|
6,8
|
0,4
|
1,8
|
0,0
|
Alopesi
|
6,4
|
0,4**
|
37,7
|
2,2**
|
|
Genel bozukluklar ve uygulama bölgesineilişkin hastalıklar
|
Çok yaygın
|
Yorgunluk
|
34,0
|
5,3
|
35,9
|
5,4
|
|
Y aygın
|
Ateş
|
8,3
|
0,0
|
7,6
|
0,0
|
|
|
* Her toksisite grade'i için Ulusal Kanser Enstitüsü GTK 2. baskı referans alınmıştır.
** Ulusal Kanser Enstitüsü Genel Toksisite Kriterlerine (GTK) (v2.0; NCl 1998) göre alopesi yalnız Grade 1 ve 2 olarak rapor edilmelidir.
|
Pemetrekset kullanmak üzere randomize olan hastaların >%1 ve <%5'inde bildirilmiş olan klinik olarak anlamlı GTK toksisiteleri: Nötropeni olmaksızın enfeksiyon, febril nötropeni,alerjik reaksiyon/aşırı duyarlılık, kreatinin düzeyinde artış, motor nöropati, sensoriyel nöropati,eritema multiforme ve abdominal ağrıyı içermektedir.
Pemetrekset kullanmak üzere randomize olan hastaların <%1'inde bildirilmiş olan klinik olarak anlamlı GTK toksisiteleri supraventriküler aritmiyi içermektedir.
Tek ajan olarak pemetrekset ile yapılan üç Faz 2 çalışmasının (n=164) birleştirilmiş sonuçları
J Bu belge, güvenli elektronik ımzaıle imzalanmıştır. vy Bu belge, güvenli elektronik ımzaıle imzalanmıştır. vy
Belge Do |
Sıklık |
Olay** |
Pemetrekset/Sisplatin |
Gemsitabin/Sisplatin |
(N=839) |
(N=830) |
Tüm
Gradelerde
Toksisite
(%) |
Grade 3-4 Toksisite(%) |
Tüm
Gradelerde
Toksisite
(%) |
Grade 3-4 Toksisite(%) |
|
Kan ve lenf sistemi hastalıkları
|
Çok yaygın
|
Hemoglobin azalması
|
33,0*
|
5,6*
|
45,7*
|
9,9*
|
|
Nötrofil/Granülosit
azalması
|
29,0*
|
15,1*
|
38,4*
|
26,7*
|
Lökosit azalması
|
17,8
|
4,8*
|
20,6
|
7,6*
|
Trombosit azalması
|
10,1*
|
4,1*
|
26,6*
|
12,7*
|
|
Sinir sistemi hastalıkları
|
Y aygın
|
Sensoriyel nöropati
|
8,5*
|
0,0*
|
12,4*
|
0,6*
|
Tat alma bozukluğu
|
8,1
|
00 *** |
8,9
|
00 *** |
|
Gastrointestinal
hastalıklar
|
Çok yaygın
|
Bulantı
|
56,1
|
7,2*
|
53,4
|
3,9*
|
Kusma
|
39,7
|
6,1
|
35,5
|
6,1
|
Anoreksi
|
26,6
|
2,4*
|
24,2
|
0,7*
|
Konstipasyon
|
21,0
|
0,8
|
19,5
|
0,4
|
Stomatit/Farenjit
|
13,5
|
0,8
|
12,4
|
0,1
|
Kolostomi olmadan diyare
|
12,4
|
1,3
|
12,8
|
1,6
|
|
Y aygın
|
Dispepsi/mide yanması
|
5,2
|
0,1
|
5,9
|
0,0
|
|
Deri ve deri altı doku hastalıkları
|
Çok yaygın
|
Alopesi
|
11,9*
|
0 *** |
21,4*
|
0,5***
|
|
Y aygın
|
Döküntü/ pul pul dökülme |
6,6
|
0,1
|
8,0
|
0,5
|
|
Böbrek ve idrar yolu hastalıkları
|
Çok yaygın
|
Kreatinin yükselmesi
|
10,1*
|
0,8
|
6,9*
|
0,5
|
|
Genel bozukluklar ve uygulama bölgesineilişkin hastalıklar
|
Çok yaygın
|
Y orgunluk
|
42,7
|
6,7
|
44,9
|
4,9
|
|
|
* P-değerleri <0.05 Fischer Kesin testi kullanarak pemetrekset/sisplatini gemsitabin/sisplatinle karşılaştırma ** Her Grade toksisitesi için Ulusal Kanser Enstitüsü Genel Toksisite Kriterlerine (GTK) (v2.0; NCl 1998)başvurunuz
*** Ulusal Kanser Enstitüsü Genel Toksisite Kriterlerine (GTK) (v2.0; NCl 1998) göre tat alma bozukluğu ve alopesi yalnız Grade 1 ve 2 olarak rapor edilmelidir.
|
Bu tablonun amacı folusunda rap^rim pemetrekset ile °ksı bir mşld °Muğunu Belge Dcdöşöniüğüı tüm ®layla¥ı®edgMirMMmw§iıiçi® %5'like birrsınırddeğersktollanıılmıştıTtr/sagiik-titck-ebys
11
Sisplatin ve pemetrekset kullanmak üzere randomize olan hastaların >%1 ve <%5'inde bildirilmiş olan klinik olarak anlamlı toksisiteler: AST ve ALT düzeylerinde artış, enfeksiyon,febril nötropeni, böbrek yetmezliği, yüksek ateş, sıvı kaybı, konjunktivit ve kreatininklerensinde azalmayı içermektedir.
Sisplatin ve pemetrekset kullanmak üzere randomize olan hastaların <%1'inde bildirilmiş olan klinik olarak anlamlı toksisiteler: GGT düzeyinde artış, göğüs ağrısı, aritmi ve motor nöropatiyiiçermektedir.
Pemetrekset ile birlikte sisplatin alan hastalarda, cinsiyete göre klinik açıdan önemli toksisiteler, genel hasta popülasyonuyla benzer olmuştur.
Aşağıdaki tabloda, tek ajan pemetrekset idame tedavisi (JMEN: N=663) ve pemetrekset devam idame tedavisi (PARAMOUNT: N=539) çalışmalarında rastgele tek ajan pemetrekset alacakşekilde randomize edilen 800 hastanın ve rastgele plasebo alacak şekilde randomize edilen 402hastanın >%5'inde bildirilen ve çalışma ilacıyla muhtemel olarak ilişkili olduğu değerlendirilenistenmeyen etkilerin sıklığı ve şiddeti sunulmaktadır. Tüm hastalara Evre IIIB veya IV KHDAKtanısı konmuş ve tüm hastalar daha önce platin bazlı kemoterapi görmüştür.
Her iki çalışma kolundaki hastalar tam folik asit ve B12 vitamini takviyesi almıştır.
Sistem organ sınıfı |
Sıklık* |
Olay** |
Pemetrekset*** |
Plasebo*** |
(N=800) |
(N=402) |
Tüm
Gradelerde
Toksisite
(%) |
Grade 3-4 Toksisite(%) |
Tüm
Gradelerde
Toksisite
(%) |
Grade 3-4 Toksisite(%) |
|
Kan ve lenf sistemi hastalıkları
|
Çok yaygın
|
Hemoglobin azalması
|
18,0
|
4,5
|
5,2
|
0,5
|
|
Y aygın
|
Lökositlerde azalma
|
5,8
|
1,9
|
0,7
|
0,2
|
Nötrofillerde azalma
|
8,4
|
4,4
|
0,2
|
0,0
|
|
Sinir sistemi hastalıkları
|
Y aygın
|
Sensoriyel nöropati
|
7,4
|
0,6
|
5,0
|
0,2
|
|
Gastrointestinal
hastalıklar
|
Çok yaygın
|
Bulantı
|
17,3
|
0,8
|
4,0
|
0,2
|
Anoreksi
|
12,8
|
1,1
|
3,2
|
0,0
|
|
Y aygın
|
Kusma
|
8,4
|
0,3
|
1,5
|
0,0
|
Mukozit/stomatit
|
6,8
|
0,8
|
1,7
|
0,0
|
|
Hepato-bilier
hastalıklar
|
Y aygın
|
ALT (SGPT) yükseltmesi
|
6,5
|
0,1
|
2,2
|
0,0
|
AST (SGOT) yükseltmesi
|
5,9
|
0,0
|
1,7
|
0,0
|
|
Deri ve deri altı doku hastalıkları
|
Y aygın
|
Döküntü/pul pul dökülme
|
8,1
|
0,1
|
3,7
|
0,0
|
|
Böbrek ve idrar yolu hastalıkları
|
Y aygın
|
Böbrek
hastalıkları****
|
7,6
|
0,9
|
1,7
|
0,0
|
|
Genel bozukluklar ve uygulamabölgesine ilişkinhastalıklar
|
Çok yaygın
|
Y orgunluk
|
24,1
|
5,3
|
10,9
|
0,7
|
|
Y aygın
|
Ağrı
|
7,6
|
0,9
|
4,5
|
0,0
|
Ödem
|
5,6
|
0,0
|
1,5
|
0,0
|
|
|
Kısaltmalar: ALT: alanin aminotransferaz; AST: aspartat aminotransferaz; CTCAE: Advers Olay için Yaygın Terminoloji Kriteri; NCI: Ulusal Kanser Enstitüsü; SGOT: serum glutamik oksaloasektik aminotransferaz, SGPT:serum glutamik piruvik aminotransferaz
|
12
* Sıklık terimlerinin tanımı: Çok yaygın: >%10; Yaygın: >%5 ve <%10. Bu tablonun amacı dotusunda, raportörün pemetrekset ile olası bir ilişki olduğunu düşündüğü tüm olayların dahil edilmesi için %5'lik bir sınırdeğer kullanılmıştır.
** Her bir toksisite derecesi için NCI CTCAE Kriterlerine (Versiyon 3.0; NCI 2003) bakınız. Gösterilen rapor oranları CTCAE versiyon 3.0 dotusundadır.
*** Birleştirilmiş advers reaksiyonlar tablosu JMEN pemetrekset idame tedavisi (N=663) ve PARAMOUNT pemetrekset devam idame tedavisi (N=539) çalışmalarının sonuçlarını birleştirmektedir.
**** Birleştirilmiş terimler serum/kan kreatinin artışı, glomerüler filtrasyon hızında azalma, böbrek yetmezliği ve renal/genitoüriner - diğer olayları içermektedir.
Rastgele pemetrekset verilen hastaların >%1 ve <%5'inde bildirilen herhangi bir grade klinik olarak ilgili Yaygın Terminoloji Kriteri (CTC) toksisitesi febril nötropeni, enfeksiyon, plateletsayısında azalma, ishal, konstipasyon, alopesi, pruritus/kaşıntı, ateş (nötropeni olmadan),oküler yüzey hastalığı (konjonktivit dahil), gözyaşı salgılanmasında artış, baş dönmesi ve motornöropatidir.
Rastgele pemetrekset verilen hastaların <%1'inde bildirilen herhangi bir dereceden klinik olarak ilgili CTC toksisitesi alerjik reaksiyon/aşırı duyarlılık, eritema multiforme, supraventriküleraritmi ve pulmoner embolizmi içermektedir.
Pemetrekset almak üzere randomize edilen hastalarda (N=800) güvenlilik değerlendirilmiştir. Advers reaksiyon insidansı <6 siklus boyunca pemetrekset idame tedavisi alan hastalarda(N=519) değerlendirilmiş ve >6 siklus boyunca pemetrekset alan hastalarla (N=281)karşılaştırılmıştır. Daha uzun süre maruz kalmayla birlikte advers reaksiyonlarda (her gradede)artış gözlenmiştir. Pemetreksete daha uzun süre maruz kalındığında, muhtemelen ilaçla ilgiliGrade 3/4 nötropeni insidansında anlamlı bir artış gözlenmiştir (<6 siklus: %3,3, >6 siklus:%6,4; p=0,046). Daha uzun süre maruz kalma ile, başka herhangi bir bireysel Grade 3/4/5advers reaksiyonlarında istatistiksel olarak anlamlı bir fark görülmemiştir.
Pemetreksetin genellikle diğer bir sitotoksik ajan ile kombine olarak verildiği klinik çalışmalarda, miyokard enfarktüsü, angina pektoris, serebrovasküler olay ve geçici iskemikatak dahil yaygın olmayan ciddi kardiyovasküler ve serebrovasküler olaylar bildirilmiştir.
Bu olayların gözlendiği hastaların çoğu önceden var olan kardiyovasküler risk faktörlerine sahiptir.
Pemetrekset klinik çalışmalarında, potansiyel olarak ciddi hepatit vakaları seyrek olarak bildirilmiştir.
Pemetrekset klinik çalışmalarında yaygın olmayan pansitopeni bildirilmiştir.
Klinik çalışmalarda, pemetrekset ile tedavi edilen hastalarda (bazen ölümcül olan intestinal ve rektal kanama, intestinal perforasyon, intestinal nekroz ve tiflit dahil) yaygın olmayan kolitvakaları bildirilmiştir.
Klinik çalışmalarda, pemetrekset ile tedavi edilen hastalarda nadir olarak bazen ölümcül olan solunum yetmezliği ile seyreden interstisyel pnömoni vakaları bildirilmiştir.
Pemetrekset ile tedavi edilen hastalarda yaygın olmayan ödem vakaları bildirilmiştir.
Pemetrekset ile yapılan klinik çalışmalarda yaygın olmayan ösofajit/radyasyon ösofajiti bildirilmiştir.
Pemetrekset ile yapılan klinik çalışmalarda bazen ölümcül olabilen sepsis yaygın olarak
bildirilmiştir
13
Pazarlama sonrası araştırmalara göre pemetrekset ile tedavi edilen hastalarda aşağıdaki advers etkiler bildirilmiştir:
Yaygın olarak hiperpigmentasyon bildirilmiştir.
Pemetreksetin tek başına veya diğer kemoterapötik ajanlarla birlikte kullanıldığında yaygın olmayan akut böbrek yetmezliği vakaları bildirilmiştir (Bkz. Bölüm 4.4.). Pazarlama sonrasıaraştırmalarda nefrojenik diyabetes insipidus ve renal tübüler nekroz bilinmeyen sıklıklabildirilmiştir.
Pemetrekset tedavisi sırasında, sonrasında veya tedaviden önce radyasyon tedavisi gören hastalarda yaygın olmayan radyasyon pnömonisi vakaları bildirilmiştir (Bkz. Bölüm 4.4.).
Daha önce radyoterapi gören hastalarda seyrek olarak radyasyon anımsatma dermatiti (radyasyon recall) vakaları bildirilmiştir (Bkz. Bölüm 4.4.).
Bazen ekstremitede nekroza yol açan yaygın olmayan periferal iskemi vakaları rapor edilmiştir.
Bazı vakalarda ölümcül olan toksik epidermal nekroliz ve Steven-Johnson sendromunu içeren büllöz durumlar seyrek olarak bildirilmiştir.
Pemetrekset ile tedavi edilen hastalarda immün yanıt sonucu gelişen hemolitik anemi seyrek olarak bildirilmiştir.
Seyrek olarak anafilaktik şok bildirilmiştir.
Başlıca alt ekstremitelerde eritematöz ödem bilinmeyen sıklıkla bildirilmiştir. Dermisin, hipodermisin ve/veya derialtı dokusunun enfeksiyöz ve enfeksiyöz olmayan bozuklukları(örneğin, akut bakteriyel dermo-hipodermit, psödosellülit, dermatit), bilinmeyen bir sıklıktarapor edilmiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Bildirilmiş doz aşımı semptomları nötropeni, anemi, trombositopeni, mukozit, duyusal polinöropati ve döküntüyü içermektedir. Doz aşımının beklenen komplikasyonları kendininötropeni, trombositopeni ve anemi ile belli eden kemik iliği baskılanmasıdır. Ayrıca ateş ilebirlikte veya ateş olmaksızın enfeksiyon, diyare ve/veya mukozit görülebilir. Doz aşımındanşüphelenildiğinde, hastalar kan sayımı ile izlenmeli ve gereken destek tedaviler uygulanmalıdır.Pemetrekset doz aşımında kalsiyum folinat/folinik asit kullanımı düşünülmelidir.
5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özellikler
14
Farmakoterapötik grubu : Folik asit analogları
ATC kodu : L01BA04
WELM (pemetrekset) etkisini, hücre çoğalması için temel oluşturan folata bağımlı metabolik süreçleri bozmak suretiyle gösteren çok hedefli, antikanser, antifolat bir ajandır.
In vitrode novo
biyosentezi için folata bağımlı önemli enzimler olan timidilat sentaz (TS), dihidrofolat redüktaz (DHFR) veglisinamid ribonükleotid formiltransferazı (GARFT) inhibe etmek suretiyle çok-hedefli birantifolat olduğunu göstermiştir. Pemetrekset, indirgenmiş folat taşıyıcı ve membran folatbağlayıcı protein taşıma sistemlerinin her ikisi tarafından hücre içine taşınmaktadır. Hücre içinegirdiğinde pemetrekset, folilpoliglutamat sentetaz enzimi tarafından hızla ve etkin bir şekildepoliglutamat formlarına dönüştürülür. Poliglutamat formları hücre içinde tutulur ve daha dakuvvetli TS ve GARFT inhibitörleridirler. Poliglutamasyon, tümör hücrelerinde ve daha azolarak da normal dokularda meydana gelen, zaman ve konsantrasyona bağımlı bir süreçtir.Poliglutamata dönüştürülmüş metabolitlerin hücre içi yarılanma ömrü artmış olup, bu da malignhücrelerde ilaç etkisinin daha uzun sürmesini sağlamaktadır.
Klinik Etkililik:
Mezotelyoma:
Malign plevral mezotelyomalı, daha önce kemoterapi almamış hastalarda, pemetrekset ve sisplatin kombinasyonuna karşılık sisplatinin karşılaştırıldığı çok merkezli, randomize, tek kör,Faz 3 çalışması (EMPHACIS), pemetrekset+sisplatin kombinasyonu ile tedavi edilen hastalarınyalnızca sisplatin verilen hastalara kıyasla klinik olarak anlamlı 2,8 aylık bir medyan sağkalımavantajına sahip olduklarını göstermiştir.
Çalışma sırasında toksisiteyi düşürmek için hastaların tedavisine düşük dozda folik asit ve B12 vitamini eklenmiştir. Bu çalışmanın primer analizi, randomize olarak bir tedavi grubuna ayrılanve çalışma ilacı verilen (randomize olan ve tedavi edilen) tüm hasta popülasyonundagerçekleştirilmiştir. Çalışma tedavisi süresince folik asit ve B12 vitamini desteği alan hastalardaalt grup analizi gerçekleştirilmiştir. Bu etkililik analizlerinin sonuçları aşağıdaki tablodaözetlenmiştir:
Malign plevral mezotelyomada pemetrekset - sisplatin kombinasyonuna karşılık sisplatin etkililiği
15
|
Randomize ve tedavi edilmiş hastalar |
Tam takviye almış hastalar |
|
Etkililik parametresi
|
Pemetrekset /Sisplatin (N=226)
|
Sisplatin
(N=222)
|
Pemetrekset /Sisplatin (N=168)
|
Sisplatin (N=163)
|
Medyan genel sağkalım (ay) (GA %95)
|
12,1
(10,0-14,4)
|
9,3
(7,8-10,7)
|
13,3
(11,4-14,9)
|
10,0
(8,4-11,9)
|
|
Log Rank p-değeri*
|
0,020
|
0,051
|
|
Tümör progresyonuna kadaı geçen medyan süre (ay) (GA%95)
|
5,7
(4,9-6,5)
|
3,9
(2,8-4,4)
|
6,1
(5,3-7,0)
|
3,9
(2,8-4,5)
|
|
Log Rank p-değeri*
|
0,001
|
0,008
|
|
Tedavi başarısızlığına kadaı geçen süre (ay) (GA %95)
|
4,5
(3,9-4,9)
|
2,7
(2,1-2,9)
|
4,7
(4,3-5,6)
|
2,7
(2,2-3,1)
|
|
Log Rank p-değeri*
|
0,001
|
0,001
|
|
Genel yanıt oranı** (GA %95)
|
% 41,3 (34,8-48,1)
|
%16,7
(12,0-22,2)
|
%45,5
(37,8-53,4)
|
%19,6
(13,8-26,6)
|
|
Fisher kesin p-değeri*
|
<0,001
|
<0,001
|
|
Kısaltmalar: GA=güven aralığı
*p-değeri kollar arasında karşılaştırmayı gösterir
** Pemetrekset/sisplatin kolunda, randomize ve tedavi edilmiş (N=225) ve tam takviye almış (N=167)
|
Tek başına sisplatin koluna (218 hasta) kıyasla pemetrekset/sisplatin kolunda (212 hasta) Akciğer Kanseri Semptom Ölçeği (Lung Cancer Symptom Scale) kullanılarak, malign plevralmezotelyoma ile ilişkili klinik olarak önemli semptomlarda (ağrı ve dispne) istatistiksel olarakanlamlı bir iyileşme gözlenmiştir. Pulmoner fonksiyon testlerinde de istatistiksel olarak anlamlıiyileşmeler gözlenmiştir. Tedavi kolları arasındaki ayrım, pemetrekset/sisplatin kolundaakciğer fonksiyonunda iyileşme ve kontrol kolunda ise zaman içinde akciğer fonksiyonundakötüleşme ile gösterilmiştir.
Yalnız pemetrekset ile tedavi edilen malign mezotelyomalı hastalara ait çok sınırlı veri bulunmaktadır. Pemetrekset 500 mg/m2 dozunda malign plevral mezotelyomalı 64 daha öncekemoterapi almamış hastada tek ajan olarak çalışılmıştır. Tüm cevap oranı %14.1'dir.
İkinci basamak küçük hücreli dışı akciğer kanseri:
Lokal olarak ilerlemiş veya metastatik küçük hücreli dışı akciğer kanseri hastalarında, daha önce alınan kemoterapi sonrasında pemetrekset ile dosetakselin karşılaştırıldığı çok merkezli,randomize, açık etiketli faz 3 çalışma sonuçlarında medyan sağkalım süresi pemetrekset iletedavi edilen hastalarda 8,3 ay (tedavi denenen popülasyon (ITT) n=283), dosetaksel ile tedaviedilen hastalarda 7,9 ay (ITT n=288)'dır. Önceki kemoterapiler pemetrekset içermemektedir.KHDAK histolojisine göre tedavinin genel sağkalım üzerindeki etkisi ile ilgili bir analiz, baskınolarak skuamöz hücreli karsinom histolojisine sahip olanlar dışındaki KHDAK hastalarında,dosetaksele karşı pemetreksetin istatistiksel olarak anlamlı düzeyde üstün olduğunu gösterirken(399 hasta, 9,3 aya karşılık, 8,0 ay düzeltilmiş HR=0,78; %95 GA=0,61-1,00, p=0,047),skuamöz hücreli karsinom histolojisine sahip hastalarda ise dosetaksel lehinedir (172 hasta, 7,4aya karşılık 6,2 ay, düzeltilmiş HR=1,56; %95 GA=1,08-2,26, p=0,018). Histolojik alt gruplararasında pemetreksetin güvenlilik profili açısından klinik olarak önemli hiçbir farkgözlenmemiştir.
Ayrı bir randomize, Faz 3, kontrollü çalışmadan elde edilen sınırlı klinik veriler pemetreksete yönelik etkililik verilerinin (genel sağkalım, progresyonsuz sağkalım) daha önce dosetaksel iletedavi edilen hastalar (n=41) ve daha önce dosetaksel tedavisi almayan hastalar (n=540)arasında benzer olduğunu göstermektedir.
16
KHDAK'inde pemetreksetin dosetaksele karşı etkililiği - ITT popülasyonu
|
|
Pemetrekset |
Dosetaksel |
Sağkalım süresi (ay) |
(n=283)
|
(n=288)
|
Medyan (m)
|
8,3
|
7,9
|
Medyan için GA %95
|
(7,0-9,4)
|
(6,3-9,2)
|
HR
|
|
|
HR için GA %95
|
|
0,99
|
Daha az etkili olmama (non-inferiority) sınırı p-
|
(0,82-1,20)
|
|
değeri (HR)
|
|
0,226
|
Progresyonsuz sağkalım (ay) |
(n=283)
|
(n=288)
|
Medyan
|
2,9
|
2,9
|
HR (GA %95)
|
|
|
|
0,97 (0,82-1,16)
|
Tedavi başarısızlığına dek geçen süre (TTTF-ay) |
(n=283)
|
(n=288)
|
Medyan
|
2,3
|
2,1
|
HR (GA %95)
|
|
|
|
0,84 (0,71-,997)
|
Yanıt (n: yanıt için uygun) |
(n=264)
|
(n=274)
|
Yanıt oranı (%) (GA %95)
|
9,1 (5,9-13,2)
|
8,8 (5,7-12,8)
|
Stabil hastalık (%)
|
45,8
|
46,4
|
|
|
Kısaltmalar: GA=güven aralığı HR=tehlike oranı ITT=tedavi denenen popülasyon n=toplam popülasyon büyüklüğü
|
Birinci basamak küçük hücreli dışı akciğer kanseri:
Daha önce kemoterapi almamış, lokal olarak ilerlemiş veya metastatik (Evre IIIb veya IV) KHDAK hastalarında yapılan çok merkezli, randomize, açık etiketli bir Faz 3 çalışmasındapemetrekset artı sisplatin tedavisini gemsitabin artı sisplatin tedavisi ile karşılaştırılmış vepemetrekset artı sisplatinin ITT popülasyonunda (862 hasta) primer sonlanım noktasınıkarşılayarak genel sağkalım açısından gemsitabin artı sisplatin ile benzer klinik etkinlikgösterdiği belirlenmiştir. Bu çalışmaya alınan tüm hastaların ECOG (The Eastern CooperativeOncology Group-Doğu Kooperatif Onkoloji Grubu) performans durumu 0 veya 1'dir.
Primer etkililik analizi, ITT popülasyonuna dayalıdır. Ayrıca ana etkililik sonlanım noktalarının duyarlılık analizleri Protokole Uygun (PQ) popülasyonda değerlendirilmiştir. PQ popülasyonukullanılarak yapılan etkililik analizleri ITT popülasyonuna yönelik analizlerle tutarlıdır vepemetrekset/sisplatin (AC) etkinliğinin gemsitabin/sisplatin (GC)'den az olmadığınıdesteklemektedir.
Progresyonsuz sağkalım (PFS) ve genel yanıt oranı tedavi gruplarında benzer olmuştur: Medyan PFS pemetrekset artı sisplatin için 4,8 ay iken gemsitabin artı sisplatin için 5,1 ay(düzeltilmiş HR 1,04; %95 GA 0,94-1,15), genel yanıt oranı pemetrekset artı sisplatin için%30,6 (%95 GA 27,3-33,9) iken gemsitabin artı sisplatin için %28,2'dir (%95 GA=25,0-31,4).PFS verileri bağımsız bir değerlendirme ile kısmen doanmıştır (1.725 hastadan 400'üdeğerlendirme için rastgele seçilmiştir).
KHDAK histolojisinin genel sağkalım üzerindeki etkisi ile ilgili analiz histolojiye göre klinik olarak farklılıklar göstermektedir, bakınız aşağıdaki tablo.
KHDAK'nin Birinci Basamak Tedavisinde Pemetrekset + Sisplatin ile Gemsitabin + Sisplatinin Etkililiklerinin Karşılaştırması - IIT Popülasyonu ve Histolojik Alt Gruplar
17
IIT Popülasyon ve Histolojik AltGruplar |
Ay Olarak Medyan Genel Sağkalım (GA %95) |
Düzeltilmiş Tehlike Oranı |
Üstünlük için |
Pemetrekset + Sisplatin |
Gemsitabin + Sisplatin |
(HR)
(GA %95) |
p değeri |
|
IIT Popülasyon
|
10,3
|
N=862
|
10,3
|
N=863
|
0,94a
|
0,259
|
|
(N=1725)
|
(9,8-11,2)
|
(9,6-10,9)
|
(0,84-1,05)
|
|
Adenokarsinom
|
12,6
|
N=436
|
10,9
|
N=411
|
0,84
|
0,033
|
|
(N=847)
|
(10,7-13,6)
|
(10,2-11,9)
|
(0,71-0,99)
|
|
Büyük Hücreli
|
10,4
|
N=76
|
6,7
|
N=77
|
0,67
|
0,027
|
|
(N=153)
|
(8,6- 14,1)
|
(5,5- 9,0)
|
(0,48-0,96)
|
|
Diğer
|
8,6
|
Z
II
o
o
|
9,2
|
\o
"-t
II
Z
|
1,08
|
0,586
|
|
(N=252)
|
(6,8- 10,2)
|
(8,1- 10,6)
|
(0,81-1,45)
|
|
Skuamöz Hücreli
|
9,4
|
N=244
|
10,8
|
N=229
|
1,23
|
0,050
|
|
(N=473)
|
(8,4- 10,2)
|
(9,5- 12,1)
|
(1,00-1,51)
|
|
Kısaltmalar: GA = güven aralığı; ITT = tedavi denenen popülasyon N = toplam popülasyon büyüklüğü a HR oranı için tüm güven aralığı 1,17645'den daha az etkili olmama sınınnın oldukça altında olacak şekilde,daha az etkili olmama sınırı için istatistiksel olarak anlamlılık vardır. (p<0,0001)
|
Histolojiye Göre Genel Sağkalım İçin Kaplan Meier Eğrileri
|
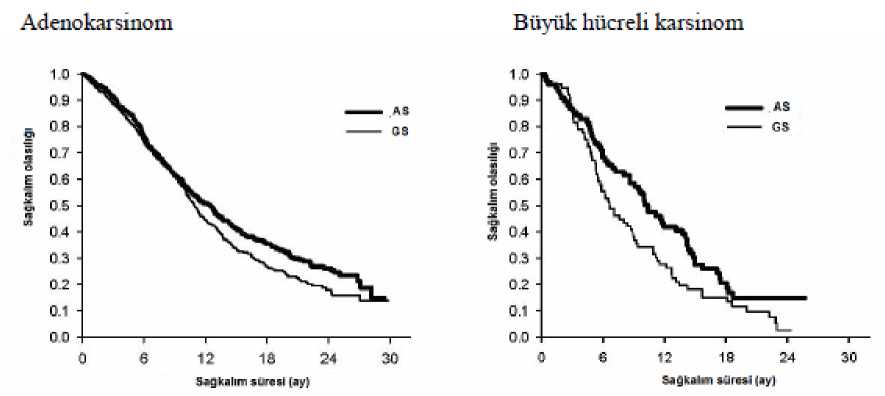 |
Histoloji alt gruplarında pemetrekset artı sisplatinin güvenlilik profilinde klinik olarak ilişkili bir farklılık gözlenmemiştir.
Pemetrekset artı sisplatin ile tedavi edilen hastalarda daha az transfüzyon (%28,9'a karşılık %16,4, p<0,001), eritrosit transfüzyonu (%27,3'e karşılık %16,1, p<0,001) ve trombosittransfüzyonu (%4,5'e karşılık %1,8, p=0,002) gerekmiştir. Ayrıca bu hastalara daha azeritropoietin/darbopoietin (%18,1'e karşılık %10,4, p<0,001), G-CSF/GM-CSF (%6,1'e karşılık%3,1, p=0,004) ve demir preperatı (%7,0'a karşılık %4,3, p=0,021) verilmesi gerekmiştir.
KHDAK, idame tedavisi:
JMEN
Gemsitabin, paklitaksel veya dosetaksel ile kombine sisplatin veya karboplatin içeren birinci basamak 4 kür ikili tedaviden sonra progrese olmayan lokal ileri (Evre IIIB) veya metastatik(Evre IV) KHDAK hastalarında pemetrekset artı en iyi destekleyici bakım (BSC) (n=441) ileplasebo artı BSC (n=222) idame tedavisinin etkililiğini ve güvenliliğini karşılaştıran çokmerkezli, randomize, çift kör, plasebo kontrollü Faz 3 çalışmadır (JMEN). Pemetrekset içeren
Bu belse, güvenli elektronik imza*ile imzalanmıştır.!
miştir. Bu çalışmaya dahil edilen tüm
I akrp Adresi:nupr \vww.rıifkıyc.gov.tr sagliK-lucl'-cnysbiuri£ncaiKobıasamakâkilkledâvlkı,uri£ncaiKobıasamakâkilkledâvlkı,
il edi
Belge Do
18
hastaların ECOG performans durumu 0 veya 1'dir. Hastalar, hastalık ilerleyene kadar idame tedavisi almıştır. Etkililik ve güvenlilik randomizasyon tarihinden birinci basamak (indüksiyon)tedavi tamamlanana kadar ölçülmüştür. Hastalar, pemetrekset ile medyan 5 kür, plasebo ilemedyan 3.5 kür idame tedavisi görmüştür. Toplam 213 hasta (%48,3) >6 kür, toplam 103 hasta(%23,4) >10 kür pemetrekset tedavisini tamamlamıştır.
Çalışma primer sonlanım noktasını karşılamış ve pemetrekset kolunda plasebo koluna göre PFS açısından istatistiksel olarak anlamlı bir iyileşme göstermiştir (n=581, bağımsız olarakincelenen popülasyon; sırasıyla medyan 4,0 ay ve 2,0 ay) (HR=0,60, %95 GA=0,49-0,73, p<0,00001). Hasta taramalarının bağımsız incelemesi araştırmacının PFS değerlendirmesibulgularını doamıştır. Genel popülasyon için medyan OS (Overall Survival-GenelSağkalım) (n=663), pemetrekset kolunda 13,4 ay ve plasebo kolunda 10,6 ay olmuştur;HR=0,79 (%95 GA=0,65-0,95, p=0,01192).
Diğer pemetrekset çalışmalarıyla tutarlı bir şekilde, JMEN'de de KHDAK histolojisine göre etkililik farkı gözlenmiştir. Ağırlıklı olarak skuamöz hücre histolojisi olanlar dışındakiKHDAK hastalarında (n=430, bağımsız olarak incelenen popülasyon) medyan PFS,pemetrekset kolu için 4,4 ay ve plasebo kolu için 1,8 ay olmuştur; HR=0,47 (%95 GA=0,37-0,60, p=0,00001). Ağırlıklı olarak skuamöz hücre histolojisi olanlar dışındaki KHDAKhastalarında medyan OS (n=481) pemetrekset kolu için 15,5 ay ve plasebo kolu için 10,3 ayolmuştur; HR=0,70 (%95 GA=0,56-0,88, p=0,002). Ağırlıklı olarak skuamöz hücre histolojisiolanlar dışındaki KHDAK hastalarında, indüksiyon fazı dahil medyan OS, pemetrekset koluiçin 18,6 ay ve plasebo kolu için 13,6 ay olmuştur; HR=0,71 (%95 GA=0,56-0,88, p=0,002).
Skuamöz hücre histolojisi olan hastalardaki PFS ve OS sonuçları pemetrekset için plaseboya göre herhangi bir avantaj göstermemiştir.
Histoloji alt gruplarında pemetreksetin güvenlilik profili açısından klinik olarak anlamlı bir fark gözlenmemiştir.
JMEN: Ağırlıklı olarak skuamöz hücre histolojisi olanlar dışındaki KHDAK hastalarında plaseboya göre pemetrekset ile progresyonsuz sağkalım (PFS) ve genel sağkalım içinKaplan Meier grafikleri:
19
Pıogresyoıısuz sağkalım
Genel sağkaiım
Pemetrekset
Plasebo
Pemetrekset
Plasebo
Ll
Sağkalım süresi
PFS siiıesi (ay)
PARAMOUNT
Birinci basamak 4 kür pemetrekset/sisplatin ikili tedavisinden sonra progrese olmayan skuamöz hücre histolojisi olanlar dışındaki lokal ileri (Evre IIIB) veya metastatik (Evre IV) KHDAKhastalarında pemetrekset artı BSC (n=359) ve plasebo artı BSC (n=180) idame tedavisininetkililiğini ve güvenliliğini karşılaştıran çok merkezli, randomize, çift kör, plasebo kontrollü birFaz 3 çalışmadır (PARAMOUNT). Pemetrekset artı sisplatin indüksiyonu ile tedavi edilen 939hastadan 539'u pemetrekset veya plasebo ile idame tedavisine randomize edilmiştir. Randomizeedilen hastaların %44,9'u pemetrekset artı sisplatin indüksiyonuna tam/kısmi yanıt verirken%51,9'u stabil hastalık yanıtı vermiştir. İdame tedavisine randomize edilen hastaların ECOGperformans durumu 0 veya 1'dir. Pemetrekset artı sisplatin indüksiyon tedavisininbaşlangıcından idame tedavisinin başlangıcına kadar geçen medyan süre hem pemetrekset hemde plasebo kolunda 2,96 ay olmuştur. Randomize edilen hastalar, hastalık ilerleyene kadaridame tedavisi almıştır. Etkililik ve güvenlilik randomizasyon tarihinden birinci basamak(indüksiyon) tedavi tamamlanana kadar ölçülmüştür. Hastalar, pemetrekset ve plasebo kolundamedyan 4 kür boyunca idame tedavisi görmüştür. Toplam 169 hasta (%47,1) pemetrekset ile>6 kür idame tedavisini tamamlamıştır, bu da pemetrekset için en az toplam 10 kürdür.
Çalışma primer sonlanım noktasını karşılamış ve pemetrekset kolunda plasebo koluna göre PFS açısından istatistiksel olarak anlamlı bir iyileşme göstermiştir (n=472, bağımsız olarakincelenen popülasyon; sırasıyla medyan 3,9 ay ve 2,6 ay) (HR=0,64, %95 GA=0,51-0,81,p=0,0002). Hasta taramalarının bağımsız incelemesi araştırmacının PFS değerlendirmesibulgularını doamıştır. Randomize edilen hastalarda, pemetrekset artı sisplatin birincibasamak indüksiyon tedavisinin başlangıcında ölçülen, araştırmacı tarafından değerlendirilenmedyan PFS, pemetrekset kolu için 6,9 ay ve plasebo kolu için 5,6 ay olmuştur (HR=0,59 %95GA=0,47-0,74).
Pemetrekset artı sisplatin indüksiyonunun ardından (4 kür), pemetrekset ile tedavi, OS açısından plaseboya göre istatistiksel olarak üstün olmuştur (medyan 13,9 ay ve 11,0 ay,HR=0,78, %95 GA=0,64-0,96, p=0,0195). Bu son sağkalım analizi sırasında, pemetreksetkolundaki hastaların %28,7'si hayattadır veya takip edilememiştir, bu oran plasebo kolunda%21,7 olmuştur. Pemetreksetin rölatif tedavi etkisi, alt gruplar arasında (hastalık evresi,indüksiyon yanıtı, ECOG PS, sigara içme durumu, cinsiyet, histoloji ve yaş dahil) tutarlı olup,ayarlanmamış OS ve PFS analizlerinde gözlenenlere benzer olmuştur. Pemetrekset grubundakihastalarda 1 yıllık ve 2 yıllık sağkalım oranları sırasıyla %58 ve %32 olup, plasebo grubundabu oranlar sırasıyla %45 ve %21 olmuştur. Pemetrekset artı sisplatin birinci basamakindüksiyon tedavisinin başlangıcında, hastalardaki medyan OS, pemetrekset kolu için 16,9 ayve plasebo kolu için 14,0 ay olmuştur (HR=0,78 %95 GA=0,64-0,96). Çalışma sonrası tedavi
Belge DtğöTeff hasta yüzdesFpemtfeiksefIİÇM'%<64),I,I3' ve plase&diçin%7t,Tsdfftww .turkiye.gov.tr/saglik-titck-ebys
20
PARAMOUNT: Skuamöz hücre histolojisi olanlar dışındaki KHDAK hastalarında plaseboya göre devam pemetrekset idamesi için PFS ve OS Kaplan Meier grafiği(randomizasyondan itibaren ölçülen)
Genel sağkahtıı
Progresyoıısuz sağkalım
Pemetrekset
Pemetrekset
>OÛ
[1
Plasebo
Plasebo
PFS süresi
S a akalım süresi
Pemetrekset idame tedavisinin JMEN ve PARAMOUNT çalışmalarında elde edilen güvenlilik profilleri benzerdir.
5.2. Farmakokinetik özelliklerGenel özellikler
Emilim:
Pemetreksetin farmakokinetik özellikleri, çeşitli solid tümörü bulunan 426 kanser hastasında tek ajan olarak 0,2-838 mg/m2 arası dozlarda, 10 dakikalık infüzyon sonrası değerlendirilmiştir.Pemetreksetin toplam eğri altı alanı (EAA) ve doruk plazma konsantrasyonu dozla doğruorantılı olarak artar. Pemetreksetin farmakokinetiği, tekrarlayan tedavi kürleri boyuncadeğişmemektedir.
Dağılım
:
Pemetreksetin kararlılık durumundaki dağılım hacmi 9 L/m2'dir.
İn vitro
çalışmalar, pemetreksetin yaklaşık %81 oranında plazma proteinlerine bağlandığını göstermiştir. Değişikevrelerdeki böbrek bozuklukları bu bağlanmayı anlamlı şekilde etkilememiştir.
Biyotransformasyon
:
Pemetrekset sınırlı hepatik metabolizmaya maruz kalır.
Eliminasyon
:
Pemetrekset esas olarak idrar ile atılmakta olup, uygulamayı takiben 24 saat içinde uygulanan dozun %70 ile %90 kadarı idrarda değişmemiş halde saptanmaktadır.
İn vitro
çalışmalarpemetreksetin organik anyon taşıyıcısı olan OAT3 tarafından aktif olarak sekrete edildiğinigöstermektedir. Pemetreksetin toplam sistemik klerensi 91,8 ml/dak ve normal böbrekfonksiyonlarına (kreatinin klerensi 90 ml/dak) sahip olan hastalarda plazmadan atılımyarılanma ömrü 3,5 saattir. Klerensteki hastalar arası değişkenlik %19,3 ile orta düzeydedir.
21
Pemetreksetin toplam eğri altı alanı (EAA) ve doruk plazma konsantrasyonu dozla doğru orantılı olarak artar. Pemetreksetin farmakokinetiği, tekrarlayan tedavi kürleri boyuncadeğişmemektedir.
Farmakokinetik/farmakodinamik ilişkiler
Pemetreksetin farmakokinetik özellikleri, eş zamanlı uygulanan sisplatinden etkilenmemektedir. Oral folik asit ve intramüsküler B12 vitamini takviyesi pemetreksetfarmakokinetiğini etkilememektedir.
5.3. Klinik öncesi güvenlilik verileri
Gebe farelere pemetrekset uygulanması, fötal yaşama kabiliyetinde düşüş, fötal ağırlıkta azalma, bazı iskelet yapılarının kemikleşmesinde tamamlanamama ve yarık damak oluşmasıylasonuçlanmıştır.
Erkek farelere pemetrekset uygulanması, fertilite oranında azalma ve testiküler atrofi ile karakterize olan üreme toksisitesiyle sonuçlanmıştır. 9 ay boyunca intravenöz bolusenjeksiyonu yapılan av köpeklerinde gerçekleştirilen bir çalışmada testiküler bulgular(seminifer epitelyumun dejenerasyonu/nekrozu) gözlenmiştir. Bu bulgular, pemetreksetinerkek fertilitesini azaltabileceğini/erkek fertilitesine zarar verebileceğini göstermektedir. Dişifertilitesi araştırılmamıştır.
Çin hamsteri over hücrelerinde yapılan
in vitroin vivo
mikronükleustestinde pemetreksetin klastojenik olduğu gösterilmiştir.
Pemetreksetin karsinojenik potansiyelini değerlendiren çalışma yapılmamıştır.
6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesi
Mannitol (E421)
Hidroklorik asit Sodyum hidroksit
6.2. Geçimsizlikler
Pemetrekset, laktatlı Ringer enjeksiyonu ve Ringer enjeksiyonu dahil kalsiyum içeren tüm seyrelticiler ile fiziksel olarak geçimsizdir. Pemetreksetin diğer ilaçlar ve seyrelticiler ile diğergeçimlilik çalışmaları olmadığından, bu tıbbi ürün diğer tıbbi ürünler ile karıştırılmamalıdır.
6.3. Raf ömrü
Açılmamış flakon: 36 ay
Sulandırılmış infüzyon çözeltileri:
Tarif edildiği şekilde sulandırılan WELM infüzyon çözeltileri antibakteriyel koruyucu içermemektedir. Ürünün %0.9'luk sodyum klorür çözeltisi ile rekonstitüsyonu sonrası eldeedilen rekonstitüye çözeltisi 25 °C'nin altındaki oda sıcaklığı ve 5 ± 3 °C koşullarında 24 saat
22
fiziksel, kimyasal ve mikrobiyolojik olarak stabildir. Mikrobiyolojik açıdan ürün hemen kullanılmalıdır. Eğer hemen kullanılmazsa atılmalıdır.
6.4. Saklamaya yönelik özel tedbirler
Açılmamış flakon:
25°C altındaki oda sıcaklığında saklayınız.
Sulandırılmış infüzyon çözeltileri:
Sulandırılmış tıbbi ürünlerin saklama koşulları için Bkz. Bölüm 6.3.
6.5. Ambalajın niteliği ve içeriği
Kauçuk tıpa ve aluminyum kapak ile kapatılmış şeffaf 50 ml'lik Tip I cam flakonda 500 mg pemetrekset içeren liyofilize toz bulunur. 1 flakonluk ambalajda kullanma talimatı ile birliktepiyasaya sunulmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi atıkların kontrolü yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmeliklerine uygun olarak imha edilmelidir.
1. Pemetreksetin intravenöz infüzyon uygulaması için sulandırılması ve daha fazlaseyreltilmesi sırasında uygun aseptik teknikleri kullanınız.
2. Gerekli olan doz ve WELM flakon sayısını hesaplayınız. Her flakon, etikette belirtilenmiktarın rahatça çekilebilmesi için bir miktar fazla pemetrekset içermektedir.
3. Her bir 10 ml'lik flakon ise 4.2 ml 9 mg/ml (%0.9'luk) koruyucusuz sodyum klorürenjeksiyonluk çözeltisi ile sulandırılarak 25 mg/ml pemetrekset içeren bir çözelti eldeedilir. Toz tamamen çözünene kadar flakonları hafifçe çeviriniz. Son çözelti berrak ve ürünkalitesi üzerinde olumsuz etkisi olmaksızın renksiz-sarı veya yeşil-sarı arasında renklidir.Hazırlanmış çözeltinin pH'ı 6.6-7.8 arasındadır. Daha fazla seyreltme gereklidir.
4. Hazırlanan pemetrekset çözeltisinin uygun hacmi, 9 mg/ml (%0.9'luk) koruyucusuzsodyum klorür enjeksiyonluk çözeltisi ile 100 ml'ye seyreltilmelidir ve 10 dakika süreyleintravenöz infüzyon şeklinde uygulanmalıdır.
5. Parenteral ilaç ürünleri uygulamadan önce partikül içeriği ve renk bozuklukları açısındangörsel olarak kontrol edilmelidir. Eğer partikül içeriği madde gözlenirse,uygulanmamalıdır.
6. Pemetrekset çözeltileri tek kullanım içindir. Kullanılmamış olan ürünler ya da atıkmateryaller, "Tıbbi Atıkların Kontrol Yönetmeliği" ve 'Ambalaj ve Ambalaj AtıklarınınKontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir.
Hazırlama ve uygulama önlemleri:
Diğer potansiyel olarak toksik antikanser ajanlarda olduğu gibi, pemetrekset infüzyon çözeltilerinin hazırlanması ve kullanımında dikkatliolunmalıdır. Eldiven kullanılması önerilir. Eğer pemetrekset çözeltisi cilt ile temas ederse, cilthemen sabun ve suyla iyice yıkanmalıdır. Eğer pemetrekset çözeltisi mukoz membranlar iletemas ederse su püskürtülerek iyice yıkanmalıdır. Pemetrekset, vezikan bir madde değildir.Pemetreksetin ekstravazasyonu için spesifik bir antidot bulunmamaktadır. Pemetreksetekstravazasyonu için bildirilen birkaç vaka, araştırıcı tarafından ciddi olarak
23
değerlendirilmemiştir. Ekstravazasyon için diğer non-vezikanlarda olduğu gibi yerel standart pratikler uygulanmalıdır.
7. RUHSAT SAHİBİ
Abdi İbrahim İlaç San. ve Tic. A.Ş.
Reşitpaşa Mah. Eski Büyükdere Cad. No:4 34467 Maslak / Sarıyer / İstanbulTel: (0212) 366 84 00Faks: (0212) 276 20 20
8. RUHSAT NUMARASI
2021/392
9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: 27.10.2021
Ruhsat yenileme tarihi:
10. KÜB'ÜN YENİLENME TARİHİ
24
1
2
3
4
|
|
