Leunase Enjektabl 10.000 IU Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Antineoplastik İlaçlar (Kanser İlaçları) » Diğer Kanser İlaçları » Diğer Antineoplastik (Kanser) İlaçlar » LAsparaginaz KISA URUN BILGISI1. BEŞERİ TIBBİ ÜRÜNÜN ADILEUNASEEnjektabl 10.000 lU Steril, apirojeıı2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Yardımcı madde(ler):Yardımcı maddeler için 6. Te bakımz.3. FARMASÖTİK FORMKullanılmadan önce rekonstitüe edilen liyofılize toz.Beyaz toz veya hafif porlu kütle (Liyofılize preparat) Bu ürün 6.5-7.5 pH değeri ve 0.02 ozmotik basınç değeri gösterir [1 mİ enjeksiyonluk su ile rekonsistüsyonun ardından (JP)]. 0 4. KLİiNİK ÖZELLİKLER 4.1. TerapÖtik endikasyonlarLEUNASE, L-Asparoginaz çoklu kemoterapi şemalarının bir bileşeni olarak çocuk ve erişkinde akut lenfoblastik lösemi (kronik miyeloid löseminin lenfoblastik dönüşümü dalıil) ve çocuklarda non-Hodgkin lenfomanın tedavisinde eııdikedir.4.2.Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:Normal dozaj, 50-200 lU/kg her gün veya günaşırı uygulanır. Uygulanan doz hastanın yaşına ve durumuna göre ayarlanabilir.Uygulama şekli:Damla infüzyon şeklinde intravenöz yolla uygulanır.Hazırlama talimatları için, Bölüm 6.6'ya bakınız. Özel popülasyonlara ilişkin ek bilgiler:A Böbrek/Karaciğer yetmezliği:^ Böbrek ve kai'aciğer yetmezliğinde doz ayarı çok dikkatli yapılmalı ve hastalar LELTMASE iletedavi süresince sürekli gözetim altında bulundurulmalıdır. Pediyatrik popülasyon:Çocuklarda kullanımında advers reaksiyonlar artabileceğinden, uygulama sırasında uygun önlemler alımnalı ve çok dikkatle uygulanmalıdır.Geriyatrik popülasyon:Yaşlı hastaların fizyolojik fonksiyonları azaldığından ve bu nedenle özellikle karaciğer hastalıklarından şüphelenilmesi durumunda, yaşlı hastalara uygulama, LEUNASE'm dozu ve hastanın durumu göz önünde bulundurularak çok dikkatli şekilde yapılmalıdır.4.3. Kontrendikasyonlart LEUNASE'm etkin maddesi olan L-Asparaginaz'a ya da ürün içeriğindeki herhangi bir bileşiğe karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir. Panki'eas iltihabı olaıı veya geçmişinde paııki'eas iltihabı geçirmiş olaıı hastalarda (pankreas iltihabında alevlenme veya nüksetme olabilir) kullanılmamalıdır. 4.4. Özei kullanım uyanları ve önlemleriL-asparaginaz tedavisi boyunca aşağıdaki hayatı tehdit eden durumlar ortaya çıkabilir:- Anafılaksi, - insülin ile tedavi edilebilecek hiperglisemik durumlar, - Kanama riskini azaltmak için taze plazma ile potansiyel ikame gerektiren pıhtılaşma bozuklukları. Bu ürün aşağıda belirtilen durumlarda dikkatli bir şekilde uygulanmalıdır; Karaciğer fonksiyon bozukluğu olan hastalai' (Hiperammonyemi meydana gelmesinden sorumludur.) Böbrek fonksiyon bozukluğu olan hastalar (Azotemi meydana gelebilir) Kemik iliği depresyonu olan hastalar (Kemik iliği depresyonu şiddetlenebilir) Enfeksiyonlu hastalar (Kemik iliği depresyonu sonucu enfeksiyon kötüleşebilir.) ^ Varicellalı hastalar (ölümcül sistemik bozukluklar meydana gelebilir) Hamileler ve emziren anneler Serebral hemoraji, serebral enl'arktüs ve pulmoner hemoraji gibi çeşitli pıhtılaşma bozukluklai'i oluşabileceğinden hastalai' tedavi süresince sık sık tekrarlanacak fıbrinojen, plazminojen, AT-III, protein C vb. testleri ile gözlem altında tutulmalı ve herhangi bir anormallik tespit edilmesi durumunda gerekli önlemler alınmalı, tedaviye ara verilmeli ya da durdurulmalıdır. Ciddi akut pankreas iltihabı oluşabileceğinden, hastalar tedavi süresince dikkatle izlenmeli; karın ağrısı, kusma ve amilaz da dahil olmak üzere pankreas enzimlerinde artış gibi belirtiler görülmesi halinde tedaviye son verilmeli ve uygun önlemler alınmalıdır. Ciddi diyabet de oluşabileceğinden, tedavi süresince hastalar dikkatle incelemneli ve susuzluk, polidipsi ve poliüri gibi belirtiler gözlenmesi halinde tedaviye ara verilmeli veya durdurulmalı ve uygun önlemler alımııalıdır. A Kemik iliği depresyonu gibi ciddi advers reaksiyonlar ortaya çıkabileceğinden, periyodik olarak yapılacak laboratuvar testleri ile (kan testi, karaciğer fonksiyon testi ve böbrek fonksiyon testi, vb) hastanın durumu gözlem altında tutulmalıdır. Herhangi bir anormallik görülmesi halinde, tedaviye ara verilmesi gibi uygun önlemler alınmalıdır. Ek olarak, ilacın uzun süreli kullanımı advers etkilerin şiddetinin aılmasma neden olabileceğinden, LEUNASE uygulaması dikkatli yapılmalıdır. Enfeksiyon oluşumu ya da kanama eğiliminde artışa karşı özel dikkat gösterilmelidir. LEUNASE, irritasyona neden olabileceği için dikkatle hazırlanmalı, deri ve ınukoz niembranlara temasından ve inlıalasyonundan kaçınılmalıdır. Temas halinde bol su ile en az 15 dakika süre ile yıkanmalıdır. LEUNASE, advers reaksiyonların ortaya çıkışına özel dikkat gösterilerek, çocuklarda dikkatle uygulanmalıdır. Çocuklardaki uygulama özellikle büyük bir dikkatle yapılmalı ve yan etkilere dikkat edilmelidir. LEUNASE'ın çocuklarda ve çocuk doğurma olasılığı buiunaiı hastalarda kullanıldığında, üreme üzerindeki potansiyel etkisi göz önünde bulundurulmalıdır. LEUNASE uygulandığında anafılaktik şok meydana getirebileceğinden, LEUNASE u>'gulamasından önce intradermal test önerilir. İntrademial test çözeltisinin hazırlanması: 1. LEUNASE 10.000 lU, 4 mİ enjeksiyonluk su ile rekonstitüe edilir. 2. Rekonstitüe edilen LEUNASE çözeltisi izotonik sodyum klorür çözeltisi ile 10 mİ'ye tamamlanır. 3. Sonra bu çözeltiden 0,1 mİ çekilir ve izotonik sodyum klorür ile 1 ml'ye tamamlanır (çözelti yaklaşık olarak 10 lU/ml etkin madde içerir). 4. Hazırlanan çözelti intrakütanoz olarak enjekte edilir. 5. Uygulandığı bölgede ağrı, kızarıklık ve enjeksiyon bölgesinde şişme gibi anormallik meydana gelip gelmediğinden emin olmak için hasta 15 ile 30 dakika gözlem altında tutulur. LEUNASE, rekonstitiüsyonun ai'dından derhal kullanılmalıdır. LEUTN'ASE uygulaması ağrı, kızarıklık ve enjeksiyon bölgesinde şişme gibi cilt reaksiyonlarına yol açabilir. Bu semptomların ortaya çıkması durumunda LEUNASE uygulaması derhal durdurulmalı ve gerekli önlemler alımTialıdır. LEUNASE'ın diğer L-asparaginaz preperatlai'indan daha yüksek potense sahip olduğu rapor edilmiştir. Bu nedenle diğer L-asparaginaz preparatlarmm uygulandığı tedavilerde kullanılan etkili dozlai' göz önünde bulundurularak LEUNASE'ın dozu belirlenmelidir, 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriVinhHslınL-Asparaginaz ile eşzamanlı olarak ya da hemen öncesinde yapılan vinkristin uygulaması, toksisite artışı ve anaflaktik reaksiyon riskinde artışla ilişkilendirilmiştir. PrednisonL-Asparaginaz ile eşzamanlı olarak prednison kullanılması pıhtılaşma değerlerinde değişme riskinde artışa neden olabilmektedir (örn. fıbrinojen ve ATTIII seviyelerinde düşme). Meloireksai. sitarabinMetotreksat ve sitarabin farklı yollarla etki gösterebilir; bu ilaçların öncesinde uygulanmasıyla L-Asparaginazın etkisinde sinerjik aılış meydana gelebilir. Sonrasında uygulamnasıyla ise bu etkin maddeler L-Asparaginazın etkisinde antagonist şekilde azalmaya yol açabilirler. GenelL-Asparaginaz, diğer ilaçların karaciğer fonksiyonu üzerindeki toksisite artışına neden olabilir. AnlikoagülanlarL-aspai'aginaz kullanılması, koagülasyon faktörlerinde dalgalaimiaya yol açabilir. Bu durum, kanama ve/veya tromboza eğilimi arttırabilir. Kumarin, vaifarin gibi aııtikoagülanlar ve dipiridamol, asetilsalisilik gibi non-steroid antienfianiatuvarlaı-ın L-asparaginaz iie eş zamanlı kullanılmasının gerektiği durumlarda çok dikkat edilmelidir. AşılamaKemoterapi ve altta yatan hastalık ile birlikte en çok kullanılan kombinasyonlar değerlendirildiğinde genel bir sonuç olarak, canlı aşılaıia aşılama ciddi enfeksiyon riskinde artışa neden olmaktadır. Bu nedenle canlı aşılar ile aşılama, lösemi tedavisinin tamamlamııasmın ai'dmdan en erken 3 ay sonra yapılmalıdır. Özel popülasyonlara ilişkin ek bilgilerMevcut veri bulunmamaktadır.Pediyatrik popülasyon:Hiçbir ilaç etkileşimi rapor edilmemiştir.4.6.Gebelik ve laktasyon Genel tavsiyeGebelik Kategorisi D'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Hamile olma olasılığı olan kadınlar bu ilacı kullanırken etkili bir doğum kontrol yöntemi kullamııalıdır. Bu ilacı kullanan kadınlar, kullanım bittikten sonra en az 3 ay hamile kalmaması konusunda uyarılmalıdır.Gebelik dönemiLEUNASE gebelik döneminde kullanılmamalıdır.Fare ve sıçanlarla yapılan hayvan çalışmalarında LEUNASE'ın, eksensefali, göğüs vertebra ve kaburgalarında anomali ve kemik oluşumunun gecikmesi şeklinde teratojenik etki göstermiştir. Laktasyon dönemiEmziren anneler tedavi boyunca emzirmeyi bırakmalıdır. Emziren annelerde LEUNASE'm güvenliliği kanıtlanmamıştır.Üreme yeteneği /FertiliteLEUNASE çocuk doğurma olasılığı bulunan kadınlarda kullanıldığında, üreme üzerindeki potansiyel etkisi göz önünde bulundurulmalıdır.4.7. Araç ve makine kullanımı üzerindeki etkilerLEUNASE belirtildiği şekilde kullanıldığında bile, bu tıbbi ürün araç ve makine kullanım yeteneğinin bozulduğu bir ölçüde, tepki olarak hastanın yeteneğini değiştirebilir. Bu alkol ile birlikte daha çok geçerlidir.4.8. İstenmeyen etkilerRapor edilen istenmeyen etkiler aşağıdaki sıklık derecesine göre listelenmiştir.Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Aşağıda listelenen advers reaksiyonlar meydana gelebilir. Hastalar tedavi sırasında dikkatli şekilde gözetim altında tutulmalı ve herhangi bir aıiomial durum ortaya çıkması dui'umunda uygulamaya ara verilmesi ya da durdurulması gibi uygun önlemler alınmalıdır. Enfeksiyonlar ve en fes tasy onlarBilimıiiyor: EnfeksiyonlarKan ve lenf sistemi hastalıklarıYaygın: Araştırılan üç hücre dizisinde de hafiften orta dereceye kadar kemik iliği baskılaııması. Protein sentezinin bozulmasından kaynaklanan koagülasyon bozuklukları: kanama, disemine intravasküler koagülasyon (DİK) ya da tromboz. Felç eğilimli imne, nöbetler, bilinç kaybı gibi serebrai belirtiler.Çok seyrek: Hemolitik anemi Bağışıklık sistemi hastalıklarıÇok yaygın: Allerjik reaksiyonlar (lokal eritem, ürtiker, nefes almanın zorlaşması gibi)Yaygın: Anaflaktik şok, bronkospazm Endokrin hastahklarıYaygın: Diyabetik ketoasidoz, hiperosmolar hiperglisemi ile birlikte pankreas fonksiyon bozukluğuÇok seyrek: Geçici sekoiıder hipotiroidizm, tiroksin bağlayan globülin azalması, hipoparatiroidizm Metabolizma ve beslenme hastalıklarıÇok yaygın: Kan lipid değerlerinde değişiklikler (öm: kolesterol yükselmesi ya da düşmesi, trigliseridlerin yükselmesi, VLDL (çok düşük yoğunluklu lipoprotein) fraksiyon artışı ya da LDL (düşük yoğunluklu lipoprotein) azalması, lipoprotein lipaz aktivitesinde artış) klinik semptomlar olmaksızın çoğu vakalarda; prerenal metabolik dengesizlik nedeniyle kan üre artışıYaygın olmayan: Kanda ürik asit değerinde yükselme (hiperürisemi), hiperammonyemi. Sinir sistemi hastalıklarıYaygın: Ajitasyon, depresyon, halüsinasyon, konfözyon ve somnolans (hafif bilinç bozukluğu) şeklinde MSS (merkezi sinir sistem) disfonksiyonu; muhtemel hiperammonyemiden dolayı EEG değişiklikleri (alfa dalga aktivitesinde azalma, teta ve delta dalga aktivitesinde artma).Seyrek: Komayı içeren, nöbetler ve ciddi bilinç bozuklukları oraya çıkabilir (Reversible Posterior Leukoenceplıalopathy Syndrome (RPLS)). Çok seyrek: Parmaklarda hafif titreme Gastrointestinal hastalıklarıÇok yaygın: İştalı kaybı, bulantı, kusma, abdominal ki'amplar, diyare ve kilo kaybı gibihafiften ona dereceye kadar gastrointestinal belirtiler Yaygın: Akut pankreatit, diyare ile birlikte görülen pankreas bozuklukları. Seyrek: Hemorajik ya da nekrolize pankreatit, parotit Çok seyrek: Pankreas psödokistleri, ölümle sonuçlanan pankreatit, akut parotitle eş zamanlı pankreatit Hepato-bilier hastalıklarıÇok yaygın: Kai'aciğer değerlerinde değişiklik (örn. alkalin fosfataz, serum transaminazları, amonyak, LDH ve serum bilirubin seviyelerinde yükselme), karaciğer yağlanması, hipoalbüminemi (ödemi de kapsayan)Seyrek: Kolestaz, sarılık, ölümle sonuçlanabılen kai'aciğer hücre nekrozu ve karaciğer yetmezliği. Deri ve deri altı doku hastalıklarıÇok yaygın: Ciltte aşırı duyarlılık reaksiyonlarıÇok seyrek: Bir vakada toksik epidermal nekroliz (Lyell's sendromu) Böbrek ve idrar yolu hastalıklarıYaygın: Akut böbrek yetmezliğiGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıÇok yaygın: Enjeksiyon bölgesinde ağrı, ödemYaygın: Vücut sıcaklığında yükselme, ağrı (sırt ağrısı, eklem ağrısı, abdominal ağrı) Seyrek: Yaşamı tehdit eden yüksek ateş (hiperpireksi) AraştırmalarYaygın: Kan amilazında yükselmeKlinik çalışma verileri ve Japonya'da ilaç kullanım sonuçlarının anket verileriRuhsatlandımia öncesinde LEUNASE ile tedavi edilen 188 hastanın 128'inde (% 68.1) laboratuvar verilerinde anormallikler de dahil olmak üzere advers reaksiyonlar rapor edilmiştir. Ruhsatlandımia öncesi, ruhsatlandırma aşaması ve 1 Mayıs 1976 arasındaki dönemde toplam 302 hasta incelemniştir. Rapor edilen başlıca advers reaksiyonlar: 103 hastada mide bulantısı (% 34.1), 89 hastada kusma (% 29.5), 63 hastada anoreksi (% 20.9), 43 hastada ateş (% 14.2), 96 hastanın 12'sinde hiperamonemi (%12.5) ve 6 hastada şok (% 2.0) görülmüştür.Klinik bakımdan önemli advers reaksiyonlarŞok veya anaflaktik semptomlar meydana gelebilir. Hastalar tedavi sırasında dikkatli şekilde gözetim altında tutularak ve ürtiker, anjiyödem, üşüme, kusma, dispne, bilinç bulanıklığı, konvülsiyon ve kan basıncının düşmesi gibi semptomlar gözlenmesi durumunda ilaç uygulaması derhal durdurularak ve uygun Önlemler alınmalıdır.Serebral hemoraji, serebral enfarktüs ve pulmoner hemoraji (fıbrinojen, plazmin, AT-III, protein C değerlerinde düşme) gibi ciddi pıhtılaşma bozuklukları gelişebilir. Hastalar tedavi süresince sıklıkla yapılacak testlerle gözlem altında tutulmalı ve herhangi bir anomali tespit edildiği taktirde, tedaviye ara verilmesi veya durdurulması gibi, gerekli önlemler alınmalıdır. Şiddetli akut pankreas iltihabı oluşabil inektedir. Tedavi süresince hastalar dikkatli şekilde gözetim altında tutulmalı; karın ağrısı, kusma ve amilaz da dahil olmak üzere pankreas enzimlerinde yükselme gibi belirtiler görülmesi halinde tedaviye durdurulmalı ve gerekli önlemler alımnalıdır. Pankreas endokrinopatisi nedeniyle diabetes mellitus (Langerhans adacıklarının inflamasyonu) da meydana gelebilir. Hastalar tedavi sırasında dikkatli şekilde gözetim altında tutulmalı ve susuzluk, polidipsi ve poliüri gözlenirse uygulamaya ara verilmeli ya da durdurulmalı ve uygun önlemler alımnalıdır. Bilinç bozukluğu ile birlikte hiperammonyemi meydana gelebilir. Hastalar sık yapılacak testlerle dikkatle incelenmeli ve eğer bir anomiallik gözlenirse, tedaviye ara verilmesi veya durdurulması gibi uygun önlemler alımnalıdır. Koma, bilinç bozukluğu ve dezoryantasyon gibi semptomlar oluşabilir. Hastalar dikkatle gözlemnelidir, eğer bir anonnallik gözlenirse, tedaviye ara verilmesi veya durdurulması gibi uygun önlemler alınmalıdır. Karaciğer yetmezliği gibi ciddi karaciğer hasarı meydana gelebilir. Hastalar karaciğer fonksiyon testiyle dikkatle izlenmelidir ve herhangi bir anormallik tespit edilmesi durumunda uygulama kesilmelidir ve uygun önlemler alınmalıdır. Ölümle sonuçlanan, geniş yayılımlı organik beyin bozukluğu rapor edilmiştir. 4.9. Doz aşımı ve tedavisiAşırı doz ile ilgili deneyim bulunmamaktadır. LEUNASE'ın özel bir antidotu yoktur. Doz aşımı durumunda semptomatik ve destek tedavisi uygulanmalıdır.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: L- Antineoplastik ve İmmünomodülatör Ajanlar ATC Kodu: L01XX02L-Asparaginaz, L-Asparagin hidrolizini L-aspartik asit ve amonyağa katalizler. Maksimum inhibisyon etki postmitotik G1 fazındadır. Tümör hücresindeki L-Aspai'agin seviyesinin düşmesi, L-Asparaginaz etki mekanizması olarak kabul edilmelidir. Asparaginaz uygulanmasının sonucu olarak, tümör hücresi için gerekli olan amino asit L-asparagin, giderek L-aspartik asit ve amonyağa dönüşür. Bunun sonucu olarak asparagin eksikliğine bağlı olai'ak bu hücrelerde protein sentezi durma noktasına gelir. Japonya'da 36 enstitüde ağırlıklı olarak hematopoietik organlarında tümör bulunan hastalar ile yüi'ütülen klinik çalışma sonuçları aşağıda özetlenmiştir. Vakalar Japon çoklu değerlendirme kriterleri tarafından akut lösemi ve malign lenfomada terapötik etkilerin tam reniisyon ve kısmi remisyon olarak verilen cevap şeklinde değerlendirilmiştir.
5.2.Farmakokinetik özellikler Genel özelliklerEmilim:L-Asparaginaz gastrointestinal sistemden emilmez, parenteral yolla verilir. Plazma seviyeleri doza bağlı olmakla birlikte, plazma yarılamrıa ömrü 8-30 saat arasmda değişir ve doz, yaş, cinsiyet, vücut yüzey alanı, böbrek ve kaıaciğer fonksiyonları ve hastalığın yayılımından bağımsızdır. L-Asparaginazın, lenfosarkoma hastalarında 11,000 lU (200 lU/ kg)Uuk dozda, birbirini izleyen 6 gün boyunca intravenöz uygulanması ile meydana gelen kan konsantrasyonu değişimleri aşağıda gösterilmiştir. :u/mL} 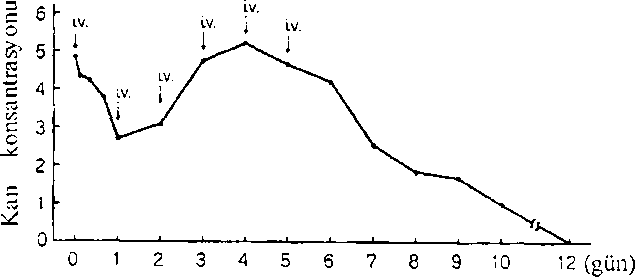
Dağılım:Sıçanlarda 2,500 lU/ kg L-Asparaginazın intravenöz uygulanmasından 15 dakika sonra en yüksek konsantrasyon karaciğerde, sonrasında sırasıyla dalak, akciğer, böbrek, mide, ve en son ince bağırsakta saptanmıştır. Arka arkaya 6 gün süre ile günde 200 lU/kg dozda intravenöz L-Asparaginaz uygulanan lenfomaİı hastalarda serum seviyeleri 4. günde maksimuma ulaşır ve 12. güne kadar gittikçe azalır. Verilen dozun % 20'si lenfatik sisteme geçer. Serebrospinal sıvıda plazmadakinin % Tinden daha az oranda bulunur. İdrarda sadece eser miktarda görülür. Bivotransformasvon:L-Asparaginaz vücutta asparaginaz enzimi ile aspartik asit ve amonyak' a dönüşür. Eliminasvon:Sıçanlarda L-Asparaginaz'm intravenöz olarak 50,000 ilal00,000 lU/kg'a kadar yüksek dozda uygulamııasından 24 saat som'a, uygulanan dozun sadece % 0.014 ila %0.032'si değişmemiş etkin madde olarak idrarda saptanmıştır. Düşük doz uygulamasından sonra idrarda etkin maddeye rastlanmamıştır.Dogrusallık/'doğrusal olmayan durum:Mevcut bilgi bulunmamaktadır. 5.3.Klinik öncesi güvenlilik verileriTek doz toksisitesi(LD50 mg / kg)Uygulama yolu Hayvan türleriIV(Intravenöz) ip(Intraperitoneal)SC(Subkutan)
210.0
240.0
95.7
Fai-e
36.1
36.
33.3 SıçanTekrarlı doz toksisitesiL-Asparaginazm sıçanlara Intraperitoneal yoldan 500 - 91.000 lU / kg dozlarında 6 ay süre ile uygulandığında, dozdan bağımsız olarak; çalışmanın başlangıç safhalarında beslenmede hızlı bir düşüş ve kilo almanın baskılandığı ve histolojik açıdan safra kesesinde konjesyon, ödem, yağ dejenerasyonu, karaciğerde ve böbrekle konjesyon, nefroz ve tesliste spenniogenez bozukluğu gözlenmiştir. TeratoienileL-Asparaginaz, fai'elere inlravenöz ve sıçanlara inlraperitoneal olarak 1000 lU/kg veya daha yüksek dozlarda uygulandığında, büyümenin baskılandığı, ölümcül sorpsiyon, beyin fıtığı, göğüs verlebra ve kaburgalarında anomali ve kemik oluşumunun gecikmesi şeklinde teralojenik etki göstermiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiBulunmamaktadır.6.2. GeçimsizliklerBu ürün başka ürünlerle karıştınlmamahdır.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler15°C'nin altında saklayınız (2-8 °C'de buzdolabında saklanması tavsiye edilir).6.5. Ambalajın niteliği ve içeriğiKarton kutuda, içinde 10.000 lU L-Asparaginaz bulunan, kauçuk tıpa ve Tıip off alüminyum kapak ile kapatılmış, saydam, tip I cam flakon şeklindedir.Her karton kutu bir flakon içermektedir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerHazırlama talimatları LEUNASE öncelikle, 2 ila 5 mİ enjeksiyonluk su ile rekonsitiüe edilir. Rekonstitüe çözelti, % 0.9 izotonik sodyum klorür çözeltisi ile 200 ila 500 ml'ye seyreltilir. Hazırlandıktan som*a hemen kullanılmalıdır. Rekonstitüsyon için enjeksiyonluk su yerine izotonik sodyum klorür çözeltisi kullanılmamalıdır; çünkü bu durum tuz açığa çıkışına bağlı olarak çözeltinin bulanıklaşmasına sebep olabilir. Kullanılmamış ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7.RUHSAT SAHİBİOnko İlaç Sanayi ve Ticaret A.Ş.Koşuyolu Cad. No: 34 34718Kadıköy - İSTANBUL Tel: (0216) 544 90 00 (Pbx)Faks: (0216) 545 59 99 8.RUHSAT NUMARASIİOİ/42^ 9.İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat laıihi: 02.07.1997Rulısat yenileme tarihi: 09.10.2001, 30.11.2010 İO.KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriLeunase Enjektabl 10.000 IUEtken Maddesi: L-Asparaginaz Atc Kodu: L01XX02 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.