Enzadre 40 Mg Yumuşak Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIENZADRE 40 mg yumuşak kapsül 2. KALİTATİF ve KANTİTATİF BİLEŞİMHer bir yumuşak kapsül: Etkin madde:Enzalutamid.........................................40 mg Yardımcı madde(ler):Sorbitol spesiyel..................................90,3 mg Yardımcı maddeler bölüm için 6.1 'e bakınız. 3. FARMASÖTİK FORMYumuşak kapsül Beyaz beyazımsı, boyu eninden uzun yumuşak kapsüller 4. KLİNİK ÖZELLİKLER4.1. Terapötik Endikasyonlar ENZADRE'nin, hormonal tedaviyle ve sonrasında dosetaksel temelli kemoterapiyleprogresyonun PSA ve radyolojik görüntüleme yöntemleriyle gösterildiği ve testosterondüzeyinin kastrasyon seviyesinde olduğu gösterilmiş olan, metastatik prostat kanserlihastalarda progresyona kadar kullanımı endikedir. ENZADRE'nin kastrasyona dirençli progresyonun PSA ve görüntüleme yöntemleriylegösterildiği ve testosteron düzeyi kastrasyon düzeyinde olan (<50 ng/dL), kemoterapininkontrendike, kemik iliği rezervi ileri derecede azalmış ve/veya diabetes mellitustanısı olanmetastatik prostat kanserli hastalarda progresyona kadar kullanımı endikedir. Daha önce abirateron kullanmış hastalarda ENZADRE kullanımı endike değildir. 4.2. Pozoloji ve kullanım şekliPozoloji/uygulama sıklığı ve süresi:Önerilen doz, oral olarak günde bir defada tek doz olarak alınan 160 mg (dört 40 mg kapsül) Enzalutamiddir. Cerrahi olarak kastre edilmemiş hastaların tedavisi sırasında LHRH analoğu ile medikal kastrasyona devam edilmelidir. Bir hasta ENZADRE' yi alması gereken zamanda almayı unutursa, reçete edilen dozun ilacın alınması gereken zamanına mümkün olan en yakın sürede alınması gerekmektedir. Birhastanın bir dozu almayı tüm gün unutması halinde, tedaviye normal günlük doz ile birsonraki gün bırakılan yerden devam edilmelidir. 1 / 24 Bir hasta grade 3 ve üzeri toksisite veya tolere edilemez bir advers reaksiyon yaşarsa, dozlama bir hafta süreyle veya semptomlar grade 2'ye ve/veya altına düzelene kadar durdurulmalıdırve sonrasında aynı dozda veya uygun görülürse, azaltılmış bir dozda (120 mg veya 80 mg)kaldığı yerden devam edilmelidir. Güçlü CYP2C8 inhibitörleri ile eşzamanlı kullanımıGüçlü CYP2C8 inhibitörlerinin eşzamanlı kullanımından mümkünse kaçınılmalıdır. Hastalara eşzamanlı güçlü bir CYP2C8 inhibitörü uygulanması zorunlu ise, Enzalutamid dozu günde birdefada 80 mg olacak şekilde düşürülmelidir. Güçlü CYP2C8 inhibitörü ile eşzamanlıuygulama sonlandırıldığında, Enzalutamid dozu güçlü CYP2C8 inhibitörüne başlamadanönceki doza geri döndürülmelidir (Bkz. Bölüm 4.5).Uygulama şekli:ENZADRE, oral kullanım içindir. Kapsüller su ile bütün olarak yutulmalıdır ve yiyeceklerle birlikte veya yiyeceklerden ayrı olarak alınabilir. Özel popülasyonlara ilişkin ek bilgiler Karaciğer yetmezliğiHafif, orta düzeyli veya ağır karaciğer yetmezliği (sırasıyla Child Pugh Sınıf A, B veya C) olan hastalarda herhangi bir doz ayarlamasına ihtiyaç yoktur. Bununla birlikte ağır karaciğeryetmezliği görülen hastalarda ilacın yarı ömründe bir artış gözlenmiştir. (Bkz. Bölüm 4.4 ve5.2).Böbrek yetmezliğiHafif veya orta şiddette böbrek yetmezliği olan hastalarda herhangi bir doz ayarlamasına ihtiyaç yoktur. Ağır böbrek yetmezliği olan veya son evre böbrek hastalığı olan hastalardadikkatli olunması tavsiye edilir (Bkz. Bölüm 4.4).Pediyatrik popülasyonENZADRE'nin çocuklarda kullanılması ile ilgili bir endikasyon yoktur. ENZADRE, dosetaksel tedavisi sırasında veya sonrasında progresyon gösteren, metastatik kastrasyona dirençli prostat kanseri olan erişkin erkeklerin tedavisinde endikedir. Geriyatrik popülasyonYaşlılarda herhangi bir doz ayarlaması yapılmasına ihtiyaç yoktur (Bkz. Bölüm 5.1 ve 5.2).4.3. Kontrendikasyonlar Etkin maddeye veya bölüm 6.1'de listelenen yardımcı maddelerin herhangi birine karşıaşırı duyarlılık. Hamile olan veya hamile kalma potansiyeli olan kadınlar (Bkz. Bölüm 4.6).2 / 24 4.4. Özel kullanım uyarıları ve önlemleriNöbet riskiENZADRE'nin nöbet öyküsü olan veya altta yatan beyin hasarını, inmeyi, primer beyin tümörlerini, beyin metastazlarını veya alkolizmi de içeren, ancak bunlarla sınırlı olmayannöbet için yatkınlığı arttırıcı diğer faktörlere sahip hastalara uygulanması halinde dikkatliolunmalıdır. Ayrıca nöbet riski, nöbet eşiğini düşüren tıbbi ürünleri eşzamanlı olarak alanhastalarda artabilir. Daha önce dosetaksel kullanmış hastaların dahil edildiği AFFIRM çalışmasında, Enzalutamid ile tedavi edilen 800 hastadan 7'sinde (%0,9) nöbet görülmüştür. Plasebo kolunda ise nöbetgeçiren hasta olmamıştır. Nöbet Enzalutamid başlandıktan 31 ile 603 gün sonra olmuştur.PREVAIL çalışmasında, Enzalutamid ile tedavi gören kemoterapi almamış 871 hastanın1'inde (%0,1), karşılaştırma kolundaki plasebo kullanan 844 hastanın 1'inde (%0,1) nöbetgörülmüştür. Nöbet geçiren hastalarda tedavi tamamen sonlandırılmış ve tüm nöbet vakalarıiyileşmiştir. Nöbet geçirmiş hastalara Enzalutamidin tekrar uygulandığı bir klinik çalışmatecrübesi yoktur. Nöbet için predispozan faktörlere sahip hastalar genellikle çalışmalardan hariç tutuldukları için sınırlı güvenlilik verisi mevcuttur. Bu hariç tutulma kriterlerine nöbet, bilinç kaybınınolduğu altta yatan bir beyin yaralanması, son 12 ay içinde geçici iskemik atak,serebrovasküler olay, beyin metastazları ve beyinde arteriovenöz malformasyon hikayesidahildir. CRPC-2 (AFFIRM) çalışmasında nöbet eşiğini düşüren ilaçların Enzalutamid ilebirlikte kullanılması bir hariç tutma kriteri iken, MCV3100-03 (PREVAIL) çalışmasında builaçların kullanımına izin verilmiştir. ENZADRE kullanımı ile ilişkili nöbet riski nedeniyle hastalara kendilerine veya başkalarına ciddi zarar verebilecek ani bilinç kaybına neden olabilme riski taşıyan aktivitelerdenkaçınmaları tavsiye edilmelidir. Tedavi sırasında nöbet geçiren hastalardan ENZADREtamamen kesilmelidir. Posterior Tersinir Ensefalopati SendromuEnzalutamid ile tedavi edilen hastalarda seyrek olarak posterior tersinir ensefalopati sendromu bildirilmiştir (Bkz. Bölüm 4.8).Posterior tersinir ensefalopati sendromu, hipertansiyonun eşlikettiği veya etmediği, hızla gelişen nöbet, baş ağrısı, konfüzyon ve diğer görsel ve nörolojikrahatsızlıklar gibi belirtileri içeren seyrek görülen, geri dönüşümlü, nörolojik bir bozukluktur.Posterior tersinir ensefalopati sendromunun tanısı tercihen manyetik rezonans görüntüleme ilebeynin görüntülenerek doğrulama gerektirir. Posterior tersinin ensefalopati sendromu gelişenhastalarda Enzalutamidin kesilmesi önerilir.Diğer tıbbi ürünlerle eşzamanlı kullanımEnzalutamid, güçlü bir enzim indükleyicisi olup, sıklıkla kullanılan birçok tıbbi ürünün etkinliğinin kaybolmasına yol açabilir (Bkz. Bölüm 4.5'te verilen örnekler).Bu nedenleEnzalutamid tedavisi başlatılırken, eşzamanlı kullanılan tıbbi ürünlerin gözden geçirilmesigerekmektedir. Enzalutamidin, terapötik etkilerinin hasta için büyük önem arz etmesi ve doz3 / 24 ayarlamalarının kolay bir şekilde etkililiğin veya plazma konsantrasyonlarının monitorizasyonuna dayalı olarak yapılamaması halinde, çoğu metabolize edici enzim veyataşıyıcıların duyarlı substratları olan tıbbi ürünlerle eşzamanlı kullanımından genel olarakkaçınılması gerekir (Bkz. Bölüm 4.5).Varfarin ve kumarin benzeri antikoagülanların eşzamanlı uygulamasından kaçınılmalıdır. ENZADRE'nin CYP2C9 tarafından metabolize edilen bir antikoagülan (varfarin veyaasenokumarol gibi) ile eşzamanlı uygulanması halinde, ilave Uluslararası NormalleştirilmişOran (INR) takibinin yapılması gereklidir (Bkz. Bölüm 4.5).Böbrek yetmezliğiAğır böbrek yetmezliği olan hastalarda dikkatli olunmalıdır, çünkü Enzalutamid bu hasta popülasyonunda henüz incelenmemiştir. Ağır karaciğer yetmezliğiMuhtemelen artan doku dağılımıyla bağlantılı olarak, ağır karaciğer yetmezliği görülen hastalarda ilacın yarı ömründe bir artış gözlenmiştir. Bu gözlemin klinik anlamlılığı halenbilinmemektedir. Bununla birlikte kararlı durum konsantrasyonlarına ulaşılması için gerekensürenin uzaması beklenmektedir ve yanı sıra maksimum farmakolojik etki başlangıcına veenzim indüksiyonu düşüşüne kadar geçen süre artabilir (bkz. Bölüm 4.5).NötropeniAFFIRM çalışmasında hastaların mutlak nötrofil sayısının > 1,500/mcL olması gerekli tutulmuştur. Bu durum, nötropenik hastalara ENZADRE reçete edilirken, göz önündebulundurulmalıdır. ENZADRE kullanmadan önce nötropeni düzeltilmelidir. Yakın zamanda geçirilmiş kardiyovasküler hastalıkFaz 3 çalışmalarında yakın zamanda geçirilmiş miyokard infarktüslü (son 6 ay içerisinde) veya stabil olmayan anjinalı (son 3 ay içerisinde), sol ventriküler ejeksiyon fraksiyonu(LVEF) > %45 olması dışında New York Kalp Derneği Sınıf (NYHA) III veya IV kalpyetmezliği olan, bradikardi veya kontrol edilemeyen hipertansiyon görülen hastalar hariçtutulmuşlardır. Hastalara Enzalutamid reçetelerken, bunun göz önünde bulundurulmasıgerekir. Androjen düşürme tedavisi QT aralığını uzatabilir. QT uzamasına yönelik risk faktörleri öyküsü veya QT uzaması öyküsü olan hastalarda ve eşzamanlı olarak QT aralığınıuzatabilecek tıbbi ürünleri (Bkz. Bölüm 4.5)Torsade de pointespotansiyeli de dahil olmak üzere yarar risk dengesinideğerlendirmelidir.Kemoterapi ile kullanımıEnzalutamidin sitotoksik kemoterapi ile eşzamanlı kullanımının güvenliliği ve etkililiği henüz belirlenmemiştir. Enzalutamidin birlikte uygulanmasının intravenöz dosetakselinfarmakokinetiği üzerinde klinik olarak anlamlı herhangi bir etkisi yoktur (Bkz. Bölüm 4.5);ancak, dosetaksele bağlı nötropeni oluşumunda artış olasılığı dışlanamaz.4 / 24 Hipersensitivite reaksiyonlarıEnzalutamid kullanımı ile dilde ödem, dudakta ödem ve faringeal ödem gibi ancak bunlarla sınırlı kalmayan semptomlarla kendini gösteren hipersensitivite reaksiyonları gözlenmiştir (Bkz. Bölüm 4.8).Yardımcı maddelerENZADRE sorbitol spesiyel içerir. Nadir kalıtımsal fruktoz intolerans problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDiğer tıbbi ürünlerin Enzalutamide maruziyeti etkileme potansiyeliCYP2C8 inhibitörleriCYP2C8, Enzalutamid eliminasyonunda ve aktif metabolitinin oluşmasında önemli bir rol oynamaktadır. Güçlü CYP2C8 inhibitörü gemfibrozilin (günde iki defa 600 mg) sağlıklı erkekgönüllülere oral uygulamasını takiben, Enzalutamid EAA değeri %326 oranında artışgöstermiş, öte yandan Enzalutamid Cmaks değeri %18 oranında düşmüştür. BağlanmamışEnzalutamid ve bağlanmamış aktif metabolitinin toplamı bakımından, EAA %77 artışgösterirken, Cmaks %19 düşmüştür. Enzalutamid tedavisi sırasında CYP2C8'in güçlüinhibitörlerinden (örn. gemfibrozil) kaçınılmalı veya bunların kullanımında dikkatliolunmalıdır. Hastalara güçlü bir CYP2C8 inhibitörünün eş zamanlı uygulanması zorunlu ise,Enzalutamid dozu günde bir defada 80 mg olacak şekilde düşürülmelidir (Bkz. Bölüm 4.2).CYP3A4 inhibitörleriCYP3A4, Enzalutamid metabolizmasında minör bir rol oynamaktadır. Güçlü bir CYP3A4 inhibitörü olan itrakonazolün (günde bir defa 200 mg) sağlıklı erkek gönüllülere oraluygulamasını takiben, Enzalutamidin EAA değeri %41 artarken, Cmaks değişmeden kalmıştır.Bağlanmamış Enzalutamid ve bağlanmamış aktif metabolitinin toplamı bakımından, EAA%27 artış gösterirken, Cmaks yine değişmeden kalmıştır. Enzalutamid, CYP3A4 inhibitörleriile eşzamanlı uygulandığında, herhangi bir doz ayarlamasına ihtiyaç yoktur. CYP2C8 ve CYP3A4 indükleyicilerOrta düzeyli CYP2C8 ve güçlü CYP3A4 indükleyici rifampinin (günde bir kez 600 mg) sağlıklı erkek gönüllülere oral yolla uygulanmasının ardından Enzalutamid ve aktifmetabolitinin EAA değeri %37 düşmüş, Cmaks değeri ise değişmeden kalmıştır. ENZADRE,CYP2C8 veya CYP3A4 indükleyicilerle birlikte uygulandığında herhangi bir doz ayarlamasıgerekmez. Enzalutamidin diğer tıbbi ürünlere maruziyeti etkileme potansiyeliEnzim indüksiyonuEnzalutamid, güçlü bir enzim indükleyicisidir ve pek çok enzimin ve taşıyıcının sentezini artırır; bu nedenle, enzimleri veya taşıyıcıların substratları olan çoğu yaygın tıbbi ürünleetkileşim beklenir. Plazma konsantrasyonlarındaki azalma önemli olabilir ve klinik etkinin 5 / 24 kaybına veya azalmasına yol açabilir. Aynı zamanda aktif metabolitlerin oluşma riskinin artması da söz konusudur. İndüklenebilen enzimler; karaciğer ve bağırsaktaki CYP3A veCYP2B6, CYP2C9, CYP2C19 ve üridin 5'-difosfo-glukuronoziltransferaz'dır (UGT'ler -glukuronid konjüge edici enzimler). Taşıyıcı protein P-gp ve muhtemelen diğer taşıyıcılar da(örn. çoklu ilaç direnci ile ilişkili protein 2 (MRP2), meme kanserine dirençli protein (BCRP)ve organik anyon taşıyıcı polipeptit 1B1 (OATP1B1) de indüklenebilmektedir. İn vivoçalışmalar, Enzalutamidin güçlü bir CYP3A4 indükleyici olduğunu ve orta düzeyde CYP2C9 ve CYP2C19'u indüklediğini göstermiştir. Enzalutamid (günde bir defa 160 mg) veduyarlı CYP substratlarının tek oral dozlarının prostat kanserli hastalarda eşzamanlıuygulaması, midazolamın (CYP3A4 substratı) EAA değerinde %86 düşüş, S-varfarinin(CYP2C9 substratı) EAA değerinde %56 düşüş ve omeprazolün (CYP2C19 substratı) EAAdeğerinde %70 düşüş ile sonuçlanmıştır. UGT1A1 de indüklenebilir. Enzalutamid (günde birkez 160 mg), metastatik kastrasyona dirençli prostat kanseri hastaları ile yürütülen bir klinikçalışmada, intravenöz yolda uygulanan dosetakselin (her 3 haftada bir infüzyon yoluyla 75mg/m2) farmakokinetiği üzerinde klinik olarak anlamlı herhangi bir etki göstermemiştir.Dosetakselin EAA değeri %12 [geometrik ortalama oranı (GMR) = 0,882 (%90 GA: 0,767,1,02)] azalmış, Cmaks ise %4 [GMR = 0,963 (%90 GA: 0,834, 1,11)] azalmıştır.Metabolizma veya aktif transport yoluyla eliminasyona uğrayan belirli tıbbi ürünlerle etkileşim olması beklenir. Terapötik etkilerinin hasta için büyük önem arz etmesi ve dozayarlamalarının etkililiğe veya plazma konsantrasyonlarına dayalı olarak kolaylıklayapılamaması halinde, bu tıbbi ürünlerin kullanımından kaçınılması ya da dikkatlikullanılmaları gerekir. Parasetamol uygulaması sonrasında karaciğer hasarı riskinin, enzimindükleyiciler ile eşzamanlı tedavi gören hastalarda daha yüksek olduğundanşüphelenilmektedir. Etkilenebilen tıbbi ürün grupları bu ilaçlarla sınırlı olmamakla birlikte şunlardır: Analjezikler (örn. fentanil, tramadol) Antibiyotikler (örn. klaritromisin, doksisiklin) Antikanser ajanlar (örn. kabazitaksel) Antikoagülanlar (örn. asenokumarol, varfarin) Antiepileptikler (örn. karbamazepin, klonazepam, fenitoin, primidon, valproik asit) Antipsikotikler (örn. haloperidol) Beta blokörler (örn. bisoprolol, propranolol) Kalsiyum kanal blokörleri (örn. diltiazem, felodipin, nikardipin, nifedipin, verapamil) Kardiyak glikozitleri (örn. digoksin) Kortikosteroidler (örn. deksametazon, prednizolon) HIV antiviralleri (örn. indinavir, ritonavir) Hipnotikler (örn. diazepam, midazolam, zolpidem) CYP3A4 ile metabolize olan statinler (örn. atorvastatin, simvastatin) Tiroid ajanları (örn. levotiroksin) 6 / 24 Her ne kadar bazı indüksiyon etkileri daha erken süreçte görülebilir olabilse de, Enzalutamidin tam indüksiyon potansiyeli, kararlı-durum plazma konsantrasyonlarınaulaşıldığı, tedavi başladıktan 1 ay sonrasına kadar ortaya çıkmayabilir. CYP2B6, CYP3A4,CYP2C9, CYP2C19 veya UGT1A1'in substratları olan tıbbi ürünleri alan hastalar,Enzalutamid tedavisinin ilk ayı sırasında farmakolojik etkilerin olası kaybı (veya aktifmetabolitlerin oluştuğu durumlarda etkilerde görülen artışlar) bakımından değerlendirilmelive uygun olduğu durumlarda doz ayarlaması düşünülmelidir. Enzalutamidin uzun yarılanmaömrü düşünüldüğünde (5,8 gün, Bkz. Bölüm 5.2),enzimler üzerindeki etkiler, Enzalutamidtedavisi durdurulduktan sonra bir ay veya daha uzun süreyle devamlılık gösterebilir.Enzalutamid tedavisi durdurulduğu zaman, eşzamanlı kullanılan tıbbi ürünün dozundakademeli olarak bir azaltma yapılmasına ihtiyaç duyulabilir.CYP1A2 ve CYP2C8 substratlarıEnzalutamid (günde bir defada 160 mg), pioglitazonun (CYP2C8 substratı) EAA veya kafeinin (CYP1A2 substratı) Cmaks değerlerinde klinik olarak anlamlı herhangi bir değişimeneden olmamıştır. Kafeinin EAA ve Cmaks değerleri sırasıyla %11 ve %4 azalmıştır.Pioglitazonun EAA değeri %20 artış gösterirken, Cmaks değeri %18 azalmıştır. Bir CYP1A2ya da CYP2C8 substratı Enzalutamid ile eşzamanlı uygulandığında, herhangi bir dozayarlaması endike değildir. P-gp substratlarıİn vitroin vivodeğerlendirilmemiştir,ancak klinik kullanım koşulları altında, Enzalutamid nükleer pregnan reseptörü (PXR)aktivasyonu aracılığıyla bir P-gp indükleyicisi olabilir. P-gp substratı olan dar terapötikaralığa sahip tıbbi ürünler (örn. kolşisin, dabigatran eteksilat, digoksin), ENZADRE ileeşzamanlı uygulama halinde dikkatli kullanılmalıdır ve ideal plazma konsantrasyonlarınınkorunması için doz ayarlaması gerektirebilirler.BCRP, MRP2, OAT3 ve OCT1 substratlarıİn vitroverilere dayanarak, hem BCRP ve MRP2'nin (bağırsakta), hem de organik anyon taşıyıcısı 3 (OAT3) ve organik katyon taşıyıcısı 1'in (OCT1) (sistemik olarak) inhibisyonuekarte edilemez. Teorik olarak, söz konusu taşıyıcıların indüksiyonu da mümkündür ve netetki şu an için bilinmemektedir.QTaralığını uzatan tıbbi ürünlerAndrojen düşürme tedavisi QT aralığını uzatabileceğinden, Enzalutamidin QT aralığını uzattığı bilinen tıbbi ürünler veya sınıf IA (örn. kinidin, disopiramid) veya sınıf III (örn.amiodaron, sotalol, dofetilid, ibutilid) antiaritmik tıbbi ürünler, metadon, moksifloksasin,antipsikotikler, vb. gibi Torsade de pointes'i(Bkz. Bölüm 4.4).7 / 24 Enzalutamid maruziyetinde gıda etkisiYiyeceklerin, Enzalutamide maruziyet miktarında klinik olarak anlamlı herhangi bir etkisi bulunmamaktadır. Klinik çalışmalarda, Enzalutamid yiyecekler dikkate alınmaksızınuygulanmıştır. 4.6. Gebelik ve LaktasyonGenel tavsiyeGebelik kategorisi: X Enzalutamid gebe olan ya da gebe olma olasılığı bulunan kadınlarda kontrendikedir (Bkz. Bölüm 4.3 ve 5.3).Çocuk doğurma potansiyeli olan kadınlar/Doğum kontrolü (kontrasepsiyon)ENZADRE, gebe olan ya da gebe olma ihtimali olan kadınlarda kontrendikedir. Enzalutamidin hamilelikte kullanımı üzerine herhangi bir insan verisi bulunmamaktadır ve bu tıbbi ürün çocuk doğurma potansiyeli olan kadınlarda kullanıma yönelik değildir. Erkeklerde ve kadınlarda kontrasepsiyon Enzalutamidin veya metabolitlerinin spermde bulunup bulunmadığı bilinmemektedir. Hastanın hamile bir kadınla cinsel ilişkiye girmesihalinde, Enzalutamid tedavisi sırasında ve tedaviden sonraki 3 ay boyunca kondomkullanılması gerekir. Hastanın hamile kalma olasılığı olan bir kadınla cinsel ilişkiye girmesihalinde ise, tedavi sırasında ve tedaviden sonraki 3 ay boyunca kondom veya başka bir doğumkontrol yönteminin kullanılması gerekir. Hayvanlarda yapılan çalışmalar, üreme toksisitesinigöstermiştir (Bkz. Bölüm 5.3).Gebelik dönemiEnzalutamid kadınlarda kullanıma yönelik değildir. Enzalutamid hamile olan veya hamile kalma olasılığı olan kadınlarda kontrendikedir (Bkz. Bölüm 4.3 ve 5.3).Laktasyon dönemiEnzalutamid kadınlarda kullanıma yönelik değildir. Enzalutamidin insan sütüyle atılıp, atılmadığı bilinmemektedir. Enzalutamid ve/veya metabolitleri sıçan sütü ile atılmaktadır (Bkz. Bölüm 5.3).Üreme yeteneği / FertiliteHayvan çalışmaları, Enzalutamidin erkek sıçanlarda ve köpeklerde üreme sistemini etkilediğini göstermiştir (Bkz. Bölüm 5.3).4.7. Araç ve makine kullanımı üzerindeki etkilerNöbeti de içeren psikiyatrik ve nörolojik olayların bildirilmiş olması nedeniyle (Bkz. Bölüm 4.8),Enzalutamidin araç veya makine kullanma yeteneği üzerine orta derecede etkisi olabilir.8 / 24 Nöbet öyküsü olan veya diğer yatkınlaştırıcı faktörleri (Bkz. Bölüm 4.4)taşıyan hastalar araç veya makine kullanımına dair risklerden haberdar edilmelidir. Enzalutamidin araç veyamakine kullanma yeteneği üzerindeki etkilerinin belirlenmesi amacıyla herhangi bir çalışmagerçekleştirilmemiştir.4.8. İstenmeyen etkilerGüvenlilik profilinin özetiEn yaygın advers reaksiyonlar asteni/bitkinlik, sıcak basması, baş ağrısı ve hipertansiyondur. Diğer önemli advers reaksiyonlar arasında düşme, patolojik olmayan kırıklar, bilişselbozukluk ve nötropeni yer almaktadır. Enzalutamid ile tedavi edilen hastaların %0,5'inde, plasebo ile tedavi edilen hastaların %0,1'inde ve bikatulamid ile tedavi edilen hastaların %0,3'ünde nöbet görülmüştür.Enzalutamid ile tedavi edilen vakalarda seyrek olarak posterior tersinir ensefalopati sendromubildirilmiştir (Bkz. Bölüm 4.4).Yan etkilerin tablo halinde özetiKlinik çalışmalar sırasında gözlenen yan etkiler sıklık kategorisine göre aşağıda listelenmiştir. Sıklık kategorileri şu şekilde tanımlanmıştır: Çok yaygın (> 1/10); yaygın (> 1/100 ila < 1/10),yaygın olmayan (> 1/1.000 ila <1/100); seyrek (> 1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her bir sıklıkgruplaması içinde advers reaksiyonlar azalan ciddiyet sırasına göre sunulmaktadır. Kan ve lenf sistemi hastalıklarıYaygın olmayan: Lökopeni, nötropeni Bilinmiyor*: Trombositopeni Bağışıklık sistemi hastalıklarıBilinmiyor*: Dil ödemi, dudak ödemi, farinks ödemi Psikiyatrik hastalıklarYaygın:Yaygın olmayan: Anksiyete Görsel halüsinasyonlar Sinir sistemi hastalıklarıÇok yaygın:Yaygın: Yaygın olmayan: Bilinmiyor*: Kardiyak hastalıklarıBilinmiyor*:Baş ağrısı Hafıza kaybı, amnezi, dikkat bozukluğu, huzursuz bacak sendromu Bilişsel bozukluk, nöbet Posterior tersinir ensefalopati sendromu QT-uzaması (Bkz. Bölüm 4.4 ve 4.5)9 / 24 Vasküler hastalıklarÇok yaygın: Sıcak basması, hipertansiyon Gastrointestinal hastalıklar:Bilinmiyor*: Bulantı,kusma, diyare Deri ve deri altı doku hastalıklarıYaygın: Kuru cilt, pruritus Bilinmiyor*: Döküntü Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Kırıklar** Bilinmiyor*: Miyalji,kas spazmları,kas zayıflığı, sırt ağrısı Üreme sistemi ve meme hastalıklarıYaygın: Jinekomasti Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok yaygın: Asteni/yorgunluk Yaralanma ve zehirlenmeYaygın: Düşme * Pazarlama sonrası deneyimden spontan bildirimler ** Patolojik kırıklar dışında bütün kırıkları kapsar Seçilmiş advers reaksiyonlarının tarifiNöbetKontrollü klinik çalışmalarda, 160 mg Enzalutamid günlük dozu ile tedavi edilen 2051 hastadan 10'unda (%0,5) bir kez nöbet yaşarken, plasebo alan hastaların (<%0,1) birinde vebikatulamid alan hastaların (%0,3) birinde nöbet yaşanmıştır. Dozun, preklinik verilerle ve birdoz-arttırma çalışmasından elde edilen verilerle yansıtıldığı üzere nöbet riskine yönelikönemli bir tahmin faktörü olduğu görülmektedir. Her iki faz 3 çalışmasında da, önceden nöbetgeçirmiş veya nöbet için risk faktörü taşıyan hastalar çalışmaya dahil edilmemiştir. AFFIRM çalışmasında, günlük 160 mg Enzalutamid dozuyla tedavi edilen kemoterapi sonrası 800 hastadan yedisi (%0,9) nöbet yaşamıştır, öte yandan plasebo alan hastalarda nöbetoluşmamıştır. Nöbet riskleri bağımsız olarak artmış olabilen bu hastaların çoğunda potansiyelkatkısı bulunan faktörlere rastlanmıştır. PREVAIL çalışmasında, 160 mg Enzalutamid günlükdozu ile tedavi edilen daha önce kemoterapi görmemiş 871 hastadan biri (%0,1) ve plaseboalan 844 hastadan biri (%0,1) bir kez nöbet yaşamıştır. Kemoterapi görmemiş hastalardayapılmış bikatulamid kontrollü çalışmalarda ise, Enzalutamid ile tedavi gören 380 hastadanüçü (%0,8) ve bikatulamid ile tedavi gören 387 hastadan biri (%0,3) nöbet yaşamıştır. 10 / 24 Enzalutamidin hangi mekanizma ile nöbet eşiğini düşürebileceği bilinmemektedir; ancak Enzalutamidin ve aktif metabolitinin GABA kapılı klor kanalına bağlandığı ve söz konusukanalın aktivitesini inhibe edebildiğini gösteren in vitroçalışmalardan edinilen verilerleilişkili olabilir.Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9. Doz aşımı ve tedavisiEnzalutamidin antidotu bulunmamaktadır. Doz aşımı durumunda, Enzalutamid tedavisi durdurulmalı ve 5,8 gün yarılanma ömrü de dikkate alınarak genel destekleyici önlemlerinbaşlatılması gerekmektedir. Doz aşımını takiben hastalar artmış nöbet riski taşıyor olabilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Endokrin tedavi, antiandrojenler ATC kodu: L02BB04 Etki mekanizmasıProstat kanserinin androjene duyarlı olduğu ve androjen reseptör sinyalinin inhibisyonuna yanıt verdiği bilinmektedir. Düşük veya tespit edilemeyen serum androjen düzeylerinerağmen, androjen reseptör sinyalizasyonu hastalık progresyonunu arttırmaya devametmektedir. Tümör hücre büyümesinin androjen reseptörü üzerinden uyarılması, nükleerlokalizasyonu ve DNA'ya bağlanmayı gerektirmektedir. Enzalutamid androjen reseptörsinyalizasyon yolağında pek çok basamağı bloke eden, potent bir androjen reseptörsinyalizasyon inhibitörüdür. Enzalutamid, yarışmalı olarak androjenlerin androjenreseptörlerine bağlanmasını, aktive olmuş reseptörlerin nükleusa translokasyonunu veandrojen reseptörünün aşırı eksprese olduğu ve antiandrojenlere prostat tümör hücrelerinindirençli olduğu durumlarda bile akvite olmuş androjen reseptörünün DNA ile birleşmesiniinhibe eder. Enzalutamid tedavisi, prostat kanseri hücrelerinin büyümesini azaltır ve kanserhücresinin ölümünü ve tümör regresyonunu indükleyebilir. Preklinik çalışmalarda,Enzalutamid, androjen reseptörüne agonist etki göstermemiştir. Farmakodinamik etkilerÖncesinde dosetaksel ile kemoterapinin başarısız olduğu hastalarda yapılan bir faz 3 klinik çalışmada, plasebo alan hastaların %1,5'ine karşılık, Enzalutamid ile tedavi edilen hastaların%54'ünde PSA düzeylerinde başlangıç düzeylerine göre en az %50 azalma görülmüştür. Klinik etkililik ve güvenlilikEnzalutamidin etkililiği androjen düşürme tedavisi [Luteinleştirici hormon salgılatıcı hormon (LHRH) analoğu veya bilateral orşiektomi sonrasında] altında progrese olmuş metastatik 11 / 24 prostat kanseri olan hastalarda yapılmış iki randomize, plasebo-kontrollü çok merkezli faz 3 klinik çalışmada belirlenmiştir [CRPC2 (AFFIRM), MDV3100-03 (PREVAIL)]. PREVAILçalışmasında daha öncesinde kemoterapi almamış hastalar çalışmaya dahil edilirken,AFFIRM çalışmasında öncesinde dosetaksel almış hastalar çalışmaya dahil edilmiştir. Tümhastalar LHRH analoğu almaya devam etmiş ya da bu hastalarda öncesinde bilateralorşiektomi yapılmıştır. Aktif tedavi kolunda, Enzalutamid günde 160 mg dozda ağızdanuygulanmıştır. Her iki klinik çalışmada da hastalar kontrol kolunda plasebo almış ve hastalaraprednizon veya başka bir glukokortikoid alma olanağı tanınmakla birlikte bu uygulama şartkoşulmamıştır (izin verilen maksimum günlük doz 10 mg prednison veya eşdeğeriydi). PSA serum konsantrasyonundaki değişimler ile ayrı olarak her zaman klinik yarar öngörülmemektedir. Bu nedenle her bir çalışmaya yönelik aşağıda belirtilen tedaviyi bırakmakriterleri karşılanana kadar, her iki çalışmada da hastaların kendi çalışma tedavilerine devametmeleri tavsiye edilmiştir. MDV3100-03 (PREVAIL) çalışması (daha öncesinde kemoterapi görmemiş hastalar)Daha önce kemoterapi almamış asemptomatik veya hafif semptomatik toplam 1717 hasta, ya günde bir kez ağızdan 160 mg Enzalutamid (N = 872) veya günde bir kez ağızdan plasebo (N= 845) almak üzere 1:1 randomize edildi. Viseral hastalığı olan hastalar, hafif-orta derece kalpyetmezliği olan hastalar (NYHA Sınıf I veya II) ve nöbet eşiğinin düşürülmesi ile ilişkili ilaçtedavilerini alan hastalara izin verildi. Önceden nöbet öyküsü veya nöbete yatkınlığıarttırabilecek bir durumu olan hastalar ve prostat kanserinden kaynaklanan orta veya şiddetliağrısı olan hastalar çalışmaya dahil edilmedi. Hastalık progresyonuna (radyolojik progresyon,iskelet ile ilgili bir olay veya klinik progresyon kanıtı) ve sitotoksik bir kemoterapinin ya dabir araştırma ajanının başlatılmasına kadar veya kabul edilemez toksisite gözlenene kadarçalışma tedavisine devam edildi. Hastaların demografik ve başlangıç hastalık özellikleri tedavi kolları arasında dengeliydi. Medyan yaş 71 (aralık 42-93) ve ırksal dağılım %77 beyaz, %10 Asyalı, %2 siyahi ve %11diğer veya bilinmeyen ırklar şeklindeydi. Hastaların %68'nin ECOG performans skoru 0;hastaların %32'sinin ise, ECOG performans skoru 1'di. Başlangıç ağrı değerlendirmesi, KısaAğrı Envanteri Kısa Formunda tanımına uygun olarak (0 ila 10 ölçeğinde son 24 saatsüresince en kötü ağrı), hastaların %67'sinde 0-1 (asemptomatik) ve hastaların %32'sinde 2-3(hafif semptomatik) şeklindeydi. Hastaların yaklaşık %45'inde çalışmaya girerken ölçülebiliryumuşak doku hastalığı ve hastaların %12'sinde ise, viseral (akciğer ve/veya karaciğer)metastazlar vardı. Ortak primer etkililik sonlanım noktaları genel sağkalım ve radyolojik progresyonsuz sağkalımdı (rPFS). Ortak primer sonlanım noktalarına ek olarak, sitotoksik kemoterapininbaşlatılmasına kadar geçen süre, en iyi genel yumuşak doku yanıtı, ilk iskelet ile ilgili olayakadar geçen süre, PSA yanıtı (başlangıç değerinden >%50 azalma), PSA progresyonuna kadargeçen zaman ve FACT-P toplam skoru düşüşüne kadar geçen zaman kullanılarak da faydadeğerlendirilmiştir. 12 / 24 Radyolojik progresyon, Prostat Kanseri Klinik Çalışmaları Çalışma Grubu 2 (PCWG2) kriterleri (kemik lezyonlarına yönelik) ve/veya Solid Tümörlerde Yanıt DeğerlendirmeKriterleri (RECIST v1.1) (yumuşak doku lezyonlarına yönelik) kullanılarakdeğerlendirilmiştir. rPFS analizinde, progresyonun radyolojik değerlendirilmesinde merkeziinceleme kullanılmıştır. 540 ölüm gözlendiğinde, genel sağkalım için önceden belirlenmiş ara analizde, Enzalutamid tedavisi plasebo tedavisine kıyasla genel sağkalımda istatistiksel olarak anlamlı iyileşmesağlanmıştır ve ölüm riskinde %29,4 azalma elde edilmiştir [HR=0,706, (%95 GA: 0,596;0,837), p < 0,0001]. 784 ölüm vakası gözlendiğinde, güncellenmiş bir sağkalım analiziyürütülmüştür. Bu analizin sonuçları ara analiz ile tutarlı idi (tablo 2, şekil 1). Güncellenmişanaliz sırasında, Enzalutamid ile tedavi edilen hastaların %52'si ve plasebo tedavi edilenhastaların %81'i metastatik kastrasyona dirençli prostat kanserinde genel sağkalımı uzatabilenardışık tedavileri almıştır.
Şekil 1: PREVAIL Çalışmasında Güncellenmiş Sağkalım Analizine Göre Kaplan-Meier Genel Sağkalım Eğrileri (Tedaviye Niyetlenilen Hasta Popülasyonunun Analizi - ITTAnalizi)13 / 24 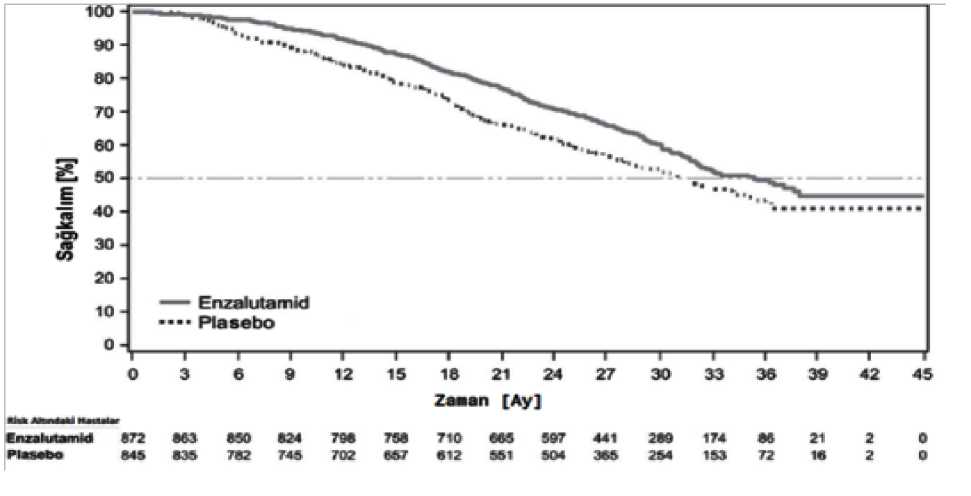 Şekil 2: Alt Gruplara Göre Güncellenmiş Genel Sağkalım Analizi: PREVAIL Çalışmasında Tehlike Oranı ve %95 Güven Aralığı (Tedaviye Niyetlenilen HastaPopülasyonunun Analizi - ITT Analizi)
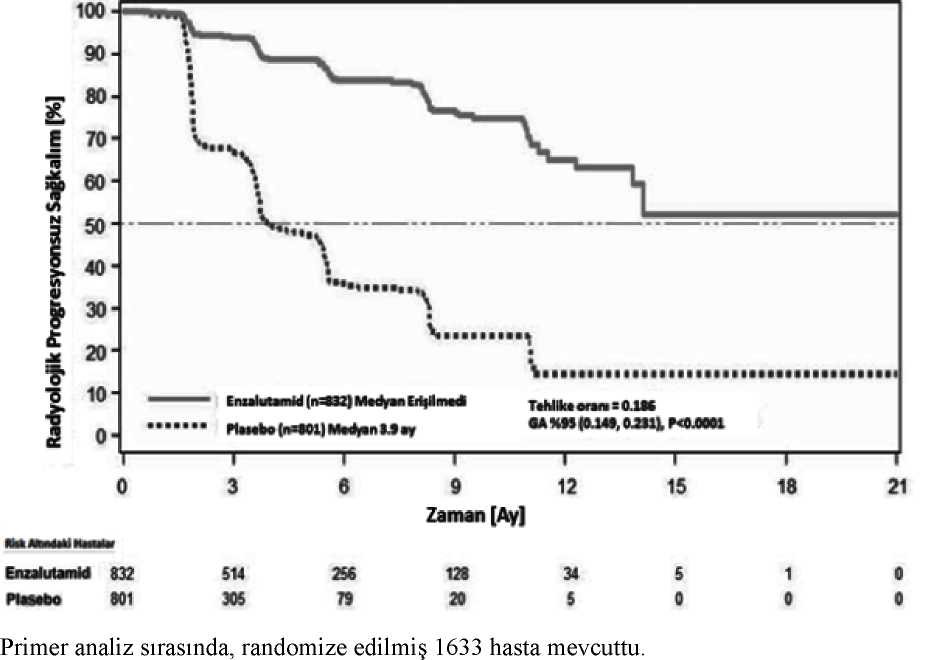
Önceden belirlenmiş rPFS analizinde, radyolojik progresyon veya ölüm riskinde %81,4 azalma ile [HR = 0,186 (%95 GA: 0,149, 0,231), p < 0,0001] tedavi grupları arasındaistatistiksel olarak anlamlı iyileşme gösterildi. Enzalutamid ile tedavi edilen 118 hastada(%14) ve plasebo ile tedavi edilen 321 hastada (%40) bir olaya rastlandı. Enzalutamid iletedavi edilen grupta medyan rPFS'ye ulaşılmadı (%95 GA: 13,8, ulaşılmadı) ve plasebo iletedavi edilen grupta 3,9 ay (%95 GA: 3,7, 5,4) olarak bulundu (Şekil 3). Önceden belirlenmiş 14 / 24 hasta alt gruplarında (örn. yaş, başlangıç ECOG performansı, başlangıç PSA ve LDH, tanı anında Gleason skoru ve taramada viseral hastalık) tutarlı bir şekilde rPFS faydası gözlendi.Önceden belirlenmiş ve araştırmacının radyolojik progresyon incelemesine dayalı takip rPFSanalizinde, tedavi grupları arasında istatistiksel olarak anlamlı iyileşme ve radyolojikprogresyon veya ölüm riskinde %69,3 azalma gösterildi [HR = 0,307 (%95 GA: 0,267,0,353), p < 0,0001]. Medyan rPFS Enzalutamid grubunda 19,7 ay ve plasebo grubunda 5,4 ayolarak idi.
Ortak primer etkililik sonlanım noktalarına ek olarak, istatistiksel olarak anlamlı iyileşmeler aynı zamanda aşağıdaki prospektif olarak tanımlanmış sonlanım noktalarında dagösterilmiştir. Sitotoksik kemoterapinin başlatılmasına kadar geçen medyan zaman Enzalutamid alan hastalarda 28 ay ve plasebo alan hastalarda 10,8 ay olmuştur (HR=0,35, %95 GA: [0,303,0,403], p<0,0001). Başlangıçta ölçülebilir hastalığı olan ve objektif yumuşak doku yanıtı olan Enzalutamid ile tedavi edilen hastaların oranı %58,8 (%95 GA: 53,8, 63,7) ve buna karşılık bu oran plaseboalan hastalarda %5'ti (%95 GA: 3, 7,7). Objektif yumuşak doku yanıtı bakımındanEnzalutamid ve plasebo kolları arasındaki mutlak fark %53,9'du (%95 GA: %48,5, %59,1,p<0,0001). Tam yanıt Enzalutamid ile tedavi edilen hastaların %19,7'sinde; plasebo ile tedavi 15 / 24 edilen hastaların %1'inde bildirilmiştir. Kısmi yanıt ise, Enzalutamid ile tedavi edilen hastaların %39,1'inde ve buna karşılık plasebo ile tedavi edilen hastaların %3,9'undabildirilmiştir. Enzalutamid ilk iskelet ile ilişkili olay riskini %28 oranında anlamlı düzeyde azaltmıştır [HR = 0,718 (%95 GA: 0,61, 0,844) p-değeri < 0,0001]. İskelet ile ilişkili bir olay prostat kanserinedeniyle kemiğe radyoterapi veya cerrahi uygulaması, patolojik kemik kırığı, omurilik basısıveya kemik ağrısının tedavisine yönelik antineoplastik tedavinin değiştirilmesi olaraktanımlanmıştır. Analize 587 iskelet ile ilişkili olay dahil edilmiştir ve bu olaylardan 389'u(%66,3) kemiğe radyoterapi, 79'u (%13,5) omurilik basısı, 70'i (%11,9) patolojik kemikkırığı, 45'i (%7,6) kemik ağrısını tedavi etmeye yönelik antineoplastik tedavide değişiklik ve22 olay (%3,7) kemiğe cerrahi uygulamasıydı. Enzalutamid alan hastaların %78'inde istatistiksel olarak plasebo alan hastaların %3,5'lik oranına kıyasla daha yüksek oranda başlangıç değerinden >%50 düşüş olarak tanımlanmıştoplam PSA yanıt oranı elde edilmiştir (fark = %74,5, p < 0,0001). PCWG2 kriterlerine göre PSA progresyonuna kadar geçen medyan zaman Enzalutamid ile tedavi edilen hastalarda 11,2 ay ve plasebo almış hastalarda 2,8 ay olarak kaydedildi[HR=0,169, (%95 GA: 0,147, 0,195), p<0,0001]. FACT-P'de kötüleşme riskini Enzalutamid tedavisi plaseboya göre %37,5 azaltmıştır (p<0,001). FACT-P'de kötüleşmeye kadar geçen medyan süre Enzalutamid grubunda 11,3 ayiken, plasebo grubunda 5,6 olarak kaydedilmiştir. 9785-CL-0222 (TERRAIN) Çalışması (önceden kemoterapi almamış hastalar)TERRAIN çalışmasına önceden kemoterapi ve antiandrojen tedavisi almamış günde bir kez 160 mg dozunda Enzalutamid (n=184) veya günde bir kez 50 mg dozunda bikatulamid(n=191) almak üzere randomize edilmiş toplam 375 hastayı çalışmaya dahil etmiştir. Medyanprogresyonsuz sağkalım süresi enzalutamid alan hastalar için 15,7 ay iken bikatulamid alanhastalar için 5,8 aydı [HR = 0,44 (%95 GA: 0,34, 0,57), p < 0,0001]. Progresyonsuz sağkalım,hangisi önce olursa, bağımsız merkezi inceleme ile radyolojik hastalık progresyonununobjektif kanıtı, iskeletle ilişkili olaylar, yeni bir antineoplastik tedavinin başlanması veyaherhangi bir nedenden ölüm olarak tanımlanmıştı. Tutarlı progresyonsuz sağkalım faydası,önceden belirlenmiş hasta altgruplarının hepsinde gözlenmiştir. CRPC2 (AFFIRM) çalışması (önceden kemoterapi almış hastalar)Enzalutamidin dosetaksel almış ve LHRH analoğu kullanmakta olan veya orşiektomi yapılmış metastatik kastrasyona dirençli prostat kanserli hastalardaki etkililiği ve güvenliliği,randomize, plasebo-kontrollü, çok merkezli, faz 3 bir klinik çalışmada değerlendirilmiştir.Toplamda 1199 hasta, 2:1 oranında ya oral yolla günde bir defada 160 mg dozda enzalutamidalmak (N = 800) ya da günde bir defada plasebo almak (N = 399) üzere randomize edilmiştir.Hastaların prednizon veya başka bir glukokortikoid almasına izin verilmiş (izin verilenmaksimum günlük doz 10 mg prednizon veya buna eşdeğer doz olmuştur), ancak şart 16 / 24 koşulmamıştır. Her iki tedavi koluna randomize edilen hastalar, hastalık progresyonuna (doğrulanmış radyografik progresyon veya iskeletle ilişkili olayların oluşumu olaraktanımlanmıştır) ve yeni sistemik antineoplastik tedavinin başlangıcına, kabul edilemeztoksisiteye veya tedavinin bırakılmasına kadar tedavilerini sürdürmüştür. Tedavi grupları arasında aşağıdaki hasta demografik ve başlangıç hastalık özellikleri dengeli idi. Medyan yaş 69 (41-92 aralığı) ve ırksal dağılım %93 beyaz, %4 siyahi, %1 Asyalı ve %2diğer ırklar şeklinde olmuştur. ECOG performans skoru hastaların %91,5'inde 0-1 ve%8,5'inde 2 idi; %28'inde ortalama Kısa Ağrı Envanteri skoru > 4'tü (hastalar tarafındanbildirilen randomizasyon öncesinde yedi gün süreyle önceki 24 saat üzerinden hesaplanan enkötü ağrının ortalaması). Çoğu hastada (%91) kemikte metastazlar gözlenmiş ve hastaların%23'ünde viseral akciğer ve/veya karaciğer tutulumu bildirilmiştir. Çalışmaya girişte,randomize edilen hastaların %41'inde yalnızca PSA progresyonu bulunurken, hastaların%59'unda radyolojik progresyonu mevcuttu. Hastaların %51'i başlangıçta bifosfonatlarlatedavi görmekteydi. AFFIRM çalışmasında, nöbete yatkın hale getirebilecek tıbbi durumu (Bkz. Bölüm 4.8)olan, nöbet eşiğini düşürdüğü bilinen tıbbi ürünleri kullanan ve aynı zamanda, kontrol edilemeyenhipertansiyon gibi klinik olarak anlamlı kardiyovasküler hastalığı olan, yakın zamandamiyokard infarktüsü geçirmiş veya stabil olmayan anjinası olan, New York Kalp DerneğiSınıf III veya IV kalp yetmezliği olan (ejeksiyon fraksiyonu > %45 olanlar hariç), klinikolarak anlamlı ventriküler aritmilerin veya AV bloğunun (kalıcı pacemaker olmayanlar)görüldüğü hastalar dahil edilmemiştir.520 ölüm sonrasında yapılan protokolle önceden belirlenmiş ara analiz, enzalutamid ile tedavi edilen hastaların genel sağkalımında, plaseboya kıyasla istatistiksel olarak anlamlı birüstünlük olduğunu göstermiştir (Tablo 3 ve Şekil 4 ve 5).
a P-değeri ECOG performans skoruna (0-1 vs. 2) ve ortalama ağrı skoruna (< 4'e karşı > 4) göre sınıflandırılan bir log-sıra testi ile tabakalanarak elde edilmiştir. b Tehlike Oranı, tabakalanmış bir orantısal riskler modelinden elde edilmiştir. Tehlike oranı < 1 Enzalutamid lehinedir. NR, erişilmemiştir. Şekil 4: AFFIRM Çalışmasında Kaplan-Meier Genel Sağkalım Eğrileri (Tedaviye Niyetlenilen Hasta Popülasyonunun Analizi - ITT Analizi)17 / 24 Enza lutamıd N = 800Medyan 18.4 ayP asebo N = 399Medyan 13.6 ayTeh ike oranı 0.63%95 GA (0.53-0.75)P < 0.0001Risk AltındakiHastalarEnzalutamid701317400167627263775376PlaseboZamanfAylTehlike OranıŞekil 5: AFFIRM Çalışmasında Alt gruplara göre Genel Sağkalım ve%95 Güven Aralığı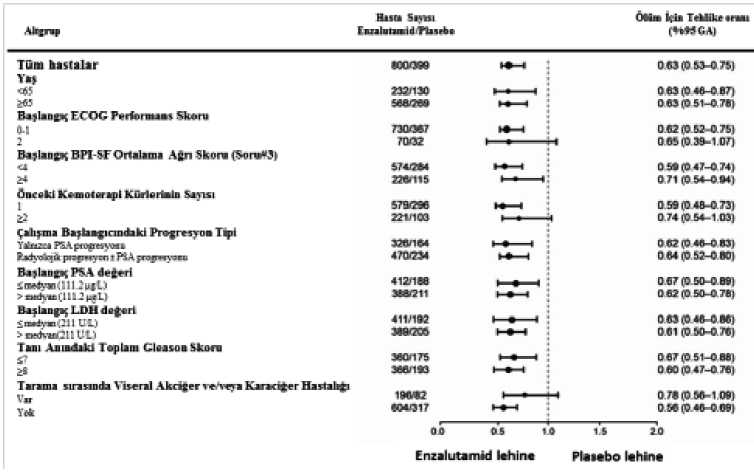 3Miu Crtrf i*iİjIihIİ5|Fsj-jImiBai'TtaıiBrkııtvııı-İMA14 4/13»-4142İS. OT 21İ«9 1 714 2IBLBflZS-41İ.5173/1İ& =nH*215 3710 3-4142 ız «ı a14 4'14 â «2/1131İ4*SA -414 2ECOG: Doğu İşbirliği Onkoloji Grubu; BPI-SF: Kısa Ağrı Envanteri-Kısa Form; PSA: Prostata Spesifik Antijen 18 / 24 Genel sağkalımda gözlenen iyileşmeye ek olarak, ana ikincil sonlanım noktaları (PSA progresyonu, radyolojik progresyonsuz sağkalım ve iskelet ile ilişkili ilk olaya kadar geçenzaman) da Enzalutamid lehine ve çoklu testlere göre ayarlama yapıldıktan sonra istatistikselolarak anlamlı bulunmuştur. Araştırmacı tarafından yumuşak doku ve kemik taramasında 2 veya daha fazla kemik lezyonu görülmesine ilişkin RECIST v1.1 kriterleri kullanılarak değerlendirilen radyolojikprogresyonsuz sağkalım, Enzalutamid ile tedavi edilen hastalarda 8,3 ay ve plasebo almış olanhastalarda 2,9 ay olarak bulunmuştur (HR = 0,404, %95 GA: [0,35, 0,466]; p < 0,0001). Sözkonusu analiz dokümente edilmiş progresyon olmaksızın 216 ölümü ve 303'ü (%47) yumuşakdoku progresyonuna bağlı, 268'i (%42) kemik lezyonu progresyonuna ve 74'ü (%11) hemyumuşak dokuya hem de kemik lezyonlarına bağlı bulunan 645 belgelenmiş progresyonvakasını kapsamıştır. %50 veya %90 konfirme edilmiş PSA düşüşü Enzalutamid ile tedavi edilen hastalarda sırasıyla %54 ve %24,8 ve plasebo almış hastalarda sırasıyla %1,5 ve %0,9 olarakbulunmuştur (p < 0,0001). PSA progresyonuna kadar geçen medyan süre Enzalutamid iletedavi edilen hastalarda 8,3 ay ve plasebo almış olan hastalarda 3 aydı (HR = 0,248, %95 GA:[0,204, 0,303]; p < 0,0001). İskelet ile ilişkili ilk olaya kadar geçen medyan zaman Enzalutamid ile tedavi edilen hastalarda 16,7 ay ve plasebo almış hastalarda 13,3 ay olarak bulunmuştur (HR = 0,688, %95GA: [0,566, 0,835]; p < 0,0001). İskelet ile ilişkili bir olay prostat kanseri nedeniyle kemiğeuygulanan bir radyoterapi veya cerrahi uygulanması, patolojik kemik kırığı, omurilikkompresyonu veya kemik ağrısının tedavisine yönelik antineoplastik tedavinin değiştirilmesiolarak tanımlanmıştır. Söz konusu analiz 448 iskelet ilişkili olayı kapsamıştır. Bu olayların277'si (%62) kemiğe radyoterapi uygulanmasını, 95'i (%21) omurilik kompresyonunu, 47'si(%10) patolojik kemik kırığını, 36'sı (%8) kemik ağrısını tedavi etmek için antineoplastiktedavide değişiklik ve 7'si (%2) kemik cerrahisini içermekte idi. Öncesinde abirateron asetat almış hastalarda Enzalutamid etkililiği çalışılmamıştır. YaşlılarFaz 3 çalışmalarında Enzalutamid almış 1671 hastadan, 1261 hasta (%75) 65 yaş ve üzeri ve 516 hasta (%31) 75 yaş ve üzeri hastalardı. Daha yaşlı olan ve daha genç olan bu hastalardagüvenlilik veya etkililik bakımından genel farklılıklar gözlenmemiştir. Pediyatrik popülasyonPediyatrik popülasyonda prostat kanseri görülmediğinden ENZADRE'nin pediyatrik hastalarda kullanımı bulunmamaktadır. Enzalutamide ait pediatrik popülasyonda kliniketkililik ve güvenlilik verisi yoktur (Bkz. Bölüm 4.2).19 / 24 5.2. Farmakokinetik özelliklerGenel özelliklerEnzalutamid, suda çok zayıf çözünür. Bu üründe, emulsifiye edici/sürfaktan olarak kaprilokaproil makrogliseritleri ile Enzalutamid çözünürlüğü arttırılmıştır. Preklinikçalışmalarda, Enzalutamid emilimi, kaprilokaproil makrogliseritlerinde çözündürüldüğündeartmıştır. Enzalutamid farmakokinetiği prostat kanseri hastalarında ve sağlıklı erkek gönüllülerde değerlendirilmiştir. Enzalutamid için hastalarda tek oral doz sonrası ortalama terminalyarılanma süresi (tı /2) 5,8 gündür (2,8-10,2 gün aralığı) ve kararlı duruma yaklaşık bir ayiçerisinde ulaşılmaktadır. Günlük oral uygulama ile Enzalutamid tek doza göre yaklaşık 8,3kat birikmektedir. Plazma konsantrasyonlarında gözlenen günlük dalgalanmaları düşüktür(zirve-çukur oranı 1,25). Enzalutamid klirensi primer olarak karaciğer metabolizmasıaracılığıyla gerçekleşerek, Enzalutamide eşit düzeyde aktif olan ve Enzalutamid ile hemenhemen aynı plazma konsantrasyonlarında dolaşıma katılan aktif bir metabolitini oluşturur.Emilim:Enzalutamidin hastalardaki maksimum plazma konsantrasyonları (Cmaks), uygulamadan 1 ila 2 saat sonra gözlenmiştir. İnsanlarda yapılan bir kütle denge çalışmasına dayanarak,Enzalutamidin oral emiliminin en az %84,2 olduğu tahmin edilmektedir. Enzalutamid P-gpveya BCRP dışa atım pompalarının bir substratı değildir. Kararlı durumda, EnzalutamidinCmaks değeri 16,6 mcg/mL (değişim katsayısı %23) ve aktif metabolitinin ortalama Cmaksdeğeri 12,7 mcg/mL'dir (değişim katsayısı %30). Yiyeceklerin emilim miktarı üzerinde klinik olarak anlamlı bir etkisi bulunmamaktadır. Klinik çalışmalarda, Enzalutamid yiyecekler dikkate alınmaksızın uygulanmıştır. Dağılım:Enzalutamidin tek bir oral doz sonrasında hastalardaki ortalama görünür dağılma hacmi (V/F) 110 L'dir (değişim katsayısı %29). Enzalutamidin dağılım hacmi, vücuttaki toplam suhacminden daha büyük olup, bu da ekstravasküler dağılımın geniş olduğunun göstergesidir.Kemirgenlerde yapılan çalışmalar, Enzalutamidin ve aktif metabolitinin kan beyin bariyerinigeçebildiğini göstermektedir. Enzalutamid, başlıca albümine olmak üzere, plazma proteinlerine %97 ila %98 oranında bağlanır. Aktif metaboliti ise, plazma proteinlerine %95 oranında bağlanmaktadır. İn vitroolarak Enzalutamid ve plazma proteinlerine yüksek olarak bağlanan diğer ilaçlar (varfarin,ibuprofen ve salisilik asit) arasında herhangi bir protein bağlanma yeri değişimi yoktur.Biyotransformasyon:Enzalutamid geniş ölçüde metabolize olur. İnsan plazmasında iki majör metaboliti vardır: N-desmetil Enzalutamid (aktif) ve bir karboksilik asit türevi (inaktif). Enzalutamid, her iki enzimin de söz konusu aktif metabolitin oluşumunda rol oynadığı CYP2C8 ve daha azmiktarda CYP3A4/5 tarafından metabolize edilir (Bkz. Bölüm 4.5). İn vitroolarak, N-desmetil20 / 24 Enzalutamid, Enzalutamidin karboksilik asit metabolitine metabolize edilmesinde de minör bir rol oynayan karboksilesteraz 1 tarafından karboksilik asit metabolitine metabolize edilir. İn vitroolarak N-desmetil Enzalutamid CYP'ler tarafından metabolize edilmez.Klinik kullanım koşulları altında, Enzalutamid CYP3A4'ün güçlü bir indükleyicisi, CYP2C9 ve CYP2C19'un orta dereceli bir indükleyicisi olup, CYP2C8 üzerinde klinik olarak anlamlıbir etkiye sahip değildir (Bkz. Bölüm 4.5).Eliminasyon:Enzalutamidin hastalardaki ortalama görünür klirensi (CL/F), 0,52 ve 0,564 L/saat aralığında değişkenlik göstermektedir. 14C-enzalutamidin oral uygulamasını takiben, doz sonrası 77. günde radyoaktivitenin %84,6'sı geri toplanmıştır: %71'i idrardan (eser miktarlarda Enzalutamid ve aktif metabolitile birlikte başlıca inaktif metabolit olarak) ve %13,6'sı dışkıdan (dozun %0,39'u değişmemişEnzalutamid olarak) geri toplanmıştır. İn vitroveriler, Enzalutamidin OATP1B1, OATP1B3 veya OCTl'in substratı olmadığını göstermektedir; N-desmetil Enzalutamid P-gb veya BCRP için bir substrat değildir.İn vitroveriler, klinik olarak anlamlı konsantrasyonlarda Enzalutamidin ve majör metabolitlerinin OATP1B1, OATP1B3, OCT2 veya OAT1 taşıyıcılarını inhibe etmediğinigöstermektedir.Doğrusallık / doğrusal olmayan durum:40 ila 160 mg doz aralığında doz orantısallığından herhangi bir majör sapma gözlenmemektedir. Enzalutamidin ve aktif metabolitinin ayrı hastalardaki kararlı durum Cmindeğerleri, bir yılın üzerinde kronik tedavi sırasında sabit kalmıştır; bu da bir kez kararlıduruma ulaşıldığında, zamana göre doğrusal farmakokinetik sergilediğini göstermektedir. Hastalardaki karakteristik özellikler Böbrek yetmezliği:Enzalutamid için resmi herhangi bir böbrek yetmezliği çalışması tamamlanmamıştır. Serum kreatinin düzeyleri >177 mcmol/L (2 mg/dL) olan hastalar klinik çalışmalardan hariçtutulmuştur. Bir popülasyon farmakokinetik analizine dayanarak, hesaplanan kreatinin klirens(CrCL) değerleri > 30 mL/dak olan hastalarda (Cockcroft ve Gault formülü ile hesaplandı)herhangi bir doz ayarlamasına ihtiyaç yoktur. Enzalutamid, ağır böbrek yetmezliği (CrCL <30 mL/dak) veya son evre böbrek hastalığı olan hastalarda değerlendirilmemiştir ve buhastaları tedavi ederken dikkatli olunması tavsiye edilir. Enzalutamidin ara ara uygulananhemodiyaliz veya devamlı ayaktan periton diyalizi ile anlamlı olarak uzaklaştırılması pekmümkün değildir. 21 / 24 Karaciğer yetmezliği:Hepatik yetmezlik Enzalutamide veya aktif metabolitine toplam maruziyet üzerinde belirgin bir etki ortaya çıkarmamıştır. Bununla birlikte sağlıklı kontrollere kıyasla ağır karaciğeryetmezliği görülen hastalarda, muhtemelen artan doku dağılımıyla bağlantılı olarak ilacın yarıömrü iki katına çıkmıştır (4,7 güne karşılık 10,4 gün). Enzalutamid farmakokinetiği başlangıçta hafif (N=6) , orta şiddetli (N=8) veya ağır (N=8) karaciğer yetmezliği (sırasıyla Child-Pugh Sınıf A, B veya C) olan gönüllülerde ve normalkaraciğer fonksiyonlarına sahip 22 eşlenmiş kontrol gönüllüsünde incelenmiştir.Enzalutamidin tek 160 mg oral dozunu takiben, sağlıklı gönüllülerle karşılaştırıldığında hafifyetmezliği olan gönüllülerde EAA %5 oranında ve Cmaks değeri ise %24 oranında artmıştır;orta derece yetmezliği olan gönüllülerde, EAA %29 artmış ve Cmaks %11 azalmıştır; ağıryetmezliği olan gönüllülerde ise, EAA %5 artmış ve Cmaks ise %41 azalmıştır. BağlanmamışEnzalutamid ve bağlanmamış aktif metabolitinin toplamı için, sağlıklı gönüllülerlekarşılaştırıldığında hafif yetmezliği olan gönüllülerdeki EAA %14 ve Cmaks %19 artarken, ortaderece yetmezliği olan gönüllülerde EAA %14 artmış ve Cmaks %17 azalmıştır, ağır yetmezliğiolan gönüllülerde ise EAA %34 artmış ve Cmaks %27 azalmıştır. Irk:Klinik çalışmalardaki çoğu hasta (>%84) beyaz ırktandı. Prostat kanserli Japon hastalarla yürütülen bir çalışmanın farmakokinetik verilerine dayanarak, Japon ve beyaz ırktan hastalararasında maruziyet bakımından klinik olarak anlamlı herhangi bir fark görülmemiştir. Diğerırklarda Enzalutamidin farmakokinetik özellikleri potansiyel farkını değerlendirmek içinyeterli bilgi yoktur. Yaşlı bireyler:Yapılan popülasyon farmakokinetik analizinde, yaşın Enzalutamid farmakokinetiği üzerinde klinik olarak anlamlı herhangi bir etkisi görülmemiştir. 5.3. Klinik öncesi güvenlilik verileriGebe farelerin Enzalutamid ile tedavisi embriyo/fetal ölümlerle ve dış ve iskeletle ilişkili değişikliklerle sonuçlanmıştır. Enzalutamid ile üreme toksisitesi çalışmaları yürütülmemiştir,ancak sıçanlarda (4 ve 26 hafta) ve köpeklerde (4, 13 ve 39 hafta) yapılan çalışmalarda, üremesisteminde atrofi, aspermi/hipospermi ve hipertrofi/hiperplazi bildirilmiştir ve bu daEnzalutamidin farmakolojik aktivitesiyle örtüşmektedir. Farelerde (4 hafta), sıçanlarda (4 ve26 hafta) ve köpeklerde (4, 13 ve 39 hafta) yapılan çalışmalarda, üreme organlarındaEnzalutamid ile ilişkili değişimler, prostat ve epididimisin atrofisi nedeniyle organağırlığındaki düşmeler nedeni ileydi. Farelerde (4 hafta) ve köpeklerde (39 hafta) Leydighücre hipertrofisi ve/veya hiperplazisi gözlemlenmişti. Üreme dokularındaki ilavedeğişiklikler, sıçanlarda hipofiz bezinde hipertrofi/hiperplaziyi ve seminal veziküllerdeatrofiyi ve köpeklerde testiküler hipospermiyi ve seminiferöz tübül dejenerasyonunuiçermiştir. Sıçan meme bezlerinde cinsiyet farklılıkları bildirilmiştir (erkekte atrofi ve dişidelobüler hiperplazi). Her iki türde üreme organlarında gözlenen değişimler, Enzalutamidinfarmakokinetik aktivitesi ile tutarlı bulunmuş ve 8 haftalık iyileşme periyodundan sonra 22 / 24 tersine dönmüş veya kısmen çözülmüştür. Her iki türde de karaciğer dahil diğer organ sistemlerinde klinik patoloji veya histopatoloji bakımından başka önemli herhangi birdeğişime rastlanmamıştır. Gebe sıçanlarda yapılan çalışmalar Enzalutamid ve/veya metabolitlerinin fetüse geçtiğini göstermiştir. Gebeliğin 14. günü 30 mg/kg dozunda (insanlar için endike olaran maksimumdozun yaklaşık 1,9 katı) radyoaktif olarak işaretlenmiş 14C-enzalutamidin sıçanlara oral olarakuygulanmasından sonra, fetüste maksimum radyoaktiviteye bu uygulamadan 4 saat sonraulaşılmıştır ve bu radyoaktivite 0,27'lik doku/plazma oranı ile anne plazmasındakinden dahadüşüktür. Uygulamadan 72 saat sonra fetüsteki radyoaktivite, maksimum konsantrasyonun0,08 katına düşmüştür. Emziren sıçanlarda yapılan çalışmalar, Enzalutamid ve/veya metabolitlerinin sıçan sütü ile atıldığını göstermektedir. 30 mg/kg dozunda (insanlar için endike olan maksimum dozunyaklaşık 1,9 katı) radyoaktif olarak işaretlenmiş 14C-enzalutamidin emziren sıçanlara oralolarak uygulanmasından sonra, sütte maksimum radyoaktiviteye uygulamadan 4 saat sonraulaşılmıştır ve bu radyoaktivite anne plazmasındakine göre 3,54 kata kadar daha yüksektir.Çalışma sonuçları da, Enzalutamid ve/veya metabolitlerinin süt vasıtası ile bebek sıçandokularına geçtiğini ve daha sonra elimine edildiğini göstermiştir. Enzalutamid, mikrobiyal mutagenez testinde (Ames) mutasyonları uyarmamıştır ve ne fare lenfoma hücreleriyle yapılan in vitroin vivoin vitrofototoksik bulunmamıştır.6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiİç fazButilhidroksianisol (BHA) (E320) Butilhidroksitoluen (BHT) (E321) Kaprilokaproil Makrogol-8 gliseritler Dış fazJelatin (sığır kaynaklı) Gliserol Sorbitol Spesiyel Titanyum Dioksit (E171) 6.2. GeçimsizliklerGeçerli değildir. 6.3. Raf ömrü24 ay 23 / 24 6.4. Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklanmalıdır. 6.5. Ambalajın niteliği ve içeriğiÜrünümüze ait primer ambalaj malzemesi olarak Şeffaf PVC/Aklar- Alüminyum folyo blister kullanılmaktadır. Blisterler, karton kutular içerisine paketlenir. Bir kutu içerisinde birblisterde uygun sayıda kapsül olacak şekilde, 112 adet yumuşak kapsül kullanma talimatı ilebirlikte sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİSABA İlaç San. ve Tic. A.Ş. Halkalı Merkez Mah. Basın Ekspres Cad. 34303 No:1 Kat:1 Küçükçekm ece/İSTANBUL Tel: 0212 692 92 92 Faks: 0212 697 00 24 E-mail: [email protected] 8. RUHSAT NUMARASI2021/503 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 09.12.2021 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ24 / 24 |
İlaç BilgileriEnzadre 40 Mg Yumuşak KapsülEtken Maddesi: Enzalutamid Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.