Fosemazon 150 Mg Iv İnfüzyonluk Çözelti Hazırlamada Kullanilacak Konsantre İçin Toz Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'a bildirmeleribeklenmektedir. Bakınız Bölüm 4.8. Şüpheli advers reaksiyonların raporlanması. 1. BEŞERİ TIBBİ ÜRÜNÜN ADIFOSEMAZON 150 mg IV infüzyonluk çözelti hazırlamada kullanılacak konsantre için toz Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her flakon, 150 mg fosaprepitanta eşdeğer (=130,5 mg aprepitant) 245,32 mg fosaprepitant dimeglumin içerir. Yardımcı maddeler:Disodyum edetat 18,80 mg Sodyum hidroksit k.m Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMİnfüzyonluk çözelti hazırlamada kullanılacak konsantre için toz Beyaz ya da hemen hemen beyaz renkli liyofilize kek. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarYetişkinlerde ve 6 aylık ve daha büyük pediatrik hastalarda yüksek ve orta derecede emetojenik kanser kemoterapisi ile ilişkili bulantı ve kusmanın önlenmesinde endikedir. FOSEMAZON kombinasyon tedavisinin bir parçası olarak verilir. (Bkz. Bölüm 4.2) 4.2. Pozoloji ve uygulama şekliPozoloji / Uygulama sıklığı ve süresiYetişkinlerdeÖnerilen doz, 1. günde kemoterapiden yaklaşık 30 dakika öncesinde, infüzyonla 150 mg'ı en az 20-30 dakikalık süre içinde uygulamaktır (Bkz. Bölüm 6.6). FOSEMAZON, aşağıdaki tablolarda belirtildiği gibi bir kortikosteroid ve 53antagonisti ile birlikte uygulanmalıdır.1/25 Emetojenik kanser kemoterapisi ile ilişkili mide bulantısı ve kusmayı önlemek için aşağıdaki rejimler önerilir.
Pediatrik Popülasyonda6 aylık ve daha büyük ve 6 kg'dan daha az olmayan pediatrik hastalar: Yüksek derecede emetojenik kemoterapi (HEC) veya orta derecede emetojenik kemoterapinin (MEC) tek veya çok günlük rejimlerinin uygulanması ile ilişkili bulantı ve kusmanın önlenmesiiçin kortikosteroid içeren veya içermeyen bir 53antagonisti ile birlikte uygulanması önerilenfosaprepitant dimegluminin doz rejimi Tablo 1'de gösterilmiştir. Tek günlük kemoterapi rejimleri,HEC veya MEC'nin sadece bir tek gün için uygulandığı rejimleri içerir. Çok günlük kemoterapi2/25 rejimleri, HEC veya MEC'nin 2 veya daha fazla gün boyunca uygulandığı kemoterapi rejimlerini içerir. Tek günlük kemoterapi rejimlerinde kullanılabilecek alternatif doz rejimi Tablo 2'de gösterilmiştir. Tek veya Çok Günlük Kemoterapi Rejimleri için DozlamaTek veya çok günlük HEC veya MEC rejimleri alan pediatrik hastalar için, FOSEMAZON 1, 2 ve 3. günlerde santral venöz kateter yoluyla intravenöz infüzyon olarak uygulanır.
*12 yaş ve üstü pediatrik hastalar için, 30 dakikadan daha uzun sürede intravenöz olarak FOSEMAZON uygulayın ve kemoterapiden yaklaşık 30 dakika önce infüzyonu tamamlayın. 12yaşından küçük pediatrik hastalar için, kemoterapiden yaklaşık 30 dakika önce infüzyonutamamlayarak, FOSEMAZON'u 60 dakikadan daha uzun sürede intravenöz olarak uygulayın.**Deksametazon, 1. gün kemoterapi tedavisinden 30 dakika önce uygulanmalıdır. Tek Günlük Kemoterapi Rejimleri için Alternatif DozlamaTek günlük HEC veya MEC alan pediatrik hastalar için FOSEMAZON, 1. Günde bir santral venöz kateter yoluyla intravenöz infüzyon şeklinde uygulanabilir. 3/25
*12 yaş ve üstü pediatrik hastalar için, 30 dakikadan daha uzun sürede intravenöz olarak FOSEMAZON uygulayın ve kemoterapiden yaklaşık 30 dakika önce infüzyonu tamamlayın. 12yaşından küçük pediatrik hastalar için, kemoterapiden yaklaşık 30 dakika önce infüzyonutamamlayarak, FOSEMAZON'u 60 dakikadan daha uzun sürede intravenöz olarak uygulayın.**Deksametazon, 1. günde kemoterapi tedavisinden 30 dakika önce uygulanmalıdır. 6 aylıktan küçük bebeklerde fosaprepitant dimegluminin güvenliliği ve etkililiği belirlenmemiştir. Veri bulunmamaktadır. GenelDiğer kortikosteroidler ve 5-HT3 antagonistleri ile kombinasyon halinde etkinlik verileri sınırlıdır. Kortikosteroidlerle birlikte uygulama hakkında ek bilgi için Bölüm 4.5'e bakınız. Birlikteuygulanan 5-HT3 antagonisti tıbbi ürünleri için Kısa Ürün Bilgileri'ne bakınız. Uygulama şekliFOSEMAZON yalnızca intravenöz olarak uygulanmalı ve intramüsküler veya subkütan yolla verilmemelidir. Yetişkinlerde intravenöz uygulama, tercihen 20-30 dakikalık bir sürede intravenözinfüzyon yoluyla gerçekleştirilir. 6 aylık ve daha büyük yaştaki pediatrik hastalarda intravenözuygulama, santral venöz kateter yoluyla önerilmektedir ve 12 yaş ve üzeri hastalarda 30 dakikadan 4/25 daha uzun bir sürede ya da 12 yaşından küçük pediatrik hastalarda ise 60 dakikanın üzerinde bir sürede uygulanmalıdır (Bkz. Bölüm 6.6). FOSEMAZON, bolus enjeksiyon veya seyreltilmemişsolüsyon olarak kullanılmaz. Uygulamadan önce ürünün sulandırılması ve seyreltilmesi ile ilgili talimatlar için bölüm 6.6'ya bakınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalar veya hemodiyalize giren son dönem böbrek yetmezliği hastaları için doz ayarlaması gerekli değildir (Bkz. Bölüm 5.2). Karaciğer yetmezliğiHafif karaciğer yetmezliği olan hastalar için doz ayarlaması gerekli değildir. Orta dereceli karaciğer yetmezliği olan hastalarda sınırlı veri vardır ve ciddi karaciğer yetmezliği olan hastalardaveri yoktur. Bu hastalarda FOSEMAZON dikkatli kullanılmalıdır (Bkz. Bölüm 4.4 ve 5.2). Geriyatrik popülasyon:Yaşlılar için doz ayarlaması gerekli değildir (Bkz. Bölüm 5.2). Cinsiyet:Cinsiyete göre doz ayarlaması gerekli değildir (Bkz. Bölüm 5.2). 4.3. KontrendikasyonlarEtkin madde veya polisorbat 80 veya Bölüm 6.1'de listelenen diğer yardımcı maddelere karşı aşırı duyarlılık. Pimozid, terfenadin, astemizol veya sisaprid ile birlikte uygulanması (Bkz. Bölüm 4.5). 4.4. Özel kullanım uyarıları ve önlemleriOrta derece ve ciddi karaciğer yetmezliği olan hastalarOrta dereceli karaciğer yetmezliği olan hastalarda sınırlı veri vardır ve ciddi karaciğer yetmezliği olan hastalarda veri yoktur. Bu hastalarda, FOSEMAZON dikkatli kullanılmalıdır (Bkz. Bölüm5.2). CYP3A4 etkileşimleriFOSEMAZON, primer olarak CYP3A4 ile metabolize olan ve siklosporin, takrolimus, sirolimus, everolimus, alfentanil, ergot alkaloid türevleri, fentanil ve kinidin gibi terapötik aralığı dar olanaktif maddeleri alan hastalarda dikkatli kullanılmalıdır (Bkz. Bölüm 4.5). Ayrıca, irinotekan ileeşzamanlı kullanımında, toksisitenin artmasına neden olabileceğinden, özellikle dikkatliolunmalıdır. 5/25 Varfarin (CYP2C9 substratı) ile birlikte uygulamaKronik varfarin tedavisi gören hastalarda, fosaprepitant kullanımından sonra 14 gün boyunca Uluslararası Normalleştirilmiş Oran (INR) yakından izlenmelidir (Bkz. Bölüm 4.5). Hormonal kontraseptifler ile birlikte uygulamaFosaprepitant, uygulanması sırasında ve uygulanmasından sonraki 28 gün boyunca hormonal kontraseptiflerin etkinliğini, azaltabilir. Fosaprepitant tedavisi sırasında ve fosaprepitantkullanımını takiben 2 ay süreyle kontrasepsiyon için hormonal olmayan alternatif destekleyiciyöntemler kullanılmalıdır (bkz. Bölüm 4.5). Aşırı duyarlılık reaksiyonlarıFosaprepitantın infüzyonu sırasında veya sonrasında, kızarıklık, eritem, dispne ve anafilaksi/ anafilaktik şok dahil ani aşırı duyarlılık reaksiyonları ortaya çıkmıştır. Bu aşırı duyarlılıkreaksiyonları genellikle infüzyonun kesilmesi ve uygun tedavinin uygulanması ile giderilmektedir.Aşırı duyarlılık reaksiyonları oluşan hastalarda infüzyonun yeniden başlatılması önerilmez. Uygulama ve infüzyon bölgesi reaksiyonlarıFosaprepitant kullanımı ile infüzyon bölgesi reaksiyonları (İBR) bildirilmiştir (Bkz. Bölüm 4.8). Tromboflebit ve vaskülit de dahil olmak üzere ciddi İBR'lerin çoğunluğu, özellikleekstravazasyonla ilişkili olduğunda, eşzamanlı vezikan kemoterapi (örn. antrasiklin bazlı)uygulaması ile bildirilmiştir. Eşzamanlı olarak vezikan kemoterapi alan bazı hastalarda nekroz dabildirilmiştir. Eşzamanlı vezikan kemoterapi olmadan, yüksek dozlarda uygulandığında hafifenjeksiyon bölgesi trombozu gözlenmiştir. FOSEMAZON bolus enjeksiyonu ile uygulanmamalıdır, her zaman seyreltilerek ve yavaş intravenöz infüzyon şeklinde uygulanmalıdır (Bkz. Bölüm 4.2). FOSEMAZON intramüskülerveya subkütan yoldan uygulanmamalıdır (Bkz. Bölüm 5.3). Lokal tahriş işaretleri veya belirtileriortaya çıkarsa, enj eksiyon veya infüzyon sonlandırılmalı ve başka damarda yeniden başlatılmalıdır. Bu tıbbi ürün her mL'sinde 1 mmol (23 mg)'den daha az sodyum ihtiva eder; yani esasında sodyum içermez. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriİntravenöz olarak uygulandığında, fosaprepitant hızla aprepitanta dönüşür. Tek doz olarak verilen 150 mg fosaprepitant zayıf bir CYP3A4 inhibitörüdür. Oral aprepitant ile digoksin arasındaki etkileşim eksikliği ile gösterildiği gibi fosaprepitantın P-glikoprotein taşıyıcısıile etkileşime girmemektedir. Fosaprepitantın CYP2C9, CYP3A4 ve glukuronidasyonun oralaprepitantın verilmesinden daha az veya daha fazla indüklenmesine neden olmayacağıöngörülmektedir. CYP2C8 ve CYP2C19 üzerindeki etkilerle ilgili veriler eksiktir. İntravenöz fosaprepitant uygulamasını takiben diğer tıbbi ürünlerle olan etkileşimler, muhtemelen oral aprepitant ile etkileşen aktif maddelerle ortaya çıkabilir. Çok günlük fosaprepitant rejimleri ile 6/25 etkileşim potansiyelinin, oral aprepitant rejimlerinden daha fazla olmadığı tahmin edilmektedir. Bu nedenle, pediatrik hastalarda diğer tıbbi ürünlerle birlikte FOSEMAZON kullanımı önerileri,fosaprepitant ve aprepitant çalışmalarından elde edilen erişkin verilerine dayanmaktadır. Aşağıdaki bilgiler, oral aprepitant ile yapılan araştırmalardan ve deksametazon, midazolam veya diltiazem ile birlikte uygulanan intravenöz fosaprepitant ile yapılan çalışmalardan elde edilmiştir. Diğer aktif maddelerin farmakokinetiği üzerine fosaprepitantın etkisi CYP3A4 inhibisyonuCYP3A4'ün zayıf bir inhibitörü olan fosaprepitantın 150 mg'lık tek dozu, CYP3A4 enzimi aracılığıyla metabolize edilen, birlikte uygulanan diğer aktif maddelerin plazmakonsantrasyonlarında geçici bir artışa neden olabilir. CYP3A4 substratlarının toplam maruziyeti,tek bir 150 mg fosaprepitant dozu ile birlikte uygulandıktan sonra 1. ve 2. günlerde 2 katına kadarçıkabilir. Fosaprepitant aynı anda pimozid, terfenadin, astemizol veya sisaprid ile birliktekullanılmamalıdır. CYP3A4'ün fosaprepitant tarafından inhibisyonu, bu aktif maddelerin plazmakonsantrasyonlarının yükselmesine neden olacağından; potansiyel olarak ciddi ya da hayati risktaşıyan reaksiyonlara neden olabilir (Bkz. Bölüm 4.3). Öncelikle CYP3A4 ile metabolize olan vesiklosporin, takrolimus, sirolimus, everolimus, alfentanil, diergotamin, ergotamin, fentanil vekinidin gibi terapötik aralığı dar olan aktif maddeler ile birlikte fosaprepitant uygulanması sırasındadikkat edilmesi önerilir (Bkz. Bölüm 4.4). KortikosteroidlerDeksametazon: Oral deksametazon dozu fosaprepitant ile birlikte verldiğinde yaklaşık %50 oranında azaltılmalıdır. Birinci günde tek bir intravenöz doz olarak uygulanan 150 mgfosaprepitant, bir CYP3A4 substratı olan deksametazonun (1, 2 ve 3. günde 8 mg tek doz oralolarak) birlikte uygulanmasıyla, EAAo-24saat'i 1. günde %100, 2. günde %86 ve 3. günde %18oranında artırmıştır.Kemoterapötik ilaçlarFosaprepitant 150 mg'ın kemoterapötik ilaçlarla etkileşim çalışmaları yapılmamıştır; ancak, oral aprepitant ve dosetaksel ve vinorelbin ile yapılan çalışmalara dayanarak, intravenöz uygulanandosetaksel ve vinorelbin fosaprepitant 150 mg ile klinik açıdan alakalı bir etkileşimi olmamasıbeklenmemektedir. CYP3A4 tarafından esas olarak veya kısmen metabolize edilen oralkemoterapötik tıbbi ürünlerle (örn., etoposid, vinorelbin) etkileşim gözardı edilemez. Primer veyakısmen CYP3A4 tarafından metabolize edilen tıbbi ürünleri alan hastalar için dikkatli olunması veilave izleme yapılması uygun olabilir (Bkz. Bölüm 4.4). İfosfamitin potansiyel bir adversreaksiyonu olan nörotoksisitenin pazarlama sonrası olayları, aprepitant ve ifosfamitin beraberuygulanmasından sonra rapor edilmeye başlanmıştır. İmmünosupresanlar7/25 Tek bir 150 mg fosaprepitant dozunu takiben, 2 günlük geçici orta dereceli bir artışın ardından, CYP3A4 (örn., siklosporin, takrolimus, everolimus ve sirolimus) tarafından metabolize edilenimmünosüpresanların maruziyetinde küçük bir azalma beklenmektedir. Artmış maruziyetinsüresinin kısalığı göz önüne alındığında, FOSEMAZON uygulamasının yapıldığı gün vesonrasında Terapötik Doz İzlemeye dayalı immünosüpresan dozunda bir azaltmaönerilmemektedir. Midazolam1. gün ve 4. günde 2 mg tek doz oral olarak uygulanan midazolam ile 1. günde tek bir intravenöz doz halinde uygulanan 150 mg fosaprepitant; 1. günde midazolamın EAAo-® değerini %77 oranındaartırmıştır ve 4. günde hiç etki göstermemiştir. Zayıf bir CYP3A4 inhibitörü olan fosaprepitant 150mg, 1. günde tek doz olarak uygulandığında, 4. Günde gözlemlenen CYP3A4 inhibisyonu veyaindüksiyonu olduğuna dair hiçbir kanıt bulunmamaktadır. CYP3A4 ile metabolize edilen midazolam ve diğer benzodiazepinlerin (alprazolam, triazolam) plazma konsantrasyonlarındaki artışın potansiyel etkileri, FOSEMAZON'un bu tıbbi ürünlerle eşzamanlı uygulanması sırasında göz önünde bulundurulmalıdır. DiltiazemFosaprepitant 150 mg ve diltiazem ile etkileşim çalışmaları henüz yapılmamıştır; bununla birlikte, diltiazem ile birlikte FOSEMAZON 150 mg kullanıldığında, 100 mg fosaprepitant ile yapılanaşağıdaki çalışma dikkate alınmalıdır. Hafif ve orta şiddette hipertansiyon hastalarında günde 3 kezdiltiazem 120 mg ile 15 dakika boyunca 100 mg fosaprepitant verilmesi ile diltiazem'in EAA'ını1,4 kat arttırmış ve kan basıncında klinik olarak anlamlı bir azalma ile sonuçlanmış olup, kalphızında veya PR aralığında klinik olarak anlamlı bir değişiklikle sonuçlanmamıştır. İndüksiyonFosaprepitant 150 mg tek doz, midazolam etkileşim çalışmasında 1. ve 4. günlerde CYP3A4'ü indüklememiştir. Fosaprepitantın, ilk aprepitant dozundan 6-8 gün sonra maksimum etki ile geçicibir indüksiyonun gözlemlendiği 3 günlük oral aprepitant rejiminin uygulanmasından daha az veyadaha fazla CYP2C9, CYP3A4 ve glukuronidasyon indüksiyonuna neden olmayacağıöngörülmektedir. 3 günlük oral aprepitant rejimi, CYP2C9 substratlarının EAA'sında %30-35'likbir azalma ve etinil estradiol konsantrasyonlarında %64'e kadar bir azalma olmasını sağladı.CYP2C8 ve CYP2C19 üzerindeki etkilerle ilgili veriler eksiktir. Varfarin, asenokumarol,tolbutamid, fenitoin veya CYP2C9 tarafından metabolize edildiği bilinen diğer aktif maddelerFOSEMAZON ile uygulandığında dikkatli olunmalıdır. VarfarinKronik varfarin tedavisi gören hastalarda, kemoterapinin neden olduğu bulantı ve kusmayı önleme amaçlı FOSEMAZON kullanımı sırasında ve tedavi sonrasında 14 gün boyunca protrombin zamanı(INR) yakından izlenmelidir (Bkz. Bölüm 4.4). 8/25 Hormonal kontraseptiflerFosaprepitantın uygulanması sırasında ve uygulanmasından sonraki 28 gün boyunca hormonal kontraseptiflerin etkinliği azalabilir. Fosaprepitant tedavisi sırasında ve fosaprepitantın son dozunutakiben 2 ay süreyle alternatif hormon içermeyen destekleyici kontrasepsiyon yöntemlerikullanılmalıdır. 5-HT3antagonistleriFosaprepitant 150 mg ve 5353antagonistlerinin birlikte kullanımıile etkileşime dair bir kanıt bulunmamaktadır.150 mg fosaprepitantın uygulanması sonucu aprepitantın farmakokinetiği üzerine diğer tıbbi ürünlerin etkisiKombinasyonda aprepitantın plazma konsantrasyonlarının birkaç kat artması beklendiği için, fosaprepitantın, CYP3A4 aktivitesini inhibe eden aktif maddelerle (örn., Ketokonazol, itrakonazol,vorikonazol, posakonazol, klaritromisin, telitromisin, nefazodon ve proteaz inhibitörleri) beraberuygulanmasında dikkatli olunmalıdır (Bkz. Bölüm 4.4). Ketokonazol oral aprepitantın terminalyarı ömrünü yaklaşık 3 kat arttırmıştır. Fosaprepitantın CYP3A4 aktivitesini kuvvetli olarak indükleyen aktif maddelerle (örn., Rifampisin, fenitoin, karbamazepin, fenobarbital) birlikte kullanılmasından kaçınılmalıdır. Çünkübu kombinasyonlar aprepitantın plazma konsantrasyonlarında azalmaya yol açar ve Fosaprepitanınetkinliğinde azalmaya neden olabilir. Fosaprepitantın St. John's Wort (Hypericum perforatum)içeren bitkisel müstahzarlarla birlikte uygulanması önerilmemektedir. Rifampisin oral aprepitantınortalama terminal yarı ömrünü, %68 azaltmıştır. DiltiazemFosaprepitant 150 mg ve diltiazem ile etkileşim çalışmaları henüz yapılmamıştır; ancak FOSEMAZON 150 mg'ı diltiazem ile birlikte kullanırken, 100 mg fosaprepitant ile yapılanaşağıdaki çalışma dikkate alınmalıdır. 100 mg fosaprepitantın 15 dakikada diltiazem ile 120 mg 3kez infüzyonu, aprepitant EAA'nın 1,5 kat artmasına neden olmuştur. Bu etki klinik olarak önemlisayılmamıştır. Özel popülasyonlara ilişkin ek bilgilerEk bilgi bulunmamaktadır. Pediatrik popülasyonEtkileşim çalışmaları sadece yetişkinlerde gerçekleştirilmiştir. 9/25 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: B Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hormonal kontraseptiflerin etkinliği, fosaprepitantın verilmesinden sonra ve 28 gün boyunca azalabilir.Fosaprepitant tedavisi srasında ve son fosaprepitant dozunu takiben 2 ay süreyle kontraseptif içinalternatif, hormon içermeyen alternatif yöntemler kullanılmalıdır (Bkz. Bölüm 4.4 ve 4.5). Gebelik dönemiFosaprepitant ve aprepitant için gebelikte maruz kalmaya ilişkin klinik veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik, embriyonal / fetal gelişim, doğum ya da doğumsonrası gelişim açısından doğrudan ya da dolaylı olarak zararlı etkiler göstermemektedir (Bkz.Bölüm 5.3). FOSEMAZON çok gerekli olmadıkça gebelik sırasında kullanılmamalıdır. Gebe kadınlara uygulanırken tedbirli olunmalıdır. Laktasyon dönemiAprepitant, fosaprepitantın intravenöz uygulanmasından sonra ve aynı zamanda aprepitantın oral uygulamasından sonra sıçanların sütüne geçmiştir. Aprepitantın insan sütüne geçip geçmediğibilinmemektedir. FOSEMAZON ile tedavisi sırasında emzirme önerilmemektedir. Üreme yeteneği/FertiliteFosaprepitant ve aprepitant'ın doğurganlık üzerindeki potansiyeli tam olarak karakterize edilmemiştir, çünkü insanlarda gözlenen terapötik maruziyetin üzerindeki maruziyet düzeylerinehayvan çalışmalarında ulaşılmamıştır. Bu doğurganlık çalışmaları çiftleşme performansı,doğurganlık, embriyonik / fetal gelişim veya sperm sayımı ve motilite açısından doğrudan veyadolaylı zararlı etkiler göstermemiştir (Bkz. Bölüm 5.3). Fosaprepitant ve aprepitantın üremetoksisiteleri potansiyeli tam olarak karakterize edilmemiştir çünkü insanlardaki terapötikmaruziyetin üzerindeki maruz kalma seviyeleri hayvan çalışmalarında elde edilememiştir.Nörokinin düzenlenmesindeki değişikliklerin üreme üzerine potansiyel etkileri bilinmemektedir. 4.7. Araç ve makine kullanımı üzerindeki etkilerFOSEMAZON, makine sürme ve kullanma becerisinde hafif bir etki oluşturabilir. Baş dönmesi ve yorgunluk, FOSEMAZON uygulamasının ardından ortaya çıkabilir (Bkz. Bölüm 4.8). 10/25 4.8. İstenmeyen etkilerGüvenlik profilinin özetiKlinik araştırmalarda 371 sağlıklı kişi ve 2.084 hasta ve 199 çocuk ve adolesan kemoterapi kaynaklı bulantı ve kusma (CINV) hastası olmak üzere toplam 2.687 kişiye çeşitli fosaprepitantformülasyonları uygulandı. Fosaprepitant aprepitanta dönüştürüldüğünden, aprepitant ile ilişkili buadvers reaksiyonların fosaprepitant ile oluşması beklenir. Aprepitantın güvenlik profili yaklaşık6.500 yetişkin ve 184 çocuk ve adolesanda değerlendirildi. Oral aprepitantYüksek derecede emetojenik kemoterapi (HEC) gören hastalarda, standart tedaviye göre aprepitant ile tedavi edilen hastalarda daha yüksek insidansla rapor edilen en yaygın advers reaksiyonlarşunlardır: hıçkırık (%4,6'e karşılık %2,9), alanin aminotransferaz (ALT) artışı (%2,8'e karşılık%1,1), dispepsi (%2,6'a karşılık %2,0), kabızlık (%2,4'e karşılık %2,0), baş ağrısı (%2,0'a karşılık%1,8) ve iştah azalması (%2,0'a karşılık %0,5). Orta derecede emetojenik kemoterapi (MEC) alanhastalarda, standart tedaviyle karşılaştırıldığında aprepitant tedavisi ile tedavi edilmiş hastalardadaha yüksek bir insidansla bildirilen en yaygın advers reaksiyon yorgunluk olmuştur (%1,4'ekarşılık %0,9). Emetojenik kanser kemoterapisi gören, kontrol tedavisine göre aprepitant ile tedavi edilen pediatrik hastalarda daha yüksek insidansla rapor edilen en yaygın advers reaksiyon hıçkırık (%3,3'e karşı%0,0) ve ciltte kızarmadır (%1,1'e karşı %0,0). Advers reaksiyonlar - aprepitant:Aşağıdaki advers reaksiyonlar, pazarlama sonrası kullanımda veya erişkin ve pediatrik hastalarda HEC ve MEC çalışmalarının birleştirilmiş analizinde standart tedaviye kıyasla oral aprepitanttedavisi ile daha yüksek insidansla gözlenmiştir. Verilen sıklık kategorileri yetişkinlerdeki çalışmalara dayanmaktadır; pediatrik çalışmalarda gözlenen sıklıklar, tabloda gösterilmediği sürece benzerdir ya da daha düşüktür. Yetişkinpopülasyonundaki yaygın olmayan advers reaksiyonların bazıları pediatrik çalışmalardagözlenmemiştir. Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Enfeksiyonlar ve enfestasyonlarSeyrek: Kandidiyaz, stafilokok enfeksiyonu Kan ve lenf sistemi hastalıklarıYaygın olmayan: Febril nötropeni, anemi 11/25 Bağışıklık sistemi hastalıklarıBilinmiyor: Anafilaktik reaksiyonları içeren aşırı duyarlılık reaksiyonları Metabolizma ve beslenme hastalıklarıYaygın: İştah azalması Seyrek: Polidipsi Psikiyatrik hastalıklarYaygın olmayan: Anksiyete Seyrek: Oryantasyon bozukluğu, öforik duygu durum Sinir sistemi hastalıklarıYaygın: Baş ağrısıYaygın olmayan: Baş dönmesi, somnolans (uyuklama) Seyrek: Kognitif bozukluk, letarji, disguzi Göz hastalıklarıSeyrek: Konjonktivit Kulak ve iç kulak hastalıklarıSeyrek: Tinnitus Kardiyak hastalıklarYaygın olmayan: Palpitasyon Seyrek: Bradikardi, kardiyovasküler bozukluk Vasküler hastalıklarYaygın olmayan: Sıcak basması Solunum göğüs hastalıkları ve mediastinal hastalıklarYaygın: HıçkırıkSeyrek: Orofarengeal ağrı, hapşırma, öksürük, postnazal sızıntı, boğaz tahrişi Gastrointestinal hastalıklarYaygın: Kabızlık, dispepsiYaygın olamayan: Erüktasyon, mide bulantısı*, kusma*, gastroözofageal reflü hastalığı, karın ağrısı, ağız kuruluğu, gaz Seyrek: Duodenal ülser perforasyonu, stomatit, abdominal distansiyon, sert dışkı, nötropenik kolit. 12/25 Deri ve deri altı doku hastalıklarıYaygın olamayan: Döküntü, akneSeyrek: Fotosensitiv reaksiyon, hiperhidroz, sebore, cilt lezyonu, kaşıntılı döküntü, Stevens Johnson sendromu / toksik epidermal nekrolizBilinmiyor: Pruritus, ürtiker Kas-iskelet, bağ doku ve kemik hastalıklarıSeyrek: Kas zayıflığı, kas spazmları Böbrek ve idrar yolu hastalıklarıYaygın olmayan: Disüri Seyrek: Pollakiüri Genel ve uygulama bölgesine ilişkin hastalıklarYaygın: YorgunlukYaygın olmayan: Halsizlik, kırıklık Seyrek: Ödem, göğüste huzursuzluk, yürüme bozukluğu Laboratuvar bulgularıYaygın: ALT artışıYaygın olmayan: AST artışı, kanda alkalen fosfataz artışı Seyrek: İdrarda kırmızı kan hücreleri pozitif, kan sodyum seviyesinde azalma, kilo kaybı, notrofil sayısında azalma, idrarda glukoz varlığı, idrar miktarında artış * Bulantı ve kusma, postkemoterapi tedavisinin ilk 5 gününde etkinlik parametreleridir ve bundan sonra sadece advers etkileri olduğu bildirilmiştir. Seçilmiş advers reaksiyonların tarifiOrta derecede ve yüksek derecede emetojenik kemoterapi çalışmalarında çoklu kürlerin 6 ilave kemoterapi kürüne kadar uzatılması sırasında gözlenen advers reaksiyon profilleri 1. kürdegözlenen profillerle genel olarak benzerdir. Aprepitant ve yüksek derecede emetojenik kemoterapi alan 1.169 hastada yürütülen başka bir aktif-kontrollü klinik çalışmada advers reaksiyonların profili, aprepitant ile yürütülen diğer emetojenik kemoterapi çalışmalarında gözlenenlerle genel olarak benzerdir. Postoperatif bulantı ve kusma için aprepitant ile tedavi edilen hastalarda ondansetrondan daha yüksek insidansla rapor edilen diğer yan etkiler şunlardır: üst abdominal ağrı, anormal barsaksesleri, kabızlık*, disartri, dispne, hipoestezi, uykusuzluk, miyozis, bulantı, duyusal bozukluk,mide rahatsızlığı, sub-ileus*, görme keskinliğinde azalma, hırıltılı solunum. *Aprepitantın daha yüksek bir dozunu alan hastalarda bildirilmiştir. 13/25 FosaprepitantHEC uygulanan hastalarda aktif kontrollü bir klinik araştırmada, fosaprepitant 150 mg'lık 1 günlük rejimi alan 1.143 hasta ile aprepitant 3 günlük rejimi alan 1.169 hasta arasında güvenlikdeğerlendirilmesi yapılmıştır. Ek olarak, MEC alan hastaların katıldığı plasebo kontrollü bir klinikaraştırmada, kontrol rejimi alan 497 hastayla karşılaştırıldığında tek doz fosaprepitant 150 mg alan504 hastada güvenlik değerlendirilmesi yapılmıştır. HEC veya MEC tedavisi almakta olan ve önerilen 1 günlük rejim dozunda veya bu dozun üstünde olmak üzere tek doz fosaprepitant dimeglumin alan pediyatrik hastalarda (6 aylıktan 17 yaşa kadar)yapılmış olan 3 aktif kontrollü klinik çalışmanın birleştirilmiş analizinde, fosaprepitantdimegluminin 1 günlük rejimini alan 139 hasta için güvenlilik değerlendirilmiştir. Aynı analizde,HEC veya MEC alan hastalar ve önerilen 3 günlük fosaprepitant rejiminde veya üzerinde tek birdoz foseprepitant alan 199 hastada güvenlilik değerlendirilmiştir. 3 günlük IV/oral/oral rejimininuygulanmasını takiben elde edilen güvenlilik verileri de dahil edilmiştir. Pediatrik hastalarda 3 günlük IV fosaprepitant rejiminin uygulanmasına ilişkin veri bulunmamaktadır. Pediatrik hastalarda 3 günlük IV fosaprepitant rejiminin güvenlik profilinin,düşük düzeydeki günlük seviyelerin sonraki günlerde maruz kalma oranlarını önemli ölçüdeartırmaması nedeniyle, 1 günlük fosaprepitant rejimine benzer olması beklenmektedir. Yetişkinlerde ve pediatrik hastalarda fosaprepitantın güvenlilik profili, aprepitant ile gözlenene genel olarak benzerdir. Advers reaksiyonlar - fosaprepitantAşağıda, yukarıda tarif edildiği gibi aprepitant ile rapor edilmemiş olan klinik çalışmalarda veya pazarlama sonrası fosaprepitant alan erişkin hastalarda rapor edilmiş olan advers reaksiyonlarverilmektedir. Verilen sıklık kategorileri yetişkinlerdeki çalışmalara dayanmaktadır; pediyatrikçalışmalarda gözlenen sıklıklar, tabloda gösterilmediği sürece benzerdir ya da daha düşüktür.Yetişkin popülasyonundaki yaygın olan advers reaksiyonların bazıları pediyatrik çalışmalardagözlenmemiştir. Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Vasküler hastalıklarYaygın olmayan: Ciltte kızarma, tromboflebit (baskın olarak infüzyon bölgesi tromboflebiti) Deri ve deri altı doku hastalıkları Yaygın olmayan: Eritem 14/25 Genel ve uygulama bölgesine ilişkin hastalıklarYaygın olmayan: İnfüzyon bölgesinde eritem, infüzyon bölgesi ağrısı, infüzyon bölgesinde kaşıntı. Seyrek: İnfüzyon bölgesinde sertlik. Bilinmiyor: Kızarma, eritem, dispne ve anafilaktik reaksiyonlar/anafilaktik şok dahil ani aşırı duyarlılık reaksiyonları. AraştırmalarYaygın olmayan: Kan basıncı artışı. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanaksağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiDoz aşımı durumunda, FOSEMAZON kesilmelidir ve genel destekleyici tedavi ve takip sağlanmalıdır. Aprepitantın antiemetik etkililiğinden dolayı, ilaç yoluyla kusturma etkiliolmayabilir. Aprepitant hemodiyaliz ile uzaklaştırılamaz. 5.FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antiemetikler ve bulantıya karşı kullanılan ilaçlar ATC kodu: A04AD12 Fosaprepitant, aprepitantın ön ilacıdır ve intravenöz olarak uygulandığında hızla aprepitanta dönüşür. (Bkz. Bölüm 5.2). Fosaprepitantın genel antiemetik etkiye katkısı tam olarak karakterizeedilememiştir, ancak başlangıç aşamasında geçici bir katkısının olduğu göz ardı edilemez.Aprepitant, insanda P maddesi nörokinin 1 (NKı) reseptörlerinin seçici, yüksek afiniteli birantagonistidir. Fosaprepitantın farmakolojik etkisi aprepitant'a bağlanmaktadır. Yetişkinlerde Fosaprepitant'ın 1 Günlük Rejimi Yüksek Emetojenik Kemoterapi (HEC)Randomize, paralel, çift kör, aktif kontrollü bir çalışmada fosaprepitant 150 mg (N = 1.147), sisplatin (>70 mg/m2) içeren, HEC rejimi alan hastalarda 3 günlük aprepitant rejimi ile (N = 1.175)karşılaştırıldı. 15/25 Fosaprepitant kombinasyon rejimi, 1. günde 150 mg fosaprepitant ve 1. günde 32 mg i.v ondansetron ve 1. günde 12 mg deksametazon, 2. gün 8 mg deksametazon ve 3. ve 4. günlerdegünde iki kez 8 mg deksametazondan oluşturulmuştur. Aprepitant kombinasyon rejimi, 1. günde 125 mg olmak üzere 2. ve 3. günlerde günde 80 mg aprepitant, 1. günde 32 mg i.v ondansetron ve 1. günde 12 mg deksametazon ve 2. ila 4. günlerde8 mg deksametazon olacak şekilde oluşturulmuştur. Körlüğü sürdürmek için plasebo fosaprepitant,plasebo aprepitant ve plasebo deksametazon (3. ve 4. günlerin akşamları) kullanıldı (Bkz. Bölüm4.2). Klinik çalışmalarda 32 mg intravenöz dozda ondansetron kullanılmış olsa da, bu artık tavsiyeedilen doz değildir. Uygun dozaj bilgileri için seçilen 5-HT3 antagonistinin ürün bilgilerinebakınız. Etkinlik, aşağıdaki kompozit önlemlerin değerlendirilmesine dayanmaktadır: hem genel hem de gecikmiş fazlarda tam yanıt ve genel fazında kusma yoktur. Fosaprepitant 150 mg'ın 3 günlükaprepitant rejimine göre üstün olmadığı gösterildi. Birincil ve ikincil sonlanım noktalarının birözeti Tablo 3'te gösterilmektedir.
*Primer sonlanım noktaları kalın harflerle yazılmıştır. **N: Tam yanıtın primer analizinde yer alan erişkin hasta sayısı. t Fark ve güven aralığı (CI) Miettinen ve Nurminen tarafından önerilen ve cinsiyete göre düzeltilmiş yöntem kullanılarak hesaplanmıştır. JTam yanıt = kusma yok ve kurtarma tedavisi yok. § Genel = Sisplatin kemoterapisinin başlamasından 0 ila 120 saat sonra. §§ Gecikmiş faz = Sisplatin kemoterapisinin başlamasından 25 ila 120 saat sonra. Orta derecede emetojenik kemoterapi (MEC)Randomize, paralel, çift-kör, plasebo kontrollü bir çalışmada, orta derecede emetojenik kemoterapi rejimi alan yetişkin hastalarda ondansetron ve deksametazon ile birlikte fosaprepitant 150 mg (N= 502), tek başına ondansetron ve deksametazon (kontrol rejimi) ile karşılaştırıldı (N = 498). 16/25 Fosaprepitant rejimi, 1. günde 150 mg fosaprepitant ile birlikte 2 doz 8 mg oral ondansetron ve 12 mg oral deksametazondan oluşmaktadır. 2. ve 3. günlerde, fosaprepitant grubundaki hastalara, her12 saatte bir ondansetron yerine plasebo verildi. Kontrol rejimi, 1. günde 150 mg i.v plasebo fosaprepitant ile birlikte 2 doz 8 mg oral ondansetron ve 20 mg oral deksametazondan oluşmaktadır. 2. ve 3. günde, kontrol grubundaki hastalar her 12saatte bir 8 mg oral ondansetron aldı. Plasebo fosaprepitant ve plasebo deksametazon (1. günde)körlüğü devam ettirmek için kullanıldı. Fosaprepitantın etkinliği, Tablo 4'de listelenen primer ve sekonder sonlanım noktalarına dayanılarak değerlendirildi ve gecikmiş ve genel fazlardaki tam yanıt açısından kontrol rejimindendaha üstün olduğu gösterildi.
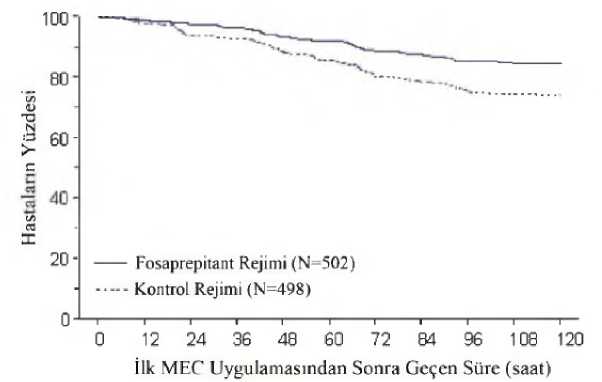
**Birincil sonlanım noktaları kalın harflerle gösterilmiştir. **N: Popülasyonun tedavi edilme amacına dahil edilen erişkin hasta sayısı. t Tam yanıt = kusma yok ve kurtarma tedavisi yok. J Gecikmiş faz = Kemoterapi başlamasından sonraki 25 ve 120 saat arası. § Genel = Kemoterapi başlamasından sonraki 0 ve 120 saat arası. §§Akut = Kemoterapi başlamasından sonraki 0 ve 24 saat arası. İlk kusmaya kadar geçen tahmini süre Şekil 1'deki Kaplan-Meier grafiği ile gösterilmiştir. 17/25 Şekil 1 Orta derecede emetojenik kemoterapi alan, zamandan bağımsız kusma yaşayan yetişkin hastaların yüzdesi Pediatrik PopülasyonAktif-kontrollü, açık etiketli 3 klinik çalışmada, yüksek veya orta derecede emetojenik kemoterapi alan 6 ay ila 17 yaş arası pediyatrik hastalar, önerilen tek günlük rejim dozunda (139 hasta) veya 3günlük rejim (199 hasta) dozunda, deksametazon içeren veya içermeyen, ondansetron ilekombinasyon halinde tek doz fosaprepitant almışlardır. 1 Günlük Fosaprepitant Rejimi Alan Pediatrik HastalarPediyatrik hastalarda 1 günlük fosaprepitant rejiminin etkililiği, yetişkinlerde Fosaprepitantın 1 Günlük Rejimi altbölümünde tanımlandığı gibi, 1 günlük fosaprepitant rejimini alan yetişkinlerdenelde edilen verilere göre tahmin edilmiştir. Pediyatrik hastalarda 1 günlük fosaprepitant rejiminin etkililiğinin, 1 günlük yetişkin fosaprepitant rejimine benzer olması beklenmektedir. 3 Günlük Fosaprepitant Rejimi Alan Pediatrik HastalarPediatrik hastalarda 3 günlük fosaprepitant rejiminin etkililiği, 3 günlük oral aprepitant rejimini alan pediatrik hastalarda gösterilmiştir. Pediatrik hastalarda 3 günlük fosaprepitant rejiminin etkililiğinin, 3 günlük oral aprepitant rejimine benzer olması beklenmektedir. 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim18/25 Aprepitant'ın bir ön ilacı olan fosaprepitant, intravenöz uygulandığında hızla aprepitanta dönüştürülür. Fosaprepitantın plazma konsantrasyonları, infüzyonun tamamlanmasından sonraki30 dakika içinde ölçülebilir seviyelerin altındadır. Fosepritant uygulamasından sonra aprepitantSağlıklı erişkin gönüllülere 20 dakikalık bir infüzyonla uygulanan tek doz intravenöz 150 mg fosaprepitantı takiben, aprepitantın EAA o-® ortalaması 35,0 |ig.saat/mL ve ortalama maksimalaprepitant konsantrasyonu 4.01 |ig/mL'dir.DağılımAprepitant plazma proteinlerine yüksek oranda (ortalama %97) bağlanır. Tek bir 150 mg'lık intravenöz fosaprepitant dozundan sonra, aprepitantın kararlı durumdaki dağılımının geometrikortalama hacmi (Vdss), insanlarda yaklaşık 82 L'dir. BiyotransformasyonFosaprepitant, insanlardan gelen karaciğer preparatlarıyla in vitro inkübasyonlarda hızla aprepitanta dönüştürülür. Ayrıca, fosaprepitant, böbrek, akciğer ve ileum da dahil olmak üzerediğer insan dokularından gelen S9 preparatlarında aprepitanta hızlı ve neredeyse tamamendönüştürülmüştür. Böylece, fosaprepitantın aprepitanta dönüşmesinin birden fazla dokudaoluşabileceği görülmektedir. İnsanlarda intravenöz olarak uygulanan fosaprepitant, infüzyonunbitiminden sonra 30 dakika içinde hızla aprepitanta dönüştürülür. Aprepitant geniş ölçüde metabolizasyona uğrar. Sağlıklı genç erişkinlerde, aprepitantın bir ön ilacı olan fosaprepitantın [14C] ile işaretlenmiş tekli 100 mg dozunun intravenöz yolla uygulanmasındansonra aprepitant 72 saat boyunca plazmadaki radyoaktivitenin yaklaşık %19'unu oluşturmaktadır;bu, plazmada metabolitlerin kayda değer varlığını gösterir. İnsan plazmasında aprepitantın 12metaboliti saptanmıştır. Aprepitant metabolizması büyük ölçüde morfolin halkası ve yanzincirlerinin oksidasyonuyla gerçekleşir ve oluşan metabolitler çok zayıf şekilde aktiftir. İnsankaraciğer mikrozomlarının kullanılarak yapıldığı in vitro çalışmalar, aprepitant'ın başlıca CYP3A4ile daha az oranda CYP1A2 ve CYP2C19 ile metabolizmaya uğradığını göstermiştir. İdrar, dışkı ve plazmada intravenöz 100 mg [14C]- fosaprepitant dozunu takiben gözlemlenen tüm metabolitler, oral [14C]- aprepitant dozunda da gözlemlendi. 245,3 mg fosaprepitant dimeglumin(150 mg mg fosaprepitant ile eşdeğer) aprepitanta dönüştürüldüğünde, 23,9 mg fosforik asit ve95,3 mg meglumin oluşur. EliminasyonAprepitant idrara değişmemiş şekilde atılmaz. Metabolitler idrarla atılır ve safra yoluyla dışkıya geçerek dışkı ile atılır. Sağlıklı kişilere [ 14C]-fosaprepitantın tekli intravenöz 100 mg dozununuygulanmasının ardından radyoaktivitenin %57'si idrarda ve %45'i feçeste bulunmuştur. 19/25 Aprepitantın farmakokinetiği klinik doz aralığında doğrusal değildir. 150 mg'lık bir intravenöz fosaprepitant dozunu takiben aprepitantın terminal yarı ömrü yaklaşık 11 saattir. 150 mg'lık birintravenöz fosaprepitant dozunun ardından aprepitantın geometrik ortalama plazma klirensiyaklaşık olarak 73 mL/dakika idi. Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Ciddi böbrek yetmezliği (CrCl < 30 mL/dakika) ve hemodiyaliz gerektiren son evre böbrek hastalığı (SEBH) olan hastalara tek bir doz 240 mg oral aprepitant uygulanmıştır. Ciddi böbrek yetmezliği olan hastalarda total aprepitantın EAA o-o-® değeri %42 azalırken, Cmaks %32 azalmıştır. Böbrek hastalığıolan hastalarda aprepitantın proteinlere bağlanmasındaki küçük azalmalara bağlı olarak,farmakolojik yönden aktif, bağlanmamış ilacın EAA'sı böbrek yetmezliği olan hastalarda sağlıklıkişilere göre anlamlı olarak etkilenmemiştir. Doz verildikten 4-48 saat sonra yapılan hemodiyalizinaprepitantın farmakokinetiği üzerinde anlamlı etkisi olmamış ve dozun %0,2'sinden azı diyalizmaddesinde saptanmıştır.Böbrek yetmezliği olan hastalarda ve hemodiyalize giren SEBH'li hastalarda FOSEMAZON dozunda ayarlama yapılması gerekmez. Karaciğer yetmezliği:Fosaprepitant çeşitli ekstrahepatik dokularda metabolize olur; dolayısıyla karaciğer yetmezliğinin fosaprepitantın aprepitanta dönüşümünü değiştirmesi beklenmemektedir. Hafif karaciğeryetmezliği (Child-Pugh sınıf A), aprepitantın farmakokinetiğini klinik açıdan önemli derecedeetkilemez. Hafif karaciğer yetmezliği olan hastalar için doz ayarlaması gerekli değildir. Mevcutverilere dayanarak, orta düzeyde karaciğer yetmezliğinin (Child-Pugh sınıf B) aprepitantfarmakokinetiği üzerindeki etkisi hakkında yargıya varılamaz. Şiddetli karaciğer yetmezliği olan hastalara (Child-Pugh sınıf C) ilişkin herhangi bir klinik veya farmakokinetik veri yoktur. Pediatrik popülasyon:3 günlük IV/IV/IV rejiminin bir parçası olarak, pediyatrik hastalarda (6 aydan 17 yaşına kadar), 1. günde medyan plazma pik konsantrasyonu (Cmax) ve 1. gün, 2. gün ve 3. Gün sonunda medyankonsantrasyonlar ile beraber aprepitantın simüle edilmiş medyan AUC o-24Tablo 5. Pediatrik hastalarda 3 günlük IV fosaprepitant rejimi için aprepitantın farmakokinetik parametreleri20/25
1 günlük IV fosaprepitant uygulamasında, pediyatrik hastalarda (6 aydan < 12 yaşına kadar), 1. günde medyan plazma pik konsantrasyonu (Cmax) ve 1. gün, 2. gün ve 3. gün sonunda medyankonsantrasyonlar ile beraber aprepitantın simüle edilmiş medyan AUC o-24saat verileri ve pediatrikhastalarda (12 yaştan 17 yaşa kadar) 1. günde medyan plazma pik konsantrasyonu (Cmax) ve 1. gün,2. gün ve 3. gün sonunda medyan konsantrasyonlar ile beraber gözlenen ortalama AUC o-24saatverileri Tablo 6'da gösterilmektedir.
Pediatrik hastalarda (6 aylık ila 17 yaş arası) aprepitantın bir popülasyon farmakokinetik analizinde, cinsiyet ve ırkın aprepitantın farmakokinetiği üzerinde klinik olarak anlamlı bir etkiyesahip olmadığını belirtilmektedir. Konsantrasyon ve etki arasındaki ilişkiTek doz intravenöz 150 mg fosaprepitant uygulanan sağlıklı genç erkeklerde, yüksek düzeyde spesifik bir NKı-reseptör izleyici kullanılarak yapılan pozitron emisyon tomografisi (PET)çalışmalarında, aprepitantın beyne nüfuz ettiği, doza ve plazma konsantrasyonuna bağlı bir şekildeNKı reseptörlerine bağlandığı, NKı reseptör doluluk oranının Tmaks ve 24. Saatte >%100, 48. saatte%97 ve 120. saatte %41 ve %75 arasında olduğu gösterilmiştir. 21/25 Bu çalışmada, beyin NKı reseptörlerinin doluluk oranı aprepitant plazma konsantrasyonları ile iyi korelasyon gösterdiği tespit edilmiştir. 5.3. Klinik öncesi güvenlilik verileriFosaprepitantın intravenöz uygulanması ve aprepitantın oral uygulanması ile elde edilen klinik öncesi veriler, tekli ve tekrarlı doz toksisitesi, genotoksisite (in vitrotestler dahil) ve üremetoksisitesi konvansiyonel çalışmalar insanlar için herhangi bir özel tehlikeyi ortayakoymamaktadır.Kemirgenlerdeki kanserojen potansiyeli, sadece oral aprepitant ile araştırılmıştır. Bununla birlikte, kemirgen, tavşan ve maymun ile yapılan toksisite çalışmalarının üreme toksisitesi çalışmaları dadahil olmak üzere, sınırlı olduğu düşünülmektedir, çünkü fosaprepitant ve aprepitantın sistemikmaruz kalmaları, insanlardaki terapötik maruz kalmaya yalnızca benzer veya hatta insandan dahadüşüktür. Yapılan güvenlik farmakolojisi ve köpeklerle yapılan tekrarlanan doz toksisitearaştırmalarında, fosaprepitant Cmaks ve aprepitant EAA değerleri sırasıyla klinik değerlerden 3 katve 40 kata kadar daha yüksekti. Fosaprepitant ile tedavi edilen yavru köpeklerde (doğum sonrası 14. günden 42. güne kadar), yapılan toksisite çalışmasında; erkeklerde 6 mg/kg/gün dozda, azalmış testiküler ağırlık ve Leydighücre büyüklüğü görüldü, dişilerde 4 mg/kg/gün dozda uterus ağırlığının artması, rahim ve servikshipertrofisi ve vajinal dokuların ödemleri görülmüştür. Doğum sonrası 10. günden 63. gündeaprepitant ile tedavi edilen yavru sıçanlarda yapılan bir toksisite çalışmasında; dişilerde günde 2defa 250 mg/kg dozda daha erken vajinal açılma ve erkeklerde günde 2 defa 10 mg/kg gecikmişpreputial ayrılma görülmüştür. Bu çalışmada çiftleşme, fertilite veya embriyonik / fetal sağkalımüzerine tedavi ile ilgili etkiler olmamıştır ve üreme organlarında patolojik bir değişiklik olmamıştır.Aprepitantın klinik açıdan anlamlı maruz kalınmasında herhangi bir marj yoktu. Kısa süreli tedaviiçin bu bulguların klinik açıdan anlamlı olmadığı düşünülmektedir. Ticari olmayan formülasyonlarda, formülasyona bağlı olarak 1 mg/mL'nin altındaki ve daha yüksek konsantrasyonlardaki fosaprepitant, laboratuvar hayvanlarında vasküler toksisiteye vehemolize neden olmuştur. Fosaprepitant konsantrasyonları 2,3 mg/mL ve daha yüksek olan ticariolmayan formülasyonlar ile insandaki yıkanmış kan hücrelerinde de hemoliz bulgusu vardı, insankanında testler negatifti. İnsan tam kanı ve yıkanmış insan eritrositlerinde 1 mg/mL'lik birfosaprepitant konsantrasyona kadar ticari formülasyonda herhangi bir hemoliz saptanmadı. Tavşanlarda, fosaprepitant, paravenöz, subkütan ve intramüsküler uygulama sonrasında başlangıçta geçici lokal akut inflamasyona neden oldu. İzleme periyodunun sonunda (8. Gün dozsonrası), paravenöz ve intramüsküler uygulama sonrasında az miktarda lokal subakut inflamasyonkaydedildi ve intramüsküler uygulamayı takiben kas rejenerasyonu ile orta derece fokal kasdejenerasyonu / nekrozu eklendiği not edildi. 22/25 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiDisodyum edetat Polisorbat 80Laktoz anhidrusSodyum hidroksitHidroklorik asitEnjeksiyonluk su 6.2. GeçimsizliklerFOSEMAZON, iki değerlikli katyonlar (örn., Ca2+, Mg2+) içeren solüsyonlarla uyumlu değildir. Bu tıbbi ürün, bölüm 6.6'da belirtilenler hariç diğer tıbbi ürünlerle karıştırılmamalıdır. 6.3. Raf ömrü24 ay Çözündürme ve seyreltmeden sonra, kimyasal ve fiziksel kullanım stabilitesi 25°C'de 24 saattir. Mikrobiyolojik açıdan bakıldığında, beşeri tıbbi ürün hemen kullanılmalıdır. Hemen kullanılmadığı takdirde, kullanım öncesi saklama süreleri ve kullanım koşulları kullanıcınınsorumluluğundadır ve normalde 2 ila 8°C'de 24 saatten uzun bekletilmemelidir. 6.4. Saklamaya yönelik özel tedbirlerBuzdolabında (2°C-8°C) saklayınız. Beşeri tıbbi ürünün çözündürülmesi ve seyreltilmesinden sonra saklama koşulları için, bölüm 6.3'e bakınız. 6.5. Ambalajın niteliği ve içeriğiBromobutil tıpa ve şeffaf flip-off kapak ile kapatılmış tip I renksiz cam flakon. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerFOSEMAZON önce rekonstitüye edilmeli ve daha sonra uygulama öncesinde seyreltilmelidir. İntravenöz uygulama için FOSEMAZON 150 mg'ın hazırlanması:1. 5 mL enjeksiyonluk sodyum klorür 9 mg/mL (%0,9) solüsyonunu, köpürmeyi önlemek içinflakon duvarı üzerinden flakona enjekte edin. Flakonu yavaşça döndürerek çözün ve tamamençözündüğünden emin olun, flakonu çalkalamaktan kaçının. 2. 145 mLenjeksiyonluk sodyum klorür 9 mg/ml (%0,9) solüsyonunu bulunan infüzyon torbasıhazırlayın; örneğin, 250 mL enjeksiyonluk sodyum klorür 9 mg/ml (%0,9) solüsyonunu içereninfüzyon torbasından 105 mL'si çıkartılarak.23/25 3. Flakondan tüm solüsyonu geri çekin ve toplam 150 mL hacim elde etmek için enjeksiyonluk145 mL sodyum klorür 9 mg/mL (%0,9) solüsyonu içeren infüzyon torbasına aktarın. Çantayı2-3 kez hafifçe ters çevirin. 4. Hazırlanan bu infüzyon torbasından, önerilen doza göre uygulanacak hacmi belirleyin (Bkz.Bölüm 4.2). YetişkinlerdeHazırlanan infüzyon torbasının (150 ml) tüm hacmi uygulanmalıdır. Pediatrik Hastalarda12 yaş ve üzeri hastalarda uygulanacak hacim, aşağıdaki gibi hesaplanmaktadır: Uygulanacak hacim (mL), önerilen doza (mg) eşittir. 6 ay ila 12 yaş arasındaki hastalarda uygulanacak hacim, aşağıdaki gibi hesaplanmaktadır: Uygulanacak hacim (mL) = önerilen doz (mg / kg) x ağırlık (kg) Not: Maksimum dozlar aşılmamalıdır (Bkz. Bölüm 4.2).5. Eğer gerekirse, 150 mL'den daha az hacimler için, hesaplanan hacim, infüzyon yoluylauygulamadan önce uygun büyüklükteki bir torbaya veya şırınganın içine aktarılabilir. Seyreltilmiş çözeltinin görünüşü, seyrelticinin görünümü ile aynıdır. Seyreltilmiş tıbbi ürün, kullanılmadan önce partiküler madde ve renk değişikliği açısından görsel olarak incelenmelidir. Tıbbi ürün, fiziksel ve kimyasal uyumluluğunun sağlanamadığı çözeltiler ile rekonstitüye edilmemeli veya karıştırılmamalıdır (Bkz. Bölüm 6.2). İmhaya ilişkin özel bir gereklilik yoktur. Beşeri tıbbi ürün, fiziksel ve kimyasal uyumluluğun bulunmadığı solüsyonlarla karıştırılmamalıdır veya çözündürülmemelidir (Bkz. Bölüm 6.2). Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİPOLİFARMA İLAÇ SAN. VE TİC. AŞ. Vakıflar OSB Mahallesi, Sanayi Caddesi, No:22/1 Ergene/TEKİRDAĞTel : 0282 675 14 04 24/25 Faks : 0282 675 14 05 8. RUHSAT NUMARASI2020/140 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 25.06.2020 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ
25/25 |
İlaç BilgileriFosemazon 150 Mg Iv İnfüzyonluk Çözelti Hazırlamada Kullanilacak Konsantre İçin TozEtken Maddesi: Fosaprepitant Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.