Airtide 500/50 Mcg İnhalasyon İçin Toz İçeren Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERI TIBBI ÜRÜNÜN ADIAİRTİDE 500/50 mcg inhalasyon için toz içeren kapsül 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:72,5 mcg 500 mcg Her bir inhalasyon kapsülü içinde Salmeterol ksinafoat * Flutikazon propiyonat *50 mcg salmeterole eşdeğer Yardımcı maddelerLaktoz............................................12,3275 mg (inek sütünden elde edilir.) Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon için Toz İçeren Kapsül Renksiz kapsül içinde beyaz ya da beyazımsı toz 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarAstım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3.basamaktan itibaren verilir. Orta ve ağır KOAH olgularında semptomları veatak sıklığını azaltır. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:AİRTİDE sadece inhalasyon yolu ile uygulanır. Hastalar, belirtileri olmasa dahi optimum fayda için AİRTİDE'ı düzenli olarak kullanmaları gerektiği konusunda uyarılmalıdır. Hastaların düzenli olarak doktor kontrolünde bulundurularak aldıkları AİRTİDE dozunun optimum düzeyde kalması sağlanmalı ve sadece doktor önerisi ile değiştirilmelidir. Alternatif olarak, uzun süre etkili beta2 agonist kullanması gereken hastalarda AİRTİDE, reçete eden hekimin görüşüne göre hastalık kontrolünün sağlanmasında yeterli olacağı düşünülüyorsagünde bir kez olacak şekilde de titre edilebilir. Hastada gece görülen semptom öyküsü varsa vegünde bir kez dozlam uygulanıyorsa doz geceleri verilmeli; hastada genellikle gündüz görülensemptom öyküsü varsa doz sabahları verilmelidir. AstımDoz, belirtileri etkili olarak kontrol eden en düşük doza ayarlanmalıdır. Günde 2 kez uygulanan 1 / 22 AİRTİDE ile belirtilerin kontrolü sağlandığında, etkili en düşük doz açısından, günde 1 kez uygulanan AİRTİDE'de değerlendirmeye dahil edebilir. Hastalara hastalıklarının şiddetine göre uygun flutikazon propiyonat dozu içeren AİRTİDE verilmelidir. Eğer hasta yalnız inhale kortikosteroid tedavisi ile yeterli derecede kontrol edilemiyorsa tedavinin terapötik olarak eşdeğer kortikosteroid dozunda AİRTİDE ile değiştirilmesi astım kontrolündedüzelme sağlayabilir. Astımı yalnız inhale kortikosteroid tedavisi ile yeterli derecede kontroledilebilen hastalarda tedavinin AİRTİDE ile değiştirilmesi astım kontrolünü sürdürürkenkortikosteroid dozunun azaltılmasını sağlayabilir. Daha ayrıntılı bilgi için lütfen Farmakodinamiközellikler bölümüne bakınız. Tavsiye edilen dozlarYetişkinler, 12 yaş ve üzeri adolesanlar:Günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 100 mikrogram flutikazon propiyonat) veya günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 250 mikrogram flutikazon propiyonat) veyagünde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 500 mikrogram flutikazon propiyonat) Hızlı şekilde kontrol edilmesi gereken, orta dereceli inatçı astımı olan erişkin veya adolesan hastalarda (hastanın günlük semptomlarına, günlük kurtarma ilacı kullanımına ve orta ila şiddetlihavayolu sınırlamasına göre tanımlanır) kısa süreli AİRTİDE uygulaması başlangıç tedavisi olarakkabul edilebilir. Bu durumlarda, önerilen başlangıç dozu günde iki kez iki inhalasyon olarak 50mikrogram salmeterol ve 100 mikrogram flutikazon propiyonattır. Astım kontrolü sağlandığında,tedavi tekrar gözden geçirilmeli ve hastaların, tek başına inhale kortikosteroid alacak şekilde dozunazaltılması düşünülmelidir. Tedavide doz azaltılırken hastaların düzenli olarak takip edilmesiönemlidir. Bir veya iki hastalık şiddeti kriteri eksik olduğunda, başlangıç tedavisi olarak tek başına inhale flutikazon propiyonat kullanımına kıyasla net bir yarar gösterilmemiştir. Genel olarak inhalekortikosteroidler hastaların büyük çoğunluğunda birinci basamak tedavi olmaya devam etmektedir.AİRTİDE'ın hafif astımın ilk tedavisinde kullanımı amaçlanmamaktadır. AİRTİDE 50 mikrogram/100 mikrogram dozları, şiddetli astımı olan çocuklarda ve erişkinlerde kullanıma uygun değildir;şiddetli astım hastalarında herhangi bir sabit kombinasyonun kullanılmasından önce uygun inhalekortikosteroid dozunun gösterilmesi önemlidir. Kronik Obstrüktif Akciğer Hastalığı (KOAH)Yetişkin hastalar için tavsiye edilen doz günde 2 kez 1 inhalasyon 50/250 mikrogram-50/500 mikrogram salmeterol/flutikazon propiyonattır. Uygulama şekli:AİRTİDE sadece inhalasyon yoluyla kullanılır. Hastalara inhalerlerini doğru şekilde kullanmaları için bilgi verilmelidir. İnhalasyon sırasında, hastanın tercihen ayakta veya dik oturur konumda olması gerekir. 2 / 22 Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda dozun ayarlanmasına gerek yoktur. Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda AİRTİDE kullanımına ilişkin bilgi yoktur. Pediyatrik popülasyon:4 -12 yaş arası çocuklarda: Günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 100 mikrogram flutikazon propiyonat). 4 yaşından küçük çocuklarda AİRTİDE kullanımı ile ilgili bilgi yoktur. Geriyatrik popülasyon:Yaşlı hastalarda doz ayarlanmasına gerek yoktur. 4.3 KontrendikasyonlarAİRTİDE, etkin madde veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir (bkz. Bölüm 6.1) 4.4 Özel kullanım uyarıları ve önlemleriEtkin maddelerden salmeterol, astımlı hastalarda tek başına monoterapi olarak kullanılmamalıdır.AİRTİDE astım hastalığının başlangıç tedavisi için önerilmez. Hastalığın kötüleşmesiAİRTİDE'ın içeriğinde bulunan salmeterol gibi uzun etkili P2 agonistler kullanılırken, özellikle astım ile ilgili advers olaylar bakımından, bu ilaç başlandıktan sonra ilk üç ay hastalar yakındantakip edilmelidir. AİRTİDE hızlı ve kısa etkili bir bronkodilatörün (örneğin salbutamol) kullanımını gerektiren akut belirtileri rahatlatmak için kullanılmamalıdır. Hastalara akut astım ataklarında rahatlamak içinkullanmaları gereken ilaçları her zaman yanlarında bulundurmaları tavsiye edilmelidir. Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. AİRTİDE ile tedavi sırasında astımla ilişki ciddi adves etkiler veya alevlenmeler gerçekleşebilir. Hastalara, AİRTİDE tedavisine başladıktan sonra astım semptomları kontrol altına alınamaz veyakötüleşirse tedaviye devam etmeleri, ancak yine de hekimlerine danışmaları gerektiği anlatılmalıdır. Rahatlatıcı ilaç (kısa etkili bronkodilatörler) kullanımı gereksinimlerinde artış veya rahatlatıcı ilaçlara yanıtta azalma astım kontrolünde bozulmaya işaret eder ve hastalar bir hekim tarafındandeğerlendirilmelidir. 3 / 22 Uzun etkili beta agonist preparatlanna bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediatrik ve adolesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem de uzun etkili betaagonist içeren bir kombinasyon preparatı kullanılması önerilir. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastalarınkontrol edici bir tedaviyle idamesi sağlanmalıdır. Astım kontrolünün ani ve ilerleyen şekilde kötüleşmesi hayatı tehdit eden bir durumdur ve hastanın hekim tarafından tekrar muayene edilmesi gereklidir. Kortikosteroid dozunun artırılmasıdüşünülmelidir. Astım semptomları kontrol altına alındığında, AİRTİDE dozunun kademeli olarak azaltılması değerlendirilebilir. Tedavi kademeli olarak azaltılırken hastaların düzenli olarak kontrol edilmesiönemlidir. AİRTİDE'ın etkili en düşük dozu kullanılmalıdır (bkz. Bölüm 4.2). Alevlenme yaşayan KOAH hastalarında genellikle sistemik kortikosteroid kullanımı endikedir, bu nedenle AİRTİDE ile semptomlar kötüleşirse hastaların hekimlerine danışmaları gerektiğianlatılmalıdır. Astımlı hastalarda alevlenme riski nedeniyle AİRTİDE tedavisi ani olarak kesilmemelidir, tedavi dozu hekim gözetiminde kademeli olarak azaltılmalıdır. KOAH'lı hastalarda tedavinin kesilmesinesemptomatik dekompanzasyon eşlik edebilir ve tedavinin kesilmesi bir hekim gözetimindeyapılmalıdır. Kortikosteroid içeren tüm inhale ilaçlarla olduğu gibi, aktif veya sessiz akciğer tüberkülozu olan hastalarda ve mantar, virüs ya da diğer solunum yolu enfeksiyonları olan hastalarda AİRTİDEdikkatli kullanılmalıdır. Gerekli olduğu takdirde uygun tedavi derhal başlatılmalıdır. Kardiyovasküler etkilerYüksek terapötik dozlarda AİRTİDE, seyrek olarak kardiyak aritmilere (örn. supraventriküler taşikardi, esktrasistoli ve atriyal fibrilasyon) ve serum potasyum seviyesinde geçici hafif azalmalaraneden olabilir. Ciddi kardiyovasküler bozuklukları veya kalp ritim bozuklukları olan hastalarda vediabetes mellitus, tirotoksikozis, tedavi edilmemiş hipokalemi veya düşük serum potasyumseviyesine predispoze hastalarda AİRTİDE dikkatli kullanılmalıdır. HiperglisemiÇok seyrek olarak kan glukoz düzeylerinde artış rapor edilmiştir (bkz. Bölüm 4.8) ve diabetes mellitus öyküsü olan hastalara reçete edilirken bu husus göz önünde bulundurulmalıdır. Paradoksal bronkospazmDiğer inhalasyon tedavilerinde olduğu gibi, doz uygulamasından hemen sonra başlayan hırıltı artışı ve nefes darlığı ile birlikte paradoksal bronkospazm ortaya çıkabilir. Paradoksal bronkospazm, hızlıetkili bronkodilatöre yanıt verir ve hemen tedavi edilmelidir. AİRTİDE derhal kesilmeli, hastadeğerlendirilmeli ve gerekli ise alternatif tedaviye başlanmalıdır. 4 / 22 P 2 agonist tedavisinin tremor, çarpıntılar ve baş ağrısı gibi farmakolojik yan etkileri bildirilmiştir fakat bunlar geçici olma ve düzenli tedaviyle birlikte azalma eğilimindedir. Sistemik kortikosteroid etkilerHerhangi bir inhale kortikosteroid özellikle yüksek dozlarda, uzun süre kullanıldığında sistemik etkiler oluşabilir. Oral kortikosteroid uygulamasına göre bu etkilerin oluşma olasılığı çok daha azdır(bkz. Bölüm 4.9 Doz Aşımı). Olası sistemik etkiler; Cushing sendromu, Cushing benzeri belirtiler,adrenal supresyon, çocukların ve adolesanların büyümesinde gecikme, kemik mineral dansitesindeazalma, katarakt ve glokom ile daha seyrek olarak psikomotor hiperaktivite, uyku bozukluğu,anksiyete, depresyon ve agresyon (özellikle çocuklarda) gibi psikolojik ve davranışsal etkileri içerir.Bu nedenle, astımı olanlarda tedavinin düzenli olarak değerlendirilmesi ve inhale kortikosteroiddozunun, etkili kontrolü sağlayan en düşük doza ayarlanması önemlidir. Hastaların yüksek dozlarda inhale kortikosteroidlerle uzun süreli tedavisi adrenal supresyon ve akut adrenal krize neden olabilir. 500 ila 1000 mikrogram flutikazon propiyonat dozlarında çok seyrekolarak adrenal supresyon ve akut adrenal krizler ile ilgili bildirimler bulunmaktadır. Potansiyel olarakakut adrenal krizi tetikleyebilecek durumlar travma, cerrahi girişim, enfeksiyon veya dozda aniazalmalardır. Gözlenen semptomlar genellikle belirsiz olmakla birlikte anoreksi, karın ağrısı, kilokaybı, yorgunluk, baş ağrısı, bulantı, kusma, hipotansiyon, bilinç seviyesinde azalma, hipoglisemi venöbettir. Stres veya elektif cerrahi girişim sırasında ilave sistemik koritkosteroid tedavisidüşünülmelidir. İnhale flutikazon propiyonat tedavisinin oral steroid ihtiyacını minimize etmesi beklenir, ancak oral steroidlerden transfer edilen hastalarda önemli bir süre adrenal yetmezlik riski olabilir. Bu nedenlebu tip hastaların yakından takip edilmesi ve adrenokortikol fonksiyonun izlenmesi gereklidir.Geçmişinde acil durum yüksek doz kortikosteroid tedavisi gereken hastalarda da bu risk mevcutolabilir. Stres yaratması muhtemel acil ve elektif durumlarda adrenal yanıt bozukluğu olasılığıdaima akılda tutulmalıdır ve uygun kortikosteroid tedavisi düşünülmelidir. Adrenal yetmezliğinderecesi elektif girişimlerden önce uzman değerlendirmesi gerektirebilir. Ritonavir, plazmadaki flutikazon propiyonat konsantrasyonunu büyük ölçüde artırabilir. Bu nedenle hastaya potansiyel yararı sistemik kortikosteroid yan etkilerinden fazla olmadığı sürece birliktekullanımdan kaçınılmalıdır. Flutikazon propiyonat'ın diğer güçlü CYP3A inhibitörleriyle birliktekullanımında da sistemik yan etki riski artar. KOAH hastalarında pnömoniKortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoni riskinde artışkanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarak gösterilmemiştir. Kortikosteroid içeren inhale ilaçlarının pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık için kesin klinik kanıt bulunmamaktadır. Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyla dikkatliolmalıdırlar. KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara kullanımı, ileri yaş, düşük vücut kitle 5 / 22 indeksi ve şiddetli KOAH bulunmaktadır. CYP3A4 inhibitörleriyle etkileşimSistemik ketokonazol ile birlikte kullanımı salmetorol'ün sistemik maruziyetini ciddi ölçüde artırmaktadır. Bu durum sistemik etkilerin (örn. QTc aralığının uzaması ve palpitasyonlar)insidansında artışa neden olabilir. Bu nedenle hastaya olan potansiyel yararı sistemik salmeterol yanetkileri riskinden fazla olmadıkça CYP3A4 inhibitörleriyle birlikte kullanımından kaçınılmalıdır. Görme bozukluklarıSistemik ve topikal kortikosteroid kullanımında görme bozuklukları rapor edilebilir. Bir hastada bulanık görüş veya diğer görme bozukluğu şikayetleri varsa hasta, sistemik ve topikal kortikosteroidkullanımı sonrası bildirilen katarakt, glokom veya santral seröz korioretinopati (CSCR) gibi olasınedenlerin değerlendirilmesi için oftalmoloji uzmanına yönlendirilmelidir. Pediyatrik popülasyonYüksek doz flutikazon propiyonat (genellikle 1000mikrogram/gün veya daha fazla) alan 16 yaşın altındaki çocuklar ve ergenler risk altında olabilir. Özellikle yüksek dozlarda uzun süreli tedavidesistemik etkiler gerçekleşebilir. Olası sistemik etkiler; Cushing sendromu, Cushing benzeri belirtiler,adrenal supresyon, akut adrenal kriz, çocukların ve adolesanların büyümesinde gecikme ile dahaseyrek olarak psikomotor hiperaktivite, uyku bozukluğu, anksiyete, depresyon ve agresyondur.Çocuk veya ergen hastanın pediyatrik solunum uzmanına sevk edilmesi düşünülmelidir. Uzun süre inhale kortikosteroid tedavisi alan çocukların boyunun düzenli olarak izlenmesi tavsiye edilmektedir. İnhale kortikosteroid astım kontrolünü sağlayan en düşük dozda kullanılmalıdır. Yardımcı madde:AİRTİDE'ın her bir dozu 12,3275 miligrama kadar laktoz monohidrat içerir. Bu miktar, laktoz intoleransı olan kişilerde normalde bir probleme neden olmamaktadır. Laktoz yardımcı maddesiküçük miktarlarda süt proteini içerir ve bu alerjik reaksiyonlara neden olabilir. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriP adrenerjik blokörler salmeterolün etkisini zayıflatabilir veya antagonize edebilir. Astımlı hastalarda kullanımları için gerekli nedenler olmadığı sürece hem selektif olmayan hem de selektif P blokörlerinkullanımından kaçınılmalıdır. P2 agonist tedavisiyle potansiyel olarak ciddi hipokalemigerçekleşebilir. Akut şiddetli astımda, bu etki ksantin türevleri, steroidler ve diüretikler ile eş zamanlıtedavi ile artabileceğinden özel dikkat tavsiye edilir. Diğer P adrenerjik içeren ilaçların eş zamanlı kullanımı potansiyel olarak aditif etkiye sahip olabilir. Flutikazon Propiyonat Normal şartlar altında, inhalasyon yolu ile uygulanmasından sonra, geniş ilk geçiş metabolizması ve karaciğer ve bağırsakta sitokrom P450 3A4'ün aracılık ettiği yüksek sistemik klirens sonucu,flutikazon propiyonatın plazma konsantrasyonu düşüktür. Bu nedenle, flutikazon propiyonatınaracılık ettiği klinik olarak anlamlı ilaç etkileşimi olası değildir. Sağlıklı gönüllüler üzerinde yapılan bir ilaç etkileşim çalışması, günde 2 defa 100 mg ritonavirin (oldukça güçlü sitokrom CYP3A4 inhibitörü), flutikazon propiyonatın plazma konsantrasyonlarınıbirkaç yüz kat artırabildiğini ve serum kortizol konsantrasyonlarında anlamlı azalmaya yol açtığınıgöstermiştir. İnhale flutikazon propiyonat için bu etkileşime dair bilgi bulunmamaktadır, ancak 6 / 22 flutikazon propiyonat plazma seviyelerinde anlamlı artış beklenmektedir. Cushing sendromu ve adrenal supresyon vakaları bildirilmiştir. Bu nedenle, hastaya olan potansiyel yararı sistemikkortikosteroid yan etkileri riskinden fazla olmadıkça, ritonavir ve flutikazon propiyonatın birliktekullanımından kaçınılmalıdır. Sağlıklı gönüllülerde yapılan küçük ölçekli bir çalışmada daha düşük potense sahip bir CYP3A inhibitörü olan ketokonazol tek inhalasyondan sonra flutikazon propiyonat maruziyetini %150artırmıştır. Bu etki tek başına flutikazon propiyonata kıyasla plazma kortizol düzeyinde daha fazladüşüşe neden olmuştur. İtrakonazol ve kobisistat içeren ilaçlar gibi diğer potent CYP3A inhibitörlerive eritromisin gibi orta kuvvetli CYP3A inhibitörleri ile birlikte tedavinin de sistemik flutikazonpropiyonat maruziyetini ve sistemik yan etki riskini artırması beklenmektedir. Hastaya olanpotansiyel yararı sistemik kortikosteroid yan etkileri riskinden fazla olmadıkça, birlikte kullanımdankaçınılmalıdır. Birlikte kullanımda hastalar sistemik kortikosteroid yan etkileri açısından takipedilmelidir. Salmeterol Kuvvetli CYP3A4 inhibitörleri 15 sağlıklı gönüllüde 7 gün süreyle yürütülen bir ilaç etkileşim çalışmasında eş zamanlı sistemik ketokonazol (günde bir kez 400 mg) ve salmeterol (günde iki kez inhale 50 mikrogram)kullanımının plazma salmeterol maruziyetini anlamlı derecede artırdığı gözlenmiştir (Cmaks 1.4 katve EAA 15 kat). Bu durum, salmeterol tedavisinin diğer sistemik etkilerinin (örn. QTc aralığınınuzama ve palpitasyonlar) insidansının tek başına salmeterol veya ketokonazole tedavisi ilekarşılaştırıldığında artmasına neden olabilir. Kan basıncı, kalp hızı, kan glukoz ve kan potasyum düzeylerinde klinik açıdan anlamlı etkiler görülmemiştir. Ketokonazol ile birlikte uygulanımı salmeterol eliminasyon yarı ömrünü veyatekrarlı dozlamla salmeterol birikimini artırmamıştır. Tedavinin yararları salmeterolün artan sistemik yan etkiler riskinden daha yüksek olmadığı sürece ketokonazol ile eş zamanlı kullanımından kaçınılmalıdır. Diğer potent CYP3A4 inhibitörleri ilebenzer bir etkileşim riskinin olması muhtemeldir (örn, itrakonazol, telitromisin, ritonavir). Orta düzeyde CYP 3A4 inhibitörleri 15 sağlıklı gönüllüde 6 gün süreyle birlikte salmeterol (inhalasyon yoluyla günde iki kez 50 mikrogram) ve eritromisin (oral yolla günde bir kez 500 mg) uygulanımı salmeterol maruziyetindeküçük ancak istatistiksel açıdan anlamlı olmayan bir artışa neden olmuştur (Cmaks 1.4 kat ve EAA1.2 kat). Eritromisinin birlikte uygulanımı herhangi bir ciddi yan etki ile ilişkilendirilmemiştir. Özel popülasyonlara ilişkin ek bilgilerYaşlı hastalarda veya böbrek veya karaciğer yetmezliği olan hastalarda etkileşim çalışmaları yapılmamıştır (bkz. Bölüm 5.2). Pediyatrik popülasyon:Pediyatrik hastalarda etkileşim çalışmaları yapılmamıştır (bkz. Bölüm 5.2). 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi : C 7 / 22 Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)AİRTİDE'ın doğum kontrol yöntemleri üzerine etkisi olup olmadığına dair herhangi bir bilgi bulunmamaktadır. Gebelik dönemiAİRTİDE'ın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik ve/veya embriyonal/fetal gelişim ve/veya doğum ve/veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz Bölüm 5.3). İnsanlarayönelik potansiyel risk bilinmemektedir. Gebe kadınlardan elde edilen veriler (1000'den fazla gebe vakası) salmeterol ve flutikazon propiyonat malformasyon veya feto/neonatal toksisitesi göstermemektedir. Hayvan çalışmaları P2adrenoreseptör agonistleri ve glukokortikosteroidlerin uygulamasından sonra üreme toksisitesigöstermiştir. İlaç kullanımı ancak anneye sağlaması beklenen yararı fetusa olan olası bir riskten fazla ise düşünülmelidir. Gebe kadınlarda flutikazon propiyonatın astım kontrolünü sağlayan etkili en düşük dozu kullanılmalıdır. Laktasyon dönemiSalmeterol ve flutikazon propiyonat/metabolitlerinin insan sütüne geçip geçmediği bilinmemektedir. Çalışmalar salmeterol ve flutikazon propiyonat ve metabolitlerinin emziren sıçanların sütüne geçtiğini göstermiştir. Emziren yenidoğanlarda/bebeklerde risk göz ardı edilemez. Çocuk için emzirmenin faydası ve anne için tedavinin faydası göz önünde bulundurularak AİRTİDE tedavisinin veya emzirmeninsonlandırılıp sonlandırılmayacağına karar verilmelidir. Üreme yeteneği / Fertiliteİnsanlarda kullanımına dair veri bulunmamaktadır. Ancak, hayvan çalışmaları salmeterol veya flutikazon tedavisinin fertilite üzerinde etkisi olmadığını göstermiştir. 4.7 Araç ve makine kullanımı üzerindeki etkilerAİRTİDE'ın araç ve makine kullanımı üzerinde etkisi yoktur veya göz ardı edilebilir düzeydedir. 4.8 İstenmeyen etkilerAİRTİDE, salmeterol ve flutikazon propiyonat içerdiğinden her iki bileşenle de ilişkili olan tipte ve şiddette advers reaksiyonlar görülebilir. Bu iki bileşiğin birlikte verilmesiyle ilave advers etkibildirilmemiştir. Salmeterol/flutikazon propiyonat ile ilgili advers olaylar sistem organ sınıfına göre aşağıdaki sıklıklarda verilmiştir: 8 / 22 Çok yaygın (> 1/10), Yaygın (> 1/100 ve < 1/10),Yaygın olmayan (> 1/1000 ve < 1/100) Seyrek (> 1/10000 ve < 1/1000) ve İzole raporlar dahil çok seyrek ( < 1/10000), bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor) Enfeksiyonlar ve enfestasyonlarYaygın :Ağız ve boğazda kandidiyazis, pnömoni (KOAH hastalarında)1, 3 5, bronşit1,3 Seyrek :Özofajiyal kandidiyaz Bağışıklık sistemi hastalıklarıYaygın olmayan : Kütanöz duyarlılık reaksiyonları, solunum semptomları (dispne) Seyrek : Anjiyoödem (temelde yüzde ve orofarinksde ödem), solunum semptomları (bronkospazm), anafilaktik şok dahil, anafilaktik reaksiyonlar Endokrin hastalıklarıSeyrek4 :Cushing sendromu,Cushing benzeri özellikleri, adrenal süpresyonu, çocuklar ve adolesanlarda gelişim geriliği, azalan kemik mineral yoğunluğu, Metabolizma ve beslenme hastalıklarıYaygın : Hipokalemi3 Yaygın olmayan : Hiperglisemi4 Psikiyatrik hastalıklarYaygın olmayan :Anksiyete, uyku bozuklukları Seyrek :Psikomotor hiperaktivite ve iritabilite dahil davranış değişiklikleri (çoğunlukla çocuklarda) Bilinmiyor :Depresyon, huzursuzluk (çoğunlukla çocuklarda) Sinir sistemi hastalıklarıÇok yaygın : Baş ağrısı1 Yaygın olmayan :Tremor Göz hastalıklarıYaygın olmayanSeyrek Bilinmiyor Katarakt Glokom4Bulanık görme4 Kardiyak hastalıklarYaygın olmayan :Palpitasyon, taşikardi, atriyal fibrilasyon, anjina pektoris Seyrek:Kardiyak aritmi (supraventriküler taşikardi ve ekstrasistol dahil) Solunum, göğüs bozuklukları ve mediastinal hastalıklarÇok yaygın :Nazofarenjit2, 3 Yaygın :Boğaz iritasyonu, ses kısıklığı/disfoni,sinüzit1,3, Seyrek :Paradoksal bronkospazm4 Deri ve deri altı doku hastalıklarıYaygın :Kontüzyonlar1, 3 Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın : Kas krampları, travmatik kırıklar1, 3, artralji, miyalji 9 / 22 1Plaseboda yaygın olarak raporlanmıştır. 2Plaseboda çok yaygın olarak raporlanmıştır. 3Bir KOAH çalışmasında 3 yıldan fazla raporlanmıştır. 4Bölüm 4.4'e bakınız. 5Bölüm 5.1'e bakınız. Seçili advers olayların tanımıP2 agonist tedavisinin tremor, çarpıntılar ve baş ağrısı gibi farmakolojik yan etkileri bildirilmiştir fakat bunlar geçici olma ve düzenli tedaviyle birlikte azalma eğilimindedir. Diğer inhalasyon tedavilerinde olduğu gibi, doz uygulamasından hemen sonra başlayan hırıltı artışı ve nefes darlığı ile birlikte paradoksal bronkospazm ortaya çıkabilir. Paradoksal bronkospazm, hızlıetkili bronkodilatöre yanıt verir ve hemen tedavi edilmelidir. AİRTİDE derhal kesilmeli, hastadeğerlendirilmeli ve gerekli ise alternatif tedaviye başlanmalıdır. Flutikazon propiyonat içeriği nedeniyle bazı hastalarda ses kısıklığı ağız ve boğaz kandidiyazı (pamukçuk) ve seyrek vakalarda özofagus kandidiyazı (pamukçuk) görülebilir. Gerek ses kısıklığıgerekse ağız ve boğaz kandidiyazı insidansı, ürün kullanıldıktan sonra ağız yıkanarak ve/veya dişlerfırçalanarak giderilebilir. Semptomatik ağız ve boğaz kandidiyazı, AİRTİDE tedavisi devamederken topikal anti-fungal terapi ile tedavi edilebilir. Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyonOlası sistemik etkiler; Cushing sendromu, Cushing benzeri belirtiler, adrenal supresyon, çocukların ve adolesanların büyümesinde gecikmedir (bkz. Bölüm 4.4). Çocuklarda ayrıca anksiyete, uykubozukluğu ve hiperaktiviteyle iritabilite gibi davranışsal değişiklikler görülebilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlıkmesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi(TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr;[email protected];4.9 Doz aşımı ve tedavisiSemptomlar ve bulgularAİRTİDE için doz aşımına dair klinik çalışma verisi bulunmamaktadır, ancak salmeterol ve/veya flutikazon propiyonat ile ilgili doz aşımı bilgileri aşağıda verilmiştir: Salmeterol doz aşımının belirti ve semptomları sersemlik hali, sistolik kan basıncında artış, tremor, baş ağrısı ve taşikardidir. AİRTİDE doz aşımı için spesifik bir tedavi bulunmamaktadır. Doz aşımıdurumunda hastaya, gerektiği şekilde uygun gözlem ile birlikte destekleyici tedavi uygulanmalıdır.Buna ek olarak hipokalemi meydana gelebilir bu nedenle serum potasyum düzeyleri izlenmelidir.Potasyum replasmanı göz önünde bulundurulmalıdır. Akut: Önerilenden yüksek flutikazon propiyonat dozlarının akut inhalasyonu adrenal fonksiyonunda geçici süpresyona neden olabilir. Adrenal fonksiyonu plazma kortizol ölçümleri ile doğrulandığıüzere birkaç günde normale döndüğünden bu doz acil tedavi gerektirmemektedir. 10 / 22 İnhale flutikazon propiyonat ile kronik doz aşımı: Adrenal rezerv izlenmelidir. Sistemik kortikosteroidler ile tedavi gerekli olabilir. Stabilizasyon sağlandığında önerilen dozda inhale kortikosteroid ile tedaviye devam edilmelidir. Adrenalsupresyon için bkz. Bölüm 4.4. Gerek akut gerekse kronik flutikazon propiyonat doz aşımı durumunda AİRTİDE tedavisine, semptom kontrolü için uygun dozajda devam edilmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grubu: Kortikosteroidler ve Diğer İlaçlar ile Kombine Adrenerjikler (Antikolinerjik Kombinasyonları Hariç) ATC Kodu: R03AK06 Etki mekanizması AİRTİDE farklı etki şekline sahip salmeterol ve flutikazon propiyonat içermektedir. İki etkin maddenin ilgili etki mekanizmaları aşağıda tartışılmaktadır. Salmeterol Salmeterol, reseptörün sekonder bağlanma bölgesine bağlanan bir uzun yan zinciri olan, selektif uzun etkili (12 saat) bir beta2 adrenoreseptör agonistidir. Salmeterol klasik kısa etkili beta2agonistlerin önerilen dozlarına kıyasla en az 12 saat süren daha uzun süreli bronkodilatasyonsağlamaktadır. Flutikazon propiyonat, Önerilen dozlarda inhalasyon yoluyla verilen flutikazon propiyonat akciğerlerde bir glukokortikoid antienflamatuvar etkiye sahiptir ve bu etki kortikosteroidler sistemik yolla uygulandığındagörülenden daha az yan etkiyle semptomlarda ve astım alevlenmelerinde azalma sağlamaktadır. Klinik etkililik ve güvenlilikFlutikazon propiyonat/Salmeterol astım klinik çalışmaları Uzun süreli astımlı 3416 erişkin ve adolesanda yapılan 12 aylık bir çalışmada (Optimal Astım Kontrolünü Sağlanması, GOAL) astım tedavisi hedeflerinin erişilebilir olup olmadığının belirlenmesiiçin tek başına inhale kortikosteroidler (Flutikazon Propiyonat) ile Flutikazonpropiyonat/Salmeterol'ün etkililik ve güvenliliği karşılatırılmıştır. Tedavi dozu **Toplam kontrolsağlanana veya çalışma ilacının en yüksek dozuna erişilene kadar 12 haftada bir artırılmıştır. GOAL,Flutikazon propiyonat/Salmeterol verilen hastadan tek başına inhale kortikosteroid (IKS) verilenhastalara kıyasla daha fazla hastalarda astım kontrolü sağlandığı ve bu kontrolün daha düşükkortikosteroid dozunda elde edildiğini göstermiştir. *İyi kontrol altına alınmış astım, tek başına IKS'ye kıyasla Flutikazon propiyonat/Salmeterol ile daha hızlı şekilde elde edilmiştir. Bireysel olarak iyi kontrolün sağlandığı haftanın elde edilmesi içinhastaların %50'sindeki tedavi süresi Flutikazon propiyonat/Salmeterol için 16 gün ve IKS grubu için37 gündü. Daha önce steroid tedavisi alamayan bir hasta alt grubunda bireysel iyi kontrol altınaalınmış haftaya kadar geçen süre Flutikazon propiyonat/Salmeterol ile 16 gün olurken IKS ile 23 günolmuştur. 11 / 22
*Yeterli düzeyde kontrol altına alınan astım; >1 semptom skoru ile < 2 gün (semptom skoru 1, 'gün içinde bir kısa süreli semptom' şeklinde tanımlanır), <2 gün ve haftada <4 SABA kullanımı, > %80öngörülen sabah pik ekspiratuar akımı, gece uyanmalarının olmaması, alevlenmelerin olmaması vetedavi değişikliği gerektiren yan etkilerin olmaması **Tam kontrol altına alınan astım; semptomların olmaması, SABA kullanımının olmaması, > %80 öngörülen sabah pik ekspiratuar akışı, gece uyanmalarının olmaması, alevlenmelerin olmaması vetedavi değişikliği gerektiren yan etkilerin olmaması Bu çalışmadaki bulgular günde iki kez Salmeterol/Flutikazon 50/100 mikrogram dozunun, hızlı astım kontrolünün gerekli olduğu düşünülen orta şiddette dirençli astım hastalarında ilk idametedavisi olarak değerlendirilebileceğini düşündürmektedir. >18 yaşındaki dirençli astım hastası 318 kişide yapılan bir çift kör, randomize, paralel gruplu çalışmada iki haftalık sürede günde iki kez iki inhalasyonla (çift doz) Flutikazonpropiyonat/Salmeterol kullanımının güvenlilik ve tolerabilitesi değerlendirilmiştir. Bu çalışma 14güne kadar her Flutikazon propiyonat/Salmeterol dozu inhalasyonunun iki katına çıkarılmasınıngünde iki kez tek inhalasyona kıyasla beta agonist ile ilişkili yan etkilerde küçük bir artışa (tremor;0'a karşı 1 hasta [%1], palpitasyon; 1 hastaya [<%1] karşı 6 [%3], kas krampları; 1 [<%1] hastayakarşı 6 [%3] ) ve inhale kortikosteroid ile ilişkili yan etkilerde benzer bir insidansa neden olduğunugöstermiştir (örn, oral kandidiyazis; 16 hastaya [%8] karşı 6 [%6], ses kısıklığı; 4 hastaya [%2]karşı 2 [%2] ). Flutikazon propiyonat/Salmeterol dozunun ek kısa süreli (14 güne kadar) inhalekortikosteroid tedavisine ihtiyaç duyulan erişkin hastalarda iki katına çıkarılması düşünülürse betaagonist ile ilişkili yan etkilerdeki küçük artış dikkate alınmalıdır. AstımÇok Merkezli Salmeterol Astım Araştırma Çalışması Çok Merkezli Salmeterol Astım Araştırma Çalışması, yetişkin ve ergen gönüllülerde olağan tedaviye salmeterol veya plasebo eklenmesinin güvenliliğini karşılaştıran 28 haftalık bir ABDçalışmasıydı. Solunum ile ilişkili ölüm ve solunum ile ilişkili yaşamı tehdit eden olayların kombinesayısı olan primer sonlanım noktası açısından anlamlı farklılık olmasa da, çalışma salmeterol alanhastalarda astımla ilişkili ölüm sayısında anlamlı artış göstermiştir (salmeterol ile tedavi edilen13.176 hastada 13 ölüme kıyasla plasebo alan 13.179 hastada 3 ölüm). Çalışma eş zamanlı inhalekortikosteroid kullanımının etkisini değerlendirmek için tasarlanmamıştır ve gönüllülerin yalnızca%47'si başlangıçta İKS kullanımını bildirmiştir. Astımda salmeterol+flutikazon propiyonat ile tek başına flutikazon propiyonatın güvenliliği ve 12 / 22 etkililiği Salmeterol+flutikazon propiyonat ile tek başına flutikazon propiyonat'ın güvenliliği ve etkililiğini karşılaştırmak için biri yetişkin ve ergen gönüllülerde (AUSTRI çalışması), diğeri 4-11 yaşlarındapediyatrik gönüllülerde (VESTRI çalışması) olmak üzere iki tane çok merkezli 26 haftalık çalışmayürütülmüştür. Her iki çalışmaya dahil edilen gönüllülerin bir önceki yılda astımla ilişkili hastaneyeyatış veya astım alevlenmesi ile birlikte orta ile şiddetli inatçı astımı vardı. İki çalışmanın da primerhedefi tek başına İKS'ye (flutikazon propiyonat) kıyasla İKS tedavisine LABA eklenmesinin(salmeterol+flutikazon propiyonat) astımla ilişkili olaylar (astımla ilişkili hastaneye yatış,endotrakeyal entübasyon ve ölüm) açısından non- inferioriteyi değerlendirmekti. Çalışmanın ikincilhedefi ciddi astım alevlenmesi (astımın kötüye gitmesi nedeniyle en az 3 gün sistemikkortikosteroid kullanımına gerek olması veya sistemik kortikosteroid kullanımı gerektiren astımnedenli hastaneye veya acile yatış olarak tanımlanmıştır) açısından İKS+LABA'nın(salmeterol+flutikazon propiyonat) tek başına İKS tedavisine (flutikazon propiyonat) üstünlüğünüdeğerlendirmekti. AUSTRI ve VESTRI çalışmalarına sırasıyla 11.679 ve 6.208 hasta randomize edilmiş ve tedavi görmüştür. Primer sonlanma noktası güvenlilik için, her iki çalışmada da non- inferioritegösterilmiştir (bkz. aşağıda tablo)
verilmiştir b Göreceli risk için %95 GA üst sonucu 2.675'ten azsa, non-inferiorite sonucuna karar verilmiştir İkincil etkililik sonlanma noktası için, flutikazon propiyonat'la karşılaştırıldığında salmeterol+flutikazon propiyonat'ta ilk astım alevlenmesine kadar geçen sürede azalma her ikiçalışmada da görülmüştür, ancak yalnızca AUSTRI'de istatistiksel olarak anlamlı fark sağlanmıştır: 13 / 22
KOAHKısa etkili beta2-agonistlerine %10 reversibilite kısıtlaması olmayan semptomatik KOAH hastaları: 6 ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/250 mikrogram ve 50/500mikrogram'lık Flutikazon propiyonat/Salmeterolün düzenli kullanımının akciğer fonksiyonunu hızlıve anlamlı derecede düzelttiğini, nefes darlığını ve rahatlatıcı ilaç kullanımını anlamlı derecedeazalttığını göstermiştir. Aynı zamanda hastaların sağlık durumunda da anlamlı derecede düzelmeolmuştur.Kısa etkili beta2-agonistlerine % 10'dan daha az reversibilite gösteren semptomatik KOAH hastaları: 6 ve 12 ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/500 mikrogram Flutikazon propiyonat/Salmeterol'ün düzenli kullanımının akciğer fonksiyonunu hızlı ve anlamlı derecededüzelttiğini, nefes darlığını ve rahatlatıcı ilaç kullanımını anlamlı derecede azalttığını göstermiştir.12 aylık periyod boyunca KOAH alevlenme riski ve ilave oral kortikosteroid ihtiyacı anlamlıderecede azalmıştır. Aynı zamanda hastaların sağlık durumunda da anlamlı derecede düzelmeolmuştur. Flutikazon propiyonat/Salmeterol 50/500 mikrogram hem tedavi sırasında sigara içen, hem de sigarayı bırakmış hastalarda akciğer fonksiyonunu ve sağlık durumunu düzeltmede ve KOAHalevlenme riskini azaltmada etkili bulunmuştur. TORCH çalışması (TOwards a Revolution in COPD Health; KOAH'ta devrime doğru): TORCH, KOAH hastalarında, günde 2 kez 50/500 mikrogram Flutikazon propiyonat/Salmeterol, günde 2 kez50 mikrogram salmeterol, günde 2 kez 500 mikrogram FP (flutikazon propiyonat) veya plasebo ileyapılan tedavinin tüm nedenlere bağlı ölümler üzerindeki etkisini değerlendirmek için yapılan 3yıllık bir çalışmadır. Başlangıç (bronkodilatatörden önce) FEV1 'i beklenen normal değerin %60'ından az olan orta-şiddetli ve şiddetli KOAH hastaları çift-kör tedavi almak üzere randomizeedilmiştir. Çalışma boyunca, diğer inhale kortikosteroidler, uzun etkili bronkodilatörler ve uzunsüre sistemik kortikosteroidler dışında, her zamanki KOAH tedavilerini almalarına izin verilmiştir.3 yıllık sağkalım durumu, çalışmadan çıkıp çıkmadıklarına bakılmaksızın hastaların tümü için tespitedilmiştir. Primer sonlanma noktası, plaseboya kıyasla Flutikazon propiyonat/Salmeterol için 3yılda tüm nedenlere bağlı ölümlerin azaltılmasıdır. (Tablo 1) 14 / 22
1. birincil etkinlik karşılaştırılması üzerinde yapılmış 2 ara analizin sigara içme durumu açısından gruplandırılmış bir log-rank analizi için ayarlanmış P değeri. Flutikazon propiyonat/Salmeterol'ün, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskini %17,5 oranında azalttığı görülmüştür. (Risk Oranı 0,825 (% 95 GA 0,68, 1,00, p = 0,052;tümü ara analizler için ayarlanmıştır). Plaseboya kıyasla, üç yıllık süre içinde herhangi bir zamandaherhangi bir nedenden dolayı gerçekleşen ölümlerde, salmeterol ile % 12 azalma (p = 0,180) ve FPile % 6 artış (p = 0,525) olmuştur. (Tablo 1)Cox'un Orantısal Risk modelinin kullanıldığı destekleyici bir analiz, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskinde % 19 azalma gösteren Flutikazon propiyonat/Salmeterol için0,811'lik (% 95 GA 0,670, 0,982, p = 0,031) bir risk oranı olduğunu göstermiştir. Model önemlifaktörler (sigara içme durumu, yaş, cinsiyet, bölge, başlangıç FEVı ve Vücut Kitle İndeksi) içinayarlanmıştır. Tedavi etkilerinin bu faktörlere göre değiştiğine dair kanıt yoktur. (Tablo 1) Üç yıl içinde KOAH'a bağlı nedenlerden dolayı ölen hastaların yüzdesi plasebo için % 6, salmeterol için % 6,1, FP için % 6.9 ve Flutikazon propiyonat/Salmeterol için % 4,7'dir. (Tablo 1) Plaseboya kıyasla Flutikazon propiyonat/Salmeterol, orta şiddetli ve şiddetli alevlenmeleri % 25 (% 95 GA: % 19 ve % 31 arasında; p < 0.001) oranında azaltmıştır Flutikazon propiyonat/Salmeterolalevlenme oranını, salmeterol ile karşılaştırıldığında % 12 (% 95 GA: % 5 ve % 19 arasında; p =0.002), FP ile karşılaştırıldığında da % 9 (% 95 GA: % 1 ve % 16 arasında; p = 0.024) oranındaazaltmıştır. Plaseboya kıyasla salmeterol ve FP alevlenme oranını anlamlı derecede sırasıyla % 15(% 95 GA: % 7 ve % 22 arasında; p < 0,001) ve % 18 (% 95 GA: % 11 ve % 24 arasında; p <0,001) oranında azaltmıştır. St George Solunum Anketi (SGSA) ile ölçülen Sağlıkla İlişkili Yaşam Kalitesi, plaseboya kıyasla tüm aktif tedavi yöntemleri ile düzelmiştir. Üç yıl boyunca Flutikazon propiyonat/Salmeterol ilesağlanan ortalama düzelme plaseboya kıyasla - 3,1 birim (% 95 GA: - 4,1 ve - 2,1 arasında; p < 15 / 22 0,001), salmeterole kıyasla - 2.2 birim (p < 0,001) ve FP'ye kıyasla - 1.2 birimdir (p = 0,017). Üç yıllık tedavi süresi boyunca, FEVı değerleri Flutikazon propiyonat/Salmeterol ile tedavi edilenlerde plasebo ile tedavi edilenlerden daha yüksektir (3 yıl boyunca ortalama fark 92 mL, %95 GA: 75 - 108 mL; p < 0,001). FEV1 üzerinde Flutikazon propiyonat/Salmeterol salmeteroldenveya FP'den daha etkilidir (salmeterol için ortalama fark 50 mL, p < 0,001 ve FP için 44 mL'dir, p< 0.001). Advers olay olarak bildirilen pnömoninin 3 yıllık tahmini olasılığı plasebo için %12.3, salmeterol için % 13.3, FP için % 18.3 ve Flutikazon propiyonat/Salmeterol için % 19,6'dır (Flutikazonpropiyonat/Salmeterol'ün plaseboya karşı risk oranı: 1,64, % 95 GA: 1,33 ve 2,01 arasında, p <0,001). Pnömoni ile ilişkili ölümlerde artış olmamıştır; tedavi sırasında birincil olarak pnömoniyebağlı oldukları düşünülen ölümler plasebo için 7, salmeterol için 9, FP için 13 ve Flutikazonpropiyonat/Salmeterol için 8 olarak tespit edilmiştir. Kemik kırılma olasılığında anlamlı farklılıkyoktur (plasebo % 5,1, salmeterol % 5,1, FP % 5,4 ve Flutikazon propiyonat/Salmeterol % 6,3;plaseboya karşı Flutikazon propiyonat/Salmeterol için risk oranı: 1,22, % 95 GA: 0,87 ve 1,72arasında, p = 0.248). Göz bozuklukları, kemik bozuklukları ve hipotalamus-hipofiz-adrenal eksenbozuklukları ile ilgili advers olayların insidansı düşüktür ve tedaviler arasında farklılıkgözlenmemiştir. Salmeterol alan tedavi gruplarında kardiyak advers olaylarında artış olduğuna dairkanıt yoktur.Pediyatrik popülasyon: SAM101667 çalışmasında, 6 ila 16 yaşlarında semptomatik astımı olan 158 çocukta, semptom kontrolü ve akciğer fonksiyonu açısından salmeterol/flutikazon propiyonat kombinasyonuflutikazon propiyonat dozunun ikiye katlanmasıyla eşit etkililikte bulunmuştur. Bu çalışmaalevlenme üzerine etkileri araştırmak için tasarlanmamıştır. 4 ila 11 yaşlarında çocukların (n=257), her ikisi de günde iki defa olmak üzere salmeterol/flutikazon propiyonat 50/100 veya salmeterol 50mcg + flutikazon propiyonat 100mcg iletedavi edildiği 12 haftalık bir çalışmada, her iki tedavi kolunda pik ekspiratuar akımda %14'lük birgelişme ile semptom skoru ve kurtarıcı salbutamol kullanımında iyileşmeler görülmüştür. İki tedavikolu arasında farklılık bulunmamıştır. İki tedavi kolu arasında güvenlilik parametreleri açısındanfarklılık bulunmamıştır. 4 ila 11 yaşlarında persistan astımı olan ve inhale kortikosteroid tedavisindeyken semptomatik olan çocukların (n=203) dahil edildiği randomize paralel grup çalışmasında güvenlilik primer hedefolmuştur. Çocuklara günde iki defa tek başına salmeterol/flutikazon propiyonat (50/100mcg) veyatek başına flutikazon propiyonat (100mcg) tedavisi verilmiştir. Salmeterol/flutikazon propiyonatalan iki çocuk ve flutikazon propiyonat alan beş çocuk astımın kötüleşmesi nedeniyle çalışmadanayrılmıştır. 12 hafta sonunda çalışmanın her iki kolunda da 24 saatlik üriner kortizol atılımı anormalolan çocuk bulunmamıştır. Çalışma kolları arasında güvenlilik profili açısından fark bulunmamıştır. Gebelik sırasında astımda flutikazon propiyonat içeren ilaçların kullanımı Majör konjenital malformasyon (MKM) riskini değerlendirmek için, Birleşik Krallık elektronik sağlık kayıtları kullanılarak birinci trimesterde tek başına inhale flutikazon propiyonat vesalmeterol+flutikazon propiyonat ile flutikazon propiyonat içermeyen İKS maruziyetininkarşılaştırıldığı, gözlemsel retrospektif epidemiyolojik kohort çalışması yürütülmüştür. Buçalışmaya karşılaştırma amaçlı plasebo dahil edilmemiştir. Birinci trimesterde İKS-maruziyeti olan 5362 gebeden oluşan astım kohortunda, 131 tanı konmuş 16 / 22 MKM belirlenmiştir; flutikazon propiyonat veya salmeterol+flutikazon propiyonat maruziyeti olan 1612'sinden (%30) 42'sinde MKM tanısı konulduğu belirlenmiştir. 1. yılda flutikazon propiyonatile flutikazon propiyonat olmayan İKS maruziyeti karşılaştırıldığında kadınlarda tanı konulmuşMKM'ler için ayarlanmış olasılık oranı orta şiddette astımlılarda 1,.1 (%95 GA: 0.5 - 2,3) veşiddetli astımlılarda 1,2 (%95 GA: 0,7 - 2,0) olmuştur. İlk trimesterde tek başına flutikazonpropiyonat ile salmeterol+flutikazon propiyonat maruziyeti karşılaştırıldığında MKM riskindefarklılık görülmemiştir. Astım şiddet basamaklarında mutlak MKM riskleri flutikazon propiyonatmaruziyeti olan 100 gebelikte 2,0 ila 2,9 arasında değişmektedir. Bu da Pratisyen HekimlikAraştırma Veritabanında astım tedavisine maruziyeti olmayan 15,840 gebelikte yürütülençalışmanın sonuçlarıyla karşılaştırılabilir olmuştur (100 gebelikte 2,8 MKM). 5.2 Farmakokinetik özelliklerGenel özelliklerHayvanlarda veya insanlarda inhalasyon yoluyla birlikte uygulanan salmeterol ve flutikazon propiyonatın birbirlerinin farmakokinetiğini etkilediğine dair herhangi bir bulgu yoktur. Bu nedenle farmakokinetik açıdan her iki bileşen ayrı ayrı düşünülebilir. Salmeterol Salmeterol akciğerlerde lokal olarak etki eder, bu nedenle plazma seviyeleri terapötik etkinin belirleyicisi değildir. Terapötik dozlarda inhalasyondan sonra çok düşük plazma konsantrasyonlarıgösterdiği için (yaklaşık 200 pg/ml veya daha az) plazmadaki ilaç miktarının tayini teknik olarak zorolduğundan salmeterolün farmakokinetiği ile ilgili sadece sınırlı veriler bulunmaktadır. Flutikazon propiyonat Emilim:Sağlıklı gönüllülerde inhalasyon yoluyla alınan tek doz flutikazon propiyonatın mutlak biyoyararlanımı, kullanılan inhalasyon cihazına göre nominal dozun yaklaşık %5-11'i arasındadeğişmektedir. Astımlı hastalarda inhale flutikazon propiyonata sistemik maruziyetin daha düşükdüzeyde gözlenmiştir. Sistemik emilim temelde akciğerlerde meydana gelmekte olup ilk başta hızlıve sonrasında uzun sürelidir. İnhale dozun kalanı yutulabilir ancak düşük suda çözünürlük vepresistemik metabolizma nedeniyle sistemik maruziyete minimum katkıda bulunur ve oralbiyoyararlanımının %1'den az olmasını sağlar. Sistemik maruziyet, inhale dozun artışıyla lineerşekilde artar. Dağılım:Flutikazon propiyonatın dispozisyonu, yüksek plazma klirens (1150 ml/dak), kararlı durumda yüksek dağılım hacmi (300 L) ve yaklaşık 8 saat olan terminal yarılanma ömrü ile karakterizedir. Flutikazon propiyonatın plazma proteinlerine bağlanma oranı % 91'dir. Biyotransformasyon:Flutikazon propiyonat başlıca sitokrom P450 enzimi CYP3A4 tarafından inaktif karboksilik asite metabolize edilir. Eliminasyon:Flutikazon propiyonat sistemik dolaşımdan çok hızlı temizlenir. Flutikazon propiyonatın renal 17 / 22 klirensi önemsiz düzeydedir. Dozun %5'inden daha azı idrarda temelde metabolitler olarak atılmaktadır. Dozun büyük bir bölümü feçeste metabolitler ve değişmemiş olarak atılmaktadır. Hastalardaki karakteristik özelliklerBöbrek/Karaciğer yetmezliği:Veri bulunmamaktadır. Değişik yaş grupları:Pediyatrik popülasyon4 ila 77 yaş arası 350 hastayı (hastaların 174'ü 4-11 yaş) içeren, farklı cihazların (DISKUS, ölçülü inhalasyon cihazı) kullanıldığı, kontrol gruplarına yer verilen 9 çalışmadan bildirilen verilerinkullanıldığı bir popülasyon farmakokinetiği analizinde, flutikazon propiyonat 100 ilekarşılaştırıldığında Flutikazon propiyonat /salmeterol 50/100 ile tedavi sonrasında daha yüksekflutikazon propionat sistemik maruziyeti görülmüştür. Çocuklarda ve Adölesan/Erişkin Popülasyonlarda flutikazon propionat karşısında Salmeterol/flutikazon propiyonat karşılaştırması için Geometrik Ortalama Oranı [%90 GA]
21 günlük Flutikazon propiyonat/salmeterol inhaler 25/50 mikrogram (spacer ile birlikte veya spacer olmaksızın günde iki kez 2 inhalasyon) veya Flutikazon propiyonat/salmeterol US 50/100mikgrogram (günde iki kez 1 inhalasyon) tedavilerinin etkisi 4 ila 11 yaşlarında hafif astımlı 31çocukta değerlendirilmiştir. Flutikazon propiyonat/salmeterol inhaler, spacer ile birlikte Flutikazonpropiyonat/salmeterol inhaler ve Flutikazon propiyonat/salmeterol için salmeterol sistemikmaruziyeti benzer olmuştur (sırasıyla 126pg sa/mL [%95 GA: 70, 225], 103pg sa/mL [%95 GA: 54,200] ve 110 pg sa/mL [%95 GA: 55, 219]). Flutikazon propiyonat sistemik maruziyeti spacer ilebirlikte kullanılan Flutikazon propiyonat/salmeterol inhaler ile (107pg sa/mL [%95 GA: 45.7,252.2]) ve Flutikazon propiyonat/salmeterol'de (138pg sa/mL [%95 GA: 69.3, 273.2]) benzerolmştur, ancak Flutikazon propiyonat/salmeterol inhaler için daha düşüktür (24pg sa/mL [%95 GA:9.6, 60.2]). 5.3 Klinik öncesi güvenlilik verileriAyrı şekilde verilen salmeterol ve flutikazon propiyonatın hayvan çalışmalarına göre insanlarda kullanıma yönelik güvenlilikle ilişkili tek endişe farmakolojik etkilerin artmasıyla ilişkili etkilerolmuştur. Hayvan üreme çalışmalarında glukokortikoidlerin, malformasyonlara (yarık damak, iskelet 18 / 22 bozuklukları) neden olduğu gösterilmiştir. Bununla birlikte bu hayvan deneylerinin önerilen dozların verildiği insanlar için anlamlı olduğu düşünülmemektedir. Salmeterol ksinafoat ile yapılanhayvan çalışmaları sadece yüksek maruziyet düzeylerinde embriyofetal toksisite göstermiştir.Birlikte uygulanımı takiben bilinen glukokortikoid kaynaklı anomalilerle ilişkilendirilen dozlardasıçanlarda artan transpoze umblikal arter ve ossipital kemikte eksik osifikasyon insidansı tespitedilmiştir. Salmeterol ksinafoat veya flutikazon propioynat genetik toksisite potansiyeligöstermemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiLaktoz monohidrat (inek sütü kaynaklıdır.) 6.2 GeçimsizliklerBilinen geçimsizliği yoktur. 6.3 Raf ömrü24 ay 6.4 Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklanmalıdır. Kuru bir yerde saklanmalıdır. Çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız. 6.5 Ambalajın niteliği ve içeriği60 kapsüllük blister ve inhalasyon cihazı içeren karton kutularda satılmaktadır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerTüm kullanılmayan ürün ve artık maddeler Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. AİRTİDE akciğerlere inhale edilen toz salıvermektedir. İnhalasyon cihazının kullanımı doktor ve eczacı tarafından hastaya gösterilmelidir. Kapsüllerin kesinlikle ağız içine alınarak yutulmaması ve kesinlikle inhaler içine yerleştirildikten sonra solukalma yolu ile kullanılması gerektiği konusunda hasta bilgilendirilmelidir. Jelatin kapsülünparçalanabileceği ve inhalasyondan sonra ağız ve boğaza küçük jelatin parçacıklarının ulaşabileceğihastaya anlatılmalıdır. Bu olasılık kapsülün birden fazla delinmemesi ile en aza indirilir. Cihaz, koruma kapağı çıkarılarak açılır ve kullanıma hazırlanır. Ağızlık ağıza yerleştirilir ve dudaklar etrafını saracak şekilde kapatılır. Bundan sonra doz inhale edilebilir ve koruma kapağıtekrar kapatılabilir. 19 / 22 AİRTİDE'ın kullanım talimatları
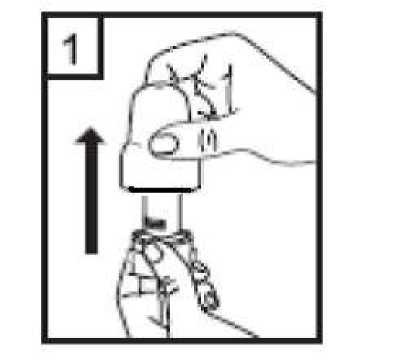
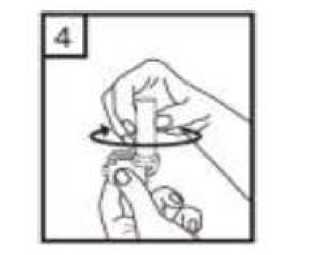
2. Bir elinizle cihazın alt kısmını tutarak diğer elinizle ağızlık kısmını ok yönünde çevirerek açın. 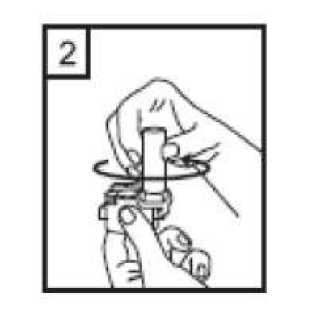 3. Bir kapsülü cihazın içindeki boşluğa yerleştirin. Kapsülü ambalajından kullanmadan hemen önce çıkartın. 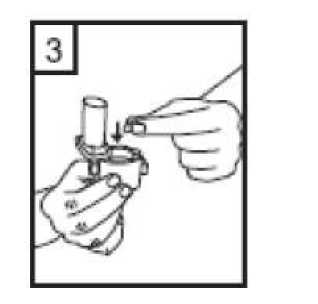 20 / 22
5. Cihazı dik tutun, kenardaki düğmelere sadece bir kez tam olarak basın ve bırakın. Kapsül her ikiucundan delinecektir. Nefes almanız sırasında küçük jelatin kapsül parçaları ağzınıza gelebilir. Jelatin parçaları zararsızdır ve yutulduktan sonra sindirileceklerdir. Küçük jelatin parçalarının oluşma riskikapsülün ambalajından çıkarılır çıkarılmaz hemen kullanılması ve düğmelere sadece bir kezbasılması ile azalır.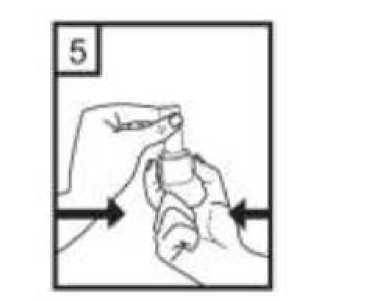
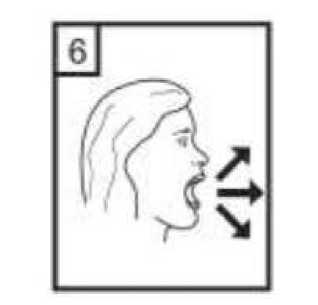
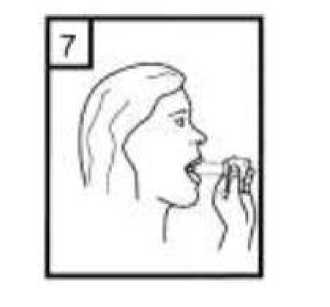
6. Nefesinizi kuvvetlice dışarı verin. 21 / 22 7. Ağız parçasını ağzınıza yerleştirin ve başınızı hafifçe arkaya doğru eğin. Ağızlık etrafındadudaklarınızı sıkıca kapatın ve olabildiğince hızlı ve derin nefes alın. 8. Cihazı ağzınızdan çıkarın ve rahatsız olmadan olabildiğince uzun süre nefesinizi tutun. Sonranormal şekilde soluk alıp verin. Cihazı tekrar açın ve kapsül içerisinde toz kalıp kalmadığınabakın. Kapsül içerisinde toz kalmış ise 6,7 ve 8 numaralı basamakları tekrar edin. 9. Kullanımdan sonra, boş kapsülü atın ve ağızlık kısmını kapatın. UNUTMAYINIZ!Cihazınızı kuru tutunuz. Kullanılmadığı zaman kapalı tutunuz. Cihazın içine asla nefes vermeyiniz. Hareket kolunu sadece ilacı almaya hazır olduğunuzda itiniz. Söylenen dozdan daha fazla almayınız. 7. RUHSAT SAHİBİPharmactive İlaç San. ve Tic. A.Ş. Bağcılar/İstanbul 8. RUHSAT NUMARASI2016/840 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ28.11.2016 10. KÜB'ÜN YENİLENME TARİHİ22 / 22 |
İlaç BilgileriAirtide 500/50 Mcg İnhalasyon İçin Toz İçeren KapsülEtken Maddesi: Salmeterol Ksinafoat, Flutikazon Propiyonat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.