Fenoster 160 Mcg/9 Mcg İnhalasyon Tozu, Sert Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIFENOSTER 160 mcg/9 mcg İnhalasyon Tozu, Sert Kapsül 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Budesonid................................. 200 mikrogram /kapsül Formoterol fumarat............. 12 mikrogram /kapsül içerir. Hastaya ulaşan 160 mikrogram budesonid, 200 mikrogram ölçülü doza ve hastaya ulaşan 9 mikrogram formoterol fumarat, 12 mikrogram ölçülü doza karşılık gelir. Yardımcı madde:Laktoz monohidrat öğütülmüş 19787,464 mikrogram /kapsül Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMİnhaler Kapsül Beyaz veya beyazımsı inhalasyon toz içeren açık sarımsı turuncumsu renkli opak kapak ve şeffaf gövdeli HPMC kapsül 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlar Astım:FENOSTER, astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. Kronik Obstrüktif Akciğer Hastalığı (KOAH)Orta ve ağır KOAH olgularında, semptomları ve atak sıklığını azaltmaktadır. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Astım:1 FENOSTER'in içindeki maddelerin dozu her hasta için farklıdır ve hastalığın şiddetine göre belirlenmelidir. Bu durum, sadece tedaviye kombinasyon ile başlandığında değil, idame dozuayarlanırken de göz önünde tutulmalıdır. Hasta, kombinasyon preparatının içindeki dozlarındışında bir doz kombinasyonuna gereksinim duyarsa uygun dozda beta2- agonist ve/veyakortikosteroidi tek başına içeren preparatlar verilmelidir. Doz, semptomların efektif kontrolünün idame ettirildiği en düşük değere titre edilmelidir. Hastalar hekimleri tarafından, en uygun FENOSTER dozunu kullanmaları açısından düzenliolarak değerlendirilmelidirler. Önerilen en düşük doz ile kontrol altına alındığında, bir sonrakiadım tek başına inhale steroid tedavisinin denenmesini içerebilir. FENOSTER için iki tedaviyaklaşımı söz konusudur: FENOSTER için iki tedavi yaklaşımı söz konusudur: A. FENOSTER idame tedavisi:Düzenli idame tedavi olarak FENOSTER ile birliktekurtarıcı nitelikte ayrıca bir hızlı etki eden bronkodilatör alınır.B. FENOSTER idame ve semptom giderici tedavi:AsFENOSTER idame tedavisi:Hastalara, kurtarıcı olarak yanlarında ayrıca bir hızlı etki eden bronkodilatör bulundurmaları önerilmelidir. Önerilen dozlar:Erişkinler (18 yaş ve üzeri):Günde iki kez 1 inhalasyon. Bazı hastalar için, günde toplam iki kez 2 inhalasyon dozunu aşmamak üzere daha yüksek doz kullanılması gerekebilir.Adolesanlar (12-17yaş):Günde iki kez 1 inhalasyon.Genel uygulamada günde iki kez kullanım ile semptomlar kontrol altına alındığında, semptomların kontrolünün sürdürülebilmesi için hekim tarafından hastanın uzun etkilibronkodilatatöre ihtiyacı olduğu düşünülüyor ise, doz titre edilerek ulaşılan etkili en düşükdoz, günde tek doz FENOSTER olarak kullanılabilir. 2 Ayrıca bir hızlı etki eden bronkodilatör kullanımının artması, altta yatan bir kötüleşme olduğunu göstermektedir ve astım tedavisinin yeniden gözden geçirilmesi gerekmektedir. Çocuklar (6 yaş ve üzeri): 6-11 yaş arasındaki çocuklarda kullanım için daha düşük doz formoterol /budesonid kombinasyonu kullanılır. 6 yaşın altındaki çocuklar: Bu konuyla ilgili kısıtlı veri olduğu için, FENOSTER 6 yaşından küçük çocuklar için önerilmez. B FENOSTER idame ve semptom giderici tedavi:FENOSTER düzenli idame tedavi olarak ve ihtiyaç halinde semptomları gidermek amaçlı alınır. Hastalara, kurtarıcı olarak FENOSTER'i her zaman yanlarında bulundurmalarıöğütlenmelidir. FENOSTER'in idame ve semptom giderici tedavi şeklinde kullanımı özellikle aşağıdaki durumlarda dikkate alınmalıdır: Yetersiz astım kontrolü ve sık sık semptom giderici tedavi ihtiyacı Tıbbi müdahale gerektiren geçmişe yönelik astım alevlenmeleri Gerekli durumlarda çok sayıda ve sık FENOSTER alan hastalarda, doza bağımlı advers etkiler açısından yakın takibe ihtiyaç vardır. Önerilen dozlar:Erişkinler ve adolesanlar (12 yaş ve üzeri):Önerilen idame doz günde 2 inhalasyondur. Doz, sabah ve akşam birer inhalasyon veya sabah 2 yada akşam 2 inhalasyon olarak alınabilir. Bazıhastalar için günde iki kez 2 inhalasyonluk idame doz uygun olabilir. Hastalar, ihtiyaç halindesemptomların giderilmesine yönelik, ilave olarak 1 inhalasyon almalıdırlar. Birkaç dakikasonra semptomlar devam ederse ilave bir inhalasyon uygulanmalıdır. Bir defada 6inhalasyondan fazla uygulanmamalıdır.Normal şartlarda ihtiyaç duyulan toplam günlük doz 4 inhalasyondan fazla değildir. Bununla birlikte sınırlı bir süre için toplam günlük doz 6 inhalasyona kadar çıkabilir. Günde 4inhalasyondan fazla kullanan hastalara mutlaka medikal yardım almaları önerilmelidir.Bu hastalar tekrar değerlendirilmeli ve idame tedavileri tekrar gözden geçirilmelidir.3 KOAH:Önerilen dozlar:Yetişkinler:Uygulama şekli:İNHALER inspirator akım ile çalışmaktadır ve İNHALER'in ağız parçası aracılığıyla derin nefes alındığında ilaç solunum yollarına ulaşır. Not:Hastayı aşağıdaki konularda bilgilendirmek önemlidir:- Her inhaler ile birlikte kutunun içinde yer alan Hasta kullanım talimatında İNHALER'inkullanımı ile ilgili kısımlar dikkatle okunmalıdır. - Akciğerlere yeterli dozun ulaşabilmesi için hasta, İNHALER'in ağız parçası aracılığıylagüçlü ve derin nefes almalıdır. - Hasta, inhalatör ağzında iken asla nefes vermemelidir. - Hasta, ağız ve boğaz bölgesinde pamukçuk oluşma riskini azaltmak için her idame dozdansonra ağzını suyla çalkalamalıdır. Ağızda ve boğazda pamukçuk oluşursa ihtiyaç duyulan herinhalasyondan sonra hasta ağızını su ile çalkalamalıdır. Kullanımdan sonra İNHALER'in kapağı kapatılmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Karaciğer ya da böbrek yetmezliği olan hastalarda FENOSTER kullanımı ile ilgili veri yoktur. Ancak budesonid ve fomoterol ilk geçiş sırasında hepatik metabolizma ile elimineedildiklerinden, ağır karaciğer sirozu olanlarda maruziyet artabilir. Geriyatrik popülasyon:Yaşlılarda özel doz gereksinimleri yoktur. Pediyatrik popülasyon:6-11 yaş arasındaki çocuklarda kullanım için daha düşük bir FENOSTER dozu mevcuttur. 4.3Kontrendikasyonlar4 Budesonid, formoterol ya da inhale edilen laktoza (düşük miktarlarda süt proteinleri içeren) karşı aşırı duyarlılığı (alerji) olanlarda kullanılmamalıdır. 4.4 Özel kullanım uyarıları ve önlemleriTedavi kesileceği zaman dozun giderek azaltılması önerilmektedir. Tedavi, birden kesilmemelidir. İnhale steroidin kombine edildiği KOAH'lı ileri yaş hastalarda pnömoni riski artabilmektedir Formoterol, astımlı hastalarda tek başına monoterapi olarak kullanılmamalıdır.Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır.Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediatrik ve adölesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem deuzun etkili beta agonist içeren bir sabit dozlu kombinasyon preparatı kullanılması önerilir. FENOSTER , astım hastalığının başlangıç tedavisi için önerilmez. Hasta tedaviyi etkisiz bulduğunda ya da FENOSTER'in önerilen en yüksek dozundan daha fazla inhalasyon gerektiğinde doktoruna başvurmalıdır (Bkz. 4.2 Pozoloji ve uygulama şekli). Astım ve KOAH'ın ani ve giderek kötüleşmesi hayatı tehdit eden bir durumdur, hasta acil olarak doktor kontrolüne alınmalıdır. Bu durumda kortikosteroid tedavisinin artırılmasıörneğin oral yoldan bir kortikosteroid verilmesi ya da bir enfeksiyon varsa antibiyotikverilmesi uygundur. 5 Hastalara kurtarıcı inhaler olarak FENOSTER'i ( idame ve semptom giderici tedavi şeklinde kullanan hastalar için) veya başka hızlı etki eden bronkodilatatör ilaçlarım (sadece idametedavide FENOSTER kullanan tüm hastalar) her zaman yanlarında bulundurmalarıöğütlenmelidir. Hastalar, semptomlar olmasa bile FENOSTER idame dozunu doktorun önerdiği şekilde almaları konusunda bilgilendirilmelidir. FENOSTER tedavisine alevlenme sırasında veya eğer astımda belirgin kötüleşme yada akut olarak kötüleşen astım var ise başlanmamalıdır. Astım semptomları kontrol altına alındıktansonra, FENOSTER dozunun yavaş yavaş azaltılması düşünülebilir. Tedavi dozu azaltılırkenhastanın düzenli olarak kontrol edilmesi önemlidir. FENOSTER'in etkili en düşük dozukullanılmalıdır. (Bkz. 4.2 Pozoloji ve uygulama şekli). İlaç başlandıktan sonra ilk üç ay hastalar yakından takip edilmelidir. FENOSTER ile tedavi sırasında, astımla ilişkili advers etkiler ve alevlenmeler görülebilir. Hastadan FENOSTER iletedaviye devam etmesi, fakat FENOSTER'e başlandıktan sonra astım semptomları kontrolaltına alınamazsa veya kötüleşirse, tıbbi destek alması istenmelidir. Bronkodilatör öncesinde FEV 1 değerinin öngörülen normale göre >%50 olan ve bronkodilatör sonrası FEV 1 değerinin öngörülen normale göre < % 70 olan KOAHhastalarda FENOSTER ile ilgili klinik çalışma verileri bulunmamaktadır . (bakınız Bölüm5.1). İnhalasyon yoluyla uygulanan diğer tedavilerde olduğu gibi, ilaç alındıktan sonra hırıltılı soluk alıp vermekte ani bir artış ile birlikte paradoksal bronkospazm görülebilir.Bu durumdaFENOSTER ile tedavi kesilmelidir; tedavi tekrar değerlendirilmeli ve gerekirse başka birtedaviye geçilmelidir. Paradoksal bronkospazm, hızlı etkili inhale bronkodilatatöre cevap verir ve hemen tedavi edilmelidir (bkz.Bölüm4.8). 6 Uzun süre özellikle yüksek dozda inhalasyon yoluyla herhangi bir kortikosteroid kullanıldığında sistemik etkiler görülebilir. Bu etkilerin görülme olasılığı oral kortikosteroidlereoranla daha azdır. Oluşabilecek sistemik etkiler: Cushing's sendromu, Cushing benzeriözellikler, adrenal yetmezlik, kemik mineral yoğunluğunda azalma, katarakt, glokom ve dahanadir olarak çeşitli psikolojik veya psikomotor hiperaktivite, uyku bozuklukları, anksiyete,depresyon veya agresyonu kapsayan davranışsal etkiler (özellikle çocuklarda) ile çocuklar veadolesanlarda büyüme geriliğidir. (Bkz. Bölüm 4.8). Uzun süreli çalışmalara ait sınırlı veriler, inhalasyon yoluyla steroid kullanan çocukların ve adolesanların büyük çoğunluğunun sonunda yetişkin boy hedeflerine ulaştığını göstermektedir.Ancak, başlangıçta, büyümede az ve geçici olarak bir gerileme (yaklaşık 1 cm) görülmüştür. Budurum genellikle tedavinin ilk bir yılı içinde görülür. Kemik yoğunluğu üzerine potansiyel etkiler, özellikle uzun süre yüksek dozda kortikosteroid kullanan ve birlikte osteoporoz risk faktörleri taşıyan hastalarda gözönünde tutulmalıdır.İnhalasyon yoluyla kullanılan budesonid ile yapılan uzun süreliçalışmalar çocuklarda günlük ortalama 400 mcg (ölçülü doz) veya yetişkinlerde günlük 800mcg (ölçülü doz) dozun kemik mineral yoğunluğu üzerinde belirgin bir etkisinin olmadığınıgöstermiştir. FENOSTER'in daha yüksek dozları ile görülen etkilerine ilişkin bilgi yoktur.Daha önceki sistemik steroid tedavisi nedeniyle adrenal yetmezliğinin belirtileri varsa, bö yle hastalar FENOSTER tedavisine alınırken dikkatli olunmalıdır. İnhalasyonla alınan budesonid tedavisinin yararı, oral steroide duyulan gereksinimi en aza indirmesidir, ancak oral steroid tedavisinden inhalasyon tedavisine geçen hastalar uzun zamanadrenal yetmezlik riski ile karşı karşıya olabilirler. Geçmişte acil olarak yüksek dozkortikosteroid tedavisi görmüş olan ya da uzun süre yüksek dozda inhalasyon yoluyla steroidkullanmış hastalar da risk altında olabilir. Oral steroid tedavisinin kesilmesinden sonraiyileşme önemli ölçüde zaman alabilir ve bu nedenle inhale budesonide geçirilen oral steroidebağımlı hastalar önemli bir süre için bozulmuş adrenal fonksiyondan dolayı risk altındakalabilir. Bu gibi durumlarda HPA eksen fonksiyonu düzenli olarak izlenmelidir Yüksekdozlarda inhale kortikosteroidler ile uzun süreli, özellikle önerilenden daha yüksek dozlarlatedavi, klinik açıdan önemli adrenal baskılanmaya neden olabilir. Bu nedenle ağır 7 enfeksiyonlar gibi stres durumlarında veya selektif operasyon uygulanan dönemlerde ilave sistemik kortikosteroid tedavisi düşünülmelidir. Steroid dozlarında hızlı azalma, akut adrenalkrizleri tetikleyebilir. Akut adrenal kriz sırasında görülebilecek belirti ve işaretler kısmenbelirsiz olabilir, ancak anoreksi, abdominal ağrı, kilo kaybı, yorgunluk, baş ağrısı, bulantı,kusma, bilinç seviyesinde azalma, nöbet, hipotansyon ve hipoglisemiyi kapsayabilir. Oral tedaviden FENOSTER'e geçilirken, alerjik veya artiritik belirtiler görünümünde rinit, egzema ve kas eklem ağrısı gibi genel olarak daha düşük bir sistemik steroid etki görülecektir.Bu durumlar için özel tedavi başlatılmalıdır. Nadir olarak, yorgunluk, baş ağrısı, bulantı vekusma oluşması halinde, genel yetersiz bir glukokortikosteroid etkiden şüphelenmek gerekir.Böyle durumlarda oral glukokortikosteroid dozlarının geçici olarak arttırılması bazengereklidir. Hastalara, ağız ve boğaz bölgesinde pamukçuk oluşma riskini azaltması için idame dozun her inhalasyonundan sonra ağızlarını suyla çalkalamaları öğütlenmelidir. Pamukçuk oluşmasıdurumunda, ihtiyaç halinde kullanılan inhalasyonun ardından ağızlarını su ileçalkalamalıdırlar. FENOSTER ile itrakonazol ve ritonavir veya diğer güçlü CYP3A4 inhibitörleri birlikte kullanılmamalıdır (Bkz. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleri).Bunun mümkün olmadığı durumlarda, etkileşen ilaçların uygulanmaları arasındaki süremümkün olduğu kadar uzun olmalıdır. Güçlü CYP3A4 inhibitörlerini kullanan hastalarda,FENOSTER idame ve semptom giderici tedavi önerilmemektedir. FENOSTER, tirotoksikoz, feokromasitoma, diabetes mellitus, tedavi edilmemiş hipokalemi, hipertrofik obstrüktif kardiyomiyopati, idiyopatik subvalvular aort stenozu, şiddetlihipertansiyon, anevrizma veya iskemik kalp hastalığı, taşiaritmi ya da kalp yetmezliği gibiağır kardiyovasküler hastalığı olanlarda dikkatli kullanılmalıdır. QTc-aralığı uzamış hastalarda FENOSTER kullanırken dikkatli olunmalıdır. Formoterol QTc-aralığının uzamasına neden olabilir. Aktif ya da pasif akciğer tüberkülozu, solunum yollarında fungal ve viral enfeksiyonu olan 8 hastalarda, inhalasyonla kullanılan kortikosteroidlere gerek olup olmadığı ve dozu yeniden değerlendirilmelidir. Yüksek dozda beta2-agonist tedavisi, ciddi hipokalemi ile sonuçlanabilir. Beta2-agonistlerin hipokalemiye neden olan veya ksantin türevleri, steroidler ve diüretikler gibi hipokalemiketkiyi artıran diğer ilaçlarla birlikte kullanılması, beta2-agonistlerin olası hipokalemik etkisiniartırabilir. Hipokalemi advers etki olasılığının arttığı; değişken sıklıkta hızlı etkilibronkodilatatörlerin kullanıldığı stabil olmayan astım, hipoksi nedeniyle hipokalemi riskininartabileceği akut ağır astım ve bu riskin artabileceği diğer durumlarda özel dikkat gösterilmesiönerilmektedir. Bu tür durumlarda serum potasyum düzeylerinin dikkatle izlenmesiönerilmektedir. Bütün beta2-agonistlerde olduğu gibi, diyabetik hastalarda kan glukoz düzeyleri daha sık izlenmelidir. Sistemik ve topikal kortikosteroid kullanımı ile görme bozukluğu bildirilebilir. Bir hastada bulanık görme veya diğer görsel rahatsızlıklar gibi semptomlar ortaya çıkarsa hasta olasınedenlerinin değerlendirilmesi için bir göz doktoruna gitmesi tavsiye edilir. Sistemik vetopikal kortikosteroid kullanımından sonra bildirilen katarakt, glokom veya merkezi serözkorioretinopati gibi nadir hastalıklar olası nedenlerdir. Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında dozun kademeli olarak azaltılmasıdeğerlendirilmeli ve eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastalarınkontrol edici bir tedaviyle idamesi sağlanmalıdır. Tedavi dozu azaltılırken hastanın düzenli olarak kontrol edilmesi önemlidir. FENOSTER'in etkili en düşük dozu kullanılmalıdır (Bkz. 4.2 Pozoloji ve uygulama şekli) Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. 9 FENOSTER yardımcı madde olarak laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glikoz-galaktoz malabsorpsiyon problemi olanhastaların bu ilacı kullanmamaları gerekir. KOAH hastalarında pnömoni Kortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni döhil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoniriskinde artış kanıtlan bulunmaktadır, ancak bu durum çalışmalann tamamında kesin olarakgösterilmemiştir. Kortikosteroid içeren inhale ilaçlannın pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık için kesin klinik kanıt bulunmamaktadır. Hekimler, KOAH hastalannda olası pnömoni gelişimine karşı, enfeksiyonlann klinik özellikleri ile KOAH semptomlarırun alevlenme durumunun kanşması ihtimali dolayısıyla dikkatliolmalıdırlar. KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içimi, ileri yaş, düşük vücut kitle indeksi ve şiddetli KOAH bulunmaktadır. İnhaler steroidin kombine edildiği ileri yaş hastalarda pnömoni riski artabilmektedir. KOAH'da yüksek doz kullanımının avantaj sağladığına ilişkin klinik kanıtlaryetersizdir.Pediyatrik popülasyonlar Uzun süre inhalasyon yoluyla kortikosteroid alan çocukların büyümeleri doktor tarafından izlenmelidir. Büyüme yavaşlarsa, inhalasyon yoluyla kullanılan kortikosteroidin dozunundüşürülmesi hedeflenerek tedavi yeniden değerlendirilmelidir. Büyüme yetersizliği riski,kortikosteroid tedavisinin sağladığı fayda ile kıyaslanmalıdır. Ayrıca hastanın, pediyatriksolunum hastalıkları uzmanına yönlendirilmesi düşünülmelidir. Uzun süreli çalışmalara ait sınırlı veriler, inhalasyon yoluyla steroid kullanan çocukların ve adolesanların büyük çoğunluğunun sonunda yetişkin boy hedeflerine ulaştığınıgöstermektedir. Ancak, başlangıçta, büyümede az ve geçici olarak bir gerileme (yaklaşık 1 10 cm) görülmüştür. Bu durum genellikle tedavinin ilk bir yılı içinde görülür 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriFarmakokinetik etkileşimler:Budesonidin metabolik değişimi, CYP P4503A4 ile metabolize olan maddeler tarafından (örn. ketokonazol, itrakonazol, vorikonazol, posakonazol, klaritromisin, telitromisin, nefazodon veHIV proteaz inhibitörleri (ritonavir) engellenmekte olduğundan bu ilaçlarla birliktekullanımından kaçınılmalıdır. Bunun mümkün olmadığı durumlarda inhibitör ile budesonidinkullanımı arasındaki zaman aralığı mümkün olduğunca uzun olmalıdır. CYP P450 3A4'ün bugüçlü inhibitörlerinin birlikte kullanılması budesonidin plazma düzeylerini yükseltebilir.Güçlü CYP3A4 inhibitörlerini kullanan hastalarda, FENOSTER idame ve semptom gidericitedavi önerilmemektedir. (Bkz.Bölüm 4.4). Günde bir kez 200 mg şeklinde uygulanan güçlü CYP3A4 inhibitörü ketokonazol, eşzamanlı olarak oral yoldan uygulanan budesonidin (3 mg'lık tek doz) plazma düzeyleriniortalama altı kat arttırmıştır. Ketokonazol, budesonid uygulamasından 12 saat sonraverildiğinde konsantrasyon ortalama sadece üç kat artmıştır ve bu durum uygulamazamanlarının birbirinden ayrılmasının plazma düzeylerindeki artışı azaltabileceğinigöstermektedir. Yüksek doz inhale budesonid ile ilgili bu etkileşim hakkındaki sınırlıveriler, günde bir kez 200 mg itrakonazol, inhale budesonid (1000 mcg'lık tek doz) ileeşzamanlı uygulandığında plazma düzeylerinde belirgin artışlar olabileceğini (ortalama dörtkat) ortaya koymaktadır. Farmakodinamik etkileşimler:Beta-adrenerjik blokör ilaçlar, formoterolün etkisini zayıflatabilir ya da tamamen inhibe edebilirler. Bu nedenle zorunlu olmadıkça, FENOSTER, beta-adrenerjik blokör ilaçlarla (gözdamlaları dahil) birlikte kullanılmamalıdır. Kinidin, disopiramid, prokainamid, fenotiyazinler, antihistaminikler (terfenadin) ve trisiklik antidepresanlarla birlikte kullanıldığında QTc-aralığı uzayabilir ve ventriküler aritmi riskiartar. Ayrıca L-dopa, L-tiroksin, oksitosin ve alkol, beta2-sempatomimetiklere karşı kardiyak toleransı azaltabilir. Monoamino oksidaz inhibitörleri ve furazolidon ve prokarbazin gibi benzer özellikteki 11 ilaçlarla birlikte kullanıldığında hipertansif reaksiyonlar artabilir. Halojenli hidrokarbon yapısındaki anestezik ilaçlarla birlikte kullanıldığında aritmi riski artar. Diğer beta-adrenerjik ilaçlarla veya antikolinerjik ilaçlarla birlikte kullanıldığında aditifbronkodilatasyon etki görülebilir. Dijital glikozitleri ile tedavi edilen hastalarda hipokalemi, aritmiye eğilimi artırabilir. Hipokalemi beta 2 -agonisti tedavisinden kaynaklanabilir ve etkisi ksantin türevleri,kortikosteroidler ve diüretiklerle eşzamanlı tedavi nedeniyle güçlenebilir (bkz. Bölüm 4.4)Budesonidin ve formoterolün astım tedavisinde kullanılan diğer ilaçlarla etkileşimigözlenmemiştir. Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyonlarEtkileşim çalışmaları sadece yetişkinlerde yapılmıştır. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeline sahip astımlı kadınlar ve gebe olan astımlı kadınları da içeren astımlı hastalarda genel olarak yetersiz astım kontrolü riski bulunması nedeniyle,çocuk doğurma potansiyeline sahip astımlı kadınları da içeren bu hastaların ideal bir anti-astmatik tedavi almaları son derece önemlidir. - FENOSTER(budesonid,formoterol) ile tedavi, gebe kadın ya da fetüsü için herhangi bir ilave anlamlı klinik risk oluşturmaz ve bu nedenle herhangi bir aktif kontrasepsiyonkullanılması gerekli değildir. -FENOSTER'in bugün bilinen kontrasepsiyon yöntemleri üzerinde herhangi bir etkisi yoktur. 12 Gebelik dönemiFENOSTER'in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir FENOSTER gebelikte ancak sağlanan fayda ortaya çıkabilecek risklerden fazla olduğunda kullanılabilir. Budesonidin, yeterli astım kontrolünü idame ettirecek etkili endüşük dozu kullanılmalıdır. Gebelikte, FENOSTER tedavisine veya formoterol ve budesonidin birlikte kullanılmasına yönelik herhangi bir klinik veri mevcut değildir. Sıçanlardaki bir embriyo-fetal gelişimçalışmasının verileri kombinasyondan kaynaklanan herhangi bir artmış etkiyi işaretetmemiştir. Formoterolün hamile kadınlarda kullanımına yönelik yeterli veri mevcut değildir. Hayvan çalışmalarında, çok yüksek sistemik dozların kullanıldığı üreme çalışmalarında formoteroladvers etkilere neden olmuştur (Bkz. 5.3 Klinik öncesi güvenlilik verileri). Yaklaşık 2000 gebeden elde edilen veriler, inhale budesonidin kullanılması ile ilişkili olarak teratojenik riskin artmadığını göstermektedir. Hayvan çalışmalarındaglukokortikosteroidlerin malformasyonlara neden olduğu gösterilmiştir (Bkz. 5.3 Kliniköncesi güvenlilik verileri). Bu durum, önerilen dozların verildiği insanlarda aynı değildir. Hayvan çalışmalarında, glukokortikoidlerin doğumdan önce aşırı miktarda alınmasının intrauterin gelişmede gecikme, yetişkin kardiyovasküler hastalık ve glukokortikoid reseptöryoğunluğunda, teratojenik doz aralığının altında görülen nörotransmitter döngüsü veetkilerinde kalıcı değişikliklere yönelik bir ilişki saptanmıştır. Laktasyon dönemiBudesonid anne sütüne geçer. Ancak tedavi dozlarında kullanıldığında bebeğe zararlı etkisi olması beklenmez. Formoterolün insanlarda anne sütüne geçip geçmediği bilinmemektedir. Sıçanlarda, az miktarda formoterolün anne sütüne geçtiği belirlenmiştir. FENOSTER, emziren annelere, ancak anneye sağlanan faydanın, çocukta görülebilecek riskten daha fazlaolması halinde verilebilir. 13 Üreme yeteneği ve fertiliteBudesonidin üreme üzerindeki etkisi hakkında veri yoktur. Formoterol ile yapılan hayvan üreme çalışmaları, erkek sıçanlarda yüksek sistemik maruziyette azalmış üreme fonksiyonugöstermiştir (bkz. Bölüm 5.3). 4.7 Araç ve makine kullanımı üzerindeki etkilerFENOSTER'in araç ve makine kullanmaya herhangi bir etkisi yoktur ya da ihmal edilebilir düzeydedir. 4.8 İstenmeyen etkilerFENOSTER, hem budesonid hem de formoterol içerdiğinden bu maddelerin herbirine ait, aynı tipte ve aynı sıklıkta advers etkiler görülebilir. Bu iki maddenin birlikte kullanılmasınabağlı olarak advers etkilerde bir artış gözlenmemiştir. En yaygın yan etkiler; beta2-agonistlerletedavide görülen tremor ve palpitasyon gibi advers etkilerdir. Bu etkiler hafiftir ve tedavininbirkaç günü içinde kaybolurlar. Budesonid ya da formoterole bağlı aşağıdaki yan etkiler organ sınıfı ve sıklığa göre sıralanmıştır. Sıklık tanımlaması: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygınolmayan (>1/1.000 ila <1/100), seyrek (>1/10.000 ila <1/1.000), çok seyrek (<1/10.000) vebilinmiyor (eldeki verilerden hareketle tahmin edilemiyor.
Orofarinksteki Candida enfeksiyonu ilaç birikmesinden kaynaklanmaktadır.Hastalara her idame dozundan sonra ağızlarının su ile çalkalanmasının önerilmesi, riski en azaindirir.Orofarinksteki Candida enfeksiyonu genelde inhale kortikosteroid tedavisinikesmeye gerek kalmadan topikal antifungal tedaviye cevap verir.Eğer orofarinkstepamukçuk oluşursa da, hastalar gerekli inhalasyonlardan sonra da ağızlarını su ileçalkalamalıdır. Diğer inhalasyon tedavilerinde olduğu gibi bazı vakalarda nadiren paradoksikal bronkospazm gelişebilir. Bu durum 10.000'de 1 kişiden azını etkilemekte, doz uygulamasının ardındanhırıltı ve nefes darlığında hızlı bir artış meydana gelmektedir. Paradoksal bronkospazm hızlıetkili bir inhale bronkodilatöre yanıt verir ve derhal tedavi edilmelidir. FENOSTER derhal 15 bırakılmalı, hasta değerlendirilmeli ve gerekiyorsa bir alternatif tedavi başlanmalıdır (Bkz. 4.4 Özel kullanım uyarıları ve önlemleri). Uzun süre özellikle yüksek dozda inhalasyon yoluyla herhangi bir kortikosteroid kullanıldığında sistemik etkiler görülebilir. Bu etkilerin görülme olasılığı oralkortikosteroidlere oranla daha azdır. Oluşabilecek sistemik etkiler; Cushing's sendromu,Cushing benzeri belirtiler, adrenal yetmezlik, çocuklar ve adolesanlarda büyüme geriliği,kemik mineral yoğunluğunda azalma, katarakt ve glokomdur. Enfeksiyonlara karşı artmışhassasiyet ve stres koşullarına adapte olmakta azalma da meydana gelebilir. Etkilermuhtemelen doza, uygulama süresine, birlikte kullanılan veya daha önceki steroidmaruziyetine ve bireysel hassasiyete bağlıdır. Beta2-agonistlerle tedavi, insülin, serbest yağ asitleri, gliserol ve keton cisimlerinin kan düzeyinin yükselmesine neden olabilir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Karaciğer ya da böbrek yetmezliği olan hastalarda FENOSTER kullanımı ile ilgili veri yoktur. Ancak budesonid ve fomoterol ilk geçiş sırasında hepatik metabolizma ile elimineedildiklerinden, ağır karaciğer sirozu olanlarda maruziyet artabilir. Geriyatrik popülasyon:Yaşlılarda özel doz gereksinimleri yoktur. Pediyatrik popülasyonlarİnhale kortikosteroidler ile uzun süreli tedavi gören çocukların boylarının düzenli olarak izlenmesi önerilir (Bkz. Bölüm 4.4.) Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99)16 4.9 Doz aşımı ve tedavisiFormoterolün doz aşımı durumunda tremor, baş ağrısı ve palpitasyon gibi P2-agonistlere bağlı tipik etkiler görülebilir. İzole vakalarda bildirilen belirtiler; taşikardi, hiperglisemi,hipokalemi, QTc-aralığında uzama, aritmi, bulantı ve kusmadır. Destekleyici ve semptomatiktedavi uygulanabilir. Akut bronşiyal obstrüksiyonu olan hastaya 3 saat içinde verilen 90mikrogramlık bir doz güvenilirlik konusunda sorun yaratmamıştır. Çok yüksek dozlarda olsa bile, akut budesonid doz aşımının klinik açıdan sorun oluşturması beklenmez. Uzun süre çok yüksek dozlarda kullanılırsa, hiperkortisizm ve adrenalbaskılanması gibi sistemik glukokortikosteroid etkileri ortaya çıkabilir. Formoterol doz aşımına bağlı olarak FENOSTER tedavisinin kesilmesi gerekirse, inhalasyon yoluyla kullanılan uygun bir kortikosteroid tedavisinin uygulanması düşünülmelidir. 5. FARMAKOLOJIK ÖZELLIKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Adrenerjikler ve obstrüktif solunum yolu hastalıklarında kullanılan diğer ilaçlar ATC kodu : R03AK07 Etki mekanizmaları ve farmakodinamik etkilerFENOSTER, formoterol ve budesonid içerir ve her ikisinin de etki mekanizmaları farklıdır ve astım alevlenmelerinin azalabilmesi için aditif etki gösterirler. Budesonid ve formoterolünspesifik özellikleri bu kombinasyonun, hem idame hem de semptom giderici tedavidekullanılmasını sağlamaktadır. Budesonid:Budesonid inhale edildiğinde, solunum yollarında doza bağımlı antienflamatuvar etki gösteren,semptomlarda ve astım alevlenmelerinde azalma sağlayan bir glukokortikosteroiddir.İnhale edilen budesonid, sistemik kortikosteroidlere göre daha az ciddi advers etkileresahiptir. Glukokortikosteroidlerin bu antienflamatuvar etkisinden sorumlu olan esasmekanizma tam olarak bilinmemekle birliktedir. 17 Formoterol:Formoterol, geri dönüşümlü solunum yolu obstrüksiyonu olan hastalarda inhale edildiğinde, bronş düz kasında hızlı ve uzun etkili gevşeme sağlayan, selektif bir beta2-adrenerjikagonisttir. Bronş genişletici etkisi doza bağımlı olarak 1-3 dakika içinde hızla başlar ve tek birdozdan sonra etkisi en az 12 saat sürer. FORMOTEROL/BUDESONİD KOMBİNASYONU:Astım:Formoterol/budesonid kombinasyonu idame tedavisinde klinik etkinlikYetişkinlerde yapılan klinik çalışmalar, budesonid/formoterol eklenmesinin astım semptomlarını ve akciğer fonksiyonlarını daha çok düzelttiğini ve alevlenmeleri azalttığınıgöstermektedir. 2 ayrı 12 haftalık çalışmada, budesonid/formoterol kombinasyonun akciğerfonksiyonları üzerine etkisinin, budesonid/formoterol ayrı ayrı kombinasyonu ile aynı, tekbaşına kullanılan budesonidden fazla olduğu budesonid/formoterol görülmüştür. İhtiyaçolduğunda tüm tedavi kollarında kısa etkili bir beta2-agonist kullanılmıştır. Anti-astmatiketkinin zamanla azaldığına dair hiçbir bilgi yoktur. Pediyatrik hastalarda yapılan 12 haftalık bir çalışmada, 6-11 yaş arasındaki 265 çocuk formetorolün ve budesonoidin'in idame dozu ile (80/4.5 mikrogram /inhalasyonkombinasyonu ile günde iki kez, 2 inhalasyon) ve gerekli hallerde kısa etkili bir beta2-agonistile tedavi edilmişlerdir. Akciğer fonksiyonunda düzelme görülmüştür ve tedavi, budesonidİNHALER'in karşılık gelen dozu ile kıyaslandığında, iyi tolere edilmiştir. Formoterol/budesonid kombinasyonu idame ve semptom giderici tedavisinde klinik etkinlik6 veya 12 ay süren 5 adet çift-kör çalışmasında (4447 hasta budesonid/formoterol idame ve semptom giderici tedavi için rastgele seçilmiştir) toplam 12076 astım hastası yer almıştır.İnhale glukokortikosteroidlerin kullanılmasına rağmen çalışmalara alınan hastalarınsemptomatik olması gerekmiştir. 5 adet çalışmadaki bütün karşılaştırma gruplarında, budesonoid ve formetorol idame ve semptom giderici tedavinin şiddetli alevlenmelerde hem istatiksel hem de klinik açıdananlamlı azalmalar sağladığı gösterilmiştir. Bu çalışmalardan ikisinde budesonoid veformetorol idame ve semptom giderici tedavi, yüksek idame dozunda budesonid/formoterolile birlikte semptom giderici olarak terbutalin (çalışma 735) ve benzer idame dozda 18 budesonid/formoterol ile birlikte semptom giderici olarak terbutalin ya da formoterolün kullanılması (çalışma 734) (Tablo 2) karşılaştırmıştır. Çalışma 735' de akciğer fonksiyonu,semptom kontrolü ve semptom giderici tedavi kullanımı tüm tedavi gruplarında benzerdir.Çalışma 734' de, her iki tedavi ile karşılaştırıldığında, semptomlar ve semptom giderici tedaviazaltılmış, akciğer fonksiyonu düzelmiştir. 5 çalışmanın kombine analizinde,budesonid/formoterol idame ve semptom giderici tedavi uygulanan hastalara, tedavigünlerinin %57'sinde herhangi bir semptom giderici tedavi uygulanmamıştır. Toleransgelişimine dair herhangi bir bulgu elde edilmemiştir.Tablo 2 Klinik çalışmalarda ciddi alevlenmeler
a Hastaneye yatırılma/acil tedavi veya oral steroidler ile tedavi b Alevlenme sıklığında azalma her iki karşılaştırmada istatiksel (P değeri < 0.01) olarak önemlidir. Yukarıda belirtilen 5 çalışma ile 160/4.5 mikrogram ile günde iki kez iki inhalasyon düzeyindeki daha yüksek bir idame dozunun kullanıldığı ek bir çalışmayı kapsayan altı çift-körçalışmada adolesanlar ve erişkinlerde kıyaslanabilir bir etkililik ve güvenlilik ortayakonmuştur, Bu değerlendirmeler 1847'si adolesan olan 14385 astım hastasını temel almıştır. 19 Budesonid/formoterol idame tedavisi ve semptom giderici olarak en az bir gün boyunca 8'den fazla inhalasyon alan adolesan hastaların sayısı sınırlıdır ve bu biçimde kullanım seyrek birdurumdur. Akut astım semptomlarından ötürü medikal dikkat gerektiren hastalar ile yapılan diğer iki çalışmada budesonid/formoterol kombinasyonu,, bronkokonstrüksiyonda, salbutamol veformoterole benzer hızda ve etkinlikte rahatlama sağlamıştır. KOAH:Orta şiddet ve ağır şiddetli KOAH'lı hastalar üzerinde yapılan 2 ayrı 12 aylık çalışmada, budesonid/formoterol kombinasyonunun akciğer fonksiyonu ve alevlenme sıklığı (uygulananoral steroid ve/veya antibiyotik kürü ve/veya hospitalizasyon sayısı ile belirlenir) üzerineetkisi değerlendirilmiştir. Her iki çalışma için dahil edilme kriteri, bronkodilatör öncesindeFEV 1 değerinin öngörülen normale göre <%50 olması olarak belirlenmiştir. Çalışmayakatılım sırasında medyan bronkodilatör sonrası FEV 1 değeri, öngörülen normalin %42'siolmuştur. Bir yıldaki ortalama alevlenme sayısında (yukarıda belirtildiği gibi), formoterol iletek başına tedavi ya da plaseboya göre budesonid/formoterol kombinasyonunun ile belirginbir azalma sağlanmıştır (ortalama sıklık budesonid/formoterol kombinasyonunun grubunda1.4, plasebo/formoterol grubunda 1.8-1.9). Her bir hastada 12 ay boyunca oral kortikosteroidkullanılan gün sayısı budesonid/formoterol kombinasyonunun kullanan grupta biraz dahaazdır (Formoterol/Budesonid kombinasyonunun kullanan grupta 7-8 gün/hasta/yıl, plasebo veformoterol kullanan hastalarda sırasıyla 11-12 gün/hasta/yıl ve 9-12 gün/hasta/yıl). FEV1 gibiakciğer fonksiyonu parametrelerindeki değişikliklerde budesonid/formoterolkombinasyonunun, formoterol ile tek başına tedaviye göre daha üstün değildir. 5.2 Farmakokinetik özelliklerGenel özelliklerEmilim:Budesonid/formoterol kombinasyonu ve bileşimindeki budesonid ve formoterolü tek başına içeren ilaçların, budesonid ve formoterolün sistemik yararlanımları açısından biyoeşdeğerolduğu gösterilmiştir. Buna rağmen bileşimindeki maddeleri tek başına içeren ilaçlarlakıyaslandığında, budesonid/formoterol kombinasyonu ile kortizol baskılanmasında hafif birartış görülmüştür. Bu farkın klinikteki güvenilirlik üzerine bir etkisi yoktur. 20 Budesonid/formoterol farmakokinetik etkileşimine ilişkin bir kanıt yoktur. Budesonid/formoterol tek başına içeren preparatların veya budesonid/formoterol kombinasyonunun uygulanmasından sonra her bir maddenin farmakokinetik parametrelerikarşılaştırılabilir. Budesonid, kombinasyon şeklinde uygulandığında, eğri altındaki alanı(EAA) biraz yüksek, emilimi daha hızlı ve doruk plazma konsantrasyonu biraz dahayüksektir. Formoterol tek başına ya da kombinasyon şeklinde kullanıldığında, doruk plazmakonsantrasyonları birbirine yakındır. İnhalasyonla alınan budesonid hızla emilir ve dorukplazma konsantrasyonuna 30 dakika içinde ulaşılır. Yapılan çalışmalarda, inhaler aracılığıylainhale edilen budesonidin akciğerlere ulaşan miktarı, hastaya ulaşan dozun %32-44'ükadardır. Uygulanan dozun sistemik yararlanımı, hastaya ulaşan dozun yaklaşık %49'ukadardır. 6-16 yaş çocuklarda akciğerdeki depozisyonu, aynı doz verilen yetişkinler ile aynıaralığa denk gelmektedir, sonuç plazma konsantrasyonları saptanmamıştır. İnhale edilen formoterol hızla emilir ve 10 dakika içinde doruk plazma konsantrasyonuna ulaşır. Yapılan çalışmalarda, inhaler aracılığıyla inhale edilen formoterolün akciğerlere ulaşanmiktarı, hastaya ulaşan dozun %28-49'udur. Sistemik yararlanım, hastaya ulaşan dozunyaklaşık %61'i kadardır. Dağılım:Formoterol yaklaşık %50, budesonid %90 oranında plazma proteinlerine bağlanır. Dağılım hacmi, formoterol için yaklaşık 4 L/kg, budesonid için ise yaklaşık 3 L/kg'dır. Biyotransformasyon:Formoterol konjugasyon reaksiyonları ile metabolize olur (aktif O-demetilasyon ve deformilasyon metabolitleri oluşur, ancak bunlar inaktif konjugatlar olarak görülür).Budesonid karaciğerden ilk geçişi sırasında (yaklaşık %90) ilk geçiş metabolizmasınauğrayarak glukokortikosteroid aktivitesi düşük metabolitlerine dönüşür. En önemlimetabolitleri olan 6-P-hidroksibudesonid ve 16-a-hidroksiprednizolonun glukokortikosteroidaktivitesi budesonidin aktivitesinin %1'inden azdır. Budesonid ve formoterol arasında herhangi bir metabolik etkileşim ya da yer değiştirme reaksiyonları olduğuna ilişkin bulgu yoktur. 21 Eliminasyon:Formoterol dozunun büyük bir kısmı karaciğerde metabolize olarak böbrekler aracılığıyla atılır. İnhalasyondan sonra hastaya ulaşan formoterol dozunun %8-13'lük miktarı metabolizeedilmeden idrarla atılır. Formoterolün sistemik klerensi yüksektir (yaklaşık 1.4 L/dak.) veplazma yarılanma süresi ortalama 17 saattir. Budesonid, CYP3A4 enziminin katalize ettiği reaksiyonlar ile metabolize olarak atılır. Budesonid metabolitleri, aynen ya da konjuge edilerek böbrekler aradığıyla atılır. İdrardadeğişmemiş halde budesonid miktarı ihmal edilebilir düzeydedir. Budesonidin sistemikklerensi yüksektir (yaklaşık 1.2 L/dak.) ve intravenöz yoldan uygulandığında plazmaeliminasyon yarılanma süresi ortalama 4 saattir. Budesonid ve formoterolün, çocuklarda ve böbrek yetmezliği olan hastalardaki farmakokinetiği konusunda bilgi yoktur. Karaciğer yetmezliği olanlarda budesonid veformoterolün sistemik yararlanımı artabilir. Doğrusallık/doğrusal olmayan durum:Hem budesonid hem de formoterol için sistemik maruziyet uygulanan doz ile doğrusal bir ilişki içindedir. 5.3 Klinik öncesi güvenlilik verileriBudesonid ve formoterol tek başına ya da ikisinin kombinasyonu ile hayvanlarda yapılan toksisite çalışmalarında görülen etkiler abartılmış farmakolojik etkilerdir. Üreme ile ilgili hayvan çalışmalarında budesonid gibi kortikosteroidlerin malformasyonlara (yarık damak, iskelet malformasyonları) sebep olduğu gösterilmişse de bu etkilerin önerilendozlarla tedavi edilen insanlar için geçerli olmadığı görülmüştür. Hayvanlarda, formoterol ileyapılan üreme çalışmalarında, sistemik yararlanımın yüksek olduğu erkek sıçanlardafertilitede azalma ve sistemik yararlanımın klinikteki kullanımdan önemli ölçüde yüksekolduğu durumlarda, implantasyon kayıpları ile birlikte postnatal yaşam süresinde ve doğumkilosunda azalma gözlenmiştir. Ancak bu hayvan deneylerinin sonuçları insanlar için geçerlideğildir. 22 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiLaktoz monohidrat, öğütülmüş (inek sütü kaynaklı) HPMC kapsülKırmızı demir oksit (E172) Titanyum dioksit (E171) Hipromelloz (E464) 6.2 GeçimsizliklerBilinen geçimsizliği yoktur. 6.3 Raf ömrü24 ay 6.4 Saklamaya yönelik özel uyarılar25°C'nin altında oda sıcaklığında ve her zaman blister içinde muhafaza edilmelidir. Blisterler ancak kullanımdan hemen önce açılmalıdır. 6.5 Ambalajın niteliği ve içeriğiBir Alu/OPA-Alu-PVC blister içinde, 1 kutuda 60 kapsül olacak şekilde ambalajlanır. Her karton kutu kullanma talimatı ile birlikte 1 adet inhalasyon cihazı içerir. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imhaedilmelidir. 7. RUHSAT SAHİBİWorld Medicine İlaç San. ve Tic. A.Ş. Bağcılar / İSTANBUL 8. RUHSAT NUMARASI2022/191 23 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 03.04.2022 Ruhsat yenileme tarihi: 10. KUB'UN YENİLENME TARİHİ
24 FENOSTER kapsülü inhaler (cihaz) ile nasıl kullanacağınızı öğrenmek için şekillerle gösterilen talimatları takip ediniz. İnhaler aşağıdaki bölümlerden oluşmaktadır: 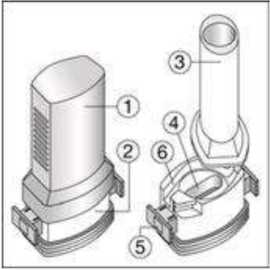 1. Ağızlığı koruyan bir kapak. 2. İlacın kapsülden düzgün olarak salınmasını sağlayanbir taban. Taban kısmı aşağıdaki kısımlardan oluşur: 3. Ağızlık. 4. Kapsül bölmesi. 5. Kapsül bölmesinin iki yanında basıldığında çıkaniğneler aracılığıyla kapsülleri delmeye yarayandüğmeler (kulakçıkları) 6. Hava geçiş kanalı. 1. Kapağı çekip çıkarınız. 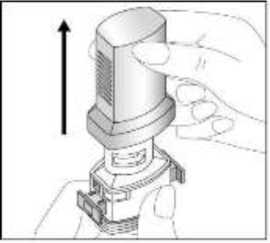 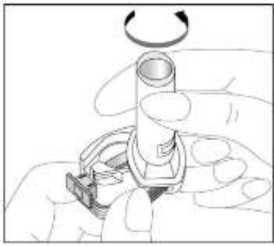 2. Kapsül bölmesini açınız. İnhalerin tabanını sıkıca tutup, açmak için ağızlığı üzerinde yer alan ok işareti yönünde döndürünüz. 25 3. Parmaklarınızın tamamen kuru olduğundan emin olunuz.Blisterden bir kapsül çıkarınız ve bu kapsülü cihazıntabanındaki kapsül bölmesine yatık olarak yerleştiriniz.Kapsülü, kullanımdan hemen önce blisterden çıkarmanızönemlidir. 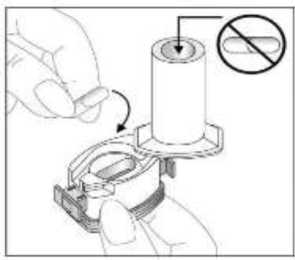 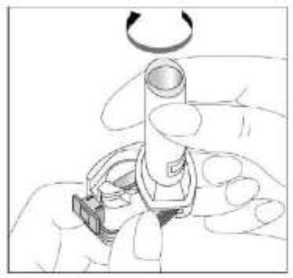 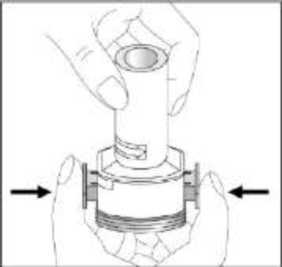 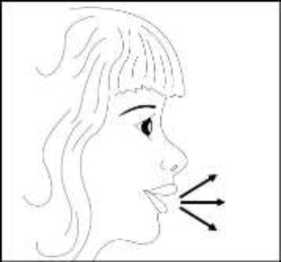 ÖNEMLİ: Kapsülü ağızlığın içerisine koymayınız!4. Tık sesini duyana kadar ağızlığı ok yönünün tersinedöndürerek kapsül bölmesini kapatınız. 5. Tozu kapsülden serbestlemek için: Cihazı ağızlık yukarı doğru bakacak şekilde dikolarak tutunuz. Kenarlardaki iki kulakçığa (düğmelere) aynı andasadece bir kezsıkıca basarak kapsülü deliniz.Not:Kapsül bu aşamada parçalanabilir ve küçük HPMC kapsül parçacıkları ağzınıza ya da boğazınıza gelebilir. Fakatkapsül yenilebilir nitelikte olduğu için zararlı değildir.6. Nefesinizi dışarıya olabildiğince veriniz. 26 7. İlacı derin bir şekilde hava yollarınıza çekmek için: Ağızlığı ağzınıza yerleştiriniz ve başınızı hafifçegeriye doğru eğiniz. 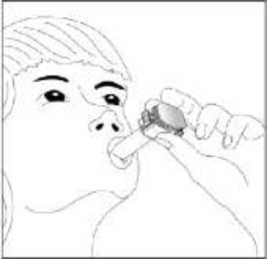 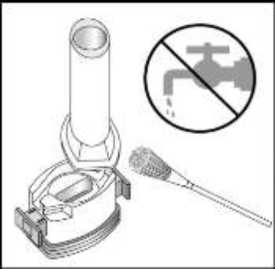 Dudaklarınızla ağızlığın etrafını sıkıca sarınız. Hızlı, duraksamadan ve alabildiğiniz kadar derinbir nefes alınız. Not:Kapsülün, kapsül bölmesinin üzerindeki alandadönmesine bağlı olarak bir vızıldama sesi duymalısınız. Eğer bu vızıldama sesini duymazsanız, kapsül bölmesini açınız vekapsülün, kapsül bölmesinde sıkışıp sıkışmadığını kontrolediniz. Daha sonra 7. basamağı tekrarlayınız. Kapsülüsıkıştığı yerden kurtarmak için düğmelere tekrar tekrar BASMAYINIZ. 8. Cihazın içerisinden nefes aldıktan sonra, nefesiniziolabildiğince tutunuz ve cihazı ağzınızdan çıkarınız.Sonra burnunuzdan nefes veriniz. Kapsül bölmesiniaçınız ve kapsülde toz kalıp kalmadığını kontrol ediniz.Eğer kalmış ise 6-8. işlemleri tekrarlayınız. 9. Tüm tozu kullandıktan sonra kapsül bölmesini açınız(Bkz. basamak 2). Boş kapsülü çıkarınız ve içeride kalantozları temizlemek için kuru bir kağıt mendil ya dayumuşak bir fırça kullanınız. Not:İnhaleri temizlemek için SU KULLANMAYINIZ.10. Önce ağızlığı, ardından kapağı kapatınız. 27 |
İlaç BilgileriFenoster 160 Mcg/9 Mcg İnhalasyon Tozu, Sert KapsülEtken Maddesi: Budesonid, Formoterol Fumarat Dihidrat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.