Fasenra 30 Mg/ml Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Enjektör Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ"VBu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERİ TIBBİ ÜRÜNÜN ADIFASENRA® 30 mg/ml enjeksiyonluk çözelti içeren kullanıma hazır enjektör Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her kullanıma hazır enjektör ml'de 30 mg benralizumab içerir. Benralizumab, rekombinant DNA teknolojisi ile memeli (Çin hamsterı overi) hücrelerinde üretilen bir insan immünoglobulin monoklonal antikordur. Yardımcı maddeler:Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti içeren kullanıma hazır enjektör Berrak ila opak arası, renksiz ila hafif sarı renkli, beyaz ila beyazımsı gözle görülebilir partiküller içerebilen çözelti. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarFASENRA®, yüksek doz inhale kortikosteroidleri ve ek olarak bir veya daha fazla kontrol ajanı kullanan ( örneğin LABA vb.), önceki yıl içerisinde en az iki alevlenme öyküsü olan ( en az 3gün sistemik kortikosteroid tedavisi gereken) ve kandaki eozinofil sayımı >300 hücre/gl olanşiddetli eozinofilik astımı olan yetişkin hastalarda ek idame tedavisi olarak endikedir (bkz.Bölüm 5.1). 4.2. Pozoloji ve uygulama şekliFASENRA® ağır astımın tanısı ve tedavisinde deneyimli doktorlar tarafından reçete edilmelidir. Pozoloji/uygulama sıklığı ve süresi:Önerilen FASENRA® dozu, ilk 3 doz için 4 haftada bir ve ondan sonra 8 haftada bir subkütan enjeksiyon yoluyla 30 mg'dır. Planlanmış tarihte bir enjeksiyon kaçırılırsa, doz uygulamasıbelirtilmiş rejimde mümkün olan en kısa sürede yeniden başlatılmalıdır; çift dozuygulanmamalıdır. FASENRA® uzun süreli tedaviye yöneliktir. Hastalık şiddetine, alevlenme kontrol düzeyine ve kan eozinofil sayımlarına dayalı olarak en az yılda bir kez tedaviye devam etme kararıdeğerlendirilmelidir. Sayfa 1 / 18Uygulama şekli:FASENRA®, bir sağlık mesleği mensubu tarafından subkütan enjeksiyon yoluyla uygulanır. Üst kol, uyluk ya da karına enjekte edilmelidir. Derinin hassas, morarmış, eritemli ya da sertleşmiş alanlarına enjekte edilmemelidir (bkz. Bölüm 6.6). Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalar için doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalar için doz ayarlaması gerekli değildir (bkz. Bölüm 5.2).Pediyatrik popülasyon:FASENRA®'nın güvenlilik ve etkililiği, 6 ila 18 yaşları arasındaki ergenlerde ve çocuklarda belirlenmemiştir. 6 ila 11 yaşlarındaki çocuklar için mevcut veri bulunmamaktadır. 12 ila 18 yaşından küçük ergenlerde elde edilmiş mevcut veriler, Bölüm 4.8, 5.1 ve 5.2'de verilmektedir; fakat pozolojiile ilgili olarak bir öneride bulunulamamaktadır. Geriyatrik popülasyon:Yaşlı hastalar için doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). 4.3. KontrendikasyonlarFASENRA®, benralizumaba veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriFASENRA® akut astım semptomları veya alevlenmelerinin tedavisi için kullanılmamalıdır. FASENRA'yı akut bronkospazmı veya status astımatikus tedavi etmek için kullanmayın. Hastalara, tedaviye başlandıktan sonra astımları kontrol altına alınmaz ya da kötüleşirse tıbbi yardım almaları söylenmelidir. FASENRA® tedavisinin başlatılmasından sonra kortikosteroidlerin hızlı bir şekilde bırakılması önerilmemektedir. Uygun olduğu durumlarda kortikosteroid dozlarındaki azaltma aşamalıolmalı ve bir hekimin gözetiminde gerçekleştirilmelidir. Aşırı duyarlılık reaksiyonlarıBenralizumab uygulamasının ardından anaflaktik reaksiyonlar ve aşırı duyarlılık reaksiyonlarını (örn. Ürtiker, papüler ürtiker, döküntü) içeren akut sistemik reaksiyonlar ortayaçıkmıştır (bkz. bölüm 4.8). Bu reaksiyonlar uygulamadan sonra birkaç saat içinde ortayaçıkabilir, ancak bazı durumlarda başlaması daha uzun sürebilir (örn. günler). Benralizumab ile ilişkili olmayan bir anaflaksi öyküsü, Fasenra uygulamasının ardından anaflaksi için bir risk faktörü olabilir (bkz. bölüm 4.3). Klinik uygulamaya paralel olarak,hastalar Fasenra uygulamasaından sonra uygun bir süre takip edilmelidir. Sayfa 2 / 18Aşrı duyarlılık reaksiyonu olması durumunda, Fasenra kalıcı olarak bırakılmalı ve uygun tedaviye başlanmalıdır. Parazitik (Helmint) EnfeksiyonuEozinofiller, bazı helmint enfeksiyonlarına verilen immünolojik yanıtta görev alabilir. Helmint enfeksiyonları olduğu bilinen hastalar klinik çalışmalardan çıkarılmışlardır. FASENRA®'nınbir hastanın helmint enfeksiyonlarına vereceği yanıtı etkileyip etkilemediği bilinmemektedir. Daha önceden var olan helmint enfeksiyonları bulunan hastalar, FASENRA® tedavisine başlamadan önce tedavi edilmelidir. Hastalar, FASENRA® tedavisi alırken enfekte hale gelirseve anti-helmint tedavisine yanıt vermezse, enfeksiyon geçene kadar FASENRA® tedavisibırakılmalıdır. Biyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriYaşları 12 ve 21 arasında olan ciddi astımlı 103 hastada yapılan bir randomize, çift-kör paralel-grup çalışmasında, mevsimsel influenza virüsü aşılaması ile uyarılan humoral antikor yanıtı, benralizumab tedavisinden etkileniyor gibi görünmemektedir. Benralizumabın, eşzamanlıuygulanan tıbbi ürünlerin farmakokinetiği üzerinde bir etki yapması beklenmemektedir (bkz.Bölüm 5.2). Benralizumabın klerensinde; sitokrom P450 enzimleri, eflüks pompaları ve protein bağlama mekanizmaları rol almamaktadır. Hepatositler üzerinde IL-5Ra ekspresyonuna dair kanıtbulunmamaktadır. Eozinofil deplesyonu, proenflamatuar sitokinlerin kronik sistemikdeğişimlerine neden olmamaktadır. Özel popülasyonlara ilişkin ek bilgilerHerhangi bir ilaç etkileşimi çalışması yapılmamıştır. Pediyatrik popülasyonYukarıda referans verilen influenza aşılama çalışması dışında, herhangi bir ilaç etkileşimi çalışması yapılmamıştır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: B Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)FASENRA®'nın gebe kadınlarda kullanımına ilişkin veri bulunmadığından çocuk doğurma potansiyeli bulunan kadınlar için doğum kontrol yöntemi kullanımı önerilmektedir. Gebelik dönemiFASENRA® için, gebeliklerde maruz kalmaya ilişkin klinik yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik / embriyonal / fetal gelisim / doğum ya dadoğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunugöstermemektedir (bkz. Bölüm 5.3). Gebe kadınlara verilirken tedbirli olunmalıdır. Sayfa 3 / 18Benralizumab gibi monoklonal antikorlar, gebelik ilerledikçe plasentadan doğrusal bir şekilde geçmektedir dolayısıyla fetüse maruziyet gebeliğin ikinci ve üçüncü trimesterinde büyükolasılıkla daha yüksek olacaktır. Gebelik sırasında FASENRA® kullanımından kaçınılması tercih edilmelidir. Gebe kadınlara uygulama yalnızca, anne için beklenen faydanın fetüsün maruz kalacağı olası risklerden dahayüksek olması durumunda düşünülmelidir. Laktasyon dönemiBenraluzimabın veya metabolitlerinin insan veya hayvan sütüyle atılıp atılmadığı bilinmemektedir. Bununla birlikte benralizumab, bir humanize monoklonal antikordur (IgG1/K-sınıfı) ve insan sütünde küçük miktarlarda immünoglobülin G (IgG) bulunur. Eğerbenralizumab insan sütüne geçerse, bebekte benralizumabın gastrointestinal sistemdeki lokalmaruziyetinin ve potansiyel sınırlı sistemik maruziyetin etkileri bilinmemektedir. Bu nedenle,memedeki çocuk açısından bir risk olduğu göz ardı edilemez. Çocuk açısından emzirmenin faydası ve kadın açısından tedavinin faydası göz önüne alınarak emzirmeyi bırakma ya da FASENRA® kullanmayı bırakma/kullanmaktan kaçınma kararıverilmelidir. Üreme yeteneği/Fertiliteİnsanlarda fertilite verisi bulunmamaktadır. Hayvan çalışmalarında benralizumab tedavisinin fertilite üzerinde advers etkileri gözlenmemiştir (bkz. Bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkilerFASENRA®'nın araç ve makine kullanımı üzerinde etkisi bulunmamakta ya da etkisi ihmal edilebilecek kadar azdır. 4.8. İstenmeyen etkilerGüvenlilik profilinin özetiTedavi sırasında en yaygın şekilde bildirilen advers reaksiyonlar baş ağrısı (%8) ve farenjittir (%3). Anaflaktik reaksiyonlar bildirilmiştir. Advers reaksiyonların tablolaştırılmış özeti1663'ü şiddetli kontrol edilemeyen eozinofilik astım hastası olmak üzere, toplam 2514 hasta 48 ila 56 haftalık süreli klinik çalışmalar sırasında FASENRA® almıştır. Advers reaksiyonların sıklığı şu şekilde tanımlanmaktadır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek(<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Sayfa 4 / 18
>10%: İmmünolojik: Antikor gelişimi (13%; nötrleştirme: 12%)Seçilmiş advers reaksiyon ile ilgili açıklamaEnjeksiyon yeri reaksiyonlarıPlasebo kontrollü çalışmalarda enjeksiyon yeri reaksiyonlarının oranı (örn., ağrı, eritem, prurit, papül), plasebo ile tedavi edilmiş hastalarda %1,9'ken önerilen benralizumab dozu ile tedaviedilmiş hastalarda %2,2 olmuştur. Uzun-vadeli güvenlilikÇalışma 1, 2 ve 3'deki astımlı hastaların yer aldığı 56 haftalık bir uzatma çalışmasında, 842 hasta önerilen dozda Fasenra ile tedavi edilmiş ve çalışmada kalmışlardır. Genel advers olayprofili yukarıda tanımlanan astım çalışmalarına benzer olmuştur. Pediyatrik popülasyonPediyatrik hastalarla ilgili veriler sınırlıdır (bkz. Bölüm 5.1). Ergen popülasyonda advers reaksiyonların sıklığı, tipi ve şiddeti, yetişkinlerde gözlenenlere benzerdir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir ([email protected];4.9. Doz aşımı ve tedavisi200 mg'a kadar olan dozlar, dozla ilişkili toksisite kanıtı olmaksızın eozinofilik astımı olan hastalara klinik çalışmalarda subkütan yoldan uygulanmıştır. Benralizumab ile doz aşımı için spesifik bir tedavi bulunmamaktadır. Eğer doz aşımı meydana gelirse, hasta gerektiği gibi uygun izlemle birlikte destekleyici şekilde tedavi edilmelidir. Sayfa 5 / 185. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Obstrüktif solunum yolu hastalıklarında kullanılan diğer sistemik ilaçlar ATC kodu: R03DX10 Etki mekanizması: Benralizumab, bir anti-eozinofil, hümanize afukozile monoklonal antikordur (IgG1, kappa). İnsan interlökin-5 reseptörünün (IL-5Ra) alfa alt birimine yüksek afinite ve özgünlüktebağlanır. IL-5 reseptörü, özellikle eozinofillerin ve bazofillerin yüzeyinde spesifik olarakeksprese edilir. Benralizumabın Fc bölgesinde fukozun olmaması, doğal öldürücü (NK)hücreler gibi bağışıklık efektör hücreleri üzerindeki FcyRIII reseptörlerine yüksek afinitegöstermesi ile sonuçlanır. Bu da, eozinofilik inflamasyonu azaltan, antikor bağımlı hücre aracılısitotoksisite (ABHS) yoluyla eozinofil ve bazofillerin apoptozuna yol açar. Enflamasyon astım patogenezinin önemli bir bileşenidir. Çok sayıda hücre tipi (örn. mast hücreleri, eozinofiller, nötrofiller, makrofajlar, lenfositler) ve aracılar (örn. histamin,eikosanoidler, lökotrienler, sitokinler) enflamasyona katılırlar. Benralizumab, IL-5Ra zincirinebağlanarak, eozinofilleri ADCC (antikor bağımlı hücresel sitotoksisite) aracılığıyla azaltır;bununla birlikte, benralizumabın astımdaki etki mekanizması tam olarak ortaya konmamıştır. Farmakodinamik etkiler: Kan eozinofilleri üzerindeki etkisiBenralizumab ile tedavi, ilk dozu takiben 24 saat içinde meydana gelen ve tedavi boyunca sürdürülen hemen hemen tam bir kan eozinofili deplesyonu ile sonuçlanır. Kan eozinofillerinindeplesyonu; serum eozinofil granül proteinleri, eozinofil kökenli nörotoksin (EKN) ve eozinofilkatyonik proteinde (EHP) ve kandaki bazofil düzeylerinde bir azalma ile birlikte görülür. Solunum yolu mukozasında eozinofiller üzerindeki etkisiBenralizumabın, yüksek balgam eozinofil sayımları olan (en az %2,5) astımlı hastaların solunum yolu mukozasındaki eozinofiller üzerindeki etkisi, 100 ya da 200 mg benralizumabınsubkütan olarak uygulandığı 12 haftalık, faz 1, randomize, çift kör, plasebo kontrollü bir klinikçalışmada değerlendirilmiştir. Bu çalışmada solunum yolu mukozası eozinofillerindebaşlangıca göre medyan azalma plasebo grubundaki % 47'lik düşüşe kıyasla benralizumab iletedavi edilmiş grupta %96 olmuştur (p=0,039). Klinik etkililik: FASENRA®'nın etkililiği, 12 ila 75 yaşları arasındaki hastalarda 28 ila 56 hafta süreyle gerçekleştirilen 3 randomize, çift kör, paralel gruplu, plasebo kontrollü klinik çalışmadadeğerlendirilmiştir. Bu çalışmalarda FASENRA®, arka plan tedaviye ek olarak ilk 3 doz için 4 haftada bir kere ve daha sonra 4 ya da 8 haftada bir kere 30 mg dozda uygulanmış ve plasebo ile karşılaştırılarakdeğerlendirilmiştir. İki alevlenme çalışması olan SIROCCO (Çalışma 1) ve CALIMA'ya (Çalışma 2) %64'ü kadın ve yaş ortalaması 49 olan şiddetli kontrol altına alınamayan astımlı toplam 2510 hastakaydedilmiştir. Hastaların son 12 ayda oral veya sistemik kortikosteroid tedavisi gerektiren 2 Sayfa 6 / 18ya da daha fazla astım alevlenmesi öyküsü vardır (ortalama 3), hastaların taramada Astım Kontrol Anketi-6 (ACQ-6) skoru 1,5 ya da daha yüksektir ve yüksek doz inhale kortikosteroid(İKS) (Çalışma 1) ile ya da orta veya yüksek doz İKS (Çalışma 2) ve uzun etkili bir P-agonisterağmen (UEBA) başlangıçta akciğer fonksiyonu düşüktür (ortalama öngörülen 1 saniye içindepre-bronkodilatör zorlu ekspiratuar hacim [FEV 1] %57,5) ve bu hastalara sırasıyla %51 ve%41'ine en az bir ilave kontrol ilacı uygulanmıştır.Oral kortikosteroid (OKS) azaltma çalışması ZONDA (Çalışma 3) için toplam 220 astım hastası (%61 kadın; ortalama yaş 51) kaydedilmiştir; bu hastalar normalyüksek doz İKS ve UEBAkullanımına ek olarak günlük OKS (gün başına 8 ila 40 mg; medyan 10 mg) ile tedaviedilmişlerdir ve vakaların %53'ünde astım kontrolünün sürdürülmesi için en az bir ilave kontrolilacı gerekli olmuştur. Çalışma, astım kontrolü kaybedilmeden OKS'nin minimum etkili dozatitre edildiği 8 haftalık bir alıştırma dönemini içermiştir. Hastaların kan eozinofil sayımları>150 hücre/^L'dir ve son 12 ayda en az bir alevlenme öyküsü vardır. Çalışma 1, 2 ve 3'te 2 doz rejimi incelenirken, daha sık doz uygulaması ile ilave fayda gözlenmemiş olduğundan, önerilen doz uygulaması rejimi, ilk 3 doz için 4 haftada bir ve dahasonra 8 haftada bir FASENRA®'dır (bkz. Bölüm 4.2). Aşağıda özetlenen bulgular önerilen dozrejimi için elde edilmiştir. Alevlenme çalışmalarıBirincil sonlanım noktası, yüksek doz İKS ve UEBA alan, başlangıç kan eozinofil sayımları >300 hücre/^L olan hastalarda klinik açıdan anlamlı astım alevlenmelerinin yıllık oranıdır. Klinik açıdan anlamlı astım alevlenmesi, en az 3 gün boyunca oral/sistemik oral kortikosteroid kullanımı gerektiren astım kötüleşmesi ve/veya oral/sistemik kortikosteroid gerektiren acilservis viziti ve/veya hastaneye yatış olarak tanımlanmıştır. İdame oral kortikosteroidler alanhastalar için bu, en az 3 gün boyunca stabil oral/sistemik kortikosteroidlerde geçici bir artış yada tek bir depo-enjektabl kortikosteroid dozu olarak tanımlanmıştır. Her iki çalışmada, kan eozinofilleri >300 hücre/^L olan FASENRA® alan hastalar, plasebo hastaları karşılaştırıldığında yıllık alevlenme oranlarında anlamlı azalmalar yaşamıştır. Buna ekolarak, çalışma sonuna kadar korunan ortalama FEWde başlangıca göre değişim 4. hafta gibikısa bir sürede yarar göstermiştir ( Tablo 2).Başlangıç eozinofil sayımından bağımsız olarak alevlenme oranlarında azalmalar gözlenmiştir; diğer yandan, başlangıç eozinofil sayımlarının yükselmesi, özellikle FEV 1için tedaviyanıtındaki iyileşme açısından potansiyel bir öngörücü olarak belirlenmiştir.Sayfa 7 / 18Tablo 2: Eozinofil sayımlarına göre Çalışma 1 ve 2 tedavisinin sonunda yıllık alevlenme oranı ve akciğer fonksiyonu bulguları
Birlikte değerlendirildiğinde Çalışma 1 ve 2'de, başlangıç kan eozinofillerindeki artışla paralel olarak sayısal olarak daha yüksek bir alevlenme sıklığı azalması ve FEVl'de daha fazlaiyileşmeler gözlenmiştir. Çalışma 1 için plasebo ile karşılaştırıldığında FASENRA® alan hastalarda hastaneye yatış ve/veya acil servis vizitleri gerektiren alevlenme oranı 0,25'e karşı 0,09 (sıklık oranı 0,37,%95 GA: 0,20, 0,67, p= <0,001) ve Çalışma 2 için 0,10'a karşı 0,12'dir (sıklık oranı 1,23,%95 GA: 0,64, 2,35, p= 0,538). Çalışma 2'de plasebo tedavi kolunda hastaneye yatış ya da acilservis vizitleri gerektiren alevlenmeler için sonuca varılmasına izin verecek kadar olaymeydana gelmemiştir. Hem Çalışma 1 hem de Çalışma 2'de FASENRA® alan hastalar, plasebo alan hastalarla karşılaştırıldığında astım semptomlarında (Toplam Astım Skoru) istatistiksel olarak anlamlıazalmalar yaşamışlardır. Astım Kontrol Anketi-6 (ACQ-6) ve 12 Yaş ve Üzeri StandardizeAstım Yaşam Kalitesi Anketi (AQLQ(S)+12) için Fasenra lehine benzer iyileşmelergözlenmiştir ( Tablo 3).Sayfa 8 / 18Tablo 3: Tedavi sonunda toplam astım semptom skorunda, ACQ-6'da ve AQLQ(s)+12'de başlangıca göre ortalama değişimdeki tedavi farklılığı - Yüksek doz İKS alan ve kaneozinofil değerleri >300 hücre/^L olan hastalar
Daha önceki alevlenme öyküsüne göre alt grup analizleri Çalışma 1 ve 2'de yapılan alt grup analizleri, daha iyi tedavi yanıtının potansiyel bir öngörücü olarak, daha önce daha yüksek alevlenme öyküsü olan hastaları belirlemiştir. Tek başına ya dabaşlangıç kan eozinofil sayımları ile kombinasyon halinde düşünüldüğünde, bu faktörlerbenralizumab tedavisinde daha yüksek yanıta ulaşabilecek hastaların daha iyi belirlenmesinisağlayabilir ( Tablo 4).Sayfa 9 / 18Tablo 4: Bir önceki yıldaki alevlenmelerin sayısına göre tedavi sonunda alevlenme oranı ve pulmoner fonksiyon (FEVı) - Yüksek doz İKS alan ve kan eozinofil değerleri>300 hücre/pL olan hastalar
Oral kortikosteroid doz azaltma çalışmasıÇalışma 3, idame amaçlı oral kortikosteroidlerin azaltılması üzerinde FASENRA®'nın etkisini değerlendirmiştir. Birincil sonlanım noktası, astım kontrolü sürdürülürken 24. ila 28. haftalararasında nihai OKS dozunda başlangıca göre yüzde azalmadır. Tablo 5'te Çalışma 3 içinçalışma bulguları özetlenmektedir.Sayfa 10 / 18
Akciğer fonksiyonu, astım semptom skoru, ACQ-6 ve AQLQ(S)+12 de Çalışma 3'te değerlendirilmiş ve Çalışma 1 ve 2'dekine benzer sonuçlar elde edilmiştir. Uzun vadeli uzatma çalışmasıFasenra'nın uzun vadeli etkililik ve güvenliliği 56-haftalık bir faz 3 uzatma çalışması olan BORA'da (çalışma 4) değerlendirilmiştir. Çalışma, 2037 erişkin ve 86 adolesan hasta (12 yaşve üzeri) olmak üzere Çalışma 1, 2 ve 3'den 2123 hastayı kaydetmiştir. Çalışma 4, Fasenra'nınyıllık alevlenme oranı, akciğer fonksiyonu, ACQ-6, AQLQ(S)+12 üzerindeki uzun vadelietkilerini ve önceki çalışmalarda incelenen 2 doz rejimindeki OKS azalmasının devamlılığınıdeğerlendirmiştir. Önerilen doz rejiminde, daha önceki plasebo-kontrollü Çalışma 1 ve 2'de gözlemlenen yıllık alevlenme oranı azalması (başlangıçta kan eozinofili sayısı >300 hücre/pL olan ve yüksekdozda İKS alan hastalarda) tedavinin ikinci yılında da devam etmiştir (Tablo 6). Uzatmaçalışması Çalışma 4'de, daha önceki Çalışma 1 ve 2'de Fasenra almış olan hastaların %73'ündealevlenme olmamıştır. Sayfa 11 / 18Tablo 6. Uzatılmış bir tedavi tedavi periyodunda alevlenmeler1
b Çalışma 1 ve 2'deki plasebo hastaları önceki çalışmanın sonuna kadar dahil olmuşlardır (Çalışma 1'de 48.hafta, Çalışma 2'de 56. hafta). c Toplam tedavi süresi: 104 - 112 haftaÇalışma 4 boyunca, akciğer fonksiyonu, ACQ-6 ve AQLQ(S)+12 açılarından benzer idame etkisi gözlenmiştir (Tablo 7). Tablo 7. Akciğer fonksiyonu, ACQ-6 ve AQLQ(S)+12 açılarından başlangıca göre değişim
n= zaman noktasında verileri bulunan hasta sayısı. SS = standart sapmaa. Başlangıç kan eozinofil sayısı >300 hücre/gL olan ve yüksek doz İKS alanlar: Fasenra önerilen doz rejimindeuygulanmıştır.b. Çalışma 1 ve 2 başlangıç birleşik analizi erişkinler ve adolesanları içermektedir.c. Çalışma 1 (48. hafta) ve Çalışma 2'de (56. hafta) bileşik Tedavi Sonu (EOT) analizi.d. Çalışma 4 için EOT 48. hafta olmuştur (erişkin ve adolesan verileri için son zaman noktası).e. Çalışma 1 ve 2'de başlangıç Fasenra tedavisi öncesidir.Başlangıçta kan eozinofili sayısı >300 hücre/gL olan hastalarda etkililik Çalışma 4'de de değerlendirilmiş ve Çalışma 1 ve 2 ile uyumlu olmuştur. Sayfa 12 / 18Çalışma 3'den gelen hastalarda günlük İKS dozundaki azalmanın uzatma çalışmasında da devam ettiği gözlenmiştir (Şekil 1).
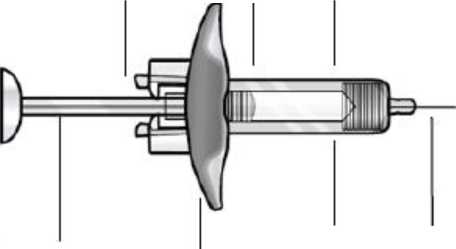
Hafta(lar)Çalışma 4'de Fasenra tedavisine devam eden önceki Çalışma 3 hastaları. 56 haftalık uzatma periyodunu tamamlamadan, Çalışma 4'de en az 8 hafta sonra hastaların ikinci bir uzatmaçalışmasına girmelerine izin verilmiştir. İmmünojenisiteFaz III plasebo kontrollü alevlenme çalışmalarının 48 ila 56 haftalık tedavi dönemi boyunca önerilen doz rejiminde FASENRA® ile tedavi edilmiş toplam 809 hastanın 107'sinde (%13)tedaviyle ortaya çıkan anti-ilaç antikor yanıtı gelişmiştir. Antikorların büyük kısmı nötralizanve persistandır. Anti-benralizumab antikorları, antikor negatif hastalarla karşılaştırıldığındayüksek anti-ilaç antikor titrelerine sahip hastalarda artmış benralizumab klerensi ve artmış kaneozinofil düzeyleri ile ilişkilidir; nadir durumlarda kan eozinofil düzeyleri tedavi öncesidüzeylere geri dönmüştür. Güncel hasta takibine dayalı olarak, etkililik ya da güvenlilikle anti-ilaç antikorları arasında bir ilişki olduğuna dair kanıt gözlenmemiştir. Faz 3 plasebo-kontrollü çalışmalardan gelen bu hastalarda ikinci bir tedavi yılının ardından ilave olarak 510'undan 18'inde (%4) yeni gelişen tedaviyle ortaya çıkan antikorlarbulunmuştur. Toplamda, daha önceki çalışmalarda anti-ilaç antikoru pozitif olan hastalarda,ikinci tedavi yılında titreler stabil kalmış ya da azalmıştır. Anti-ilaç antikorlarıyla etkililik vegüvenlilik arasında bir ilişki kanıtı gözlenmemiştir. Pediyatrik popülasyonFaz 3 çalışmalara kaydedilmiş astımlı 108 ergen bulunmaktadır (Çalışma 1: n = 53; Çalışma 2: n = 55). Bunların içinde 46 tanesi plasebo ve 40 tanesi FASENRA® almıştır (3 doz için 4 haftadabir ve bunu takiben 8 haftada bir); 22 tanesi ise 4 haftada bir FASENRA® almıştır. Buçalışmalarda önerilen doz uygulaması rejiminde FASENRA® ile tedavi edilmiş ergen Sayfa 13 / 18hastalarda astım alevlenme oranı 0,70 (n=40; %95 GA: 0,42, 1,18); plasebo için 0,41 (n=46, %95 GA: 0,23, 0,73 [oran oranı 1,70, %95 GA: 0,78, 3,69])'dir. Çalışma 1 ve 2'den 12 ila 17 yaşındaki adolesan hastalar (n=86) Çalışma 4'de 108 haftaya kadar Fasenra ile tedaviye devam etmiştir. Etkililik ve güvenlilik önceki çalışmalarla uyumluolmuştur. Pediyatrik popülasyonda astım etkililiği ile ilgili bir sonuç çıkarılmamaktadır. 5.2. Farmakokinetik özelliklerAstımlı hastalarda benralizumabın farmakokinetiği, 2 ila 200 mg'lık bir doz aralığında subkutan uygulamanın ardından dozla orantılı olmuştur. Emilim:Astımlı hastalara subkütan uygulamayı takiben emilim yarı ömrü 3,5 gündür. Popülasyon farmakokinetiği analizine dayalı olarak, tahmini mutlak biyoyararlanım yaklaşık %59'dur veabdomene, uyluğa ya da üst kola uygulamada bağıl biyoyararlanım açısından klinik olarakanlamlı farklılık gözlenmemiştir. Dağılım:Popülasyon farmakokinetiği analizine dayalı olarak, benralizumabın merkezi ve periferik dağılım hacmi, 70 kg'lık bir kişi için sırasıyla 3,1 L ve 2,5 L'dir. Biyotransformasyon:Benralizumab, vücuda yaygın şekilde dağılmış ve karaciğer dokusu ile sınırlı olmayan proteolitik enzimlerle parçalanan bir hümanize IgG1 monoklonal antikordur. Eliminasyon:Popülasyon farmakokinetiği analizine dayalı olarak benralizumab doğrusal farmakokinetik sergilemektedir ve hedef reseptör aracılı klerens yolağı kanıtı bulunmamaktadır. Benralizumabiçin tahmini sistemik klerens (KL) 0,29 L/d'dir. Subkütan uygulamayı takiben eliminasyon yarıömrü yaklaşık 15,5 gündür. Doğrusallık/Doğrusal Olmayan Durum:Benralizumabın farmakokinetiği, 2 ila 200 mg doz aralığında subkütan uygulamayı takiben astımı olan hastalarda dozla orantılıdır. Hastalardaki karakteristik özelliklerYaşlılar (>65 yaş):Popülasyon farmakokinetiği analizine dayalı olarak, yaşın benralizumab klerensini etkilemediği belirlenmiştir. Bununla birlikte, 75 yaş üzerindeki hastalar için veri mevcutdeğildir. Pediyatrik popülasyon:Popülasyon farmakokinetiği analizine dayalı olarak 12 ila 17 yaşları arasındaki ergenlerde benralizumab farmakokinetiği, yetişkinlerde elde edilenlerle tutarlıdır. Benralizumabçocuklarda (5 ila 11 yaş) incelenmemiştir (bkz. Bölüm 4.2). Sayfa 14 / 18Cinsiyet, ırk:Popülasyon farmakokinetiği analizi, cinsiyet ve ırkın benralizumab klerensi üzerinde anlamlı bir etkisi olmadığını göstermiştir. Böbrek yetmezliği:Böbrek yetmezliğinin benralizumab üzerindeki etkisinin araştırılması için herhangi bir formel klinik çalışma yürütülmemiştir. Popülasyon farmakokinetiği analizine dayalı olarak,benralizumab klerensi, kreatinin klerensi değerleri 30 ila 80 ml/dak arasında olan kişilerde venormal böbrek fonksiyonuna sahip kişilerde benzerdir. Kreatinin klerensi değerleri30 ml/dak'nın altında olan kişilerde mevcut veriler sınırlıdır, bununla birlikte benralizumabınklerensi böbrekler aracılığıyla gerçekleşmemektedir. Karaciğer yetmezliği:Karaciğer yetmezliğinin benralizumab üzerindeki etkisinin araştırılması için herhangi bir formel klinik çalışma yürütülmemiştir. IgG monoklonal antikorların klerensi öncelikli olarakkaraciğer aracılığı ile değildir; bu nedenle karaciğer fonksiyonundaki değişimin benralizumabklerensini etkilemesi beklenmez. Popülasyon farmakokinetiği analizine dayalı olarak, başlangıçkaraciğer fonksiyonu biyobelirteçlerinin (ALT, AST ve bilirubin) benralizumab klerensiüzerinde klinik açıdan anlamlı bir etki yapmadığı belirlenmiştir. İlaç-ilaç etkileşimleri:Benralizumabın eşzamanlı uygulanan tıbbi ürünlerin farmakokinetiği üzerinde bir etki yapması beklenmemektedir. Popülasyon farmakokinetiği analizine dayalı olarak, yaygın olarakuygulanan eşzamanlı tıbbi ürünlerin (montelukast, parasetamol, proton pompası inhibitörleri,makrolidler ve teofilin/aminofilin) astımlı hastalarda benralizumab klerensi üzerinde herhangibir etkisi bulunmamaktadır. 5.3. Klinik öncesi güvenlilik verileriBenralizumabın karsinojenik potansiyelini değerlendirmek için uzun vadeli hayvan çalışmaları yapılmamıştır. Hayvan modellerin kullanıldığı yayınlanmış literatür, IL-5 ve eozinofillerintümorogenezis bölgesinde bir erken enflamatuar reaksiyonda yer aldıklarını ve tümör reddiniuyarabileceklerini düşündürmektedir. Bununla birlikte, başka raporlar tümörlerin içindeeozinofil infiltrasyonunun tümör büyümesini uyarabileceğini belirtmektedir. Bu nedenle,insanlarda benralizumab gibi IL-5Ra'ya bağlanan bir antikordan kaynaklanan malignite riskibilinmemektedir. Benralizumab bir monoklonal antikor olduğundan, genotoksisite veya karsinojenisite çalışmaları yürütülmemiştir. Hayvan toksikolojisi ve/veya farmakolojisiKlinik dışı veriler, maymunlarda yapılan konvansiyonel güvenlilik farmakolojisi veya tekrarlı doz toksisitesi çalışmalarına dayalı olarak insanlar için özel tehlikelere işaret etmemiştir.Sinomolgus maymunlarına intravenöz ve subkütan uygulama, toksikoloji bulguları olmaksızınperiferik kanda ve kemik iliğinde eozinofil sayımlarında azalma ile ilişkilendirilmiştir. GebelikGebe sinomolgus maymunları üzerinde gerçekleştirilen bir prenatal ve postnatal gelişim çalışmasında, benralizumab ile bağlantılı maternal, embriyo-fetal ya da postnatal etkilergözlenmemiştir. Sayfa 15 / 18FertiliteÖzel hayvan çalışmaları yürütülmemiştir. Erkek ve dişi sinomolgus maymunlarının üreme parametrelerinde benralizumab ile ilişkili azalma gözlenmemiştir. Benralizumab ile tedaviedilmiş hayvanlarda surrogate6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiL-histidin L-histidin hidroklorür monohidrat a,a-Trehaloz dihidratPolisorbat 20 (bitkisel kaynaklı) Enjeksiyonluk su 6.2. GeçimsizliklerGeçimsizlik çalışmaları olmadığından bu tıbbi ürün başka tıbbi ürünler ile karıştırılmamalıdır. 6.3. Raf ömrü36 ay 6.4. Saklamaya yönelik özel tedbirler2°C - 8°C arasında buzdolabında saklayınız. Çalkalamayınız. 6.5. Ambalajın niteliği ve içeriğiPasif bir güvenlik cihazı içinde, bir 29-gauge /-inç paslanmaz çelik iğne ucu, sert iğne muhafazası ve Fluorotec-kaplı piston tıpası ile birlikte Tip I camdan yapılmış tek kullanımlıkkullanıma hazır dolu enjektör içindeki bir ml çözelti. Tek kullanımlık 1 kullanıma hazır doluenjektörlük ambalaj büyüklüğü 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. Fasenra enjeksiyonluk çözelti, bireysel kullanıma yönelik olan steril, tek kullanımlık, kullanıma hazır dolu enjektörler içinde tedarik edilmektedir. Çalkalamayınız. Donmuşsa kullanmayınız. Sayfa 16 / 18Uygulama talimatlarıUygulamadan önce, kartonundan çıkararak FASENRA®'yı oda sıcaklığında ısıtınız. Bu genellikle 30 dakika sürer. 24 saat içinde uygulayın ya da kesici-delici aletler atık kutusunaatınız. İğne Güvenlik Muhafazası olan Kullanıma Hazır Enjektör için TalimatlarUygulama adımlarında kullanılacak kullanıma hazır enjektör bileşenlerini belirlemek için aşağıdaki Şekil 2Şekil 2Son kullanma tarihini İğne başlığı gösteren etiket
Piston İğne güvenlik muhafazasının erken aktivasyonunu engellemek için iğne muhafazası aktivasyon klipslerine dokunmayınız.1enjektör gövdesinden tutunuz.Enjektör üzerindeki son kullanma tarihini kontrol ediniz. Uygulamadan önceFASENRA®'yı partiküllü madde ve renk değişimi açısından kontrol ediniz. FASENRA®berrak ila opalesan, renksiz ila sarı renktedir ve şeffaf ya da beyaz ila beyazımsı partikülleriçerebilir. Sıvı bulanık ya da rengi değişmişse ya da büyük partiküller veya yabancıpartiküller madde içeriyorsa FASENRA®'yı kullanmayınız. Enjektör hava kabarcığıiçerebilir; bu normaldir. Uygulamadan önce hava kabarcığınıdışarı atmayınız. Enjeksiyona hazır hale gelene kadar iğne başlığını çıkarmayınız. Enjektörgövdesini tutun ve tereddüt etmedençekerek iğne başlığını çıkarınız. İğnebaşlığını çıkarırken pistonu ya da pistonbaşını tutmayınız; aksi takdirde pistonoynayabilir. Eğer kullanıma hazırenjektör hasar görürse ya da kontamineolursa (örneğin, iğne başlığı yerine takılıdeğilken düşerse), enjektörü atıp yeni bir kullanıma hazır enjektör kullanınız.Sayfa 17 / 18
7. RUHSAT SAHİBİAstraZeneca İlaç San. ve Tic. Ltd. Şti. Büyükdere Cad. Yapı Kredi Plaza B Blok Kat 3-4 34330 Levent-İstanbul 8. RUHSAT NUMARASI2022/159 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 30.03.2022 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİSayfa 18 / 18 |
İlaç BilgileriFasenra 30 Mg/ml Enjeksiyonluk Çözelti İçeren Kullanıma Hazır EnjektörEtken Maddesi: Benralizumab Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.