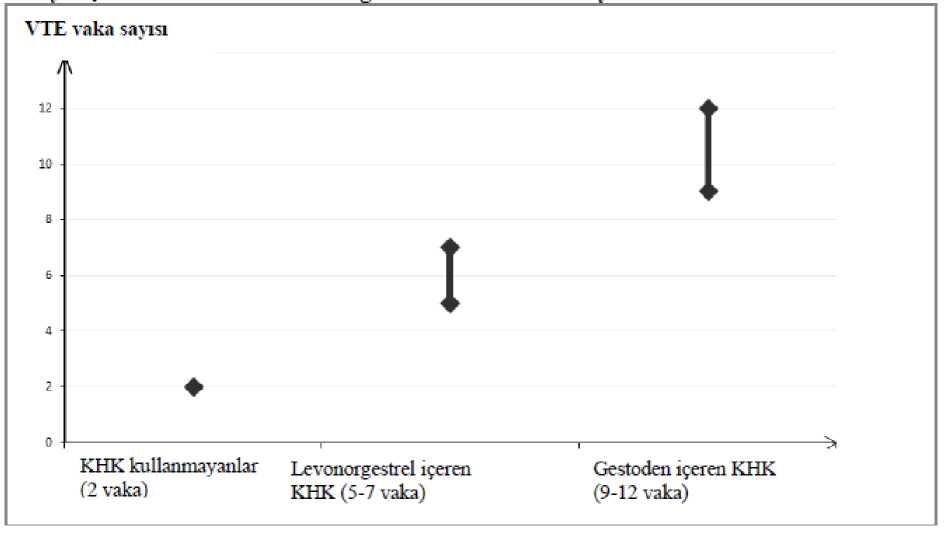
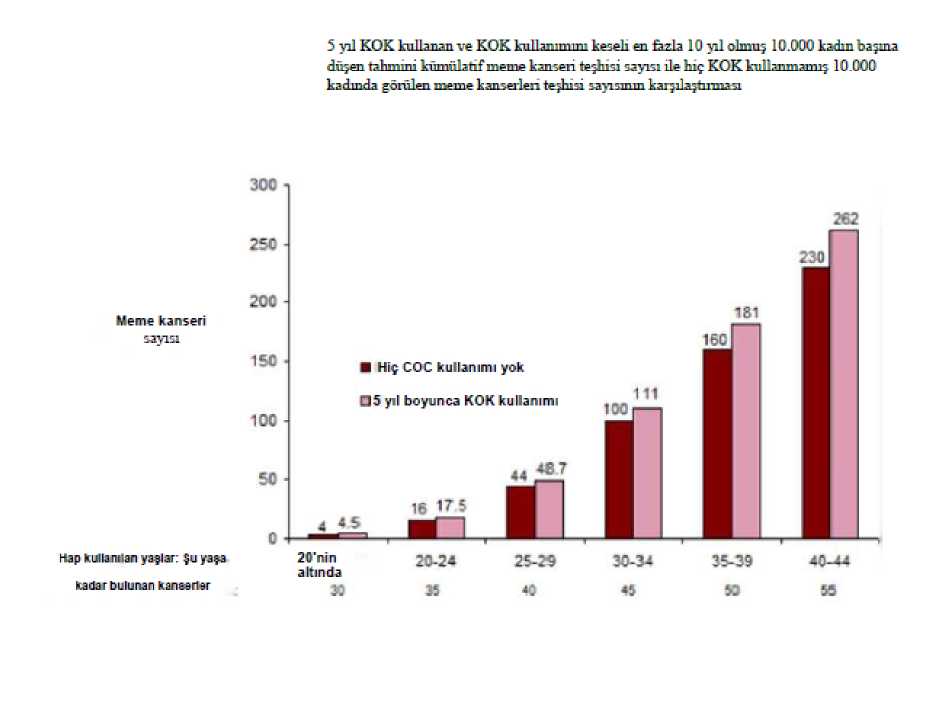
Reginon 20 Mcg/75 Mcg Kaplı Tablet Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIREGİNON 20 mcg/75 mcg kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her kaplı tablet etkin madde olarak 75 mcg gestoden ve 20 mcg etinilestradiol içerir. Yardımcı madde(ler):Her bir kaplı tablet Laktoz monohidrat (sığır kaynaklı) 36,865 mg Şeker19,631 mg içerir. Yardımcı maddeler için 6.1'e bakınız 3. FARMASOTİK FORMKaplı tablet Beyaz renkli, bikonveks, yuvarlak parlak kaplı tablet 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarOral kontrasepsiyon (doğum kontrolü) REGİNON reçete etme kararı, venöz tromboembolizmi (VTE) olan kadınlar başta olmak üzere, her kadının mevcut risk faktörleri ve REGİNON ile ortaya çıkan VTE riskinin diğer kombinehormonal kontraseptifler (KHK) ile karşılaştırması (bkz. bölüm 4.3 ve bölüm 4.4) dikkate alınarakverilmelidir. 1 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Kombine oral kontraseptifler (KOK), doğru şekilde kullanıldıklarında yılda yaklaşık % 1 başarısızlık oranına sahiptir. İlaç unutulduğunda ya da yanlış kullanıldığında başarısızlıkoranı artabilir. Kaplı tabletler, paketin üstünde gösterildiği yönde, her gün yaklaşık aynı zamanda bir miktar suyla alınmalıdır. Birbirini izleyen 21 gün boyunca her gün bir kaplı tablet alınır. Her birsonraki pakete 7 günlük, sıklıkla çekilme kanamasının izlendiği, kaplı tablet alınmayandönemi takiben geçilir. Bu kanama genellikle son kaplı tabletin alınmasını takiben 2.-3. günbaşlar ve bir sonraki pakete başlandığında kesilmemiş olabilir. Uygulama şekli:Oral kullanım içindir. REGİNON'a başlangıç Bir önceki ay hormonal kontraseptif kullanımı yoksa: Kaplı tablet alımına kadının normal siklusunun ilk günü (kanamasının ilk günü) başlanmalıdır. Kaplı tabletlere 2. ile 5. günlerarasında başlanması da kabul edilebilir, ancak bu durumda ilk siklus için kaplı tabletalınmaya başlanmasından itibaren 7 gün boyunca ilave olarak bir bariyer kontrasepsiyonyöntemi kullanılmalıdır. Bir kombine hormonal kontraseptiften geçiş (kombine oral kontraseptif (KOK), vajinal halka, transdermal flaster): Tercihen önceki kombine oral kontraseptifın son aktif kaplı tabletini(hormon içeren son kaplı tablet) izleyen gün REGİNON alımına başlanmalıdır. En geç isekaplı tabletsiz dönemi ya da hormon içermeyen kaplı tablet döneminin ertesi günündebaşlanabilir. Vajinal halka ya da transdermal flaster kullanılması durumunda, kullanıcı döngüpaketindeki son halkanın ya da flasterin çıkarıldığı gün ya da en geç bir sonraki uygulamanınyapılması gereken gün REGİNON'a başlamalıdır. Yalnız progestagen içeren bir yöntemden (minipil, enjeksiyon, implant) ya da progesteron salımlı rahim içi sistemden (RİS) geçiş: Minipilden herhangi bir günde, (implant veya RİS'inçıkarıldığı gün, enjeksiyonda ise bir sonraki enjeksiyonun yapılması gereken gün) geçiş 2 yapılabilir. Ancak tüm bu koşullarda kaplı tablet alımının ilk 7 günü ek bir bariyer yöntemi kullanılması önerilir. İlk trimestr düşüğünü takiben: Hemen başlanabilir. Ek kontraseptif önlemler alınmasına ihtiyaç duyulmaz. Doğumu veya ikinci trimestr düşüğünü takiben: Emziren kadınlar için bkz. 4.6 Gebelik ve laktasyon. Emzirmeyen kadınların doğumu veya ikinci trimestr düşüğünü takiben: 21.-28. günlerde başlanması önerilir. Daha sonra başlandığı takdirde kaplı tablet alımının ilk 7 günü ek birbariyer yöntemi kullanılmalıdır. Eğer o zamana kadar ilişki gerçekleştiyse, kombine oralkontraseptif kullanımı başlamadan önce gebelik ekarte edilmeli veya ilk menstruel kanamabeklenmelidir. Kaplı tablet alımı unutulduğunda: Eğer kullanıcı kaplı tabletini almakta, 12 saatten daha az geç kalmışsa kontraseptif koruyuculuk azalmaz. Hatırlanır hatırlanmaz kaplı tablet alınmalıve sonraki kaplı tabletler de her zamanki gibi alınmaya devam edilmelidir. Eğer 12 saatten daha fazla gecikme olmuşsa kontraseptif koruyuculuk azalmış olabilir. Bu durumda 2 temel kural uygulanır: 1. Kaplı tablet alımına hiç bir zaman 7 günden fazla ara verilmez. 2. Hipotalamus-hipofız-over aksının uygun şekilde baskılanması için 7 gün boyunca aralıkvermeden kaplı tablet alınması gereklidir. Buna bağlı olarak günlük uygulamada şu öneriler verilebilir: 1. Hafta: Aynı zamanda iki kaplı tablet almak anlamına gelse de, kullanıcı unuttuğu kaplıtableti hatırlar hatırlamaz içmelidir. Kalan kaplı tabletlerini normal zamanında kullanmayadevam edebilir. Takip eden 7 gün boyunca kondom gibi ek bir bariyer yöntemi kullanmalıdır.Kaplı tablet alımının unutulduğu günden önceki 7 gün içinde cinsel birleşme olmuşsa gebelikolasılığı göz önüne alınmalıdır. Ne kadar çok kaplı tablet unutulursa ve bu kaplı tabletlerinunutulduğu gün kaplı tabletsiz döneme ne kadar yakınsa gebelik riski o kadar yüksektir. 2. Hafta: Aynı zamanda iki kaplı tablet almak anlamına gelse de, kullanıcı son unuttuğukaplı tableti hatırlar hatırlamaz içmelidir. Kalan kaplı tabletlerini normal zamanındakullanmaya devam edebilir. Eğer ilk unutulan kaplı tablete kadar 7 gün boyunca kaplı 3 tabletler doğru olarak alınmışsa ek korunma yöntemi kullanmaya gerek yoktur. Aksi takdirde ya da kadın birden fazla kaplı tablet unutmuşsa sonraki 7 gün boyunca ek önlemleralınmalıdır. 3. Hafta: Kaplı tabletsiz dönemin yaklaşıyor olması nedeni ile güvenilirlikte azalma riskiyüksektir. Yine de, kaplı tablet alımında ayarlamalar yapılarak kontraseptif korumada azalmaönlenebilir. Eğer unutulan kaplı tabletten önceki 7 gün boyunca kaplı tabletler doğru olarakalındıysa, aşağıdaki iki seçenekten birinin uygulamasıyla ek bir kontraseptif yönteme gerekkalmaz. Aksi takdirde bu seçeneklerden ilki seçilip, ayrıca 7 gün boyunca ek önlemler almak gerekir. 1. Aynı zamanda iki kaplı tablet almak anlamına gelse de kullanıcı son unuttuğu kaplı tabletihatırlar hatırlamaz içmelidir. Kalan kaplı tabletlerini normal zamanda kullanmaya devamedebilir. Bir sonraki kutuya 7 gün ara vermeden mevcut kutu biter bitmez başlanmalıdır.Kullanıcıda ikinci kutunun sonuna kadar bir çekilme kanaması beklenmez. Ancak kaplı tabletalındığı günlerde lekelenme veya kırılma kanaması görülebilir. 2. Kullanmakta olduğu kutuyu bırakması önerilebilir. 7 günlük (kaplı tableti unuttuğu günlerdahil) aradan sonra yeni kutuya başlanır. Kaplı tablet almayı unutan kullanıcıda ilk kaplı tabletsiz dönemde beklenen çekilme kanaması görülmezse gebelik olasılığı göz önüne alınmalıdır. Mide-bağırsak bozuklukları durumunda: Şiddetli mide-bağırsak bozukluklarının olması durumunda emilim tam olmayabilir ve ek kontraseptif önlemler alınmalıdır. Eğer kaplı tablet alımını takiben 3-4 saat içinde kusma olursa unutulan kaplı tabletler için verilen öneriler (bkz. 4.2 Pozoloji ve uygulama şekli - kaplı tablet alımı unutulduğunda)geçerlidir. Eğer kadın normal kaplı tablet alma programını değiştirmek istemezse, gerekenekstra kaplı tabletleri başka bir kutudan almalıdır. Menstruasyonun öne alınması veya ertelenmesi: Menstruasyonu ertelemek için kullanıcı kaplı tablet alınmayan dönem olmadan başka bir REGİNON paketi ile devam etmelidir. Uzatma, eğer istenirse ikinci paketin sonuna kadar 4 yapılabilir. Uzatma sırasında kullanıcı kırılma kanaması ya da lekelenme yaşayabilir. Daha sonra 7 günlük kaplı tablet alınmayan dönemin ardından düzenli REGİNON alımına devamedilir. Kullanıcının adet dönemini haftanın başka bir gününe kaydırmak için kaplı tablet alınmayan dönemini istediği gün kadar kısaltması önerilir. Aralık ne kadar kısa olursa, kadının çekilmekanaması olmama ve ikinci paket sırasında kırılma kanaması ve lekelenme yaşama riski okadar yüksektir (adet geciktirirken olduğu gibi). Özel popülasyonlara ilişkin ek bilgiler:Karaciğer yetmezliği:REGİNON şiddetli karaciğer hastalıkları olan kadınlardakontrendikedir. Ayrıca 4.3 bölümüne bakınız. Böbrek yetmezliği:REGİNON böbrek yetmezliği olan hastalarda özel olarakaraştırılmamıştır. Mevcut veriler bu hasta popülasyonun tedavisinde bir değişiklik yapılmasını ileri sürmemektedir. Pediyatrik popülasyon:REGİNON yalnızca menarştan sonra endikedir.Geriyatrik popülasyon:4.3. KontrendikasyonlarKOK'lar aşağıda belirtilen durumlarda kullanılmamalıdır. KOK kullanırken aşağıdaki durumlardan herhangi birinin ilk kez görülmesi halinde kullanım derhal durdurulmalıdır. Etkin ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılık VTE varlığı veya riski o Venöz tromboembolizm - mevcut VTE (antikoagülanlar üzerinde) veya öyküsü (örn. derin ven trombozu [DVT] veya pulmoner embolizm [PE]) o APC direnci (Faktör V Leiden dahil), antitrombin III eksikliği, protein C eksikliği, protein S eksikliği gibi VTE için bilinen kalıtımsal veya kazanılmış yatkınlıko Uzun süreli hareketsizliğe neden olan majör cerrahi müdahale (bkz. bölüm 4.4)o Çoklu risk faktörlerinin varlığından kaynaklanan yüksek VTE riski (bkz. bölüm 4.4) Arteriyel tromboembolizm (ATE) varlığı veya riski o Arteriyel tromboembolizmi - mevcut ATE, ATE öyküsü (örn. miyokard infarktüsü) veya prodromal durum (örn. anjina pektoris) 5 o Serebrovasküler hastalık - mevcut inme, inme veya prodromal durum öyküsü (örn. geçici iskemik atak, TIA) o Hiperhomosisteinemi ve antifosfolipid antikorlar (antikardiyolipin antikorlar, lupus antikoagülanı) gibi ATE için bilinen kalıtımsal veya kazanılmış yatkınlıko Fokal nörolojik semptomlu migren öyküsü o Çoklu risk faktörlerinden kaynaklanan yüksek ATE riski (bkz. bölüm 4.4) veya aşağıdaki gibi bir ciddi risk faktörü varlığı: vasküler semptomlu diabetes mellitus şiddetli hipertansiyon şiddetli dislipoproteinemi Karaciğer fonksiyon değerlerinin normale dönmediği, aktif viral hepatit ve ağır siroz gibiağır karaciğer hastalığı varlığı veya öyküsü, Karaciğer tümörü varlığı ya da öyküsü (iyi veya kötü huylu) Eğer seks steroidlerinden etkileniyorsa genital organların veya memenin bilinen ya daşüpheli malign hastalıkları Tanı konulmamış vajinal kanama Bilinen gebelik varlığı ya da gebelik şüphesi REGİNON'un ombitasvir, paritaprevir, ritonavir veya dasabuvir içeren tıbbi ürünler ile eş zamanlı kullanımı kontraendikedir (bkz. bölüm 4.4 ve 4.5). 4.4. Özel kullanım uyarıları ve önlemleriUyarılarAşağıda belirtilen durum veya risk faktörlerinden herhangi biri varsa, REGİNON'un uygun olup olmadığı kadın ile tartışılmalıdır. Bu durumlardan veya risk faktörlerinden herhangi birinin şiddetlenmesi veya ilk defa ortaya çıkması halinde, kadının REGİNON kullanımının sonlandırılmasının gerekli olupolmadığının belirlenmesi için doktoru ile iletişime geçmesi tavsiye edilmelidir. Dolaşım bozuklukları VTE Riski6 KHK kullanan kadınlarda VTE riski kullanmayanlara göre artar. Levonorgestrel, norgestimat veya noretisteron içeren ürünler en düşük VTE riski ile ilişkilendirilmiştir.REGİNON gibi diğer ürünlerde ise bu riskin iki katına kadar çıkabilir. En düşük VTEriskine sahip olduğu bilinenlerden farklı bir ürünün kullanılması kararı, ancak kadınınREGİNON ile ilişkili VTE riskini, mevcut risk faktörlerinin bu riski nasıl etkilediğini veVTE riskinin kullanımınım ilk yılında en yüksek olduğunu anladığından emin olduktansonra alınmalıdır. Ayrıca KHK kullanımına 4 hafta veya daha uzun süre araverildikten sonra tekrar başlandığında riskin arttığını gösteren bazı kanıtlar vardır.KHK kullanmayan ve gebe olmayan kadınlarda, 10.000 kişiden yaklaşık 2'si bir yıllık süreiçinde VTE geliştirir. Bununla birlikte, herhangi bir kadında altta yatan risk faktörlerine bağlıolarak söz konusu risk çok daha yüksek olabilir (aşağı bakınız).Gestoden içeren KHK kullanan 10.000 kadından 9 ila 12'sinin bir yıl içinde VTE geliştireceği tahmin edilmektedir1; bu oran levonorgestrel içeren KHK kullanan kadınlarda 62 civarındadır. Düşük dozlu KHK'ler ile bir yıldaki VTE sayısı gebelikte veya postpartum dönemde kadınlarda beklenen sayıdan düşüktür. VTE, bu vakaların %1-2'sinde ölümcül olabilir. Bir yıl içinde her 10.000 kadında görülen VTE vakası sayısı7 Son derece nadir olarak, KHK kullanıcılarında diğer kan damarlarında (örn. hepatik, mesenter, böbrek veya retinal toplardamarlar ve atardamarlar) tromboz meydana geldiği raporedilmiştir. VTE risk faktörleriVenöz tromboembolik komplikasyon riski KHK kullanıcılarında özellikle çoklu risk faktörleri olduğunda, ilave risk faktörleri olan kadınlarda ciddi ölçüde artabilir (bkz. Tablo:VTE Risk faktörleri). Yüksek venöz tromboz riski oluşturan çoklu risk faktörleri mevcut olan kadında REGİNON kullanımı kontrendikedir (bkz. bölüm 4.3). Bir kadın birden fazla risk faktörüne sahipse riskartışı tüm faktörlerin ayrı ayrı toplamından fazla olabilir ve bu durumda toplam VTE riskidikkate alınmalıdır. Fayda ve risk dengesinin negatif olduğu düşünülüyorsa KHK reçeteedilmemelidir (bkz. bölüm 4.3). Tablo: VTE Risk faktörleri
8
Gebelikte ve özellikle 6 haftalık puerperium periyodunda tromboemboli riskindeki artış dikkate alınmalıdır (bkz. bölüm 4.6). VTE semptomları (Derin Ven Trombozu-DVT ve Pulmoner Emboli-PE)9 Semptomlar olması halinde, kadınlara acil tıbbi yardım almaları ve sağlık çalışanlarını KHK aldıkları konusunda bilgilendirmeleri tavsiye edilmelidir. DVT semptomları aşağıdakileri kapsayabilir: - bacakta/ayakta tek taraflı ya da bacaktaki bir damar boyunca şişme; - bacakta yalnızca ayakta dururken ya da yürürken hissedilebilen ağrı ya da hassasiyet, - etkilenen bacakta sıcaklık artışı; bacakta ciltte kırmızılık ya da renk değişmesi. Pulmoner embolizm (PE) semptomları aşağıdakileri kapsayabilir: - aniden ortaya çıkan, açıklanamayan nefes darlığı ya da hızlı soluma; - kanın söz konusu olabileceği ani öksürük; - keskin göğüs ağrısı; - şiddetli dengesizlik ya da baş dönmesi; - hızlı veya düzensiz kalp atışı. Bu semptomlardan bazıları (ör, nefes darlığı, öksürük) özgün değildir ve daha yaygın ya da daha az şiddetli olaylar (ör, solunum yolu enfeksiyonları) şeklinde yanlış yorumlanabilir. Vasküler oklüzyona ilişkin diğer belirtiler; bir ekstremitedeki ani ağrı, şişme ya da mavi tonda hafif renk değişikliği olabilir. Gözde tıkanma meydan geldiği takdirde, semptomlar ağrısız bulanık görme ile başlayıp görme kaybına kadar ilerleyebilir. Bazen, görme kaybı aniden meydana gelebilir. ATE riskiEpidemiyolojik çalışmalarda, KHK kullanımı ATE (miyokard enfarktüsü) veya serebrovasküler olay (örn. geçici iskemik atak, inme) riskinde artışla ilişkilendirilmiştir. ATEölümcül olabilir. ATE risk faktörleri10 Arteriyel tromboembolik komplikasyon veya serebrovaksüler olay riski, risk faktörleri olan KHK kullanan kadınlarda artar (bkz. Tablo: ATE Risk faktörleri). Yüksek arteriyel tromboz riskine maruz bırakan ciddi ya da çoklu ATE risk faktörleri mevcut olan kadında gestoden ve etinilestradiol kullanımı kontrendikedir (bkz. bölüm 4.3). Birkadında birden fazla risk faktörü varsa, riskteki artışın ayrı ayrı faktörlerin toplamından dahayüksek olması olasılığı vardır. Bu durumda VTE toplam riski dikkate alınmalıdır. Fayda verisk dengesinin negatif olduğu düşünülüyorsa, KHK reçete edilmemelidir (bkz. bölüm 4.3). Tablo: ATE risk faktörleri
11
ATE semptomlarıSemptomlar görüldüğünde, kadınlar en kısa sürede tıbbi yardıma başvurmaları ve KHK kullandıklarını sağlık uzmanına bildirmek konusunda bilgilendirilmelidir. Serebrovasküler bir olaya ilişkin semptomlar şunlardır: - yüzde, bacak veya kolda, özellikle vücudun bir tarafında ani hissizlik ya da güçsüzlük; - ani yürümede güçlük, baş dönmesi, denge ya da koordinasyon kaybı; - ani konfüzyon, konuşma ya da kavramada güçlük; - bir ya da her iki gözde ani görme güçlüğü; ani yürüme güçlüğü, - bilinen nedeni olmayan ani, şiddetli veya uzun süren baş ağrısı; - bilinç kaybı ya da nöbetin eşlik ettiği ya da tek başına bayılma. Geçici belirtiler olayın geçici iskemik atak olduğunu göstermektedir. Miyokard enfarktüsü (MI) semptomları şunları kapsayabilir: - göğüs, kol ya da göğüs kemiği altında ağrı, rahatsızlık, basınç, ağırlık, sıkışma ya dadolgunluk hissi; - sırt, çene, boğaz, kol ve mideye yayılan rahatsızlık; - dolgunluk, hazımsızlık ya da sıkıştırma hissi; - terleme, bulantı, kusma ya da baş dönmesi; - aşırı güçsüzlük, anksiyete, nefes darlığı; - hızlı veya düzensiz kalp atışı. Tıbbi muayene/konsültasyon Hastanın oral kontraseptif kullanmaya başlamadan önce ve sonrasında düzenli aralıklarla tıbbi öyküsü (aile öyküsünü de içerecek şekilde) değerlendirilmelidir ve gebelik ekarte edilmelidir.Kan basıncı ölçülmeli ve fiziksel muayene kontrendikasyonlar (bkz. bölüm 4.3) ile uyarılar(bkz. bölüm 4.4) doğrultusunda gerçekleştirilmelidir. VTE ve ATE semptomları, bilinen riskfaktörleri ve şüpheli tromboz durumunda ne yapılacağı, REGİNON'un diğer KHK'lara 12 kıyasla riski de dahil olmak üzere venöz ve arteriyel tromboz bilgilerine kadının dikkatini çekmek önemlidir. Kadına ayrıca kullanma talimatını dikkatlice okuması ve verilen tavsiyelere uyması talimatı verilmelidir. Muayenenin niteliği ve sıklığı belirlenmiş uygulama kılavuzlarına dayanmalı vekadına özel olarak uyarlanmalıdır. Kullanıcılar oral kontraseptiflerin HIV enfeksiyonları (AIDS) ve diğer cinsel yolla bulaşan hastalıklara karşı koruyucu olmadığı konusunda bilgilendirilmelidir. Altta yatan durumlar için şüpheli tanısı konmamış vajinal kanama araştırılmalıdır. Dikkatli tıbbi gözetim gerektiren durumlar KOK reçete edilmesi konusu klinik karar kullanılarak ve hastanın fikri alınarak kararlaştırılmalıdır. Bu durum veya risk faktörlerinden birinin ilk kez ortaya çıkması veyaalevlenmesi oral kontraseptif kullanımının kesilmesi gerektiğine işaret edebilir. Hastadoktoruna danışmalı, doktor da KOK kullanımına son verilip verilmemesine ilişkin kararvermelidir: Hafif vasküler hastalık veya hafif nefropati, retinopati veya nöropatinin eşlik ettiğidiyabet Yeterli kontrol altında olan (sistolik >140 ila 159 mm Hg veya diyastolik >90 ila 94mmHg) hipertansiyon Porfiri Obezite Migren Kardiyovasküler hastalıklar Oral kontrasepsiyon kullanımını derhal kesme nedenleri:Oral kontrasepsiyon kullanımını keserken, kontraseptif korumanın devam edebilmesi için hormonal olmayan kontrasepsiyon kullanılmalıdır. 1. Migrenli baş ağrılarının veya normal olmayan sıklıktaki/şiddetteki baş ağrılarının ilk kezortaya çıkması veya mevcut olanların şiddetlenmesi. 2. Görmede veya işitmede ani bozulmalar veya diğer algı bozuklukları 13 3. Tromboz veya kan pıhtılaşması ilk belirtileri (örneğin, bacakta/bacaklarda olağan dışıağrılar veya şişme, gözle görülür bir neden olmaksızın nefes alırken veya öksürürken bıçakgibi saplanan ağrılar). Göğüste ağrı veya sıkışma hissi 4. Elektif majör operasyondan (örn. abdominal, ortopedik), herhangi bir bacak ameliyatından,varisli damarlar veya uzun süreli hareketsizlik (örn. kazalar veya ameliyattan sonra) için tıbbitedaviden altı hafta önce. Tam yürür hale geldikten sonra 2 hafta geçinceye kadar yenidenbaşlamayın. Acil cerrahi durumunda genellikle trombotik profilaksi endikedir, örn.subkutanöz heparin. 5. Sarılık başlangıcı, hepatit, tüm vücutta kaşıntı 6. Kan basıncında önemli artış 7. Şiddetli üst abdominal ağrı veya karaciğer büyümesi 8. Oral kontrasepsiyon veya gebelik sırasında kötüleşebildiği bilinen koşulların açık birşekilde şiddetlenmesi (bkz. bölüm 4.4 'Diğer durumlar' içinde 'Gebelikte veya önceki KOKkullanımı sırasında kötüleşen durumlar'). Tümörler Kombine oral kontraseptif kullanan kadınlarda yumurtalık, endometrial, rahim ağzı ve meme kanseri riskleri konusunda çok sayıda epidemiyolojik çalışma bildirilmiştir. Yüksek dozlukombine oral kontraseptiflerin hem yumurtalık hem de endometrial kansere karşı önemli birkoruma sağladığı açıkça kanıtlanmıştır. Bununla birlikte, düşük doz KOK'ların aynı seviyedekoruyucu etki sağlayıp sağlamadığı açık değildir. Meme Kanseri 54 epidemiyolojik çalışmanın meta analizi sonucu halen KOK kullanan kadınlarda tanı konan meme kanseri bağıl riskinde hafif bir artış saptanmıştır (Bağıl risk =1.24). Bu artmış riskKOK'un kesilmesini takiben on yıl içinde azalarak kaybolmaktadır. Meme kanseri 40 yaşınaltındaki kadınlarda nadir olduğundan, halen KOK kullanan ya da kullanmış olanlardakonulan meme kanseri tanılarındaki artış, tüm meme kanseri riski ile karşılaştırıldığındadüşüktür. Anılan çalışmalar nedensellik ilişkisi konusunda kanıtlar getirmemektedir.Gözlenen artmış risk paterni, KOK kullanıcılarında meme kanserinin daha erken tanınmasına,KOK'ların biyolojik etkilerine veya ikisinin kombinasyonuna bağlı olabilir. KOK kullanmış 14 olanlarda tanı konan meme kanserleri hiç kullanmamış olanlara göre klinik olarak daha az ilerlemiş olma eğilimi gösterir. Meme kanseri, KOK kullanıyor olsun veya olmasın 40 yaşın altındaki kadınlarda nadirdir. Bu arka plan risk yaşla birlikte artsa da, halihazırda ve yakın zamanlı KOK kullanıcılarındakifazladan meme kanseri teşhisi sayısı, genel meme kanseri riskine göre küçüktür (bkz. çubukgrafik). KOK kullanıcılarında meme kanseri için en önemli risk faktörü, kadınların KOK kullanımını bırakma yaşıdır. Kadınlar ilacı ne kadar geç yaşta keserse, o kadar daha fazla meme kanseriteşhisi konulmaktadır. Kullanım süresi daha az önemli olup KOK kullanımını kestiktensonraki 10 yıl boyunca fazladan risk kademeli olarak kaybolmaktadır. Öyle ki, görünüşe göre10. yıl itibariyle fazladan risk kalmamaktadır. Meme kanseri riskindeki olası artış kullanıcı ile tartışılmalı ve diğer bazı kanserlerin (örneğin, yumurtalık kanseri ve endometriyal kanser) gelişme riskine karşı önemli bir korumasunduğuna dair kanıtlar dikkate alınarak, KOK'ların faydasıyla karşılaştırılmalıdır. 15 Servikal Kanser Servikal kanser için en önemli risk faktörü süregelen human papilloma virus (HPV) enfeksiyonudur. Bazı epidemiyolojik çalışmalarda uzun süre KOK kullanımının servikalkanser riskinde artışa neden olabileceği bildirilmiştir ancak bu bulguların KOK kullanımınınhangi etkilerine bağlı olabileceği (servikal inceleme, bariyer kontraseptif kullanımı dahilolmak üzere seksüel davranış) halen tartışılmaktadır. Karaciğer Kanseri REGİNON'da bulunanlara benzer hormonal maddelerin kullanımın ardından izole vakalarda hayatı tehdit eden izole abdominal kanamalara neden olan nadir olarak iyi huylu, daha nadirolarak da kötü huylu karaciğer tümörleri gözlemlenmiştir. Ciddi üst abdominal şikayetler,karaciğer büyümesi veya intra-abdominal hemoraji emareleri meydana gelirse, ayırt edicitanıya karaciğer tümörü olasılığı dahil edilmelidir. Diğer durumlar 16 Kombine oral kontraseptiflerin kullanımı sırasında bazı kronik hastalıkların zaman zaman kötüleşme olasılığı göz ardı edilemez. Bilinen hiperlipidemiler Hipertrigliseridemisi veya aile öyküsü olan kadınların KOK kullanımı sırasında pankreatit riski artabilir. Hiperlipidemisi olan kadınlar, daha fazla arteriyel hastalık riski altındadır (bkz.bölüm 4.4 'Dolaşım bozuklukları'). Bununla birlikte, rutin olarak KOK kullanan kadınlarıntaranması uygun değildir. Kan Basıncı Hipertansiyon; inme ve miyokard enfarktüsü için bir risk faktörüdür (bkz. bölüm 4.4 'Arteriyel tromboembolikle ilgili durumlar'). Her ne kadar KOK kullanan birçok kadında kanbasıncında küçük artışlar bildirilmiş olsa da, klinik olarak ilgili artışlar nadirdir. Ancak, KOKkullanımı sırasında sürekli hipertansiyon gelişirse, normalde komplikasyonsuz hastalarda160/100 mm Hg seviyesinde ve hedef organ hasarı, teşhis konmuş kardiyovasküler hastalık,diyabet veya kardiyovasküler risk faktörleri artmış hastalarda ise 140/90 mm Hg seviyesindeantihipertansif tedavi yapılmalıdır. KOK kullanımının devamıyla ilgili kararlar daha düşük BPseviyelerinde verilmelidir. Alternatif kontrasepsiyon önerilebilir. Gebelikte veya önceki KOK kullanımı sırasında kötüleşen durumlar Aşağıdaki durumların hem gebelik hem de KOK kullanımıyla ortaya çıktığı veya kötüleştiği bildirilmiştir. Kullanım sırasında aşağıdakilerden herhangi biri olursa, REGİNON'u kesmekdeğerlendirilmelidir: kolestazla ilişkili sarılık ve/veya pruritus KOK'lar safra taşı oluşumu riskini artırabilir ve mevcut hastalığı kötüleştirebilir sistemik lupus eritematozus herpes gestasyones otoskleroz ile ilgili işitme kaybı orak hücre anemisi böbrek yetmezliği kalıtsal anjiyoödem gebelik veya önceki KOK kullanımı sırasında kadının yaşadığı yeni veya kötüleşen mevcutdurumlar. 17 Karaciğer fonksiyonu bozuklukları Karaciğer fonksiyonlarının akut veya kronik bozulmaları, karaciğer fonksiyon testlerinin normale dönmesine kadar KOK kullanımının kesilmesini gerektirebilir. İlk kez gebelikte yada daha önce seks steroidlerinin kullanımı sırasında oluşmuş olan kolestatik sarılığıntekrarlaması KOK kullanımının sonlandırılmasını gerektirir. Diyabet (vasküler tutulum olmadan) Vasküler hastalığı olmayan insüline bağımlı diyabet hastaları KOK kullanabilir. Ancak, tüm diyabet hastalarının arteriyel hastalık riskinin yüksekolduğu ve bunun KOK reçete ederken dikkate alınması gerektiği unutulmamalıdır. Mevcutvasküler hastalığı olan diyabet hastalarında KOK kullanımı kontrendikedir (bkz. bölüm 4.3).KOK'ların periferik insülin direnci ve glukoz toleransı üzerinde etkisinin olma ihtimalinerağmen, düşük dozda KOK (0,05 mg etinilestradiolden az) kullanan diyabet hastalarındatedavi rejiminin değiştirilmesini gerektirecek hiçbir kanıt yoktur. Ancak, diyabet hastasıkadınların KOK kullanımı sırasında dikkatli bir şekilde gözlemlenmesi gerekir. Psikiyatrik Bozukluklar Depresif ruh hali ve depresyon, hormonal kontraseptif kullanımının iyi bilinen istenmeyen etkileridir (bkz. bölüm 4.8). Depresyon ciddi olabilir ve intihara meyilli davranış ve intihar için iyi bilinen bir risk faktörüdür. Kadınların, duygudurum değişiklikleri ve tedaviye başladıktan hemen sonraortaya çıkan depresyon belirtileri durumunda doktorlarına başvurmaları önerilir. Kloazma Kloazma, özellikle kloazma gravidarum öyküsü olan kadınlarda bazen gelişebilir. Kloazmaya eğilimi olan kadınlar KOK kullandıkları sürece güneşe veya ultraviyoleışınlarına maruz kalmaktan kaçınmalıdırlar. Adet Değişiklikleri Adet akışının azalması: Bu anormal değildir ve bazı hastalarda olması beklenir. Aslında, daha önce yoğun adet yaşanan durumlarda faydalı bile olabilir. 18 Adet gecikmesi: Bazen çekilme kanaması hiç meydana gelmeyebilir. Tabletler doğru alınmışsa, gebelik olası değildir. İkinci paketin sonunda çekilme kanaması gerçekleşmezse,bir sonraki pakete geçmeden önce gebelik olasılığının elenmesi gerekir. İntermenstrüel kanama: Özellikle ilk aylarda düzensiz kanama (lekelenme veya ani kanama) oluşabilir. Bu nedenle düzensiz kanamaların değerlendirmesi, ancak yaklaşık üç döngülükbir adaptasyon süresinden sonra anlamlıdır. Önceden düzenli olan döngülerden sonrakanama düzensizlikleri oluşursa veya devam ederse, hormonal olmayan nedenler göz önündebulundurulmalı malignite veya gebeliği dışlamak için gereken testler yapılmalıdır. Bunlararasında kürtaj da bulunabilir. Bazı kadınlar, oral kontraseptiflerin kesilmesinden sonra bilhassa bu koşulların kullanımdan önce mevcut olduğu durumlarda amenore veya oligomenore yaşayabilir. Kadınlara buolasılık hakkında bilgi verilmelidir. Dolaşım bozuklukları ile ilgili advers etkilerin ortaya çıkma riski özellikle 35 yaş üzeri ve sigara içen kadınlarda yüksektir. ALT artışları Hepatit C virüsü (HCV) enfeksiyonları için tedavi gören hastalarda, ribavirin ile veya ribavirin olmadan, ombitasvir/paritaprevir/ritonavir ve dasabuvir içeren tıbbi ürünlerleyapılan klinik çalışmalar sırasında, normalin üst sınırının (ULN) 5 katından fazlatransaminaz (ALT) yükselmeleri, kombine hormonal kontraseptifler (CHC'ler) gibietinilestradiol içeren ilaçlar kullanan kadınlarda önemli ölçüde daha sık meydana gelmiştir(bkz. bölüm 4.3 ve 4.5). 1 Bu insidanslar, levonorgestrel içeren KOK'lara kıyasla farklı ürünlere ait göreceli risklerkullanılarak epidemiyolojik çalışma verilerinin toplamından hesaplanmştır. 2 10.000 yıl/kadın başına 5-7 aralığının orta noktası, levonorgestrel içeren KOK'lara karşılık ilaçkullanmama için göreceli riske dayalı olarak yaklaşık 2,3 ila 3,6. 19 Laktoz: Her bir kaplı tablet 36,865 mg laktoz içerir. Galaktozemi gibi ender bir kalıtımsal tablo olan galaktoz intoleranslı hastalar bu ilacı kullanmamalıdır. Nadir kalıtımsal galaktoz intoleransı, ,Lapp laktoz yetmezliği ya da glukoz galaktoz malabsorpsiyon problemi olan hastaların builacı kullanmaması gerekir. Sukroz: Her bir kaplı tablet 19,631 mg sukroz içerir. Nadir kalıtımsal fruktoz intoleransı, glikoz-galaktoz malabsorpsiyon veya sükraz-izomaltaz yetmezliği problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriEnzim İndükleyicileri Mikromozal enzimleri indükleyen ilaçlar (özellikle sitokrom P450 3A4) ile arasındaki etkileşimler seks hormonu klerensinde artışa neden olabilir, bu durum da ara kanamayave/veya kontraseptif başarısızlığa yol açabilirler. Birkaç günlük tedavinin ardından enzim indüksiyonu gözlemlenebilir. En fazla enzim indüksiyonu genellikle birkaç hafta içinde görülür. Enzim indüksiyonu, ilaç tedavisininkesilmesinin ardından 4 hafta kadar sürebilir. Belirtilen ilaçlardan herhangi biri ile tedavi edilmekte olan kadınlar, KOK'a ek geçici bir bariyer yöntemi kullanmalı ya da başka bir kontrasepsiyon yöntemi seçmelidirler. İlaçlar ilebirlikte kullanımları süresince ve tedavinin kesilmesini takiben 28 gün boyunca bariyeryöntemi kullanmalıdırlar. Eğer bariyer yöntemi kullanılan dönem KOK kutusundakitabletlerin bitiminden sonra devam ediyorsa, bir sonraki kutuya ara vermeden devamedilmelidir. Bu durumda, ikinci paketin sonuna kadar çekilme kanaması beklenmemelidir.Hasta, ikinci paketin bitiminden sonraki tablet kullanılmayan dönemde çekilme kanamasıyaşamazsa, sonraki pakete devam etmeden önce gebelik olasılığının elenmesi gerekir. Enzim indükleyicilerle uzun süreli tedavi alan kadınlar için, başka bir kontrasepsiyon yöntemi kullanılmalıdır. Aşağıdakilerin KOK'larla klinik olarak anlamlı etkileşimlerinin olduğu gösterilmiştir: 20 Antikonvülsanlar: barbitüratlar (fenobarbital dahil), primidon, fenitoin, karbamazepin, okskarbazepin, topiramat. Antibiyotikler/antifungaller: griseofulvin, rifampisin. Bitkisel ilaçlar: St John's wort (kantaron - Hypericum perforatum) Antiretroviral ajanlar: ritonavir, nelfinavir, nevirapin. Not: Cinsiyet hormonlarının plazma konsantrasyonunu artırabilen başka antiretroviral ajanlar da vardır. KOK klerensini azaltan maddeler (enzim inhibitörleri): Azol antifungaller (örn. itrakonazol, vorikonazol, flukonazol), verapamil, makrolidler (örn. klaritromisin, eritromisin), diltiazem ve greyfurt suyu gibi kuvvetli ve orta düzeyde CYP3A4inhibitörleri östrojen veya progesteron veya her ikisinin de plazma konsantrasyonunuartırabilir. 60 - 120 mg/gün etorikoksib dozlarının 0,035 mg etinilestradiol içeren KHK ile eş zamanlı olarak alındığı takdirde etinilestradiolün plazma konsantrasyonlarını sırasıyla 1,4 - 1,6 katarttırdığı görülmüştür. KOK'lerin diğer tıbbi ürünler üzerine etkisi: Oral kontraseptifler diğer bazı ilaçların metabolizmasını etkileyebilir. Buna bağlı olarak plazma ve doku konsantrasyonları artabilir (örn. siklosporin, tizanidin, teofilin) ya daazalabilir (örn. lamotrigin). Farmakodinamik etkileşimler Ribavirinli veya ribavirin içermeyen; Ombitasvir, paritaprevir, ritonavir ve dasabuvirin, kombinasyonlarını içeren tıbbi ürünlerin birlikte uygulanması ALT seviyelerinde artmariskini yükseltebilir (bkz. bölüm 4.3 ve bölüm 4.4). Bu nedenle, REGİNON kullanıcıları, bu kombinasyon ilaç rejimiyle tedaviye başlamadan önce alternatif bir kontrasepsiyon yöntemine (örneğin, sadece progestajenle kontrasepsiyonveya hormonal olmayan yöntemler) geçmelidir. REGİNON, bu kombinasyon ilaç rejimi iletedavi tamamlandıktan 2 hafta sonra yeniden başlatılabilir. 21 Diğer etkileşim şekilleri: Laboratuvar Testleri Oral kontraseptiflerin kullanılması, örn. kortikosteroid bağlayıcı globulin ve lipid/lipoprotein fraksiyonları, karbonhidrat metabolizması parametreleri ve koagülasyon ve fibrinolizparametreleri gibi karaciğer, tiroid, adrenal ve renal fonksiyonun biyokimyasal parametreleridahil olmak üzere belirli laboratuvar testlerinin sonuçlarını etkileyebilir. Bu nedenlelaboratuvar testleri istendiğinde, laboratuvar personeline oral kontraseptif kullanımıhakkında bilgi verilmelidir. Not: Olası etkileşmeleri belirlemek amacıyla eşzamanlıkullanılacak ilacın prospektüsüne (kullanma talimatına) başvurulmalıdır. Özel popülasyonlara ilişkin ek bilgiler: Özel popülasyonda etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon: Pediyatrik popülasyonda etkileşim çalışması yapılmamıştır. 4.6. Gebelik ve LaktasyonGenel tavsiyeGebelik kategorisi: X Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)REGİNON doğum kontrolü amacıyla kullanılmaktadır. Kullanıldığı sürece fertiliteyi engeller. Gebelik dönemiREGİNON'un gebelikte kullanımı kontrendikedir. Gestoden ve etinilestradiol gebelik döneminde uygulandığı takdirde ciddi doğum kusurlarına yol açmaktadır. REGİNON kullanımı sırasında gebelik meydana gelmesi durumunda kullanım durdurulmalıdır. Ancak, yaygın epidemiyolojik çalışmalar ne gebeliğinden önce kombineoral kontraseptif kullanmış olan kadınların çocuklarında doğumsal kusur riskinde herhangi 22 bir artışı ne de erken gebeliği süresince yanlışlıkla kombine oral kontraseptif kullanıldığında oluşan bir teratojenik etkiyi göstermemiştir. REGİNON kullanımına yeniden başlarken postpartum dönemi sırasında artan VTE riski dikkate alınmalıdır (bkz. bölüm 4.2 ve bölüm 4.4.) Laktasyon dönemiREGİNON'un emzirme döneminde kullanılması üretilen süt hacminde azalmaya ve bileşiminde değişikliğe neden olabilir. Etkin maddelerin çok küçük bir miktarı sütle atılır. Bu miktar, çocuğuözellikle doğumdan sonraki ilk 6 hafta içinde etkiler. Emziren annelere, başka bir kontrasepsiyonyöntemi kullanmaları önerilebilir. Üreme yeteneği/FertiliteREGİNON bir KHK'dır. Kullanıldığı sürece fertiliteyi engeller. 4.7. Araç ve makine kullanımı üzerindeki etkilerREGİNON'un araç ve makine kullanma becerileri üzerinde bilinen bir etkisi bulunmamaktadır. 4.8. İstenmeyen etkilerREGİNON ile en yaygın olarak bildirilen advers reaksiyonlar mide bulantısı, abdominal ağrı, kilo artışı, baş ağrısı, depresif ruh hali, duygu durum bozukluğu, meme ağrısı, memehassasiyetidir. Kullanıcıların > %1'inde meydana gelir. Ciddi advers reaksiyonlar ATE ve VTE'dir. Pazarlama sonrası raporlanan advers reaksiyonlar Bağışıklık sistemi hastalıklarıKalıtsal anjiyoödemin alevlenmesi Sinir sistemi hastalıklarıKorenin alevlenmesi Gastrointestinal hastalıklarÜlseratif kolit 23 Hepatobiliyer hastalıklarKaraciğer fonksiyon bozuklukları Deri ve deri altı doku bozuklukları:Kloazma Üreme sistemi ve meme hastalıklarıAzalmış adet kanaması, lekelenme, ani kanama, çekilme kanaması yoksunluğu, tablet sonrası amenore Advers reaksiyonlar, aşağıda sistem-organ sınıfı (MedDRA) ve sıklık derecesine göre listelenmektedir. Sıklık dereceleri şu şekilde tanımlanmaktadır; çok yaygın (>1/10), yaygın(>1/100, <1/10), yaygın olmayan (>1/1.000, <1/100), seyrek (>1/10.000 ila <1/1.000), çokseyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sistemi hastalıklarıSeyrek: Aşırı duyarlılık Metabolizma ve beslenme hastalıklarıYaygın olmayan: Sıvı tutulumu Psikiyatrik hastalıklarYaygın: Depresif duygu durumu, duygu durum değişiklikleri Yaygın olmayan: Libido azalmasıSeyrek: Libido artışı Sinir sistemi hastalıklarıYaygın: Baş ağrısı Yaygın olmayan: Migren Göz hastalıklarıSeyrek: Kontakt lens intoleransı 24 Gastrointestinal hastalıklarYaygın: Bulantı, karın ağrısı Yaygın olmayan: Kusma, diyare Vasküler hastalıkları Seyrek: Venöz tromboembolizm (VTE), arteryel tromboembolizm (ATE) Deri ve deri altı doku hastalıklarıYaygın olmayan: Döküntü, ürtiker Seyrek: Eritema nodozum, eritema multiforme Üreme sistemi ve meme hastalıklarıYaygın: Meme ağrısı, meme hassasiyeti Yaygın olmayan:Memede hipertrofı Seyrek: Vajinal akıntı, memede akıntı AraştırmalarYaygın: Kiloda artış Seyrek: Kilo kaybı Seçilmiş advers reaksiyonların tanımı KHK kullanan kadınlarda 4.4 Özel kullanım uyarıları ve önlemleri bölümünde daha ayrıntılı olarak ele alınmış miyokard infarktüsü, inme, geçici iskemik ataklar, venöz tromboz vepulmoner emboli dahil olmak üzere arteriyel ve venöz trombotik ve tromboembolik olaylardaartış riski gözlemlenmiştir. KOK kullanan kadınlarda bildirilen, 4.4 Özel kullanım uyarılarıve önlemleri bölümünde bahsi geçen ciddi advers olaylar: Venöz tromboembolik bozukluklar Arteriyel tromboembolik bozukluklar İnme (örneğin geçici iskemik atak, iskemik inme, hemorajik inme) Hipertansiyon Hipertrigliseridemi 25 Karaciğer tümörleri (benign ve malign) Meme kanseri tanı sıklığı oral kontraseptif kullananlarda çok hafif düzeyde artmıştır. Meme kanseri 40 yaşın altındaki kadınlarda nadir görüldüğünden, aşırı rakam genel meme kanseririskiyle ilişkili olarak küçüktür. KOK kullanımıyla neden sonuç ilişkisi bilinmemektedir.Ayrıca bkz. bölüm 4.3 ve 4.4. Gebelikte veya önceki KOK kullanımı sırasında bildirilen kötüleşen durumlar Kolestazla ilgili sarılık ve/veya kaşıntı; safra taşı oluşumu; sistemik lupus eritematozus;herpes gestasyonis; duyma kaybıyla ilişkili otoskleroz; crohn hastalığı; orak hücreli anemi;böbrek yetmezliği; kalıtsal anjiyoödem; porfiri; rahim ağzı kanseri. KOK kullanan kadınlarda glukoz toleransındaki değişiklikler veya periferik insülin direnci üzerindeki etki bildirilmiştir (bkz. bölüm 4.4). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. ([email protected];4.9. Doz aşımı ve tedavisiDoz aşımına bağlı bildirilen ciddi yan etki yoktur. Görülebilecek belirtiler, bulantı, kusma ve çekilme kanamasıdır. Çekilme kanaması, ilacı yanlışlıkla almaları halinde kız çocuklarındamenarştan önce bile görülebilir. Antidotu yoktur ve tedavisi semptomatik olmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Östrojenler ve progestojenler, fıks kombinasyonlar ATC kodu: G03AA10 Etki mekanizması 26 Bu östrojen-progestojen kombinasyonu, luteinizan hormonun orta döngü artışını bastırarak yumurtlamayı inhibe etmek, rahim ağzı mukusunu dehidrasyon yoluyla koyultarak sperm içinbir bariyer oluşturmak ve endometriyumu implantasyona kapalı hale getirmek suretiyle etkigösterir. Ruhsatlandırma sonrası güvenlilik çalışması (PASS) VTE tanısı sıklığının düşük östrojen dozlu (<50 g,g etinilestradiol) KOK kullanıcılarında yılda 7 ila 10/10000 aralığında olduğugösterilmiştir. En yeni veriler VTE tanısı sıklığının gebe olmayan KOK kullanmayankişilerde yılda yaklaşık 4/10000, gebe kadınlarda ya da post partum süreçte ise 20 ila 30/10000 olduğunu ileri sürmektedir. KOK kullanımı ile ilişkili VTE riski östrojen bileşeninden kaynaklanır. KOK'ların progesteron bileşeni tarafından VTE riski üzerinde herhangi bir modüle etki ettiği halentartışılmaktadır. Etinilestradiol/gestoden içeren KOK'ların levonorgestrel içeren KOK'larakıyasla VTE risk artışını gösteren epidemiyolojik çalışmalar VTE riskinin hiç artmadığınıveya 3 kata kadar arttırdığını gösteren farklı sonuçlar bildirmiştir. KOK'lar gebelikten korumalarının yanı sıra, sahip oldukları bazı olumsuz özellikler dışında (Bkz. 4.4 Özel kullanım uyarıları ve önlemleri, 4.8. İstenmeyen Etkiler) doğum kontrolyöntemi seçmede yönlendirici olabilecek ek yararlar sunabilmektedir. Sikluslar daha düzenli,kanamalar sıklıkla daha az ağrılı ve daha hafiftir. Kanamaların daha hafif olması demiryetmezliği görülme olasılığını azaltır. Bunların dışında, endometriyum ile ovaryumkanserlerinde azalma gösterilmiştir. Ayrıca, daha yüksek dozlu KOK'ların (0.,05 mgetinilestradiol), ovaryum kistlerinde, pelvik inflamatuvar hastalık, benign meme hastalığı veektopik gebelik görülme sıklıklarında azalma sağladığı gösterilmiştir. Bunların düşük dozKOK'lar için de geçerli olduğu henüz gösterilmemiştir. 5.2. Farmakokinetik özelliklerGenel ÖzelliklerGestoden Emilim:27 Ağızdan alınan gestoden hızla ve tamamen emilir. Tek alımı takiben yaklaşık 1 saat sonra 4 ng/ml olan en yüksek plazma konsantrasyonlarına ulaşılır. Gestodenin mutlakbiyoyararlanımı, uygulanan dozun %99'u olarak belirlenmiştir. Dağılım:Gestodenin belirgin dağılım hacmi 0,7 l/kg olarak belirlenmiştir. Gestoden serum albuminine ve seks hormonu bağlayıcı globuline (SHBG) bağlanır. Yaklaşık olarak % 50-70 oranındaspesifik olarak SHBG'lere bağlanır ve total serum düzeylerinin yalnızca %l-2 si serbeststeroid halinde bulunur. Bağıl dağılım (serbest, albümine bağlı, SHBG'ye bağlı) serumdakiSHBG konsantrasyonlarına bağlıdır. Bağlayıcı proteinin indüklenmesinin ardından, bağlanmamış ve albümine bağlı fraksiyonlar azalırken, SHBG'ye bağlı fraksiyon artar. Biyotransformasvon:Biyotransformasyon, steroid metabolizmasının bilinen yolaklarını takip eder. Bilinen farmakolojik olarak aktif metabolit bulunmamaktadır. Serumdan metabolik klerens oranıyaklaşık 0,8 ml/dak/kg olarak belirlenmiştir. Eliminasvon:Gestoden serum düzeyleri iki fazda azalır. Terminal dispozisyon fazı 12-15 saatlik bir yanlanma ömrü ile karakterizedir. Gestoden, değişmemiş formda değil, yaklaşık 1 günlük biryarılanma ömrü ile elimine edilen metabolitler olarak atılır. Gestoden metabolitleri yaklaşık6: 4 olan idrar/safra oranında atılır. Doğrusallık / doğrusal olmavan durum:Günlük REGİNON uygulamasının tekrarlanmasının ardından, serumdaki gestoden konsantrasyonları 2,8 kat artmaktadır. Ortalama serum seviyeleri, tedavi döngüsünün ikinciyarısı boyunca ulaşılan kararlı durum koşullarında dört kat daha fazladır. Gestodenfarmakokinetiği SHBG serum seviyelerinden etkilenir. REGİNON ile tedavi sırasında, ilktedavi döngüsünde serum SHBG seviyelerinde üç katlık bir artış gözlemlenmiştir. Gestoden,SHBG'ye spesifik olarak bağlandığı için SHBG seviyelerindeki artışa neredeyse paralelolarak gestoden serum seviyelerinde artış oluşur. Üç tedavi döngüsünden sonra, döngü başınaSHBG indüksiyonunun kapsamı artık değişmez. Etinilestradiol Emilim:28 Oral olarak alınan etinilestradiol hızla ve tamamen emilir. REGİNON'un alınmasının ardından 1,4 saat içinde 82 pg/ml'lik maksimum ilaç seviyesi konsantrasyonuna erişilir. Dağılım:Etinilestradiol için yaklaşık 5 L/kg'lık görünür dağılım hacmi ve serumdan yaklaşık 5 ml/dak/kg'lik metabolik bir klerens hızı belirlenmiştir. Etinilestradiol, serum albüminineyüksek düzeyde bağlanır ancak spesifik olarak bağlanmaz. Yaklaşık %2'lik ilaç seviyeleribağlanmamış olarak kalır. Biyotransformasvon:Etinilestradiol, absorpsiyon ve ilk karaciğer geçişi sırasında metabolize olarak mutlak ve değişken oral biyoyararlanımı azalır. Eliminasvon:Etinilestradiol serum seviyeleri, 1-2 saat ve yaklaşık 20 saatlik yarı ömür ile karakterize iki aşamada düşer. Analitik nedenlere bağlı olarak bu parametreler ancak daha yüksek dozlarınuygulanmasından sonra hesaplanabilir. Değişmeyen ilaç atılmaz. Etinilestradiol metabolitleri, yaklaşık 1 günlük bir yarı ömürle 4:6 olan idrar/safra oranında atılır. Doğrusallık / doğrusal olmavan durum:Serum ve günlük alım terminal dispozisyon evresinin yarılanma ömrüne göre, kararlı durum serum seviyelerine 3-4 gün sonra ulaşılmakta olup, kararlı durum seviyeleri tekli bir dozakıyasla %30-40 daha yüksektir. Laktasyon döneminde, günlük anne dozunun %0,02'si yenidoğana süt ile aktarılabilir. Etinilestradiolün sistemik yararlanımı, diğer ilaçlarca her iki yönde etkilenebilir. Bununla birlikte, yüksek dozlarda C vitamini ile etkileşim yoktur. Etinilestradiol, sürekli kullanım sırasında SHBG veCBG'nin (kortikoid bağlayıcı globülin) hepatik sentezini indükler. Ancak SHBG indüksiyonununkapsamı, kimyasal yapıya ve eşzamanlı olarak uygulanan progestojenin dozuna göre değişir.REGİNON ile tedavi sırasında, serumdaki SHBG konsantrasyonları, 69 nmol/L'den başlayıp birincidöngüde 198 nmol/L'ye ve üçüncü döngüde 210 nmol/l'e yükselmiştir. Serum CBG konsantrasyonları37 pg/ml'den başlayıp ilk döngüde 85 pg/ml'ye çıkmış ve bundan sonra sabit kalmıştır. Klinik öncesi güvenlilik verileri :Diğer kontraseptif steroidlerle olduğu gibi etinilestradiol ve gestoden kombinasyonu, sıçan karaciğerinde artan neoplastik nodül insidansı ile ilişkilidir. Bunun insanla ilişkisi 29 bilinmemektedir. Uzun süreli oral kontraseptif kullananlarda nadiren kötü huylu karaciğer tümörleri bildirilmiştir. İlacı reçete edeni ilgilendirebilecek ve KÜB'ün diğer ilgili bölümlerine henüz dahil edilmemiş olan başka klinik öncesi güvenlik verisi mevcut değildir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiLaktoz monohidrat (sığır kaynaklı) Sodyum kalsiyum EDTA Mısır nişastasıP.V.P(K 30) Magnezyum stearat Şeker Talk Montan glycol wax Kalsiyum karbonatPolietilen glikol 6000Saf su 6.2. GeçimsizliklerGeçerli değil. 6.3. Raf ömrü36 ay 6.4. Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız. 6.5. Ambalajın niteliği ve içeriği21 ve 63 kaplı tabletlik takvimli Al/PVC blister ambalaj 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler30 Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİKOÇAK FARMA İlaç ve Kimya Sanayi AŞ. Mahmutbey Mah. Kuğu Sok. No:18 Bağcılar / İSTANBULTel. : 0212 410 39 50Faks. : 0212 447 61 65 8. RUHSAT NUMARASI(LARI)211/33 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 21.05.2007 Ruhsat yenileme tarihi: 31.05.2013 10. KÜB'ün YENİLENME TARİHİ31 |
İlaç BilgileriReginon 20 Mcg/75 Mcg Kaplı TabletEtken Maddesi: Gestoden ve Etinilestradiol Kullanma talimatı ve kısa ürün bilgileri |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.