Humalog 100 IU/ml 3 ml kartuş Kısa Ürün BilgisiSindirim Sistemi ve Metabolizma » Diyabet (Şeker Hastalığı) İlaçları » İnsülinler ve Analogları » Insulins and analogues for injection, intermediate-acting » İnsülin Lispro KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIHUMALOG 100 lU/ml 3 mİ kartuş2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Her 1 ml'de, 100 ünite (3.5 mg' a eşdeğer) rekombinant DNA orijinli, E. coli'de üretilmiş insülin lispro içerir. Her kartuşta 300 ünite insülin üsproya eşdeğer 3 mİ çözelti bulunur.Yardımcı maddeler:Her ml'de 3.15 mg metakrezol bulunur.Yardımcı maddeler için 6. Te bakmız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti.HUMALOG, steril, berrak, renksiz sıvı bir çözeltidir. 4. KLİNİK ÖZELLİKLER4.1 TerapötikendikasyonlarHUMALOG, normal glukoz horaeostazmm korunması için insüline gereksinim duyan diabetes mellituslu hastalarm tedavisinde endİkedir. HUMALOG ayrıca, diabetes mellitusun başlangıç stabilizasyonu için de endİkedİr.4.2 Pozoloji ve uygulama şekli Pozoloji:Doz, hastanın gereksinimine göre doktor tarafından belirlenmelidir.Uygulama sıklığı ve süresi:HUMALOG yemeklerden 15 dakika önce uygulanabilir. Gerek duyulduğunda HUMALOG yemeklerden hemen sonra da uygulanabilir.Uygulama şekli:HUMALOG subkütan enjeksiyon şeklinde ya da sürekli subkütan infuzyon pompası ile uygulanmalıdır; tavsiye edilmemesine rağmen intramüsküler enjeksiyon da uygulanabilir. HUMALOG gerektiğinde (ketoasidozda kan glukoz seviyesinin kontrolü, akut hastalıkta, cerrahi operasyon sırasında ve sonrasında kullanım örnek gösterilebilir) intravenöz olarak da uygulanabilir.Subkütan uygulama kolun üst kısmı, uyluk, kalça ya da karına yapılmalıdır. Enjeksiyon yapılan bölgeler değiştirilerek aynı bölgenin ayda bir seferden fazla kullanılmaması sağlanmalıdır, HUMALOG, subkütan uygulandığı sırada bir kan damarına girilmediğinden emin olunmalıdır. Uygulamadan sonra, enjeksiyon bölgesine masaj yapılmamalıdır. Hastalar uygun enjeksiyon tekniğinin kullanılması konusunda eğitilmelidir. HUMALOG etkisini çabuk gösterir ve subkütan uygulamada regüler insüline kıyasla daha kısa bir etki süresine sahiptir (2 ila 5 saat). Etkinin hızlı başlaması, HUMALOG enjeksiyonunun (ya da sürekli subkütan infuzyon şeklindeki uygulamalarda HUMALOG bolus) öğünlere çok yakın bir zamanda yapılmasına olanak verir. Herhangi bir insülinin etki süresi kişiden kişiye ya da aynı kişilerde farkh zamanlardaki uygulamalarda değişkenlik gösterebilir. Regüler insan insülinine kıyasla etkinin hızlı oluşması enjeksiyon bölgesinden bağımsızdır. Tüm insülin preparatlarında olduğu gibi HUMALOG'un etki süresi doz, enjeksiyon yeri, kanlanma, vücut sıcaklığı ve fiziksel aktiviteye bağlıdır. Doktor tarafından önerilmişse, HUMALOG daha uzun etkili insan insülinleri ile ya da oral sülfonilüre bileşikleri ile birlikte kullanılabilir. HUMALOG'un insülin infüzvon pompasıyla kullanımı:Yalnızca belirli CE-işaretli insülin infuzyon pompaları insülin lispro infüzyonunda kullanılabilir, insülin lisproyu inftize etmeden önce, uygunluğun belirlenmesi için üreticinin talimatları ya da özel pompa üzerinde çalışılmalıdır. Hastalar HUMALOG'u insülin infUzyon pompası ile birlikte kullanmadan önce insülin infuzyon pompası ile birlikte verilen talimatları ve HUMALOG'un Kullanma Talimatlarını dikkatlice okuyup uygulamalıdır ve yoğunlaştırılmış insülin tedavisi ve infüzyon pompası ve pompa aksesuarlarının fonksiyonları hakkında eğitilmelidir. Doktorlar, HUMALOG Kısa Ürün Bilgilerinde yer alan HUMALOG'un insülin infuzyon pompasıyla kullanımı bölümünü ve insülin infüzyon pompası ile birlikte verilen talimatları dikkatlice değerlendirmelidir. Pompa İçin doğru hazne ve katater kullanınız. İnfuzyon seti 48 saatte bir değiştirilmelidir. İnfüzyon seti yerleştirilirken aseptik teknik uygulanmalıdır. Açıklanamayan hipoglisemi atağı veya ketozis meydana gelirse, hızla fark edilmeli ve atak çözümleninceye kadar infüzyon durdurulmalıdır. Subkütan insülin enjeksiyonu ile ara tedavi gerekebilir. Eğer tekrarlanırsa ya da kan şekeri düzeyinizde ciddi düşüş olursa, doktorunuzu bilgilendirip insülin infüzyonunu azaltma veya durdurma gerekliliği değerlendirilmelidir. Pompadaki bozukluk veya infüzyon setindeki tıkanma giukoz seviyesinde hızlı artışa neden olabilir. İnsülin akışının kesilmesinden şüphelenilirse, ürüne ait talimatları takip edip; doktorunuzu bilgilendiriniz. İnsülin infüzyon pompası ile beraber kullanıldığında HUMALOG, seyreltilmemelİ veya diğer insülinlerie karıştırılmamalıdır. HUMALOG, infüzyon pompası İle kullanıldığında 37°C'nin üzerindeki sıcaklıklara maruz bırakılmamalıdır. İnsülin infuzyon pompasıyla HUMALOG kartuşlar 7 güne kadar kullanılabilir. İnsülinin intravenöz uvgulanımı:İnsülin lispronun intravenöz enjeksiyonu, intravenöz bolus ya da infüzyon sisteminde olduğu gibi intravenöz enjeksiyonlar için klinik uygulamalara göre yapılmalıdır. Kan şeker düzeyinin sık aralarla gözlenmesi gereklidir. İnsülin lispronun, %0.9 sodyum klorür ve %5 dekstroz içinde 0.1 U/ml ile 1.0 U/ml konsantrasyonlarındaki infüzyon sistemleri oda sıcaklığında 48 saat stabildir. Hastaya infüzyon uygulantmına başlamadan önce sistemin havasının alınması tavsiye edilir. İnsülinin kalem ile uveulanımı:Hastalar, tedaviye başlamadan önce ve reçete her yenilendiğinde ürün ile ilgili bilgileri içeren Kullanma Talimatı'nı ve kalem ile ilgili bilgileri içeren Kalem Kullanma Kılavuzu'nu okumalıdır. Hastalar, uygulama kaleminin uygun kullanımı, insülin akışı görülene kadar kalemin kullanıma hazır hale getirilmesi ve iğnelerin uygun şekilde imha edilmesi konusunda eğitilmelidir. Hastalara kalemlerini başkalarıyla paylaşmamaları tavsiye edilmelidir. Kullanım ile ilgili talimatlarHUMALOG kartuşlar CE işaretli bir kalem ile birlikte önerilen şekilde uygulanmalıdır. A) Dozun hazırlanması: HUMALOG çözehisini inceleyiniz. Berrak ve renksiz olması gerekmektedir. Eğer içeriği bulanık, koyulaşmış veya hafifçe renklenmiş görünüyorsa, ya da görülebilen katı parçacıklar varsa HUMALOG'u kullanmayınız. Aşağıdaki bilgiler genel bir açıklamadır. İğnenin takılması ve insülin enjeksiyonunun yapılması üreticinin insülin kalemiyle birlikte verdiği Kalem Kullanım Kılavuzu'na göre uygulanmalıdır. B) Dozun enjeksiyonu: 1. Ellerinizi yıkayınız. 2. Enjeksiyon bölgesini seçiniz. 3. Enjeksiyon yapılacak bölgeyi uygun şekilde temizleyiniz. 4. İğnenin dış kapağını çıkartınız. 5. Geniş bir alanı gererek ya da sıkıştırarak cildi sabitleştirin. İğneyi tarif edildiği şekilde batırınız. 6. Düğmeye basınız. 7. İğneyi enjeksiyon yerinden çıkartınız ve enjeksiyon bölgesine birkaç saniye süresince hafif bir basınç uygulayınız. Enjeksiyon bölgesini ovuşturmayınız. 8. Enjeksiyonun hemen ardından, iğnenin dış kapağını kullanarak iğneyi kalemden çıkartınız ve emniyetli bir biçimde atınız. 9. Enjeksiyon yapılan bölgeler değiştirilerek aynı bölgenin ayda bir seferden fazla kullanılmaması sağlanmalıdır. C) İn sü I i nlerin karı ştırı İması: HUMALOG kartuşlar başka bir insülini kartuş içinde karıştırmak, kartuş içerisindeki insülini seyreltmek veya tekrar doldurulmak üzere tasarlanmamıştır. Flakonlardaki insülinleri kartuşlardaki insülinler ile karıştırmayınız. HUMALOG'un diğer üreticilerin ürettiği insülinlerle veya hayvan kökenli insülin preparatlarıyla karıştırılması hakkında herhangi bir çalışma yapı İmam ıştır(Bkz. bölüm 6.2). Özel popülasyonlara ilişkin ek bilgilerBöbrek/Karaciğer yetmezliğiBöbrek yetmezliğinde insülin gereksinimi azalabilir.Karaciğer yetmezliği durumunda glukoneojenez kapasitesinin ve insülin yıkımının azalmasına bağlı olarak insülin gereksinimi azalabilir. Bununla beraber, kronik karaciğer yetmezliği olan hastalarda insülin rezistansındaki artış, insülin gereksiniminin artmasına neden olabilir. Böbrek ve karaciğer işlev bozukluğu olan hastalarda glukoz düzeylerinin izlenmesi ve insülin dozunda ayarlama gerekebilir. Pediyatrik popülasyon:HUMALOG çocuklarda yalnızca hızlı etkili insülinin etkisi daha yararlı olacaksa regüler insüline tercih edilebilir (örneğin; enjeksiyon zamanlarının öğünlerle ilişkili olarak belirlenmesi gibi).Geriyatrik popülasyon:HUMALOG yaşlılarda kullanım için uygundur.4.3 Kontrendikasyonlarİnsülin lispro veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılık.Hipoglisemi sırasında. 4.4 Özel kullanım uyanları ve önlemleri UyarılarBu insan insülin analogu regüler insan insülininden hızlı etki başlangıcı ve aktivitenin kısa olması açısından farklılık gösterir. Yemeklerle ilişkili olarak kullanddığında, HUMALOG öğünlerden 15 dakika önce ve yemeklerden hemen sonra yapılmalıdır. HUMALOG'un kısa etki süresi nedeniyle, tip I diyabetli hastalar glukoz kontrolünü sağlamak için uzun etkili insüline de ihtiyaç duyarlar (dışarıdan insülin pompası kullanımı haricinde).HUMALOG da dahil olmak üzere insülinlerle ilgili görülen en yaygın advers etki hipoglisemidir. Tüm insülinlerle olduğu gibi, hipogliseminin zamanlaması değişik insülin formülasyonlarında farklılıklar gösterir. Diyabetli hastalarda glukoz monitorizasyonu tavsiye edilir.İnsülinde yapılan herhangi bir değişiklik dikkatle ve medikal gözlem altında yapılmalıdır.Doz, marka (üretici), tip (regüler, NPH, lente v.s.), tür (hayvan, insan, insan insülin analoğu) ve/veya üretim yöntemindeki (rekombinant DNA teknolojisiyle üretilen insüline karşı hayvan kökenli insülin) farklılıklar doz ayarlanmasını gerektirebilir.ÖnlemlerGenelHastalar, insülin ve diğer alternatif tedavilerin potansiyel riskleri hakkında bilgilendirilmelidir. Hastalar ayrıca, insülinin uygun saklama koşulları, enjeksiyon teknikleri, uygulama süresi, öğün planlamasına eklenmesi, düzenli fiziksel aktivite, düzenli kan glukoz seviyesi monitorizasyonu, periyodik hemoglobin Aie testi, hipoglisemi ve hipergliseminin fark edilmesi ve yönetilmesi ve diyabet komplikasyonlarının periyodik değerlendirilmesi konusunda da bilgilendirilmelidir. Tüm insülinlerin kullanımı ile ilişkili olarak görülen potansiyel klinik advers etkiler hipoglisemi ve hipokalemidir. Tedavi edilmeyen hipokalemi solunum felci, ventriküler aritmi ve ölüme neden olabilir. HUMALOG ve diğer insülinlerin etki farklılığı nedeniyle klinik olarak, ilgili potansiyel yan etkiler görülen hastalarda (örneğin oruç tutan, otonomik nöropatisi olan veya potasyum düşürücü ilaçlar kullanan ya da serum potasyum düzeylerine hassasiyet gösteren ilaç olan hastalar) dikkat edilmelidir. Lipodistrofl ve aşırı hassasiyet tüm insülinlerin kullanımı ile oluşan diğer potansiyel klinik advers etkilerdir. Tüm insülin preparatlannda olduğu gibi, HUMALOG'un etkİ süresi değişik bireylerde ya da aynı kişide değişik zamanlarda farklılıklar gösterir ve enjeksiyon bölgesi, kan desteği, sıcaklık ve fiziksel aktiviteye bağlıdır. Hasta fiziksel aktivitesini veya her zamanki yemek planını değiştirdiğinde hangi insülin olursa olsun doz ayarlaması yapılması gerekebilir. Hastalık, duygusal rahatsızlık veya stres sırasında insülin gereksinimleri değişebilir. Hipoglisemi Diğer insülİn preparatlannda olduğu gibi, hipoglisemİk reaksiyonlar HUMALOG uygulamasıyla ilişkili olabilir. Serum glukoz konsantrasyonlarındaki hızlı değişim diyabetli hastalarda glukoz değerinden bağımsız olarak hipoglisemi semptomlarını uyarabilir. Uzun süreli diyabet, yoğun insülin tedavisi, diyabetik nöropati ya da beta blokörler gibi ilaçlar hipogliseminin erken uyan semptomlannı daha farklı ya da daha az belirgin hale getirebilir. Alerji Lokal Alerji Tüm insülin tedavilerinde olduğu gİbi, hastalarda enjeksiyon bölgesinde kızarıklık, şişkinlik veya kaşıntı olabilir. Bu minör reaksiyonlar birkaç gün İle birkaç haftada düzelir. Bazen, bu reaksiyonlar cih temizleme malzemeleri içindeki iritanlar veya uygun olmayan enjeksiyon teknikleri gibi insülinden başka faktörlerle de ilişkili olabilir. Sİstemik Alerji_ Sık olmayan ancak potansiyel olarak daha ciddi olan insüline genel alerji tüm vücutta döküntüye (kaşıntı dahil), nefes kesilmesine, tansiyon düşmesi, hızh nabız, hınitılı solunum veya terlemeye neden olabilir. Anafılaktik reaksiyonun dahil olduğu ciddi sistemik alerji vakaları hayatı tehdit edebilir. Kontrollü klinik çalışmalarda, kaşıntı (döküntü olan veya olmayan) Humulin R (N=2969) kullanan 17 hastada ve HUMALOG (N=2944)(p=0.053) kullanan 30 hastada görülmüştür. Krezolün enjeksiyonluk preparatlarda yardımcı madde olarak kullanılması sonucu lokalize reaksiyonlar ve yaygın kas ağrısı bildirilmiştir. Antikor oluşumu, Büyük klinik araştırmalarda, insan insülini ve insülin lispro ile çapraz reaksiyon gösteren antikorlar Humulin R ve HUMALOG tedavi gruplarında gözlenmiştir. Beklendiği gibi 12 aylık klinik çalışmalar sırasında antikor düzeylerindeki en büyük artış insülin tedavisine yeni başlayan hastalarda gözlenmiştir. Hastanın, başka bir insülin tipi veya markasına geçirilmesi kesinlikle tıbbi gözetim altmda gerçekleştirilmelidir. Doz, marka (üretici), tip (regüler, NPH, lente v.s.), tür (hayvan, insan, insan insülin analogu) ve/veya üretim yöntemindeki (rekombinant DNA teknolojisiyle üretilen insüline karşı hayvan kökenli insülin) farklılıklar doz ayarlanmasını gerektirebilir. Hızlı etkili insülinler için, bazal insülin kullananlar da dahil tüm hastalarda tüm gün boyunca özellikle noktürnal/açlık glukoz kontrolünü sağlamak için her iki insülinin dozu optimize edilmelidir. Hayvan kökenli insülinden insan kökenli insüline geçen birkaç hastada uyarıcı nitelikteki erken hipoglisemi semptomlarının derecesinin önceki insüline göre azaldığı ya da değişikliğe uğradığı bildirilmiştir. Düzeltilmemiş hipoglisemi ya da hİperglisemi reaksiyonları, bilinç kaybı, koma ya da ölüme neden olabilir. Yetersiz dozların kullanılması ya da tedavinin kesilmesi, özellikle insüline bağımlı diyabetlilerde ölümcül potansiyeli bulunan hiperglisemiye ve diyabetik ketoasidoza yol açabilir. Böbrek yetmezliğinde insülin gereksinimi azalabilir. Glukoneojenez kapasitesinde ve insülin yıkımında azalmaya bağlı karaciğer yetmezliği olan hastalarda insülin gereksinimi azalabilir, ancak kronik karaciğer yetmezliği olan hastalarda insülin direncindeki artış insülin gereksinimlerinde artışa yol açabilir. Hastalık ya da duygusal bozukluklarda insülin gereksiniminde artış olabilir. Fiziksel aktivitesinde artış olan ya da alıştıkları beslenme tarzını değiştiren hastalarda da doz ayarlaması gerekebilir. Öğünden hemen sonra yapılan egzersiz hipoglisemi riskini artırabilir. Hızlı etkili insülin analoglarının farmakodinamik özelliklerine bağlı olarak eğer hipoglisemi oluşursa, regüler insülinle karşılaştırıldığında enjeksiyondan sonra daha erken oluşabilir. HUMALOG çocuklarda yalnızca hızlı etkili insülİnİn etkisi daha yararlı olacaksa regüler insüline tercih edilebilir. Örneğin; enjeksiyon zamanlarının öğünlerle ilişkili olarak belirlenmesi gibi. HUMALOG'un pioglitazon İle kombine kullanımı: Özellikle kalp yetmezliği gelişimi riskini taşıyan hastalarda, pİoglİtazon insülin ile kombine olarak kullanıldığında kalp yetmezliği vakaları bildirilmiştir. Eğer HUMALOG ve pioglitazonun kombine kullanımı düşünülüyorsa, bu göz önünde bulundurulmalıdır. Kombine tedavi uygulandığında hastalar kalp yetmezliğinin belirtileri ve semptomları, kilo artışı ve ödem bakımından gözetilmelidir. Kardiyak semptomlarda bozulma olduğu takdirde pioglitazon kesilmelidir. Bu tıbbi ürün, alerjik reaksiyonlara sebep olabilecek metakrezol maddesini içermektedir. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriOral kontraseptifler, kortikosteroidler, izoniazid, niasin gibi lipid düşürücü ilaçlar, östrojen, fenotiyazinier veya tiroid replasman tedavisinde kullanılan bileşikler, danazol, beta2 stimülanlan (ritodrin, salbutamol, terbutalin) gibi hiperglisenıik aktivite gösteren ilaçlar insülin gereksiniminde artışa yol açabilir.Oral hipoglisemik ajanlar, salisilatlar (örneğin asetilsalisilik asit), sülfa grubu antibiyotikler, bazı antidepresanlar (monoamin oksidaz inhibitörleri, selektif serotonin geri alım inhibitörleri), bazı anjiyotensin dönüştürücü enzim inhibitörleri (kaptopril, enalapril), anjiyotensin II reseptör blokörleri, beta blokörler, oktreotid ya da alkol gibi hipoglisemik aktivite gösteren bileşikler kullanıldığında insülin dozunun azaltılması gerekebilir. Beta-adrenerjik blokör ilaçlar, bazı hastalarda hipogliseminin semptomlarını maskeleyebilir. HUMALOG ile birlikte başka ilaçlar kullanılırken doktora danışılmalıdır (Bkz. bölüm 4.4). Özel popülasyonlara ilişkin ek bilgilerHiçbir etkileşim çalışması yapılmamıştır.Pediyatrik popülasyon:Hiçbir etkileşim çalışması yapılmamıştır.4.6 Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi; BÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çok sayıda gebelikte maruz kalma olgularına ilişkin veriler insülin lispronun gebelik üzerinde ya da fetusun/yeni doğan çocuğun sağlığı üzerinde advers etkileri olduğunu göstermemektedir. Bugüne kadar herhangi önemli bir epidemiyolojik veri elde edilmemiştir.Gebe kadınlara verilirken tedbirli olunmalıdır. Oral kontraseptiflerin kullanımı insülin gereksiniminde artışa yol açabilir (Bkz. Bölüm 4.5) Diyabetli hastalara, gebe kaldıklarında ya da kalmayı düşündüklerinde durumu doktorlarına bildirmeleri tavsiye edilmelidir. Gebelik dönemiTeratojenik etkiler - Gebe sıçanlar ve tavşanlar üzerinde sırasıyla 4 ve 0.3 keze kadar parenteral dozlarda (vücut yüzey alanına bağlı olarak ortalama insan dozu ortalama 40 ünite/gün) üreme çalışmaları yapılmıştır. Sonuçlar, HUMALOG'un fertilitede azalmaya veya fetüste zarara yol açtığına dair herhangi bir belirti göstermemiştir. Ancak, HUMALOG'un gebe kadınlarda yapılmış yeterli sayıda kontrollü çalışması mevcut değildir. Hayvanlar üzerinde yapılan üreme çalışmaları her zaman insan üzerindeki etkilerini tahmin edebilmek için yeterli olmadığından, HUMALOG gebe kadınlara sadece kesinlikle gereksinim duyulduğunda verilmelidir.HUMALOG'un gebelik sırasında kullanımına dair kısıtlı klinik çalışma olmasına rağmen, insan insüiinleri ile yapılan yayınlanmış çalışmalar, gebelik öncesi ve gebelik sırasında postprandiyal kontrolü de içeren genel glisemik kontrolü optimize etmenin bebeğin gelişimi ile ilgili sonuçları geliştirdiğini göstermektedir. Her ne kadar maternal hiperglisemiye bağlı fetal komplikasyonlar iyi dokümante edilmişse de, maternal hipoglisemiye bağlı maternal toksisite de raporlanmıştır. Gebelik sırasında insülin lispro kullanan çok sayıda gebe kadma ait veriler, insülin lispronun gebelik üzerinde ya da fetusun/yenidoğanın sağlığı üzerinde herhangi bir advers etkisi olmadığını göstermiştir. Gebelik sırasında insülin tedavisi gören hastada (insüline bağımlı diyabet ya da gestasyonel diyabet) diyabet kontrolü büyük önem taşır. Genellikle, insülin gereksiniminde ilk trimesterde azalma, ikinci ve üçüncü trimesterlerde artış gözlenir. Diyabetli hastalara, gebe kaldıklarında ya da kalmayı düşündüklerinde durumu doktorlarına bildirmeleri tavsiye edilmelidir. Diyabetli hastaların gebeliği sırasında glukoz düzeylerinin ve genel sağlık durumlarının dikkatle izlenmesi gerekir. Laktasyon dönemiİnsülin lispronun insan ya da hayvan sütü ile atılmasma ilişkin yetersiz/sınırlı bilgi mevcuttur. Emzirilen çocuk açısından bir risk olduğu göz ardı edilemez. Emzirmenin durdurulup durdurulmayacağına ya da HUMALOG tedavisinin durdurulup/durdurulmayacağma/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve HUMALOG tedavisinin emziren anne açısından faydası dikkate alınmalıdır.Emziren diyabetli annelerin HUMALOG dozunda, beslenme tarzında ya da her ikisinde değişiklik yapılması gerekebilir. Üreme yeteneği (fertilite)Üreme yeteneği üzerinde bir etkisi bulunmamaktadır.4.7 Araç ve makine kullanımı üzerindeki etkilerHastanın konsantre olabilme ve reaksiyon gösterme yetileri, hipoglisemi nedeniyle azalabilir. Bu durum, söz konusu yetilerin özellikle önemli olduğu durumlarda (örn; araç sürme ya da makine kullanma gibi) rİsk yaratabilir.Hastalar araç kullanımı sırasında hipoglisemiyi engelleyecek Önlemler almaları konusunda uyarılmalıdır. Bu özellikle uyarıcı hipoglisemi belirtileri azalmış ya da bunların farkına varmayan ya da sık sık hipoglisemi atağı geçiren hastalarda önemlidir. Bu gibi durumlarda hasta araç kullanımı konusunda uyarılmalıdır. 4.8 İstenmeyen etkilerinsülin tedavisi gören bir diyabet hastasında en yaygın görülen yan etki hipoglisemidir, Cİddi hipoglisemi bilinç kaybına ve ileri vakalarda da ölüme neden olabilir. Hipoglisemi hem insülin dozu hem de hastanın diyeti ve egzersizi gibi diğer faktörlerin sonucu olduğundan hipoglisemi içİn spesifik bir sıklık belirlenmemiştir.Sıklıklar aşağıdaki şekilde tanımlanır: Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1,000 ila <1/100); seyrek (> 1/10,000 ila <1/1,000); çok seyrek (< 1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). İmmün sistem bozukluklarıYaygm:Lokal alerji, İnsülin enjeksiyon bölgesinde kızarıklık, şişme ve kaşıntı görülebilir. Bu durum genellikle birkaç gün ile birkaç hafta arasında ortadan kaybolur. Bazen alerji, insülinden çok, deriyi temizlemekte kullanılan tahriş edici maddelere ya da uygun olmayan enjeksiyon tekniğine bağlı olabilir. Seyrek: Sistemik alerji (insüline karşı genel bir alerji durumudur), Sistemik alerji tüm vücutta döküntülere, solunum güçlüğüne, hırıltılı solunuma, kan basıncında azalmaya, kalp ritminde artışa ya da terlemeye yol açabilir. Ciddi sistemik alerji vakaları hayatı tehdit edici özellikte olabilir. Deri ve deri altı dokusu bozukluklarıYaygın olmayan:Enjeksiyon bölgesi reaksiyonları, lipodistrofı, kaşıntı, döküntü Özellikle zayıf metabolik kontrolün yoğunlaştırılmış insülin tedavisi ile iyileştirildiği durumlar olmak üzere insülin tedavisi sırasında ödem vakaları bildirilmiştir, 4.9 Doz aşımı ve tedavisiSerum glukoz konsantrasyonları; insülin düzeyleri, kullanılabilir glukoz miktarı ve diğer metabolik süreçler arasındaki karmaşık etkileşimlerin bir sonucu olduğundan, insülinlerin spesifik bir doz aşımı tanımlaması yoktur. Hipoglisemi insülinin alınan besinlere ya da enerji harcamalarına göreceli olarak fazla gelmesinin bir sonucu olarak ortaya çıkabilir. Ürün dozunda ve öğün planında düzenleme veya egzersiz gerekebilir.Hipoglisemi ile birlikte dikkatsizlik, konfüzyon, çarpıntı, baş ağrısı, terleme ve kusma olabilir. Hafif hipoglisemi ataklan, glukoz, şeker ya da şekerli ürünlerin oral yolla alınmasına yanıt verebilir. Orta düzeyde hipoglisemi intramüsküler ya da subkütan glukagon uygulanması ve hasta yeterince iyileştikten sonra oral karbonhidrat verilmesi ile düzeltilebilir, Glukagona yanıt vermeyen hastalara, intravenöz glukoz çözehisi uygulanmalıdır. Hasta komada ise, intramüsküler ya da subkütan glukagon uygulanmalıdır. Ancak, glukagon mevcut olmadığında ya da hasta glukagona yanıt vermediğinde intravenöz glukoz çözeltisi uygulanmalıdır. Bilinç kaybı düzeldikten hemen sonra hastaya yemek yedirilmelidir. Belirgin klinik iyileşme olduktan sonra da hipoglisemi tekrarlayabileceğin den, sürekli karbonhidratlı gıda alımı sağlanmalı ve hasta gözlem altında bulundurulmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodina mi k özelliklerFarmakoterapötik grubu: Hızlı etkili insan insülin analoğu.ATC kodu; AlOA B04 Etki mekanizması: İnsülin lispronun asıl etkisi, glukoz metabolizmasının regülasyonudur. Buna ilaveten insülin çeşitli dokularda bir takım anabolik ve anti-katabolik etkilere sahiptir. Bu etkiler, kas dokusunda glikojen, yağ asitleri, gliserol ve protein sentezi ile amino asit aliminin artışı, glikojenoliz, glikoneojenez, ketojenez, lipoliz, protein katabolizması ve amino asit açığa çıkışının azalması biçiminde gerçekleşir. İnsülin lispronun hızlı bir etki başlangıcına sahip olması (yaklaşık 15 dakika), regüler insüline göre öğünlere daha yakın uygulanmasına olanak verir; regüler insülin, öğünlerden 30 ila 45 dakika önce, insülin lispro ise öğüne başlamadan hemen önce ya da 15 dakika öncesine kadar uygulanabilir. Regüler insülin ile karşılaştırıldığında, etkisi daha hızlı ve daha kısa sürelidir (2-5 saat). Tip 1 ve tip 2 diyabetli hastalarda yapılan klinik çalışmalar insülin lispro ile postprandiyal hiperglİseminin regüler insüline göre daha iyi kontrol edildiğini göstermiştir. Tüm insülin preparatlarında olduğu gibi insülin lispronun etkİsİ kişiden kişiye değiştiği gibi, aynı kişide farklı zamanlarda da değişkenlik gösterir. Etki süresi doz, enjeksiyon bölgesi, kanlanma, sıcakhk ve fiziksel aktiviteye bağlıdır. Subkütan enjeksiyondan sonra tipik aktivite profili aşağıda gösterilmiştir. Hipog lisem ik aktivite 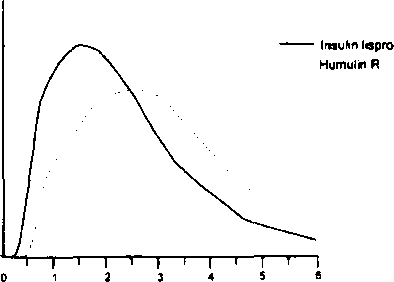 Zaman, saat
Zaman, saatYukarıdaki şekil, kişinin kan glukoz konsantrasyonlarını açlık kan şekerinin seviyesine yakın düzeylerde tutmak İçin gerekli glukoz miktarını yansıtmakta olup bu, insülinlerin zaman içinde glukoz metabolizması üzerindeki etkilerinin bir göstergesidir. Çocuklarda (2 ila 11 yaş arasındaki 6! hasta) ve çocuklar ile adolesanlarda (9 ila 19 yaş arasındaki 481 hasta) insülin lispro ile regüler insan insülinini karşılaştıran klinik çalışmalar yürütülmüştür. İnsülin lispronun çocuklardaki farmakodinamik profili yetişkinlerde gözlenen ile benzerdir. Subkütan infüzyon pompası ile kullanıldığında insülin lispro ile tedavinin, regüler insan insülinine göre daha düşük bir glikozile hemoglobin düzeyi oluşturduğu görülmüştür. Bir çift kör, çapraz çalışmada 12 haftalık uygulama sonrasında glikozile hemoglobin düzeylerindeki düşme insülin lispro ile 0.37 yüzde puan ve regüler insülin için 0.03 yüzde puan olmuştur (p= 0.004). Çok yüksek dozlarda sülfonilüre alan tip 2 diyabetli hastalarda yapılan çalışmalar, sülfonilüre ile beraber insülin lispro kullanımınm, tek başma sülfonilüre kullanımma göre, HbAic'yi belirgin oranda azalttığını göstermiştir. HbAı^'deki bu azalma diğer insülin ürünleri (Örn: regüler ve izofan insülin) ile de beklenir. Tip 1 ve tip 2 diyabetli hastalarda yapılan klinik çalışmalar, insülin lispro kullanan hastalarda regüler insüline göre gece hipoglisemisi epizodlarının azaldığını göstermiştir. Bazı çalışmalarda gece hipoglisemisindeki azalma gündüz hipoglisemisindeki artışla ilişkilidir. İnsülin lisproya gelen glukodinamik cevap böbrek veya karaciğer fonksiyon bozukluğundan etkilenmez. Bir glukoz klamp çalışması sırasında insülin lispro ile regüler insan insülini arasındaki glukodinamik farklılıklar böbrek fonksiyonların derecesi farklı olan birçok hasta üzerinde ortaya konmuştur. İnsülin lispronun molar açıdan insan insülİnİne eşdeğer olduğu belirlenmiştir ancak insülin lispro daha hızlı ve daha kısa süreli etkiye sahiptir. 5.2 Farmakokinetik özelliklerGenel ÖzelliklerEmilim:HUMALOG'un biyoyararlanımı regüler insan insülini İle aynı olup mutlak biyoyararlanımı, 0.1 ila 0.2 U/kg dozları arasında %55-%77 arasındadır. Diyabetik olmayanlar ve tip 1 (insüline bağımlı) diyabetli hastalarda yapılan çalışmalarda HUMALOG'un regüler insan insülinininden (U-100) daha hızlı emildiği gösterilmiştir. Diyabetik olmayanlara 0.1-0.4 U/kg dozlarda subkütan olarak verilen HUMALOG ile doruk serum konsantrasyonu dozlama sonrası 30-90. dakikalarda gözlenmiştir. Diyabetik olmayanlar regüler insan insülini ile eşdeğer dozlar aldığında doruk serum konsantrasyonları dozlamadan 50-120. dakikalarda oluşmuştur. Benzer sonuçlar tip 1 diyabetli hastalarda görülmüştür. Diyabetik olmayanlara intravenöz yolla uygulandığında HUMALOG ve regüler insan insülininin farmakokinetik profilleri karşılaştırılabilir. Sağlıklı erkek gönüllülere 0.2 U/kg regüler insan insülini veya diyabetli hastalarca en çok kullanılan 3 bölge olan abdominal, deltoİd veya femoral bölgelere subkütan yapıldığında HUMALOG regüler insan insülinine göre sürekli hızlı hızda emilir. HUMALOG'un abdominal uygulamasından sonra serum ilaç düzeyleri daha yüksek ve etki süresi deltoid ve kalçadan uygulama sonrası kısmen kısadır (bkz. Pozoloji ve uygulama şekli). HUMALOG regüler insan insülinine göre daha az hasta ve hastalar arası değişkenlik gösterir.
HumulinR(n=10) l[umalog(n=10) (Ortalama doz= 15.4 U) 
PFr-'eorrfı-r 139 W Süre (^dakika) ¦"Tf-rr"I' 4»
?Û
eo
to
10 ..3AQ m
«M
e B y> C
S e d> LO
3 CCRegüler insan insülini veya HUMALOG'un tip 1 diyabetli 10 hastada yüksek karbonhidratlı yemek öncesi yapılan subkütan enjeksiyonu sonrası serum HUMALOG ve insülİB dUzeyleri** 0.2 mU/dak/kg insan insülin infiizyonu ile insülin konsantrasyonunun taban çizgisi sağlanmaktadır.Böbrek yetmezliği olan hastalarda, regüler insan insülİni ile karşılaştırıldığında, insülin lispro daha hızlı emilir. Böbrek fonksiyonlarının derecesi farklı olan tip 2 diyabetli hastalarda insülin lispro ve regüler insan insülini arasındaki farmakokinetik farklılıkların böbrek fonksiyonundan bağımsız olduğu gösterilmiştir. Karaciğer yetmezliği olan hastalarda, regüler insan insülini ile karşılaştırıldığında, insülin lispro daha hızlı emilir ve atılır. Darılım:HUMALOG'un dağılım hacmi insan regüler İnsülininki ile aynı olup 0.26 ila 0.36 L/kg aralığındadır. Bivotransformasvon:İnsan metabolizma çalışmaları yürütülmemiştir. Ancak, hayvan çalışmaları HUMALOG metabolizmasının insan regüler insülininkİyle aynı olduğunu göstermektedir. Eliminasvon:Subkütan olarak verildiğinde HUMALOG'un yanlanma ömrü regüler insülininkinden daha kısadır (sırasıyla, 1 saate karşılık 1.5 saat). İntravenöz olarak verildiğinde HUMALOG ve insan regüler insülini sırasıyla 0.1 U/kg ve 0.2 U/kg dozlarında 26 ve 52 dakikalık yarılanma ömrü İle aynı bir doza-bağımlı elimİnasyon sergilemiştir. Do&rusallık/doğrusal olmayan durum:Veri yoktur. Hastalardaki karakteristik özelliklerVeri yoktur.Farmakokinetik/farmakodinamik özelliklerVeri yoktur.5.3 Klinik öncesi güvenlilik verileriİn vitrotestlerde insüUn reseptör bölgelerine bağlanma ve büyüme hücreleri üzerine etkileri incelendiğinde insülin lispro insan insülinine benzerlik göstermiştir. Ayrıca yapılan çalışmalarda, insülin lispronun bağlanmış olduğu insülin reseptörlerinden ayrılma özelliğinin insan insülini ile aynı olduğu görülmüştür. Akut, 1 ay ve 12 ay süreli toksisite çalışmaları anlamlı toksisite bulgulan göstermemiştir.Yapılan hayvan çalışmalarında, insülin lispro fertilite bozulması, embriyotoksisite ya da teratojenite üzerinde bir etkide bulunmamıştır, 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiMetakrezol (3.15 mg/ml)Gliserol Dibazik sodyum fosfat.7 H2O Çinko oksit Enjeksiyonluk su pH'ı 7.0 - 7.8 a ayarlamak için hidroklorik asİt ve sodyum hidroksit kullanılabilir. 6.2 GeçimsizliklerHUMALOG diğer üreticilerin ürettiği İnsülinterle veya hayvan kökenli insülin preparatlanyla karıştırılmamalıdır. Bu tıbbi ürün, bölüm 4.2'de belirtilenler dışındaki tıbbi ürünlerle karıştırılmamalıdır.6.3 Raf ömrüKullanımdan önce:36 ay Kullanıma başladıktan sonra: 28 gün 6.4 Saklamaya yönelik özel uyanlarKullanımdan önce:Buzdolabmda 2-8C arasında saklayınız. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız. Aşırı sıcak ve direkt güneş ışığı altında bırakmayınız. Kullanıma başladıktan sonra: Kartuş kaleme yerleştirildikten sonra çözelti 30"*C'nin altındaki sıcaklıklarda saklanarak 28 gün boyunca kullanılabilir. Bu süreden sonra kullanılmamalıdır. Buzdolabmda saklamayınız. Kaleme yerleştirilmiş kartuşları iğne takılı olarak saklamayınız. 6.5 Ambalajın niteliği ve içeriğiÇözelti, butil veya halobutil disk kapak ve piston ve alüminyum emniyet kapsülü ile kapatılmış tip I flint cam kartuşlardadır. Kartuş tıpası ve/veya cam kartuş dimetikon veya silikon emülsiyonu ile muamele edilmiş olabilir.5 X 3 mİ HUMALOG 100 lU/ml 3 mİ kartuş 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Kullanılmamış olan ürünler ya da atık materyaller, 'Tıbbi atıkların kontrol yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmeli ki eri'ne uygun olarak imlıa edilmelidir. 7. RUHSAT SAHİBİ Lilly İlaç Ticaret Limited Şirketi Kuşbakışı cad. Rainbovv PlazaNo:4 Kat:3 34662 Altunizade - İstanbul Tel : O 216 554 00 00 Faks : 0 216 474 71 99 8. RUHSAT NUMARASI 108/24 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ İlk ruhsatlandırma tarihi: 1 Ağustos 2000 Ruhsat yenileme tarihi: 26 Aralık 2005 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriHumalog 100 IU/ml 3 ml kartuşEtken Maddesi: insülin lispro Atc Kodu: A10AC04 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.