Cabometyx 20 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ^^Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERİ TIBBİ ÜRÜNÜN ADICABOMETYX 20 mg film kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her film kaplı tablette 20 mg kabozantinibe eşdeğer 25,34 mg kabozantinib (S)-malat bulunur. Yardımcı madde(ler):Laktoz................15,54 mg Kroskarmeloz sodyum............4,80 mg Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMFilm kaplı tablet.Tabletler sarı renklidir, yuvarlak biçimli, çentiksizdir ve bir yüzünde XL, diğer yüzünde ise 20 yazısı bulunur. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarRenal Hücreli Karsinom (RHK)CABOMETYX, metastatik şeffaf hücreli renal hücreli karsinom (RHK) tanısı almış, ilerlemiş renal hücreli karsinomda monoterapi olarak; - Orta ve yüksek riskli yetişkin hastaların birinci basamak tedavisinde (bkz. Bölüm 5.1), - Daha önce uygulanan vasküler endotelyal büyüme faktörü (VEGF)-hedefli tedaviyitakiben ikinci basamakta veya anti-PD/PDLl tedavi sonrası anti-VEGF tedavi olarakkullanımı endikedir (bkz. Bölüm 5.1). CABOMETYX, nivolumab ile kombinasyon halinde yetişkinlerde, Karnofsky Performans Skalası 70 ve üzerinde olan, aktif beyin metastazı olmayan, ilerlemiş şeffaf hücreli böbrekkarsinomun birinci basamak tedavisinde endikedir (bkz. Bölüm 5.1). 1 / 36 Hepatoselüler Karsinom (HSK)CABOMETYX, daha önce sorafenib ile tedavi edilen yetişkinlerde, Child-Pugh A olarak sınıflandırılan hepatoselüler karsinomun (HSK) tedavisi için monoterapi olarak endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:CABOMETYX tedavisi yalnızca kanser ilaçlarının uygulamasında deneyimli bir hekim tarafından başlatılmalıdır. PozolojiCABOMETYX tabletler ile kabozantinib kapsüller biyoeşdeğer değildir ve birbirleri yerine kullanılmamalıdır (bkz. Bölüm 5.2). Monoterapi olarak CABOMETYXRHK ve HSK için önerilen CABOMETYX dozu günde bir kez alınan 60 mg'dir. Tedavi, hastanın tedaviden daha fazla klinik yarar sağlamadığı zamana kadar veya kabul edilemeztoksisite ortaya çıkana kadar sürdürülmelidir. Birinci basamak ilerlemiş RHK'da nivolumabla kombinasyon halinde CABOMETYXÖnerilen CABOMETYX dozu, her 2 haftada bir 240 mg ya da her 4 haftada bir 480 mg olacakşekilde intravenöz yoldan uygulanan nivolumab ile kombinasyon halinde günde bir kez 40mg'dır. CABOMETYX tedavisine, hastalık progresyonuna veya kabul edilemez toksisiteortaya çıkana kadar devam edilmelidir. Nivolumaba hastalık progresyonuna, kabul edilemeztoksisite ortaya çıkana kadar veya hastalık progresyonu olmayan hastalarda 24 aya kadar devamedilmelidir (nivolumab pozolojisi için Kısa Ürün Bilgisine (KÜB) bakınız).Tedavi değişikliğiŞüpheli advers ilaç reaksiyonlarının yönetimi, tedavinin geçici olarak durdurulmasını ve/veya CABOMETYX dozunun azaltılmasını gerektirebilir (bkz. Tablo 1). Monoterapide doz azaltımıgerekli olduğunda dozun günde 40 mg'ye ve ardından günde 20 mg'ye düşürülmesi önerilir. CABOMETYX nivolumab ile kombinasyon halinde uygulandığında, dozun günde bir kez 20 mg CABOMETYX'e ardından iki günde bir 20 mg'ye düşürülmesi önerilir (nivolumab içinönerilen tedavi değişikliği konusunda nivolumab KÜB'üne bakınız). CTCAE derece 3 veya üzeri toksisitelerin veya tolere edilemeyen derece 2 toksisitelerin tedavisi için doza ara verilmesi önerilmektedir. Devam etmesi durumunda ciddileşebilecekveya tolere edilemez hale gelebilecek olaylarda dozun azaltılması önerilmektedir. Bir dozun atlanması durumunda bir sonraki doza 12 saatten kısa bir süre kaldıysa atlanmış olan doz alınmamalıdır. 2 / 36
Eş zamanlı tıbbi ürünlerCYP3A4'ü güçlü şekilde inhibe eden eşzamanlı tıbbi ürünler dikkatli şekilde kullanılmalıdır ve CYP3A4'ün güçlü indükleyicileri olan eşzamanlı ürünlerin kronik kullanımındankaçınılmalıdır (bkz. Bölüm 4.4 ve 4.5). 3 / 36 CYP3A4'ü indükleme veya inhibe etme potansiyeli minimal olan veya hiç olmayan alternatif bir eşzamanlı tıbbi ürünün seçilmesi düşünülmelidir. Uygulama şekli:CABOMETYX oral kullanıma yöneliktir. Tabletler bütün halde yutulmalı, çiğnenmemelidir. Hastalara CABOMETYX almadan önceki en az 2 saat ve aldıktan sonraki 1 saat süresincehiçbir şey yememesi söylenmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Kabozantinib hafif veya orta derecede böbrek yetmezliği bulunan hastalarda dikkatli şekilde kullanılmalıdır. Şiddetli böbrek yetmezliği bulunan hastalarda kabozantinibin güvenlilik veetkililiği kanıtlanmadığından bu popülasyonda kullanımı önerilmez. Karaciğer yetmezliği:Hafif karaciğer yetmezliği olan hastalarda doz ayarlaması gerekmez. Orta derecede karaciğer yetmezliği olan hastalar (Child Pugh B) için sınırlı veri bulunduğundan, herhangi bir doz önerisisağlanamaz. Bu hastalarda genel güvenliğin yakından takip edilmesi önerilmektedir (bkz.Bölüm 4.4 ve 5.2). Şiddetli karaciğer yetmezliği olan hastalarda (Child Pugh C) klinik deneyimyoktur, bu nedenle bu hastalarda kabozantinib kullanılması önerilmemektedir (bkz. Bölüm 5.2). Kardiyak yetmezliği:Kardiyak yetmezliği olan hastalara ilişkin veriler sınırlıdır. Herhangi bir spesifik doz önerisinde bulunulamamaktadır. Pediyatrik popülasyon:Kabozantinibin çocuklar ve 18 yaş altı adolesanlardaki güvenliliği ve etkililiği henüz kanıtlanmamıştır. Veri mevcut değildir. Geriyatrik popülasyon:Yaşlı hastalarda (> 65 yaş) kabozantinib kullanılırken herhangi bir spesifik doz ayarlaması önerilmez. Irk:Etnik kökene göre doz ayarlaması gerekmez (bkz. Bölüm 5.2). 4.3. KontrendikasyonlarEtkin madde veya bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılık. 4.4. Özel kullanım uyarıları ve önlemleriAdvers reaksiyonların çoğu tedavinin erken dönemlerinde ortaya çıktığından, tedaviyi uygulayan hekim doz değişikliklerinin gerekli olup olmadığını belirlemek için tedavinin ilksekiz haftasında hastayı yakından değerlendirmelidir. Genel olarak erken dönemde başlayanadvers reaksiyonlar arasında hipokalsemi, hipokalemi, trombositopeni, hipertansiyon, palmar- 4 / 36 plantar eritrodizestezi sendromu (PPES), proteinüri ve gastrointestinal (Gİ) olaylar (abdominal ağrı, mukozal enflamasyon, konstipasyon, diyare, kusma) yer alır. Şüpheli advers ilaç reaksiyonlarının yönetimi, kabozantinib tedavisinin geçici olarak durdurulmasını ya da dozun azaltılmasını gerektirebilir (bkz. Bölüm 4.2).Pivot klinik çalışmada (METEOR) renal hücreli karsinomda önceki vasküler endotelyal büyüme faktörü (VEGF)-hedefli tedaviyi takiben, bir advers olaydan (AO) kaynaklanan dozazaltımı ve doza ara verme olayları kabozantinible tedavi uygulanan hastaların sırasıyla%59,8'inde ve %70'inde ortaya çıkmıştır. Hastaların %19,3'ünde iki doz azaltımı gerekliolmuştur. İlk doz azaltımına kadar geçen medyan süre 55 gün, ilk doza ilk ara vermeye kadar geçen medyan süre ise 38 gün olmuştur. Klinik çalışmada (CABOSUN) daha önce tedavi uygulanmamış renal hücreli karsinomda doz azaltımı ve doz kesme olayları kabozantinible tedavi uygulanan hastaların sırasıyla %46'sındave %73'ünde ortaya çıkmıştır. Kabozantinib birinci basamak ilerlemiş renal hücreli karsinomda nivolumab ile kombinasyon halinde kullanıldığında, klinik çalışmada (CA2099ER) bir AO nedeniyle kabozantinib ile dozazaltımı ve doz kesintileri hastaların %54,1 ve %73,4'ünde ortaya çıkmıştır. Hastaların%9,4'ünde iki doz azaltımı gerekli olmuştur. İlk doz azaltımına kadar geçen medyan süre 106gün, ilk doz kesintisine kadar geçen medyan süre ise 68 gün olmuştur. Klinik çalışmada (CELESTIAL), daha önce uygulanmış olan sistemik tedaviyi takiben hepatoselüler karsinomda doz azaltımı ve doz kesme olayları kabozantinib ile tedavi edilenhastaların sırasıyla % 62 ve % 84'ünde ortaya çıkmıştır. Hastaların% 33'ünde iki doz azaltımıgerekmiştir. İlk doz azaltımına kadar geçen medyan süre 38 gün, ilk doz durdurmaya kadargeçen medyan süre ise 28 gün olmuştur. Hafif veya orta derecede karaciğer yetmezliği olanhastaların daha yakından takip edilmesi önerilmektedir. HepatotoksisiteKabozantinib ile tedavi edilen hastalarda karaciğer fonksiyon testlerinde anormallikler (alanin aminotransferaz [ALT], aspartat aminotransferaz [AST] ve bilirubinde artışlar) sıklıklagözlenmiştir. Kabozantinib tedavisine başlamadan önce karaciğer fonksiyon testlerinin (ALT,AST ve bilirubin) yapılması ve tedavi sırasında yakından izlenmesi önerilmektedir.Kabozantinib tedavisi ile ilgili olduğu düşünülen karaciğer fonksiyon testleri kötüleşen hastalariçin (yani alternatif bir neden bulunmadığı durumlarda), Tablo 1'deki doz değişikliğitavsiyesine uyulmalıdır (bkz. Bölüm 4.2). Cabozantinib, nivolumab ile kombinasyon halinde verildiğinde, ilerlemiş RCC hastalarında kabozantinib monoterapisine göre 3. ve 4. derece ALT ve AST artışlarının daha sık olduğubildirilmiştir (bkz. Bölüm 4.8). Karaciğer enzimleri tedavi başlamadan önce ve tedavi sırasındaperiyodik olarak izlenmelidir. Her iki ilacın tıbbi yönetim kılavuzları izlenmelidir (bkz. Bölüm4.2 ve nivolumab KÜB). Kabozantinib, esas olarak hepatik yolla elimine edilir. Hafif veya orta dereceli karaciğer yetmezliği olan hastalarda genel güvenliğin daha yakından izlenmesi önerilmektedir (ayrıcabkz. Bölüm 4.2 ve 5.2). Orta derecede karaciğer yetmezliği olan hastaların (Child-Pugh B) 5 / 36 göreceli olarak daha yüksek oranında kabozantinib tedavisi ile hepatik ensefalopati gelişmiştir. CABOMETYX'in şiddetli karaciğer yetmezliği olan hastalarda kullanılması önerilmemektedir.(Child-Pugh C, bkz. Bölüm 4.2) Hepatik ensefalopatiHSK çalışmasında (CELESTIAL), hepatik ensefalopati kabozantinibte plasebo kolundan daha sık rapor edilmiştir. Kabozantinib, diyare, kusma, iştah azalması ve elektrolit anormallikleri ileilişkilendirilmiştir. Karaciğer yetmezliği olan HSK hastalarında, bu hepatik olmayan etkilerhepatik ensefalopati gelişimi için hızlandırıcı faktör olabilir. Hastalar hepatik ensefalopatibulguları ve semptomları açısından izlenmelidir. Perforasyonlar ve fistüllerKabozantinible ciddi, bazen ölümcül olan Gİ perforasyonlar ve fistüller gözlenmiştir. Enflamatuvar bağırsak hastalığı (örneğin Crohn hastalığı, ülseratif kolit, peritonit, divertikülitveya apandisit), Gİ kanalda tümör infiltrasyonu görülen veya daha önce uygulanmış Gİameliyatında komplikasyonlar (özellikle gecikmiş veya tam olmayan iyileşme ile ilişkili ise)yaşamış olan hastalar kabozantinib tedavisine başlanmadan önce dikkatli şekildedeğerlendirilmelidir ve sonrasında apse ve sepsis dahil perforasyon ve fistül semptomlarıaçısından yakından takip edilmelidir. Tedavi sırasında geçmeyen veya tekrarlayan diyare analfistül oluşumu açısından bir risk faktörü olabilir. Yeterli düzeyde kontrol altına alınamayanfistül veya Gİ perforasyon görülen hastalarda kabozantinib kesilmelidir. Gastrointestinal (Gİ) hastalıklarıDiyare, bulantı/kusma, iştah azalması ve stomatit/ağızda ağrı en sık bildirilen Gİ olaylardan bazılarıdır (bkz. Bölüm 4.8). Dehidrasyonu, elektrolit dengesizliklerini ve kilo kaybını önlemekiçin antiemetikler, antidiyareik ilaçlar veya antasitler ile destekleyici bakım da dahil olmaküzere, derhal tıbbi tedavi yapılmalıdır. Sürekli veya tekrarlayan önemli Gİ advers reaksiyonlarıdurumunda, doz kesme veya azaltımı veya kabozantinibin kalıcı olarak kesilmesidüşünülmelidir (bkz. Tablo 1). Tromboembolik olaylarKabozantinib ile pulmoner embolizmi ve bazen ölümcül olan arteriyel tromboembolizmi de içeren venöz tromboembolizm olayları gözlenmiştir. Bu olaylar açısından risk altında olan veyabu olayları içeren bir öyküye sahip olan hastalarda kabozantinib dikkatli kullanılmalıdır. HSKçalışmasında (CELESTIAL), bir ölümcül olay da dahil olmak üzere kabozantinib ile portal ventrombozu gözlenmiştir. Portal ven invazyon öyküsü olan hastaların portal ven trombozugelişme riskinin daha yüksek olduğu görülmüştür. Akut miyokard enfarktüsü veya klinik açıdananlamlı başka herhangi bir tromboembolik komplikasyon yaşayan hastalarda kabozantinibkesilmelidir. HemorajiKabozantinib kullanımı ile birlikte bazen ölümcül olan şiddetli hemoraji gözlenmiştir. Şiddetli kanama öyküsüne sahip olan hastalar kabozantinib tedavisine başlanmadan önce dikkatlişekilde değerlendirilmelidir. Şiddetli kanama görülen veya şiddetli kanama riski altında olanhastalara kabozantinib uygulanmamalıdır. 6 / 36 HSK çalışmasında (CELESTIAL), ölümcül hemorajik olayların, plaseboya göre kabozantinib ile daha sık görüldüğü rapor edilmiştir. İlerlemiş HSK popülasyonunda ciddi hemoraji içinzemin hazırlayan risk faktörleri, majör kan damarlarının tümör invazyonu ve altta yatankaraciğer sirozu ile sonuçlanan özofagus varislerinin varlığı, portal hipertansiyon vetrombositopeni olabilir. CELESTIAL çalışmasında, birlikte antikoagülasyon tedavisi veyaantiplatelet ajanları alan hastalar hariç tutulmuştur. Ayrıca, tedavi edilmemiş veya tamamentedavi edilmemiş kanamalı veya kanama riski yüksek varisleri olan hastalar da bu çalışmadandışlanmıştır. Birinci basamak ilerlemiş RHK'de nivolumabla kombinasyon halindeki kabozantinib çalışmasında (CA2099ER) terapötik dozlarda antikoagülanlar kullanan hastalar dışarıdabırakılmıştır. Anevrizmalar ve arter diseksiyonlarıVEGF yolak inhibitörlerinin, hipertansiyonu olan veya olmayan hastalarda kullanılması, anevrizmalar ve/veya arter diseksiyonlarının oluşumunu kolaylaştırabilir. CABOMETYXbaşlamadan önce hipertansiyon veya anevrizma öyküsü gibi risk faktörleri olan hastalarda burisk dikkatle değerlendirilmelidir. TrombositopeniHSK çalışmasında (CELESTIAL), trombositopeni ve trombosit azalması bildirilmiştir. Trombosit seviyeleri kabozantinib tedavisi sırasında izlenmeli ve trombositopenininciddiyetine göre doz değiştirilmelidir (bkz. Tablo 1). Yara komplikasyonlarıKabozantinib ile birlikte yara komplikasyonları gözlenmiştir. Kabozantinib tedavisi mümkünse dental cerrahi operasyonlar veya invaziv dental prosedürler dahil olmak üzere planlıcerrahilerden en az 28 gün önce kesilmelidir. Cerrahiden sonra kabozantinib tedavisine devametme kararı yeterli yara iyileşmesine ilişkin klinik karara göre verilmelidir. Tıbbi müdahalegerektiren yara iyileşmesi komplikasyonları yaşayan hastalarda kabozantinib kesilmelidir. HipertansiyonKabozantinib kullanımı ile birlikte hipertansiyon gözlenmiştir. Kabozantinib tedavisine başlanmadan önce kan basıncı iyi şekilde kontrol altına alınmalıdır. Kabozantinib tedavisisırasında tüm hastalar hipertansiyon açısından izlenmeli ve gerektiğinde standart anti-hipertansif tedavi uygulanmalıdır. Anti-hipertansiflerin kullanılmasına karşın devam edenhipertansiyon vakalarında kabozantinib dozu azaltılmalıdır. Hipertansiyon şiddetliyse ve anti-hipertansif tedavisine ve kabozantinib dozunun azaltılmasına karşın devam ediyorsa kabozantinib kesilmelidir. Hipertansif kriz durumunda kabozantinibkesilmelidir. Osteonekroz Kabozantinib kullanımı ile birlikte çene osteonekrozu (ÇON) olayları gözlenmiştir. Kabozantinib tedavisine başlanmadan önce ve kabozantinib tedavisi boyunca periyodik olarakoral muayene yapılmalıdır. Hastalara ağız hijyeni uygulamaları konusunda bilgi verilmelidir. 7 / 36 Kabozantinib tedavisi, mümkünse, planlanan diş cerrahisi veya invaziv diş prosedürlerinden en az 28 gün önce durdurulmalıdır. Bifosfonatlar gibi ÇON ile ilişkili ajanları alan hastalardadikkatli olunmalıdır. ÇON yaşayan hastalarda kabozantinib kesilmelidir. Palmar-plantar eritrodizestezi sendromuKabozantinib kullanımı ile birlikte palmar-plantar eritrodizestezi sendromu (PPES) gözlenmiştir. PPES şiddetli olduğunda kabozantinib tedavisine ara verilmesi düşünülmelidir.PPES derece 1'e gerilediğinde kabozantinib tedavisi daha düşük bir dozla yenidenbaşlatılmalıdır. Proteinüri Kabozantinib kullanımı ile birlikte proteinüri gözlenmiştir. Kabozantinib tedavisi sırasında idrardaki protein düzeyi düzenli şekilde izlenmelidir. Nefrotik sendrom gelişen hastalardakabozantinib kullanımı kesilmelidir. Posterior reversibl ensefalopati sendromuKabozantinib kullanımı ile birlikte Posterior Reversibl Ensefalopati Sendromu (PRES) gözlenmiştir. Nöbetler, baş ağrısı, görme bozuklukları, konfüzyon veya zihinsel fonksiyondeğişikliklerinin de aralarında olduğu birden fazla semptom sergileyen tüm hastalarda busendrom düşünülmelidir. PRES gözlenen hastalarda kabozantinib tedavisi kesilmelidir. QT aralığında uzamaKabozantinib QT aralığı uzaması öyküsüne sahip hastalarda, anti-aritmikler alan hastalarda veya önceden mevcut önemli kardiyak hastalık, bradikardi veya elektrolit bozuklukları olanhastalarda dikkatli şekilde kullanılmalıdır. Kabozantinib kullanılırken tedavi sırasında EKG veelektrolitlerin (serum kalsiyum, potasyum ve magnezyum) izlenmesini de içeren periyodiktakip düşünülmelidir. Tiroid disfonksiyonuTüm hastalarda başlangıçta tiroid fonksiyonunun laboratuvar ölçümü önerilir. Önceden hipotiroidizmi veya hipertiroidizmi olan hastalar, kabozantinib tedavisine başlamadan öncestandart tıbbi uygulamaya göre tedavi edilmelidir. Kabozantinib tedavisi sırasında tüm hastalartiroid disfonksiyonunun belirti ve semptomları açısından yakından izlenmelidir. Kabozantinibtedavisi boyunca tiroid fonksiyonu periyodik olarak izlenmelidir. Tiroid disfonksiyonu gelişenhastalar standart tıbbi uygulamaya göre tedavi edilmelidir. Biyokimyasal laboratuvar test anormallikleriKabozantinib, artan elektrolit anormallikleri (hipo ve hiperkalemi, hipomagnezemi, hipokalsemi, hiponatremi dahil) insidansı ile ilişkilendirilmiştir. Kabozantinib tedavisisırasında biyokimyasal parametrelerin izlenmesi ve gerektiğinde standart klinik uygulamayagöre uygun replasman tedavisi başlatılması önerilmektedir. Kabozantinib tedavisi sırasındabiyokimyasal parametrelerin izlenmesi ve gerektiğinde standart klinik uygulamaya göre uygunreplasman tedavisi başlatılması önerilmektedir. HSK hastalarında hepatik ensefalopati vakalarıelektrolit bozukluklarının gelişmesine bağlanabilir. Sürekli veya tekrarlayan önemli 8 / 36 anormallikler olması durumunda doz kesme veya azaltımı veya kabozantinibi kalıcı olarak kesme düşünülmelidir (bkz. Tablo 1). CYP3A4 indükleyicileri ve inhibitörleriKabozantinib bir CYP3A4 substratıdır. Kabozantinibin güçlü CYP3A4 inhibitörü ketokonazolle eş zamanlı uygulanması kabozantinibin plazma maruziyetinde bir artışa nedenolmuştur. Kabozantinib güçlü CYP3A4 inhibitörleri olan ajanlarla birlikte uygulanırkendikkatli olunması gerekmektedir. Kabozantinibin güçlü CYP3A4 indükleyici rifampisinle eşzamanlı uygulanması kabozantinibin plazma maruziyetinde bir düşüşe neden olmuştur. Bunedenle güçlü CYP3A4 indükleyiciler olan ajanların kronik şekilde kabozantinible birlikteuygulanmasından kaçınılmalıdır (bkz. Bölüm 4.2 ve 4.5). P-glikoprotein substratlarıMDCK-MDR1 hücrelerinin kullanıldığı iki yönlü bir tayinde kabozantinibin P-glikoprotein (P-gp) transportunun substratı değil bir inhibitörü (IC50 = 7,0 ^M) olduğu görülmüştür. Bu nedenle kabozantinib, eşzamanlı uygulanan P-gp substratlarının plazma konsantrasyonlarını artırmapotansiyeline sahip olabilir. Hastalar kabozantinib kullanırken P-gp substratı (örneğin feksofenadin, aliskiren, ambrisentan, dabigatran eteksilat, digoksin, kolşisin, maravirok, posakonazol, ranolazin, saksagliptin,sitagliptin, talinolol, tolvaptan) alımı konusunda uyarılmalıdır (bkz. Bölüm 4.5). MRP2 inhibitörleri MRP2 inhibitörlerinin uygulanması, kabozantinibin plazma konsantrasyonlarında artışa yol açabilir. Bu nedenle MRP2 inhibitörlerinin (örneğin siklosporin, efavirenz, emtrisitabin)eşzamanlı kullanımı konusunda dikkatli olunmalıdır (bkz. Bölüm 4.5). Yardımcı maddelerle ilgili uyarılar LaktozNadir kalıtımsal galaktoz intoleransı, toplam laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu tıbbi ürünü kullanmamaları gerekir. SodyumBu tıbbi ürünün her bir tableti 1 mmol'den (23 mg) daha az sodyum içerir, dolayısıyla esasında sodyum içermediği kabul edilebilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDiğer tıbbi ürünlerin kabozantinib üzerindeki etkileri CYP3A4 inhibitörleri ve indükleyicileri Güçlü CYP3A4 inhibitörü ketokonazolün (27 gün boyunca her gün 400 mg) sağlıklı gönüllülere uygulanması kabozantinibin klirensini azaltmış (%29 oranında) ve tek doz plazma kabozantinibmaruziyetini (EAA) %38 arttırmıştır. Bu nedenle güçlü CYP3A4 inhibitörlerinin (örneğinritonavir, itrakonazol, eritromisin, klaritromisin, greyfurt suyu) kabozantinib ile birlikteuygulanmasına dikkatle yaklaşılmalıdır. 9 / 36 Güçlü CYP3A4 indükleyici rifampisinin (31 gün boyunca her gün 600 mg) sağlıklı gönüllülere uygulanması kabozantinibin klirensini arttırmış (4,3 kat) ve tek doz plazma kabozantinibmaruziyetini (EAA) %77 azaltmıştır. Bu nedenle, güçlü CYP3A4 indükleyicilerin (örneğinfenitoin, karbamazepin, rifampisin, fenobarbital veya sarı kantaron [Hypericum perforatum]içeren bitkisel preparatlar) kabozantinib ile birlikte kronik kullanımından kaçınılmalıdır.Gastrik pH'ı değiştiren ilaçlar Sağlıklı gönüllülere proton pompası inhibitörü (PPI) esomeprazolün (6 gün süresince günde 40 mg) 100 mg tek doz kabozantinib ile birlikte uygulanması, plazma kabozantinib maruziyeti(EAA) üzerinde klinik açıdan anlamlı herhangi bir etki ortaya çıkarmamıştır. Gastrik pH'ıdeğiştiren ajanlar (yani PPI'lar, H2 reseptörü antagonistleri ve antasitler) kabozantinib ilebirlikte uygulanırken herhangi bir dozaj ayarlaması endike değildir. MRP2 inhibitörleri In vitroveriler kabozantinibin bir MRP2 substratı olduğunu göstermektedir. Bu nedenle MRP2 inhibitörlerinin uygulanması, kabozantinibin plazma konsantrasyonlarında artışlara yolaçabilir.Safra tuzu sekestranları Kolestiramin ve kolestagel gibi safra tuzu sekestranları kabozantinible etkileşime girebilir ve emilimi (veya yeniden emilimi) etkileyerek potansiyel olarak azalmış maruziyet ortayaçıkarabilir (bkz. Bölüm 5.2). Bu potansiyel etkileşimlerin klinik anlamlılığı bilinmemektedir. Kabozantinibin diğer tıbbi ürünler üzerindeki etkileri Kabozantinibin kontraseptif steroidlerin farmakokinetiği üzerindeki etkisi araştırılmamıştır. Kontraseptif etkinin değişmeyeceği garanti edilemeyeceğinden bariyer yöntemi gibi ilave birkontraseptif yöntem kullanılması önerilir. Kabozantinibin warfarinin farmakokinetiği üzerindeki etkisi araştırılmamıştır. Warfarin ile bir etkileşim mümkün olabilir. Bu gibi bir kombinasyon durumunda INR değerleri takipedilmelidir. P-glikoprotein substratları MDCK-MDR1 hücrelerinin kullanıldığı iki yönlü bir tayinde kabozantinibin P-gp transportunun substratı değil bir inhibitörü (IC50 = 7,0 ^M) olduğu görülmüştür. Bu nedenlekabozantinib, eşzamanlı uygulanan P-gp substratlarının plazma konsantrasyonlarını artırmapotansiyeline sahip olabilir. Hastalar kabozantinib kullanırken P-gp substratı (örneğinfeksofenadin, aliskiren, ambrisentan, dabigatran eteksilat, digoksin, kolşisin, maravirok,posakonazol, ranolazin, saksagliptin, sitagliptin, talinolol, tolvaptan) alımı konusundauyarılmalıdır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: D 10 / 36 Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)Hayvan çalışmalarına dayanarak, kabozantinib gebe kadınlara uygulandığında fetusta hasar oluşturabilir. Gebe kalma potansiyeli olan kadınlar kabozantinib tedavisi sırasında gebekalmaktan kaçınmalıdır. Çocuk doğurma potansiyeline sahip kadınlar kabozantinib kullandıkları sırada gebelikten kaçınmaları konusunda uyarılmalıdır. Kabozantinib alan erkek hastaların kadın partnerleri degebelikten kaçınmalıdır. Tedavi sırasında ve tedavinin tamamlanmasını takip eden en az 4 aysüresince erkek ve kadın hastalar ve bunların partnerleri etkili doğum kontrol yöntemleriuygulamalıdır. Oral kontraseptifler belki de etkili doğum kontrol yöntemleri olarak kabuledilemeyebileceğinden bariyer yöntemler gibi bir başka yöntemle birlikte kullanılmaları gerekir(bkz. Bölüm 4.5). Gebelik dönemiKabozantinib kullanan hamile kadınlar üzerinde herhangi bir çalışma yapılmamıştır. CABOMETYX'in gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileribulunmaktadır. Hayvanlar üzerinde gerçekleştirilen çalışmalar embriyo-fetal ve teratojeniketkiler ortaya koymuştur (bkz. Bölüm 5.3). İnsanlar açısından söz konusu olan riskbilinmemektedir. Hastanın klinik durumu CABOMETYX ile tedaviyi gerekli kılmadığıtakdirde kabozantinib hamilelik sırasında kullanılmamalıdır. Laktasyon dönemiEmzirilen bebekte ortaya çıkması muhtemel ciddi advers etkiler nedeniyle emziren anne kabozantinib kullanmamalı veya bebeğin emzirilmesine son verilmelidir. Kabozantinib veyametabolitlerinin anne sütüne geçip geçmediği bilinmemektedir. Bebeğin zarar görmepotansiyeli nedeniyle anneler CABOMETYX ile uygulanan tedavi sırasında ve tedavinintamamlanmasını takip eden en az 4 ay süresince emzirmeyi kesmelidir. Üreme yeteneği/Fertiliteİnsan fertilitesine ilişkin herhangi bir bilgi bulunmamaktadır. Klinik dışı güvenlilik bulguları ışığında, erkek ve kadın fertilitesi CABOMETYX tedavisinden zarar görebilir (bkz. Bölüm5.3). Hem erkeklere hem de kadınlara bu konuda tavsiye almaları ve tedaviden önce fertilitekorumasını düşünmeleri önerilmelidir. 4.7. Araç ve makine kullanımı üzerindeki etkilerKabozantinib motorlu taşıt ve makine kullanma becerisi üzerinde çok az etkiye sahiptir. Bitkinlik ve güçsüzlük gibi advers reaksiyonlar kabozantinib ile ilişkilendirilmiştir. Bu nedenlemotorlu taşıt ve makine kullanırken dikkatli olunması önerilmelidir. 4.8. İstenmeyen etkilerMonoterapi olarak kabozantinibGüvenlilik profilinin özetiRHK popülasyonunda (> %1 insidans) en yaygın ciddi advers ilaç reaksiyonları abdominal ağrı, diyare, bulantı, hipertansiyon, embolizm, hiponatremi, pulmoner embolizm, kusma, 11 / 36 dehidratasyon, yorgunluk, asteni, iştah azalması, derin ven trombozu, baş dönmesi, hipomagnezemi ve palmar-plantar eritrodizestezi sendromudur (PPES). RHK popülasyonunda tüm derecelerden en sık bildirilen advers reaksiyonlar (hastaların en az %25'i tarafından yaşanan) diyare, yorgunluk, bulantı, iştah azalması, PPES, hipertansiyon, kilokaybı, kusma, disguzi, konstipasyon ve AST artışıdır. Hipertansiyon, daha önce VEGF-hedeflitedavi görmüş olan RHK hastalarına (%37) kıyasla hiç tedavi uygulanmamış RHKpopülasyonunda (%67) daha sık gözlenmiştir. HSK popülasyonunda (> %1 insidans) en yaygın ciddi advers ilaç reaksiyonları hepatik ensefalopati, asteni, yorgunluk, PPES, diyare hiponatremi, kusma, abdominal ağrı vetrombositopenidir. HSK popülasyonunda tüm derecelerden en sık bildirilen advers reaksiyonlar (hastaların en az %25'i tarafından yaşanan) diyare, iştah azalması, PPES, yorgunluk, bulantı hipertansiyon vekusmadır. İstenmeyen etkilerin tablo özet listesiMonoterapi olarak kabozantinibin klinik çalışmalarında tanımlanan veya kabozantinibin pazarlama sonrası kullanımından sonra bildirilen istenmeyen etkiler, Tablo 2'de MedDRAsistem organ sınıfı ve sıklık kategorilerine göre listelenmiştir. Sıklıklar tüm dereceleri temelalmaktadır ve şu şekilde tanımlanmıştır: çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygınolmayan (>1/1.000 ila <1/100), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) Hersıklık derecesi grubunda istenmeyen etkiler azalan ciddiyet sırasına göre sunulmaktadır. Tablo 2: Klinik çalışmalarda veya monoterapi olarak kabozantinib ile tedavi edilen hastalarda pazarlama sonrası dönemde bildirilen advers ilaç reaksiyonları (AİR'ler)
12 / 36
*Seçilen istenmeyen etkilerin daha fazla karakterize edilmiş açıklaması için bkz Bölüm 4.8. a Bildirilen advers reaksiyonlara dayanarakb En sık bildirilen advers reaksiyon olarak burun kanaması dahilc Bozulmuş iyileşme ve kesi yeri komplikasyonu. Birinci basamak ilerlemiş RHK 'de nivolumabla kombinasyon halinde kabozantinibGüvenlilik profilinin özetiKabozantinib nivolumabla kombinasyon halinde uygulandığında, tedaviye başlamadan önce nivolumab KÜB'üne bakınız. Nivolumab monoterapisinin güvenlilik profili hakkında dahafazla bilgi için lütfen nivolumab KÜB'üne bakınız. 13 / 36 RHK'de (n=320) iki haftada bir 240 mg nivolumab ile kombinasyon halinde günde bir kez 40 mg kabozantinib veri kümesinde, minimum 16 aylık takipte, en yaygın ciddi advers ilaçreaksiyonları (>% 1 insidans) diyare, pnömonit, pulmoner emboli, pnömoni, hiponatremi,pireksi, adrenal yetmezlik, kusma, dehidrasyondur. En sık görülen advers reaksiyonlar (>%25) diyare, yorgunluk, palmar-plantar eritrodizestezi sendromu, stomatit, kas-iskelet ağrısı, hipertansiyon, döküntü, hipotiroidizm, iştahta azalma,bulantı, karın ağrısıdır. Advers reaksiyonların çoğu hafif ila orta şiddetliydi (Derece 1 veya 2). İstenmeyen etkilerin tablo özet listesiNivolumabla kombinasyon halindeki kabozantinibin klinik çalışmasında tanımlanan advers reaksiyonlar Tablo 3'te MedDRA Sistem Organ Sınıfı ve sıklık kategorilerine görelistelenmiştir. Sıklıklar tüm dereceleri temel almaktadır ve şu şekilde tanımlanmıştır: çokyaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila <1/100), bilinmiyor(eldeki verilerden hareketle tahmin edilemiyor). Her sıklık derecesi grubunda istenmeyenetkiler azalan ciddiyet sırasına göre sunulmaktadır.
14 / 36
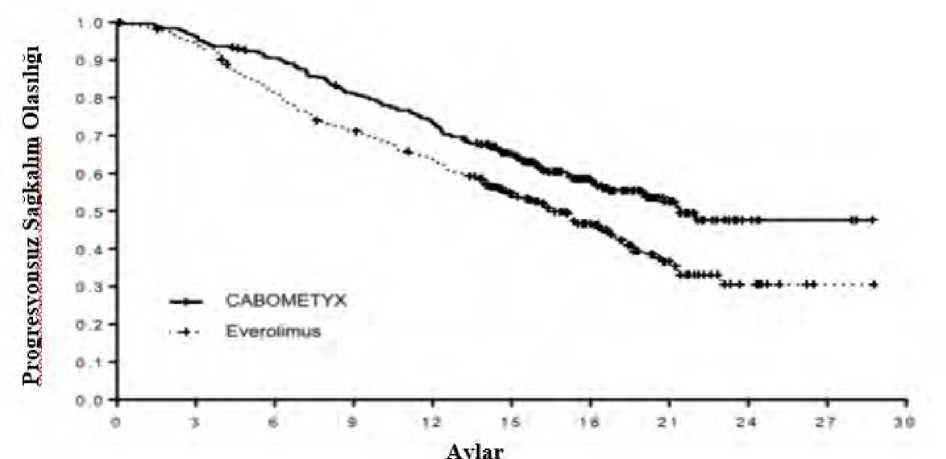
Tablo 3'te sunulan advers reaksiyon sıklıkları, tamamen tek başına kabozantinibe bağlanamaz, ancak altta yatan hastalık veya kombinasyon halinde kullanılan nivolumab bunlara katkıdabulunabilir. c Döküntü; dermatit, akneli dermatit, bullöz dermatit, eksfoliatif dermatit, eritematöz döküntü, foliküler döküntü, makular döküntü, makülo papüler döküntü, papüler döküntü,pruritik döküntü ve ilaç erüpsiyonunu kapsayan kompozit bir terimdird Kas iskelet ağrısı; sırt ağrısı, kemik ağrısı, kas-iskelet göğüs ağrısı, kas iskelet rahatsızlığı,miyalji, boyun ağrısı, ekstremitelerde ağrı, spinal ağrıyı içeren kompozit bir terimdir.e Laboratuvar terimlerinin sıklıkları, kilo kaybı, kanda kolesterol artışı vehipertrigliseridemi haricinde laboratuvar ölçümlerinde başlangıca göre kötüleşmeyaşayan hastaların oranını yansıtmaktadır. 15 / 36 Seçilen istenmeyen etkilerin açıklamasıAşağıdaki reaksiyonlarla ilgili veriler, RHK konusunda gerçekleştirilmiş pivot çalışmalarda daha önce uygulanmış olan VEGF-hedefli tedaviyi takiben ve daha önce tedavi uygulanmamışRHK hastaları ile HSK'de önceki sistemik tedavinin ardından monoterapi olarak oral yolla hergün 60 mg Cabometyx alan hastaları veya birinci basamak RHK'de nivolumabla kombinasyonhalinde oral yolla günde bir kez 40 mg CABOMETYX alan hastaları esas almaktadır (bkz.Bölüm 5.1). Gastrointestinal (Gİ) perforasyon (bkz. Bölüm 4.4)RHK'de önceki VEGF-hedefli tedaviyi takiben gerçekleştirilmiş olan çalışmada (METEOR), kabozantinible tedavi uygulanan RHK hastalarının %0,9'unda (3/331) Gİ perforasyonlarbildirilmiştir. Olayların Derece 2 veya 3 olduğu belirlenmiştir. Başlangıca kadar geçen medyansürenin 10 hafta olduğu görülmüştür. Daha önce tedavi uygulanmamış hastalar üzerinde gerçekleştirilen RHK çalışmasında (CABOSUN) GI perforasyonlar, kabozantinible tedavi uygulanan hastaların %2,6'sında (2/78)bildirilmiştir. Derece 4 veya 5 olaylar. HSK çalışmasında (CELESTIAL) Gİ perforasyonlar, kabozantinible tedavi uygulanan hastaların %0,9 unda (4/467) bildirilmiştir. Tüm olaylar Derece 3 veya 4 olduğu belirlenmiştir.Başlangıca kadar geçen medyan sürenin 5,9 hafta olduğu görülmüştür. İleri evre RHK'de birinci basamak tedavide nivolumab ile kombinasyon halinde (CA2099ER), GI perforasyonlarının insidansı tedavi edilen hastalarda %1,3'tü (4/320). Olaylardan biri 3.Derece, iki olay 4. Derece ve bir olay da 5. Dereceydi (ölümcül). Kabozantinib klinik programında ölümcül perforasyonlar ortaya çıkmıştır. Hepatik ensefalopati ( bkz. Bölüm 4.4)HSK çalışmasında (CELESTIAL) hepatik ensefalopati (hepatik ensefalopati, ensefalopati, hiperamonemik ensefalopati), kabozantinible tedavi uygulanan hastaların %5,6'unda (26/467);(%2,8'inde Derece 3-4 olayı ve birinde (%0,2) Derece 5) olayı bildirilmiştir. Başlangıca kadargeçen medyan sürenin 5,9 hafta olduğu görülmüştür. RSK çalışmalarında (METEOR,CABOSUN ve CA2099ER) hepatik ensefalopati vakası rapor edilmemiştir. Diyare (bkz. Bölüm 4.4)RHK'de önceki VEGF-hedefli tedaviyi takiben gerçekleştirilmiş olan çalışmada (METEOR) diyare, kabozantinible tedavi uygulanan RHK hastalarının %74'ünde (245/331) (%11'indeDerece 3-4 olaylar) bildirilmiştir. Başlangıca kadar geçen medyan sürenin 4,9 hafta olduğugörülmüştür. Daha önce tedavi uygulanmamış hastalar üzerinde gerçekleştirilen RHK çalışmasında (CABOSUN) diyare, kabozantinible tedavi uygulanan hastaların %73'ünde (57/78) (%10'undaDerece 3-4 olaylar) bildirilmiştir. 16 / 36 HSK çalışmasında (CELESTIAL) diyare, kabozantinible tedavi uygulanan hastaların %54 unda (251/467) (%9,9'unda Derece 3-4 olaylar) bildirilmiştir. Başlangıca kadar geçen medyansürenin 4,1 hafta olduğu görülmüştür. Diyare sırasıyla 84/467 (%18), 69/467 (%15), 5/467 (%1)oranında doz değişimine, kesilmesine ve kalıcı olarak kesilmesine neden olmuştur. İleri evre RHK'de birinci basamak tedavide nivolumab ile kombinasyon halinde (CA2099ER), diyare insidansı tedavi edilen hastaların %64,7'ydi (207/320); %8,4'ünde (27/320) olaylarDerece 3-4 şeklindeydi. Tüm olayların başlangıcına kadar geçen medyan süre 12,9 haftaydı.Diyare olan hastaların sırasıyla %26,3'ünde (84/320) doz gecikmesi veya azaltılması ve%2,2'sinde (7/320) bırakılması meydana gelmiştir. Fistüller (bkz. Bölüm 4.4)RHK'de önceki VEGF-hedefli tedaviyi takiben gerçekleştirilmiş olan çalışmada (METEOR), kabozantinible tedavi uygulanan hastaların %1,2'sinde (4/331) fistüller bildirilmiştir vehastaların %0,6'sında (2/331) görülen anal fistüller de buna dahildir. Olaylardan bir tanesininDerece 3, kalanların ise Derece 2 olduğu saptanmıştır. Başlangıca kadar geçen medyan sürenin30,3 hafta olduğu görülmüştür. Daha önce tedavi uygulanmamış hastalar üzerindegerçekleştirilen RHK çalışmasında (CABOSUN) hiç fistül vakası bildirilmemiştir. HSK çalışmasında (CELESTIAL); HSK hastalarının %1,5'inde (7/467) fistüller bildirilmiştir. Başlangıca kadar geçen medyan sürenin 14 hafta olduğu görülmüştür. İleri evre RHK'de birinci basamak tedavide nivolumab ile kombinasyon halinde (CA2099ER), fistül insidansı tedavi edilen hastalarda %0,9'du (3/320) ve şiddeti Derece 1'di. Kabozantinib klinik programında ölümcül fistüller ortaya çıkmıştır. Hemoraji (bkz. Bölüm 4.4)RHK'de önceki VEGF-hedefli tedaviyi takiben gerçekleştirilmiş olan çalışmada (METEOR), kabozantinible tedavi uygulanan RHK hastalarında şiddetli (Derece > 3) hemorajik olaylarıninsidansının %2,1 (7/331) olduğu belirlenmiştir. Başlangıca kadar geçen medyan sürenin20,9 hafta olduğu görülmüştür. Daha önce tedavi uygulanmamış RHK çalışmasında (CABOSUN), kabozantinible tedavi uygulanan RHK hastalarında şiddetli (Derece > 3) hemorajik olayların insidansının %5,1 (4/78)olduğu belirlenmiştir. HSK çalışmasında (CELESTIAL), kabozantinible tedavi uygulanan hastalarda şiddetli (Derece > 3) hemorajik olayların insidansının %7,3 (34/467) olduğu belirlenmiştir. Başlangıca kadargeçen medyan sürenin 9,1 hafta olduğu görülmüştür. İleri evre RHK'de birinci basamak tedavide nivolumab ile kombinasyon halinde (CA2099ER), Derece > 3 hemoraji insidansı tedavi edilen hastalarda %1,9'du (6/320). Kabozantinib klinik programında ölümcül kanamalar ortaya çıkmıştır. 17 / 36 Posterior Reversibl Ensefalopati Sendromu (PRES) (bkz. Bölüm 4.4)METEOR veya CABOSUN veya CA2099ER veya CELESTIAL çalışmasında hiçbir PRES vakası bildirilmemiştir, fakat diğer klinik çalışmalarda (2/4872 gönüllüde, %0.04) nadirenPRES bildirilmiştir. RHK'de kabozantinib nivolumab ile kombine edildiğinde karaciğer enzimlerinde artışNivolumab ile kombinasyon halinde kabozantinib alan daha önce tedavi edilmemiş RHK'li hastaların klinik bir çalışmasında, ileri evre RCC'li hastalarda kabozantinib monoterapisinegöre Derece 3 ve 4 ALT artışı (%10,1) ile AST artışında (%8,2) daha yüksek insidansgözlenmiştir (METEOR çalışmasında ALT %3,6 ve AST %3,3 artmıştır. Derece > 2 ALT veyaAST artışı başlangıcına kadar geçen medyan süre 10,1 haftaydı (aralık: 2 ila 106,6 hafta; n=85).Derece > 2 ALT veya AST artışı olan hastalarda, artışlar %91'inde Derece 0-1'e kadargerilemiş olup, gerilemeye kadar geçen medyan süre 2,29 haftaydı (aralık: 0,4 ila 108,1 hafta). Tek ajan olarak veya birlikte (n = 25) uygulanan kabozantinib (n = 10) veya nivolumab (n = 10) ile tekrar eprüve edilen Derece >2 ALT veya AST artışı olan 45 hasta arasında, kabozantinibalan 4 hastada, nivolumab alan 3 hastada ve hem kabozantinib hem de nivolumab alan 8 hastadaDerece >2 ALT veya AST artışının tekrarladığı gözlenmiştir. HipotiroidizmRHK'de önceki VEGF-hedefli tedaviyi takiben gerçekleştirilmiş olan çalışmada (METEOR), hipotiroidizm insidansı %21'di (68/331). Tedavi edilmemiş RHK çalışmasında (CABOSUN), kabozantinib ile tedavi edilen hastalarda hipotiroidizm insidansı %23'tü (18/78). HSK çalışmasında (CELESTIAL), kabozantinib ile tedavi edilen hastalarda hipotiroidizm insidansı %8,1'di (38/467) ve %0,4'ünde (2/467) olaylar Derece 3'tü. İleri evre RHK'de birinci basamak tedavide nivolumab ile kombinasyon halinde (CA2099ER), hipotiroidizm insidansı tedavi edilen hastalarda %35,6'ydı (114/320). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; eposta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiKabozantinib doz aşımının herhangi bir spesifik tedavisi yoktur ve doz aşımının olası semptomları belirlenmemiştir. Doz aşımından şüphelenilmesi durumunda kabozantinib uygulaması durdurulmalıdır ve destekleyici bakım uygulanmalıdır. Herhangi bir olası değişim eğiliminin değerlendirilmesiamacıyla metabolik klinik laboratuar parametreleri en az haftada bir veya klinik açıdan uygungörüldüğü şekilde takip edilmelidir. Doz aşımı ile ilişkili advers reaksiyonlar için semptomatiktedavi uygulanmalıdır. 18 / 36 5.FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik ÖzelliklerFarmakoterapötik grup: antineoplastik ajan, protein kinaz inhibitörü ATC kodu: L01EX07. Etki mekanizmasıKabozantinib tümör büyümesinden, anjiyogenezden, patolojik kemik yeniden modellenmesinden, ilaç direncinden ve metastatik kanser progresyonundan sorumlu birdenfazla reseptör tirozin kinazı (RTK) inhibe eden küçük bir moleküldür. Kabozantinib çeşitlikinazlara karşı inhibe edici aktivitesi açısından değerlendirilmiştir ve MET (hepatosit büyümefaktörü reseptörü proteini) ve VEGF (vasküler endotelyal büyüme faktörü) reseptörlerini inhibeettiği bulunmuştur. Ek olarak kabozantinib GAS6 reseptörü (AXL), RET, ROS1, TYRO3,MER, kök hücre faktörü reseptörü (KIT), TRKB, Fms-benzeri tirozin kinaz-3 (FLT3) ve TIE-2'nin de aralarında olduğu başka tirozin kinazları da inhibe etmektedir. Farmakodinamik etkiler Kabozantinib geniş çeşitlilikte preklinik tümör modellerinde dozla ilişkili tümör büyümesi inhibisyonu ve tümör regresyonu sergilemiştir ve/veya metastazı inhibe etmiştir. Kardiyak elektrofızyolojiMedullar tiroid kanseri hastaları üzerinde gerçekleştirilen bir kontrollü klinik çalışmada kabozantinib tedavisine (günde 140 mg dozunda) başlanmasını takiben Fridericia iledüzeltilmiş QT aralığında (QTcF) 29. Günde (fakat 1. Günde değil) başlangıca göre 10 - 15ms'lik bir artış gözlenmiştir. Bu etki kardiyak dalga formu morfolojisinde bir değişiklikle veyayeni ritimlerle ilişkilendirilmemiştir. Bu çalışmada kabozantinible tedavi uygulanan hastalarınveya RHK veya HSK çalışmalarında kabozantinible tedavi uygulanan gönüllülerin hiçbirinde(60 mg dozunda) doğrulanmış QTcF >500 ms gözlenmemiştir. Klinik etkililik ve güvenlilikRenal hücreli karsinom (RHK)Daha önce vasküler endotelyal büyüme faktörü (VEGF) hedefli tedavi gören RHK hastalarındaki randomize çalışma (METEOR)Önceki vasküler endotelyal büyüme faktörü (VEGF)-hedefli tedaviyi takiben renal hücreli karsinom tedavisinde CABOMETYX'in güvenliliği ve etkililiği randomize, açık etiketli, çokmerkezli bir faz 3 çalışmada (METEOR) değerlendirilmiştir. Daha önce en az 1 VEGFreseptörü tirozin kinaz inhibitörü (VEGFR TKI) almış olan berrak hücreli bileşene sahipilerlemiş RHK hastaları (N=658) CABOMETYX (N=330) veya everolimus (N=328) almaküzere randomize edilmiştir (1/1). Hastaların daha önce sitokinlerin ve VEGF'yi, programlıölüm 1 (PD-1) reseptörünü veya onun ligandlarını hedef alan antikorların da aralarında olduğubaşka tedaviler almış olmasına izin verilmiştir. Beyin metastazları tedavi edilmiş olan hastalarınçalışmaya katılmasına izin verilmiştir. Progresyonsuz sağkalım (PFS) körleştirilmiş birbağımsız radyolojik inceleme kurulu tarafından değerlendirilmiştir ve randomize edilmiş olanilk 375 gönüllü üzerinde primer analiz gerçekleştirilmiştir. Sekonder etkililik sonlanmanoktaları objektif yanıt oranı (ORR) ve genel sağkalım (OS) olarak belirlenmiştir. 19 / 36 Tümör değerlendirmeleri ilk 12 ay süresince 8 haftada bir ve ardından 12 haftada bir gerçekleştirilmiştir. Başlangıçtaki demografik özellikler ve hastalık özellikleri CABOMETYX ve everolimus kollarında birbiri ile benzerlik sergilemiştir. Hastaların çoğunun erkek (%75) ve medyan yaşın 62 olduğu belirlenmiştir. Yüzde yetmiş biri (%71) daha önce yalnızca bir VEGFR TKI almıştır; hastaların %41'inin daha önce aldığı tekVEGFR TKI'nın sunitinib olduğu belirlenmiştir. Prognostik risk kategorisine ilişkin MemorialSloan Kettering Cancer Center kriterlerine göre %46'sının olumlu (0 risk faktörü), %42'sininorta (1 risk faktörü) ve %13'ünün kötü (2 veya 3 risk faktörü) olduğu görülmüştür. Hastaların%54'ünün 3 veya daha fazla organında metastatik hastalık tespit edilmiştir ve bu organlarıakciğer (%63), lenf düğümleri (%62), karaciğer (%29) ve kemikler (%22) oluşturmaktadır.Medyan tedavi süresinin CABOMETYX alan hastalarda 7,6 ay (aralık 0,3 - 20,5), everolimusalan hastalarda ise 4,4 ay (aralık 0,21 - 18,9) olduğu belirlenmiştir. CABOMETYX için everolimus ile kıyasla PFS'de istatistiksel olarak anlamlı bir iyileşme gösterilmiştir (Şekil 1 ve Tablo 4). PFS analizi sırasında planlı bir OS analizi gerçekleştirilmiştirve istatistiksel anlamlılığa ilişkin ara sınıra ulaşmamıştır (202 olay, HR=0,68 [0,51, 0,90],p=0,006). Daha sonra gerçekleştirilen planlı olmayan bir ara OS analizinde CABOMETYX'erandomize edilmiş hastalarda everolimusa kıyasla istatistiksel olarak anlamlı iyileşme ortayakonmuştur (320 olay, medyan 21,4 aya karşılık 16,5 ay; HR=0,66 [0,53, 0,83], p=0,0003; Şekil2). 430 olayda bir takip analizi (tanımlayıcı) ile OS için karşılaştırılabilir bulgular gözlenmiştir. ITT popülasyon üzerinde gerçekleştirilen keşifsel PFS ve OS analizleri de yaşa (<65 veya >65), cinsiyete, MSKCC risk grubuna (olumlu, orta, kötü), ECOG durumuna (0 veya 1), tanıdanrandomizasyona kadar geçen süreye (<1 yıl veya >1 yıl), tümör MET durumuna (yüksek veyadüşük veya bilinmiyor), kemik metastazları (yok veya var), viseral metastazlar (yok veya var),viseral ve kemik metastazları (yok veya var), önceki VEGFR-TKI'ların sayısı (1 veya >2), ilkVEGFR-TKI'nın süresi (<6 ay veya >6 ay) göre oluşturulmuş farklı alt gruplarda everolimusakıyasla CABOMETYX lehine tutarlı sonuçlar ortaya koymuştur. Objektif yanıt oranı bulguları Tablo 5'te özetlenmektedir. 20 / 36 Şekil 1: Daha önce uygulanan vasküler endotelyal büyüme faktörü (VEGF)-hedefli tedavinin ardından RHK'li gönüllülerde bağımsız radyolojik inceleme kuruluincelemesiyle elde edilen Kaplan Meier progresyonsuz sağkalım eğrisi (randomize edilenilk 375 gönüllü) (METEOR)o s-Hi0.3-CABOMETYXV-f----*+ - "Everolimusû ü ¦AylarRisk altındaki gönüllülerin sayısıCABOMETYX 187 15292 Everolimus 1889946 Tablo 4: Daha önce uygulanan vasküler endotelyal büyüme faktörü (VEGF)-hedefli tedavinin ardından RHK'li gönüllülerde bağımsız radyolojik inceleme kuruluincelemesiyle elde edilen PFS bulgularının özeti (METEOR)
21 / 36 Risk altındaki gönüllülerin sayısı
239 178 202 141 CABOMETYX 330 318296264 Everolimus 328307262229
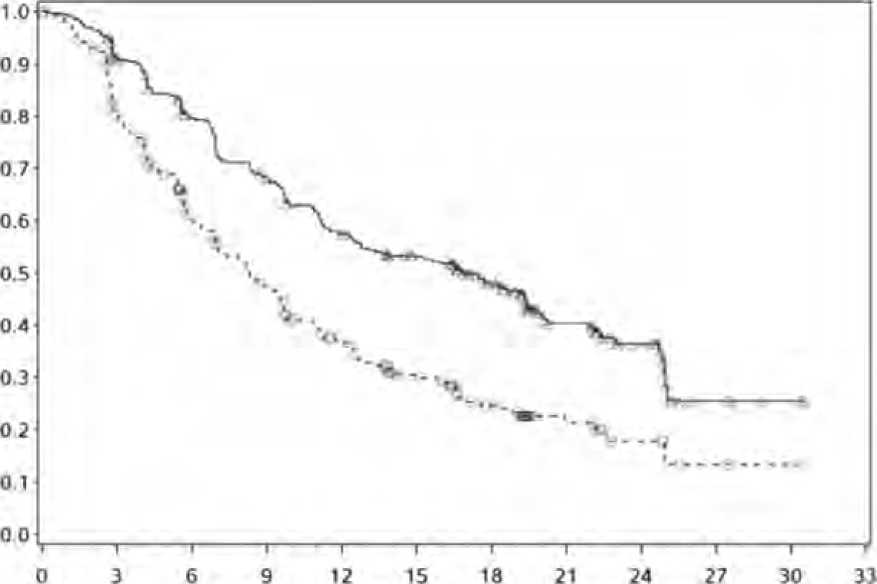
22 / 36 Daha önce tedavi uygulanmamış renal hücreli karsinom hastalarında randomize çalışma (CABOSUN)Daha önce tedavi uygulanmamış renal hücreli karsinom tedavisinde CABOMETYX'in güvenliliği ve etkililiği randomize, açık etiketli, çok merkezli bir çalışmada (CABOSUN)değerlendirilmiştir. Daha önce tedavi uygulanmamış, lokal olarak ilerlemiş veya metastatikberrak hücreli bileşene sahip RHK hastaları (N=157) CABOMETYX (N=79) veya sunitinib(N=78) almak üzere randomize edilmiştir (1/1). Hastaların, Uluslararası Metastatik RHK VeriTabanı Konsorsiyumu (IMDC) risk grubu kategorilerine göre tanımlandığı üzere, orta veyakötü riskli hastalığa sahip olması gerekmiştir. Hastalar IMDC risk grubuna göre ve kemik metastazı varlığına göre (evet/hayır) basamaklandırılmıştır. Hastaların yaklaşık %75'i tedavinin başlamasının öncesinde birnefrektomi geçirmiştir. Orta riskli hastalıkta aşağıdaki risk faktörlerinden bir veya ikisi karşılanmıştır, kötü riskli hastalıkta ise üç veya daha fazla faktör karşılanmıştır: RHK tanısından sistemik tedaviye kadargeçen süre < 1 yıl, Hgb < LLN, Düzeltilmiş kalsiyum > ULN, KPS < %80, nötrofıl sayısı >ULN ve trombosit sayısı > ULN. Primer sonlanma noktası PFS olarak belirlenmiştir. Sekonder etkililik sonlanma noktaları objektif yanıt oranı (ORR) ve genel sağkalım (OS) olarak belirlenmiştir. Tümördeğerlendirmeleri 12 haftada bir gerçekleştirilmiştir. Başlangıçtaki demografik özellikler ve hastalık özellikleri CABOMETYX ve sunitinib kollarında birbiri ile benzerlik sergilemiştir. Hastaların çoğunun erkek (%78) ve medyan yaşın62 olduğu belirlenmiştir. IMDC risk gruplarına göre hasta dağılımı %81 orta (1-2 risk faktörü)ve %19 kötü (>3 risk faktörü) olmuştur. Çoğu hastanın (%87) ECOG performans durumunun0 veya 1; hastaların %13'ünün ise ECOG performans durumunun 2 olduğu görülmüştür.Hastaların %36'sında kemik metastazları tespit edilmiştir. Körleştirilmiş Bağımsız Radyolojik İnceleme Kurulu (IRC) tarafından retrospektif şekilde değerlendirildiği üzere, CABOMETYX ile sunitinible olana kıyasla PFS'de istatistiksel olarakanlamlı iyileşme ortaya konmuştur (Şekil 3 ve Tablo 6). PFS üzerinde araştırmacı tarafındanyapılmış analiz ile IRC tarafından yapılmış analizin sonuçları tutarlılık sergilemiştir. MET durumu hem pozitif hem de negatif olan hastalar CABOMETYX ile sunitinib ile olana kıyasla olumlu bir etki sergilemiştir ve MET durumu pozitif olan hastalarda MET durumunegatif olan hastalara kıyasla daha fazla aktivite gözlenmiştir (sırasıyla HR=0,32 (0,16, 0,63)ve 0,67 (0,37, 1,23)). CABOMETYX tedavisi sunitinible karşılaştırıldığında daha uzun bir sağkalım yönünde eğilim ortaya çıkarmıştır (Tablo 6). Çalışma, OS analizi için yeterli güce sahip değildi ve veriler olgundeğildi. Objektif yanıt oranı (ORR) bulguları Tablo 6'da özetlenmektedir. 23 / 36 Şekil 3: Daha önce tedavi uygulanmamış RHK'li gönüllülerde IRC değerlendirmesinegöre progresyonsuz sağkalıma ilişkin Kaplan-Meier eğrisiRisk altındaki gönüllülerin sayısıCABOMETYX 795137242218125210 Sunitinib 783621129532100
24 / 36
IxRS'ye göre basamaklandırma faktörleri IMDC risk kategorilerinden (orta risk, kötü risk ve kemik metastazı (evet, hayır)) oluşmaktadır. c IxRS'ye göre belirlenmiş basamaklandırma faktörlerine göre ayarlanmış Cox orantılı tehlikeler modeli kullanılarak hesaplanmıştır. Tehlike oranı <1 kabozantinib lehineprogresyonsuz sağkalım göstermektedir Sunitinib karşısında nivolumab ile kombinasyon halindeki kabozantinib için randomize faz 3 çalışması (CA2099ER)İleri evre/metastatik RHK'nin birinci basamak tedavisi için 2 haftada bir intravenöz yoldan 240 mg nivolumab ile kombinasyon halinde günde bir kez oral yoldan alınan 40 mg kabozantinibingüvenliliği ve etkililiği, bir faz 3, randomize, açık etiketli çalışmada (CA2099ER)değerlendirilmiştir. Çalışmaya, PD-L1 durumlarına veya IMDC risk grubuna bakılmaksızın,berrak hücreli bileşene sahip ileri evre veya metastatik RHK'li, Karnofsky Performans Durumu(KPS)>%70 ve RECIST v1.1'e göre ölçülebilir hastalığı olan hastalar (18 yaş veya üstü) dahiledilmiştir. Çalışmada, otoimmün hastalığı veya sistemik immünosupresyon gerektiren diğertıbbi koşulları olan hastalar, daha önce bir anti-PD-1, anti PD-L1, anti-PD-L2, anti-CD137 veyaanti-CTLA-4 antikoru ile tedavi görmüş hastalar, antihipertansif tedaviye rağmenhipertansiyonu kontrol edilemeyenler, aktif beyin metastazları ve kontrolsüz adrenal yetmezliğiolan hastalar dışarıda bırakılmıştır. Hastalar IMDC prognostik skoru, PD-L1 tümörekspresyonu ve bölgeye göre katmanlandırılmıştır. Toplam 651 hasta, her 2 haftada bir intravenöz yoldan uygulanan 240 mg (n =323) nivolumab ile kombinasyon halinde oral olarak günde bir kez 40 mg kabozantinib veya 4 hafta boyuncagünde bir kez 50 mg sunitinib (n = 328) ve takiben 2 hafta ara verilerek uygulanacak şekilderandomize edilmiştir. Tedavi, en fazla 24 ay boyunca nivolumab uygulamasıyla hastalıkprogresyonuna veya kabul edilemez toksisiteye kadar devam etmiştir. Araştırmacı tarafındanbelirlendiği üzere, hastanın klinik fayda sağlaması ve çalışma ilacını tolere etmesi halinde,araştırmacı tarafından değerlendirilen RECIST versiyon 1.1 ile tanımlanan ilk progresyonsonrasında tedaviye izin verilmiştir. Başlangıç sonrası ilk tümör değerlendirmesi,randomizasyondan sonra 12 haftada (± 7 gün) gerçekleştirilmiştir. Sonraki tümördeğerlendirmeleri, 60. Haftaya kadar her 6 haftada bir (± 7 gün), daha sonra radyografikprogresyona kadar her 12 haftada bir (± 14 gün) yapılmış ve Körleştirilmiş Bağımsız Merkeziİnceleme (BICR) ile doğrulanmıştır. Primer etkililik sonuç ölçüsü, bir BICR tarafındanbelirlendiği şekliyle PFS idi. Diğer etkililik ölçüleri arasında kilit sekonder sonlanım noktalarıolarak OS ve ORR bulunuyordu. İki grup arasında başlangıç özellikleri genel olarak dengelenmişti. Medyan yaş 61 olup (aralık: 28-90), %38,4'ü> 65 yaşında ve %9,5'i > 75 yaşındaydı. Hastaların çoğu erkek(%73,9) ve beyazdı (%81,9). Hastaların yüzde sekizi Asyalıydı, %23,2'si ve %76,5'i, sırasıyla%70 ila %80 ve %90 ila %100'lük bir başlangıç KPS'sine sahipti. IMDC risk kategorilerinegöre hasta dağılımı %22,6 iyi, %57,6 orta ve %19,7 yüksekti. Tümör PD-L1 ekspresyonuaçısından, hastaların %72,5'inde PD-L1 ekspresyonu <% 1 veya belirsizdi ve hastaların%24,9'unda PD-L1 ekspresyonu >% 1'di,. Hastaların %11,5'inde sarkomatoid özelliklitümörler vardı. Tedavinin medyan süresi nivolumab ile birlikte kabozantinible tedavi edilen 25 / 36 hastalarda 14,26 ay (aralık: 0,2-27,3 ay) ve sunitinib ile tedavi edilen hastalarda 9,23 aydı (aralık: 0,8-27,6 ay). Çalışma, nivolumab ile kombinasyon halinde kabozantinibe randomize edilen hastalarda sunitinib ile karşılaştırıldığında PFS, OS ve ORR'de istatistiksel olarak anlamlı bir faydaolduğunu kanıtlamıştır. Önceden belirlenmiş alt gruplarda, IMDC risk kategorileri ve PD-L1tümör ekspresyon durumunda tutarlı sonuçlar gözlenmiştir. Primer analizden elde edilen etkililik sonuçları (minimum takip 10,6 ay; medyan takip 18,1 ay) Tablo 7'de gösterilmektedir. Tablo7:Etkililik sonuçları (CA2099ER)
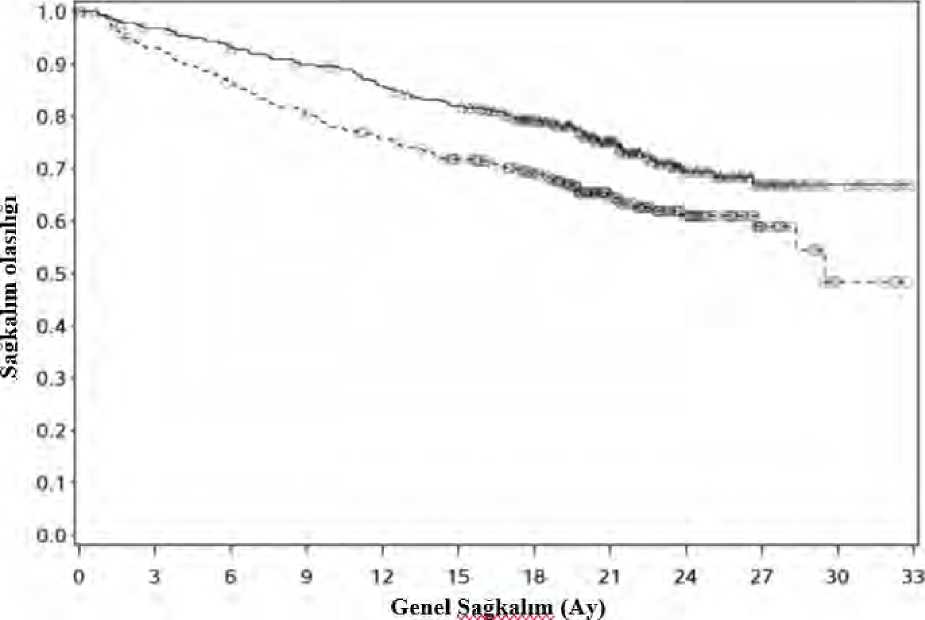
b Katmanlandırılmış log-sıra testinin 2 taraflı p değerleri. c IMDC prognostik risk skoru (0, 1-2, 3-6), PD-L1 tümör ekspresyonu (>%1'e karşı <% 1 veya belirsiz) ve IRT'ye girildiği gibi bölgeye (ABD/Kanada/Batı Avrupa/Kuzey Avrupa, ROW)göre katmanlandırılmış log-sıra testi.d Kaplan-Meier tahminlerine göre.e İstatistiksel anlamlılık için sınır p-değeri <0,0111.f CI, Clopper ve Pearson yöntemine dayanmaktadır. 26 / 36 g DerSimonian ve Laird'e göre objektif yanıt oranındaki (nivolumab + kabozantinib -Sunitinib) katman ayarlı fark h CMH testinden 2 taraflı p-değeri. NE = hesaplanamaz PFS'nin primer analizi, yeni kanser tedavisi için sansürlemeyi içeriyordu (Tablo 7). Yeni kanser tedavisi için sansür içeren ve içermeyen PFS sonuçları tutarlıydı. Sunitinib karşısında, nivolumab ile kombinasyon halindeki kabozantinib kolunda, tümör PD L1 ekspresyonundan bağımsız olarak PFS yararı gözlenmiştir. Tümör PD L1 ekspresyonu > 1%için medyan PFS, nivolumab ile kombinasyon halinde kabozantinib için 13.08 ay, ve sunitinibkolunda 4,67 aydı (HR = 0,45; %95 CI: 0,29, 0,68). Tümör PD L1 ekspresyonu < 1% içinmedyan PFS, nivolumab ile kombinasyon halinde kabozantinib için 19.84 ay, ve sunitinibkolunda 9,26 aydı (HR = 0,50; %95 CI: 0,38, 0,65). Sunitinib karşısında, nivolumab ile kombinasyon halindeki kabozantinib kolunda, tümör (IMDC) risk kategorisinden bağımsız olarak PFS yararı gözlenmiştir. İyi risk grubu içinmedyan PFS'e, nivolumab ile kombinasyon halinde kabozantinib için erişilmemiştir vesunitinib kolunda 12,81 aydı (HR = 0,60; %95 CI: 0,37, 0,98). Orta risk grubu için medyanPFS, nivolumab ile kombinasyon halinde kabozantinib için 17,71 ay ve sunitinib kolunda 8,38aydı (HR = 0,54; %95 CI: 0,41, 0,73). Yüksek risk grubu için medyan PFS, nivolumab ilekombinasyon halinde kabozantinib için 12,29 ay ve sunitinib kolunda 4,21 aydı (HR = 0,36;%95 CI: 0,23, 0,58). Güncellenmiş bir PFS ve OS analizi, tüm hastaların minimum 16 aylık bir takip süresi ve 23,5 aylık bir medyan takip süresi dolduğunda gerçekleştirilmiştir (bkz. Şekil 4 ve 5). PFS tehlikeoranı 0,52'ydi (%95 CI: 0,43, 0,64). OS tehlike oranı 0,66'ydı (%95 CI: 0,50, 0,87). IMDC riskkategorileri ve PD-L1 ekspresyon seviyeleri için alt gruplarda güncellenmiş etkililik verileri(PFS ve OS) orijinal sonuçları doğrulamıştır. Güncellenen analizle iyi risk grubunda medyanPFS'ye ulaşılmıştır. 27 / 36
_iNivolumab + kabozantinib (olaylar: 175/323), medyan ve %95 CI : 16,95 (12,58, 19,38) 3 - - Sunitinib (olaylar: 206/328), medyan ve %95 CI: 8,31 (6,93, 9,69) 28 / 36
Nivolumab + kabozantinib (olaylar: 86/323), medyan ve %95 CI: NE ^ - Sunitinib (olaylar: 116/328), medyan ve %95 CI: 29,47 (28,35, NE) Hepatoselüler karsinomSorafenib alan hastalarda kontrollü çalışma (CELESTIAL)CABOMETYX'in güvenliliği ve etkinliği randomize, çift kör, plasebo kontrollü faz 3 çalışmasında (CELESTIAL) değerlendirilmiştir. Küratif tedaviye uygun olmayan ve daha önceilerlemiş hastalık için sorafenib alan HSK'lı hastalar (N = 707), CABOMETYX (N = 470) veyaplasebo (N = 237) alacak şekilde randomize edilmiştir (2: 1). Hastalar, sorafenibin yanı sırailerlemiş hastalık için daha önce bir başka sistemik tedavi almış olabilirler. Randomizasyon,hastalığın etiyolojisi (HBV [HCV ile birlikte olan veya olmayan], HCV [HBV ile olmayan]veya diğer), coğrafi bölge (Asya, diğer bölgeler) ve hastalığın ekstrahepatik yayılımının ve/veya makrovasküler invazyonun varlığına (Evet, Hayır) göre sınıflara ayrılmıştır. Primer sonlanma noktası genel sağkalım (OS) olarak belirlenmiştir. Sekonder etkililik sonlanma noktaları progresyonsuz sağkalım (PFS) ve objektif yanıt oranı (ORR) araştırmacıtarafından Katı Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST ) 1.1 kullanılarakbelirlenmiştir. Tümör değerlendirmeleri 8 haftada bir gerçekleştirilmiştir. Gönüllüler radyolojikhastalığın ilerlemesinden sonra klinik fayda görürken veya sonraki sistemik veya karaciğer 29 / 36 yönelimli lokal antikanser tedavisine ihtiyaç duyulana kadar kör çalışma tedavisine devam etmişlerdir. Kör tedavi aşamasında plasebodan kabozantinibe çapraz geçişe izin verilmemiştir. Başlangıçtaki demografik özellikler ve hastalık özellikleri CABOMETYX ve placebo kollarında birbiri ile benzerlik sergilemiştir ve 707 randomize hastanın tümü için aşağıdagösterilmiştir. Hastaların çoğu erkek (%82) ve medyan yaş 64'tü. Hastaların çoğu (%56) Beyaz ve hastaların %34'ü Asyalıydı. Hastaların yüzde elli üçünün (%53) ECOG performans durumu (PS) 0 ve%47'sinin ECOG PS'i 1'di. Hemen hemen tüm hastalar (%99) Child Pugh A ve %1'i ChildPugh B idi. HSK için etiyolojide %38 hepatit B virüsü (HBV), %21 hepatit C virüsü (HCV),%40 diğer (ne HBV ne de HCV) bulunuyordu. Yüzde yetmiş sekizinde (%78) makroskopikvasküler invazyon ve/veya karaciğer dışı tümör yayılması, %41'inde alfa-fetoprotein (AFP)seviyeleri >400p,g/L idi, %44'ü lokal-bölgesel transarteryel embolizasyon veya kemoinfüzyonprosedürleriyle tedavi edilmişti ve %37'si kabozantinib tedavisinden önce radyoterapi almıştı.Sorafenib tedavisinin medyan süresi 5,32 aydı. İleri evre hastalık için daha önce hastalarınyüzde yetmiş ikisi (%72) 1 ve %28'i 2 sistemik tedavi rejimi almıştır. OS'de CABOMETYX için plaseboya kıyasla istatistiksel olarak anlamlı bir iyileşme olduğu gösterilmiştir (Tablo 8 ve Şekil 6) PFS ve ORR bulguları Tablo 8'de özetlenmiştir. Tablo 8: HSK'da etkililik sonuçları (ITT popülasyon, CELESTIAL)
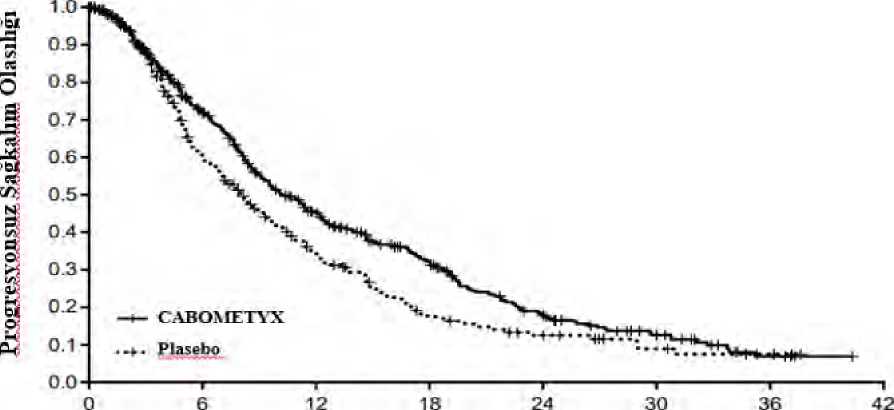
30 / 36 3 RECIST 1.1 uyarınca araştırmacı tarafından değerlendirildiği şekilde 4 tabakalı Cochran-Mantel-Haenszel (CMH) testi
Risk altındaki gönüllülerin sayısıŞekil 7: Progresyonsuz sağkalıma ilişkin Kaplan-Meier eğrisi (CELESTIAL)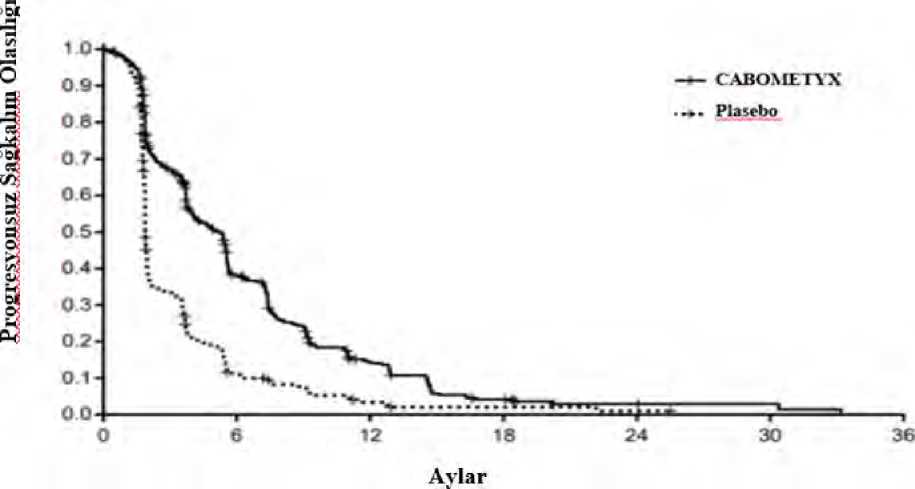
Risk altındaki gönüllülerin sayısıSistemik radyasyon dışı ve lokal karaciğere yönelik sistemik protokol olmayan antikanser tedavisi (NPACT) insidansı, kabozantinib kolunda %26 ve plasebo kolunda %33'tür. Bu 31 / 36 tedavileri alan gönüllüler, çalışma tedavisine son vermek zorunda kalmıştır. NPACT kullanımı için sansür uygulayıcı bir inceleme OS analizi, birincil analizi desteklemiştir: tabakalaşmafaktörleri (IxRS'e göre) için düzeltilen HR 0.66 (%95 GA: 0.52, 0.84; tabakalı logrank p-değeri= 0.0005)'tir. Kaplan-Meier eğrisine göre medyan OS süresi 4.2 aylık fark ile, kabozantinibkolunda 11.1 aya karşılık plasebo kolunda 6.9 ay olarak tahmin edilmiştir. EuroQoL EQ-5D-5L kullanılarak hastalığa özgü olmayan yaşam kalitesi (QoL) değerlendirilmiştir. CABOMETYX'in plaseboya karşı EQ-5D fayda endeksi skoru üzerindeolumsuz bir etkisi tedavinin ilk haftası boyunca gözlenmiştir. Bu periyot sonunda yalnızcasınırlı QoL verileri elde edilmiştir. Pediyatrik popülasyonAvrupa İlaç Ajansı, solid malign tümörlerin tedavisinde pediatrik popülasyonun-bir ya da daha fazla alt grubunda CABOMETYX ile yapılan çalışmalardan elde edilen bulguların sunulmasızorunluluğunu ertelemiştir. (pediatrik kullanıma ilişkin bilgiler için bkz. Bölüm 4.2). 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:Kabozantinibin oral yolla uygulanmasını takiben pik plazma konsantrasyonlarına dozdan 3 ila 4 saat sonra erişilmektedir. Plazma konsantrasyonu-zaman profilleri, kabozantinibinenterohepatik yeniden dolaşıma maruz kaldığına işaret eder şekilde, uygulamadan yaklaşık 24saat sonra ikinci bir emilim piki olduğunu göstermektedir. Kabozantinible 19 gün süresince 140 mg dozunda her gün yapılan tekrarlı doz uygulaması tek doz uygulamasına kıyasla yaklaşık 4 ila 5 katlık bir ortalama kabozantinib birikimi ortayaçıkarmıştır (EAA'ya göre); kararlı duruma yaklaşık 15 günde erişilmektedir. Kabozantinibin 140 mg'lik tek bir oral dozunun uygulandığı sağlıklı gönüllülerde yüksek miktarda yağ içeren bir öğün, açlık durumuna kıyasla, Cmaks ve EAA değerlerini orta düzeydearttırmıştır (sırasıyla %41 ve %57). Kabozantinib uygulamasından 1 saat sonra alınan gıdalarınkesin etkisi konusunda bilgi bulunmamaktadır. Sağlıklı gönüllülerde 140 mg'lik tek bir dozun ardından kabozantinib kapsül ile tablet formülasyonları arasında biyoeşdeğerlik ortaya konamamıştır. Tablet formülasyonunun Cmaksdeğerinde kapsül formülasyonuna kıyasla %19'luk bir artış gözlenmiştir. Kabozantinib tabletve kapsül formülasyonları arasında %10'un altında bir EAA farkı görülmüştür. Dağılım:Kabozantinibin in vitroinsan plazmasında proteine bağlanma oranı yüksektir (>%99,7). Popülasyon farmakokinetiği (PF) modeline göre merkez bölmenin (Vc/F) dağılım hacminin212 L olduğu tahmin edilmiştir.32 / 36 Biyotransformasyon:Kabozantinib in vivometabolize edilmiştir. Plazmada ana maddenin %10'undan yüksek maruziyelerde (EAA) dört metabolit tespit edilmiştir: XL184-N-oksit, XL184 amid kleavajürünü, XL184 monohidroksi sülfat ve 6-desmetil amid kleavaj ürünü sülfat.Ana madde kabozantinibin hedefli kinaz inhibisyonu potensinin <%1'ine sahip iki konjuge olmayan metabolitin (XL184-N-oksit ve XL184 amid klevaj ürünü) her biri toplam ilaçla ilişkiliplazma maruziyetinin <%10'unu oluşturmaktadır. Bir nötralize edici CYP3A4 antikoru, NADPH katalizörlü insan karaciğeri mikrozomal (HLM) inkübasyonunda metabolit XL184 N-oksit oluşumunu >%80 inhibe ettiğinden, kabozantinib bir in vitroCYP3A4 metabolizması substratıdır; bunun aksine CYP1A2, CYP2A6, CYP2B6,CYP2C8, CYP2C19, CYP2D6 ve CYP2E1 nötralize edici antikorları kabozantinib metabolitioluşumu üzerinde herhangi bir etki ortaya çıkarmamıştır. Bir CYP2C9 nötralize edici antikorkabozantinib metaboliti oluşumu üzerinde minimal etki (yani <%20 azalma) sergilemiştir.Eliminasyon:Hastalardaki karakteristik özellikler ve farmakokinetik/farmakodinamik ilişkilerBöbrek yetmezliği:Tek bir 60 mg dozunda kabozantinib ile yapılan böbrek yetmezliği çalışmasında, toplam plazma kabozantinib, Cmaks ve EAA0-inf değerlerine ilişkin geometrik LS ortalama oranlarınınböbrek fonksiyonu normal olan gönüllülere kıyasla hafif derecede böbrek yetmezliği görülengönüllülerde %19 ve %30 daha yüksek (Cmaks değerine ilişkin %90 GA %91,60 ila %155,51;EAA0-inf %98,79 ila %171,26), orta derecede böbrek yetmezliği görülen gönüllülerde ise %2ve %6-7 daha yüksek (Cmaks değerine ilişkin %90 GA %78,64 ila %133,52; EAA0-inf %79,61ila %140,11) olduğu gösterilmiştir. Bağlanmamış plazma kabozantinib EAA0-inf içingeometrik LS ortalamaları, normal böbrek fonksiyonu olan gönüllülere kıyasla, hafif böbrekyetmezliği olan gönüllüler için %0,2 daha yüksek (%90 CI %55,9 ila %180) ve orta derecedeböbrek yetmezliği olanlar için %17 daha yüksekti (%90 CI %65,1 ila %209,7). Ciddi böbrekyetmezliği olan gönüllüler üzerinde çalışma yapılmamıştır. Karaciğer yetmezliği:Sağlıklı gönüllülerde ve kanser hastalarında (HSK dahil) kabozantinibin bütünleşik bir popülasyon farmakokinetik analizine dayanarak, normal karaciğer fonksiyonuna (n = 1425) vehafif karaciğer yetmezliğine sahip (n = 558) deneklerde ortalama kabozantinib plazmamaruziyetinde klinik olarak anlamlı bir fark gözlenmemiştir. UKE-ODÇG (Ulusal KanserEnstitüsü - Organ Disfonksiyonu Çalışma Grubu) kriterlerine göre orta derecede karaciğer 33 / 36 yetmezliği (n = 15) olan hastalarda sınırlı veri vardır. Kabozantinibin farmakokinetiği şiddetli karaciğer yetmezliği olan hastalarda değerlendirilmemiştir. Irk:Gerçekleştirilmiş olan bir popülasyon FK analizinde kabozantinibin FK'sinde ırk bazında klinik açıdan anlamlı farklılık tespit edilmemiştir. 5.3. Klinik öncesi güvenlilik verileriKlinik çalışmalarda advers etkiler gözlemlenmemiştir ancak klinik maruz kalma düzeylerine benzer maruz kalma düzeylerinde hayvanlarda advers etkiler gözlemlenmiştir ve bu,muhtemelen klinik kullanım açısından önem taşımaktadır. Sıçanlar ve köpekler üzerinde 6 aya varan sürelerle gerçekleştirilen tekrarlı doz toksisitesi çalışmalarında toksisite açısından hedef organların Gİ kanal, kemik iliği, lenfoid dokular,böbrek, adrenal dokular ve üreme sistemi dokuları olduğu görülmüştür. Bu bulgular için adversetki görülmeyen düzeyin (NOAEL) amaçlanan terapötik dozda insanlardaki klinik maruziyetdüzeylerinin altında olduğu belirlenmiştir. Kabozantinib standart bir grup genotoksisite tayininde mutajenik veya klastojenik potansiyel sergilememiştir. Kabozantinibin karsinojenik potansiyeli iki tür üzerinde değerlendirilmiştir:rasH2 transgenik fareler ve Sprague-Dawley sıçanları. Sıçanlar üzerinde gerçekleştirilen 2yıllık karsinojenisite çalışmasında, insanlardaki amaçlanan maruziyetin oldukça altında kalanmaruziyetlerde kabozantinible ilişkili neoplastik bulgular, her iki cinsiyette adrenal medulladatek başına veya malign feokromositoma/kompleks malign feokromositoma ile birlikte selimfeokromositoma insidansında artış şeklinde olmuştur. Sıçanlarda gözlenen neoplastiklezyonların klinik anlamı belirsizdir fakat düşük olması olasıdır. Kabozantinibin insanlarda amaçlanan terapötik maruziyetten hafifçe daha yüksek maruziyetlerde rasH2 fare modelinde karsinojenik olmadığı görülmüştür. Sıçanlar üzerine yapılan fertilite çalışmaları erkek ve dişi fertilitesinde azalma ortaya koymuştur. Ek olarak, insanlarda amaçlanan terapötik dozda ortaya çıkan klinik maruziyetdüzeylerinin altındaki maruziyet düzeylerinde erkek köpeklerde hipospermatogenezgözlenmiştir. Sıçanlar ve tavşanlar üzerinde embriyofetal gelişim çalışmaları yapılmıştır. Sıçanlarda kabozantinib implantasyon sonrası kayıp, fetal ödem, yarık damak/dil, dermal aplazi ve kıvrıkveya rudimenter kuyruk ortaya çıkmasına neden olmuştur. Tavşanlarda kabozantinib fetalyumuşak doku değişikliklerine (dalak boyutunda azalma, akciğer orta lobunun küçük olmasıveya mevcut olmaması) neden olmuş ve fetal total malformasyon insidansını arttırmıştır.Embriyofetal toksisite ve teratojenik bulgulara ilişkin NOAEL düzeyinin amaçlanan terapötikdozda insanlardaki klinik maruziyet düzeylerinin altında olduğu belirlenmiştir. Kabozantinib uygulanan juvenil sıçanlar (>2 yaş pediyatrik popülasyon ile karşılaştırılabilir) artmış WBC parametreleri, azalmış hematopoez, pubesent/olgunlaşmamış dişi üreme sistemi(vajinal açılım gecikmesi olmadan), diş anormallikleri, kemik mineral içeriğinde veyoğunluğunda azalma, karaciğer pigmentasyonu ve lenf düğümü lenfoid hiperplazisisergilemiştir. Uterustaki/yumurtalıklardaki bulguların ve azalmış hematopoezin geçici olduğu 34 / 36 görülmüştür, kemik parametreleri ve karaciğer pigmentasyonu üzerindeki etkiler ise devam etmiştir. Juvenil sıçanlar (<2 yaş pediyatrik popülasyon ile korelasyon sergiler) tedaviyle ilişkilibenzer bulgular sergilemiştir fakat karşılaştırılabilir doz düzeylerinde kabozantinible ilişkilitoksisiteye karşı daha hassas oldukları görülmüştür. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı Maddelerin ListesiTablet içeriğiMikrokristalin selüloz Laktoz (susuz) (sığır sütünden elde edilir) Hidroksipropil selüloz Kroskarmelloz sodyumKolloidal silikon dioksit (susuz) Magnezyum stearat Film kaplama ajanı Opadry Sarı (03K92254)Hipromelloz 2910 Titanyum dioksit (E171) Triasetin Sarı demir oksit (E172) 6.2. Geçimsizlikler6.3. Raf ömrü48 ay. 6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. 6.5. Ambalajın niteliği ve içeriğiÇocuk emniyetli polipropilen kapaklı HDPE şişede, üç tane silika jel desikant kanister ve polyester fiber. Her şişede 30 film kaplı tablet bulunur. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerGeçerli olduğu takdirde kullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj Atıklarının Kontrolü Yönetmeliği' ne uygun olarak imhaedilmelidir. Kullanılmayan tıbbi ürün veya atık materyaller yerel gerekliliklere uygun şekilde bertaraf edilmelidir. 35 / 36 7. RUHSAT SAHİBİGEN İLAÇ VE SAĞLIK ÜRÜNLERİ SAN. VE TİC. AŞ. Mustafa Kemal Mah., 2119. Sok., No:3, D:2-3, 06520, Çankaya/ANKARA 8. RUHSAT NUMARASI2019/397 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsatlandırma tarihi: 18.08.2019 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ36 / 36 |
İlaç BilgileriCabometyx 20 Mg Film Kaplı TabletEtken Maddesi: Kabozantinib S-malat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.