Epamor 30 Mg/3ml Enjeksiyonluk Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIEPAMOR 30 mg/3 mL enjeksiyonluk çözelti Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her kartuş etkin madde olarak 30,90 mg apomorfrn hidroklorür hemihidrat içerir. Toplam çözelti miktarı 3 mL'dir.Yardımcı madde(ler):Sodyum metabisülfit (E223) 3 mg (her mL'de 1 mg) Sodyum hidroksit y.m. (pH ayarlayıcı olarak) Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti içeren kartuş Berrak, renksiz veya hafif sarımsı renkli ve gözle görünür partikül içermeyen çözelti pH 3.0-5.0 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarParkinsonlu hastalarda oral Parkinson tedavisiyle yeterince kontrol edilemeyen motor dalgalanmaların (on-off' fenomeni) tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/ uygulama sıklığı ve süresi:EPAMOR enjeksiyonu için uygun hastaların seçimi: EPAMOR ile tedavi için seçilen hastaların off semptomlarının başlangıcını tanımlayabiliyor olması gerekmektedir. Hastalar, kendilerine enjeksiyon yapabilecek yetiye sahip olmalıdırveya gerektiğinde kendilerine enjeksiyon yapabilecek sorumlu bir kişinin bulunmasıgerekmektedir. Tedaviye başlamadan önce hastanın en az iki gün boyunca genellikle domperidon tedavisi Beige ^iım^ğfrekidi Fsomperidon 3dözu?3ena&Wşük etMe dozaefrtreMlmelHF mütöKüraAn^1 kısa sürede kesilmelidir. Domperidon ve apomorfin tedavisini başlatma kararından önce, hastadaki QT interval uzaması için risk faktörleri, faydanın riskten daha ağır bastığından eminolmak için dikkatle değerlendirilmelidir (bkz. Bölüm 4.4). Apomorfin uzman kliniklerdeki kontrollü ortamlarda başlanmalıdır. Hasta, Parkinson hastalığının tedavisinde uzman bir doktor (örn. nörolog) tarafından izlenmelidir. EPAMORtedavisine başlanmadan önce hastanın levodopa tedavisi, dopamin agonistleriyle birlikte veyadopamin agonistleri olmadan optimize edilmelidir. Yetişkinler:Uygulama şekli:EPAMOR, aralıklı bolus enjeksiyonla subkütan kullanım içindir. EPAMOR, hastanın ve/veya bakımından sorumlu kişinin yeterli eğitimi sonrası sadece EASY ON PEN enjeksiyon cihazı ile kullanılmalıdır. Uygulama için, kalemin kullanımınınanlatıldığı talimatlar takip edilmelidir. (bkz. Bölüm 6.6) Apomorfin intravenöz yolla kullanılmamalıdır.Çözelti yeşile dönmüşse kullanmayınız. Çözelti kullanım öncesinde görsel olarak incelenmelidir. Sadece berrak, renksiz veya hafif sarımsı renkli ve partikül içermeyençözeltiler kullanılmalıdır. Eşik dozun tayini: Her hasta için uygun doz, artan doz programıyla belirlenir. Aşağıdaki program önerilir: Yaklaşık olarak 15-20 mikrogram/kg'a eşdeğer 1 mg apomorfin HCl (0.1 ml) hipokinetikveya off periyodu sırasında subkütan olarak enjekte edilebilir ve hasta motor yanıt için 30dakika boyunca gözlenir. Eğer yanıt yoksa veya yanıt yetersizse, 2 mg apomorfin HCl ikinci dozu (0.2 mL) subkütan olarak enjekte edilir. Hasta daha sonraki 30 dakika boyunca yeterli yanıt için gözlenir. Dozaj, yeterli motor yanıt sağlanıncaya kadar ardıl enjeksiyonlarla en az 40 dakikalık aralıklarla artırılabilir. Tedavinin kurulması: Uygun dozun tayin edilmesiyle, tek subkütan enjeksiyon off epizodunun ilk belirtilerinde dış kalça veya alt karına yapılabilir. Absorbsiyonun tek bir kişide, farklı enjeksiyon
2 bölgelerine göre farklı olabileceği unutulmamalıdır. BUsebepten hasta, daha sonraki saatler içinde tedaviye yanıt verme kalitesi açısından gözlenmelidir. Hastanın yanıtına göre dozajdadeğişiklikler yapılabilir.Optimal apomorfin hidroklorür dozu bireyler arası değişkenlik gösterebilir ancak bir kere belirlendiğinde her hasta için göreceli olarak sabit kalır. Tedavinin sürekliliği için önlemler:EPAMOR günlük dozu; 3-30 mg aralığı içinde, çoğu kez günde 1 -10 enjeksiyon şeklinde ve bazen de 12 ayrı enjeksiyon ile hastalar arası değişkenlik gösterir. Apomorfin HCl günlük total dozunun 100 mg'ı aşmaması önerilir ve bireysel bolus enjeksiyonlar 10 mg'ı aşmamalıdır. Klinik çalışmalarda genellikle levodopa dozunda azalma sağlanabilmiştir; bu etki hastalar arası değişkenlik gösterir ve tecrübeli doktor tarafından dikkatlice düzenlenmesi gereklidir. Tedavi belirlendikten sonra, domperidon tedavisi bazı hastalarda kademeli olarak azaltılabilir ancak, çok az hastada kusma veya hipotansiyon olmadan başarıyla sonlandırılmıştır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek /Karaciğer yetmezliği:Yetişkinler ve yaşlılar için önerilen doza benzer olan doz şeması, böbrek yetmezliği olan hastalar için takip edilmelidir (bkz. Bölüm 4.4). Pediyatrik popülasyon:EPAMOR, 18 yaşının altındaki çocuk ve adolesanlarda kontrendikedir (bkz. Bölüm 4.3). Geriyatrik popülasyon:Yaşlılar Parkinson hasta popülasy onunu iyi temsil eden gruptur ve apomorfin HCl klinik çalışmalarının uygulandığı grubun büyük bir kısmını oluşturmaktadırlar. EPAMOR ile tedavigören yaşlı hastaların tedavisi, genç hastalardan farklı değildir. Ancak, yaşlı hastalardapostural hipotansiyon riski nedeniyle tedavinin başlangıcında ekstra dikkat edilmesiönerilmektedir. 4.3. Kontrendikasyonlar
3 Solunum depresyonu, bunama, psikotik hastalıklar veya karaciğer yetmezliği olanhastalarda kontrendikedir. Apomorfin HCl tedavisi, levodopaya yanıtı on olan, şiddetli diskinezi veya distoni gösteren hastalara uygulanmamalıdır. EPAMOR, apomorfme veya bu tıbbi ürünün bileşenlerinden herhangi birine karşı aşırı duyarlılık gösteren kişilere uygulanmamalıdır. EPAMOR, 18 yaşının altındaki çocuk ve adolesanlarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriApomorfin HCl, bulantı ile kusmaya eğilimi olan kişilerde ve böbrek, akciğer veya kardiyovasküler hastalığı olan kişilere verilirken dikkatli olunmalıdır. Yaşlılarda ve/veya düşkün hastalarda tedaviye başlarken ekstra dikkat edilmelidir. Apomorfin hipotansiyona neden olduğundan, domperidon ön tedavisi ile verilse bile, öncesinde kardiyak hastalığı bulunan hastalarda veya antihipertansifler gibi vazoaktif ilaçkullanan ve özellikle önceden postural hipotansiyonu olan hastalarda dikkatli kullanılmalıdır. Apomorfin özellikle yüksek dozlarda QT uzama potansiyeline sahip olabileceğinden, torsades de pointes aritmi riski bulunan hastalara uygulanırken dikkatli olunmalıdır. Domperidon ile kombinasyon halinde kullanıldığında, hastadaki risk faktörleri dikkatlice değerlendirilmelidir. Bu, tedavi başlamadan önce ve tedavi sırasında yapılmalıdır. Önemli riskfaktörleri konjestif kalp yetmezliği, ciddi karaciğer yetmezliği veya önemli elektrolitbozuklukları gibi ciddi kalp rahatsızlıklarını içermektedir. Ayrıca elektrolit dengesini,CYP3A4 metabolizmasını veya QT aralığını etkileyebilecek ilaçlar da değerlendirilmelidir.QTc aralığı üzerindeki etkinin izlenmesi önerilmektedir. Aşağıdaki durumlarda bir EKGçekilmelidir: - domperidon ile tedaviden önce - tedaviye başlama aşamasında - bundan sonra klinik olarak belirtildiği gibi Hastaya çarpıntı, senkop veya presenkop gibi olası kardiyak semptomları bildirmesi talimatı verilmelidir. Ayrıca, gastroenterit veya diüretik tedavisinin başlatılması gibi hipokalemiye yolaçabilecek klinik değişiklikleri de bildirmelidirler.
4 Her tıbbi ziyarette, risk faktörleri gözden geçirilmelidir. Apomorfin lokal subkütan etkilerle ilişkilidir. Bunlar bazen enjeksiyon yerinin değiştirilmesiyle veya (mümkünse) ultrason kullanılarak nodülarite ve endurasyonalanlarından kaçınma ile azaltılabilir. Apomorfin ile tedavi edilen hastalarda hemolitik anemi ve trombositopeni bildirilmiştir. Apomorfin, levodopayla beraber kullanıldığında düzenli aralıklarda hematoloji testleriuygulanmalıdır. Apomorfin özellikle dar terapötik aralıklı diğer tıbbi ürünler ile birlikte kullanıldığında dikkat edilmelidir (bkz, Bölüm 4,5), İlerlemiş Parkinson hastalığı bulunan pek çok hastada aynı zamanda nöropsikiyatrik problemler bulunmaktadır, Nöropsikiyatrik bozuklukların bazı hastalarda apomorfinkullanımıyla kötüleşebileceğine ilişkin kanıt mevcuttur, Bu hastalarda apomorfin kullanırkenözel dikkat gerekmektedir, Apomorfin, özellikle Parkinson hastalarında uyku hali ve aniden gelen uyku epizodlarıyla ilişkilendirilmiştir, Hastalar bu konuda bilgilendirilmeli ve özellikle araç veya makinekullanırken dikkatli olmaları önerilmelidir. Uyku hali ve/veya ani gelen uyku durumu gelişenhastalar araç ve makine kullanımından sakınmalıdır. Ayrıca dozajın azaltılması düşünülebilir, Dürtü kontrol bozuklukları: Hastalar, dürtü kontrol bozukluğu gelişimi açısından düzenli olarak izlenmelidir, Hastalar ve bakıcıları, apomorfin dahil dopamin antagonistleriyle tedavi edilen hastalarda meydanagelebilecek patolojik kumar oynama, libido artışı, hiperseksüalite, kompulsif harcama ya dasatın alma, aşırı yeme ve kompulsif yeme gibi dürtü kontrol bozukluğunun davranışsalsemptomlarına karşı bilinçli olmalıdır. Bu semptomlar gelişirse dozun azaltılması/dozunazaltılarak kesilmesi düşünülmelidir, Dopamin Disregülasyon Sendromu (DDS) apomorfin ile tedavi edilen bazı hastalarda görülen ürünün aşırı kullanımıyla sonuçlanan bağımlılık yapan bir bozukluktur. Tedaviye başlamadanönce hastalar ve bakıcılar potansiyel DDS gelişme riski konusunda uyarılmalıdır. EPAMOR, nadiren şiddetli alerjik reaksiyonlar ve bronkospazma neden olabilen sodyum metabisülfit içerir,
5 Bu tıbbi ürün her kartuşta 1 mmol'den (23 mg) daha az sodyum içermektedir, yani aslında sodyum içermediği kabul edilebilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriApomorfın HCl tedavisi için seçilen hastaların, Parkinson hastalığının tedavisi için eş zamanlı ilaçlar alacağı neredeyse kesindir. Apomorfın HCl tedavisinin başlangıcında hasta, olağan dışıyan etkiler ve etkinin potansiyalizasyonu açısından gözlenmelidir. Nöroleptik tıbbi ürünler apomorfın ile beraber kullanıldığında antagonistik etki gösterebilir. Apomorfin ve klozapin arası potansiyel bir etkileşim bulunmaktadır; fakat klozapinnöropsikiyatrik komplikasyon semptomlarını azaltmak için de kullanılabilir. Apomorfınin diğer tıbbi ürünlerin plazma konsantrasyonları üzerindeki olası etkileri çalışılmamıştır. Bu nedenle apomorfinin, özellikle terapötik aralığı dar olan diğer tıbbiürünlerle birlikte kullanımında dikkatli olunması tavsiye edilir. Antihipertansif ve Kardiyak Aktif Tıbbi Ürünler Domperidon ile birlikte kullanıldığında dahi, apomorfin bu tıbbi ürünlerin antihipertansif etkilerini arttırabilir (bkz. Bölüm 4.4). QT aralığını uzattığı bilinen diğer ilaçlar ile apomorfin uygulanmasından kaçınılması önerilmektedir. Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:EPAMOR, 18 yaşının altındaki çocuk ve adolesanlarda kontrendikedir. 4.6. Gebelik ve laktasyonGenel TavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)EPAMOR'un çocuk doğurma potansiyeli bulunan kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Doğurganlık potansiyeli olan kadınlarda uygun bir kontrasepsiyon yöntemiönerilmelidir.
6 Gebelik dönemiEPAMOR'un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir. İnsanlara yönelik potansiyel risk bilinmemektedir (bkz. Bölüm 5.3). EPAMOR açıkça gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiApomorfrnin anne sütüne geçip geçmediği bilinmemektedir. Emzirmenin sürdürülüp sürdürülmeyeceğine ya da EPAMOR tedavisinin sürdürülüp sürdürülmeyeceğine ilişkin kararverilirken, emzirmenin çocuk açısından faydası ve EPAMOR tedavisinin emziren anneaçısından faydası dikkate alınmalıdır. Üreme yeteneği/FertiliteHayvan üreme çalışmaları herhangi bir teratojenik etkiye işaret etmemekte ancak, anneye toksik olan dozlar sıçanlara verildiğinde yeni doğanda solunum yetersizliğine neden olmuştur.İnsanlar için potansiyel risk bilinmemektedir (bkz. Bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkilerApomorfin HCl'nin araç ve makine kullanım yeteneği üzerine hafif veya orta derecede etkisi bulunmaktadır. Apomorfinle tedavi edilen ve uyku hali ve/veya ani uyku epizodları gösteren hastalar, tekrarlayan epizodlar ve uyku hali ortadan kalkana dek, araç kullanma veya dikkatbozukluğunun kendilerini ve diğer kişileri ciddi yaralanma veya ölüm riski altınasokabilecekleri faaliyetlerde bulunmaktan (örn. makine kullanma) sakınma konusundabilgilendirilmelidir (bkz. Bölüm 4.4). Bu ilaç, zihinsel fonksiyona zarar verebilir ve hastanın güvenli şekilde araç kullanma yeteneğini etkileyebilir. Bu ilaç reçete edilirken hasta aşağıdaki şekilde bilgilendirilmelidir: - Bu ilacın, araç kullanma yeteneğinizi etkileme ihtimali vardır.- İlacın sizi nasıl etkilediğini bilene dek araç kullanmayınız.4.8. İstenmeyen etkilerSistem organ sınıfına göre aşağıda listelenen istenmeyen olayların sıklık dereceleri şu şekilde tanımlanmıştır:
7 Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1,000 ila <1/100); seyrek (>1/10,000 ila <1/1,000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor) Kan ve lenf sistemi hastalıklarıYaygın olmayan: Apomorfinle tedavi gören hastalarda hemolitik anemi ve trombositopeni bildirilmiştir. Seyrek: Apomorfin HCl ile tedavi sırasında nadiren eozinofili oluşmuştur, Bağışıklık sistemi hastalıklarıSeyrek: Sodyum metabisülfit varlığından dolayı anafilaksi ve bronkospazm dahil alerjik reaksiyonlar oluşabilir. Psikiyatrik hastalıklarÇok yaygın: Halüsinasyonlar Yaygın: Parkinson hastalarında nöropsikiyatrik bozukluklar yaygındır. EPAMOR bu hastalarda dikkatli kullanılmalıdır. Apomorfin HCl tedavisi sırasında geçici hafif bilinçbulanıklığı ve görsel halüsinasyonlar dahil nöropsikiyatrik bozukluklar oluşmuştur, Bilinmiyor: Dürtü kontrol bozuklukları: Apomorfin dahil olmak üzere, dopamin agonistleri ile tedavi gören hastalarda, patolojik kumar oynama, cinsel istekte artış, hiperseksüalite, kompulsifharcama veya satın alma, aşırı yeme ve kompulsif yeme meydana gelebilir (bkz, Bölüm 4,4),Agresyon, ajitasyon Sinir sistemi hastalıklarıYaygın: Tedavinin başlangıcında apomorfin HCl'nin her dozuyla geçici sedasyon oluşabilir; bu genellikle ilk birkaç hafta içinde düzelir, Apomorfin uyku hali ile ilişkilendirilir, Baş dönmesi/bayılma hissi bildirilmiştir. Yaygın olmayan: Apomorfin on periyodu sırasında, bazı durumlarda şiddetli olabilen diskineziyi indükleyebilir ve bu durum birkaç hastada tedavinin kesilmesi ile sonuçlanabilir,Apomorfin ani uyku epizodları ile ilişkilendirilmiştir (bkz, ayrıca bölüm 4,4), Bilinmiyor: Senkop Başağrısı 8 Vasküler hastalıklarYaygın olmayan: Seyrek olarak postural hipotansiyon gözlenir ve genellikle geçicidir (bkz. Bölüm 4.4). Solunum, göğüs hastalıkları ve mediastinal hastalıklarYaygın: Apomorfin tedavisi sırasında esneme bildirilmiştir. Yaygın olmayan: Solunum güçlükleri bildirilmiştir. Gastrointestinal hastalıklarYaygın: Genellikle domperidon kesilmesinin sonucu olarak, özellikle apomorfin tedavisine ilk başlandığında bulantı ve kusma bildirilmiştir (bkz. Bölüm 4.2). Deri ve deri altı doku hastalıklarıYaygın olmayan: Lokal ve yaygın döküntü bildirilmiştir. Genel bozukluklar ve uygulama bölgesine ilişkin bozukluklarÇok yaygın: Çoğu hastada, özellikle sürekli kullanımla enjeksiyon bölgesi reaksiyonları meydana gelmektedir. Bunlar arasında, subkütan nodüller, sertleşme, eritem, aşırı hassasiyetve panikülit yer alabilir. Çeşitli diğer lokal reaksiyonlar da gelişebilir (irritasyon, kaşıntı,çürükler ve ağrı gibi). Yaygın olmayan: Enjeksiyon bölgesi nekrozu ve ülser bildirilmiştir. Bilinmiyor: Periferal ödem bildirilmiştir. AraştırmalarYaygın olmayan: Apomorfin alan hastalarda pozitif Coombs' testi bildirilmiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonların raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
9 4.9. Doz aşımı ve tedavisiBu uygulama yoluyla apomorfin aşırı dozajı üzerine sınırlı sayıda deneyim bulunmaktadır. Aşırı dozaj semptomları aşağıda önerildiği şekilde empirik olarak tedavi edilebilir: Aşırı kusma: Domperidon ile tedavi edilebilir. Solunum depresyonu: Nalokson ile tedavi edilebilir. Hipotansiyon: Uygun ayarlamalar yapılmalıdır; örneğin yatağın ayak yüksekliğiniartırmak. Bradikardi: Atropinle tedavi edilebilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup : Dopamin agonistleri ATC Kodu : N04BC07 Apomorfin dopamin reseptörlerinin direkt stimülanıdır ve hem D1 hem de D2 reseptör agonisti özellikleri gösterirken levodopa ile metabolik veya transport yolaklarını paylaşmaz. Her ne kadar deney hayvanlarında, apomorfin uygulaması nigro-striatal hücrelerin ateşleme (deşarj) hızını baskılarsa da, düşük dozun endojen dopamin salınımının pre-sinaptikinhibisyonuyla lokomotor aktivitede azalmaya neden olduğu gösterilmiştir. Parkinson'a bağlımotor yetersizlik üzerine etkisi post-sinaptik reseptör bölgeleri aracılığıyladır. Bu bifazik etkiinsanlarda da gözlenmiştir. 5.2. Farmakokinetik özelliklerGenel özelliklerApomorfinin subkütan enjeksiyonu sonrası farmakokinetiği iki kompartımanlı bir model ile tanımlanabilir. Emilim:Apomorfin, klinik etkilerin hızlı başlangıcı ile korele (uyumlu) olarak (4-12 dakika) subkütan dokudan hızlı ve tam olarak absorbe olur.
10 Dağılım:Serebrospinal sıvıdaki apomorfin seviyesi ile klinik cevap doğrudan ilişkilidir; ilacın dağılımını en iyi iki kompartımanlı model tanımlar. Dağılım yarı ömrü 5 (± 1.1) dakikadır. Biyotransformasyon:Apomorfin metabolizması, toplamın yaklaşık olarak yüzde onu şeklinde glukuronidasyon ve sülfonasyon aracılığıyladır; diğer yolaklar tanımlanmamıştır. Eliminasyon:Eliminasyon yarı-ömrü 33 (± 3.9) dakikadır. Etkin maddenin klinik etkisinin kısalığı (yaklaşık 1 saat), maddenin hızlı klerensi ile açıklanmaktadır. Doğrusallık/Doğrusal olmayan durum:Veri yoktur. 5.3. Klinik öncesi güvenlilik verileriKısa ürün bilgilerinin diğer kısımlarında yer alan bilgiler yanında, tekrarlanan doz subkütan toksisite çalışmaları insanlar için özel bir tehlike göstermemektedir. İn vitroin vivoçalışmalarda apomorfin genotoksik değildir.Apomorfinin üreme üzerine etkileri sıçanlarda incelenmiştir. Apomorfin bu türde teratojenik değildir, fakat anneye toksik olan dozların yeni doğanda solunum güçlüğü ve maternalbakımda kayıplara neden olabileceği kaydedilmiştir. Herhangi bir karsinojenite çalışması yapılmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSodyum metabisülfıt (E223) Hidroklorik asit (pH ayarlaması için) Sodyum hidroksit (pH ayarlaması için) elektronik imza ile imzalanmıştır.
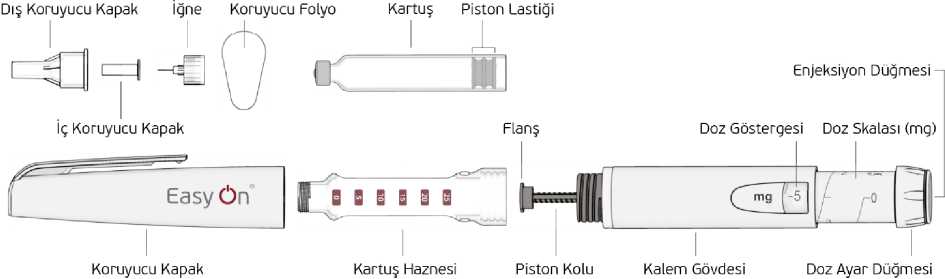
11 Enjeksiyonluk SU6.2. GeçimsizliklerGeçimsizlik çalışmaları bulunmadığından, bu ürün diğer tıbbi ürünlerle karıştırılmamalıdır. 6.3. Raf ömrü24 ay İlk açıldıktan sonra: 25°C'de 15 gün stabilitesini koruduğu gösterilmiştir. 6.4. Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız. Işıktan korumak amacıyla orijinal ambalajında saklayınız. Kartuş içindeki çözelti yeşile dönmüşse, kullanmayınız. Sadece berrak, renksiz veya hafif sarımsı renkli ve gözle görünür partikül içermeyen kartuş kullanılmalıdır. Ürün açıldıktan sonra 25°C'de 15 güne kadar kullanılabilir. Bu süreden sonra EPAMOR'u yeniden kullanmayın. Yeni bir EPAMOR kullanın. 6.5. Ambalajın niteliği ve içeriğiBromobütil tıpalı, 3 mL'lik Tip I renksiz cam kartuş. Her bir kartuş 3mL çözelti içermektedir. Bir kutu 5 adet kartuş içerir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler veya atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. EPAMOR kartuşu kullanmadan önceNot: Kalem ve kalem iğnesi kutu içeriğine dahil değildir. EPAMOR kartuş, yalnızca EasyON® PEN apomorfin HCL Otomatik Enjeksiyon Kalemi ve tek kullanımlık otomatik enjeksiyon kalemi iğneleri ile birlikte kullanılmak üzeretasarlanmıştır. Otomatik enjeksiyon kalemi bileşenleri
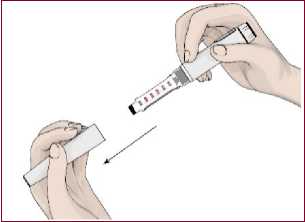
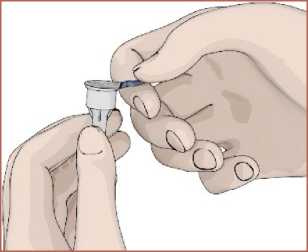
12 Kontaminasyonu önlemek için her enjeksiyon için daima yeni bir iğne kullanın. İğnelerinizi ve otomatik enjeksiyon kaleminiz başka kişiler ile paylaşmayınız. EPAMOR kartuşu kullanmadan önce, doğru kullanım hakkında bilgi edinmek içinotomatik enjeksiyon kaleminizi ve kullanım kılavuzunuzu inceleyin. Kaleminiz hasarlıysaveya düzgün çalışmıyorsa (mekanik arızalar nedeniyle), lütfen kalemin KullanımTalimatlarına bakın. EPAMOR kartuş nereye ve nasıl enjekte edilir? Ellerinizi yıkayın. Başlamadan önce koruyucu folyosu içinde yeni bir otomatik enjeksiyon kalemi iğnesi,alkollü ped veya pamuğa ihtiyacınız olacaktır. Otomatik enjeksiyon kaleminin hazırlanması / kartuşun değiştirilmesi1. Koruyucu kapağı çıkarın. 2. Kartuş haznesini saat yönününde döndürerek çıkarın. 3. Kartuş haznesi içerisine yeni kartuşu yerleştirin.
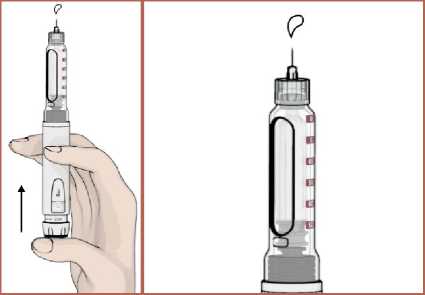
13  4. Parmağınız ile piston kolunu tamamen geriye itin.
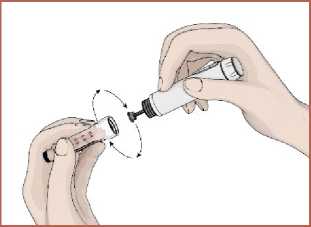
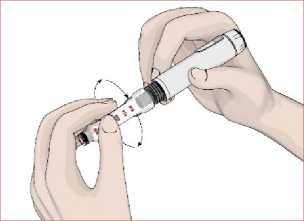
5. Kartuş haznesini saat yönünün tersinde döndürerek kalem gövdesi ile birleştirin. Otomatik enjeksiyon kalemine iğnenin takılması1. Talimatları takip edin. Koruyucu folyoyu çıkartın. 2. İğneyi saat yönünün tersinde döndürerek kartuş haznesi ile birleştirin. 14 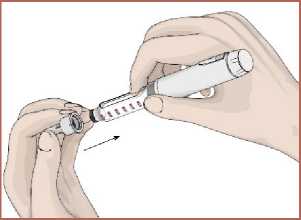 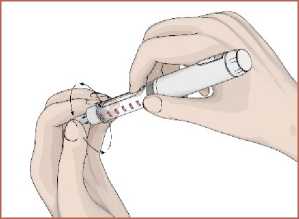 3. İğnenin dış koruyucu kapağını çıkarın. Dış koruyucu kapağı saklayın. 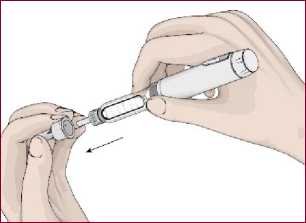 4. İğnenin iç koruyucu kapağını çıkarın. İç koruyucu kapağı saklayın. 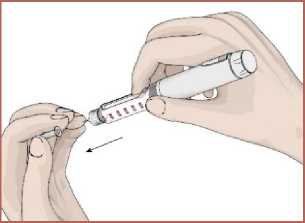 Kartuş içindeki havanın boşaltılması / İşlev kontrolüKullanmadan önce kartuş içerisinde kalan havanın çıkartılması gerekir. Bunun yapılması otomatik enjeksiyon kaleminizi kullanırken ayarlanan dozun tam olarak enjekte edilmesi içinönemlidir. 1. DOZU1 mg'a ayarlayın.
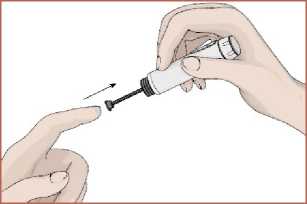
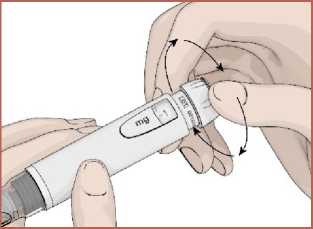
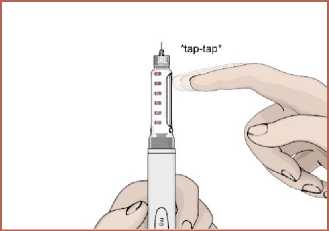
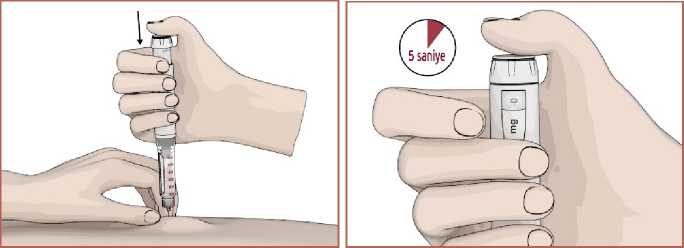
15 2. Kalemi iğne yukarıya gelecek şekilde tutun. Hava kabarcıklarının yukarıya çıkabilmesikartuş haznesine parmağınızla hafifçe vurun. 3. Enjeksiyon düğmesine basın ve 5 saniye kadar basılı tutun. Birkaç damla ilacın iğneucundan çıkıp çıkmadığı kontrol edin. 4. İğne ucundan ilaç çıkmaz ise 1 ile 4 arasındaki adımları tekrarlayın. 1 ile 4 arasındakiadımları tekrar etmenize rağmen iğne ucundan ilaç gelmiyorsa veya herhangi bir endişenizvarsa iğneyi değiştirerek 1 ile 4 arasındaki adımları tekrar edin. Dozun ayarlanması1. Dozaj düğmesini saat yönünde çevirerek ilaç dozunuzu ayarlayın. Ayarladığınız ilaçdozunu doz göstergesinden kontrol edebilirsiniz. Eğer gerekenden fazla dozayarladıysanız dozaj düğmesini saat yönünün tersinde döndürerek düzeltebilirsiniz.
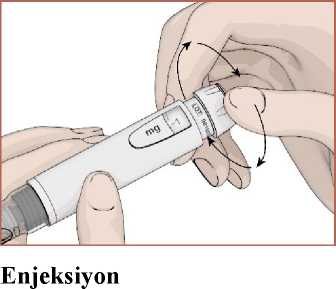
16 1. Seçtiğiniz enjeksiyon yerini alkollü ped veya pamuk ile temizleyin ve kurumasına izinverin. 2. EPAMOR kartuşu, doktorunuzun veya hemşireniz tarafından gösterildiği şekilde karınveya bacağınızın üst ve ön kısmına (Diz ile kasığınız arasında yer alan kısım) Deri Altıolarak enjekte ediniz. 3. Başparmak ve işaret parmak arasında enjeksiyon yerinin cilt ve yağ dokusunun bir kısmınısıkıştırın. Diğer elinizle, baş parmağınızı enjeksiyon düğmesinin üzerine koyun ve iğneyisıkışmış deriye batırın. Enjeksiyon düğmesini yavaş yavaş ve güçlü bir şekilde, duruncayakadar aşağıya bastırın. Durduktan sonra düğmeyi 5 saniye süreyle basılı tutun ve ardındaniğneyi deriden dışarıya çekin. 4. Dozaj penceresinde görüntüye gelen 0 rakamı dozun tümünü vermiş olduğunuzugösterir. Her EPAMOR kartuş enjeksiyonu için farklı bir enjeksiyon bölgesi kullanın. Bu,enjeksiyon yerinde cilt reaksiyonu oluşma şansını azaltacaktır. EPAMOR kartuşenjeksiyonlarını cildin ağrılı, kızarmış veya hasarlı bir bölgesine yapmayın. Asla damar içine (intravenöz) veya kas içine (intramüsküler) enjeksiyon yapmayın. EPAMOR kartuşu kullandıktan sonraHer enjeksiyondan sonra iğneyi çıkarın ve atın. (güvenli imha için bkz. Bölüm 6.6)
17 Her enjeksiyondan sonra iğnenin çıkartılması1. İğnenin iç ve dış koruyucu kapağını takın. 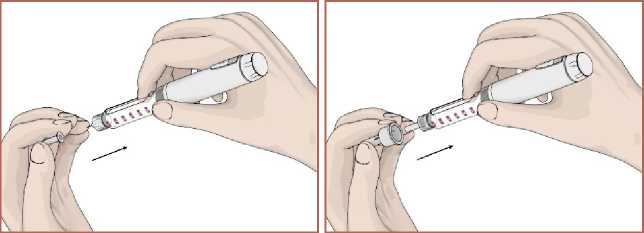 2. İğneyi saat yönünde döndürerek kartuş haznesinde çıkarın. Kullanılmış olan iğneyi imhaedin. Her enjeksiyon için yeni bir iğne kullanınız. 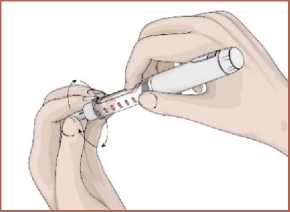 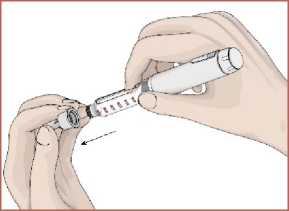 3. Kullanım sonrasında koruyucu kapağı takınız. 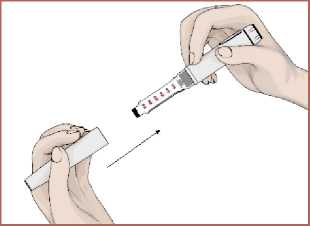 Kullanmadığınız zamanlarda koruyucu kapağı daima kapalı tutunuz. Yeni bir EPAMOR kartuş 15 güne kadar kullanılabilir. (bkz. Bölüm 6.4) Bir sonraki enjeksiyon için kartuş içerisinde yeterli çözelti yok ise kartuşu atınız. Kullanılmış olan iğneyi doktorunuz veya eczacınız önerdiği şekilde imha edin. 7. RUHSAT SAHİBİGEN İLAÇ VE SAĞLIK ÜRÜNLERİ SAN. VE TİC. AŞ. Mustafa Kemal Mah., 2119. Sok., No:3, D:2-3, 06520 Çankaya/ANKARA 8. RUHSAT NUMARASI2022/314 Bu belge
18 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 03.06.2022 Ruhsat yenileme tarihi: 10. KUB'UN YENİLENME TARİHİ19 |
İlaç BilgileriEpamor 30 Mg/3ml Enjeksiyonluk ÇözeltiEtken Maddesi: Apomorfin Hidroklorür Hemihidrat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.