Onbrez Breezhaler 150 Mcg Inhaler Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIONBREZ BREEZHALER 150 mcg İnhaler Kapsül 2. KALİTATİF VE KANTİFATİF BİLEŞİMEtkin madde:İndakaterol maleat 194 gg (150 mikrogram indakaterole eşdeğer) Cihazdan serbestlenen doz (ONBREZ BREEZHALER cihazının ağız parçasından çıkan doz) 120 mikrogram indakateroldür. Yardımcı maddeler:Laktoz monohidrat (sığır kaynaklı) 24,8 mg Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMİnhaler kapsülİçerisinde beyaz toz bulunan, sarımsı transparan renksiz sert jelatin kapsüllerin başlık kısmındaki siyah bir çizginin altında siyah renkte firma logosu 1", no: 3 boyutundaki gövdesindeki siyah çizginin üst kısmında siyah renkte ürün kodu IDL 150 basılıdır. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarONBREZ BREEZHALER, kronik obstrüktif akciğer hastalığı (KOAH) olan yetişkin hastalardaki hava yolu obstrüksiyonunun idame (sürekli) tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Önerilen doz, ONBREZ BREEZHALER inhalasyon cihazı kullanılarak bir adet 150 mikrogramlık kapsül içeriğinin günde bir kere inhalasyonudur. Doz, sadece tıbbi tavsiyeüzerine artırılmalıdır. Günde bir kez, 1 adet 300 mikrogramın ONBREZ BREEZHALER cihazı ile inhalasyonunun, özellikle şiddetli KOAH'ı olan hastalarda nefes darlığı açısından ilave klinik yarar sağladığıgösterilmiştir. Gerektiğinde maksimum doz olan günde 300 mikrograma çıkılabilir. Uygulama şekli:ONBREZ BREEZHALER kapsülleri sadece ONBREZ BREEZHALER inhalasyon cihazı kullanılarak oral inhalasyon yolu ile uygulanmalıdır. ONBREZ BREEZHALER kapsülleryutulmamalıdır. ONBREZ BREEZHALER kapsüller her zaman blister ambalajında saklanmalıve KULLANMADAN HEMEN ÖNCE blisterden çıkarılmalıdır. ONBREZ BREEZHALER, her gün aynı saatte uygulanmalıdır. Eğer bir doz kaçırılırsa, sonraki doz ertesi gün her zamanki saatinde alınmalıdır. Her ürün ambalajı bir adet ONBREZ BREEZHALER cihazı içermektedir. Kutu içerisindeki kapsüller bittikten sonra inhalasyon cihazı atılır. Ürünün doğru olarak nasıl uygulanacağı hastalara gösterilmelidir. Solunumunda düzelme olmayan hastalara ilacı inhale etmek yerine yutup yutmadığı sorulmalıdır. Uygulama öncesinde tıbbi ürünün kullanımına ilişkin talimatlar için Bölüm 6.6'ya bakınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda doz ayarlamasına gerek bulunmamaktadır (bkz. Bölüm 5.2). Karaciğer yetmezliği:Hafif ila orta şiddette karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli karaciğer yetmezliği olan hastalarda ONBREZ BREEZHALER kullanımı ile ilgili verimevcut değildir (bkz. Bölüm 5.2). Pediyatrik popülasyon:ONBREZ BREEZHALER, 18 yaşın altındaki hastalardakullanılmamalıdır. Geriyatrik popülasyon:4.3. Kontrendikasyonlarİndakaterole ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılıkta kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriAstım: ONBREZ BREEZHALER, astımda kullanılmamalıdır, çünkü astımda ONBREZ BREEZHALER ile ilgili uzun dönem sonuç verileri yoktur. Uzun etkili beta2-adrenerjik agonistler, astım tedavisinde kullanıldığında, astım ile bağlantılı ölümler de dahil olmak üzere astım ile ilişkili ciddi advers olaylar riskini artırabilir. Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. ONBREZ BREEZHALER astım hastalığının tedavisi için önerilmez. İnhale kortikosteroidlere ek olarak uzun etkili beta agonist kullanan pediyatrik ve adölesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem de uzunetkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir. Aşırı duyarlılık: ONBREZ BREEZHALER uygulamasından sonra ani aşırı duyarlılık reaksiyonları bildirilmiştir. Eğer alerjik reaksiyonlara işaret eden (özellikle, nefes ya da yutkunma güçlüğü, 2 / 18 dil, dudaklar ve yüzde şişme, ürtiker, deri döküntüsü) belirtiler meydana gelirse, ONBREZ BREEZHALER kullanımı hemen bırakılmalı ve alternatif bir tedavi başlatılmalıdır. Paradoksal bronkospazm: Diğer inhalasyon tedavilerinde olduğu gibi ONBREZ BREEZHALER uygulaması da yaşamı tehdit edebilen paradoksal bronkospazm ile sonuçlanabilir. Paradoksal bronkospazm oluşursa,ONBREZ BREEZHALER hemen kesilmeli ve alternatif tedavi başlanmalıdır. Hastalığın kötüleşmesi: ONBREZ BREEZHALER, akut bronkospazm epizotlarının tedavisi için (yani kurtarıcı tedavi olarak) endike değildir. ONBREZ BREEZHALER tedavisi sırasında KOAH'ta (KronikObstrüktif Akciğer Hastalığı) kötüleşme görülürse, hastanın ve KOAH tedavi rejiminin tekrardeğerlendirilmesi gereklidir. ONBREZ BREEZHALER günlük dozunun, 300 mikrogramlıkmaksimum dozun üzerine çıkarılması uygun değildir. Sistemik etkiler: Önerilen dozlarda ONBREZ BREEZHALER uygulamasından sonra kardiyovasküler sistem üzerinde klinik olarak anlamlı herhangi bir etki genellikle gözlenmemesine rağmen diğer beta2-adrenerjik agonistlerde olduğu gibi ONBREZ BREEZHALER de kardiyovasküler bozukluğu(koroner arter hastalığı, akut miyokard infarktüsü, kardiyak aritmiler ve hipertansiyon),konvülsif bozukluğu veya tirotoksikozisi olan hastalarda ve beta2-adrenerjik agonistlerebeklenmedik şekilde yanıt veren hastalarda dikkatle kullanılmalıdır. Diğer inhale beta2-adrenerjik ilaçlarla olduğu gibi ONBREZ BREEZHALER, tavsiye edilenden daha yüksek dozda ve sıklıkta kullanılmamalıdır. ONBREZ BREEZHALER, diğer uzun etkili beta2-adrenerjik agonistlerle ya da uzun etkili beta2-adrenerjik agonistleri içeren bir tedavi ile birlikte kullanılmamalıdır. Kardiyovasküler etkiler: ONBREZ BREEZHALER, diğer beta2-adrenerjik agonistler gibi, bazı hastalarda, nabız, kan basıncı ve/veya semptomlarda artışla ölçülen klinik olarak anlamlı kardiyovasküler etkioluşturabilir. Bu tür etkiler oluşursa tedavinin kesilmesi gerekebilir. Ayrıca, beta-adrenerjikagonistlerin EKG değişiklikleri (T dalgasında düzleşme, QT aralığında uzama ve ST segmentdepresyonu) oluşturduğu bildirilmiştir. Bu bulguların klinik önemi bilinmemektedir. Bu yüzdenONBREZ BREEZHALER gibi uzun etkili beta2-adrenerjik agonistler (LABA) veya LABAiçeren Onbrez Breezhaler gibi ürünler, QT aralığında uzama görülen ya da şüphelenilen veyaQT aralığını etkileyen ilaçlarla tedavi edilen hastalarda dikkatli kullanılmalıdır. Hipokalemi: Beta2-adrenerjik agonistler, bazı hastalarda kardiyovasküler advers etkiler oluşturma potansiyeli olan anlamlı hipokalemi oluşturabilir. Serum potasyum düzeyinde düşüş genelliklegeçicidir ve takviye gerektirmez. Şiddetli KOAH'lı hastalarda hipokalemi; hipoksi ve eşzamanlı olarak kullanılan tedavilerle (bkz. Bölüm 4.5.) artabilir ve bu da kardiyak aritmilerekarşı duyarlılığı artırabilir. Hiperglisemi: Beta2-adrenerjik agonistlerin yüksek dozlarda inhalasyonu, plazma glukozunda artışlara yol açabilir. ONBREZ BREEZHALER tedavisinin başlatılmasını takiben plazma glukozudiyabetik hastalarda daha yakından takip edilmelidir. 3 / 18 Klinik çalışmalar sırasında kan glukozundaki klinik açıdan anlamlı değişiklikler, önerilen dozlarda ONBREZ BREEZHALER'in uygulandığı grupta plaseboya göre %1-2 daha sıkgözlenmiştir. ONBREZ BREEZHALER, diyabeti iyi kontrol altında olmayan hastalardaaraştırılmamıştır. ONBREZ BREEZHALER, laktoz monohidrat içerir. Nadir kalıtımsal galaktoz intoleransı, toplam laktaz eksikliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacıkullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriSempatomimetik ajanlar: Diğer sempatomimetik ajanların eş zamanlı uygulanması (tek başına veya kombinasyon tedavisinin bir parçası olarak) ONBREZ BREEZHALER'in istenmeyen etkilerinigüçlendirebilir. ONBREZ BREEZHALER, diğer uzun etkili beta2-adrenerjik agonistler ya da uzun etkili beta2-adrenerjik agonistler içeren tıbbi ürünlerle birlikte kullanılmamalıdır. Hipokalemik tedavi: Metilksantin türevleri (örn. teofilin), steroidler (örn. prednizolon) veya potasyum tutucu olmayan diüretikler ile eş zamanlı hipokalemik tedavi, beta2-adrenerjik agonistlerin olasıhipokalemik etkisini güçlendirebilir, bu nedenle dikkatli kullanılmalıdır (bkz. Bölüm 4.4). Beta-adrenerjik blokörler: Beta-adrenerjik blokörler ve beta2-adrenerjik agonistler, birlikte uygulandıklarında birbirlerinin etkisini zayıflatabilir veya antagonize edebilir. Bu nedenle, kullanılmaları zorunlu olmadığısürece indakaterol, beta-adrenerjik blokörlerle (göz damlaları dahil) birlikte kullanılmamalıdır.Gerekli olduğu durumlarda kardiyoselektif beta-adrenerjik blokörler tercih edilmeli, ancakbunlar dikkatle uygulanmalıdır. Metabolik ve taşıyıcı bazlı etkileşimler: İndakaterol klirensinde temel rolü olan CYP3A4 ve P-glikoproteinin inhibisyonu, sistemik indakaterol maruziyetini iki kata kadar artırmaktadır. ONBREZ BREEZHALER'in önerilenmaksimum terapötik dozların 2 katına kadar olan dozlarda, 1 yıla kadar süreyle kullanıldığıklinik çalışmalarda tedavi konusunda elde edilen güvenlilik deneyimi göz önüne alındığında,ilaç etkileşimlerine bağlı olarak maruziyet büyüklüğünün artışı herhangi bir güvenlilik endişesioluşturmamaktadır. İndakaterolün eş zamanlı kullanılan ilaçlarla etkileşime neden olduğu gösterilmemiştir. İn vitro4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk sahibi olma potansiyeline sahip kadınlar için özel öneriler bulunmamaktadır. 4 / 18 Gebelik dönemiHayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. ONBREZ BREEZHALER, gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Indakaterolün gebe kadınlarda kullanımına ilişkin veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, klinik olarak ilgili maruziyetlerde üreme toksisitesi açısından doğrudanveya dolaylı zararlı etkiler göstermemektedir (bkz. Bölüm 5.3). Diğer beta2-adrenerjikagonistler gibi, indakaterol de rahim düz kası üzerindeki gevşetici etkisi nedeniyle doğumuengelleyebilir. ONBREZ BREEZHALER gebelik sırasında ancak beklenen yararlar potansiyelrisklerden fazlaysa kullanılmalıdır. Laktasyon dönemiİndakaterol/metabolitlerin insan sütüne geçip geçmediği bilinmemektedir. Hayvanlardan elde edilen farmakokinetik/toksikolojik veriler indakaterol/metabolitlerin süte geçtiğinigöstermektedir. Emzirilen çocuk için risk göz ardı edilemez. Emzirmenin çocuk için vetedavinin anne için yararları göz önüne alınarak emzirmenin ya da ONBREZ BREEZHALERtedavisinin bırakılması kararı verilmelidir. Üreme yeteneği/Fertilite:Sıçanlarda gebelik oranlarında düşme gözlenmiştir. Yine de, önerilen maksimum dozda inhalasyonu takiben, indakaterolün insanlarda üreme ya da fertilite performansını etkilemesininpek olası olmadığı düşünülmektedir (bkz. Bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkilerONBREZ BREEZHALER'in araç ve makine kullanımı üzerine hiçbir etkisi yoktur ya da ihmal edilebilir bir etkisi vardır. 4.8. İstenmeyen etkilerÖnerilen dozlarda gözlenen en yaygın advers reaksiyonlar; nazofarenjit (14,3), öksürük (% 8,2), üst solunum yolu enfeksiyonu (%14,2), baş ağrısı (%3,7) ve kas spazmlarıdır (%3,5). Bunlarınbüyük kısmı hafif ya da orta şiddettedir ve tedavinin devam ettirilmesi durumunda sıklıklarıazalmaktadır. KOAH hastalarında önerilen dozlarda ONBREZ BREEZHALER'in advers ilaç reaksiyonu profili, beta2-adrenerjik stimülasyonunun klinik olarak anlamlı olmayan sistemik etkilerinigöstermektedir. Ortalama kalp atım hızı değişiklikleri dakikada birden daha az olmuştur;taşikardi nadir olarak gözlenmiştir ve plasebo grubuna benzer oranda bildirilmiştir. Plasebo ilekarşılaştırıldığında, QTcF aralıklarında anlamlı uzamalar saptanmamıştır. Dikkate değer QTcFaralığı [yani >450 ms (erkekler) ve >470 ms (kadınlar)] ve hipokalemi bildirimleri plasebo ilebenzer bulunmuştur. Kan şekerinde maksimum değişikliklerin ortalaması, ONBREZBREEZHALER ve plasebo gruplarında benzer bulunmuştur. ONBREZ BREEZHALER, Faz III klinik gelişim programı, orta ila şiddetli KOAH klinik tanısı olan hastaları içermiştir. 4.764 hasta, bir yıla kadar önerilen maksimum dozun iki katına kadarolan dozlarda indakaterole maruz kalmıştır. Bu hastalardan 2.611'i günde bir kez 150 5 / 18 mikrogram indakaterol tedavisindeyken 1.157'si günde bir kez 300 mikrogram indakaterol tedavisi görmüştür. Hastaların yaklaşık olarak %41'i ağır KOAH olup ortalama yaşları 64'tür,%48'i 65 yaşın üzerindedir ve çoğunluğu (%80) beyaz ırka mensuptur. Aşağıdaki advers ilaç reaksiyonları, KOAH güvenlilik veritabanında MedDRA sistem organ sınıfına göre sıralanmıştır. Advers reaksiyonlar her bir sistem organ sınıfı içinde aşağıdakikategoriler altında azalan sıklık sırasına göre dizilmiştir (CIOMS III): Çok yaygın (>1/10);yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila<1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Sıklık kategorisiYaygın Yaygın Yaygın Yaygın olmayan Yaygın olmayan Yaygın Yaygın Yaygın olmayan Yaygın olmayan Yaygın olmayanYaygın olmayanYaygın olmayan Yaygın Yaygın Yaygın Yaygın olmayan Yaygın olmayanYaygın Yaygın olmayan Yaygın olmayan Advers reaksiyonlarEnfeksiyonlar ve enfestasyonlarNazofarenjit Üst solunum yolu enfeksiyonu Sinüzit Bağışıklık sistemi hastalıklarıAşırı duyarlılık 1 Metabolizma ve beslenme hastalıklarıDiyabet ve hiperglisemi Sinir sistemi hastalıklarıBaş ağrısı Baş dönmesiParestezi Kardiyak hastalıklarİskemik kalp hastalığı PalpitasyonlarAtriyal fibrilasyonTaşikardi Solunum, göğüs bozuklukları ve mediastinal hastalıklarıÖksürük Gırtlak irritasyonu içeren orofaringal ağrı Rinore Paradoksal bronkospazm Deri ve deri altı doku hastalıklarıKaşıntı/döküntü Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıklarıKas spazmı Kas-iskelet ağrısı Miyalji 6 / 18 Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıYaygın Yaygın Göğüs ağrısı Periferal ödem 1 Ruhsatlandırma sonrası pazarlama deneyiminden ONBREZ BREEZHALER kullanımıyla bağlantılı olarak aşırı duyarlılık raporları alınmıştır. Bunlar, büyüklüğü belirsiz birpopülasyondan gönüllü olarak rapor edilmiştir ve bu nedenle, tıbbi ürüne maruz kalma sıklığınıgüvenilir bir şekilde tahmin etmek veya nedensel bir ilişki kurmak her zaman mümkün değildir.Bu nedenle sıklık, klinik çalışma deneyiminden hesaplanmıştır. Günde bir kez 600 mikrogram dozunda ONBREZ BREEZHALER'nın güvenlilik profili genel olarak önerilen dozlarınkine benzer bulunmuştur. Ek bir advers reaksiyon tremor olmuştur (yaygın). Seçilmiş advers ilaç reaksiyonları tanımı: Faz III klinik çalışmalarda, sağlık mesleği mensupları, klinik vizitlerde, ortalama olarak hastaların %17-20'sinde, genellikle inhalasyonu takiben 15 saniye içinde ortaya çıkan ve tipikolarak 5 saniye süren sporadik öksürük (sigara içerenlerde yaklaşık 10 saniye) olduğunugözlemlemişlerdir. Bu öksürük, erkeklerle karşılaştırıldığında kadınlarda ve sigarayı bırakmışolanlarla karşılaştırıldığında halen sigara kullanmakta olanlarda daha yüksek sıklıktagözlenmiştir. İnhalasyondan sonra ortaya çıkan bu öksürük, genel olarak iyi tolere edilmiştir veönerilen dozlarda hiçbir hastanın çalışmalardan ayrılmasına yol açmamıştır (öksürük KOAH'tagözlenen bir semptomdur ve hastaların %8.,2'sinde öksürük bir advers olay olarakbildirilmiştir). İnhalasyon sonrası ortaya çıkan öksürüğün, bronkospazm, alevlenmeler,hastalığın kötüleşmesi veya etkililik kaybı ile ilişkili olduğunu gösteren bulgu yoktur. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr;[email protected];4.9. Doz aşımı ve tedavisiKOAH hastalarında, önerilen maksimum terapötik dozun 10 katı olan tek dozlar, nabızda, sistolik kan basıncında ve QTc aralığında orta derece bir artışla ilişkilendirilmiştir. İndakaterol ile doz aşımının, beta2-adrenerjik uyarıcılar için tipik olan abartılı etkilere (yani taşikardi, titreme, çarpıntılar, baş ağrısı, bulantı, kusma, baş dönmesi, ventriküler aritmiler,metabolik asidoz, hipokalemi ve hiperglisemi) yol açma olasılığı yüksektir. Destekleyici ve semptomatik tedavi endikedir. Ciddi vakalarda hastalar hastaneye yatırılmalıdır. Kardiyoselektif beta-blokör kullanımı düşünülebilir, ancak beta-adrenerjikblokörler bronkospazmı uyarabildiğinden, bunlar doktor gözetiminde çok dikkatli bir şekildeuygulanmalıdır. 7 / 18 5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Obstrüktif solunum yolu hastalıklarında kullanılan ilaçlar, selektif beta-2-adrenoreseptör agonistleriATC kodu: R03AC18 Etki Mekanizması: İndakaterol gibi beta2-adrenoseptör agonistlerinin farmakolojik etkileri, en azından kısmen, intraselüler adenil siklazın (adenozin trifosfatın (ATP) siklik-3', 5'-adenozin monofosfata(siklik monofosfat) dönüşmesini katalize eden enzim) stimülasyonuna bağlanabilir. Yükseksiklik AMP düzeyleri, bronşiyal düz kasta gevşemeye neden olur. İn vitroçalışmalar, uzun etkilibir beta2-adrenerjik agonist olan indakaterolün beta2 reseptörlerdeki agonist aktivitesinin,beta1-reseptörlerindekinden 24 kattan daha fazla ve beta3-reseptörlerdekinden 20 kattan dahafazla olduğunu göstermiştir.İnhale edildiğinde indakaterol akciğerlerde lokal olarak bronkodilatör etki gösterir. İndakaterol, insan beta2-adrenerjik reseptör düzeyinde nanomolar potensi olan bir kısmi agonisttir. İzoleinsan bronşunda indakaterolün etkisi hızlı başlar ve etki süresi uzundur. Beta2-reseptörlerin, bronş düz kasında, beta1-reseptörlerin insan kalbinde hakim olan adrenerjik reseptörler olmasına rağmen, insan kalbindeki toplam adrenerjik reseptörlerin %10-50'sinibeta2-adrenerjik reseptörleroluşturur. Kalpteki beta2-adrenerjik reseptörlerin kesin fonksiyonubilinmemektedir; fakat bunların varlığı yüksek düzeyde seçici beta2-adrenerjik agonistlerin bilekardiyak etkilerinin olma olasılığını artırmaktadır. Farmakodinamik Etkiler: Bir dizi klinik farmakodinami ve etkililik çalışmasında, günde bir kere 150 ve 300 mikrogram dozlarda uygulanan ONBREZ BREEZHALER, akciğer fonksiyonunda (birinci saniyedekizorlu ekspiratuar hacim, FEV1, ölçümlerine göre) tutarlı bir şekilde 24 saati aşan klinik açıdananlamlı düzelme sağlamıştır. İnhalasyondan sonra etkisi, beş dakika içinde hızlı bir şekildeortaya çıkar ve başlangıca göre FEVkde 110-160 ml artış meydana gelir. Bu, hızlı etkili beta2-agonist salbutamol 200 mg'ın etkisine benzemektedir; ayrıca salmeterol/flutikazon 50/500mikrogram ile karşılaştırıldığında etkisi, istatistiksel olarak anlamlı oranda daha hızlıdır.Kararlı durumda başlangıca göre FEVkdeki azami düzelmelerin ortalaması 250-330 ml'dir. Bronkodilatör etkinin doz uygulama saatine (sabah veya akşam) bağlı olmadığı saptanmıştır. ONBREZ BREEZHALER'in akciğer hiperinflasyonunu azalttığı gösterilmiştir; bu durum plasebo ile karşılaştırıldığında egzersiz sırasında ve dinlenirken inspiratuar kapasiteninartmasına yol açar. Kardiyak elektrofizyoloji üzerindeki etkiler: 404 sağlıklı gönüllüye 2 hafta süre ile indakaterolün çoklu dozlarının (günde bir kere 150, 300 veya 600 mikrogram) uygulandığı çift-kör, plasebo ve aktif (moksifloksasin) kontrollü birçalışmada, QTcF (milisaniye) aralığındaki maksimum ortalama (%90 güven aralıkları)uzamaların 150, 300 ve 600 mikrogram için sırası ile 2,66 (0,55, 4,77), 2,98 (1,02, 4,93) ve 3,34(0,86, 5,82) olduğu gösterilmiştir. Değerlendirilen doz aralığında konsantrasyon-delta QTcilişkisine dair bulgu saptanmamıştır. 8 / 18 KOAH'ı olan 605 hasta üzerinde yapılan 26 haftalık, çift kör, plasebo kontrollü bir faz III çalışmada gösterildiği üzere, başlangıçta ve 26 haftalık tedavi döneminde 3 kereye kadaryapılan 24 saatlik monitorizasyona göre önerilen dozlarda ONBREZ BREEZHALER ileplasebo ya da tiotropium ile tedavi edilmiş hastalar arasında aritmik olayların gelişimi açısındanklinik olarak anlamlı bir fark gözlenmemiştir. Klinik etkililik ve güvenlik: Klinik geliştirme programı, KOAH klinik tanısı konulmuş hastalarda yürütülen bir tane 12 haftalık, iki tane altı aylık (bunlardan bir tanesi güvenlilik ve tolerabilitenin değerlendirilmesiiçin bir yıla uzatılmıştır) ve bir tane bir yıllık randomize kontrollü çalışmayı kapsamaktadır. Buçalışmalar akciğer fonksiyonu ölçümlerini ve dispne, alevlenmeler ve sağlıkla bağlantılı yaşamkalitesi gibi sağlık sonuçlarını kapsamaktadır. Akciğer fonksiyonu: ONBREZ BREEZHALER günde bir kere 150 mikrogram ve 300 mikrogram dozlarda uygulandığında akciğer fonksiyonunda klinik açıdan anlamlı iyileşmelere neden olmuştur. 12-haftalık primer sonlanım noktasında (24-saatlik 'through' FEV1-doz öncesi-) 150 mikrogramdozu plasebo ile karşılaştırıldığında 130-180 ml artışa (p<0,001) ve günde iki kere 50mikrogram salmeterol ile karşılaştırıldığında 60 ml artışa yol açmıştır (p<0,001). 300mikrogram dozu plasebo ile karşılaştırıldığında 170-180 ml artışa (p<0,001) ve günde iki kere12 mikrogram formoterol ile karşılaştırıldığında 100 ml artışa (p<0,001) yol açmıştır. Her ikidoz da günde bir kere uygulanan açık etiketli 18 mikrogram tiotropium ile karşılaştırıldığında40-50 ml artışa neden olmuştur (150 mikrogram, p = 0,004; 300 mikrogram, p = 0,01).ONBREZ BREEZHALER'in 24 saatlik bronkodilatör etkisi ilk dozdan itibaren bir yıl boyuncakorunmuş ve etkililik kaybına (taşifilaksi) dair kanıta rastlanmamıştır. Semptomatik yararlar: Her iki doz da dispne ve sağlık durumu açısından (sırasıyla Tranzisyonel Dispne İndeksi [TDI] ve St. George Solunum Anketi [SGRQ] ile yapılan değerlendirmelere göre) semptomlarınrahatlatılmasında plaseboya göre istatistiksel olarak anlamlı düzelmeler sağlamıştır. Yanıtbüyüklüğü genellikle aktif karşılaştırma grupları ile gözlenenden daha yüksektir (Tablo 2).Ayrıca, ONBREZ BREEZHALER ile tedavi edilmiş hastalar kurtarma ilacına anlamlı orandadaha az gereksinim duymuş, plasebo ile karşılaştırıldığında bu hastalarda kurtarma ilacınagereksinim duyulmayan günlerin sayısı daha fazla olmuş ve gündüz semptomlarınıngözlenmediği günlerin yüzdesinde anlamlı bir artış meydana gelmiştir. 6 aydan daha uzun süreli tedavilerin birleştirilmiş etkililik analizi, KOAH alevlenmesi oranının plasebodan istatistiksel olarak anlamlı oranda daha düşük olduğunu göstermiştir. Plaseboyagöre yapılan tedavi karşılaştırmasında sırasıyla 150 mikrogram ve 300 mikrogram için 0,68(%95 GA [0,47, 0,98]; p-değeri 0,036) ve 0,74'lük (%95 GA [0,56, 0,96]; p-değeri 0,026)oranları bulunmuştur. Afrika kökenli kişilerde tedavi deneyimi sınırlıdır. Tablo 26 aylık tedavi sonucunda semptomlardaki rahatlama
9 / 18
Çalışma tasarımında belirtilen ilaçlar kullanılmıştır: a: indakaterol 150 mikrogram, salmeterol ve plasebo; b: indakaterol 150 ve 300 mikrogram, Tiotropium ve plasebo; c: indakaterol 300mikrogram, Formoterol ve plasebo ^MCID = klinik açıdan önemli minimum fark (TDI'de 1> puan değişim, SGRQ'de >4 puan değişim) n/e = altıncı ayda değerlendirilmedi. 5.2. Farmakokinetik özelliklerGenel özelliklerİndakaterol, R-konfigürasyona sahip bir kiral moleküldür. Farmakokinetik veriler, sağlıklı gönüllüler ve KOAH hastaları üzerinde yapılan bir dizi klinik çalışmadan elde edilmiştir. Emilim:İndakaterolün doruk serum konsantrasyonuna ulaşması için medyan süre, tek dozdan veya tekrarlanan inhale dozlardan sonra yaklaşık olarak 15 dakika olarak saptanmıştır. Artan dozlabirlikte indakaterole sistemik maruziyet, dozla orantılı bir şekilde artmıştır (150 mikrogram ila600 mikrogram). İnhale dozdan sonra indakaterolün mutlak biyoyararlanımı ortalama %43-45olmuştur. Sistemik maruziyet, akciğer emilimi ve bağırsak emiliminin bileşimine bağlıdır;sistemik maruziyetin yaklaşık %75'i akciğer emiliminden ve yaklaşık %25'i bağırsakemiliminden olmuştur. İndakaterol serum konsantrasyonları, günde bir kere uygulanan tekrarlı dozlarla artış göstermiştir. Kararlı duruma 12-14 günde ulaşılmıştır. İndakaterolün ortalama birikim oranı(yani, 1. günle karşılaştırıldığında 14. günde 24 saatlik dozlama aralığı için EAA), 150mikrogram ile 600 mikrogram arasında günde bir kere uygulanan inhale dozlar için 2,9 ila 3,5arasında bulunmuştur. 10 / 18 Dağılım:İntravenöz infüzyondan sonra, terminal eliminasyon fazı sırasında indakaterolün dağılım hacmi 2557 L olarak yaygın bir dağılıma işaret etmektedir. İn vitroolarak insan serum ve plazmaproteinlerine bağlanma sırasıyla %94,1-95,3 ve %95,1-96,2 olarak saptanmıştır.Biyotransformasyon:İnsanda gerçekleştirilen bir ADME (emilim, dağılım, metabolizma, atılım) çalışmasında radyoaktif element ile işaretlenmiş indakaterolün oral uygulamasından sonra değişmemişindakaterolün serumdaki temel bileşen olduğu belirlenmiştir; bu bileşen 24 saatlik toplamEAA'nin yaklaşık olarak üçte birini oluşturur. Hidroksile bir türev, serumdaki en belirginmetabolittir. Hidroksile indakaterol ve indakaterolün fenolik O-glukuronidleri de diğer belirginmetabolitlerdir. Hidroksile türevin diastereomeri, indakaterolün bir N-glukuronidi ve C- ve N-dealkile ürünler, belirlenen diğer metabolitler olmuştur. İn vitroİn vitroaraştırmalar, indakaterolün 'efflux' pompası P-gp için düşük afiniteli bir substrat olduğunugöstermiştir.Eliminasyon:İdrar örneklerinin de toplandığı klinik çalışmalarda, idrar yoluyla değişmeden atılan indakaterol miktarı, genellikle dozun %2'sinden az olmuştur. İndakaterolün böbrek klerensi ortalamaolarak 0,46 ile 1,20 litre/saat arasındadır. İndakaterolün 23,3 litre/saat'lik serum klerensi ilekarşılaştırıldığında, böbrek klerensinin, sistemik olarak mevcut indakaterolün atılmasındaönemsiz bir rol oynadığı açık olarak görülmektedir (sistemik klerensin %2-5'i). İndakaterolün oral yoldan verildiği bir insan ADME çalışmasında, dışkıyla atılımın, idrarla atılımdan daha belirgin olduğu bulunmuştur. İndakaterol, insanlarda dışkıyla büyük orandadeğişmeden ana ilaç şeklinde (dozun %54'ü) ve daha az oranda hidroksile indakaterolmetabolitleri şeklinde atılmıştır (dozun %23'ü). Dışkıda dozun >%90'ı toplandığı için kütledengesi tam olmuştur. Tekrarlı dozlardan sonra indakaterol birikiminden hesaplanan efektif yarı ömür 40 ila 52 saat arasında değişmektedir (yaklaşık olarak 12-14 gün olan kararlı hale kadar geçen süre ileuyumludur). Doğrusallık/Doğrusal Olmayan Durum:İndakaterol serum konsantrasyonu, multifazik bir şekilde düşmektedir (ortalama terminal yarı ömrü 45 ,Hastalardaki karakteristik özelliklerKaraciğer yetmezliği:Hafif ila orta şiddette karaciğer yetmezliği olan hastalarda indakaterolün Cmaks ya da EAA' sinde anlamlı değişiklikler gözlenmemiştir; ayrıca hafif ila orta şiddette karaciğer yetmezliği olangönüllüler ve sağlıklı gönüllüler arasında protein bağlama oranları açısından da fark yoktur.Şiddetli karaciğer yetmezliği olan hastalarda çalışma yapılmamıştır (bkz. bölüm 4.2.). 11 / 18 Böbrek yetmezliği:Toplam vücut eliminasyonunda idrar yolunun çok düşük bir katkısı olduğundan, böbrek yetmezliği olan hastalarda bir çalışma yapılmamıştır. Pediyatrik popülasyon:ONBREZ BREEZHALER'in 18 yaşın altındaki hastalarda kullanılması önerilmemektedir. Geriyatrik popülasyon:Maksimum plazma konsantrasyonu ve genel sistemik maruziyet yaşla birlikte artmaktadır (bkz.Bölüm 4.2.). Ancak yaşlı hastalarda doz ayarlamasına gerek bulunmamaktadır. Yaş, cinsiyet, kilo, ırk:Yapılan bir popülasyon farmakokinetiği analizinde, yaşın (88 yaşına kadar yetişkinler), cinsiyetin, kilonun (32-168 kg) ya da ırkın indakaterol farmakokinetiği üzerinde klinik açıdananlamlı bir etki meydana getirmediği gösterilmiştir. Elde edilen bulgular bu popülasyonda etnikalt gruplar arasında herhangi bir farka işaret etmemiştir. 5.3. Klinik öncesi güvenlilik verileriKöpeklerde yapılan çalışmalarda, indakaterolün kardiyovasküler sistem üzerindeki beta2-agonistik özelliklerine bağlanan etkileri taşikardi, aritmiler ve miyokard lezyonlarını kapsamaktadır. Kemirgenlerde, burun boşluğu ve larinkste hafif düzeyde tahriş gözlenmiştir.Tüm bu bulgular insanlarda beklenenin yeterince üzerinde olan maruziyetlerde meydanagelmiştir. Bir sıçan fertilitesi çalışmasında indakaterol genel üreme performansını etkilememiş olsa da, gelişim ve gelişim sonrası dönemde olan sıçanlar üzerinde yapılan ve ONBREZBREEZHALER ile tedavi edilen insanlardakinden 14 kat daha yüksek maruziyetin kullanıldığıbir çalışmada gebe F1 dölünün sayısında bir azalma gözlenmiştir. İndakaterol sıçanlarda ya datavşanlarda embriyotoksik ya da teratojenik değildir. Genotoksisite çalışmalarında, mutajenik ya da klastojenik potansiyel gözlenmemiştir. İndakaterolün karsinojenisitesi, sıçanlarda 2 yıllık bir sıçan çalışmasında ve 6 aylık transgenikfare çalışmasında değerlendirilmiştir. Sıçanlarda iyi huylu over leyomiyomu ve over düzkasında fokal hiperplazi insidanslarında artışların, diğer beta2-adrenerjik agonistler içinbildirilen benzer bulgularla tutarlı olduğu görülmüştür. Farelerde karsinojenisite kanıtınarastlanmamıştır. Bu çalışmalarda advers etkilerin gözlenmediği düzeylerde sıçanlarda vefarelerde meydana gelen sistemik maruziyetler (EAA), günde bir kere 300 mikrogram dozdaONBREZ BREEZHALER ile tedavi edilmiş olan insanlarda gözlenen değerlerden sırasıyla enaz 7 ve 49 kat daha yüksek olmuştur. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiKapsül dolumu:Laktoz monohidrat (sığır kaynaklı) Boş kapsül kabuğu:Jelatin (sığır kaynaklı) Siyah baskı mürekkebi Baskı mürekkebi:Şellak (E904) 12 / 18 N-bütil alkol Saf su Susuz etanol İzopropil alkolGüçlü amonyak çözeltisi 6.2. Geçimsizlikler6.3. Raf ömrü30 ay 6.4. Saklamaya yönelik özel tedbirler30°C'nin altındaki oda sıcaklığında ve ambalajında saklayınız. Nemden koruyunuz. ONBREZ BREEZHALER kapsüllerini nemden korumak için blister içinde saklanmalı ve yalnızca kullanımdan hemen önce çıkarılmalıdır. 6.5. Ambalajın niteliği ve içeriğiHer biri 10'ar kapsül içeren PA/Alu/PVC - Alu blisterler (şekillendirici folyo: PA/Alu/PVC, kapatıcı folyo: Alüminyum) ve her kutuda bulunan bir adet BREEZHALER inhalasyon cihazı BREEZHALER bir tekli doz inhalasyon cihazıdır. İnhalasyon cihazının gövdesi ve kapağı, akrilonitril bütadien stiren, basma düğmeleri metil metakrilat akrilonitril bütadien stirendenyapılmıştır. İğneler ve yaylar paslanmaz çelikten imal edilmiştir. 30 kapsüllük ambalaj: Her biri 10'ar kapsül içeren 3 blister ve 1 inhaler (BREEZHALER) 2 kutuluk (60 kapsül) çoklu ambalaj: Her biri 30 kapsül + 1 inhaler (BREEZHALER) içeren iki kutu 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. Her bir ONBREZ BREEZHALER kutusu içeriğinde inhalasyon kapsüllerine ek olarak bir inhalasyon cihazı (Breezhaler) yer almaktadır. Kutu içeriği bittiğinde inhalasyon cihazı daatılmalıdır. Kullanıma ilişkin talimatlar:ONBREZ BREEZHALER'ı kullanmadan önce lütfen Kullanma Kılavuzunun tamamını okuyun. 13 / 18 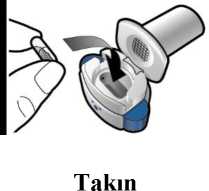
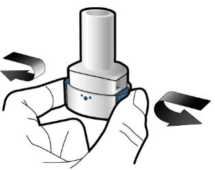
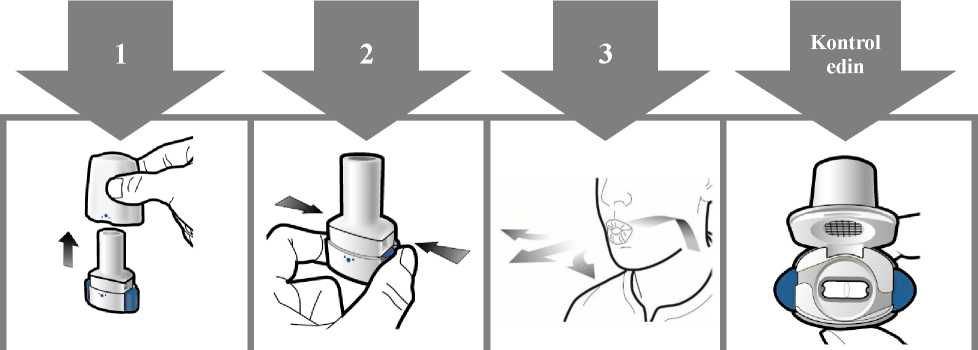
 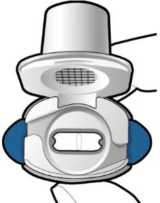 Kapsülün boş olup olmadığını kontroledin
14 / 18 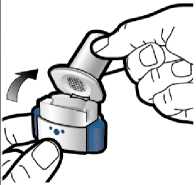
Adım 1b: İnhaleri açın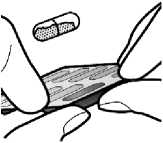
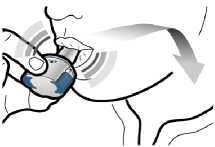
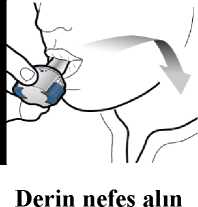
Adım 3b: İlacı derin bir nefesle içinize çekinİnhaleri resimde gösterildiği gibitutun.Ağızlığı ağzınıza yerleştirin vedudaklarınızıetrafına sıkıcakapatın. Yan düğmelere basmayın.Olabildiğince hızlıve derin nefes alın.Nefesinizi çektiğinizsırada bir vızıltı sesiduyacaksınız.Nefes alırken ilacın tadını alabilirsiniz. 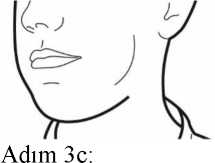
Kapsülde toz kalmışsa: İnhaleri kapatın. 3a ila 3carasındakiadımlarıtekrarlayın.
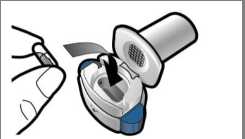
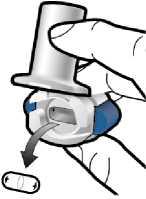 Boş kapsülü çıkarınBoş kapsülü evsel atıklarınıza koyun.İnhaleri kapatın vekapağı takın.
15 / 18
Önemli bilgiler Onbrez Breezhalerkapsülleri her zamanblister karttasaklanmalı veyalnızca kullanımdan hemen önce çıkarılmalıdır. Kapsülü yutmayın. Onbrez Breezhalerkapsüllerini başkaherhangi bir inhalerile kullanmayın. Onbrez Breezhalerinhaleri başka birkapsül ilacı almakiçin kullanmayın. Kapsülü aslaağzınıza veyainhalerin ağızlığınayerleştirmeyin. Yan düğmelerebirden fazlabasmayın. Ağızlığın içineüflemeyin. Ağızlıktan nefesalırken yandüğmelerebasmayın. Kapsülleri ıslakellerle tutmayın. İnhalerinizi aslasuyla yıkamayın. Onbrez Breezhaler İnhaler paketiniz şunları içerir: Bir adet Onbrez Breezhaler inhaler Her biri inhalatörde kullanılacak 6 veya10 Onbrez Breezhaler kapsülü içeren birveya daha fazla blister kart
İnhaler tabanı Blister tartSıkça Sorulan SorularTeneffüs ettiğimde solunum cihazıneden sesçıkarmadı?İnhalerintemizlenmesiToz kalıntılarını gidermek içinağızlığın içini vedışını temiz, kuru, tüybırakmayan bir bezlesilin. İnhaleri kurututun. Solunumcihazınızı asla suylayıkamayın.
16 / 18 Kapsül, kapsül haznesine sıkışmışolabilir. Böyle birdurumda, inhalerintabanına hafifçevurarak kapsülüdikkatlice gevşetin. 3 aila 3 c arasındakiadımları tekrarlayarakilacı tekrar soluyun. Kapsülün içinde toz kalırsa neyapmalıyım?İlacınızdan yeterince almadınız. İnhalerikapatın ve 3a ila 3carasındaki adımlarıtekrarlayın. Teneffüs ettikten sonra öksürdüm - buönemli mi?Bu olabilir. Kapsül boş olduğu süreceilacınızdan yeterincealdınız. Kapsülün küçük parçalarını dilimdehissettim - bu önemlimi?Bu olabilir. Zararlı değildir. Kapsülbirden fazla delinirsekapsülün küçükparçalara ayrılmaşansı artacaktır.İnhalerinkullanımdan sonra atılmasıHer inhaler, tüm kapsüllerkullanıldıktan sonra atılmalıdır. Eczacınızaartık gerekli olmayanilaçları ve inhalerlerinasıl atacağınızısorun. 7. RUHSAT SAHİBİNovartis Sağlık, Gıda ve Tarım Ürünleri San. ve Tic. A.Ş. Kavacık/Beykoz/İstanbul 8. RUHSAT NUMARASI131/44 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ:İlk ruhsat tarihi: 13.05.2011 Ruhsat yenileme tarihi: 21.06.2019
17 / 18 10. KÜB'ÜN YENİLENME TARİHİ:
18 / 18 1 / 18 |
İlaç BilgileriOnbrez Breezhaler 150 Mcg Inhaler KapsülEtken Maddesi: Indakaterol Maleat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.