Asamesa 4 G/60 Ml Rektal Süspansiyon Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIAsamesa 4 g/60 ml rektal süspansiyon 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir rektal süspansiyon (60 ml süspansiyon), etkin madde olarak 4 g mesalazin içerir. Yardımcı madde(ler):Sodyum metabisülfit.........................0,060 g/60 ml Sodyum benzoat.................................0,060 g/60 ml Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMRektal Süspansiyon ASAMESA, kahverengiye yakın renkte süspansiyondur. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarÜlseratif kolitin (kalın bağırsaktaki bir kronik inflamatuvar hastalık) akut ataklarının tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/ uygulama sıklığı ve süresi:Yetişkinler: Akut inflamasyon olan hastalarda, bir süspansiyon şişesinin (60 ml rektal süspansiyon) içeriği yatmadan önce lavman olarak bir defada bağırsağa uygulanır. En iyi sonuç ASAMESA uygulamasından önce bağırsaklar boşaltıldığında elde edilir. ASAMESA, düzenli ve devamlı kullanılmalıdır, çünkü başarılı bir iyileşme ancak bu şekilde sağlanabilir. Kullanım süresi doktor tarafından belirlenir.
1 /8Uygulama şekli: Rektal kullanım. Asamesa rektal süspansiyon günde bir defa yatmadan önce uygulanır.  Hazırlanışı:¦ 30 saniye boyunca şişe çalkalanır. ¦ Aplikatörün koruyucu kapağı çıkarılır. ¦ Şişe alttan ve üstten tutulur. Uygulama için doğru pozisyon: ¦ Hasta sol tarafının üzerine sol bacağını uzatıp sağ bacağını karnına doğru çekerek uzanır. Bu pozisyonla ASAMESA daha kolay uygulanır ve daha etkili olur. 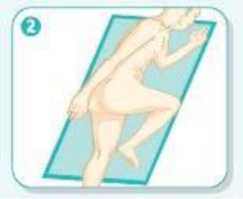 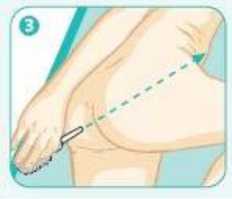 Rektal süspansiyonun uygulanması: ¦ Aplikatörün ucu rektumun içine sokulur. ¦ Şişenin ucu hafif aşağı bakacak şekilde eğilir ve yavaşça sıkılır. ¦ Kullanıldıktan sonra boş şişenin aplikatör ucu yavaşça rektumdan çıkarılır. ¦ İlacın rektumda dengeli bir şekilde dağılımı sağlanması için ilacın uygulandığı yatarpozisyon, 30 dakika süre ile korunmalıdır. ¦ Mümkünse, rektal süspansiyonun gece boyunca etki sağlamasına izin verilmelidir.  Özel popülasyonlara ilişkin ek bilgiler: Böbrek/ Karaciğer yetmezliği: Karaciğer fonksiyon bozukluğu olan hastalarda dikkatli kullanılmalıdır. Böbrek fonksiyonları bozuk olan hastalarda kullanılması önerilmez. Tedavi sırasında böbrek fonksiyonları bozulursa, mesalazinin yol açtığı renal toksisite düşünülmelidir. Şiddetli böbrek ve karaciğer yetmezliği olan hastalarda kontrendikedir.
2 /8Pediyatrik popülasyon:ASAMESA'nın çocuklarda etkili olduğuna dair çok az deneyim ve sınırlı sayıda doküman vardır. Geriyatrik popülasyon:Yetişkinler için verilen pozoloji ve uygulama şekli geriyatrik popülasyon için de geçerlidir. 4.3. KontrendikasyonlarASAMESA aşağıdaki durumlarda kontrendikedir: - Etkin maddeye, salisilatlara ya da 6.1 bölümünde listelenen diğer bileşenlere karşı bilinenduyarlılığı olanlarda - Şiddetli karaciğer veya böbrek yetmezliği olan hastalarda 4.4. Özel kullanım uyarıları ve önlemleriTedaviye başlamadan önce ve tedavi sırasında hekimin isteğine göre kan testleri (diferansiyel kan sayımı; ALT veya AST gibi karaciğer fonksiyon testleri; serum kreatinin) ve idrarmuayenesi (dipstick test) yapılmalıdır. Kılavuz olarak, kontroller tedaviye başlandıktan 14 günsonra yapılmalı ve 4 haftalık aralarla 2-3 kez tekrarlanmalıdır. Bulgular normal ise, tedavi sonrası kontroller 3 aylık aralarla yapılabilir. Eğer ilave belirtiler gelişirse, kontrol muayeneleri hemen yapılmalıdır. Karaciğer fonksiyon bozukluğu olan hastalarda dikkatli kullanılmalıdır. Böbrek fonksiyonları bozuk olan hastalarda kullanılması önerilmez. Tedavi sırasında böbrek fonksiyonları bozulursa, mesalazinin yol açtığı renal toksisite düşünülmelidir. Mesalazin kullanımı ile %100 mesalazin içerikli taşlar içeren nefrolitiazis vakaları rapor edilmiştir. Tedavi sırasında yeterli sıvı alımının sağlanması önerilir. Özellikle astım olmak üzere akciğer hastalığı olan hastalar ASAMESA tedavisi sırasında çok dikkatli bir şekilde izlenmelidir. Sülfasalazin içeren ilaçlarla yan etki görülme öyküsü olan hastalarda, ASAMESA tedavisine yalnızca dikkatli bir hekim muayenesi ile başlanmalıdır. ASAMESA abdominal kramplar,akut karın ağrısı, ateş, şiddetli baş ağrısı ve deride döküntü gibi akut intolerans reaksiyonlarınaneden olursa tedavi hemen kesilmelidir. ASAMESA 0,060 g/60 ml sodyum metabisülfit içerir. Bu nedenle, özellikle astım hastasıysanız veya alerji öykünüz varsa, nadir olarak şiddetli aşırı duyarlılık reaksiyonları vebronkospazma (bronşların daralması) neden olabilir. ASAMESA, sodyum benzoat içerir. Bu nedenle deriye, göze ve mukoz membranlarına hafif derecede irritan (tahriş edici) olabilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBelge DKrştMuekflgşffleffi^nögeFatöfffrmM yapılmamfftpr.dresi:httPs://wwwturkiyeg°vtr/sagiik-titck-ebys3 / 8 Mesalazin beraberinde azatiyoprin, 6-merkaptopürin ya da tioguanin ile tedavi görmekte olan hastalarda, azatiyoprinin, 6-merkaptopürinin ya da tioguaninin miyelosüpresif etkilerinde olasıartış dikkate alınmalıdır. Mesalazinin, varfarinin antikoagülan etkisini azaltmasına ilişkin zayıf kanıt vardır. Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:ASAMESA'nın çocuklarda etkili olduğuna dair çok az deneyim ve sınırlı sayıda doküman vardır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi B Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)ASAMESA'nın çocuk doğurma potansiyeli bulunan kadınlara herhangi bir etkisi veya doğum kontrolü (kontrasepsiyon) için kullanılan ilaçlarla herhangi bir etkileşimi bildirilmemiştir. Gebelik dönemiASAMESA'nın gebe kadınlarda kullanımına ilişkin yeterli veri yoktur. Sınırlı sayıda gebelikte maruz kalma olgularına ilişkin veriler, mesalazinin gebelik üzerinde ya da fetüs/yenidoğançocuğun sağlığı üzerinde advers etkileri olduğunu göstermemektedir. Bugüne kadar herhangiönemli bir epidemiyolojik veri elde edilmemiştir. Oral yol ile alınan mesalazinde hayvanlar üzerinde yapılan çalışmalar gebelik, embriyonal/fetal gelişim/doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlıetkiler olduğunu göstermemektedir. İzole tek bir vakada gebelik sırasında yüksek mesalazin dozunun uzun süreli uygulanması neticesinde (2 - 4 g/gün, oral) yenidoğanda böbrek yetmezliği bildirilmiştir. ASAMESA, gebelik sırasında ancak beklenen faydanın potansiyel riskten fazla olması halinde uygulanmalıdır. Laktasyon dönemiN-asetil-5 aminosalisilik asit ve daha az miktarda mesalazin anne sütüne geçmektedir. Mesalazinin kadınlarda emzirme dönemine etkisi ile ilgili sınırlı deneyim mevcuttur. Diyaregibi aşırı duyarlılık reaksiyonları emzirilen bebeklerde gözardı edilemez. Emzirmenindurdurulup durdurulmayacağına ya da ASAMESA tedavisinin durdurulupdurdurulmayacağına/ tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken,emzirmenin çocuk açısından faydası ve ASAMESA tedavisinin emziren anne açısındanfaydası dikkate alınmalıdır. Emzirilen bebekte diyare gelişirse emzirmeye son verilmelidir. Üreme yeteneği/FertilitetesMa ürsmssstsnşli/CersilitsJiemektedir. ://www. turkiye.gov.tr/saglik-titck-ebysBelge Do
4 / 8 4.7. Araç ve makine kullanımı üzerindeki etkilerASAMESA'nın araç ve makine kullanma yeteneği üzerinde hiçbir etkisi görülmemiş ya da ihmal edilebilir düzeyde etki görülmüştür. 4.8. İstenmeyen etkilerMesalazin uygulandıktan sonra aşağıdaki istenmeyen etkiler gözlenmiştir:Çok yaygın: ( > 1/10) Yaygın: ( > 1/100 - < 1/10) Yaygın olmayan: ( > 1/1000 - 1/100) Seyrek: ( > 1/10.000 - 1/1000) Çok seyrek: ( < 1/10.000) (istisnai raporlar dahildir) Bilinmiyor: Eldeki verilerden hareketle tahmin edilemiyor. Kan ve lenf sistemi hastalıklarıÇok seyrek: Bozulan kan sayımı (aplastik anemi, agranülositoz, pansitopeni, nötropeni, lökopeni, trombositopeni) Bağışıklık sistemi hastalıklarıÇok seyrek: Alerjik egzantem, ilaç ateşi, lupus eritomatozus sendromu, pankolit gibi hipersensitivite reaksiyonları Sinir sistemi hastalıklarıSeyrek: Baş ağrısı, sersemlik Çok seyrek: Periferal nöropati Kardiyak hastalıklarSeyrek: Miyokardit, perikardit Solunum, göğüs bozuklukları ve mediastinal hastalıklarıÇok seyrek: Alerjik ve fibrotik akciğer reaksiyonları (dispne, öksürük, bronkospazm, alveolit, pulmoner eozinofili, akciğer infiltrasyonu, pnömoni) Gastrointestinal hastalıklarSeyrek: Karın ağrısı, diyare, gaz, bulantı, kusma, konstipasyon Çok seyrek: Akut pankreatit Hepatobiliyer hastalıklarÇok seyrek: Karaciğer fonksiyon testlerinde değişiklikler (transaminazlarda ve kolestaz parametrelerinde artış), hepatit, kolestatik hepatit Deri ve deri altı doku hastalıklarıSeyrek: Işığa duyarlılık* Çok seyrek: Alopesi *Işığa duyarlılıkAtopik dermatit ve atopik egzama gibi önceden var olan cilt rahatsızlığı olan hastalarda daha ciddi reaksiyonlar bildirilmiştir.
5 / 8 Kas-iskelet, bağ dokusu bozuklukları ve kemik hastalıklarıÇok seyrek: Miyalji, artralji Böbrek ve idrar yolu hastalıklarıÇok seyrek: Akut ve kronik intersitisyel nefrit ve böbrek yetmezliğini içeren böbrek fonksiyon bozuklukları Bilinmiyor: Nefrolitiazis (ilave bilgi için bkz. Bölüm 4.4) Üreme sistemi hastalıklarıÇok seyrek: Oligospermi (geri dönüşümlü) Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarakizlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli adversreaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir(www.titck.gov.tr; e- posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 3599). 4.9. Doz aşımı ve tedavisiAşırı doz üzerine (örneğin oral olarak aşırı dozda mesalazin ile intihar teşebbüsü) renal veya hepatik toksisite göstermeyen seyrek veriler vardır. Özel bir antidotu yoktur, tedavisemptomatik ve destekleyicidir. 5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Bağırsak içi antienflamatuvar ajanlar; aminosalisilik asit ve benzeri ajanlarATC kodu: A07EC02 Etki mekanizmasıAntienflamatuvar etki mekanizması bilinmemektedir. İn vitro çalışmaların sonuçları lipoksijenaz inhibisyonunun etkili olabileceğini göstermektedir. Bağırsak mukozasındaki prostaglandin konsantrasyonları üzerine etkisi de gösterilmiştir. Mesalazin (5-Aminosalisilik asit/5-ASA) reaktif oksijen bileşenlerinradikal tutucusu olarak da etki göstermektedir. Farmakodinamik etkilerRektal yol ile uygulanan mesalazin, bağırsağın luminal bölümüne eriştiğinde, bağırsağın mukoza ve submukoza dokusunda büyük oranda lokal etki gösterir. 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:Mesalazin emilimi en yüksek oranda bağırsağın proksimal bölgelerinde, en düşük
6 /8oranda da bağırsağın distal bölgelerinde gerçekleşir. Kararlı durum koşulları altında remisyondaki ülseratif kolitli hastaların üzerinde yapılan bir çalışmada, pik plazma konsantrasyonlarına (0,92 mikrogram/ml 5-ASA ve1.62 mikrogram /mlN-Ac-5-ASA) yaklaşık 11 - 12 saat sonra ulaşılmıştır. Mesalazin ile tedavi edilen kronik enflamatuvar bağırsak hastalığı olan çocuklarda kararlı durum plazma konsantrasyonları; 0,5 - 2,8 mikrogram/ml 5-ASA ve 0,9 - 4,1mikrogram/ml N-Ac-5-ASA'dır. Dağılım:Hafif - orta dereceli akut ülseratif kolitli hastalarda yapılan bir görüntüleme çalışması, tedavinin başlangıcında ve 12 hafta sonra remisyonunda rektalsüspansiyonun çoğunlukla rektum, sigmoid kolon ve daha az olmak üzere kolonungeri kalanına dağıldığını göstermiştir. Biyotransformasyon:Mesalazin presistemik olarak bağırsak mukozasında ve karaciğerde farmakolojik açıdan inaktifmetaboliti olan N-asetil-5-aminosalisilik asite (N-Ac-5-ASA) dönüşür.Asetilasyon, hastanın asetilatör fenotipinden bağımsız olarak gerçekleşmektedir.Bazı asetilasyon işlemleri kalın bağırsak bakterileri tarafından oluşmaktadır.Mesalazin ve N-Ac-5-ASA'nın proteine bağlanma oranları sırasıyla %%78'dir.Eliminasyon:Mesalazin ve metaboliti olan N-Ac-5-ASA feçes (büyük kısmı) ile birlikte renal (miktarı uygulama şekline, farmasötik formuna ve mesalazinin salınma yoluna bağlıolarak %20 - % 50 arasında değişir) ve biliyer (küçük bir kısmı) yollarıylaatılmaktadır. Renal atılım temelde N- Ac-5-ASA şeklinde gerçekleşir. Ağız yoluylatoplam uygulanan mesalazin dozunun yaklaşık % 1'i temelde N-Ac-5-ASA şeklindeanne sütüne geçer. Mesalazinin eliminasyon oranı; en çok elimine edilen (yaklaşık%85) metabolit formundaki N-Ac-5-ASA ile yaklaşık %13'tür (45 saatlik değer).Doğrusallık/Doğrusal olmayan durum:Veri yoktur. 5.3. Klinik öncesi güvenlilik verileriİyi rektal tolerans gösteren köpekler üzerindeki lokal tolerans çalışması dışında mesalazin ile preklinik çalışmalar yapılmamıştır. Güvenlilik farmakolojisi, genotoksisite, karsinojenite (sıçanlarda) veya üreme toksisitesi çalışmalarından elde edilen preklinik veriler, insanlar için özellikli birtehlike göstermemiştir. Toksisite çalışmalarında, mesalazinin oral olarak yüksek dozda tekrarlı uygulanmasından sonra böbrek toksisitesi (böbrek papiller nekrozu ve tüm nefron veya proksimal kıvrımlı (pars convoluta) tübüllerinin epitelyal hasarı) gözlenmiştir. imzanmıştır.Belge Do?''SMuFyzTAx * Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys7 / 8 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiKsantan zamkı Sodyum metabisülfitSodyum benzoatDeiyonize su 6.2. GeçimsizliklerGeçerli değil. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25oC'nin altında oda sıcaklığında saklayınız. 6.5. Ambalajın niteliği ve içeriği7 adet LDPE şişe içeren karton kutuda. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygunolarak imha edilmelidir. 7. RUHSAT SAHİBİDİNÇSA İLAÇ SAN. VE TİC. AŞ. 1. Organize Sanayi Bölgesi, Avar Cad. No: 2 06935, Sincan/ANKARATel : 0 312 267 11 92Fax : 0 312 267 11 99 8. RUHSAT NUMARASI(LARI)2022/417 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ31.07.2022 10. KÜB'ÜN YENİLENME TARİHİBelge Do Kodu: !ZW56aklUM0FyZmxXRG83ZmxXM0FyZl Ax Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys8 /8 |
İlaç BilgileriAsamesa 4 G/60 Ml Rektal SüspansiyonEtken Maddesi: Mesalazin Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.