Coriva 18 Mcg İnhalasyon Tozu, Sert Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADICORİVA 18 mcg İnhalasyon Tozu, Sert Kapsül 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her inhalasyon tozu kapsülü, 18 mikrogram tiotropium' a eşdeğer, 21,66 mikrogram tiotropium bromür içerir. Yardımcı madde:Yardımcı madde olarak, kapsül başına 12,478 mg laktoz (inek sütü kaynaklıdır) içermektedir. 3. FARMASOTİK FORMBeyaz ya da beyazımsı toz içeren kapsüller. 4. KLİNİK OZELLİKLER4.1 Terapötik endikasyonlarTiotropium bromür, orta ve ağır KOAH (kronik obstruktif akciğer hastalığı) olgularında düzenli kullanıldığında atak sıklığını azaltmakta, semptomları ve yaşam kalitesinidüzeltebilmekte, ancakuzun dönemdeki FEV1 düşüşünü değiştirmemektedir. 4.2 Pozoloji ve uygulama şekliErişkinlerPozoloji ve uygulama sıklığı:CORİVA'nın önerilen dozu, günde bir kez bir kapsül içeriğinin inhale edilmesidir. Önerilen dozdan daha fazla ilaç kullanılmamalıdır. Uygulama sekli:Sadece inhalasyon yoluyla kullanılır. Kapsüller ağızdan yutulmaz. İlacın uygun şekilde uygulandığından emin olmak için, bir doktor veya başka bir sağlık profesyoneli tarafından inhalerin nasıl kullanılacağı hastaya gösterilmelidir. Kuru tozinhalerlerin (DPI) doğru kullanımı tedavinin başarısı için gereklidir. Hastaya kullanmatalimatını dikkatlice okumaları ve kullanım talimatları ve talimattaki resimli şemalarıizlemeleri önerilir. Hastaların jelatin kapsülün parçalanabileceğini ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini bilmesi önemlidir. Hastaya jelatinin zararsızolduğu, ağızda yumuşayacağı ve yutulabildiği söylenmelidir. Kapsülü bir defadan fazladelmemek suretiyle parçalanma olasılığı asgari düzeye indirilebilir. 1 / 16 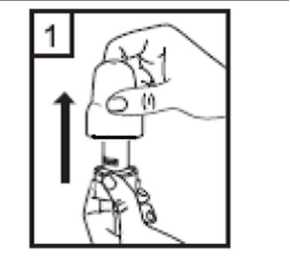 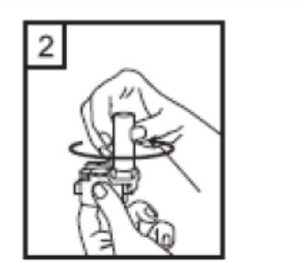 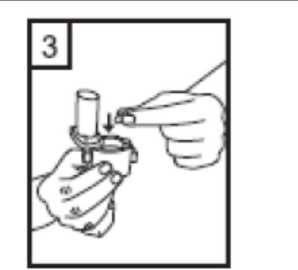 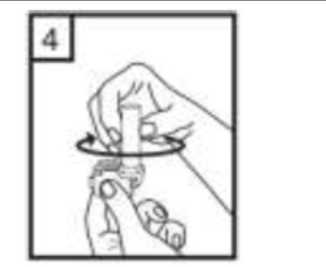
1-Kapağı çekip çıkarınız. 2-Kapsül bölmesini açınız. Cihazın tabanını sıkıca tutup, açmak için cihazın üst tarafında bulunan ok yönünde çeviriniz. 3-Parmaklarınızın tamamen kuru olduğundan emin olunuz. Ambalajından bir kapsül çıkarınız ve bukapsülü cihazın tabanındaki kapsül bölmesine yatıkolarak yerleştiriniz. Kapsülleri, kullanımdan hemenönce ambalajından çıkarmanız önemlidir. 4-Ağızlığı klik sesi duyana kadar geri çevirerek kapalı duruma getiriniz.
2 / 16 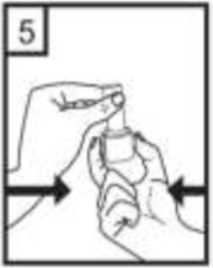 5- Tozu kapsülden serbest bırakmak için: Cihazı dik tutun (ağız parçası yukarıdaolacakşekilde) Kenarlardaki iki kulakçığa (düğmelere)AYNI ANDA ve SADECE BİR KEZ basıp bırakınız.Böylelikle cihazdaki kapsülü delmiş oldunuz. Lütfen dikkat: Bu aşamada jelatin kapsül parçalanabilir ve soluma sırasında küçük jelatin parçaları ağzınıza veya boğazınıza gelebilir. Fakatjelatin yenilebilir nitelikte olduğundan zararsızdır.
6-Nefesinizi kuvvetlice dışarı verin. 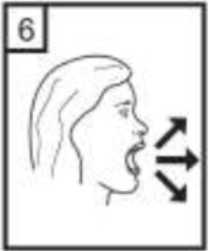  7-Ağız parçasını ağzınıza yerleştirin ve başınızı hafifçe geriye doğru eğiniz. Dudaklarınız ile ağızlığısıkıca sarınız. Olabildiğince hızlı, duraksamadan vealabildiğiniz kadar derin nefes alınız. Lütfen dikkat: Nefes alma sırasında, kapsül, kapsül haznesinde titreşir ve bir ses (vızıltı) oluşur. Bu sesiduymadıysanız kapsülün, kapsül bölmesinde sıkışıpsıkışmadığını kontrol ediniz. Bu durumda cihazıaçınız ve kapsülü bölmesinde oynatarak gevşetiniz.Daha sonra 7. basamağı tekrarlayınız. Kapsülü sıkıştığı yerden kurtarmak için düğmelere tekrar tekrarBASMAYINIZ.
3 / 16
Temizleme:Temizleme talimatları için hastalara Kullanma Talimatını dikkatlice okumaları önerilmelidir. Toz kalıntılarını temizlemek için ağız parçasını ve kapsül haznesini KURU ve temiz bir bezilesilin. Temiz yumuşak bir fırça da bu amaçla kullanılabilir. Cihazı temizlemek için SU KULLANMAYIN. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Karaciğer yetmezliği:Karaciğerleri bozuk olan hastalar CORİVA'yı önerilen dozlarda kullanabilirler (Bkz.5.2). Pediyatrik popülasyon:18 yaşından küçük hasta grubunda KOAH durumunda CORİVA'nın kullanım alanı yoktur. CORİVA'nın kistik fibrozda, çocuklar ve adolesanlardaki güvenliği ve etkinliliği belirlenmemiştir. Bu konuda veri yoktur. Geriyatrik popülasyon:Yaşlı hastalar CORİVA'yı önerilen dozlarda kullanabilirler. 4.3 KontrendikasyonlarCORİVA, tiotropium bromüre, atropin veya türevlerine, örn. ipratropium ya da oksitropium veya bu ilacın bileşenlerinden herhangi birine karşı aşırı duyarlılık öyküsü olan hastalardakontrendikedir (Bkz. Bölüm 2 ve Bölüm 6.1; Yardımcı maddeler). 4.4 Özel kullanım uyarıları ve önlemleriCORİVA, günde bir kez kullanılan bir idame tedavisi bronkodilatörüdür, akut bronkospazm epizotlarının başlangıç tedavisinde, yani kurtarma tedavisi şeklinde kullanılmamalıdır. 4 / 16 CORİVA uygulamasından sonra ani aşırı duyarlılık reaksiyonları oluşabilir. Diğer antikolinerjik ilaçlarla olduğu gibi, CORİVA dar-açılıglokomu kötüleştirebileceğinden, prostat hiperplazisi ya da mesane boynu obstrüksiyonu bulunan hastalarda idrar güçlüğü oluşturabileceğinden bu hastalarda dikkatle kullanılmalıdır. İnhalasyon yoluyla alınan ilaçlar, inhalasyonun indüklediği bronkospazma neden olabilirler. Yeni (<6 ay) miyokard enfarktüsü geçiren hastalarda; stabil olmayan veya yaşamı tehdit edici veya girişim gerektiren veya son 1 yıl içinde tedavisinde değişiklik yapılmış kardiyak aritmi durumlarında; son 1 yıl içinde kalp yetmezliği nedeniyle (NYHA Sınıf III veya IV) hastaneyeyatırılan hastalarda dikkatli kullanılmalıdır. Bu hastalar klinik çalışmalara dahil edilmemiştirvebu koşullar antikolinerjik etki mekanizmasından etkilenebilir. Renal fonksiyonlardaki azalmaya bağlı olarak plazma konsantrasyonu arttığı için, orta ile şiddetli böbrek yetmezliği olan hastalarda (kreatinin klerensi < 50 mL/dk) CORİVA, sadecebeklenen yararlar potansiyel risklere göre daha üstünse kullanılmalıdır. Şiddetli böbrekyetmezliği olan hastalarda uzun süreli deneyim yoktur (Bkz. 5.2). Hastalara, CORİVA'nın doğru bir şekilde nasıl kullanılacağı öğretilmelidir. Hastalara tozun göze kaçmaması için dikkatli olmaları öğütlenmelidir. Bu ilacın göze kaçması durumunda,dar- açılı glokomunun ortaya çıkabileceği veya kötüye gidebileceği, konjonktivada konjesyonveya korneada ödem sonucunda gelişen göz kızarmasıyla birlikte gözde ağrı veya rahatsızlıkhissi, geçici bulanık görme, haleler veya renkli görüntüler görme, akut dar açılı glokombelirtileri olabileceği konusunda hasta bilgilendirilmelidir. Bu semptomlar herhangi birkombinasyonu gelişirse, hasta ilacı kesmeli ve hemen bir uzman hekime başvurmalıdır.Miyotik göz damlalarının,etkili bir tedavi sağlamadıkları kabul edilmektedir. Antikolinerjik ilaçlarla gözlenen agız kuruluğu uzun dönemde diş çürüklerine yol açabilir. CORİVA günde bir defadan daha sık kullanılmamalıdır (Bkz. 4.9). CORİVA kapsülleri yalnızca inhaler cihazı ile kullanılmalıdır. CORİVA laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glikoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamalarıgerekir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDüzenli ilaç etkileşimi çalışmaları yürütülmemiş olmakla birlikte, tiotropium bromür inhalasyon tozu, KOAH tedavisinde yaygın olarak kullanılan diğer ilaclar ile beraber, ilaçetkileşimine yönelik klinik bulgular görülmeksizin kullanılmıştır; sempatomimetikbronkodilatatorler, metilksantinler, oral ve inhale steroidler, bu ilaçlar arasındadır. 5 / 16 Uzun etkili beta agonistlerin veya inhale kortikosteroidlerin tiotropium maruziyetini değiştirmediği bulunmuştur. CORİVA'nın diğer antikolinerjik içeren ilaçlarla birlikte uygulanması henüz çalışılmamıştır vebu nedenle önerilmemektedir. Özel popülasyonlara ilişkin ek bilgiler:Özel veri bulunmamaktadır. Pediyatrik popülasyon:Özel veri bulunmamaktadır. 4.6 Gebelik ve laktasyonGenel tavsiye: Gebelik kategorisi C'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):Çocuk doğurma potansiyeli bulunan kadınlar, tedavi süresince tıbben etkili olduğu kabul edilen doğumkontrol yöntemleri kullanmalıdır.Gebelik dönemi:Gebe kadınlarda kullanımına ilişkin yeterli ve iyi kontrollü çalışmalara dayanan veri mevcut değildir. Hayvanlar çalışmaları, klinik olarak ilgili dozlarda üremetoksisitesi açısından direk veya indirek zararlı etkilere işaret etmemiştir (Bkz. 5.3). İnsanlarayönelik potansiyel risk bilinmemektedir. CORİVA, olası yararlar fetüs üzerindeki olası riskeüstün olmadıkça, gebelik döneminde kullanılmamalıdır.Laktasyon dönemi:Tiotropium bromürün insanlarda süte geçip geçmediği bilinmemektedir. Laktasyondaki kemirgenlerde yapılan çalışmalarda, az miktarda tiotropiumun süte geçtiğibelirlenmiştir. Bununla birlikte, CORİVA emziren annelerde önerilmez. Tiotropium bromüruzun etkili bir maddedir. Emzirmenin kesilip kesilmeyeceği veya CORİVA tedavisine devamedilip edilmeyeceği kararı, emmenin bebeğe olan yararları ve CORİVA tedavisinin anneyeyararları birlikte değerlendirilerek verilmelidir.Üreme yeteneği/Fertilite:4.7 Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma becerileri üzerindeki etkilerine yönelik bir çalışma yapılmamıştır. Baş dönmesi ve bulanık görme olaylarının ortaya çıkması, araç ve makine kullanmabecerilerini etkileyebilir. 6 / 16 4.8 İstenmeyen etkilerGüvenlilik profili özetiListelenmiş olan istenmeyen etkilerin çoğu, CORİVA'nın antikolinerjik özelliklerine bağlanabilir. Advers reaksiyonların tablolu özetiAşağıda listelenen advers ilaç reaksiyonları için belirlenen sıklıklar, dört hafta ile dört yıl arasında değişen tedavi dönemlerini kapsayan 28 plasebo kontrollü klinik araştırmaya aithavuzun tiotropium grubunda (9,647 hasta) gözlenen advers reaksiyonların ham (crude)insidans oranlarına(yani, tiotropium atfedilen olaylar) dayanmaktadır. Aşağıdaki listede belirtilen istenmeyen etkilerin sıklık oranları şöyle tanımlanır: Çok yaygın >1/10 Yaygın >1/100 ilâ<1/10 Yaygın olmayan > 1/1.000 ilâ < 1/100 Seyrek >1/10.000 ilâ < 1/1.000 Çok seyrek <1/10.000 Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) Metabolizma ve beslenme hastalıklarıBilinmiyor: Dehidratasyon Sinir sistemi hastalıklarıYaygın olmayan: Baş dönmesi, baş ağrısı, tat alma bozuklukları Seyrek: Uykusuzluk Göz hastalıklarıYaygın olmayan: Bulanık görme Seyrek: Glokom, göz içi basıncında artış Kardiyak hastalıklarYaygın olmayan: Atriyal fibrilasyon Seyrek: Supraventriküler taşikardi, taşikardi,palpitasyonlar Solunum, göğüs bozuklukları ve mediyastinal hastalıklarYaygın olmayan: Farenjit, disfoni, öksürük Seyrek: Bronkospazm, burun kanaması,larenjit,sinüzit Gastro-intestinal hastalıklarYaygın: Ağız kuruluğu Yaygın olmayan: Stomatit, gastroözofajiyal reflü hastalığı, konstipasyon, bulantı Seyrek: İntestinal obstrüksiyon(paralitik ileus dahil), gingivit, glossit, 7 / 16 orofarenjiyal kandidiyazis, disfaji Bilinmiyor:Diş çürümesi Deri ve derialtı dokusu hastalıkları- Bağışıklık sistemi hastalıklarıYaygın olmayan: Döküntü Seyrek: Aşırı duyarlılık reaksiyonları (ani reaksiyonlar dahil), ürtiker, kaşıntı Bilinmiyor: Anjiyonörotik ödem, deri infeksiyonu ve deri ülseri, deride kuruluk Kas-iskelet, bağ dokusu ve kemik hastalıklarıBilinmiyor: Eklemlerde şişme Böbrek ve idrar hastalıklarıYaygın olmayan: İdrar retansiyonu,idrar yapmada güçlük Seyrek: İdrar yolu enfeksiyonu Seçilmiş advers reaksiyonların açıklamasıKontrollü klinik çalışmalarda yaygın olarak gözlenen istenmeyen etkiler, hastaların yaklaşık %4'ünde ortaya çıkan ağız kuruluğu gibi antikolinerjik etkilerdir. 28 klinik çalışmadatiotropium ile tedavi edilen 9.647 hastanın 18' i (%0.2). Ağız kuruluğu nedeniyle çalışmayıbırakmıştır. Antikolinerjik etkilerle tutarlı ciddi istenmeyen etkiler arasında, glokom, konstipasyon, paralitikileus dahil intestinal obstrüksiyon ve idrar retansiyonu bulunur. Diğer özel popülasyonlarİlerleyen yaşla birlikte antikolinerjik etkilerde artış görülebilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirilmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected] Doz aşımı ve tedavisiYüksek dozlarda CORİVA, antikolinerjik bulgu ve semptomlara yol açabilir. Ancak, sağlıklı gönüllülerde 340 mikrogram tiotropium dozuna kadar inhale edilen tek doz sonrasında, hiçbir sistemik antikolinerjik istenmeyen etki görülmemiştir. Ek olarak, sağlıklıgönüllülerde 170 mikrogram doza kadar tiotropium bromürün 7 gün uygulanmasını takibenağız kuruluğu dışında ilgili bir advers etki gözlenmemiştir. KOAH hastalarında yapılan çokludoz bir çalışmada, 4 hafta boyunca günlük maksimum 43 mikrogram tiotropium bromüruygulanması ileönemli bir istenmeyen etki gözlenmemiştir. 8 / 16 Sağlıklı gönüllülerde, günde bir kez 141 mg dozunda tekrarlı inhalasyonları izleyerek, ağız kuruluğu ile birlikte bilateral konjonktivit görülmüş ve bu durum tedavi halen sürmekte ikenortadan kaybolmuştur. KOAH'ı olan kişilerde dört hafta süreyle, günlük maksimum 36mikrogram tiotropium dozları ile uygulanan çok-dozlu bir çalışmada gözlenen tiotropiumabağlanabilecek tek istenmeyen olay, ağız kuruluğu olmuştur. Tiotropium kapsüllerinin oral yoldan alınması ile akut intoksikasyon pek olası değildir, çünkü oralyoldan biyoyararlanımı düşüktür. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Obstruktif akciğer hastalıkları için diğer ilaçlar, inhalerler, Antikolinerjikler, tiotropium ATC kodu:R03BB04 Etki mekanizmasıTiotropium, klinik tıpta genellikle antikolinerjik olarak adlandırılan, uzun etkili spesifik bir muskarinik reseptör antagonistidir. Tiotropium bromür, bronşiyal düz kaslarda bulunanmuskarinik reseptörlere bağlanarak, parasempatik sinir uçlarından salıverilen asetilkolininkolinerjik (bronkokonstrüktif) etkilerini inhibe eder. Ml'den M5'e kadar olan muskarinikreseptör alt-tiplerine karşı benzer bir afinite gösterir. Hava yollarında, düz kasta bulunan M3reseptörlerini kompetetif ve geri dönüşümlü olarak inhibe ederek gevşeme sağlar.Antagonizmanın yarışmacı ve geri-dönüşümlü olduğu, insan ve hayvan kaynaklı reseptörlerdeve izole organ preparatlarında gösterilmiştir. Klinik öncesi in vitroin vivoçalışmalarda,bronkoprotektif etkiler doza bağımlı olmuş ve 24 saatten daha uzun sürmüştür. Etkisinin uzunsüreli oluşu, muhtemelen M3 reseptörlerinden son derecede yavaş ayrışmasına bağlıdır;ipratropium ile gözlenenden anlamlı derecede daha uzun bir ayrışma yarı ömrüne sahiptir. N-kuaterner bir antikolinerjik olarak tiotropium, inhalasyon yoluyla uygulandığında, topikalolarak (bronko-) selektiftir; sistemik antikolinerjik etkilere yol açmadan önce kabul edilebilirbir terapötik aralık gösterir.Farmakodinamik etkilerTiotropium inhalasyonunu izleyen bronkodilatasyon, esas olarak bölgeye özgü (havayolları üzerinde) bir etki olup, sistemik bir etki değildir. M2 reseptörlerinden ayrışması, M3 reseptörlerindekinden daha hızlıdır. Fonksiyonel in vitro çalışmalarda (kinetik olarak kontrol edilmiş), M3 reseptörleri için reseptör alt tipselektivitesinin M2 reseptörlerinden fazla olduğu gösterilmiştir. Yüksek düzeydeki potens vereseptörden yavaş ayrışmanın klinikteki karşılığı, KOAH' lı kişilerdeki belirgin ve uzun etkilibronkodilatasyondur. Kardiyak elektrofizyolojiElektrofizyoloji: QT için özel olarak tasarlanmış ve 53 sağlıklı gönüllüyü kapsayan bir 9 / 16 çalışmada, 12 gün boyunca 18 mcg ve 54 mcg (yani, terapötik dozun 3 katı) Tiotropium uygulanması, EKG' de QT intervalini anlamlı şekilde uzatmamıştır. Klinik etkililik ve güvenlilikKlinik geliştirme programında 2663 KOAH hastası üzerinde yürütülen (1308' ine Tiotropium verilmişti) dördü bir yıl süreli, ikisi ise altı ay süreli randomize, çift-kör çalışmabulunmaktaydı. Bir yıllık program, iki plasebo kontrollü ve iki ipratropium kontrollüaraştırmadan oluşmuştur. Altı ay süreli araştırmalar, hem salmeterol hem de plasebokontrollüydü. Bu çalışmalar, akciğer fonksiyonlarının, dispne, KOAH' ta alevlenme şeklindekisağlıkla ilgili sonuçlanım ölçümlerinin ve sağlıkla ilişkili yaşam kalitesinin hastalarınkendileri tarafından değerlendirilmesini içeriyordu. Akciğer fonksiyonuSözü edilen bu çalışmalarda, günde bir kez uygulanan Tiotropium, akciğer fonksiyonlarında (bir saniyelik zorlu ekspirasyon hacmi, FEV1 ve zorlu vital kapasite, FVC) ilk dozu izleyen30 dakika içinde belirgin iyileşmeye yol açmış ve bu etki 24 saat süreyle kalıcı olmuştur.Bronkodilatasyon büyük çoğunlukla üçüncü gün gözlenmeye başlanmış ve farmakodinamikkararlı duruma bir hafta içinde ulaşılmıştır. Tiotropium sabah ve akşam doruk ekspiratuar akımhızı (PEFR) düzeylerini, hastalarda yapılan günlük kayıtlarda ölçüldüğü şekliyle, anlamlıolarak iyileştirmiştir. Tiotropium bromürün bronkodilatör etkisi, herhangi bir tolerans belirtisiolmaksızın, 1 yıl boyunca devametmiştir. 105 KOAH hastasıyla yürütülen randomize, plasebo kontrollü klinik çalışmada, plasebo ile karşılaştırıldığında, sabah veya akşam uygulanmasından bağımsız olarak, 24 saat süreylebronkodilatasyon etkisinin devam ettiği gösterilmiştir. Uzun dönem klinik çalışmalar (6 ay ve 1 yıl)Dispne, Egzersiz toleransıTiotropium bromür dispnede anlamlı iyileşmeler sağlamıştır (Geçiş Dispne Endeksi (Transition Dysponea Index) kullanılarak değerlendirilmiştir). Bu iyileşme, tedavi dönemiboyunca devam etmiştir. Dispnedeki iyileşmenin egzersiz toleransı üzerindeki etkisi, 433 orta-şiddetli KOAH hastasında yürütülen, 2 randomize, çift kör, plasebo kontrollü çalışmada incelenmiştir. Buçalışmalarda, 6 hafta süreli Tiotropium tedavisi, bisiklet ergometrisinin semptomlarlasınırlanan dayanıklılık süresini anlamlı oranda (plasebo ile karşılaştırıldığında, %75maksimum çalışma kapasitesinde %19.7 (Çalışma A) ve %28.3 (çalışma B) oranında)iyileştirmiştir. Sağlıkla ilişkili yaşam kalitesi492 hastada yürütülen, 9 ay süreli, randomize, çift kör, plasebo kontrollü klinik çalışmada, Tiotropium, St. George Solunum Anketi (St. George' s Respiratory Questionnaire =SGRQ)total skoru ile değerlendirilen sağlıkla ilişkili yaşam kalitesini iyileştirilmiştir. Tiotropium iletedavi edilen hastalardan SGRQ total skorunda anlamlı iyileşmeler (yani >4 birim) gösteren 10 / 16 hastaların oranı, plasebo ile karşılaştırıldığında, %10.9 daha yüksek bulunmuştur. (Tiotropium gruplarında %59.1' e karşı plasebo grubunda %48.2, p=0.029). Gruplar arasındaki ortalamafarklılık 4.19 birimdir (p=0.001; güven aralığı: 1.69-6.68). SGRQ skoru alt alanlarındakiiyileşmeler, semptomlar için: 8.19 birim, aktivite için: 3.91 birim ve günlük yaşamüzerindeki etkileri için: 3.61 birimdir. Bu alt alanların tümündeki iyileşmeler istatistikselolarak anlamlıdır. KOAH alevlenmeleri1.829 orta-şiddetli KOAH hastasını içeren bir randomize, çift kör, plasebo kontrollü çalışmada, tiotropium bromür KOAH alevlenmesi yaşayan hastaların oranında istatistikselolarak anlamlı bir azalma (%32.2' den %27.8' e) sağlamış ve alevlenme sayısında daistatistiksel olarak anlamlı şekilde %19 oranında azalmıştır (1.05 olay/maruziyet hastayılından 0.85 olay/maruziyet hasta yılına). Ayrıca, KOAH alevlenmesi nedeniyle hastaneyeyatan hastaların oranı, tiotropium bromür grubunda %7.0 ve plasebo grubunda %9.5 olmuştur(p=0.056). KOAH nedeniyle hastaneye yatanların sayısı %30 oranında azalmıştır (0.25olay/maruziyet hasta yılından 0.18 olay/maruziyet hasta yılına). Önceki yıl içinde alevlenme öyküsü olan 7.376 KOAH hastasında 1 yıl süreli randomize, çift kör, çift sağır maskeleme (double dummy), paralel gruplu çalışmada, günde bir kez 18mikrogram Tiotropium tedavisi ile, günde iki kez 50 mikrogram salmeterol HFA pMDItedavisinin, orta ve şiddetli alevlenmelerin insidansı üzerindeki etkisi karşılaştırılmıştır.
*Zaman (gün) hastaların ilk çeyreğini refere eder. Zamana karşı olay analizleri, Cox orantılı tehlike regresyon modeli kullanılarak merkez (havuzlanmış) ve kovaryant olarak tedavi ileyapılmıştır; oran, tehlike oranını refere eder. **Zamana karşı olay analizleri, Cox orantılı tehlike regresyon modeli kullanılarak merkez (havuzlanmış) ve kovaryant olarak tedavi ile yapılmıştır; oran, tehlike oranını refere eder.Hastaların ilk çeyreği için zaman (gün) hesaplanamaz, çünkü şiddetli alevlenme yaşayanhastaların oranı çok düşüktür. ***Olay yaşayan hastaların sayısı, havuzlanmış merkezle tabakalandırılmış Cochran- 11 / 16 Mantel-Haenszel testi kullanılarak analiz edilmiştir; oran, risk oranını işaret eder. Salmeterol ile karşılaştırıldığında, Tiotropium ilk alevlenmeye kadar geçen zamanı uzatmış (187 güne karşı 145 gün), riskte %17 oranında düşme sağlamıştır (tehlike oranı 0.83; %95güven aralığı(GA) 0.77-0.90; p<0.001). Tiotropium aynı zamanda ilk şiddetli alevlenmeye (hastaneye yatma) kadar geçen zamanı da uzatır (tehlike oranı 0.72; %95 GA 0.61-0.85; p<0.001). Uzun dönemli klinik çalışmalar (1 yıldan uzun, 4 yıla kadar)5.993 randomize hastada yürütülen (3.006 hasta plasebo ve 2.987 hasta Tiotropium almıştır) 4 yıl süreli, randomize, çift kör, plasebo kontrollü klinik çalışmada, Tiotropium ile elde edilenFEV1 iyileşmesi, plasebo ile karşılaştırıldığında, 4 yıl süreyle tutarlı bir seyir izlemiştir.Tiotropium grubunda >45 ay tedaviyi tamamlayan hasta oranı plasebo ile karşılaştırıldığındadaha yüksektir (%63.8' e karşı %55.4, p<0.001). FEV1' deki azalmanın yıllık oranıTiotropium ile plasebo arasında benzerdi. Tedavi sırasında ölüm riskinde %16 azalmamevcuttu. Ölüm insidans hızı plasebo grubunda 4.79/100 hasta yılına karşı tiotropiumgrubunda 4.10/100 hasta yılı bulunmuştur (tehlike oranı (tiotropium/plasebo)=0.84, %95GA=0.73, 0.97). Tiotropium ile tedavi respiratuvar yetmezlik (advers olay bildirimleri ilekaydedilmiştir) riskini %19 oranında (2.09' a karşı 1.68vaka/100 hasta yılı, rölatif risk(tiotropium/plasebo)=0.81, %95 GA=0.65, 0.999) düşürmüştür. Tiotropium aktif kontrollü çalışmaUzun süreli, geniş bir randomize, çift kör, aktif kontrollü, gözlem süresi 3 yıla kadar uzayan çalışmada tiotropium inhalasyon için toz içeren kapsül ile tiotropium inhalasyon çözeltisininetkililiği ve güvenliliği karşılaştırılmıştır (5.694 hasta tiotropium inhalasyon için toz içerenkapsül, 5.711 hasta da tiotropium inhalasyon çözeltisi almıştır). Primer sonlanım noktaları, ilkKOAH alevlenmesine kadar geçen zaman, tüm nedenlere bağlı mortaliteye kadar geçenzaman ve bir alt çalışmada (906 hasta) çukur FEV1' dir (dozlama öncesi). İlk KOAH alevlenmesine kadar geçen zaman, tiotropium inhalasyon için toz içeren kapsül ve tiotropium inhalasyon çözeltisi çalışmasında sayısal olarak benzerdir (tehlike oranı (tiotropiuminhalasyon için toz içeren kapsül/tiotropium inhalasyon çözeltisi) 1.02' dir, %95 GA 0.971.08). İlk KOAH alevlenmesine kadar geçen medyan gün sayısı, tiotropium inhalasyon içintoz içeren kapsül için 719 gün ve tiotropium inhalasyon çözeltisi için 756 gündür. Tiotropium inhalasyon için toz içeren kapsülün bronkodilatör etkisi 120 hafta boyunca devam etmiştir ve tiotropium inhalasyon çözeltisi ile benzerdir. Tiotropium inhalasyon çözeltisinekarşı tiotropium inhalasyon için toz içeren kapsül için çukur FEV1' deki ortalama farklılık0.010 litredir(%95 GA -0.018-0.038 1). Tiotropium inhalasyon çözeltisi ile tiotropium inhalasyon için toz içeren kapsülü karşılaştıran pazarlama sonrası TIOSPIR çalışmasında, vital durum takibini de içeren tüm nedenlere bağlımortalite, çalışma sırasında tiotropium inhalasyon için toz içeren kapsül ve tiotropiuminhalasyon çözeltisi için benzer bulunmuştur (tehlike oranı tiotropium inhalasyon için toz 12 / 16 içeren kapsül/tiotropium inhalasyon çözeltisi) 1.04, %95 GA 0.91-1.19). Pediyatrik popülasyonAvrupa İlaç Ajansı, KOAH ve kistik fibroz için pediyatrik popülasyonun tüm alt gruplarında Tiotropium ile yapılacak çalışmaların sonuçlarını sağlama zorunluluğunu kaldırmıştır(pediyatrikkullanım ile ilgili bilgiler için Bkz. 4.2). 5.2 Farmakokinetik özelliklerGenel özelliklerTiotropium bromür, kiralite göstermeyen bir kuaterner amonyum bileşiğidir ve suda kısmen çözünür. Tiotropium bromür, kuru toz inhalasyonu şeklinde uygulanır. İnhalasyon yolu ileuygulamada genel olarak, verilen dozun büyük çoğunluğu gastrointestinal kanalda, daha azbir kısmı ise, amaçlanan organ olan akciğerde tutulur. Aşağıda açıklanan farmakokinetikverilerinçoğu, tedavi için önerilenden daha yüksek dozlar ile elde edilmiştir. Emilim:Sağlıklı genç gönüllüler tarafından kuru toz inhalasyonundan sonra elde edilen %19.5 düzeyindeki mutlak biyoyararlanım değeri, akciğere ulaşan bölümün yüksek ölçüdebiyoyararlanılabilir olduğunu düşündürmektedir. Bileşiğin kimyasal yapısından (kuaterneramonyum bileşiği), tiotropiumun gastro-intestinal kanaldan iyi absorbe edilmemesi beklenir.Aynı nedenle besinlerin tiotropium absorpsiyonu üzerinde etkili olması beklenmemektedir.Oral tiotropium solüsyonları, %2-3 düzeyinde bir mutlak biyoyararlanıma sahiptirler.Maksimum plazma tiotropium konsantrasyonları, inhalasyondan 5-7 dakika sonragözlenmiştir. Kararlı durumda doruk tiotropium düzeyleri KOAH hastalarında 12.9 pg/ml' dir ve çok kompartmanlı modele uygun olarak, hızla azalır. Kararlı durum çukur plazmakonsantrasyonları 1.71 pg/ml' dir. Tiotropium inhalasyon için toz içeren kapsülün kullanımını takiben elde edilen sistemik maruziyet, tiotropium inhalasyon çözeltisi kullanımı ile benzerdir. Dağılım:İlaç plazma proteinlerine %72 oranında bağlanır ve 32 L/kg' lık bir dağılım hacmi gösterir. Akciğerdeki lokal konsantrasyonlar bilinmemektedir, ancak uygulama şekli, akciğerlerdeönemli oranda daha yüksek konsantrasyonların varlığını düşündürmektedir. Sıçanlarda yapılançalışmalarda, tiotropiumun kan beyin bariyerini önemli bir düzeyde geçmediği gösterilmiştir. Biyotransformasyon:Biyotransformasyona uğrama derecesi küçüktür. Bu durum, sağlıklı genç gönüllülerde bir doz intravenöz uygulamadan sonra %74 oranında değişmemiş maddenin idrarla atılmasıylabelirlenmiştir. Ester yapısındaki tiotropium, enzimatik olmayan bir yol ile parçalanarak, biralkol olan N-metilskopin ve ditiyenilglikolik aside parçalanır; bu maddelerin her ikisi demuskarinik reseptörlere bağlanmazlar. 13 / 16 İnsan karaciğer mikrozomları ve insan hepatositleriyle yapılan in vitrodeneyler bir miktar ilacın (intravenöz uygulama sonrasında dozun %20'sinden azı), sitokrom P450' ye bağımlıoksidasyon ve daha sonrasında glutatyon konjügasyonu yoluyla, çeşitli Faz II metabolitlerinemetabolize olduğunu düşündürmektedir. Bu enzimatik yol CYP450 2D6 (ve 3A4) inhibitörleriolan kinidin, ketokonazol ve gestoden ile inhibe edilebilir. Böylelikle CYP450 2D6 ve 3A4,dozun küçük bir bölümünün eliminasyonundan sorumlu metabolik yolda yer almaktadırlar.Tiotropium bromür,supra-terapötikkonsantrasyonlarda bile, insan karaciğermikrozomlarındaki sitokrom P450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ya da 3A'yı inhibe etmez. Eliminasyon:Tiotropiumun efektif yarılanma ömrü, KOAH hastalarında, 27-45 gündür. Sağlıklı genç gönüllülerde intravenöz uygulanan dozdan sonra total klerens 880 mL/dk, bireyler arasıdeğişkenlik ise %22 oranındaydı. İntravenöz uygulanan tiotropium, idrar yoluyla esas olarakdeğişmemiş halde atılır (%74). KOAH hastalarında kuru toz inhalasyonundan sonra kararlıduruma kadar üriner ekskresyon, 24 saat içinde, değişmemiş ilacın dozun %7' sidir(1.3mikrogram) geri kalanı büyük oranda barsaklarda emilmemiş ilaç halinde bulunur vefeçes ile elimine edilir. Tiotropiumun renal klerensi, kreatinin klerensini geçer; bu durumidrara sekrete olduğunu işaret etmektedir. KOAH' lı kişiler tarafından, günde bir kez kronikinhalasyondan sonra, farmakokinetik kararlı duruma 7nci günde ulaşılır ve daha sonrasındaherhangi bir birikim görülmez. Doğrusallık/doğrusal olmayan durum:Tiotropium, gerek intravenöz uygulama, gerekse kuru toz inhalasyonu sonrasında terapötik aralıkta, formülasyondan bağımsız olarak, doğrusal farmakokinetik gösterir. Hastalardaki karakteristik özelliklerYaş:Pediyatrikpopülasyon:Bkz. 4.2.Geriyatrik popülasyon:Esas olarak böbrekler yoluyla atılan bütün ilaçlardan beklendiği gibi, ileri yaş tiotropiumun renal klerensinde bir azalma ile ilişkili bulundu (<65 yaşındaki KOAHhastalarında 365 ml/dk iken, >65 yaşındaki KOAH hastalarında 271 ml/dk). Bu durum,EAA0-6,ss veya Cmaks,ss değerlerinde ilişkili bir artışla sonuçlanmamıştır.Böbrek yetmezliği:KOAH hastalarında tiotropiumun inhalasyonla kararlı duruma kadar günde bir kez uygulamalarını takiben, normal böbrek fonksiyonu olan hastalarla (CLCR >80 ml/dk)kıyaslandığında, hafif böbrek bozuklukları (CLCR 50-80 ml/dk), hafifçe daha yüksek EAA0-6,ss değerleri ile (%1.8-30 daha yüksek) sonuçlanmış, Cmaks,ss değerleri ise benzerbulunmuştur. Böbrek fonksiyonları normal KOAH hastalarıyla kıyaslandığında, orta ile şiddetli böbrek bozukluğu (CLCR <50 mL/dk) olan KOAH hastalarında intravenöz tiotropium uygulaması,plazma konsantrasyonlarının iki katına çıkmasıyla sonuçlanmış (EAA0-4saat değerinde %82 14 / 16 artış) ve Cmaks değerinde %52 artış) ve bu durum kuru toz inhalasyonundan sonraki plazma konsantrasyonları ile doğrulanmıştır. Karaciğer yetmezliği:Karaciğer yetersizliğinin tiotropium farmakokinetiği üzerinde önemli bir etkisinin olması belirlenmemektedir. Tiotropium büyük çoğunlukla renal eliminasyon yoluyla (sağlıklı gençgönüllülerde %74) ve enzimatik olmayan basit ester parçalanmasıyla muskarinik reseptörlerebağlanmayan ürünlere ayrılarak vücuttan temizlenmektedir. Japon KOAH hastaları Çalışmalar-arası karşılaştırmada, tiotropium inhalasyonunu takiben, kararlı durumda dozlamadan 10 dakika sonra, Japon hastalardaki ortalama doruk tiotropium konsantrasyonları,beyaz ırktan KOAH hastalarına göre %20-70 daha yüksek bulunmuştur. Bununla birlikte,Japon hastalarda beyaz ırktan olanlara göre daha yüksek mortalite veya kardiyak risk sinyalisaptanmamıştır. Diğeretnik orijinden ve ırktan kişilerle ilgili farmakokinetik veriler yetersizdir. Farmakokinetik/Farmakodinamik ilişkiler5.3 Klinik öncesi güvenlilik verileriGüvenlilik farmakolojisi, tekrarlı doz tosisitesi ve üreme tosisitesi için yürütülen konvansiyonel çalışmalarda gözlenen birçok etki, tiotropium bromürün antikolinerjiközellikleriyle açıklanabilir. Tipik olarak, hayvanlarda, gıda tüketiminde azalma, vücut ağırlığıartışının inhibisyonu, ağız ve burunda kuruluk, lakrimasyonda ve tükürük salgısında azalma,midriyaz ve kalp atım hızında artma gözlenmiştir. Tekrarlı doz toksisite çalışmalarındakaydedilen diğer ilgili etkiler, sıçan ve farelerde rinit ve nazal boşluk ve larinkste epitelyaldeğişikliklerle ortaya çıkan hafif solunum yolu irritasyonu ile sıçanlarda proteinli depozitlerlebirlikte prostatit ve idrar torbasında taş oluşumudur. Gebelik, embriyonal/fötal gelişim, doğum veya postnatal gelişim üzerindeki zararlı etkiler, sadece anneye toksik olan doz düzeylerinde gösterilmiştir. Tiotropium bromür, sıçanlar vetavşanlarda teratojenik değildir. Sıçanlarda yürütülen genel bir üreme ve fertiliteçalışmasında, ilaç uygulanan ebeveynlerin veya yavrularının fertilite veya çiftleşmeperformansı üzerinde, hiçbir dozda, hiçbir advers etki saptanmamıştır. Solunum (irritasyon) ve ürogenital (prostatit) değişiklikler ve üreme tosisitesi, terapötik maruziyetin 5 katından daha yüksek lokal veya sistemik maruziyet düzeylerinde gözlenmiştir.Genotoksisite ve karsinojenik potansiyel çalışmaları, insanlar için özel bir tehlikegöstermemiştir. 15 / 16 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiLaktoz (inek sütü kaynaklıdır.) 6.2 GeçimsizliklerCORİVA'nın bilinen bir geçimsizliği yoktur. 6.3 Raf ömrüSatışa sunulmak üzere paketlenmiş CORİVA inhalasyon tozu kapsülünün raf ömrü 24 aydır. 6.4 Saklamaya yönelik özel tedbirler25oC altında oda sıcaklığında saklanmalıdır. Kapsüller dondurulmamalıdır. 6.5 Ambalajın niteliği ve içeriğiCORİVA 18 mcg İnhalasyon Tozu, Sert Kapsül, HDPE şişelerde ambalajlarda ve aşağıdaki şekilde piyasaya sunulmaktadır: 30 veya 60 kapsül ve monodoz inhaler cihazı içeren karton kutuda, kullanım talimatı ile birlikte. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerÖzel bir gereklilik yoktur. Kullanılmamış olan ürün ya da atık materyaller, Tıbbi Atıkların Kontrolü ve Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmeliklerine uygun olarak imha edilmelidir. Son kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre ve Şehircilik Bakanlığınca belirlenen toplama sistemine veriniz. 7. RUHSAT SAHİBİAbdi İbrahim İlaç San. ve Tic. A.Ş. Reşitpaşa Mahallesi, Eski Büyükdere Caddesi No:4 34467Masl ak/ S arıyer/İstanbul 8. RUHSAT NUMARASI2022/520 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 12.09.2022 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ16 / 16 |
İlaç BilgileriCoriva 18 Mcg İnhalasyon Tozu, Sert KapsülEtken Maddesi: Tiotropium Bromür Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.