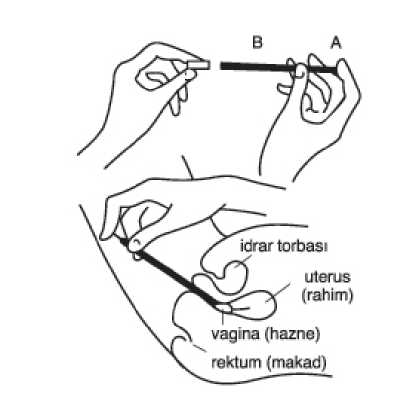
Gyno Canesten 150 Mg Vajinal Tablet Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIGYNO CANESTEN® 1 500 mg vajinal tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Klotrimazol mikronize 500 mg Yardımcı maddeler:Laktoz (inek) 395 mg Yardımcı maddelerin tam listesi için 6.1'e bakınız. 3. FARMASÖTİK FORMVajinal tablet. Beyaza yakın hafif sarımsı renkte tablet. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarGenital bölgede mantarların (çoğunlukla Candida) sebep olduğu enfeksiyonlar (vajinit) ve klotrimazole duyarlı bakterilerin sebep olduğu süperenfeksiyonlar. 4.2. Pozoloji ve uygulama şekliPozoloji / uygulama sıklığı ve süresi:1 vajinal tablet gece uygulanmalıdır. Gerektiğinde tedavi tekrarlanabilir ancak reküran enfeksiyonlar, altta yatan bir tıbbi sebebe işaret ediyor da olabilirler. Semptomların 2 ay içerisinde tekrarlaması halinde hastanın doktorabaşvurması ve tıbbi tavsiye alması gerekir. Uygulama şekli:GYNO CANESTEN, tercihen gece yatarken aplikatör yardımı ile vajinaya mümkün olduğu kadar derine yerleştirilmelidir (aplikatör kullanım talimatına bakınız). Yerleştirme işlemi en iyi, sırt üstüyatarak ve bacakları hafifçe yukarı doğru çekerek yapılır. Aplikatör kullanım talimatı: 1. A pistonunu duruncaya kadar çekiniz. Aplikatör B içine, bir vajinal tablet koyunuz. 2. Tableti içeren aplikatörü vajinanın mümkün olduğu kadar derinine dikkatlice yerleştiriniz. Bu en iyi şekilde sırt üstü yatarak yapılır. Semptomlar 7 günden fazla devam ederse, hastada, bir doktorun görmesi ve tedavi etmesi gereken bir tıbbi sorun bulunuyor olabilir. Tedavi menstruasyon (adet) başlamadan önce tamamlanmalı, menstruasyon döneminde tedavi yapılmamalıdır. Özellikle candida vulvitiscandidabalanitis'tereenfeksiyonu önlemek için, hastanın eşi de aynı zamanda lokal olarak CANESTEN® Krem kullanmalıdır.Labiyumlar ve bitişik bölgeler eşzamanlı olarak enfekte oldukları takdirde, intravajinal tedaviye ek olarak bir harici kremle lokal tedavi de önerilmeli ve uygulanmalıdır(kombinasyon tedavisi). Cinsel partnerde de kaşıntı, enflamasyon, vb. gibi semptomların mevcut olması halinde onun da lokal olarak tedavi edilmesi gerekir. Bu ürünü kullanırken tamponlar, intravajinal duş, spermisidler veya başka vajinal ürünler kullanmayınız. Vajinal enfeksiyon varlığında vajinal cinsel ilişkiden kaçınılması tavsiye edilir, aksi halde bu ürünün kullanımı sırasında enfeksiyon cinsel partnere de bulaşabilir Hamilelik sırasında, vajinal tabletler aplikatör kullanmadan vajinaya uygulanmalıdır. GYNO CANESTEN, kokusuz ve renksizdir, iç çamaşırları lekelemez. GYNO CANESTEN'in tamamen eriyebilmesi için vajinada neme ihtiyaç vardır. Yeterli nemin olmaması halinde erimeyen tablet parçaları vajina içine dağılır. Bunun önlenmesi için,GYNO CANESTEN, yatmadan önce vajinanın mümkün olduğu kadar derinineyerleştirilmelidir. Gece boyunca tabletin erimemesi halinde krem kullanımı düşünülebilir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek / Karaciğer yetmezliği:Böbrek/karaciğer yetmezliği olan hastalarda kullanıma ait veri bulunmamaktadır. Pediyatrik popülasyon:Bu ürün, yetişkinlerde ve 12 yaş ve üzerine çocuklarda kullanılmak üzere tasarlanmış ve üretilmiştir. 12 yaş altındaki çocuklarda kullanılmamalıdır. Geriyatrik popülasyon:Geriyatrik kullanımına ait veri bulunmamaktadır. 4.3. KontrendikasyonlarEtkin madde (klotrimazol) veya Bölüm 6.1'de listelenen herhangi bir yardımcı maddeye karşı aşırı duyarlılığı olanlarda kullanılmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleriHastada ateş (38°C veya daha yüksek), alt karın bölgesinde ağrı, sırt ağrısı, kötü kokulu vajinal akıntı, bulantı, vajinal kanama ve/veya bağlantılı omuz ağrısı varsa, hastanın birdoktora başvurması gerekir. Klotrimazol krem, genital bölgeye uygulandığında prezervatif ve diyafram gibi lateks ürünlerin etkililiğini ve güvenliliğini azaltabilir (kadınlar: intravajinal olarak, labia vevulvanın komşu bölgesi; erkekler: prepus ve penisin glansı). Gözlerle temas etmesine engel olunuz. Yutmayınız. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriVajinal klotrimazol ve oral takrolimusun (FK-506: immünsupresan) eşzamanlı tedavisi, takrolimusun ve benzer şekilde sirolimus'un plazma seviyelerinde artışa neden olabilir.Bundan ötürü, hastalarda takrolimus ve sirolimus doz aşımı semptomlarının, gerekirse, ilgiliplazma seviyelerinin izlenmesi gerekir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlar uygun korunma yöntemlerini kullanmalıdırlar. Gebelik dönemiGebelikte maruz kalma olgularına ilişkin sınırlı sayıda klinik veri mevcuttu r. Hayvanlar üzerine yapılan çalışmalar üreme toksisitesi açısından doğrudan ya da dolaylı zararlı etkilerolduğunu göstermemektedir (bkz. Bölüm 5.3). Klotrimazol gebelik süresince sadece hekim önerisi doğrultusunda kullanılabilir. Gebelik sırasında GYNO CANESTEN ile tedavi, aplikatör kullanılmadan yapılmalıdır. Laktasyon dönemiKlotrimazolün insan sütüne geçmesine ilişkin veri yoktur. Bununla birlikte, uygulamadan sonra sistemik absorpsiyon minimumdur ve sistemik etkilere yol açması olası değildir.Klotrimazol emzirme döneminde kullanılabilir. Üreme yeteneği/FertiliteKlotrimazolün üreme yeteneği (fertilite) üzerine etkileri ile ilgili insanlar üzerinde yapılmış bir çalışma bulunmamaktadır. Ancak hayvan çalışmalarında üreme yeteneği üzerine etkisigözlenmemiştir. (bkz. Bölüm 5.3) 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı üzerine etkisi yoktur veya gözardı edilebilir düzeydedir. 4.8. İstenmeyen etkilerÇok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1,000 ila < 1/100); seyrek (>1/10,000 ila < 1/1,000); çok seyrek (<1/10,000), bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor) Aşağıdaki advers reaksiyonlar onay sonrası süreçte klotrimazol kullanımıma bağlı olarak ortaya çıkmışlardır. Bu reaksiyonların popülasyonun bilinmeyen bir bölümü tarafındangönüllülük esasına göre bildirilmiş olmalarından dolayı, güvenilir bir sıklık değerlendirmesiher zaman mümkün değildir. Bağışıklık sistemi hastalıklarıBilinmiyor: Anafilaktik reaksiyon, anjiyoödem, hipersensitivite. Damar hastalıklarıBilinmiyor: Senkop, hipotansiyon. Solunum, göğüs hastalıkları ve mediastinal bozukluklarBilinmiyor: Dispne. Gastrointestinal hastalıklarBilinmiyor: Karın ağrısı, mide bulantısı. Deri ve deri altı doku hastalıklarıBilinmiyor: Dö küntü, ü rtiker. Üreme sistemi ve meme rahatsızlıklarıBilinmiyor: Vajinal eksfolasyon, vajinal akıntı, vajinal kanama, vulvovajinal rahatsızlık hissi, vulvovajinal eritem, vulvovajinal yanma hissi, vulvovajinal kaşıntı, vulvovajinal ağrı. Genel bozukluklar ve uygulama yeri rahatsızlıklarıBilinmiyor: Uygulama yeri tahrişi, ödem, ağrı. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. ([email protected];;tel: 0800 314 00 08; faks: 0312 218 35 99).4.9. Doz aşımı ve tedavisiOlası tek doz vajinal veya dermal uygulama sonrasında (absorpsiyonu artıracak şeklinde geniş bölgeye uygulanması durumunda) veya yanlışlıkla oral yoldan alınması durumunda akutintoksikasyon riski gözlenmemiştir. Spesifik bir antidotu yoktur. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerATC kodu: G01AF02 Farmakoterapötik grup: Jinekolojik Antiinfektifler ve Antiseptikler/İmidazol Türevleri Etki mekanizması Azoller (örneğin klotrimazol) genellikle kaşıntı, yanma, akıntı, kızarıklık, şişme ve ağrı gibi vulvovajinal semptomlarla karakterize vulvovajinal kandidozun lokal tedavisi için tavsiyeedilir. Klotrimazol, mantarlara karşı etkisini ergosterol sentezini inhibe ederek gösterir. Ergosterol sentezinin inhibisyonu, sitoplazmik membranın yapısal ve fonksiyonel olarak bozulmasına yolaçar. Klotrimazol dermatofitler, mayalar, küfler vb.'ne karşı in vitroin vivoolarak geniş spektrumlu antimikotik etkiye sahiptir.Antimikotik etkisinin yanı sıra, gram-pozitif mikroorganizmalar (Streptokoklar / Stafilokoklar) ve gram-negatif mikroorganizmalara (Bakteroides / Gardnerella vaginalis)karşı da etkilidir.Uygun test koşulları altında, bu mantar tipleri için MİK değerleri, 0,062 - 8,0 mcg / ml substrat aralığı içindedir. Klotrimazolün etki şekli, enfeksiyon bölgesinde biriken klotrimazol konsantrasyonuna bağlı olarak, temelde fungistatik ya da fungisidaldir. İlacın in-vitroetkinliği, fungal elementlerin proliferasyonuyla sınırlıdır; fungal sporlar çok az duyarlıdırlar.İn vitroklotrimazol, 0,5 - 10 mcg / ml substrat konsantrasyonlarında enterokoklar hariç gram-pozitif kokların ve korinebakterilerin çoğalmasını inhibe eder.Duyarlı fungal suşların birincil düzeyde dirençli varyantları çok nadirdir; duyarlı mantarların sekonder direnç oluşturması olayı, bugüne kadar terapötik koşullar altın da sa dece çok izolevaka ve durumlarda gözlemlenmiştir. 5.2. Farmakokinetik ÖzelliklerGenel özelliklerEmilim:Vajinal uygulamalardan sonra yapılan farmakokinetik araştırmalar, yalnızca az miktarda klotrimazolün (%3-10'unun) emildiğini göstermektedir. Dağılım:500 mg klotrimazolün vajinal uygulamasından sonra doruk plazma konsantrasyonları < 10 ng/ml olup (tespit sınırının altında), ölçülebilir sistemik etki veya yan etkilere yolaçmamaktadır. Biyotransformasyon:Klotrimazol insanlara oral yoldan tek doz uygulandıktan sonra aktivitenin %10'u 24 saatte idrarla ve %25'i altı günde idrarla atılmıştır. İdrar kromatografisi iki majör metabolit ve üçminör metabolit göstermiştir. Ana aktivite, 2-klorofenil-4-hidroksifenil-fenil-metana karşılıkgelmektedir. Hidrolizden sonra baskın bileşenin 2-klorofenil-bis-fenil-metan olduğugörülürken, az miktarda 2-klorofenil-bis-fenil-metanol ve 2 -klorofenil-bis-fenil-metanol ve 2-klorofenil-4-hidroksifenil-metan da gözlemlenmiştir. Değişmeyen klotrimazol yalnızca eser miktarlarda bulunmuştur. Eliminasyon:Sıçanlarda ve insanlarda oral yoldan uygulanan klotrimazolün kolay emildiği ve cilt dahil tüm vücut dokularına dağıldığı görülmüştür. Pik serum düzeyleri uygulamadan üç saat sonraelde edilir. Klotrimazol inaktif metabolitlerine parçalanarak inaktif metabolitler şe klinde dışkıve idrarla atılır. Metabolitlerin büyük bir kısmı safra üzerinden dışkıya ulaşırken, bir kısmıbağırsak mukozası tarafından atılabilir. Doğrusallık/Doğrusal Olmayan Durum:Veri bulunmamaktadır. 5.3. Klinik öncesi güvenlilik verileriNon-klinik veriler geleneksel güvenlilik farmakolojisi çalışmaları, tekrarlayan doz toksisitesi, genotoksisite, karsinojenik potansiyal ve üreme ve gelişim toksisitesi açısından insandaspesifik herhangi bir zararlı etki ortaya koymamıştır. Klotrimazolün farklı doz ve formlarındaki lokal ve sistemik toleransı, köpeklerde ve maymunlarda subakut intravajinal çalışmaların yanı sıra tavşanlarda subakut dermalçalışmalar ile değerlendirilmiştir. Bu çalışmaların hiçbirinde tedaviyle ilgili bir kanıtolabilecek lokal veya sistemik advers etki bulunmamıştır. Klotrimazolün oral toksisitesi iyi çalışılmıştır. Tek bir oral uygulamanın ardından klotrimazol; fareler için 761 ila 923 mg/kg beden ağırlığı (ba), yeni doğan sıçanlar için 95 ila 114 mg/kg ba ve erişkin sıçanlar için 114 ila 718 mg/kgba, tavşanlar için > 1000 mg/kg ba ve köpekler ve kediler için > 2000 mg/kg ba LD50değerleri ile deney hayvanlarında hafif ila orta derecede toksiktir. Sıçanlarda ve köpeklerde gerçekleştirilen oral tekrarlayan doz çalışmaların da, toksisitenin birincil hedef organının karaciğer olduğu tespit edilmiştir. Bu durum, kronik (78 hafta) sıçançalışmasında 50 mg/kg'da ve subkronik (13 hafta) köpek çalışmasında 100 mg/kg'dabaşlayan serum transaminaz aktivitelerinde bir artış ile birlikte karaciğerde vaküolasyon veyağ birikintilerinin görülmesi ile kanıtlanmıştır. Klotrimazol, in vitro ve in vivo mutajenisite miktar tayinlerinde kapsamlı olarak çalışılmış ve mutajenik potansiyeline dair bir kanıt bulunamamıştır. Sıçanlarda Klotrimazol'ün 78 haftalıkoral doz çalışmasında herhangi bir karsinojenik etki gösterilmemiştir. Sıçan doğurganlık çalışmasında, FB30 sıçan gruplarına çiftleşmeden önce 10 hafta boyunca ve 3 haftalık çiftleşme dönemi sırasında (yalnızca erkekler için) veya dişiler iç in, gebeliğin13. gününe kadar veya doğum sonrasında 4. haftaya kadar 50 mg/kg ba'na kadar oraldozlarda klotrimazol verilmiştir. Neonatal sağkalım 50 mg/kg ba grubunda düşmüştür. 25mg/kg ba'na kadar verilen dozlarda klotrimazol, yavruların gelişimini etkilememiştir.Klotrimazol uygulamalarında hiçbir doz doğurganlığı etkilememiştir. Farelerde, tavşanlarda ve sıçanlarda sırasıyla 200, 180 ve 100 mg/kg'a kadar verilen oral dozlarda hiçbir teratojenisite gösterilmemiştir. İntravenöz yolla 30 mg/kg klotrimazol uygulanan emzirme dönemindeki 3 sıçan ile gerçekleştirilen bir çalışmada, uygulamadan 4 saat sonra ilacın plazma düzeyine kıyasla sütte10 ila 20 kat daha fazla salgılandığı gösterilmiştir. Bunu 24 saatte 0,4 katlık bir azalmaizlemiştir. Topikal uygulamadan sonra ilacın sınırlı sistemik absorpsiyonu düşünüldüğünde, topikal klotrimazol kullanımına ilişkin bir tehlike beklenmemektedir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiKalsiyum laktat Laktik asit Laktoz (kaynak: inek) Avicel Mısır nişastası 1 -Ethenil-2-prolidon homopolimer (Polyplasdone XL10) Hidroksi propil metil selüloz (HPM Selüloz 15CP) Silikon dioksit (Aerosil 200) Magnezyum stearat 6.2. GeçimsizliklerBilinen herhangi bir geçimsizliği yoktur. 6.3. Raf ömrü60 ay 6.4. Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız. Bu ilacı çocukların göremeyeceği ve erişemeyeceği yerlerde saklayınız. 6.5. Ambalajın niteliği ve içeriğiAlüminyum folyoda, karton baskılı kutu içinde, aplikatör ve kullanma talimatı ile beraber tek tablet. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİBayer Türk Kimya San.Ltd.Şti., İstanbul. Fatih Sultan Mehmet Mah. Balkan Cad. No: 53 34770 Ümraniye / İstanbulTel: 0 216 528 36 00Faks: 0 216 645 39 50 8. RUHSAT NUMARASI05.12.1990 - 154/36 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 05.12.1990 10. KÜB'ün YENİLENME TARİHİ |
İlaç BilgileriGyno Canesten 150 Mg Vajinal TabletEtken Maddesi: Klotrimazol Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.