Klavunat Es 600 Mg / 42,9mg Oral Süspansiyon Hazırlamak İçin Kuru Toz Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ URUNUN ADIKLAVUNAT® ES 600/42.9 mg oral süspansiyon hazırlamak için kuru toz 2. KALİTATİF VE KANTİTATİF BİLEŞİMİEtkin madde:Her 5 mL'de: 600 mg amoksisiline eşdeğer 723,186 mg amoksisilin trihidrat 42,9 mg klavulanik asite eşdeğer 107,271 mg potasyum klavulanat Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMOral süspansiyon hazırlamak için kuru toz. Sarımsı beyaz renkte, akışkan, homojen, ahududu kokulu toz. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarKLAVUNAT ES, lokal resmi antibiyotik reçeteleme kılavuzları ve duyarlılık verilerine uygun olarak kullanılmalıdır. KLAVUNAT ES, pediatrik hastalarda KLAVUNAT ES'e duyarlı organizmaların yol açtığı bakteriyel enfeksiyonların kısa süreli tedavisinde endikedir. Üst solunum yolu enfeksiyonları (KBB dahil); örneğin: Streptococeus pneumoniaeHaemophilus influenzae#Moraxella catarrhalis#tenkaynaklanan nükseden veya kronik ortakulak iltihabı. Böyle hastalar çoğunlukla önceki 3ay içinde akut orta kulak iltihabı için antibiyotik tedavisi almış, 2 yaşında ve daha küçükolan veya kreşe giden hastalardır. Tipik olarak Streptococcus pneumoniae, Haemophilus influenzae#,Streptococcuspyogenes'inneden olduğu tonsillo-farenjit ve sinüzit. Alt solunum yolu enfeksiyonları; örneğin tipik olarak Streptococcus pneumoniae,Haemophilus influenzae#Moraxella catarrhalis#"in neden olduğu lobar pnömoni vebronkopnömoni. Tipik olarak Staphylococcus aureus#Streptococcus pyogenes'inneden olduğu deri veyumuşak doku enfeksiyonları.#Bu bakteri türlerinin bazı üyeleri, amoksisiline duyarsız hale gelmelerini sağlayan beta-laktamaz üretirler (bknz. Bölüm 5.1).
1 KLAVUNAT ES'e duyarlılık, coğrafya ve zamana göre değişecektir. Mevcut ise lokal duyarlılık verilerine danışılmalı ve gerektiğinde mikrobiyolojik örnekleme ve duyarlılıktestleri yapılmalıdır. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Önerilen KLAVUNAT ES dozu, 10 gün boyunca, 12 saat arayla, ikiye bölünmüş doz halinde verilen 90/6.4 mg/kg/gün'dür (aşağıdaki tabloya bakınız). Ağırlığı 40 kg'ın üzerinde olanpediatrik hastalar veya yetişkinler üzerinde herhangi bir deneyim yoktur. 3 aylıktan küçükçocuklarda KLAVUNAT ES ile ilgili klinik veri bulunmamaktadır.
KLAVUNAT ES 600/42.9 mg oral süspansiyon hazırlamak için kuru toz diğer amoksisilin-klavulanat süspansiyonlarıyla aynı miktarda klavulanik asit (potasyum tuzu olarak) içermez. KLAVUNAT ES 600/42.9 mg oral süspansiyon hazırlamak için kuru toz, her 5 mL'de 42,9 mg klavulanik asit içerirken, KLAVUNAT-BID 200/28 mg oral süspansiyon hazırlamak içinkuru toz her 5 mL'de 28,5 mg klavulanik asit, KLAVUNAT-BID 400/57 mg Forte oralsüspansiyon hazırlamak için kuru toz ise her 5 mL'de 57 mg klavulanik asit içerir. Bunedenle, KLAVUNAT-BID 200/28 mg oral süspansiyon hazırlamak için kuru toz veKLAVUNAT-BID 400/57 mg Forte oral süspansiyon hazırlamak için kuru toz, KLAVUNATES 600/42.9 mg oral süspansiyon hazırlamak için kuru toz yerine kullanılmamalıdır çünkü buürünler birbirlerinin yerine kullanılamaz. Uygulama Şekli:Gastrointestinal intoleransı en aza indirmek için KLAVUNAT ES yemekle birlikte alınmalıdır. Tedavi, gözden geçirilmeden 14 günden fazla uzatılmamalıdır. Tedavi parenteral olarak başlatılıp bir oral preparat ile sürdürülebilir. Kullanmadan önce oral süspansiyon iyice çalkalanmalıdır.
2 Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Kreatinin klerensi 30 mL/dak veya üzerinde olan çocuklarda doz ayarlamasına gerek yoktur. Kreatinin klerensi 30 mL/dak altında olan çocuklarda KLAVUNAT ES kullanımı tavsiyeedilmemektedir. Karaciğer yetmezliğinde doz dikkatli bir şekilde ayarlanmalıdır; karaciğer fonksiyonları düzenli aralıklarla izlenmelidir. Doz önerisinde bulunmaya temel teşkil edecek yeterli veribulunmamaktadır. Pediatrik popülasyon:Yukarıda belirtilen pozoloji/uygulama sıklığı ve süresi bilgileri pediyatrik popülasyon için geçerlidir. Geriatrik popülasyon:Uygulanabilir değildir. 4.3. KontrendikasyonlarEtkin maddelere, penisilinlerden herhangi birine ya da bölüm 6.1'de listelenen yardımcı maddelerin herhangi birine aşırı duyarlılığı olanlarda kontrendikedir. KLAVUNAT ES, diğer beta-laktam ajanlara karşı (örn. sefalosporin, karbapenem veya monobaktam) aşırı duyarlılık hikayesi (örn. anafilaksi) olan hastalarda kontrendikedir.KLAVUNAT ES, amoksisilin/klavulanik asit ile ilişkili sarılık/karaciğer fonksiyonbozukluğu geçmişi olan hastalarda kontrendikedir (bkz.Bölüm 4.8). 4.4. Özel kullanım uyarıları ve önlemleriKLAVUNAT ES ile tedaviye başlanmadan önce geçmişinde penisilin, sefalosporin veya diğer alerjenlere karşi aşırı duyarlılık hikayesinin varlığı dikkatlice sorgulanmalıdır (bkz.Bölüm 4.3 ve 4.8). Penisilin tedavisi alan hastalarda ciddi ve nadiren ölümcül aşırı duyarlılık reaksiyonları (anafilaktoid ve şiddetli kutanöz advers reaksiyonlar dahil) bildirilmiştir. Bu reaksiyonlarıngeçmişinde penisiline karşı aşırı duyarlılık hikayesi olan ve atopik bireylerde görülmesi dahaolasıdır. Alerjik bir reaksiyon meydana gelmesi halinde, KLAVUNAT ES tedavisi kesilmelive uygun alternatif tedaviye başlanmalıdır. Ciddi anafilaktik reaksiyonlar adrenalinle acildurum tedavisi gerektirir. Entübasyon da dahil olmak üzere oksijen, intravenöz steroidler vehava yolu kontrolü gerekebilir. Bir enfeksiyonunun amoksisiline duyarlıorganizma/organizmalara bağlı olduğu kanıtlanırsa, resmi kılavuzlara göreamoksisilin/klavulanik asitten amoksisiline geçiş göz önünde bulundurulmalıdır. Böbrek fonksiyonunda bozukluk olan veya yüksek dozlar alan hastalarda konvülsiyonlar görülebilir (bkz. Bölüm 4.8).
3 Amoksisilin kullanımını takiben görülen kızamık benzeri döküntü enfeksiyöz mononükleoz ile ilişkili olabileceğinden eğer enfeksiyöz mononükleoza ilişkin bir şüphe var iseKLAVUNAT ES tedavisinden kaçınılmalıdır. Amoksisilin ile tedavi sırasında eşzamanlıallopurinol kullanımı alerjik deri reaksiyonları olasılığını arttırabilir. Uzun süreli kullanım bazen duyarlı olmayan organizmaların aşırı üremesi ile sonuçlanabilir. Tedavinin başında püstüllerle birlikte ateşli bir genel eritemin oluşması akut jeneralize eksantematöz püstülozun (AGEP) bir semptomu olabilir (bkz. Bölüm 4.8). Bu reaksiyonKLAVUNAT ES'in bırakılmasını gerektirir ve daha sonraki amoksisilin kullanımıkontrendike hale gelir. Amoksisilin/klavulanik asit karaciğer fonksiyon bozukluğu bulgusu olan hastalarda dikkatle kullanılmalıdır (bkz. Bölüm 4.2, 4.3 ve 4.8). Karaciğer olayları daha çok erkeklerde ve yaşlı hastalarda bildirilmiştir ve uzun süreli tedaviyle ilişkili olabilir. Bu olaylar çocuklarda nadiren bildirilmiştir. Tüm popülasyonlardabelirti ve semptomlar, genellikle tedavi sırasında ya da tedaviden kısa süre sonra ortaya çıkarancak bazı olgularda tedavinin kesilmesinin ardından birkaç haftaya kadar belirgin halegelmeyebilir. Bunlar genellikle geri dönüşlüdür. Hepatik olaylar ciddi olabilir ve son derecenadir koşullarda ölümler bildirilmiştir. Bunlar hemen her zaman altta yatan ciddi hastalığıolanlarda ya da eşzamanlı olarak karaciğer üzerinde etkili olma potansiyeli bilinen ilaçlarıkullananlarda meydana gelmiştir (bkz. Bölüm 4.8). Mikotik veya bakteriyel patojenler ile süperenfeksiyonların olasılığı tedavi sırasında unutulmamalıdır. Süperenfeksiyonların meydana gelmesi durumunda (genelde Pseudomonasveya Candida dahil), ilaç kesilmeli ve/veya uygun bir tedavi başlatılmalıdır. Amoksisilin dahil neredeyse tüm antibakteriyel ajanlarla, antibiyotiğe bağlı kolit bildirilmiştir ve şiddeti hafiften yaşamı tehdit edici boyuta kadar uzanabilir (bakınız Bölüm 4.8). Busebeple, herhangi bir antibiyotik tedavisi sırasında veya sonrasında ishal olan hastalarda buteşhisin değerlendirilmesi önemlidir. Antibiyotiğe bağlı kolit gözlendiğinde, KLAVUNATtedavisi derhal kesilmeli, bir doktor tarafından değerlendirilmeli ve uygun tedavibaşlatılmalıdır. Bu durumda anti-peristaltik ilaçlar kontrendikedir. Uzun süreli tedavi sırasında böbrek, karaciğer fonksiyonları ve hematopoetik fonksiyonlar dahil olmak üzere organ sistemi fonksiyonlarının periyodik olarak değerlendirilmesi tavsiyeedilir. KLAVUNAT ES ve oral antikoagülan kullanan bazı hastalarda seyrek olarak protrombin zamanında uzama (INR değerinde yükselme) bildirilmiştir. Antikoagülanlar ile birlikte reçeteedildiğinde uygun şekilde izlenmesi gereklidir. İstenilen antikoagülasyon düzeyinisürdürebilmek için oral antikoagülan dozunda ayarlama yapılması gerekebilir (bkz. Bölüm 4.5 ve 4 8) Bu ke^e' güvenli elektronik imza ile imzalanmıştır. Belge Do 4 Azalmış idrar çıkışı olan hastalarda, özellikle parenteral tedavide çok seyrek olarak kristalüri görülmüştür. Yüksek doz amoksisilin tedavisi sırasında, amoksisilin kristalüri olasılığınıazaltmak için uygun miktarda sıvı alınması ve idrar miktarının düzenlenmesi tavsiye edilebilir. Mesane kateterleri olan hastalarda düzenli açıklık kontrolü sürdürülmelidir (bkz. Bölüm 4.9). Amoksisilinle tedavi sırasında idrarda glukozun arandığı testler yapıldığında, enzimatikglukoz oksidaz yöntemleri kullanılmalıdır, çünkü enzimatik olmayan yöntemlerde yalancıpozitif sonuçlar görülebilir. KLAVUNAT ES'te klavulanik asit varlığı, kırmızı hücre membranlarınca IgG ve albüminin spesifik olmayan bağlanmasına neden olarak yalancı pozitif Coombs testine yol açabilir. Amoksisilin/klavulanik asit alan ve daha sonra ÂspergillusÂspergillusÂspergillusÂspergillus-dışı4.5. Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleriOral antikoagülanlarOral antikoagülanlar ve penisilin antibiyotikleri etkileşim raporları alınmaksızın uygulamada yaygın olarak kullanılmıştır. Bununla birlikte literatürde asenokumarol veya varfarinle idameettirilen ve bir amoksisilin kürü reçete edilen hastalarda artmış uluslararası normalize oran(INR) vakaları mevcuttur. Eşzamanlı uygulama gerekli ise, protrombin zamanı veyauluslararası normalize oran (INR) amoksisilin ilavesi veya kesilmesi durumunda dikkatliceizlenmelidir. Ayrıca, oral antikoagülanların dozunda ayarlamalar da gerekli olabilir (bkz.Bölüm 4.4 ve 4.8). MetotreksatPenisilinler metotreksatın atılımını azaltabilir ve bu da toksisitede potansiyel bir artışa neden olur. ProbenesidProbenesid ile birlikte kullanımı önerilmemektedir. Probenesid amoksisilinin renal tübüler sekresyonunu azaltır. Probenesidin KLAVUNAT ES ile birlikte kullanımı amoksisilinin kanseviyelerinin artışına ve kanda bulunma süresinin uzamasına neden olabilirken, klavulanatıetkilemez.
bildirilmiştir. Doz öncesi düzeydeki değişim, genel mikofenolik aist maruziyetindeki değişimleri doğru şekilde temsil etmeyebilir. Bu nedenle, mikofenolat mofetil dozunda bir değişikliknormalde klinik greft fonksiyon bozukluğu kanıtı yokluğunda gerekli olmayacaktır. Öteyandan, kombinasyon sırasında ve antibiyotik tedavisinden kısa süre sonra yakın klinik takipyürütülmelidir. AllopurinolAmoksisilin tedavisi sırasında allopurinol kullanımı alerjik cilt reaksiyonları olasılığını artırabilir. Allopurinol ve KLAVUNAT ES'in birlikte kullanımına ait veri yoktur. Oral kontraseptiflerDiğer antibiyotiklerde de olduğu gibi KLAVUNAT ES, barsak florasını etkileyebilir, östrojen reabsorpsiyonunun azalmasına yol açar ve kombine oral kontraseptiflerin etkililiğini azaltır. Özel popülasyonlara ilişkin ek bilgilerEtkileşim çalışması yapılmamıştır. Veri bulunmamaktadır. Pediyatrik popülasyon:Etkileşim çalışması yapılmamıştır. Yukarıda verilen bilgiler pediyatrik popülasyon için geçerlidir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: B Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Diğer antibiyotiklerde de olduğu gibi KLAVUNAT ES, barsak florasını etkileyebilir, östrojen reabsorpsiyonunun azalmasına yol açar ve kombine oral kontraseptiflerin etkililiğini azaltır.Bu nedenle tedavi süresince alternatif, etkili ve güvenilir bir doğum kontrol yöntemiuygulanmalıdır. Gebelik dönemiHayvan çalışmaları, gebelik, embriyonal/fetal gelişim, doğum ya da postnatal gelişim açısından doğrudan ya da dolaylı zararlı etkilere işaret etmemektedir (bkz. Bölüm 5.3).İnsanlarda gebelik sırasında amoksisilin/klavulanik asit kullanımına ilişkin kısıtlı verilerartmış konjenital malformasyonlar riskine işaret etmemektedir. Preterm, prematüre fetalmembran rüptürü görülen kadınlarda yürütülen tekli bir çalışmada, amoksisilin/klavulanik asitile profilaktik tedavinin neonatlarda artmış nekrotizan enterokolit riski ile ilişkili olabileceğibildirilmiştir. Hekim tarafından zorunlu bulunmadıkça gebelik sırasında kullanımındankaçınılmalıdır. Gebe kadınlara verilirken dikkatli olunmalıdır.
6 Oral ve parenteral yolla verildiği hayvanlar (fare ve sıçanlara insanlarda uygulanan dozun 10 katı dozda) üzerinde yapılan reprodüktif çalışmalarda, KLAVUNAT ES teratojenik etkigöstermemiştir. Tüm ilaçlarda olduğu gibi, doktor tarafından gerekli görülmedikçe gebelik esnasında özellikle gebeliğin ilk üç ayında kullanılmamalıdır. LaktasyonKLAVUNAT ES'in iki etkin maddesi de anne sütüne geçer (klavulanik asitin anne sütü alan sütçocukları üzerindeki etkisi ile ilgili herhangi bir bilgi yoktur). Dolayısıyla anne sütüylebeslenen süt çocuklarında ishal ve mukoz mebranlarda mantar enfeksiyonu olasılığı vardır, bunedenle emzirmenin kesilmesi gerekebilir. Sensitizasyon olasılığı göz önüne alınmalıdır.Emzirme döneminde amoksisilin/klavulanik asit sadece tedaviyi uygulayan hekiminfayda/risk değerlendirmesinden sonra kullanılmalıdır. Üreme yeteneği/Fertilite1,200 mg/kg/güne varan oral dozlarda (vücut yüzey alanı temelinde maksimum yetişkin insan dozunun 5.7 katı) KLAVUNAT ES'in, 2:1 oranında amoksisilin:klavulanat formülasyonu iledozlanmış sıçanlarda fertilite ve üreme performansı üzerinde etkisi olmadığı tespit edilmiştir. 4.7. Araç ve makine kullanımı üzerindeki etkilerKLAVUNAT ES'in araç ve makine kullanımı üzerindeki etkileriyle ilgili bir çalışma gerçekleştirilmemiştir. Ancak, hastalar araç ve makine kullanımını etkileyebilecek istenmeyenetkiler (örn. alerjik reaksiyonlar, sersemlik hali, konvülsiyonlar) oluşabileceği ile ilgilibilgilendirilmelidir (bkz. Bölüm 4.8). 4.8. İstenmeyen etkilerEn çok raporlanan istenmeyen etkiler diyare, bulantı ve kusmadır. KLAVUNAT ile yapılan klinik çalışmalardan ve pazarlama sonrası gözetimden elde edilen ve MedDRA sistem organ sınıfına göre ayrılan advers ilaç reaksiyonları aşağıda listelenmektedir. İstenmeyen etkilerin meydana gelme sıklıklarına göre sınıflandırılması için aşağıdaki terminolojiler kullanılmıştır: Çok yaygın > 1/10 Yaygın > 1/100 ila < 1/10Yaygın olmayan > 1/1000 ila < 1/100Seyrek > 1/10.000 ila < 1/1000Çok seyrek < 1/10.000 Bilinmiyor (mevcut verilerden tahmin edilemiyor) Enfeksiyonlar ve enfestasyonlarYaygın: Mukokutanöz kandidiazis Belge DoaalreS1:httpS://www.turklye.gov.tr/SagHk-t1tek-ebyS:httpS://www.turklye.gov.tr/SagHk-t1tek-ebyS7 Kan ve lenf sistemi hastalıklarıSeyrek: Geri dönüşümlü lökopeni (nötropeni dahil) ve trombositopeni. Bilinmiyor: Geri dönüşümlü agranülositoz, hemolitik anemi, kanama ve protrombin zamanında uzama1, geri dönüşümlü trombositopenik purpura ve eozinofili Bağışıklık sistemi hastalıklarıBilinmiyor: Anjiyonörotik ödem11, anafilaksi11, serum hastalığı benzeri sendrom11, aşırı duyarlılık vasküliti11, kollaps Sinir sistemi hastalıklarıYaygın olmayan: Baş ağrısı, baş dönmesi Seyrek: Ajitasyon, anksiyete, davranış değişiklikleri, zihin bulanıklığı, konfüzyon, sersemlik, insomnia Bilinmiyor: Geri dönüşümlü hiperaktivite, konvülziyonlar2 (konvülziyonlar renal fonksiyon bozukluğu olanlarda veya yüksek doz alanlarda görülebilir), aseptik menenjit. Gastrointestinal hastalıklarÇok yaygın: Diyare (yetişkinlerde) Yaygın: Diyare, bulantı3, kusma. Yaygın olmayan: Sindirim güçlüğü Bilinmiyor: Antibiyotiğe bağlı kolit4, siyah tüylü dil (dildeki papillaların belirginleşip siyah renk alması), dişte renk değişikliği5 (Çocuklarda çok seyrek olarak dişlerdeyüzeysel renk değişimleri olduğu bildirilmiştir. Genellikle fırçalama ilegiderildiğinden, iyi bir ağız hijyeni ile diş rengi değişimi engellenebilir). Hepato-bilier bozukluklarYaygın olmayan: AST ve/veya ALT6'da artış. Bilinmiyor: Hepatit7 ve kolestatik sarılık7. Hepatik olaylar çoğunlukla erkeklerde ve yaşlılarda bildirilmiştir ve uzun süreli tedavi ile ilişkili olabilir. Bu olaylar çocuklarda nadiren bildirilmiştir. Tüm popülasyonlarda belirti vesemptomlar, genellikle tedavi sırasında ya da tedaviden kısa süre sonra ortaya çıkar ancakbazı olgularda tedavinin kesilmesinin ardından birkaç haftaya kadar belirgin halegelmeyebilir. Bunlar genellikle geri dönüşlüdür. Hepatik olaylar ciddi olabilir ve son derecenadir koşullarda ölümler bildirilmiştir. Bunlar hemen her zaman altta yatan ciddi hastalığıolanlarda ya da eşzamanlı olarak karaciğer üzerinde etkili olma potansiyeli bilinen ilaçlarıkullananlarda meydana gelmiştir. Deri ve deri altı doku hastalıkları8Yaygın olmayan: Deride döküntü, kaşıntı, ürtiker Seyrek: Eritema multiforme Bilinmiyor: Stevens-Johnson sendromu, toksik epidermal nekrolizis, bülloz döküntülü dermatit, akut generalize ekzantemöz püstüller (AGEP)10. Eozinofili ve sistemik
^emptamlailPy#<ş!ik{İStj»iia&reakSiyBu ffiRE iaBelge Dohttps://www.turkiye.gov.tr/saglik-titck-ebys8 Böbrek ve idrar yolu hastalıkları:Seyrek: Hematüri Bilinmiyor: İnterstisyel nefrit, kristalüri9 (bkz. Bölüm 4.9). 1 bkz. Bölüm 4.4 2 bkz. Bölüm 4.4 3 Bulantı çoğu kez daha yüksek oral dozlarla ilişkilendirilir. Gastrointestinal reaksiyonlarbelirginse, bunlar amoksisilin/klavulanik asit yemekle birlikte alınarak azaltılabilir. 4 Psödomembranöz kolit ve hemorajik kolit dahil (bkz. Bölüm 4.4). 5Çocuklarda çok nadir olarak yüzeysel dişte renk değişikliği bildirilmiştir. Genellikle fırçalama ile giderilebildiğinden, iyi bir ağız hijyeni dişte renk değişimini önlemeye yardımcıolabilir. 6 Beta-laktam sınıfı antibiyotikler ile tedavi edilmiş hastalarda AST ve/veya ALT'de ortadüzeyde artış bildirilmekle birlikte bu bulguların anlamı bilinmemektedir. 7 Bu olaylar diğer penisilinler ve sefalosporinler ile not edilmiştir (bkz. Bölüm 4.4). 8 Herhangi bir aşırı duyarlılık dermatit reaksiyonu meydana gelirse tedavi bırakılmalıdır (bkz.Bölüm 4.4). 9 bkz. Bölüm 4.9 10 bkz. Bölüm 4.4 11 bkz. Bölüm 4.3 ve 4.4 Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9. Doz aşımı ve tedavisiDoz aşımı semptomları ve belirtileriGastrointestinal semptomlar ve sıvı ile elektrolit dengesi bozuklukları belirgin olabilir. Bazı durumlarda böbrek yetmezliğine yol açan amoksisilin kristalürisi gözlenmiştir (bkz. Bölüm 4.4) . Böbrek fonksiyonu bozulmuş hastalarda ve yüksek dozları alanlarda konvülsiyonlar meydana gelebilir. Amoksisilinin ağırlıklı olarak büyük dozlarının intravenöz uygulanmasından sonra mesane kateterlerinde çöktüğü bildirilmiştir. Düzenli açıklık kontrolü sürdürülmelidir (bkz. Bölüm 4.4) . İntoksikasyon tedavisiGastrointestinal semptomlar su/elektrolit dengesine dikkat edilerek semptomatik olarak tedavi edilebilir. Belge Doi.türkiye.gov.tr/saglik-titck-ebyshttps:/
9 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Beta laktamaz inhibitörlerini de içeren penisilin kombinasyonları ATC kodu: J01CR02 Etki mekanizması:Amoksisilin bakteriyel hücre duvarının bütünleyici bir yapısal bileşeni olan biyosentetik bakteriyel peptidoglikan yolağındaki bir ya da daha fazla enzimi (sıklıkla penisilin bağlayanproteinler, PBP'ler olarak adlandırılan) inhibe eden yarı sentetik bir penisilindir (beta-laktamantibiyotik). Peptidoglikan sentezinin inhibisyonu genellikle hücre duvarının zayıflamasınayol açar ki bunu genellikle hücre lizisi ve ölüm izler. Amoksisilin dirençli bakterilerin ürettiği beta-laktamazlarla parçalanmaya duyarlıdır ve bu nedenle tek başına amoksisilinin aktivite spektrumu bu enzimleri üreten organizmalarıiçermez. Klavulanik asit yapısal olarak penisilinlerle ilişkili bir beta-laktamdır. Bazı beta-laktamaz enzimlerini inaktive ederek amoksisilinin inaktivasyonunu önler. Tek başına klavulanik asitklinik açıdan faydalı antibakteriyel etki göstermez. Farmakokinetik/farmakodinamik ilişkisiMinimum inhibe edici konsantrasyon üzerindeki süre (T>MİK) amoksisilin için ana etkililik belirleyici etken olarak kabul edilir. Direnç mekanizmalarıAmoksisilin/klavulanik aside direnç için başlıca iki mekanizma mevcuttur: Sınıf B, C ve D dahil kendileri klavulanik asit ile inhibe olmayan bakteriyelbeta-laktamazlar ile inaktivasyon. Hedef için antibakteriyel ajanın afinitesini azaltan, PBP'lerde değişiklik Bakterilerin veya atım pompası mekanizmalarının geçirmezliği özellikle Gram-negatif bakterilerde bakteriyel dirence neden olabilir veya katkıda bulunabilir. Kesim noktalarıAmoksisilin/klavulanik asit için M İKkesim noktaları, Avrupa Antimikrobiyal Duyarlılık Testi (EUCAST) kesim noktalarıdır.
10
Direnç prevalansı seçili türler için coğrafik açıdan ve zamanla çeşitlilik gösterebilir ve dirence ilişkin yerel bilgiler özellikle şiddetli enfeksiyonlar tedavi edilirken arzu edilir. Gerektiğindeyerel direnç prevalansı enfeksiyonların en azından bazı tiplerinde ajanın faydasından şüpheedilmesine yol açacak şekilde olduğunda uzman tavsiyesi alınmalıdır. Genellikle duyarlı türlerAerobik Gram-pozitif mikroorganizmalarStaphylococeus aureus(metisiline duyarlı)*Streptococeus pneumoniae1Streptococcuspyogenesve diğer beta hemolitik streptokoklarAerobik Gram-negatif mikroorganizmalarHaemophilus influenzae2Moraxella catarrhalisMoraxella catarrhalisEdinilmiş direncin bir sorun oluşturabileceği türlerAerobik Gram-negatif mikroorganizmalarKlebsiella pneumoniaeDoğası gereği dirençli organizmalarAerobik Gram-negatif mikroorganizmalarLegionella pneumophilaDiğer mikroorganizmalarChlamydophila pneumoniaeChlamydophila psittaciCoxiella burnetiiMycoplasma pneumoniae* Metisiline dirençli tüm stafilokoklar amoksisilin/klavulanik asite dirençlidir. 1 Yalnızca onaylı endikasyonlarda penisiline dirençli olan Streptococcus pneumoniae'ninamoksisilin/klavulanik asitin bu sunumuyla tedavisi uygundur (bkz. Bölüm 4.1).2 Bazı AB ülkelerinde duyarlılığı azalmış suşlar, %10'dan daha yüksek bir sıklıkta BelgeDoama Kodu: lZW56aldUaldUM0FyRG83ZW56Q3NRYnUyelge Takip Adres i: https: / /www.terkiye. go v. tr/s aglik-tit ek-ebys
11
bildirilmiştir. 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:KLAVUNAT'ın her iki bileşeni, hem amoksisilin hem de klavulanik asit, fizyolojik pH'da sulu çözeltilerde tamamen ayrışırlar. İki bileşen de oral uygulama sonrası hızla ve iyi absorbeolur. Oral uygulamayı takiben amoksisilin ve klavulanik asit yaklaşık %70 oranında serumdaserbest halde bulunur. Her iki bileşenin plazma profilleri benzer olmakla birlikte, pik plazmakonsantrasyonlarına ulaşma süresi (Tmaks) her durumda yaklaşık bir saattir. Aşağıda, pediatrik hastalara her 12 saatte bir 45 mg/3.2 mg/kg olarak uygulanan KLAVUNAT ES için farmakokinetik parametreler yer almaktadır.
Amoksisilin/klavulanik asit ile elde edilen amoksisilin ve klavulanik asit serum konsantrasyonları, amoksisilin ve klavulanik asitin tek başlarına oral yolla verilişi ile eldeedilen konsantrasyonlarla benzerlik göstermektedir. Dağılım:Toplam plazma klavulanik asitinin %25 ve toplam plazma amoksisilinin %18 kadarı proteine bağlanır. Görünürdeki dağılım hacmi amoksisilinde 0.3-0.4 l/kg ve klavulanik asitte 0.2 l/kgdolayındadır. İntravenöz uygulamadan sonra safra kesesinde, abdominal dokularda, deri, yağ, kas dokularında, sinoviyal ve peritoneal sıvılarda, safra ve iltihapta hem amoksisilin hem deklavulanik asit bulunmuştur. Amoksisilinin beyin omurilik sıvısına dağılımı yeterli değildir. Hayvan çalışmalarında, bileşenlerden herhangi biri için ilaçtan kaynaklanan materyallerle önemli doku tutulumuna ilişkin kanıt yoktur. Penisilinlerin çoğu gibi amoksisilin de annesütünde saptanabilir. Anne sütünde eser miktarda klavulanik asit de saptanabilmektedir (bkz. Bölüm 4.6). Bu belge Belge Do 12 Hem amoksisilin hem de klavulanik asitin plasenta bariyerini geçtiği gösterilmiştir (bkz. Bölüm 4.6). Biyotransformasyon:Amoksisilin kısmen idrarla, başlangıç dozunun yaklaşık %10-25'i oranında inaktif penisiloik asit şeklinde atılır. Klavulanik asit insanda büyük oranda metabolize olur, idrar ve feçesiçinde ve karbondioksit şeklinde hava ile atılır. Eliminasyon:Amoksisilinin başlıca eliminasyon yolu böbreklerdir, buna karşılık klavulanik asit hem renal hem de renal olmayan mekanizmalarla atılır. Amoksisilin/klavulanik asitin ortalama eliminasyon yarılanma ömrü yaklaşık bir saattir ve ortalama total klirens sağlıklı kişilerde yaklaşık 25 l/saattir. 250 mg/125 mg ya da 500 mg/125mg'lık tek bir KLAVUNAT tabletinin uygulanmasından sonraki ilk 6 saatte amoksisilininyaklaşık %60-70'i ve klavulanik asitin yaklaşık %40-65'i idrarla değişikliğe uğramadan atılır.Çeşitli çalışmalarda, 24 saatlik bir dönemde amoksisilinin idrarla atılım miktarının %50-85 veklavulanik asitin %27-60 arasında olduğu bulunmuştur. Klavulanik asitte, ilacın en büyükmiktarı uygulamadan sonraki ilk 2 saatte atılmaktadır. Eşzamanlı probenesid kullanılması, amoksisilin atılmasını geciktirmekle birlikte klavulanik asitin böbreklerden atılmasını geciktirmez (bkz. Bölüm 4.5). Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Böbrek işlevinin azalmasıyla doğru orantılı olarak amoksisilin/klavulanik asitin total serum klirensi de azalır. İlaç klirensindeki azalma, amoksisilinin daha büyük bir bölümünün böbrekyoluyla atılması nedeniyle, amoksisilinde klavulanik asitten daha belirgindir. Bu yüzden,böbrek yetmezliğinde dozlar, amoksisilinin fazla birikmesini önlerken, yeterli klavulanik asitdüzeylerinin sürdürülmesini sağlamalıdır (bkz. Bölüm 4.2). Karaciğer yetmezliği:Karaciğer yetmezliği bulunan hastalarda doz dikkatle belirlenmeli ve karaciğer işlevleri düzenli aralıklarla izlenmelidir. Yaş:Amoksisilinin eliminasyon yarılanma ömrü 3 aylıktan 2 yaşına kadar olan çoçuklarda ve daha büyük çocuklarda aynıdır. Yaşamın ilk haftasındaki çok küçük çocuklar için (preterm yenidoğanlar dahil) uygulama aralığı renal eliminasyon yolağının gelişmemiş olmasından dolayıgünde iki kez uygulamayı aşmamalıdır. Yaşlı hastalarda böbrek işlevlerinde azalma olasılığıdaha fazla olduğundan, doz seçiminde dikkatli olunmalıdır ve böbrek işlevinin izlenmesiyararlı olabilir.
13 Cinsiyet:Sağlıklı erkek ve kadınlara oral yoldan amoksisilin/klavulanik asit uygulanmasından sonra cinsiyetin amoksisilin ya da klavulanik asitin farmakokinetikleri üzerinde önemli bir etkisigörülmemiştir. Doğrusallık/Doğrusal olmayan durum:Amoksisilin, terapötik doz aralığında doğrusal farmakokinetiğe sahiptir. 5.3. Klinik öncesi güvenlilik verileriKlinik öncesi veriler, farmakoloji, genotoksisite ve üreme toksisitesi güvenliliğine yönelik çalışmalar temelinde insanlar açısından özel bir tehlike ortaya koymamıştır. Köpeklerde amoksisilin/klavulanik asitle yapılan tekrarlanan doz toksisitesi çalışmalarında, gastrik tahriş, kusma ve dilde renk bozukluğu görülmüştür. KLAVUNAT ES ya da bileşenleriyle karsinojenisite çalışmaları yapılmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiHidroksipropil metil selüloz Syloid Ksantan gum Sakkarin sodyumAerosil 200 Ahududu aroması TR 9570 6.2. GeçimsizliklerBilinen herhangi bir geçimsizliği bulunmamaktadır 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirlerOral süspansiyon tozu iyice kapatılmış ambalajı içinde, 25°C'nin altındaki oda sıcaklığında ve kuru bir yerde saklanmalıdır. Kullanıma hazırlanan süspansiyon buzdolabında (2-8°C)saklanmalı ve 7-10 gün içinde kullanılmalıdır. 6.5. Ambalajın niteliği ve içeriğiKLAVUNAT ES 600/42.9 mg Oral Süspansiyon Hazırlamak İçin Kuru Toz, kutuda, HDPE kapaklı amber renkli Tip III cam şişede (100 ve 150 mL), 1,25 mL ve 2,5 mL işaretli 5 mL'likölçü kaşığı ile birlikte bulunmaktadır.
14 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerTüm kullanılmayan ürün ve atık maddeler Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir. KLAVUNAT ES süspansiyonun hazırlanması:KLAVUNAT ES toz halindedir, bu yüzden ilk önce sulandırmak gerekir. KLAVUNAT ES'i sulandırmak için aşağıdaki talimatları takip ediniz: Tüm toz serbestçe akana kadar şişeye hafifçe vurunuz
1. KLAVUNAT ES 600/42.9 mg Oral Süspansiyonu hazırlamak için önceşişe üzerindeki işaretli çizginin yaklasik 2/3 'üne denk gelecek kadar suekleyiniz ve tozu süspansiyon haline getirmek için şişeyi iyice çalkalayınız(Süspansiyon hazırlamak için önceden kaynatılmış ve soğutulmuş su tercihedilmelidir). 2. İlk sulandırışta tam bir dağılma sağlamak için 5 dakika dinlendiriniz. 3. Kalan suyu (1/3) şişe üzerindeki işaretli çizgiye kadar doldurunuz ve çalkalayınız (100 mL süspansiyon için toplam 90 mL, 150 mL süspansiyon için toplam135 mL su ilave edilmelidir).Süspansiyon hazırlamak için önceden kaynatılmış ve soğutulmuş su tercih edilmelidir. 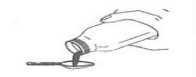 4. Süspansiyon 5 mL'lik ölçü kaşığı ile uygulanabilir. Her dozdan önce şişeyi iyice çalkalayınız. Kullanım sonrası şişeyi hemen ve sıkıca kapatınız. KLAVUNAT ES 600/42.9 mg oral süspansiyon'un rengi, kullanımı sırasında hafifçe sararma gösterebilir. Bu durumun ilacın etkililiği üzerinde herhangi bir etkisi yoktur. Eğer KLAVUNAT'ı 2 yaşından küçük bir çocuğa verecekseniz, süspansiyonu vermeden hemen önce uygulanacak miktardaki süspansiyonu ayrı bir kaşık veya bardakta sukullanarak çalkalayıp seyreltebilirsiniz. Seyreltilmiş olan bu süspansiyonu saklamayınız. 7. RUHSAT SAHİBİATABAY KİMYA SAN. ve TİC. A.Ş. Acıbadem Köftüncü Sokak No: 1 34718 Kadıköy / İSTANBULTel : 0216 339 69 03Faks : 0216 340 13 77e-posta : [email protected] 8. RUHSAT NUMARASI2014/655 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk Ruhsat Tarihi: 05.09.2014
Belge Do
Bu belgeBelge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys 15 10. KÜB'ÜN YENİLEME TARİHİ
16 |
İlaç BilgileriKlavunat Es 600 Mg / 42,9mg Oral Süspansiyon Hazırlamak İçin Kuru TozEtken Maddesi: Amoksisilin Trihidrat + Potasyum Klavulanat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.