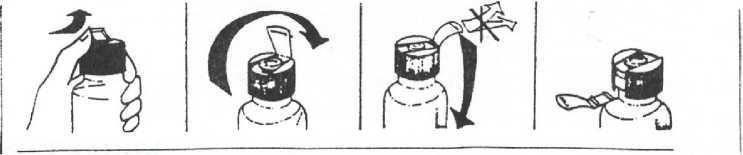
Ferplex Fol 40 Mg+0,185 Mg/15 Ml Oral Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIFERPLEX FOL 40 mg + 0.185 mg/15 ml oral çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir 15 mL'lik flakon etken madde olarak 40 mg Fe3+ (üç değerlikli demir)'e eşdeğer miktarda 800 mg demir proteinsüksinilat ve rezervuarlı kapak içerisinde, bastırmakla çözelti içerisine giren(0.185 mg folinik asit'e eşdeğer) 0,2 mg kalsiyum folinat pentahidrat içerir. Yardımcı maddeler:1,4 mg 0,045 g0,015 g Sorbitol E420 Sodyum metil hidroksibenzoat Sodyum propil hidroksibenzoat Yardımcı maddeler için Bölüm 6.1.'e bakınız. 3. FARMASÖTİK FORMOral çözeltipH'ı 6,5 ila 8,5 olan berrak, kahverengi çözelti. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarDemir ve folik asit eksikliğinin tedavisi veya önlenmesi. 4.2. Pozoloji ve uygulama şekliPozoloji/ uygulama sıklığı ve süresi:FERPLEX FOL, yetişkinlerde günde 15 - 30 ml (40-80 mg demire eşdeğer) (1-2 flakon) iki eşit doza bölünmüş olarak ve tercihen yemeklerden önce alınır. Çocuklarda hekimin önerisine göre tercihen yemeklerden önce günde 1,5 mL/kg şeklindeki dozaj 2 veya 3'e bölünerek uygulanır. Tedavi süresi: Vücut demir depoları normal düzeye gelinceye kadar (genellikle 2-3 ay) tedaviye devam edilmelidir. Uygulama şekli:FERPLEX FOL, oral yoldan uygulanmalıdır. Flakon üzerindeki koruyucu kapak kuvvetlice ileriye itilip kaldırıldıktan sonra kapağın tam ortasındaki hazneli kısım kuvvetlice aşağıya bastırılır ve flakon iyice çalkalanır. Daha sonra kapakaçılıp su ile ya da direkt olarak flakondan içilir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:FERPLEX FOL, ciddi karaciğer ve böbrek yetmezliğinde kullanılmamalıdır. Pediyatrik popülasyonBaşka bir şeklide önerilmediği takdirde 1,5 ml/kg/gün (4 mg/kg/gün Fe3+ ve 0,0235 mg kalsiyum folinata eşdeğer) günden iki veya üç seferde verilebilir. Geriyatrik popülasyonYaşlılardaki uygulama aynen yetişkinlerdeki gibidir. 4.3. KontrendikasyonlarDemire, kalsiyum folinata veya FERPLEX'in içeriğindeki Bölüm 6.1'de yer alan maddelerden herhangi birine karşı aşırı duyarlılıkta, hemokromatoziste, hemosiderozisde, aplastik anemi,hemolitik anemi veya demir kullanımında bozukluktan kaynaklanan sideroakrestik (sideroblastik)anemide, hemokromatozise bağlı gelişen karaciğer sirozunda veya kronik pankreatittekontrendikedir. Eğer B12 vitamini ile beraber uygulanmıyorsa, vitamin B12 eksikliğine sekondergelişen pernisiyöz (megaloblastik) anemide kullanılmamalıdır. FERPLEX FOL içeriğinde 1,4 mg sorbitol bulunmaktadır. Nadir kalıtımsal fruktoz intolerans problemi olan hastaların bu ilacı kullanmaması gerekir. 4.4. Özel kullanım uyarıları ve önlemleriDemir eksikliği veya demir eksikliği anemisinin temelinde yer alabilecek hastalıklar tespit edilmeli ve bu hastalıklar uygun şekilde tedavi edilmelidir. Tolerans veya bağımlılık riski açısından özel bir uyarı yoktur. Sürekli kanama, menoraji veya hamilelik durumları haricinde tedavi süresi 6 aydan uzun olmamalıdır. Çocuklarda demir içeren ürünlerin yanlışlıkla alınması ölümcül zehirlenmeye yol açabilir. Çocukların erişemeyeceği yerlerde saklayınız. FERPLEX FOL, süt proteini içermesinden dolayı, süt proteini intoleransı olan ve alerjik reaksiyonun gelişebileceği hastalarda dikkatle kullanılmalıdır. FERPLEX FOL sodyum metil hidroksibenzoat (E219) ve sodyum propil hidroksibenzoat (E217) içerdiğinden alerjik reaksiyonlara (muhtemelen gecikmiş) sebebiyet verebilir. 2/7 İçeriğinde bulunan sorbitol E420 nedeniyle, nadir kalıtımsal fruktoz intolerans problemi olan hastaların bu ilacı kullanmamaları gerekir. Aşağıdaki durumlarda kullanımı dikkatle değerlendirilmelidir:Alkolizm, hepatit, aktif infeksiyoz durumlar, enterit, kolit, divertikülit ve ülseratif kolit gibi intestinal sistemin enflamatuvar durumları, pankreatit ve peptik ülser. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriUzun süre üç değerli demirle birlikte alkol kullanımı, demirin absorbsiyonunu ve karaciğerde depolanmasını arttıracağından toksisiteye neden olabilir. Demir türevleri; tetrasiklinler,bisfosfonatlar, kinolon grubu antiinfektif ilaçlar, penisilamin, tiroksin, levadopa, karbidopa, alfa-metildopa gibi ilaçların emilimini veya biyoyararlanımını azaltabilir. Bu ilaçlar FERPLEX FOLuygulamasından en az 2 saat önce veya sonra uygulanmalıdır. Demir emilimi, 200 mg'ın üzerinde askorbik asitin eş zamanlı uygulaması ile artabilmekte veya antiasid kullanımı ile azalabilmektedir. Kloramfenikol demir tedavisine terapötik yanıtıgeciktirebilir. H2-reseptör antagonistleri ile FERPLEX FOL eş zamanlı kullanımı sırasında farmakolojik etkileşim rapor edilmemiştir. Sebzelerin içeriğindeki fosfat, fitat, oksalat gibi demir ile kompleks yapan ajanlar ve süt, kahve veya çay demir emilimini baskılar. Bu tür yiyecek ve içecekler FERPLEX FOL uygulamasından enaz 2 saat önce veya sonra uygulanmalıdır. Levotiroksin içeren ilaçların demir içeren diğer ilaçlarla birlikte alındığında emilimi bozulduğundan, iki ilacın en az 2 saat ara verilerek alınması gerekmektedir. Diyagnostik Test Sonuçları ile EtkileşimlerDemir, ortotoludin test sonuçları ile yalancı pozitif sonuçlar verir. Demir suplemanları ayrıca, Tc 99 m ile işaretli diyagnostik ajanların kemikte tutulumunun azalmasına yol açar. Dışkının renginisiyaha boyadığından, gaytada kan aranması için yapılan testler FERPLEX FOL kullanımı sırasındayapıldığında yanıltıcı olabilir. Bazı antineoplastik ve antilösemik ilaçlar (aminopterin, metotreksat ve diğer pterinik türevleri) folik asidin kompetitif antagonistleri olarak rol oynarlar. Bu nedenle folik asit veya folinik bazlı tümpreparatlar gibi FERPLEX FOL uygulanması da neoplastik hastalıklar veya lösemi gibi antifolinikilaçlarla tedavi gören hastalarda kullanılmamalıdır. FERPLEX FOL, benzer antagonistik etkilerdendolayı etkinliğin azalmasına yol açabileceğinden sülfamid ve trimetoprim gibi antibakteriyelaj anlarla aynı zamanda uygulanmaması gerekir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi A' dır. o Bu gebelik kategorisine rağmen hekim, gebenin ilacı kullanıp kullanmaması konusundaki nihai kararını; gebelik haftasına, gebenin var olan/tespit edilen hastalığına ve diğerözelliklerine göre ayrıntılı yarar-risk değerlendirmesi yaparak vermelidir. 3/7 o Risk kategorileri ilacın gebelikteki potansiyel riski konusunda sağlık personeline yardımcı olmakla birlikte, hekimin değerlendirmesi esastır. Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda kullanılmamasına ait herhangi bir bilgi bulunmamaktadır. Gebelik dönemiİyi yönetilmiş epidemiyolojik çalışmalar etkin maddenin gebelik üzerinde ya da fetusun/yeni doğan çocuğun sağlığı üzerinde advers etkileri olmadığını göstermektedir. FERPLEX FOL'ün gebelik döneminde kullanımında sakınca yoktur. Laktasyon dönemiFERPLEX FOL'ün emzirme döneminde kullanımında sakınca yoktur. Üreme yeteneği/ FertiliteFERPLEX FOL'ün üreme yeteneği üzerine herhangi bir etkisi bulunmamaktadır. 4.7. Araç ve makine kullanımı üzerindeki etkilerFERPLEX FOL'ün, araç ve makine kullanımı üzerine etkisi bildirilmemiştir. 4.8. İstenmeyen etkilerİlaca bağlı olduğu kabul edilen advers reaksiyonlar aşağıda listelenmiştir: Yaygınlık şu şekilde tanımlanır: çok yaygın (> 1/10); yaygın (> 1/100 ila < 1/10); yaygın olmayan (> 1/1.000 ila < 1/100); seyrek (> 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000), bilinmiyor(eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sistemi hastalıklarıBilinmiyor: Alerjik belirtiler Gastrointestinal hastalıklarSeyrek: Epigastrik ağrı, bulantı, konstipasyon, diyare Bu yan etkiler dozun azaltılması veya tedavinin sonlandırılmasıyla geçer. Demir preparatlarının oral kullanımı ile birlikte feçes genellikle siyah bir renk alır. Bunun sebebi absorbe olmayan demir olup zararsız bir durumdur. Ayrıca yüksek dozlarda demir sülfid oluşumunabağlı olarak idrar rengi koyulaşabilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonların raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlıkmesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi(TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected];tel:0 800314 00 08; faks: 0 312 218 35 99)4/7 4.9. Doz aşımı ve tedavisiAkut toksisite çalışmalarında demir proteinsüksinilatın çok iyi tolere edildiği gösterilmiştir; fare ve sıçanlarda oral uygulama sonrası LD50 değerleri 4000 mg/kg üzerindedir. Demirin yüksek dozda alınımını izleyen 6 - 8 saatlik sürede hastada epigastrik ağrı, bulantı, kusma, diyare ve hematemez görülebilir. Bu semptomlara solukluk, siyanoz, uyku hali, şok ve koma hali deeşlik edebilir. Ipeka şurubu ile emezis oluşturulur; hasta komatöz ise sodyum bikarbonatla lavaj yapılır. Sıvı ve elektrolit dengesi sağlanmalıdır ve asidoz için i.v. sodyum bikarbonat uygulanır. Antidotudeferoksamindir, şiddetli vakalarda yavaş i.v. enjeksiyon şeklinde uygulanır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Folik asit ile kombine ferrik demir içeren oral antianemik ilaç. ATC kodu: B03AD Demir, hemoglobin oluşumunda rol alan, etkin bir eritropoez ve kanın oksijen taşıma kapasitesi için yeterli miktarda alınması gereken esansiyel bir elementtir. Ayrıca, miyoglobin üretiminde de benzerbir fonksiyona sahip olan demir, birçok esansiyel enzim için de bir kofaktördür. Demir proteinsüksinilat, Fe+3 iyonlarının proteik bir taşıyıcı olan kazeine bağlı olduğu, yarı sentetik bir bileşiktir. Asit ortamda çözünmediğinden demir iyonlarının midede serbest hale geçmesi sözkonusu değildir. Bu özelliği ile diğer demir preparatlarından farklı olarak gastrik tolerans önemliölçüde artmış olup, mukoza irritasyonuna bağlı olarak ortaya çıkabilecek bulantı, mide yanması gibiyan etkilerin görülme insidansı son derece düşüktür. Demir proteinsüksinilatın çözünürlüğü pH'ın6,5'in üzerine çıkması ve duodenumdaki pankreatik enzimlerin proteik kompleksi parçalaması ileoluşur ve serbest hale geçen demir absorbe olur. Folinik asit (Leucovorin, citrovorum faktörü), biyolojik olarak aktif formunu temsil ettiği folik asidin formil türevidir. Böylece folinik asidin doğrudan uygulanması, folik asidi dönüştüren veaktive eden hepatik ve medüller enzimlerde eksiklik olsa bile bazı metabolik aşamaların atlanmasınıve vitamin eksikliklerinin düzeltilmesini sağlar. Folinik asit pürin ve pirimidin sentezinde önemlirol oynar ve özellikle hematopoietik dokuda DNA sentezi için esansiyeldir. Folinik asit, folateksikliğinden kaynaklanan tüm anemi formlarında aktiftir. Yapılan deneyler, FERPLEX FOL'unetkili bir antianemik aktiviteye sahip olduğunu göstermektedir. 5.2. Farmakokinetik özelliklerGenel özelliklerDemir:Emilim:Demir proteinsüksinilatın protein kısmı gastrointestinal sıvılarla sindirilince demir serbestleşerek emilir. Demir proteinsüksinilat, başlıca duodenumdan absorbe olur. Demir eksikliği olmayanbireylerde alınan demirin %3 ila 10'u absorbe olurken, demir eksikliğinde bu oran, eksiklikleorantılı olarak, %20 - 30'lara erişir. 5/7 Gıdalarla birlikte alındığında absorbsiyonu, boş midedekine kıyasla 1/2 ila 1/3 oranında azalır. Dağılım:Hemoglobin'e bağlanma oranı yüksektir. Eliminasyon:Demirin itrahı için herhangi bir fizyolojik sistem bulunmamakla birlikte deri, saç ve tırnaklardan; feçes, ter, anne sütü (0,5 - 1 mg/gün), menstrüel kan ve idrarla, düşük miktarlarda bir kayıp sözkonusudur. Ortalama günlük kayıp, erkekler ve postmenopozal kadınlarda 1 mg.; premenopozalkadınlarda ise 1,5 mg'dır. Folik Asit:Emilim:Serbest folik asit ince barsağın tümü boyunca absorbe edilir. Bununla beraber mideden sonraki ilk 1/3 bölümünde absorpsiyon diğer bölümlerde olduğundan daha hızlıdır. Demir proteinsüksinilat'ın fare ve ratlara oral uygulanması sonucu LD50> 4000 mg/kg olarak bulunmuştur. İntraperitoneal yolla uygulama sonucu farelerde LD50= 707 mg/kg, ratlarda 708 mg/kg olarak tespit edilmiştir. Eliminasyon:Atılım karaciğerden ve böbreklerden olur. Safra içinde barsağa gelen folik asidin bir kısmı reabsorbsiyona uğrar. 5.3. Klinik öncesi güvenlilik verileriAkut Toksisite:50 mL/kg FERPLEX FOL (2000 mL/kg demir proteinsüksinilat ve 1000 mcg/kg kalsiyum folinat) verilen ratlarda dispne, depresyon, hareketsizliğe yatkınlık belirtileri gözlenmiş ve bu belirtilerinilacın bırakılmasından 120 dakika sonra kaybolduğu bildirilmiştir. Ratlarda LD50'nin 50 mL/kg (2000 mL/kg demir proteinsüksinilat ve 1000 mcg/kg kalsiyum folinat)'ın üzerinde olduğu gözlenmiştir. Kronik Toksisite:Kronik toksisite çalışmaları 3 grup rat üzerinde yürütülmüştür. 1. grup: 2,5 mL/kg 100 mg demir proteinsüksinilat ve 50 mcg/kg kalsiyum folinata eşdeğer) 2. grup: 1,25 mL/kg (50 mg demir proteinsüksinilat ve 50 mcg/kg kalsiyum folinata eşdeğer) 3. grup: Kontrol İlaç verilen grup ile kontrol grubu arasında vücut ağırlığı ve genel durum açısından bir farklılık gözlenmemiştir. Ayrıca nekropside ve laboratuvar çalışmalarında her iki grup arasında bir farklılıkbulunmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSorbitol E420 6/7 Saf su 6.2 GeçimsizliklerKuvvetli asitler ve alkalilerle veya indirgeyici bileşiklerle fiziksel ve kimyasal geçimsizlik görülebilir. Demir, gaytada gizli kan testini bozabilir. 6.3. Raf ömrü24 ay 6.4 Saklamaya yönelik özel tedbirler300C altındaki oda sıcaklığında saklayınız. 6.5 Ambalajın niteliği ve içeriği10 x 15 ml flakonlarda sunulur. 6.6 Tıbbi üründen arta kalan maddelerin imhası ve dier özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıkları Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİITALFARMACO S.p.A. İtalya lisansı ile, Abdi İbrahim İlaç San. ve Tic. A.Ş. Reşitpaşa mahallesi, Eski Büyükdere Cad. No:4 34467 Maslak /Sarıyer/ İstanbulTel: 0212 366 84 00Faks: 0212 276 20 20 8. RUHSAT NUMARASI203/40 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 12.11.2003 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ:7/7 |
İlaç BilgileriFerplex Fol 40 Mg+0,185 Mg/15 Ml Oral ÇözeltiEtken Maddesi: Demir Proteinsüksinilat,kalsiyum Folinat Pentahidrat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.