Lucrin Depot 3 Ay Im/sc 11,25 Mg Kullanıma Hazır Toz ve Çözücü İçeren Çift Bölmeli Enjektör Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADILUCRİN DEPOT 3 AY IM/SC 11,25 mg kullanıma hazır toz ve çözücü içeren çift bölmeli enjektör Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİM:Etkin Madde:Löprolid asetat 11,25 mg (her bir kullanıma hazır enjektörde) Yardımcı maddeler:Sodyum karboksimetilselüloz 5 mg Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyon için liyofilize mikroküre toz içeren enjektör Önceden doldurulmuş iki bölümlü bir enjektör içinde, seyreltici ile süspansiyon haline getirilmek üzere üretilmiş enjeksiyonluk liyofilize mikroküre tozdur. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarLUCRİN DEPOT, Prostat Kanseri:LUCRIN DEPOT, testosteron üretiminin kastrasyon düzeyinde baskılanmasının istendiği, lokal ileri evre veya metastatik prostat kanserinin tedavisinde endikedir. Endometriyozis:LUCRİN DEPOT, hafif-şiddetli endometriyozis tedavisinde endikedir. Tedavi süresi 6 ay ile sınırlandırılmalıdır. Uterus Miyomu:LUCRİN DEPOT, uterus miyomu tedavisinde yalnız pre-operatif dönemde endikedir. Tedavi süresi 6 ay ile sınırlandırılmalıdır. Meme Kanseri:LUCRİN DEPOT, östrojen ve/veya progesteron reseptör pozitif premenopozal ve perimenopozal meme kanserli olguların hormonal tedavisinde (adjuvant veyametastatik olgular) over kaynaklı östrojen sekresyonunu önlemek amacıyla endikedir. Santral Puberte Prekoks (gerçek erken puberte)LUCRİN DEPOT santral puberte prekoks (gerçek erken puberte - CPP) olan çocukların (9 yaşın altındaki kızlar, 10 yaşın altındaki erkekler) tedavisinde endikedir. 1/26 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi Uygulama şekli:Bu ilaçlar sadece kullanma tecrübesi olan bir doktor veya hemşire tarafından hazırlanmalı ve verilmelidir. Tavsiye edilen doz, her 3 ayda bir kez intramüsküler veya subkütan olarak uygulanan 11,25 mg'dır. Enjeksiyon bölgesi, hastaya göre değişebilir. Endometriyozis ve pre-operatif dönemde Uterus miyomu tedavisi endikasyonları için tedavi süresi 6 ay ile sınırlandırılmalıdır. Prostat kanseri için GnRH analogları ile tedavi edilen hastalarda kastrasyona dirençli prostat kanseri gelişiminde tedavi genellikle devam eder. Pediyatrik Popülasyon:LUCRİN DEPOT ile tedavi edilen çocuklar, pediyatrik endokrinolog hekim gözetimi altında olmalıdır. Doz şeması, bireysel olarak belirlenmelidir. Önerilen başlangıç dozu, vücut ağırlığına bağlıdır. Vücut ağırlığı 20 kg ve 20 kg'dan fazla olan çocuklar130 mg sürekli-salımlı mikrokapsül içeren 1 ml (11,25 mg löprolid asetat) süspansiyon, tek bir subkütan enjeksiyon olarak her 3 ayda bir kez uygulanır. Vücut ağırlığı 20 kg'dan az olan çocuklarBu gibi nadir vakalarda aşağıda yer alan dozaj, santral puberte prekoksun klinik etkinliğine göre uygulanmalıdır: 0,5 ml (5,625 mg löprolid asetat) her 3 ayda bir kez tek bir subkütan enjeksiyon olarak uygulanır. Süspansiyonun geri kalan kısmı atılmalıdır. Çocuğunuzun kilo alımı izlenmelidir. Santral puberte prekoksun etkinliğine bağlı olarak yetersiz baskılama durumunda dozajın arttırılması gerekebilir (Örneğin klinik bulgularda, LHRH testinde yetersiz gonadotropinsupresyonu ya da lekelenme). Daha sonra uygulanacak olan etkili en düşük 3 aylık doz LHRHtestine göre belirlenmelidir. LUCRİN DEPOT, intramüsküler olarak önerilen dozlardan daha yüksek bir dozda verildiğinde enjeksiyon yerinde steril abseler sıklıkla görülür. Bu sebeple, bu gibi durumda LUCRİNDEPOT subkütan yoldan uygulanmalıdır (bkz. Bölüm 4.4). İntramusküler/subkütan enjeksiyon ile ilgili rahatsızlığı azaltmak için çocuklarda enjeksiyonluk ilaçlar için mümkün olan en düşük hacimlerin kullanılması önerilir. Tedavinin süresi, tedavinin başlangıcı ya da tedavi süresince ortaya çıkan klinik parametrelere (nihai boy prognozu, büyüme hızı, kemik yaşı ve/veya kemik yaşı ivmesi) bağlıdır ve uygunolması halinde tedavi edilen çocuğun yasal vasisi ile doktoru tarafından karar verilir. Tedavisırasında, 6-12 ay boyunca kemik yaşı aralıklarla izlenmelidir. 2/26 Klinik parametreleri dikkate alınarak, 12 yaşından büyük kızlarda ve 13 yaşından büyük erkeklerde meydana gelen kemik olgunlaşmasına göre tedavinin kesilmesi düşünülmelidir. Tedaviye başlamadan önce kızlarda gebelik olasılığı dışlanmalıdır. Tedavi sırasında gebelik oluşumu genellikle dışlanamaz. Bu gibi durumlarda, tıbbi tavsiye alınmalıdır. Not:Erken ergenlik belirtilerinin tekrarını önlemek için uygulama aralığı 90 ± 2 gün olmalıdır. Uygulama şekli:Tavsiye edilen doz, her 3 ayda bir kez intramüsküler veya subkütan olarak uygulanan 11,25 mg'dır. Enjeksiyon bölgesi, hastaya göre değişebilir. Özel popülasyonlara ilişkin ek bilgilerBöbrek/Karaciğer yetmezliğiBöbrek ve karaciğer yetmezliğinde kullanımı için herhangi bir veri yoktur. Geriyatrik popülasyonYaşlı hastalarda kullanımına dair herhangi bir veri yoktur. 4.3 KontrendikasyonlarLUCRİN DEPOT aşağıdaki durumlarda kontrendikedir: Etkin madde löprolid asetata veya benzer nonapeptidlere ya da bölüm 6.1'de listelenenyardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda; LUCRİN DEPOT hormon-duyarsız tümörü olan hastaların tedavisinde veya orşiektomisonrası kullanımda; Gebelikte veya gebe olma ihtimali olan kadınlarda; Emziren kadınlarda, Santral puberte prekoksu olan kızlarda: Gebelik ve laktasyon halinde Kesin tanısı konmamış vajinal kanamalarda 4.4 Özel kullanım uyarıları ve önlemleriLUCRİN DEPOT tedavisi uzman bir doktor gözetimi altında uygulanmalıdır. Löprolid asetat gibi GnRH agonistleri ile tedavi edilen hastalarda potansiyel şiddetli depresyon riski artmaktadır. Hastalar bu doğrultuda bilgilendirilmeli ve semptomların oluşmasıdurumunda uygun şekilde tedavi edilmelidir. KonvülsiyonlarPazarlama sonrası dönemde, LUCRİN DEPOT ile tedavi edilen geçmişinde predispozan faktörü olan veya olmayan hastalarda konvülsiyon olguları bildirilmiştir. Konvülsiyonlarınmevcut klinik uygulamaya göre tedavi edilmesi gerekir. 3/26 İdiyopatik intrakraniyal hipertansiyonLöprolid kullanan hastalarda idiyopatik intrakraniyal hipertansiyon (psödotümör serebri) bildirilmiştir. Hastalar şiddetli veya rekürren baş ağrısı, görme bozuklukları ve kulakçınlamasını da içeren idiyopatik intrakraniyal hipertansiyon belirti ve semptomları açısındanuyarılmalıdır. İdiyopatik intrakraniyal hipertansiyon ortaya çıkarsa, löprolidin bırakılmasıdüşünülmelidir. KadınlardaLUCRİN DEPOT ile tedavi, özel gözetim altında yürütülmelidir. Löprolid asetat tedavisine başlamadan önce, hastanın gebe olup olmadığı kontrol edilmelidir. Şüphe halinde gebelik testi yapılmalıdır. LUCRİN DEPOT ile tedaviye başlamadan önce oralkontraseptiflerin ve diğer hormon-bazlı kontraseptiflerin kullanımı durdurulmalıdır. Tedaviboyunca korunma için alternatif kontraseptif (hormon-bazlı olmayan) metotlar kullanılmalıdır.Hastanın gebe olduğu anlaşılır anlaşılmaz tedavi sonlandırılmalıdır. Tedavinin erken dönemlerinde, seks hormonlarındaki geçici artışa bağlı olarak şikayetler ve semptomlarda artış olabilir. Bunlar tedaviye devam edildiğinde kesilecektir. Menopoz esnasında doğal olarak kemik mineral yoğunluğunda (KMY) kayıp olması beklenir. Benzer şekilde, tıbbi olarak tetiklenmiş hipo-östrojenik durumu olan vakalarda da bu durumgörülebilir. LHRH agonistlerinin kullanımının 6 aylık tedavi süresi boyunca KMY'de aydaortalama %1 azalmaya neden olması muhtemeldir. Her %10 kemik mineral yoğunluğu kaybıile kırık riski 2-3 kat artar. KMY kaybının altı aylık tedavi süresinden sonra geri dönüşümlüolduğu gösterilmiştir. Klinik çalışmalar, löprolid monoterapisi ile 6 aylık tedaviden sonra %3,2ve 12 aylık tedaviden sonra %6,3'lük bir KMY kaybı göstermiştir. Endometriyozis tedavisi için löprolid asetat alan hastalarda, hormon yerine koyma tedavisinin eklenmesinin kemik mineral dansite kaybını ve vasomotor semptomları azalttığı gösterilmiştir(ayrıca bkz. bölüm 4.8). LUCRİN DEPOT ile tedaviye başlamadan önce anormal vajinalkanamanın sebebi tespit edilmelidir. Erkeklerde Prostat Kanseri:Prostat kanseri olan hastaların tedavisi, hormon tedavisinde tecrübeli olan bir hekim tarafından yakından takip edilmelidir. İlk haftalarda, şikayetler artabilir ve serum testosterondüzeylerindeki başlangıç artışının bir sonucu olarak semptomlar kötüleşebilir. Semptomatikolarak tedavi edilebilen az sayıdaki hastada, kemik ağrısında geçici bir artış yaşanabilir. DiğerLH-RH agonistlerinde olduğu gibi, ölümcül komplikasyonlara ve/veya felçe neden olabilecekizole edilmiş vakalarda üreter obstrüksiyon ve spinal kord kompresyonu gözlemlenmiştir. Metastazdan kaynaklanan idrar yolu tıkanıklığı olan hastalar ilk haftalarda yakından takip edilmelidir. Bu hastalarda, orşiektomi ve östrojen ile tedavi daha güvenlidir. Metastatikvertebral lezyon hastaları, LUCRİN DEPOT ile tedavi başlangıcında yakından izlenmelidir(bkz. Bölüm 4.8). Bu fazda, klinik tabloya göre bir anti-androjen ile geçici olarak kombinetedavi verilmesi düşünülebilir. LUCRİN DEPOT 3 AY 11,25 mg ile tedavi edilen hastalarda bariz bir risk varsa iki haftalık bir süre için LUCRİN DEPOT 3 AY 11,25 mg yerine LUCRİN DEPOT'un günlük dozajı iletedaviye başlanması düşünülebilir. Günlük tek doz iyi tolere edilirse LUCRİN DEPOT'adönülebilir. 4/26 Löprolid asetatın kemik lezyonları üzerine etkisi kemik taramaları ile incelenebilir. GnRH (gonadotropin salıverici hormonu) agonistleri alan erkeklerde hiperglisemi ve yüksek diyabet gelişimi riskinde artış bildirilmiştir. Hiperglisemi, diabetes mellitus gelişimine ya dadiyabetli hastalarda glisemik kontrolün kötüleşmesine işaret edebilir. GnRH agonistleri alanhastalarda kan şekeri ve/veya (HbA1c) seviyeleri periyodik olarak izlenmeli ve duruma görehiperglisemi ya da diyabet tedavisi için standart uygulamalar takip edilmelidir. Erkeklerde GnRH agonistlerinin kullanımıyla bağlantılı olarak miyokard infarktüs gelişmesi, ani kardiyak ölüm ve inme risklerinde artış bildirilmiştir. Söz konusu risk, bildirilen olasılıkoranları göz önüne alındığında düşük görünmektedir ve prostat kanseri hastalarında tedaviyöntemine karar verirken kardiyovasküler risk faktörleri ile birlike bu risk dikkatledeğerlendirilmelidir. GnRH agonistleri alan hastalar, kardiyovasküler hastalık gelişiminidüşündüren semptom ve işaretler için izlenmeli ve güncel klinik uygulamalar doğrultusundakontrol altına alınmalıdır. Androjen deprivasyon tedavisi QT aralığını uzatabilir. Doktorlar, QT uzaması risk faktörleri ile ilgili öyküsü olan hastalarda veya QT aralığını uzatabilen eşzamanlı tıbbi ürünler alan hastalarda LUCRİN DEPOT tedavisine başlamadanönce, Torsade de pointes potansiyeli dahil olmak üzere yarar/risk oranını değerlendirmelidir(bkz. Bölüm 4.5). Laboratuvar Testleri:Löprolid asetata yanıt, testosteron, ve aynı zamanda prostata spesifik antijen serum düzeyleri ve asit fosfatazın serum düzeyleri ölçülerek izlenmelidir. Testosteron düzeyleri başlangıçdozunun etkisiyle yükselir ve sonra iki haftalık süre içinde kademeli olarak düşer. Kastrasyonsonrası (0,25 ng/ml) eşdeğer seviyelere iki ila dört hafta sonra erişilir ve daha sonra LUCRİNDEPOT ile tüm tedavi süresi boyunca korunur. Tedavinin erken dönemlerinde asit fosfataz düzeylerinde geçici bir artış gözlenmiştir. Bu yükselmiş değerler genellikle tedavinin iki ila dördüncü haftasında %25'den fazla azalır. Pediyatrik popülasyon:Tedaviye başlamadan önce idiyopatik ve/veya nörojenik santral puberte prekoksun kesin tanısının konması gereklidir. Psödo puberte prekoks (gonadal veya adrenal tümör veyahiperplazi) ve gonadotropin bağımsız puberte prekoks (testis toksikozu, ailevi Leydig hücrehipoplazisi) ihtimali ortadan kaldırılmalıdır. Tedavi uzun süreli olup bireysel olarak ayarlanır. LUCRİN DEPOT düzenli aylık periyotlarla mümkün olduğunca hassas bir şekilde uygulanmalıdır Enjeksiyon tarihinin bir kaç günlük (90± 2 gün) istisnai gecikmesi tedavi sonucunu etkilemez. Enjeksiyon bölgesinde steril apsenin görülmesi durumunda (çoğunlukla tavsiye edilenden daha yüksek dozlarda, İM enjeksiyondan sonra rapor edilmiştir) löprolid asetat depotunabsorpsiyonu azalabilir. Bu durumda hormon parametreleri (testosteron, estradiol) 2 haftalıkaralıklarla izlenmelidir (bkz. Bölüm 4.2). Progresif beyin tümörü olan çocukların tedavisinde dikkatle bireysel yarar-zarar değerlendirmesi yapılmalıdır. 5/26 Kızlarda hormonun kesilme belirtisi olarak ilk enjeksiyondan sonra vajinal kanama, lekelenme ve akıntı görülebilir. Tedavinin ilk/ikinci ayından sonraki vajinal kanamanın incelenmesigerekir. Santral puberte prekoksun GnRH tedavisi esnasında kemik mineral yoğunluğu (KMY) azalabilir. Ancak tedavinin kesilmesini takiben kemik kütlesi büyümesi korunur ve geçergenlerde pik kemik kütlesi tedaviden etkilenmediği gözükmektedir. GnRH tedavisinin kesilmesi ile femur başı epifiz kayması görülebilir. Öngörülen varsayım GnRH agonistleri ile tedavi esnasındaki düşük östrojen konsantrasyonlarının epifiz plağınızayıflattığıdır. Tedavinin durdurulmasından sonra büyüme hızı artışı epifizin yer değiştirmesiiçin kesme kuvvetinin azalması ile sonuçlanır. Doz rejimine uyulmaması veya yetersiz dozlama pubertal sürecin yetersiz kontrolü ile sonuçlanabilir. Yetersiz kontrol sonuçları, menstrüasyon, meme büyümesi veya testislerdebüyüme gibi puberte semptomlarının nüksetmesidir. Terapötik doz belirlendikten sonragonadotropin ve seks steroid düzeyleri prepubertal seviyelere düşecektir. Gonadlar tarafından steroid sekresyonunun yetersiz kontrolünün uzun süreli etkileri bilinmemektedir. Erişkin boyunda daha fazla uzlaşma mümkün olabilir. Sodyum Uyarısı: LUCRİN DEPOT her dozunda 23 mg'dan daha az sodyum ihtiva eder, yani aslında sodyum içermez. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriAndrojen yetersizliği tedavisi QT aralığını uzatabileceği için, LUCRİN DEPOT'un QT aralığı uzamasına sebep olduğu bilinen tıbbi ürünlerle veya Sınıf IA (örn. kinidin, disopiramid) ya daSınıf III (örn. amiodaron, sotalol, dofetilid, ibutilid) antiaritmikler, metadon, moksifloksasin,antipsikotikler vb. gibi Torsade de Pointes'i indükleyebilen tıbbi ürünlerle birlikte kullanılmasıhalinde dikkatli bir değerlendirme yapılmalıdır (bkz. Bölüm 4.4). Seks hormonları löprolid asetatın etkisini inhibe ederler. Bu nedenle, bu ilaçlar aynı anda kullanılmamalıdır. Çocuklarda, büyüme hormonu ile etkileşim meydana gelebilir. Bu da overlerin gelişimini etkileyebilir. Eğer birlikte kullanılacaksa, hasta bu bakımdan yakından takip edilmelidir. Özel popülasyonlara ilişkin ek bilgilerPediyatrik popülasyon :Çocuklarda, büyüme hormonu ile etkileşim meydana gelebilir. Bu da overlerin gelişimini etkileyebilir. Eğer birlikte kullanılacaksa, hasta bu bakımdan yakından takip edilmelidir. Böbrek/Karaciğer yetmezliğiBöbrek ve karaciğer yetmezliğinde kullanımı için herhangi bir veri yoktur. Geriyatrik PopülasyonYaşlı hastalarda kullanımına dair herhangi bir veri yoktur. 6/26 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: X Çocuk doğurma potansiyeli bulunan kadınlar /Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli olan kadınlar tedavi süresince etkili doğum kontrolü uygulamak zorundadırlar. Eğer gebeliği önleyici bir yöntem gerekli görülüyorsa hormonal olmayan birkorunma yöntemi kullanılmalıdır. Gebelik dönemiLUCRİN DEPOT'un gebelik döneminde kullanımı kontrendikedir. Gebe kadınlarda löprolid asetatın kullanımının zararlarının değerlendirilmesi için yeterli veri yoktur. Mevcut az sayıdakideneyim gebelik esnasında löprolid asetat kullanımı ile konjenital malformasyonlarda riskartışını düşündürmez. Ancak hayvan çalışmaları farmakodinamik aktivitenin bir sonucu olaraküreme toksisitesi göstermiştir (bkz. Bölüm 5.3). İnsanlardaki potansiyel risk bilinmemektedir.Bu yüzden LUCRİN DEPOT ile tedaviye başlamadan önce gebelik ihtimali elimineedilmelidir. Laktasyon dönemiLUCRİN DEPOT'un laktasyon döneminde kullanımı kontrendikedir. Löprolid asetatın anne sütüne geçip geçmediği bilinmemektedir. LUCRİN DEPOT tedavisine başlamadan önceemzirme sonlandırılmalıdır ve LUCRİN DEPOT tedavisi sırasında emzirilmemelidir. Üreme yeteneği/FertilitePitiüter-gonadal eksen üzerine löprolid asetatın farmakolojik etkileri dikkate alındığında ve depo formülasyon ile elde edilen hayvan bulguları esas alındığında LUCRİN DEPOT'un erkekve kadın fertilitesi üzerine olumsuz etkileri olabilir (bkz. Bölüm 5.1). Kadınlarda löprolid asetatve benzer analogları ile yapılan klinik ve farmakolojik çalışmalarda, 24 haftaya kadar sürekliuygulandıktan sonra ilacın kesilmesiyle fertilite süpresyonunun tümüyle geri döndüğügösterilmiştir. İnsanlarda löprolid asetat ile tedaviyi takiben erkek fertilitesine etkileri üzerineveri yoktur. 4.7 Araç ve makine kullanımı üzerindeki etkilerLUCRİN DEPOT'un tepki verme yeteneğini olumsuz etkilediğine dair herhangi belirti bulunmamaktadır. 4.8 İstenmeyen etkilerLöprolid asetata uzun süreli maruziyet (6-12 ay) osteoporoza yol açabilir (ayrıca bkz. bölüm 4.4). Erkeklerde: Daha önce hormon tedavisi almamış olan erkeklerde, tedavinin ilk haftasında genellikle başlangıç seviyesinin üzerinde testosteron düzeyleri oluşur. İkinci haftanın sonunda tedavininbaşlangıcında var olan seviyeye veya daha alt düzeylere düşer. Bununla birlikte, tedavinin ilkhaftalarında prostat kanseri semptomlarının geçici olarak şiddetlenmesi riski vertebralmetastazı ve/veya obstrüktif üropatisi veya hematürisi olan hastalarda endişe nedenidir.Alevlenme geçici zayıflık ve/veya bacaklarda parestezi ya da üriner semptomlarda kötüleşmegibi nörolojik problemlere sebep olabilir (bkz. Bölüm 4.4). 7/26 Tedavinin ilk haftaları boyunca kadınlarda estradiol seviyelerindeki geçici artıştan kaynaklanan şikayetler ve semptomlarda artış olabilir. Çocuklarda: Çocuklarda tedavinin ilk fazında, pre-pübertal aralık içindeki değerlere düşüşü takiben seks hormonu seviyesinde kısa süreli alevlenme şeklinde artış görülür. Farmakolojik etkiye bağlıolarak advers olaylar bilhassa tedavi başlangıcında görülebilir. İstenmeyen etkiler aşağıdaki sıklıklarla görülür: çok yaygın (> 1/10), yaygın (> 1/100 ila < 1/10), yaygın olmayan (> 1/1.000 ila <1/100), seyrek (> 1/10.000 ila < 1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) olarak tanımlanmaktadır. Aşağıdaki istenmeyen etkiler klinik çalışmalar esnasında gözlenmiştir ya da bu veya diğer LUCRİN DEPOT formülasyonları ile pazarlama sonrası deneyim boyunca bildirilmiştir.
8/26
9/26
10/26
11/26
12/26
13/26
14/26
15/26
16/26
18/26
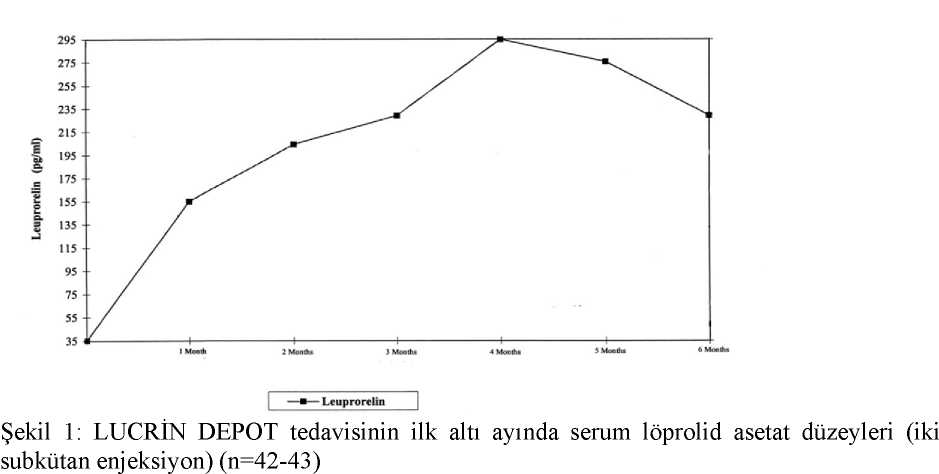
Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected]; tel 0 800 314 00 08; faks: 0 312 218 35 99).20/26 4.9 Doz aşımı ve tedavisiLöprolid asetat depot süspansiyonun akut doz aşımının etkileriyle ilgili klinik deneyim bulunmamaktadır. Doz aşımı durumunda hastalar yakından izlenmeli ve tedavi semptomatikve destekleyici olmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antineoplastik ve immunomodülatör ajanlar, endokrin tedavi, hormonlar ve ilgili ajanlar, Gonadotropin salıverici hormon (GnRH) analoglarıATC Kodu: L02AE02 LUCRİN DEPOT'un etkin maddesi olan löprolid asetat sentetik bir nonapeptiddir. Bu nonapeptid LH-RH (gonadorelin veya gonadotropin serbestleştirici hormon) analoğu,hipotalamusda üretilen doğal bir hormondur. Löprolid asetat bazı hormon ilişkili tümörlerinbüyümesini engeller; üreme organlarının atrofisine de sebep olabilir. Şimdiye dek uzun süreli tedaviden sonra antikor oluştuğuna dair bir bilgi yoktur. Löprolid asetat hipofiz bezinden luteinizan hormon (LH) ve folikül stimülan hormonun (FSH) salımını uyaran bir etkiye sahiptir. Bu sebeple, premenopozal dönemdeki kadınlardabaşlangıçta LH ve FSH seviyelerinde oluşan artışı takiben östrojen seviyelerinde geçici birartışa neden olur. Ancak, LUCRİN DEPOT'un sürekli uygulanması, LH, FSH ve östrojenlerindüzeylerinde düşmeyle sonuçlanır. Pre-menopozal dönemdeki kadınlarda östrojenler post-menopozal düzeylere iner. Söz konusu hormonal değişimler, önerilen dozlarda ilaç tedavisinebaşlandıktan sonra bir ay içinde gerçekleşir ve önerilen dozlarda tedavinin tüm dönemiboyunca korunur. Kadınlarda olduğu gibi erkeklerde de löprolid asetat LH ve FSH seviyelerinde geçici artışa sebep olur, bu yüzden testosteron salınımı artar. Ancak, LUCRİN DEPOT'un devamlıkullanımı testosteron üretimini kastrasyon seviyesine indiren LH ve FSH düzeylerindeazalmaya sebep olmaktadır. Bu etkiler tedavi başlangıcından sonra iki ila dört hafta içindegörülür ve tedavi sürecinin tümünde korunur. Dolayısı ile löprolid asetat pitüiter gonadotropinler ve insan üreme organları üzerine spesifik etkilere sahiptir. Bu özellik, bilhassa kardiyovasküler advers etki riskini düşürür. Bu tipreaksiyonlar dietilstilbestrol gibi östrojenlerin kullanımı ile ilişkilidir. Jinekomasti ve karaciğerile safra kesesi bozukluğu, tromboembolizm ve ödem gibi ilişkili diğer istenmeyen etkilerinriski de azalır. Tedavinin askıya alınması, pitüiter-gonadal sistem tarafından aktiviteninnormale dönmesi ile sonuçlanır ki bu durum, tedavinin geri dönüşümlü olduğunu gösterir. LUCRİN DEPOT 3 ay 11.25 mg östrojenlerin kullanımına bağlı risk artışı olan metastatik prostat karsinomu olan hastalar için bir alternatif sunar. Metastatik kastrasyona dirençli prostat kanseri hastalarında yürütülen klinik çalışmalar, löprolid asetat gibi GnRH agonistleri tedavisine androjen ekseni inhibitörleri olan abirateronasetat ve enzalutamid, dosetaksel taksanlar ve kabazitaksel ve radyofarmasötik Ra-223 gibiajanların eklenmesinden fayda gördüğünü göstermiştir. 21/26 ÇocuklardaPitüiter gonadotropin serbestleşmesinin geçici olarak baskılanmasını takiben estradiol (E2) veya testosteron düzeyleri pre-pubertal aralık değerlerine düşer. Başlangıçta gonadal uyarım (alevlenme), tedavi başlangıcında post-menarş olan kızlarda vajinal kanamaya sebep olabilir. Tedavi başlangıcında kesilme kanaması görülebilir. Tedavidevam ettiğinde kanama genellikle durur. Aşağıdaki terapötik etkiler görülebilir: - Bazal ve stimüle gonadotropin düzeylerinin pre-pubertal seviyelere baskılanması; - Erken artmış olan seks hormon seviyelerin pre-pubertal seviyelere baskılanması veerken menstrüasyonun durdurulması; - Vücutta pubertal gelişimin (Tanner evreleri) durdurulması/engellenmesi; - Kronolojik yaş ve kemik yaşı oranlarının iyileştirilmesi/normalleştirilmesi; - Progresif kemik yaşı hızlanmasının önlenmesi; - Büyüme hızının azalması ve normalleşmesi; - Nihai boyda uzama. Tedavi sonucu patolojik olarak, erken aktive olmuş hipotalamik-pitüiter-gonadal eksenin pre-pubertal yaşa göre baskılanmasıdır. Löprolid asetat ile aylık 15 mg' a dek olan dozlarla tedavi edilen çocuklardaki uzun süreli klinik çalışmalarda, tedavinin kesilmesinden sonra pubertal gelişimin 4 yıldan daha uzun süregeriletildiği gözlenmiştir. 20 kadın hastanın erişkin yaşlardaki takibinde %80'inde normalmenstrüasyon siklusları gözlenirken 4'ü çoklu gebelik olmak üzere 7'sinde toplam 12 gebelikgörülmüştür. 5.2 Farmakokinetik ÖzellikleriGenel özellikler:Oral uygulamayı takiben, löprolid asetat aktif değildir. Bu ilacın subkütan uygulama sonrasındaki biyoyararlanımı intramüsküler uygulama sonrasındaki biyoyararlanım ilekıyaslanabilir orandadır. LUCRİN DEPOT 3 AY 11,25 mg tek doz uygulanmasından üç aysonra hala tespit edilebilir düzeylerdedir. Kronik uygulamayı takiben birikme yoktur. Çocuklar:Şekil 1'de LUCRİN DEPOT'un subkütan uygulanmasını (iki enjeksiyon) takiben ilk altı aylık dönemde çocuklarda löprolid asetat serum seviyeleri verilmiştir. İlk enjeksiyondan itibaren, löprolid asetat serum seviyeleri, 4. ayda (294,79 pg/ml ± 105,42) maksimum serum seviyelerine ulaşırken, 6. aya (229,02 pg/ml ± 103,33) kadar hafifçeazalmaktadır. 22/26
Üç aylık formülasyon LUCRIN DEPOT 11,25 mg'ın ilerlemiş prostat kanserli erkek gönüllülere tek bir enjeksiyon olarak uygulanmasını takiben, löprolid asetatkonsantrasyonunda hızlı bir artış gözlenmiştir. Ortalama tepe löprolid plazma konsantrasyonuenjeksiyondan üç saat sonra 21,82 (±11,24) ng/mL olarak gözlenmiştir. Löprolid asetatenjeksiyondan 7 ila 14 gün sonra plato seviyelerine ulaşmıştır. Dördüncü haftada, ortalamalöprolid plazma konsantrasyonu 0,26 (± ,10) ng/mL olarak belirlenmiştir. Daha sonra 12.haftada ortalama löprolid plazma konsantrasyonu 0,17 (± ,08) ng/mL'ye düşmüştür. Üç aylık formülasyon LUCRIN DEPOT 11,25 mg'ın kadın gönüllülere tek bir enjeksiyon olarak uygulanmasını takiben, 36,3 ng/mL olan ortalama plazma löprolid asetatkonsantrasyonu 4 saatte gözlenmiştir. Doz uygulamasından sonraki üçüncü haftada kararlıdurum düzeylerinin başlamasını takiben, löprolid asetatın sabit bir hızda salındığı görülmüş vedaha sonra ortalama düzeyler gerileyerek 12 haftada alt saptama sınırına yaklaşmıştır. Üç haftaile 12 hafta arasındaki ortalama (± standart sapma) löprolid asetat konsantrasyonu 0,23 ± 0,09mg/mL olarak belirlenmiştir. Ancak araştırmada uygulanan analizle değişmemiş löprolid asetatve inaktif bir majör metabolit ayırt edilememiştir. İlk ani artış ve bunu izleyen hızlı bir biçimdekararlı durum düzeyine gerileme, ayda bir kez uygulanan formülasyonla görülen salımpaternine benzerlik göstermiştir. Üç aylık formülasyon LUCRIN DEPOT 11,25 mg'ın CPP'li çocuk gönüllülere tek bir enjeksiyon olarak uygulanmasını takiben, ortalama tepe löprolid plazma konsantrasyonu 19,1ng/mL olmuştur. Daha sonra konsantrasyonlar, dozlamadan 2 hafta sonra 0,08 ng/mL'yedüşmüştür. Ortalama löprolid plazma konsantrasyonu 1. aydan 3. aya kadar sabit kalmıştır.Birinci ve ikinci enjeksiyonlardan 3 ay sonra ortalama löprolid konsantrasyonları, tekrarlananuygulamada löprolid birikimi olmadığını belirtecek şekilde benzer olmuştur. Dağılım:Sağlıklı erkek gönüllülere intravenöz bolus uygulamayı takiben löprolid asetatın ortalama kararlı-durum dağılım hacmi 27 L' dir. İnsan plazma proteinlerine in vitro%49 arasındadır.23/26 Biyotransformasyon:Sağlıklı erkek gönüllülerde intravenöz olarak verilen 1 mg bolus löprolid asetatın ortalama sistemik klerensi 7,6 L/saat olup terminal eliminasyon yarı-ömrü iki kompartmanlı bir modelegöre ortalama üç saattir. Hayvan çalışmaları, 14C işaretli löprolid asetatın, bir pentapeptit (Metabolit I), tripeptit (Metabolit II ve III) ve bir dipeptit (Metabolit IV) halinde daha küçük inaktif peptitleremetabolize edildiğini göstermiştir. Bu fragmanlar daha fazla metabolize edilebilir. Beş prostat kanseri hastasında ölçülen major metabolit (M-I) plazma konsantrasyonları, dozlamadan iki ila altı saat sonra maksimum konsantrasyona ulaşmıştır ve en yüksek ana ilaçkonsantrasyonunun yaklaşık %6'idi.Eliminasyon:LUCRİN DEPOT 3,75 mg'ın üç hastadaki uygulamasını takiben, dozun %5'inden azı ana bileşik ve M-I metaboliti olarak idrarda 27 günden fazla geri kazanılmıştır. Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Löprolid asetatın böbrek yetmezliği olan hastalardaki farmakokinetiği belirlenmemiştir. Karaciğer yetmezliği:Löprolid asetatın karaciğer yetmezliği olan hastalardaki farmakokinetiği belirlenmemiştir. 5.3 Klinik öncesi güvenlilik verileriSıçanlara löprolid asetatın uzun süreli tedavi olarak uygulanmasından sonra pitüiter tümörlerde artış gözlenmiştir. Bu etki farelerde görülmez. Kemirgenlerde pitüiter tümörlerin oluşumudiğer LHRH-analogları ile de beklenmektedir. Bu gözlemin insanlarla herhangi bir ilişkisiolduğu düşünülmemektedir. Sıçanlar ve tavşanlardaki üreme toksisitesi çalışmalarında, tek bir enjeksiyon ürünü ile embriyo/fetotoksik etkiler ve embriyo fetal gelişimde gecikme gözlenmiştir. Dozla ilişkilimajör fetal anomalilerin artışı bir aylık depo preparatın uygulanmasını takiben tavşanlardagözlenmiştir. Bu çalışmalarda kullanılan dozajlar insan mutat dozundan daha düşüktür. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiLiyofilize tozun hazırlanmasında kullanılan yardımcı maddeler:Polilaktik asit (PLA) Mannitol 24/26 Seyrelticinin hazırlanmasında kullanılan yardımcı maddeler:Sodyum karboksimetilselüloz MannitolPolisorbat 80Enjeksiyonluk su 6.2 GeçimsizliklerÇözündürmek için sadece LUCRİN DEPOT ile birlikte verilen çözücüyü kullanınız. 6.3 Raf ömrü36 ay Seyreltici ile karıştırılarak hazırlanmış süspansiyon 25 °C'de 24 saat boyunca fiziksel ve kimyasal olarak stabildir. Ancak mikrobiyolojik açıdan hazırlandıktan hemen sonrakullanılmalıdır. Hazırlanmış ürün derhal uygulanmazsa kullanıcı/uygulayıcı kullanımzamanından ve ürünün uygulama sırasındaki durumundan sorumludur. Normalde bu süre,kullanıma hazır ürünün kontrollü ve valide edilmiş koşullar altında olmaması durumda 2-8°C'de saklandığında 24 saatten fazla olamaz. 6.4 Saklamaya yönelik özel tedbirlerLUCRİN DEPOT, 25 °C'nin altındaki oda sıcaklığında saklanmalıdır. Buzdolabında saklamayınız, dondurmayınız. Seyreltici ile karıştırıldıktan sonra 24 saat süreyle stabil olduğu gösterilmiş olmakla birlikte içinde koruyucu madde bulunmadığından, hemen kullanılmadığı takdirde süspansiyonatılmalıdır. 6.5 Ambalajın niteliği ve içeriğiPlastik muhafaza içerisinde conta ile birbirinden ayrılmış çift bölmeli üst bölmesinde çözelti, alt bölmesinde toz içeren, tozlu bölmede piston ile üzerine bastırı1dığında sıvı geçişinisağlayan bombesi bulunan ucunda iğnesi ve plastik iğne kılıfı takılı renksiz cam enjektör, kutuiçinde vidalı piston ve 2 adet alkollü tampondan oluşacak şekilde ambalajlanmıştır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİAbbVie Tıbbi İlaçlar Sanayi ve Ticaret Limited Şirketi Barbaros Mah. Begonya Sk. Nidakule Ataşehir Batı Blok No: 1 İç Kapı No: 33 Ataşehir / İstanbul Tel: 0216 636 06 00 Faks: 0216 425 09 69 25/26 8. RUHSAT NUMARASI134/22 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ26.09.2012 10. KÜB'ÜN YENİLENME TARİHİ26/26 |
İlaç BilgileriLucrin Depot 3 Ay Im/sc 11,25 Mg Kullanıma Hazır Toz ve Çözücü İçeren Çift Bölmeli EnjektörEtken Maddesi: Leuprolide Asetat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.