Somatuline Autogel 120 Mg/0,5 Ml Uzaltılmış Salımlı Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Şırınga Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADISOMATULINE AUTOGEL 120 mg/0.5 ml, uzatılmış salımlı enjeksiyonluk çözelti içeren kullanıma hazır şırınga. Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Lanreotid (I.N.N), 120 mg (149,4 mg lanreotid asetat olarak bulunur). Her bir kullanıma hazır enjektör, 120 mg'lık lanreotid enjeksiyon dozunu sağlayacak şekilde çözeltinin her miligramında 0,246 mg lanreotide karşılık gelen süper doyurulmuş 149,4 mglanreotid asetat çözeltisi içerir. Yardımcı maddeler:Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMUzatılmış salımlı enjeksiyonluk çözelti içeren kullanıma hazır şırınga. Beyaz-soluk sarı, yarı katı formülasyon. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarSOMATULINE AUTOGEL, Ameliyat ve/veya radyoterapi sonrası, kandaki Büyüme Hormonu (GH) ve İnsülin-benzeri Büyüme Faktörü-1 (IGF-1) düzeyleri normal olmayan akromegali hastalarınıntedavisinde veya bu haller dışında medikal tedaviye ihtiyaç duyan hastalarda endikedir.Akromegali tedavisinde amaç, GH ve IGF-1 seviyelerini düşürerek, mümkünse normaldeğerlere getirmektir. Anrezektabl, lokal ileri veya metastatik grade 1 ve grade 2 (Ki67 indeksi %10'a kadar)olan, orta bağırsak, pankreatik veya orijini bilinmeyen (arka bağırsak hariç)gastroenteropankreatik nöroendokrin tümörleri (GEP-NETler) bulunan yetişkinhastaların tedavisinde endikedir (bkz. Bölüm 5.1.). Nöroendokrin tümörler (özellikle karsinoid) ile ilişkili semptomların tedavisindeendikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Akromegali Bu belge Belge Dqöngrf^etf,ba|langıçjaozu/ıhefı28|ünde(^ruygulananı60ımğciiai :i2,o%'ğ'âfr.>'egovtr/sagiik-titck-eb>'s1 Doz, hastanın tedaviye verdiği yanıta göre bireysel olarak belirlenmelidir (semptomlardaki azalma ve/veya GH ve/veya IGF-1 seviyelerindeki düşüş değerlendirilerek). Klinik semptomları ve biyokimyasal parametreleri yeterince kontrol edilemeyen (GH konsantrasyonları halen 2,5 ng/mL'nin (yaklaşık 5 mU/L) üzerinde veya IGF-1 değerlerinormalin üzerinde (yaşa göre)) hastalarda SOMATULINE AUTOGEL dozu, her 28 günde birmaksimum 120 mg olacak şekilde arttırılabilir. Bir somatostatin analoğu ile iyi kontrol edilen hastalar, alternatif olarak her 42-56 günde (6 ila 8 hafta) bir SOMATULINE AUTOGEL 120 mg ile tedavi edilebilir. Tüm hastalarda semptomların, GH'nin ve IGF-1 düzeylerinin uzun süre takip edilmesi rutin olarak yapılmalıdır. Anrezektabl, lokal ileri veya metastatik grade 1 ve grade 2 (Ki67 indeksi %10'a kadar) olan,orta bağırsak, pankreatik veya orijini bilinmeyen (arka bağırsak hariç) gastroenteropankreatiknöroendokrin tümörleri (GEP-NETler) bulunan yetişkin hastaların tedavisiÖnerilen doz, 28 günde bir 120 mg SOMATULINE AUTOGEL uygulamasıdır. Tümörün kontrolü için ihtiyaç duyulan süre boyunca SOMATULINE AUTOGEL tedavisi sürdürülmelidir. Nöroendokrin tümörlere ilişkin semptomların tedavisiÖnerilen başlangıç dozu, her 28 günde bir uygulanan 60-120 mg'dır. Semptomatik rahatlamanın derecesine göre doz ayarlanmalıdır. Uygulama şekli:SOMATULINE AUTOGEL kalçanın üst dış kadranına veya uyluğun üst dış kısmına derin subkütan yolla enjekte edilir. SOMATULINE AUTOGEL, ürününün stabil dozunu alan hastalarda, uygun eğitim sonrası, hastanın kendisi ya da bir başka eğitilmiş kişi tarafından uygulanabilir. Kendi kendineenjeksiyon durumunda (self-enjeksiyon) enjeksiyon, uyluğun üst dış kısmına yapılmalıdır. Eğitilmiş kişi ya da hasta tarafından uygulama kararına sağlık profesyoneli karar vermelidir. Uygulama yeri ne olursa olsun, deri hiçbir zaman kıvrılmamalı ve iğne deriye tamamen ve dikolarak hızlıca geçirilmelidir. Enjeksiyon bölgesi sağ ve sol taraf arası değiştirilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:SOMATULINE AUTOGEL'in çocuklar ve adolesanlarda kullanımı ile ilgili yeterli güvenlilik ve etkililik verisi olmadığından, çocuklarda ve adolesanlarda SOMATULINE AUTOGEL i ıı iBu belgekullanımı önerilmez. 2 Geriyatrik Popülasyon:Lanreotidin geniş bir terapötik pencereye sahip olması sebebiyle, geriyatrik hastalarda özel bir doz ayarlamasına gerek yoktur (bkz. Bölüm 5.2). Böbrek/karaciğer yetmezliği:Lanreotidin geniş bir terapötik pencereye sahip olması sebebiyle, böbrek veya karaciğer yetmezliği olan hastalarda özel bir doz ayarlamasına gerek yoktur (bkz. Bölüm 5.2). 4.3. KontrendikasyonlarSOMATULINE AUTOGEL, Lanreotid veya ilgili peptidlere karşı veya içeriğindeki yardımcı maddelerden herhangi birine (bkz. Bölüm 6.1) karşı aşırı duyarlılık durumlarındakontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriLanreotid safra kesesinin motilitesini azaltabilir ve safra taşı oluşumuna yol açabilir. Bu nedenle hastaların periyodik olarak gözlenmesi gerekebilir. Laneotid alan hastalarda pazarlama sonrası, kolesistektomi gerektiren kolesistit, kolanjit ve pankreatit gibi komplikasyonlarla sonuçlanan safra kesesi taşları rapor edilmiştir. Eğerkolelityazis komplikasyonlarından şüpheleniliyorsa, lanreotit kullanımı kesilerek uygun şekildetedavi edilmelidir. İnsanlardaki ve hayvanlardaki farmakolojik çalışmalar lanreotidin, somatostatin ve diğer somatostatin analogları gibi insülin ve glukagon salgılanmasını inhibe ettiğini göstermektedir.Bu nedenle, lanreotid ile tedavi edilen hastalarda hipoglisemi veya hiperglisemi görülebilir.Lanreotid tedavisine başlandığında veya doz değişikliği yapıldığında kan glukoz düzeylerigözlenmelidir ve tüm antidiyabetik tedaviler buna göre ayarlanmalıdır. Her ne kadar klinik hipotiroidizm nadirse de (< %1), akromegalisi olan hastaların lanreotid ile tedavisi sırasında tiroid fonksiyonlarında hafif azalmalar görülmüştür. Klinik olarakgerektiğinde tiroid fonksiyon testleri yapılmalıdır. Altta yatan kardiyak problemleri olmayan hastalarda lanreotid, bradikardi eşiğine ulaşmadan kalp atım hızında azalmaya yol açabilir. Lanreotid tedavisinden önce kardiyak rahatsızlıklarıolan hastalarda sinüs bradikardisi oluşabilir. Bradikardisi olan hastalarda lanreotid ile tedavibaşlatılırken dikkatli olunmalıdır (bkz. Bölüm 4.5). 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriLanreotidin farmakolojik gastrointestinal etkileri, eş zamanlı uygulanan ilaçların (siklosporin de dahil) intestinal emilimini azaltabilir. Siklosporinin lanreotid ile eş zamanlı uygulaması,siklosporinin bağıl biyoyararlanımını azaltabilir; bu da terapötik seviyeleri idame ettirebilmekamacıyla siklosporin doz ayarlamasını zorunlu kılabilir. J Bu belge Bu belge
3 İnsülin, glitazonlar, repaglinid, sülfonilüreler ile beraber kullanımda hipoglisemi veya hiperglisemi riski bulunmaktadır. Endojen glukagon salgısındaki azalmayı veya artmayıtakiben antidiyabetik tedavi ihtiyacı azalabilir veya artabilir. Hasta hipoglisemi riski nedeniylebilgilendirilmelidir. Kendi kendine yapılan glisemik gözlem desteklenmeli ve lanreotid iletedavi sırasında antidiyabetik tedavinin dozu adapte edilmelidir. Plazma proteinlerine yüksek oranda bağlanan ilaçlarla etkileşim, lanreotidin serum proteinlerine orta derecede bağlanması nedeniyle beklenmez. Yayınlanmış sınırlı sayıda veri, somatostatin analogları ve bromokriptin eş zamanlı uygulamasının, bromokriptin biyoyararlanımını artırabileceğini göstermektedir. Bradikardi indükleyici ilaçların (örneğin beta blokörler) eş zamanlı uygulanması, lanreotid ile ilişkili kalp atım hızındaki hafif azalmanın üzerinde aditif etki yapabilir. Bu eş zamanlı ilaçtedavilerinde doz ayarlaması gerekli olabilir. Yayınlanmış mevcut sınırlı veriler somatostatin analoglarının, sitokrom P450 enzimleri ile metabolize olduğu bilinen bileşiklerin metabolik klerensini azaltabileceğini belirtmektedir. Budurum büyüme hormonunun baskılanmasına bağlı olabilir. Lanreotidin bu etkiye sahipolabileceği hariç tutulamadığından, başlıca CYP3A4 ile metabolize olan ve düşük terapötikindekse sahip olan (örneğin kinidin, terfenadin) diğer ilaçlar ile dikkatli kullanılması gerekir. Özel popülasyonlara ilişkin ek bilgiler:Herhangi bir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:Herhangi bir etkileşim çalışması yapılmamıştır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğuııı kontrolü (Kontrasepsiyon)Özel veri bulunmamaktadır. Gebelik dönemiSınırlı sayıda (300'den az gebelik sonucu) gebelikte maruz kalma olgularından gelen veriler, SOMATULINE AUTOGEL'in gebelik üzerinde ya da fetusun/yeni doğan çocuğun sağlığıüzerinde advers etkileri olduğunu göstermemektedir. Bugüne kadar herhangi önemli birepidemiyolojik veri elde edilmemiştir. Hayvanlar üzerinde yapılan çalısmalar, gebelik / embriyonal / fetal gelisim / doğum ya da doğum sonrası gelisim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu güvenli elektronik imza ile imzalanmıştır. .Bu beBelge
4 Önlem olarak, hamilelik sırasında lanreotid kullanımından kaçınılması tercih edilmelidir. SOMATULINE AUTOGEL, gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiSOMATULINE AUTOGEL'in insan sütüyle atılıp atılmadığı bilinmemektedir. Yeni doğanlar/bebekler için risk taşıdığı göz ardı edilmemelidir. Gerekli olmadıkça emzirme döneminde kullanılmamalıdır. Üreme yeteneği/ Fertiliteİnsanlardaki terapötik dozların üstündeki dozlarda, büyüme hormonu (GH) salgılanmasının inhibisyonuna bağlı olarak dişi sıçanlarda azalmış fertilite gözlemlenmiştir. 4.7. Araç ve makine kullanımı üzerindeki etkilerSOMATULINE AUTOGEL'in araç ve makine kullanımı üzerine düşük veya orta dereceli etkisi bulunmaktadır. Araç ve makine kullanımı üzerine etkisine ilişkin herhangi bir çalışmayapılmamıştır fakat SOMATULINE AUTOGEL ile baş dönmesi rapor edilmiştir (bkz. Bölüm4.8). Eğer hasta etkilenmişse araç veya makine kullanmamalıdır. 4.8. İstenmeyen etkilerKlinik çalışmalarda lanreotid ile tedavi edilen akromegali ve GEP-NET'li hastalar tarafından rapor edilen istenmeyen etkiler, ilgili vücut organ sistemlerine göre listelenmiştir. İstenmeyen etkiler aşağıdaki sıklık derecesine göre listelenmiştir: Çok yaygın (> 1/10); yaygın (> 1/100 ila < 1/10); yaygın olmayan (> 1/1.000 ila < 1/100); seyrek (> 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000); bilinmeyen (eldeki verilerdenhareketle tahmin edilemiyor). Lanreotid ile tedaviyi takiben beklenen en yaygın advers etkiler gastrointestinal bozukluklar (en yaygın rapor edilenler diyare ve karın ağrısıdır, bu etkiler genellikle hafif veya orta dereceliolup geçicidir), kolelitiyazis (genellikle asemptomatik) ve enjeksiyon bölgesi reaksiyonlarıdır(ağrı, nodüller ve endürasyon). İstenmeyen etkilerin profili tüm endikasyonlar için benzerdir. Enfeksiyonlar ve enfestasyonlarBilinmeyen1: Enjeksiyon yerinde apse Bağışıklık sistemi hastalıklarıBilinmeyen1: Alerjik reaksiyon (anjiyoödem, anaflaksi, hipersensivite). Metabolizma ve beslenme hastalıklarıYaygın: Hipoglisemi, iştah kaybı**, hiperglisemi, şeker hastalığı (DM)
5 Psikiyatrik hastalıklarYaygın olmayan: Uykusuzluk* Sinir sistemi hastalıklarıYaygın: Baş dönmesi, baş ağrısı, letarji** Kardiyak hastalıklarYaygın: Sinüs bradikardisi* Vasküler hastalıklarYaygın olmayan: Ateş basması* Gastrointestinal hastalıklarÇok yaygın: Diyare, karın ağrısı, yumuşak gaita* Yaygın: Bulantı, kusma, konstipasyon, flatulans, abdominal distensiyon, abdominal rahatsızlık hissi, dispepsi, steatore** Yaygın olmayan: Gaitada renk değişikliği* Bilinmeyen1: Pankreatit Hepato-bilier hastalıklarÇok yaygın: Kolelitiyazis (safra kesesinde taş oluşumu) Yaygın: biliyer dilatasyon* Bilinmeyen1: Kolesistit, kolanjit Deri ve deri altı doku hastalıklarıYaygın: Alopesi, hipotrikozis* Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Muskuloskeletal ağrı**, miyalji** Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Asteni, yorgunluk, enjeksiyon bölgesi reaksiyonları (ağrı, kitle, endürasyon, nodül, kaşıntı) Araştırmalar:Yaygın: Artmış ALT*, anormal AST*, anormal ALT*, artmış kan bilirubin*, artmış kan glukoz düzeyi*, artmış glukolize hemoglobin*, kilo kaybı, pankreas enzimlerinde azalma**. Yaygın olmayan: Artmış AST*, artmış kan alkalin fosfataz*, anormal kan bilirubini*, azalmış kan sodyum düzeyi*. 1 Pazarlama sonrası güvenlilik deneyimleri * Akromegalik hastalarda yürütülen bir grup çalışmaya dayanmaktadır. ** GEP-NET'li hastalarda yürütülen bir grup çalışmaya dayanmaktadır.
6 Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiDoz aşımı durumunda semptomatik tedavi yapılır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup:,ATC kodu:Etki mekanizmasıLanreotid doğal somatostatinin bir oktapeptid analoğudur. Somatostatin gibi, lanreotid de değişik endokrin, nöroendokrin, ekzokrin ve parakrin fonksiyonların bir inhibitörüdür.Lanreotid, insan somatostatin reseptörleri (SSTR) 2 ve 5 için yüksek bağlanma afinitesigösterirken, SSTR 1, 3 ve 4 için afinitesi azdır. İlacın SSTR 2 ve 5'deki aktivitesi büyümehormonu (GH) inhibisyonundan sorumlu olduğu düşünülen primer mekanizmadır. Lanreotiddoğal somatostatinden daha aktiftir ve etki süresi daha uzundur. Lanreotid, somatostatin gibi genel ekzokrin antisekretuvar etki gösterir. Motilinin bazal salgılanmasını, gastrik inhibitör peptidi ve pankreatik polipeptidin salgılanmasını inhibe ederfakat, açlık sekretin ve gastrin salgılanması üzerinde anlamlı bir etkisi yoktur. Ayrıca GEP-NET'i olan hastalarda plazma kromogranin A ve üriner 5-HIAA (5-Hidroksiindolasetik asit)ve yükselmiş olan tümör belirteçlerinin seviyelerini düşürür. Lanreotid superior mezenterik arter kan akışı ve portal venöz kan akışında yemekle uyarılan artışları, önemli derecede inhibe eder. Lanreotid, prostaglandin E1 ile stimüle olan jejunum su,sodyum, potasyum ve klorür sekresyonunu anlamlı derecede azaltır. Lanreotid, uzun süre tedavigören akromegali hastalarında prolaktin düzeylerini düşürür. Klinik çalışmalarAçık etiketli bir çalışmada, hipofizer makroadenom tanısı koyulmuş ve daha önce tedavi görmemiş 90 akromegali hastasına, 48 hafta boyunca her 28 günde bir 120 mg SOMATULINEAUTOGEL uygulanmıştır. Çalışma periyodu boyunca hipofizer operasyon veya radyoterapigereksinimi duyması beklenen hastalar dahil edilmemiştir.
7 48. haftada, istatistiksel anlama ulaşılamasa da (%95 GA: %52-%73), hastaların %63'ünde tümör hacminde > %20'lik bir azalma görülmüştür (primer etkinlik sonlanım noktası). 24hastada (%27) %20'den az bir azalma elde edilmiş ve 9 hastada (%10) tümör hacminde artışgözlenmiştir.Tümör hacmindeki ortalama % azalma, %26,8 olmuş; hastaların %77,8'inde GH seviyeleri 2,5 mcg/L'nin altında kalmış ve %50'sinde IGF-1 seviyeleri normalleşmiştir. Hastaların%43,5'inde, 2,5 mcg/L'nin altındaki GH seviyeleriyle birlikte normalleşmiş IGF-1 seviyelerigözlenmiştir.Hastalar, yorgunluk (%56,5), aşırı terleme (%66,1), artralji (%59,7) ve yumuşak doku şişmesi (%66,1) gibi akromegali semptomlarında azalma bildirmiştir. Daha az hasta baş ağrısındaazalma yaşamıştır (%38,7).Tümör hacmi ve GH ve IGF-1 konsantrasyonlarındaki azalma 12. haftadan itibaren görülmüş ve 48 hafta boyunca devam etmiştir.En az 4 ay boyunca SOMATULINE AUTOGEL'in stabil bir dozuyla tedavi edilmiş akromegali hastalarını kapsayan bir açık etiketli, kontrollü çalışma süresince, uygun eğitimin ardındankendi başına veya bir partner tarafından SOMATULINE AUTOGEL enjeksiyonları alanhastaların %93'ünün gözetimsiz enjeksiyonları uygulamada yetkin oldukları düşünülmüştür(GH ve IGF-1 seviyelerinin idamesi).SOMATULINE AUTOGEL'in 96 haftalık, randomize, çift-kör, çok merkezli, plasebo kontrollü bir faz III çalışması, gastroenteropankreatik nöroendokrin tümörleri bulunanhastalarda lanreotidin antiproliferatif etkisini belirlemek amacıyla yapılmıştır.Hastalar, her 28 günde bir SOMATULINE AUTOGEL 120 mg alanlar (n=101) ve plasebo alanlar (n=103) olmak üzere bire bir oranında randomize edilmiştir. Randomizasyon, çalışmayadahil olmadan önceki tedavi başında ve 3-6 aylık görüntüleme fazı boyunca -RECIST 1.0(Response Evaluation Criteria in Solid Tumours) ile belirlenen- progresyon olup olmadığışeklinde sınıflandırılmıştır.Hastalarda metastatik ve/veya lokal ileri, anrezektabl iyi veya orta diferansiye tümörler bulunmaktaydı. Özellikle pankreas (hastaların %44,6'sı), orta bağırsak (%35,8), arka bağırsak(%6,9) veya diğer/primeri bilinmeyen (%12,7) tümörlerin iyi veya orta diferansiye olduğuhistolojik olarak doanmıştır.GEP-NET'li hastaların % 69'unda grade 1 (G1) tümör bulunurken (proliferasyon indeksi Ki67 < %2 (toplam hasta popülasyonunun %50,5'i) veya mitotik indeks < 2 mitoz/10 HPF (toplamhasta popülasyonunun %18,5'i) olarak tanımlanır), %30'unda daha düşük seviyede grade 2(G2) tümör bulunmaktadır (%2 < Ki67 indeks < %10 şeklinde tanımlanır). Hastaların %1'iningrade'i bilinmemektedir. Hücresel proliferasyon indeksi yüksek olan (%10 < Ki67 < %20) G2GEP-NET'li hastalar ve G3 GEP-NET nöroendokrin tümörleri olan hastalar (Ki67 indeks >%20) çalışmaya dahil edilmemiştir.
8 Toplamda, hastaların %52,5'inde hepatik tümör yükü < %10, %14,5'inde > %10 ve < %25, %33'ünde ise > %25 şeklindedir.Primer sonlanım noktası progresyonsuz sağkalımdır ve hastalığın progresyonuna (RECIST 1.0'a) kadar geçen veya ilk tedaviden sonraki 96 hafta içinde meydana gelen ölüme kadar geçensüre olarak belirlenir. Progresyonsuz sağkalım analizleri, progresyonun, bağımsız, merkeziolarak incelenen radyolojik değerlendirmesi ile yapılmıştır (bkz. Tablo 1 ve Şekil 1).Tablo 1. Faz III çalışmasına ait etkililik sonuçları
Şekil 2.'de de görüldüğü gibi, lanreotidin progresyon veya ölüm riskini azaltıcı yöndeki faydalı , i .......iBu bel2e, güvenli elektronik in>aa ile imzalanmıstırı..i ..tt- -iBelge Doeta Kpfflmer5 dümöSün mlokasyonufidaaw^ePatikB etMemöSpXürkündseM,wöPuCeykeigokermaake-racEledesn, 9başlangıçtaki Ki67'den, tümör grade'inden veya önceden belirlenmiş diğer karakteristiklerden bağımsızdır. Toplam çalışma popülasyonundaki pankreatik, orta bağırsak ve diğer/bilinmeyen orijinli tümörlere sahip hastalarda, SOMATULINE AUTOGEL ile tedavinin klinik yararı görülmüştür.Arka bağırsak tümörü bulunan sınırlı sayıda hastanın varlığı (14/204), bu alt gruba aitsonuçların yorumlanmasında güçlük yaratmıştır. Elde edilen veriler, lanreotidin bu hastalardaherhangi bir yarar sağlamadığını göstermektedir. Şekil 2.PFS'nin Cox Orantısal Risk Eş Değişkeni Analizi Sonuçları
Not:Tüm risk oranı değerleri, lanreotid Autogel'in plaseboya karşı rölatif risk değerleridir. Eş değişkenler için sonuçlar tedaviye, başlangıçtaki progresyon durumuna ve bir önceki tedaviyebağlı olarak ayrı Cox oransal risk modellerinden elde edilmiştir. Terimler düşey eksendegösterilmiştir.Genişletilmiş çalışmada, hastaların %45,6'sında (47/103) plasebodan açık etiketli SOMATULINE AUTOGEL'e geçiş meydana gelmiştir. Pediyatrik popülasyon:Avrupa İlaç Ajansı (EMA), SOMATULINE AUTOGEL'in pediyatrik popülasyonun tüm alt gruplarında (akromegali ve hipofizer devlik) yapılan çalışmalara ait sonuçların sunulmasızorunluluğundan vazgeçmiştir (pediyatrik kullanım için bkz. Bölüm 4.2). Ajans, gastroenteropankreatik nöroendokrin tümörleri de (nöroblastoma, nörogangliablastoma, feokromositoma hariç) muafiyet sınıfına dahil etmiştir.
10 5.2. Farmakokinetik özelliklerEmilim:Her 28 günde bir verilen SOMATULINE AUTOGEL 60, 90 ve 120 mg'ın üç derin subkütan enjeksiyonundan sonra elde edilen lanreotid serum düzeylerinin, sırasıyla 14, 10 veya 7 gündebir intramüsküler verilen lanreotid 30 mg uzatılmış salımlı mikropartikülleriyle (SomatulineLA) önceden tedavi gören akromegali hastalarında elde edilen kararlı serum düzeylerinebenzediği tespit edilmiştir. Yapılan çalışmalarda, 1 ng/mL lanreotid serum konsantrasyonu, hastaların %60'ından fazlasında büyüme hormonu GH'ı 5 ng/mL'den daha düşük değerlere baskılamıştır. Lanreotidserum seviyesi 2,5 ng/mL olduğunda ise hastaların %90'ından fazlasında GH, 5 ng/mL'ninaltındaki değerlere baskılanabilmiştir. Bir popülasyon PK analizinde, SOMATULINE AUTOGEL 120 mg alan 290 GEP-NET'li hastada, tek bir enjeksiyondan sonraki ilk gün içerisinde 7,49 ± 7,58 ng/mL değerine ulaşanCmaks ile birlikte ani, hızlı salım gözlenmiştir. Kararlı hal konsantrasyonlarına, SOMATULINEAUTOGEL 120 mg'ın 28 günde bir uygulanan 5 enjeksiyonu ile ulaşılmıştır ve uygulama sondeğerlendirmeye kadar sürdürülmüştür (ilk enjeksiyonu takiben, 96 haftaya kadar). Kararlıdurumda ortalama Cmaks değerleri 13,9 ± 7,44 ng/mL ve ortalama serum seviyeleri 6,56 ± 1,99ng/mL şeklindedir. Ortalama sanal terminal yarılanma ömrü ise 49,8 ± 28. gündür. Sağlıklı gönüllülere derin subkütan yolla SOMATULINE AUTOGEL 60, 90 ve 120 mg uygulamasından sonra lanreotid konsantrasyonları 4,25, 8,39 ve 6,79 ng/mL ortalamamaksimum serum konsantrasyonlarına ulaşmıştır. Bu Cmaks değerlerine ilk gün sırasıyla 8, 12ve 7. (medyan değerleri) saatlerde yapılan uygulamalar sonunda ulaşılmıştır. Lanreotidin pikserum seviyelerinden, sırasıyla 23,3 , 27,4 ve 30,1 gün terminal eliminasyon yarı ömrü ilebirinci dereceden kinetiği takip eden konsantrasyonlar yavaş yavaş azalmaktadır. Uygulamadan4 hafta sonra ortalama lanreotid serum seviyeleri sırasıyla 0,9, 1,11 ve 1,69 ng/mL değerlerinialmıştır. Mutlak biyoyararlanım ise sırasıyla %73,4,69,0 ve 78,4'tür. Akromegali hastalarına derin subkütan yolla SOMATULINE AUTOGEL 60, 90 ve 120 mg uygulaması sonrasında, lanreotid konsantrasyonları sırasıyla 1,6, 3,5 ve 3,1 ng/mL ortalamamaksimum serum konsantrasyonlarına ulaşmıştır. Bu Cmaks değerlerine ilk gün süresincesırasıyla 6,6 ve 24. (medyan değerleri) saatlerde yapılan uygulamalar sonunda ulaşılmıştır.Lanreotid konsantrasyonları, pik serum seviyesinden birinci derece kinetiğe uygun olarakyavaşça azalmıştır. Uygulamadan 4 hafta sonra ortalama lanreotid serum seviyeleri sırasıyla0,7, 1,0 ve 1,4 ng/mL değerlerini almıştır. Kararlı hal lanreotid serum seviyesine her 4 haftada bir yapılan 4 enjeksiyon sonrasında ulaşılmıştır (ortalama olarak). Her 4 haftada bir tekrarlayan dozlar sonrasında kararlı durumaulaşıldığında ortalama Cmaks değerleri 60, 90 ve 120 mg için sırasıyla 3,8, 5,7 ve 7,7ng/mL'dir. Ortalama Cmin değerleri ise 1,8, 2,5 ve 3,8 ng/mL olarak elde edilmiştir. Dalgalanmaindeksi ise orta düzeyde değişkenlik göstermekte olup %81 -108 olarak bulunmuştur. Belge Doama Kodu: lZW56aklUSHY3ZmxXZmxXRG83S3k0ZW56 Belge Takip Adresi:https://www.turkiye.gov.fr/saglik-titck-ebys11 Dağılım:Sağlıklı gönüllülerde intravenöz uygulama sonrasında lanreotidin intrinsik farmakokinetik parametreleri, 16,1 litrelik kararlı bir dağılma hacmiyle sınırlı ekstravasküler dağılımgöstermiştir. Biyotransformasyon:Veri bulunmamaktadır. Eliminasyon:Somatuline Autogel 60, 90 ve 120 mg'ın akromegali hastalarına derin subkütan uygulamasından sonra, lanreotid konsantrasyonları sırasıyla 1,6, 3,5 ve 3,1 ng / ml ortalamamaksimum serum konsantrasyonlarına ulaşmak için artmaktadır. Bu Cmaks değerleriuygulamadan sonraki ilk gün 6, 6 ve 24 saat içinde elde edilmektedir. Lanreotidin pik serumseviyelerinden, birinci dereceden kinetiği takiben konsantrasyonlar yavaş yavaş azalmaktadırve uygulamadan 4 hafta sonra lanreotid serum seviyeleri sırasıyla 0,7, 1,0 ve 1,4 ng/ml'dir. SOMATULINE AUTOGEL 60, 90 ve 120 mg'ın sağlıklı gönüllülere derin deri altı enjeksiyonu sonrasında lanreotid konsantrasyonları, pik serum seviyesinden birinci derece kinetiğe uygunolarak azalmıştır. Terminal eliminasyon yarılanma ömürleri sırasıyla 23,3 , 27,4 ve 30,1 günolarak saptanmıştır. Sağlıklı gönüllülerde intravenöz uygulama sonrasında total klerens 23,7 L/sa, terminal yarılanma ömrü 1,14 saat ve vücutta ortalama kalma süresi ise 0.68 saattir. Eliminasyonu değerlendiren çalışmalar, lanreotidin %5'ten daha azının idrar ile atıldığını ve feçeste % 0,5'ten daha az miktarda saptanması da kısmen safra itrahının söz konusu olduğunugöstermektedir.Doğrusallık /Doğrusal Olmayan Durum:Akromegali hastalarına derin subkütan yolla SOMATULINE AUTOGEL 60, 90 ve 120 mg uygulaması sonrasında lineer farmakokinetik salım profilleri gözlenmiştir. Hastalardaki karakteristik özelliklerBöbrek/karaciğer yetmezliği:Şiddetli böbrek yetmezliği olan kişilerde yarılanma ömrü ve EAA (eğri altı alanı) değerlerinde artış, lanreotidin total serum klerensinde yaklaşık olarak 2 kat azalma gözlenmiştir.Orta/şiddetli karaciğer hasarı bulunan hastalarda, klerenste %30 oranında düşüş gözlenmiştir.Karaciğer yetmezliğinin herhangi bir aşamasında olan hastalarda, dağılım hacmi ve ortalamakalış süresi artmıştır. SOMATULINE AUTOGEL ile tedavi edilen, hafif ve orta dereceli böbrek yetmezliği olan GEP-NET'li 165 hastada (sırasıyla 106 ve 59) yapılan bir popülasyon PK analizine göre,lanreotid klerensi üzerinde ıheshangieta iötkEgözkenmemişticr. Şiddetli böbrek yetmezliği olan
12 GEP-NET'li hastalar üzerinde ve karaciğer yetmezliği Child-Pugh skorlaması ile değerlendirilmiş olan GEP-NET'li hastalar üzerinde herhangi bir çalışma yapılmamıştır. Böbrek veya karaciğer yetmezliği olan hastalarda başlangıç dozunun ayarlanması gerekmez. Bu popülasyonda serum lanreotid konsantrasyonunun sağlıklı bireylerde güvenli bir şekildetolere edilebilen doz aralığında olması beklenmektedir. Geriyatrik Popülasyon:Yaşlı bireyler, ortalama kalış süresi ve yarılanma ömründe sağlıklı genç bireylere kıyasla artış gösterir. Bu popülasyonda serum lanreotid konsantrasyonunun sağlıklı bireylerde güvenli birşekilde tolere edilebilen doz aralığında olması beklendiğinden, başlangıç dozunda herhangi birdeğişiklik yapmak gerekmemektedir. 65 ila 85 yaş aralığındaki 122 GEP-NET'li hastanın yer aldığı bir popülasyon PK analizine göre, yaş faktörünün klerens ve lanreotidin dağılım hacmi üzerine herhangi bir etkisigözlenmemiştir. 5.3. Klinik öncesi güvenlilik verileriKlinik olmayan çalışmalardaki etkiler, sadece klinik kullanımla çok az ilgisi olduğunu gösteren maksimum insan maruziyetinin yeterince fazla olduğu düşünülen maruziyetlerde gözlenmiştir.Fare ve sıçanlarda gerçekleştirilen karsinojenik biyoassay çalışmalarında, hayvanlara insanterapötik dozlarının üstünde dozlar uygulandığında, sistemik neoplastik değişikliklergözlenmemiştir. İnsanlardaki aylık dozlamayla kıyaslanabilen, hayvanlarda artan dozsıklığında (günlük) enjeksiyon bölgesinde subkütanöz tümör gözlenme sıklığında bir artışgerçekleşmiştir. Ancak bu durum klinik olarak ilişkilendirilemeyebilir. In vivoin vitrostandart battery testlerinde, lanreotid herhangi bir genotoksik potansiyel göstermemiştir.Lanreotid sıçanlarda ve tavşanlarda teratojenik değildir. Sıçanlarda (implantasyon öncesi kayıpta artış) ve tavşanlarda (implantasyon sonrası kayıpta artış) embriyo/fetal toksisitegözlemlenmiştir. Her 2 haftada bir subkutan enjeksiyonla 30 mg/kg (vücut yüzey alanı karşılaştırmalarına göre insan dozunun beş katı) verilen gebe sıçanlarda yapılan üreme çalışmaları, embriyo/fetalsağkalımında azalma ile sonuçlanmıştır. 0.45 mg/kg/gün (göreceli vücut yüzey alanıkarşılaştırmalarına dayalı olarak, önerilen maksimum 120 mg dozda insan terapötikmaruziyetlerinin iki katı) deri altı enjeksiyonları verilen hamile tavşanlarda yapılan çalışmalar,fetal hayatta kalmanın azaldığını ve fetal iskelet/yumuşak doku anormalliklerinin arttığınıgöstermektedir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiEnjeksiyonluk su Glasiyal asetik asit (pH ayarlaması için)
13 6.2. GeçimsizliklerSOMATULINE AUTOGEL diğer tıbbi ilaçlar ile karıştırılmaya uygun değildir. 6.3. Raf ömrü24 ay Koruyucu laminatlı ambalaj açıldıktan sonra ürün hemen uygulanmalıdır. 6.4. Saklamaya yönelik özel tedbirlerIşıktan korumak için orijinal ambalajı içinde, +2oC ile +8oC arasında (buzdolabında) saklanmalıdır. Buzdolabından çıkartıldıktan sonra özel ambalajında kalan ürün 40°C'nin altında toplamda 24 saati geçmeyecek şekilde saklanması koşuluyla, daha sonra kullanılması ve saklanmayadevam edilmesi için buzdolabına tekrar konabilir (sıcaklık sapmalarının sayısı 3 defayıgeçmemelidir). Orijinal ambalajında saklayınız. 6.5. Ambalajın niteliği ve içeriğiSOMATULINE AUTOGEL kullanıma hazır şırınga içerisinde bulunan lanreotidin beyazımsı, yarı saydam bir jel halinde aşırı doygun çözeltisidir. SOMATULINE AUTOGEL, bir pistontıpası (bromobutil kauçuk) ve üzeri plastik bir kapak ile kapatılmış bir iğne (paslanmaz çelik)ile birlikte otomatik güvenlik sistemi içerisine yerleştirilmiş kullanıma hazır şırınga(polipropilen) içinde sunulur. Her bir kullanıma hazır şırınga, bir plastik tablaya yerleştirilerek ve lamine edilmiş ambalaj ile karton kutu içinde ambalajlanmıştır. Bir kutu, 0.5 mL kullanıma hazır şırınga ve bir iğne(1.2 mm x 20 mm) içermektedir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerAşağıda verilen talimatlar, SOMATULINE AUTOGEL'in nasıl enjekte edileceğini açıklamaktadır.
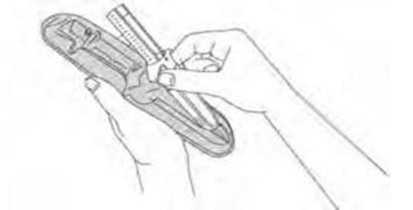
14 ENJEKSİYONA BAŞLAMADAN ÖNCE LÜTFEN TÜM TALİMATLARI DİKKATLİCE OKUYUNUZ.Bu enjeksiyon, normal deri altı (subkütan) enjeksiyondan farklı özel bir teknik gerektiren derin deri altı (subkütan) enjeksiyondur. SOMATULINE AUTOGEL, bir otomatik güvenlik sistemi ile birlikte kullanıma hazır şırınga şeklinde sunulmaktadır. İğne, ürünün tamamen uygulanmasının ardından, iğne batmasınailişkin yaralanmaları önlemek üzere otomatik olarak geri çekilecektir. Tablaİğne başlığıKullanım öncesi
desij
iğne gövKullanım sonrası (iğne muhafazası)1- Uygulamadan 30 dakika önce buzdolabından SOMATULINE AUTOGEL'i alınız.Soğuk ilacın enjekte edilmesi ağrıya neden olabilir. Enjeksiyondan hemen öncesinekadar laminatlı ambalajı kapalı tutunuz.  2- Ambalajı açmadan önce, ürünün son kullanma tarihinin geçmemiş ve zarar görmemişolduğunu kontrol ediniz. Kullanıma Hazır Şırınga'yı aşağıdaki durumlarda kullanmayınız: Eğer kullanıma hazır şırıngayı düşürürseniz veya şırıngaya zarar verirsenizveya kullanıma hazır şırınga ya da şırınganın ambalajı herhangi bir şekildezarar görmüş ise. Eğer ürünün son kullanma tarihi dolmuş ise; son kullanma tarihi, dış kutuve ambalaj üzerinde basılıdır. Bu uyarılardan herhangi biri mevcut ise, doktorunuza veya eczacınıza danışınız. 3- Ellerinizi sabunla yıkayınız. 4- Laminatlı ambalajı kesikli çizgi boyunca yırtarak açınız ve kullanıma hazır şırıngayıçıkartınız. Kullanıma hazır şırınga içerik olarak, jele benzer görünüme ve viskoz
15 özelliklere sahip, rengi beyaz ile soluk sarı arasında değişen yarı katı halde bir maddedir. Aşırı doymuş çözelti ayrıca enjeksiyon sırasında yok olabilen mikro baloncuklariçerebilir. Bu farklılıklar normaldir ve ürünün kalitesi üzerinde herhangi bir etkiye sahipdeğildir.
5- Enjeksiyon bölgesini seçiniz: 5a. Eğer enjeksiyon bir sağlık profesyoneli ya da hastanın eğitilmiş bir yakını tarafından uygulanacaksa: enjeksiyon için kalçanın arka (üst, dış) kadranını veyauyluğun üst dış kısmını kullanın. 5b. Eğer kendi kendinize enjeksiyon-uyguluyorsanız, uyluğun üst dış kısmını kullanın.
Sağlık profesyoneli veya eğitilmiş kişitarafından
Kendi kendine enjeksiyon veyasağlık personelitarafındanenjeksiyon Enjeksiyon bölgesini her enjeksiyonda sağ veya sol olarak değiştiriniz. Benler, yara dokusu veya ciltte kızarık görülen ya da engebeli bir his veren alanlardankaçınınız.6- Enjeksiyon bölgesini temizleyiniz.
16 7- Enjeksiyondan önce kullanıma hazır şırıngayı tablasından çıkarınız. Tablayı atınız. 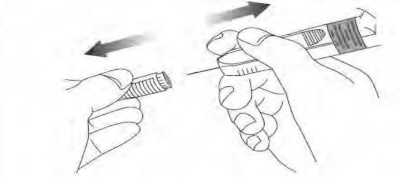
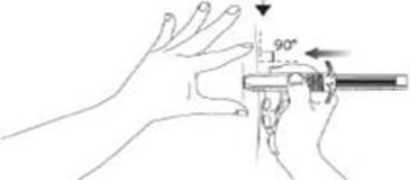
9- Deriyi gerginleştirmek için, kullanıma hazır şırıngayı tutmayan elinizin başparmağını ve işaret parmağını kullanarak enjeksiyon bölgesini düz hale getiriniz. Cildi parmaklarınızınarasında sıkıştırmayınız. Güçlü, dart oku atar gibi bir hareketle, iğneyi cilde dik açıyapacak şekilde (90 derecelik açıyla) hızlıca ve tamamen sokunuz. İğneyi tamamen sokmanız çok önemlidir. İğne tamamen girdikten sonra iğneyi hiç görmüyor olmalısınız. Aspire etmeyiniz.(pistonu geri çekmeyiniz.)
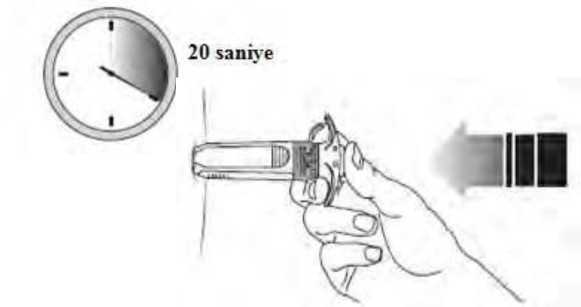
10- Elinizle düzleştirmiş olduğunuz enjeksiyon bölgesini serbest bırakınız. Pistonu kımıldatmadan sıkı bir basınç uygulayarak itiniz. İlaç uygulaması düşündüğünüzdendaha yoğun ve itmesi daha güç olabilir. Genellikle 20 saniye gereklidir. Tüm dozuenjekte ediniz ve daha fazla bastıramadığınızdan emin olmak için son bir kez pistonu
17
 13 - Kanamayı önlemek için kuru pamukla ya da steril gazlı bezle enjeksiyon bölgesine nazikçe bastırılmalıdır. Uygulamadan sonra enjeksiyon bölgesi ovulmamalı veya masaj yapılmamalıdır. 14- Kullanılan şırınga uygun şekilde imha edilmelidir. Enjeksiyon için kullanılan materyalin nasıl imha edileceği konusunu doktorunuz veya hemşireniz size açıklayacaktır. Aparat ev çöpüne ATILMAMALIDIR.
Sadece tek bir kullanım içindir. Açıldıktan sonra hemen kullanılmalıdır. Enjeksiyonun tam olarak Kullanma Talimatında yer alan talimatlara göre gerçekleşmesi önemlidir. Laminatlı ambalaj açılmış veya zarar görmüşse ürünü kullanmayınız. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.Kullanılmamış olan ürünler ya da atık materyaller, yerel düzenlemelere uygun olarakatılmalıdır. 7. RUHSAT SAHİBİGEN İLAÇ VE SAĞLIK ÜRÜNLERİ SAN. VE TİC. AŞ. Mustafa Kemal Mah., 2119. Sok, No:3, D:2-3, 06520, Çankaya/Ankara/Türkiye Tel: 0 312 219 62 19Faks: 0 312 219 60 10e-mail: 118/41 13/09/2005
19 |
İlaç BilgileriSomatuline Autogel 120 Mg/0,5 Ml Uzaltılmış Salımlı Enjeksiyonluk Çözelti İçeren Kullanıma Hazır ŞırıngaEtken Maddesi: Lanreotid Asetat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.